JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
중추 신경계에 대한 생체 내 수초화 연구를위한 삼투압 펌프 기반 약물 전달
요약
탈수초화는 여러 중추 신경계 질환에서 발생합니다. 신뢰할 수 있는 생체 내 약물 전달 기술은 약물 검사를 재수초화하는 데 필요합니다. 이 프로토콜은 뇌실질로 직접 장기간 약물 전달을 허용하고 약물 생체 이용률을 향상시키는 삼투압 펌프 기반 방법을 설명하며 수초화 연구에 광범위하게 적용됩니다.
초록
탈수초화는 다발성 경화증 (MS)뿐만 아니라 알츠하이머 병 및 자폐증과 같은 다른 중추 신경계 질환에서도 확인되었습니다. 수초화가 질병 증상을 효과적으로 개선 할 수 있다는 증거가 시사됨에 따라 미엘린 재생 과정을 촉진하기위한 약물 개발에 대한 관심이 증가하고 있습니다. 따라서, 생체내에서 이들 약물의 효율 및 특이성을 시험하기 위해 영역-선택가능 및 결과-신뢰할 수 있는 약물 전달 기술이 요구된다. 이 프로토콜은 리솔레시틴-유도된 탈수초화 마우스 모델에서 새로운 약물 전달 접근법으로서 삼투압 펌프 임플란트를 도입한다. 삼투 펌프는 혈액 뇌 장벽 (BBB)을 우회하여 마우스 뇌의 특정 영역에 약물을 꾸준히 직접 전달할 수있는 작은 이식 가능한 장치입니다. 또한 짧은 반감기로 펩타이드 및 단백질과 같은 약물의 생체 이용률을 효과적으로 향상시킬 수 있습니다. 따라서이 방법은 중추 신경계 미엘린 재생 연구 분야에 큰 가치가 있습니다.
서문
삼투 펌프는 작은 이식 가능한 용액 방출 장치입니다. 그것은 피하 또는 복강에 이식 할 때 전신 전달에 사용할 수 있습니다. 삼투 펌프의 표면은 반투과성 막이고 안쪽은 투과성 층입니다. 삼투압 펌프는 삼투층과 펌프가 이식되는 조직 환경 사이의 삼투압 차이를 이용하여 작동한다. 삼투층의 높은 삼투압은 조직 내의 물이 펌프 표면의 반투과성 막을 통해 삼투층으로 흐르게 한다. 삼투층은 펌프 내부의 유연한 저장소를 팽창시키고 압축하여 오랜 기간 동안 유연한 저장소에서 용액을 특정 속도로 대체합니다1. 펌프는 세 가지 다른 저장소 부피, 100 μL, 200 μL 및 2 mL를 가지며, 전달 속도는 0.11 μL/h에서 10 μL/h까지 다양합니다. 선택한 펌프 유형에 따라 장치는 1 일에서 6 주2까지 작동 할 수 있습니다. 이 프로토콜에서는 14일 동안 작동할 수 있는 0.25μL/h의 이송 속도를 갖는 100μL 삼투 펌프가 사용됩니다.
1970 년대로 거슬러 올라가면, 삼투 펌프는 신경 과학 연구 3,4에 사용되었습니다. 예를 들어, Wei et al.은 약물 중독에 대한 연구에서 오피오이드 펩티드를 심실에 주입하는 삼투 펌프 접근법을 채택했습니다 3. 지속적인 개선 후, 삼투 펌프는 이제 펩티드, 성장 인자, 중독성 약물, 호르몬, 스테로이드, 항체 등을 포함한 수천 가지 약물의 조절 된 전달에 대한 연구에 사용되었습니다. 또한 특수 카테터 (뇌 주입 키트)가 부착되어 있으면 척수, 뇌, 비장 및 간 5,6,7을 포함한 특정 조직 또는 장기에 표적 주입에 사용할 수 있습니다.
수초화에 대한 연구에서, 많은 약물들이 시험관 내에서 미엘린 재생을 촉진하는 것으로 밝혀졌지만, 대부분은 적절한 투여 방법의 부족으로 인해 생체내에서 유의한 효과를 달성하지 못했다. 복강내 주사, 피하주사, 위내 투여와 같은 전통적인 투여 방법은 약물의 생체이용률에 한계가 있다. 또한 일부 약물은 혈액 뇌 장벽 투과성이 좋지 않아 뇌 실질에 대한 접근을 방해합니다. 함께, 이러한 한계는 새로운 효율적인 전달 방법을 요구합니다. 뇌 주입 키트와 함께 삼투 펌프는 혈액 - 뇌 장벽을 우회하여 코퍼스 캘로섬에 직접 약물을 전달할 수 있으므로 약물의 생체 이용률을 효과적으로 향상시킬 수 있으며, 특히 반감기가 짧은 일부 폴리펩티드 및 단백질 약물의 경우 특히 그렇습니다. 따라서, 새로운 약물 전달 기술로서 삼투압 펌프는 중추신경계 미엘린 재생 연구 분야에 큰 가치를 지닌다. 이 기술의 적용은 아래에서 상세히 소개될 것이다.
프로토콜
모든 동물 절차는 세 번째 군사 의과 대학의 동물 복지 및 윤리위원회에서 승인 한 제도적 지침 및 프로토콜에 따라 수행되었습니다.
1. 리솔레시틴-유도된 탈수초화 마우스 모델의 확립
- 멸균 PBS로 1% 리솔시틴(L-α-Lysophosphatidylcholine이라고도 함) 용액을 준비합니다.
- 오토클레이브 살균으로 가위, 집게, 구부러진 지혈제 및 기타 수술 도구를 살균하십시오. 수술 부위를 살균하고 멸균 시트를 내려 놓으십시오. 수술에 사용되는 모든 물질과 시약은 무균적으로 준비해야합니다. 수술 기간 동안 수술 부위를 멸균 상태로 유지하는 것이 중요합니다.
- 산후 56일째 (P56) C57BL6 마우스를 다음과 같이 마취시킨다.
- 마우스를 작은 동물 마취 기계의 이소플루란 챔버에 놓는다. O2 흐름을 300-500 mL/min으로, 이소플루란을 3%-4%로 조정한다. 충분한 마취 후, 마우스가 느리고 안정적인 호흡으로 움직이지 않을 때, 마우스를 가열 패드가있는 입체 조영 장치로 옮깁니다.
- 챔버에서 가스 출력을 마취 마스크로 전환하고 이소플루란을 1% - 1.5%로 조정하여 마우스를 마취 상태로 유지합니다. 마우스가 완전히 마취 될 때까지 기다렸다가 케토프로펜 (3 - 5 mg / kg)을 복강 내로 주사하여 통증을 완화시킵니다. 수술 전에 마우스의 발가락을 꼬집고 반응을 확인하여 성공적인 마취를 확인하십시오8.
- 마우스가 마취되면 체온을 조절할 수 없습니다. 따라서 수술 중 마우스의 체온을 모니터링하고 조절하십시오. 마취 상태에서 마우스의 안구를 촉촉하게 유지하려면 안구 표면을 에리스로 마이신 눈 연고로 덮으십시오.
- 마우스 헤드를 치아 바 및 이어 바가있는 입체 택시 장치에 고정하십시오. (그림 1A).
- 면도기를 사용하여 머리 꼭대기에서 머리카락을 제거하십시오. 베타 딘과 75 % 에탄올의 세 사이클로 머리 피부를 살균하십시오. 윤리적 인 우려의 경우, 수술 장소를 제외한 동물의 몸을 덮으십시오. 메스를 사용하여 1cm 길이의 중간 시상을 목 밑에서부터 눈 사이로 절개하여 두개골을 노출시킵니다 (그림 1B).
- 30% 과산화수소가 들어있는 멸균 면봉으로 두개골 표면을 부드럽게 닦아 두개골 봉합사를 시각화합니다(그림 1C). 치아 막대와 이어 바의 높이를 조정하여 람다 점과 브레그마 점을 동일한 높이 (즉, 바늘 팁이 점에 닿을 때 동일한 z 축 좌표로)에 배치하여 시상 봉합사가 수평이되도록하십시오.
- 마이크로리터 주사기 바늘(10μL, 33G)의 팁을 브레그마 지점에 부드럽게 놓고 x, y 및 z 좌표를 0으로 재설정합니다(그림 1D). 디지털 판독의 프롬프트에 따라 주사기를 주사 부위(x: 1.04; y: 1.0, 즉 1.04 mm 측면으로 미드라인으로, 1.0 mm 후방을 브레그마 지점으로 이동시킨다)(도 1E).
- 1 mL 주사기 바늘 (26 G, 0.45 mm)로 경막을 관통하지 않고 주사 부위의 두개골을 통해 작은 버 구멍을 천천히 뚫습니다 (그림 1F). 특정 깊이에 도달할 때까지 구멍을 통해 마이크로리터 주사기 바늘을 뇌 조직에 천천히 삽입합니다(대부분의 P56 마우스의 경우 z=-1.62mm).
참고 : 경험적으로 -1.62mm의 삽입 깊이는 바늘 팁이 대부분의 P56 마우스의 코퍼스 캘로섬 중앙에 도달하여 리솔레시틴이 탈수초화를 유도하기 위해 코퍼스 캘로섬으로 직접 전달 될 수 있도록합니다. - 1% 리솔레시틴 1.5μL를 0.3μL/min의 속도로 주입합니다. 주사 후, 주입 바늘 경로를 따라 액체의 누출을 방지하기 위해 마이크로 리터 주사기를 천천히 꺼내기 전에 5 분 동안 기다리십시오.
- 5-0개의 수술 봉합사로 피부를 스티치합니다(그림 1H).
- 체온 강하를 피하기 위해 마우스를 가열 패드에 놓습니다. 통증을 완화하기 위해 24 시간마다 5mg / kg 카프로펜을 피하 주사하십시오. 상처가 제대로 치유되도록 매일 절개에 에리스로 마이신 연고를 바르십시오. 수술을받은 마우스를 새장에만 놓고 완전히 회복 될 때까지 촉촉한 음식으로 먹이십시오. 수술 후 매일 마우스를 모니터링합니다.
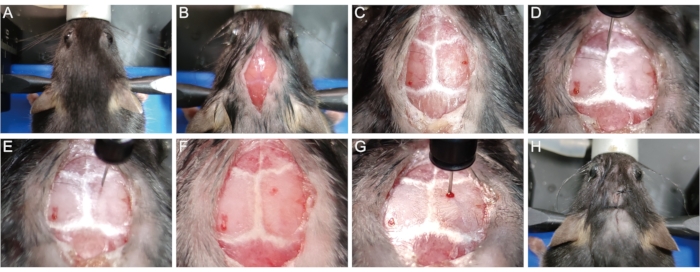
도 1: 리솔레시틴-유도된 탈수초화 마우스 모델의 확립 . (A) 마우스를 입체탁 장치에 고정시킨다. (B) 두개골을 노출시키기 위해 1cm 중간 시상 절개를 엽니 다. (C) 두개골 봉합사를 시각화한다. (D) Bregma 점에서 x, y 및 z 좌표를 0으로 재설정합니다. (e) 주사기를 주사 부위로 옮긴다. (F) 주사 부위의 두개골에 구멍을 뚫는다. (G) 바늘을 뇌 조직에 천천히 삽입하고 리솔레시틴을 주입한다. (H) 피부를 꿰매십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 삼투압펌프의 제조
참고: 펌프의 주요 부품은 그림 2A에 나와 있습니다.
- 뇌에 뇌 주입 캐뉼라의 삽입 깊이를 결정하십시오. 사용 된 뇌 주입 캐뉼라의 바늘이 길이가 3mm이고 각 깊이 조절 스페이서가 0.5mm인지 확인하십시오. 1.5mm의 주입 깊이(캘로섬에 가까움)를 달성하려면 조직 접착제로 뇌 주입 캐뉼라의 바늘에 세 개의 깊이 조절 스페이서를 부착하십시오(그림 2B, C).
- 삼투압 펌프를 채우려면 펌프 패키지와 함께 제공되는 주사기 바늘을 1 mL 주사기에 부착하고 약물을 흡인하십시오. 펌프를 똑바로 잡고 주사기를 펌프 상단의 개구부에 삽입한 다음 거품9 가 생성되지 않도록 주의하여 약물을 천천히 주입 합니다(그림 2D 참조). 액체가 개구부에서 흘러 나오면 천천히 주사기를 꺼냅니다.
- 흐름 조정기에서 흰색 플랜지를 분리하고 가위 또는 펜치가 흐름 중재자를 구부리거나 부수지 않도록 주의합니다. 그런 다음 유량 조절기를 펌프에 삽입합니다(그림 2E). 삼투 펌프에 기포가 있는지 확인하려면 충전 전후에 삼투 펌프를 별도로 칭량하십시오.
- 카테터를 동물의 크기에 따라 특정 길이로 다듬습니다 (약 25 g의 P56 마우스의 경우 20-25 mm 카테터). 카테터를 뇌 주입 캐뉼라에 부착하십시오.
- 공기를 도입하지 않고 주사기를 사용하여 카테터에 약물을 채웁니다(그림 2F).
- 카테터를 흐름 중재자에 연결합니다. 부착 후 카테터가 노출된 유동 중재자의 약 4mm를 덮고 있는지 확인하십시오(그림 2G).
- 삼투압 펌프가 이식 후 즉시 작동할 수 있도록 하기 위해, 충전된 펌프를 37°C의 멸균 0.9% 식염수 또는 PBS에 적어도 4 내지 6시간(바람직하게는 하룻밤 연장) 동안 침지시켜 조직 환경과 동일한 삼투압을 갖는 용액으로 펌프 표면의 반투과성 막을 미리 적시다(도 2H).
- 펌프에 적재된 모든 용액은 멸균되어야 합니다. ALZET 펌프는 60Co의 살균 용량에 노출되어 멸균 상태로 공급됩니다. 그러나 외부 오염이 발생하면 펌프의 표면을 이소프로필 알코올 (물 중 70 %)로 닦아 청소할 수 있습니다.

도 2: 삼투압 펌프의 제조. (A) 삼투압 펌프의 주요 성분. (B,C) 깊이 조절 스페이서를 뇌 주입 캐뉼라의 바늘에 부착하십시오. (d) 1 mL 주사기를 사용하여 삼투압 펌프를 채운다. (E) 흐름 중재자를 펌프에 삽입합니다. (f) 주사기를 사용하여 카테터를 채운다. (G) 카테터를 유동 중재자에 연결합니다. (H) 충전된 펌프를 37°C의 멸균 0.9% 식염수 또는 PBS에 담그십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 삼투압 펌프의 이식
- 코퍼스 캘로섬 탈수초화 모델을 수립 한 후 3 일 동안 기다리십시오. 작은 동물 마취 시스템을 켭니다. 가위, 핀셋 및 지혈 펜치를 소독하고 75 % 알코올 용액에 담그십시오. 수술 부위에 멸균 시트를 놓습니다.
- 마우스를 마취시키고 입체 택시 장치에 다시 고정시킵니다. 건조를 방지하기 위해 안구 표면을 눈 연고로 덮으십시오.
- 원래 상처를 75 % 알코올로 소독하십시오. 이전에 꿰매어 놓은 수술 절개를 열고(그림 3A) 절개를 어깨 뼈까지 확장합니다(그림 3B).
- 견갑골에서 지혈 펜치 또는 핀셋으로 피하 결합 조직으로부터 피부를 분리하여 공동을 엽니다(그림 3C). 삼투 펌프를 캐비티에 넣습니다(그림 3D,E).
- 면봉으로 탈수초화 모델을 수립할 때 생성된 두개골 표면의 핀홀을 부드럽게 닦아내고 노출시킵니다(단계 1.8 참조). 이 핀홀을 통해 뇌 주입 캐뉼라를 수직으로 삽입하고 조직 접착제로 두개골에 신속하게 고정하십시오 (그림 3F).
- 한 쌍의 가위로 뇌 주입 캐뉼라 위의 이동식 탭을 제거하십시오 (그림 3G, H). 또는이 과정에서 흔들리지 않도록 캐뉼라를 삽입하기 전에 탭을 먼저 제거하십시오.
- 절개를 바늘로 꿰매거나 조직 접착제로 부착하십시오 (그림 3I).
- 수술 후 체온 강하를 피하기 위해 마우스를 가열 패드에 놓습니다. 통증을 완화하기 위해 24 시간마다 5mg / kg 카프로펜을 피하 주사하십시오. 상처가 제대로 치유되도록 매일 절개에 에리스로 마이신 연고를 바르십시오. 동물을 새장에 혼자 놓고 완전히 회복 될 때까지 축축한 음식을 먹이십시오. 매일 마우스를 모니터링하고 뇌 주입 캐뉼라가 단단히 부착되어 있는지 확인하십시오.
- 수술 후 11 일 후에 150-200 mg / kg Pentobarbital 나트륨을 복강 내로 주입 한 다음 4 % 포름 알데히드로 심폐 관류하여 마우스를 안락사시킵니다.
- 용액이 정상적으로 전달되는지 확인하려면 삼투압 펌프를 조심스럽게 제거하고 뇌 해부 전에 펌프 저장소의 잔류 부피를 측정하십시오.
- 잔류 부피를 측정하려면 뇌 주입 캐뉼라를 제거하고 카테터에 1 mL 주사기를 부착 한 다음 나머지 용액을 흡인하여 부피를 결정하십시오. 실제 잔류 부피를 이론적 잔류 부피와 비교하십시오 (초기 부피 - 평균 펌핑 속도 * 주입 기간).
참고: 과도한 잔류 부피는 카테터 폐색 또는 펌프 오작동으로 인한 주입 실패를 나타냅니다.
- 잔류 부피를 측정하려면 뇌 주입 캐뉼라를 제거하고 카테터에 1 mL 주사기를 부착 한 다음 나머지 용액을 흡인하여 부피를 결정하십시오. 실제 잔류 부피를 이론적 잔류 부피와 비교하십시오 (초기 부피 - 평균 펌핑 속도 * 주입 기간).
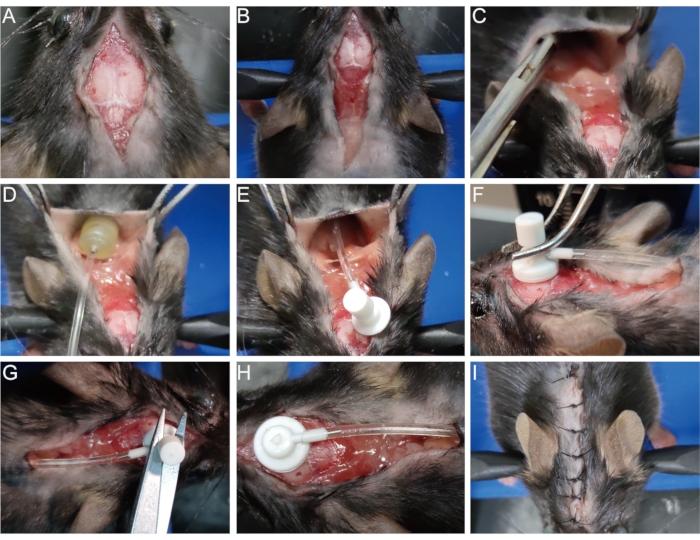
그림 3: 삼투압 펌프의 이식. (A) 수술 절개를 엽니 다. (B) 절개를 어깨 뼈까지 확장한다. (C) 피부를 피하 결합 조직으로부터 분리하여 공동을 만든다. (D,E) 삼투 펌프를 캐비티에 넣으십시오. (F) 두개골 표면의 핀홀에 뇌 주입 캐뉼라를 삽입하고 두개골에 단단히 고정시킵니다. (G, H) 캐뉼라에서 이동식 탭을 제거하십시오. (I) 절개를 꿰매십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
미엘린 재생 연구에서 삼투압 펌프의 효과를 검증하기 위해, P56 마우스에서 리솔레시틴-유도 탈수초화 모델을 만든 다음, UM206(1.5 mL 0.9% 식염수 중 1 mg)을 함유하는 삼투압 펌프를 이식한 후, 반감기가 짧고 BBB 투과성이 떨어지는 펩티드가 최근 수초화를 촉진한다고 보고되었다10 . 0.9% 식염수를 대조군으로 사용하였다. 모델 확립 후 14일 후, 마우스를 4% 포름알데히드로 경심 관류?...
토론
이 프로토콜은 삼투압 펌프를 미엘린 재생 연구를위한 새로운 약물 전달 기술로 설명하며, 이는 약물을 치료 부위에 직접 전달하고 장기간 일관된 약물 전달을 허용하여 전체 실험 기간 동안 중추 신경계의 미세 환경에서 안정적인 약물 농도를 창출 할 수 있습니다. 다른 약물 전달 방법과 비교하여, 삼투압 펌프는 탈수초화 병변(13)에서 약물 농도를 유지하는 데 더 도움이 된다....
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
이 연구는 중국 국립 자연 과학 재단 (NSFC 32070964, 31871045)에서 J.N.과 심천 기본 연구 재단 (JCYJ20210324121214039)에서 Y.S.에 대한 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Anesthesia Air Pump | RWD | R510-29 | E05818-006 |
| Brain Infusion kit 3 | ALZET | 0008851 | 1-3 mm |
| Carprofen | Macklin | C830557-1g | 5 mg/kg every 24 h |
| Erythromycin eye ointment | Along technology | YCKJ-RJ-024780 | Cover the surface of the eyeballs during anesthesia |
| Erythromycin ointment | pythonbio | RG180 | |
| Gas Evacuation Apparatus | RWD | R546W | E05518-002 |
| L-α-Lysophosphatidylcholine | Sigma | L0906 | Dissolve at 1% with sterile PBS |
| Microliter Syringe | Hamilton | 65460-05 | Syringe Series:1700, 10 µL, 33 gauge |
| Micro-smotic pump model 1002 | ALZET | 0004317 | 0.25 µL per hour, 14 days |
| PBS (pH = 7.3) | ORIGENE | ZLI-9061 | |
| Pentobarbital sodium | Shanghai Civi | CAS NO: 57-33-0 | 150-200 mg/kg intraperitoneal injection for euthanasia |
| Small Animal Anesthesia Machine | RWD | R520IE | E05807-006 M |
| Stereotaxic Equipment | RWD | E06382 | |
| STERI 250 sterilizer | Keller | 31101 | Rapid sterilization of surgical instruments |
| Surgical sutures | Shanghai jinhuan | F504 | 5-0 |
| Syringe needle (1 mL) | Shanghai KDL | 6930197811018 | 26 gauge (0.45 mm x 16 mm) |
| Testing drug and solvent | Experiment dependent | N/A | |
| ThermoStar Homeothermic Monitoring System | RWD | 69026 | Maintain body temperature during anesthesia |
| Vetbond Tissue adhesive | 3M | 1469SB | Secure the brain infusion cannula , Adhere the skin incision |
참고문헌
- Theeuwes, F., Yum, S. I. Principles of the design and operation of generic osmotic pumps for the delivery of semisolid or liquid drug formulations. Annals of Biomedical Engineering. 4 (4), 343-353 (1976).
- Herrlich, S., Spieth, S., Messner, S., Zengerle, R. Osmotic micropumps for drug delivery. Advanced Drug Delivery Reviews. 64 (14), 1617-1627 (2012).
- Wei, E., Loh, H. Physical dependence of opiate-like peptides. Science. 193 (4259), 1262-1263 (1976).
- Pettigrew, J. D., Kasamatsu, T. Local perfusion of noradrenaline maintains visual cortical plasticity. Nature. 271 (5647), 761-763 (1978).
- Wang, Y., et al. Reduced oligodendrocyte precursor cell impairs astrocytic development in early life stress. Advanced Science (Weinheim). 8 (16), 2101181 (2021).
- Tang, C., et al. Neural stem cells behave as a functional niche for the maturation of newborn neurons through the secretion of PTN. Neuron. 101 (1), 32-44 (2019).
- Watanabe, S., Komine, O., Endo, F., Wakasugi, K., Yamanaka, K. Intracerebroventricular administration of Cystatin C ameliorates disease in SOD1-linked amyotrophic lateral sclerosis mice. Journal of Neurochemistry. 145 (1), 80-89 (2018).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments: JoVE. , e50326 (2013).
- Tang, C., Guo, W. Implantation of a mini-osmotic pump plus stereotactical injection of retrovirus to study newborn neuron development in adult mouse hippocampus. STAR Protocols. 2 (1), 100374 (2021).
- Niu, J., et al. Oligodendroglial ring finger protein Rnf43 is an essential injury-specific regulator of oligodendrocyte maturation. Neuron. 109 (19), 3104-3118 (2021).
- Breitschopf, H., Suchanek, G., Gould, R. M., Colman, D. R., Lassmann, H. In situ hybridization with digoxigenin-labeled probes: sensitive and reliable detection method applied to myelinating rat brain. Acta Neuropathologica. 84 (6), 581-587 (1992).
- Cree, B. A. C., et al. Clemastine rescues myelination defects and promotes functional recovery in hypoxic brain injury. Brain. 141 (1), 85-98 (2018).
- Eckenhoff, B., Yum, S. I. The osmotic pump: novel research tool for optimizing drug regimens. Biomaterials. 2 (2), 89-97 (1981).
- Thoenen, H., Sendtner, M. Neurotrophins: from enthusiastic expectations through sobering experiences to rational therapeutic approaches. Nature Neuroscience. 5, 1046-1050 (2002).
- Hagg, T. Intracerebral infusion of neurotrophic factors. Methods in Molecular Biology. 399, 167-180 (2007).
- Bittner, B., Thelly, T., Isel, H., Mountfield, R. J. The impact of co-solvents and the composition of experimental formulations on the pump rate of the ALZET osmotic pump. International Journal of Pharmaceutics. 205 (1-2), 195-198 (2000).
- Arnot, M. I., Bateson, A. N., Martin, I. L. Dimethyl sulfoxide/propylene glycol is a suitable solvent for the delivery of diazepam from osmotic minipumps. Journal of Pharmacological and Toxicological Methods. 36 (1), 29-31 (1996).
- Gullapalli, R., et al. Development of ALZET osmotic pump compatible solvent compositions to solubilize poorly soluble compounds for preclinical studies. Drug Delivery. 19 (5), 239-246 (2012).
- White, J. D., Schwartz, M. W. Using osmotic minipumps for intracranial delivery of amino acids and peptides. Methods in Neurosciences. 21, 187-200 (1994).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유