A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
גישה מבוססת ספקטרומטריית מסות לזיהוי פוספטזות פוספופרוטאין והאינטראקציות שלהם
In This Article
Summary
כאן אנו מציגים פרוטוקול להעשרת פוספטזות פוספופרוטאין אנדוגניות והחלבונים המתקשרים ביניהן מתאים ורקמות וזיהוי וכימות שלהם על ידי פרוטאומיקה מבוססת ספקטרומטריית מסות.
Abstract
רוב התהליכים התאיים מווסתים על ידי זרחון חלבונים דינמי. יותר משלושה רבעים מהחלבונים עוברים זרחון, ופוספופרוטאין פוספטזות (PPPs) מתאמות יותר מ-90% מכלל הדפוספורילציה של סרין/תראונין תאי. דה-רגולציה של זרחון חלבונים הייתה מעורבת בפתופיזיולוגיה של מחלות שונות, כולל סרטן וניוון עצבי. למרות פעילותם הנרחבת, המנגנונים המולקולריים השולטים ב-PPPs וכאלה הנשלטים על ידי PPPs מאופיינים בצורה גרועה. כאן מתוארת גישה פרוטאומית המכונה חרוזי מעכבי פוספטאז וספקטרומטריית מסה (PIB-MS) כדי לזהות ולכמת PPPs, את השינויים הפוסט-טרנסלציוניים שלהם ואת האינטראקטיביסטים שלהם תוך 12 שעות בלבד באמצעות כל קו תאים או רקמה. PIB-MS משתמש במעכב PPP לא סלקטיבי, microcystin-LR (MCLR), המשותק על חרוזי ספארוז כדי ללכוד ולהעשיר PPPs אנדוגניים ואת החלבונים הקשורים אליהם (המכונים PPPome). שיטה זו אינה דורשת ביטוי אקסוגני של גרסאות מתויגות של PPPs או שימוש בנוגדנים ספציפיים. PIB-MS מציעה דרך חדשנית לחקור את ה-PPPs השמורים מבחינה אבולוציונית ולהרחיב את ההבנה הנוכחית שלנו של איתות דה-פוספורילציה.
Introduction
זרחון חלבונים שולט ברוב התהליכים התאיים, כולל אך לא מוגבל לתגובה לנזק לדנ"א, איתות גורמי גדילה ומעבר דרך מיטוזה 1,2,3. בתאי יונקים, רוב החלבונים עוברים זרחון בשאריות סרין, תראונין או טירוזין אחד או יותר בנקודת זמן כלשהי, כאשר פוספוסרינה ופוספוטריאונינים מהווים כ-98% מכלל אתרי הזרחון 2,3. בעוד קינאזות נחקרו בהרחבה באיתות תאי, תפקידם של PPPs בוויסות תהליכים תאיים דינמיים עדיין מתפתח.
דינמיקת הזרחון נשלטת על ידי יחסי הגומלין הדינמיים בין קינאזות לפוספטזות. בתאי יונקים ישנם יותר מ-400 קינאזות חלבוניות המזרזות פוספורילציה של סרין/תראונין. יותר מ-90% מהאתרים האלה עוברים דה-פוספורילציה על-ידי פוספטאזות של פוספופרוטאין (PPPs), משפחה קטנה של אנזימים המורכבת מ-PP1, PP2A, PP2B, PP4-7, PPT ו-PPZ 2,3. PP1 ו-PP2A אחראים לרוב הפוספוסרין והפוספוטראונין דה-פוספורילציה בתוך תא 2,3,4. ההבדל הבולט במספר בין קינאזות לפוספטזות וחוסר הספציפיות של תת-יחידות קטליטיות PPP במבחנה הובילו לאמונה כי קינאזות הן הגורם העיקרי לזרחון 2,3. עם זאת, מחקרים רבים הראו כי פוספטזות מבססות את הספציפיות של המצע באמצעות היווצרות של הולואנזים רב-שמריים 5,6,7,8,9. לדוגמה, PP1 הוא הטרודימר המורכב מיחידת משנה קטליטית, ובזמן נתון, אחד מתוך יותר מ -150 תת-יחידות רגולטוריות 6,7,8. לעומת זאת, PP2A הוא הטרוטרימר שנוצר מפיגומים (A), יחידת משנה רגולטורית (B) ותת-יחידהקטליטית (C) 2,3,9. ישנן ארבע משפחות נפרדות של תת-יחידות רגולטוריות של PP2A (B55, B56, PR72 וסטריאטין), שלכל אחת מהן גנים מרובים, גרסאות שחבור ודפוסי לוקליזציה 2,3,9. האופי הרב-מהותי של PPPs ממלא את הפער במספר קינאזות ותת-יחידות קטליטיות של PPP. עם זאת, היא יוצרת אתגרים אנליטיים לחקר איתות PPP. כדי לנתח באופן מקיף איתות PPP, חשוב לחקור את ההולו-אנזים השונים בתוך תא או רקמה. התקדמות גדולה נעשתה בחקר הקינום האנושי באמצעות שימוש בחרוזי מעכבי קינאז, המכונים חרוזי מעכבי מולטיפלקס או קינוביאדות, אסטרטגיה פרוטאומית כימית שבה מעכבי קינאז משותקים על חרוזים וספקטרומטריית מסה משמשת לזיהוי קינאזות מועשרות והאינטראקצים שלהם 10,11,12,13.
ביססנו גישה דומה לחקר הביולוגיה של PPP. טכניקה זו כוללת לכידת זיקה של תת-יחידות קטליטיות PPP באמצעות חרוזים עם מעכב PPP משותק ולא סלקטיבי הנקרא מיקרוציסטין-LR (MCLR) המכונה חרוזי מעכבי פוספטאז (PIBs)14,15. בניגוד לשיטות אחרות הדורשות תיוג אנדוגני או ביטוי של תת-יחידות PPP אקסוגניות שיכולות לשנות את פעילות החלבון או לוקליזציה שלו, PIB-MS מאפשר העשרה של תת-יחידות קטליטיות אנדוגניות של PPP, תת-יחידות רגולטוריות ופיגומים הקשורות אליהן, וחלבונים מתקשרים (המכונים PPPome) מתאים ורקמות בנקודת זמן נתונה או בתנאי טיפול ספציפיים. MCLR מעכב PP1, PP2A, PP4-6, PPT ו-PPZ בריכוזי ננו-מולארים, מה שהופך את ה-PIBs ליעילים ביותר בהעשרת PPPome16. ניתן לשנות את קנה המידה של שיטה זו לשימוש בכל חומר מוצא, מתאים ועד דגימות קליניות. כאן נתאר בפירוט את השימוש ב-PIBs ובספקטרומטריית מסות (PIB-MS) כדי ללכוד, לזהות ולכמת ביעילות את ה-PPPome האנדוגני ואת מצבי השינוי שלו.

איור 1: סיכום חזותי של פרוטוקול PIB-MS. בניסוי PIB-MS ניתן לקבל דגימות בצורות שונות, מתאים ועד גידולים. הדגימה נאספת, משוקרת ומוגזמת לפני העשרת PPP. כדי להעשיר עבור PPPs, lysate הוא דגירה עם PIBs עם או בלי מעכב PPP, כגון MCLR. לאחר מכן נשטפים ה-PIBs, ו-PPPs נשטפים בתנאי דנטורציה. הדגימות מוכנות לניתוח ספקטרומטריית מסה על ידי הסרת חומרי ניקוי באמצעות העשרת חלבוני SP3, עיכול טריפטי והתפלה. לאחר מכן ניתן לתייג דגימות באופן אופציונלי TMT לפני ניתוח ספקטרומטריית מסות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
PIB-MS כולל ליזה והבהרה של תאים או רקמות, דגירה של הליזאט עם PIBs, אלוטיון וניתוח של האלואט באמצעות כתמים מערביים או גישות מבוססות ספקטרומטריית מסה (איור 1). התוספת של MCLR חופשי יכולה לשמש כבקרה כדי להבחין בין קלסרים ספציפיים של PIB לבין אינטראקציות לא ספציפיות. עבור רוב היישומים, ניתן להשתמש בגישה נטולת תוויות כדי לזהות ישירות חלבונים ב- eluates. במקרים שבהם יש צורך בדיוק רב יותר בכימות או בזיהוי של מינים בעלי שפע נמוך, ניתן להשתמש בעיבוד נוסף עם תיוג תג מסה טנדם (TMT) כדי להגדיל את הכיסוי ולהפחית את הקלט.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: הדור של PIBs נעשה כפי שתואר על ידי Moorhead et al., כאשר 1 מ"ג של מיקרוציסטין וכ -6 מ"ל של ספארוז מצומדים כדי ליצור PIBs עם יכולת קשירה של עד 5 מ"ג / מ"ל17.
1. הכנה לדוגמה
הערה: כמות התחלתית טיפוסית עבור PIB-MS היא 1 מ"ג של חלבון כולל לכל מצב. עבור ניסוי זה, בערך 2.5 x 106 תאי HeLa שימשו כדי לחלץ 1 מ"ג של חלבון. חישוב זה צריך להתבצע עבור כל קו תא או רקמה המשמשים בניסוי18. אם הדגימה מוגבלת ולא ניתן להשיג 1 מ"ג, ניתן להפחית את כמות הקלט עם אובדן קל של זיהוי תת-יחידות PPP. לחלופין, ניתן להשתמש בתיוג TMT כדי לאפשר ערבוב של כל התנאים בדגימה אחת, מה שמגדיל את רגישות הזיהוי כפי שמוצג בשלב 9.
- אסוף דגימות רקמה או כדורי תאים. עבור כדורי תאים, אספו תאים על ידי צנטריפוגה בטמפרטורה של 277 x גרם למשך 2 דקות בטמפרטורת החדר (RT), הסירו את המדיה ושטפו את התאים ב-5 מ"ל של מלוחים עם מאגר פוספט (PBS). ניתן לאחסן כדורי תאים בטמפרטורה של -80 °C (80 °F) למשך מספר חודשים.
- הכינו מאגר ליזיס (500 mM NaCl, 50 mM Tris-HCl pH 7.5, 0.5% Triton X-100 (vol/vol), 5 mM בטא-גליצרופוספורי חומצה דיסודיום מלח פנטהידרט, 1:500 (vol/vol) קוקטייל מעכב פרוטאז III) והמשיכו על קרח. לעשות מספיק כדי לשקר ולשטוף את כל הדוגמאות. אם מתחילים עם 1 מ"ג של חלבון לכל מצב, יש להכין כ-3 מ"ל של מאגר לכל דגימה עבור תזה ושטיפות.
הערה: מאגר הליזיס שצוין בשלב זה הוא תמיסת דטרגנט קלה, אשר עשויה שלא להספיק כדי לבודד ממברנה מסיסה או חלבונים הקשורים לציטוסקטליים. ניתן לחקור דטרגנטים אחרים כדי לשפר את הסולוביליזציה. נבדקו מגוון של ריכוזי NaCl ו-Triton-X-100, והריכוזים הנ"ל נמצאו אופטימליים לרקע נמוך וקשירת תת-יחידות פוספטאז גבוהה. - הוסיפו מאגר ליזיס צונן לדגימות. עבור lysis של 1 מ"ג של חלבון, להשתמש 1 מ"ל של מאגר. אם הדגימה קפואה, הוסיפו חיץ ליזיס ותנו לדגימה להפשיר על הקרח בחיץ.
- עבור תאים, הומוגניזציה של הדגימות באמצעות סוניפיקציה, תוך שמירה על התאים על קרח בין פולסים. סוניק את הדגימות באמפליטודה של 15% עם שלושה פולסים של 15 שניות. זה עשוי להשתנות בהתאם לסוניקטור שבו נעשה שימוש (ראו טבלת חומרים).
- עבור רקמות, הומוגניזציה של הדגימות תחילה באמצעות מטחנת רקמת Dounce כדי לטחון את הרקמה עד לסילוק לפני ההדבקה כמתואר בשלב 1.3.1.
- הבהירו את הדגימה ההומוגנית של פסולת בלתי מסיסה על ידי צנטריפוגה ב-21,130 x גרם למשך 15 דקות בטמפרטורה של 4 מעלות צלזיוס. לאחר מכן, מבלי להפריע לכדורים או לשומנים שנוצרו שנאספו בצד הצינורות, מעבירים את הליזטים לצינורות חדשים. הסר 100 μL של דגימת טרום העשרה של הליזאט המובהר אם תרצה ואחסן בטמפרטורה של -20 °C (75 °F). הקפידו לשמור את הליזטים על הקרח.
- קבעו את תכולת החלבון הכוללת בכל דגימה על ידי ביצוע בדיקת כימות חלבונים, כגון בדיקת חומצה ביצינכונינית (BCA), על גבי אליקו קטן של כל דגימה, על פי הוראות היצרן. ודא שהליזטים נשמרים על הקרח במהלך בדיקת ה-BCA.
- לאחר ביצוע בדיקת BCA, העבירו כמות שווה של חלבון לצינורות חדשים ודללו עם מאגר ליזה כדי להבטיח שלכל צינור יש את אותו ריכוז חלבון (למשל, 1 מ"ג/מ"ל). אם הניסוי דורש שליטה במעכבי PPP, הכינו שני אליקוטים של כל דגימה בעלי אותה תכולת חלבון והמשיכו לשלב 1.7. אם אין צורך בבקרות מעכבי PPP, דלג לשלב 2. ודא שהדגימות נשמרות על קרח.
הערה: זה קריטי שריכוזי חלבון שווים ישמשו לכל מצב בניתוח PIB-MS. בקרות מעכבי PPP משמשות להבחנה בין קלסרים ספציפיים ל-PIBs לבין הרקע הלא ספציפי. - עבור בקרת מעכבי PPP, טפלו בדגימה אחת עם MCLR חופשי (1 μM) ובשנייה עם נפח שווה של DMSO כבקרה. מערבולת את הדגימות בעדינות ודוגרים אותן על קרח במשך 15 דקות.
הערה: טיפול MCLR בליזאטים חוסם את הקשירה של תת-יחידות קטליטיות של PPP, אך לא חלבונים שנקשרים באופן לא ספציפי ל-PIBs בדגימות. היו זהירים כשאתם מטפלים ב-MCLR מכיוון שהוא רעיל. עיין באמצעי זהירות לטיפול בטבלת החומרים.
2. הכנת PIBs
- קבעו את כמות ה-PIB הדרושה לניסוי. עבור 1 מ"ג של חלבון, 1-3 מיקרוגרם של PPPs וחלבונים אינטראקציה ניתן להשיג; השתמש בלפחות 10 μL של שרף PIBs מוצק לכל דגימה כדי למזער את אובדן החרוזים. קיבולת הקשירה של PIBs היא 3-5 מ"ג/מ"ל14,17.
- העבר את הכמות המתאימה של PIBs לצינור 1.5 מ"ל ושטף אותם 3x עם 0.5 מ"ל של חיץ ליזיס על ידי מערבולת עדינה ולאחר מכן צנטריפוגה ב 376 x g עבור 30 שניות ב- RT בין שטיפות. יש להימנע מפירוז החרוזים בעת הסרת חיץ ליזיס בין השטויות.
- צור תמיסת PIB/buffer של 50% (vol/vol) על-ידי הוספת כמות מתאימה של מאגר ליזיס ל-PIBs השטופים. בעדינות לטפטף למעלה ולמטה ולסובב את קצה הפיפטה ברפיון כדי להחיות את ה- PIBs.
- העבר 20 μL של slurry לצינור חדש 1.5 מ"ל כבר מכיל 0.5 מ"ל של מאגר lysis. חיץ הליזיס בצינור מסייע בהרחקת החרוזים מקצה הפיפטה. בצע פעולה זו עד שיהיו מספיק צינורות המכילים כמות שווה של PIBs עבור כל דגימה.
- סובב את הצינורות ב- 376 x g במשך 30 שניות ב- RT. ודא שכל הצינורות מכילים כמות שווה של שרף חרוזים. יש להשליך כל סופרנטנט, ולהשאיר רק שרף מוצק ומקסימום של 50 μL של חיץ ליזיס בכל צינור.
3. דגירה של PIBs עם lysates
- העבר את ה-lysates משלב 1.6. או שלב 1.7. לצינור המסומן כראוי המכיל PIBs משלב 2. סובב את הליזאט ב-8 סל"ד עם ה-PIBs למשך שעה אחת ב-4 מעלות צלזיוס.
4. שטיפת PIBs
- צנטריפוגה PIBs ב 376 x g עבור 30 s ב 4 °C כדי לאסוף את החרוזים. הסר והשליכו את ה-supernatant, תוך שמירת 100 μL aliquot לניתוח לאחר העשרה, אם תרצה בכך.
- שטפו את ה-PIBs 3x על ידי הוספת 0.5 מ"ל של חיץ ליזיס לחרוזים, היפוך הצינורות (מערבולת לא מומלצת), איסוף החרוזים על ידי צנטריפוגה ב-376 x g במשך 30 שניות ב-4 מעלות צלזיוס, והסרת חיץ הליזיס מהחרוזים המיושבים, תוך הקפדה שלא לשבש את גלולת החרוזים.
5. העלאת PPPs מה-PIBs
- לאחר הכביסה הסופית, יש להסיר כמה שיותר ממאגר הליזיס מבלי לטפטף אף אחד מה-PIBs. הפוך את מאגר ה-elution המכיל 2% SDS (vol/vol) ומחק את ה-PPPs מה-PIBs על-ידי הוספת נפח מספיק של מאגר אלוטציה כדי להיות פי 4x-5 מנפח ה-PIBs. לדוגמה, אם נעשה שימוש ב- 10 μL של PIBs, השתמש ב- 50 μL של מאגר elution. דגירה של ה-PIBs עם חיץ ה-elution ב-65 °C למשך שעה אחת כדי לגרש את ה-PPPs מה-PIBs.
- לאחר האלוטציה, לאסוף את eluate על ידי צנטריפוגה של הצינורות ב 376 x g במשך 30 s ב- RT ו pipetting eluate לתוך צינור נפרד, תוך זהירות לא להעביר כל PIBs. השתמש ב- eluate לניתוח כתמים מערביים או לניתוח ספקטרומטריית מסות. ניתן לאחסן אלואטים בטמפרטורה של -20 מעלות צלזיוס למשך עד מספר חודשים.
- כדי לחדש את ה-PIBs לשימוש נוסף, דגרו את החרוזים ב-2% SDS (vol/vol), תוך סיבוב של 8 סל"ד ב-RT למשך שעה אחת. שטפו אותם 3x-5x ב-25 mM Tris-HCl (pH 7.5) עם סיבוב של 30 דקות לכל שטיפה. לאחר כל הכביסה, יש לאחסן PIBs במאגר אחסון של 25 mM Tris-HCl (pH 7.5) עם נתרן אזיד (0.05% wt/vol).
- לנתח את האלואטים על ידי כתם מערבי או ספקטרומטריית מסה. ניתוח ספקטרומטריית המסות של אלואטים PIB מתואר להלן.
6. הסרת חומרי ניקוי
הערה: ניתן להשתמש בגישות שונות כדי להסיר חומר ניקוי מדגימות מדגימות מתכלות לצורך ניתוח טרשת נפוצה. מצאנו שהכנת דגימה (SP3) של סיר יחיד, המשופרת בפאזה מוצקה, שתוארה על ידי יוז ואחרים, עובדת היטב19.
- הוסף 0.5 μL של חרוזי SP3 ל- 50 μL של eluate משלב 5.2 לעיל. השתמש בחרוזי SP3 ביחס של 10:1 (מיקרוגרם:מיקרוגרם) או לפחות 0.5 מיקרוגרם/מיקרול (תמיסת המלאי היא 50 מיקרוגרם/מיקרול'). סובבו בעדינות את החרוזים והתחמקו.
- הוסיפו נפח אלוטיון אחד של 100% אתנול לתערובת החרוזים(לדוגמה, אם נעשה שימוש ב-50 μL של האלואט, השתמשו ב-50 μL של 100% אתנול). דגירה של הדגימות במשך 5 דקות בתרמומיקסר שנקבע לרעוד ב-1000 סל"ד ב-24 מעלות צלזיוס.
- כדי לאסוף את כל החרוזים, הניחו אותם במדף צינור מגנטי. לאחר שהחרוזים נאספים, השליכו את ה-supernatant ושטפו את החרוזים ב-0.5 מ"ל של 80% אתנול (vol/vol) 3x. לצורך שטיפה, יש להחיות את החרוזים על ידי מערבולת, לאסוף את החרוזים על ידי הנחתם במדף הצינור המגנטי, ולהשליך את הסופרנטנט בין השטיפות.
- שטפו את החרוזים פעם נוספת עם 0.5 מ"ל של 100% אצטוניטריל (ACN) כדי להסיר את כל עקבות האתנול, ולהסיר כמה שיותר ACN.
7. עיכול חלבונים
- בצע דילול של 1:100 של טריפסין (ריכוז סופי של 0.004 מיקרוגרם/μL) ב-166 mM HEPES (pH 8.5) והוסף 30 μL של תמיסת טריפסין זו לכל צינור עם החרוזים, תוך שימוש חוזר על ידי מערבולת.
- דגירה של תערובת חרוזי SP3-טריפסין בתרמומיקסר ב-1000 סל"ד ב-37 מעלות צלזיוס למשך 5 שעות או ללילה ב-30 מעלות צלזיוס. הניחו את הצינורות במדף המגנטי כדי לאסוף את החרוזים ולהסיר את התקצירים לצינורות חדשים.
- עבור ניתוח ללא תוויות, מרווה את התגובה על ידי הוספת 20% חומצה טריפלואורואצטית (TFA) (vol/vol) לריכוז סופי של 0.2% TFA (vol/vol). בדוק שה- pH של כל דגימה הוא בין 2-3 עם נייר pH. אם לא, הוסף אליקוטים קטנים נוספים של 20% TFA עד שזה יושג. הדגימות חייבות להיות חומציות כראוי לפני ההתפלה. המשך לשלב 8.
- עבור תיוג TMT של הדגימות, אל תחמיצו והמשיכו לשלב 9.
8. התפלת העכל
- הכן טיפ שלב עבור כל דגימה על ידי אריזת 200 μL של קצה תואם ממס MS עם שרף C18 כמתואר על ידי Rappsilber et al.20. השתמש במחט בעלת קצה קהה כדי ללחוץ על שני דיסקים של חומר C18, כדי להבטיח שהדיסקים יישארו במחט. העבר את הדיסקים לתוך הקצה התואם לממס MS באמצעות בוכנה חוט דקה כדי לגרש את הדיסקים מהמחט.
הערה: זה קריטי להשתמש בטיפים תואמי ממס MS מנקודה זו בפרוטוקול מכיוון שטיפים אחרים של פיפטה עשויים להחדיר כימיקלים לדגימות שניתן לזהות באמצעות ספקטרומטריית מסות. - שיווי משקל כל קצה שלב עם 30 μL של 100% MeOH, לאחר מכן עם 30 μL של 60% MeOH (vol/vol), ואחריו 30 μL של 0.1% TFA (vol/vol). דחפו כל פתרון דרך קצה הבמה באמצעות מזרק. חברו קצה צינור לקצה המזרק עם סרט שקוף כדי להגביר את המגע בין המזרק לקצה הבמה במידת הצורך. הקפידו לעולם לא לתת לחומר C18 בתוך קצה הבמה להתייבש.
- מוסיפים עיכול פפטיד חומצי משלב 7.3 לקצה הבמה המסומן ודוחפים את קצה הבמה עם מזרק, ושוב נזהרים שלא לתת לקצה הבמה להתייבש לחלוטין.
- יש לשטוף כל דגימה 2x עם 30 μL של 0.1% TFA (נפח/נפח). יש להרקות את הפפטידים מכל קצה שלב על ידי הוספת 30 μL של 60% MeOH (vol/vol) לכל קצה שלב ולגרש את כל זה מהקצה עם לחץ מזרק לתוך צינור חדש, מסומן. זהו השלב היחיד שבו החומר C18 מיובש לחלוטין.
- יש לייבש כל דגימה על ידי צנטריפוגת ואקום. ניתן לאחסן פפטידים מיובשים בטמפרטורה של -20 מעלות צלזיוס למשך מספר חודשים. הדגימות מוכנות כעת לניתוח ספקטרומטריית מסות ללא תווית. השתמש רק במחצית מהדגימה לניתוח על ספקטרומטר המסה ובחצי השני להדמיה חוזרת במידת הצורך. ודא את השימוש בשיטת ספקטרומטר מסה מתאימה לניתוח.
9. תיוג TMT
הערה: תיוג תגים בעלי מסה טנדם משמש לריבוי דגימות לניתוח כמותי. בקבוקון של 0.8 מ"ג של ריאגנט TMT מספיק לסימון של עד 0.8 מ"ג חלבון21. בניסוי משיכה של PIB המתחיל במ"ג אחד של חלבון, מתקבלות 1-3 מיקרוגרם של תת-יחידות פוספופרוטאין. הפרוטוקול שלהלן הוא אופטימלי עבור עד 10 מיקרוגרם של חלבון.
- שחזרו בקבוקון אחד במינון 0.8 מ"ג של ריאגנט TMT ב-80 μL של ACN נטול מים.
- תייג כל דגימה משלב 7.4 עם תווית TMT שונה עבור עד 18 ערוצים. הקפד לציין איזו תווית TMT מתווספת לכל דגימה. הוסף 2 μL של ריאגנט TMT ו- 2 μL של ACN לעיכול הפפטיד, מערבולת בעדינות כדי לערבב, צנטריפוגה ב 376 x g עבור 30 s ב- RT כדי לאסוף את הדגימה, ודגירה ב- RT במשך שעה אחת כדי לתייג את הדגימה.
- כדי לבחון את יעילות הסימון של TMT, הכינו דגימת בדיקת תוויות על ידי שילוב של 1 μL של כל תגובת תיוג בצינור של 0.5 מ"ל המכיל 9 μL של מים בדרגה LC-MS ו-1 μL של 10% הידרוקסילאמין (vol/vol) כדי להרוות את התגובה. הניחו את שאר הדוגמאות המסומנות ללא התווית במקפיא של -80 מעלות צלזיוס. ניתן לאחסן דגימות במשך מספר ימים תוך הערכת יעילות הסימון.
- החמצת דגימת בדיקת התווית TMT על-ידי הוספת 30 μL של 0.1% TFA (vol/vol). בדוק שה- pH הוא בין 2-3. אם לא, הוסף 20% TFA (vol/vol) עד להשגת pH זה. התפלת דוגמת בדיקת התווית באמצעות הטיית שלבים, כמתואר בשלבים 8.1.-8.5.
- נתח את דגימת בדיקת התווית TMT בספקטרומטר המסה כדי להעריך את יעילות התווית. סנן את תוצאות החיפוש לשיעור גילוי שגוי של 1% (FDR) ברמת הפפטידים וקבע את יעילות הסימון21,22.
- לפפטידים בעלי תווית TMT מלאה יש ריאגנט TMT ב-N-terminus ובכל הליזינים. לכמת את עוצמות היונים של כתב TMT ולהשוות את הסכום הכולל שלהם בכל הערוצים. הדגימה מסומנת במידה מספקת כאשר >95% מכלל הפפטידים מסומנים ועוצמות סכום היונים של כתב TMT דומות
הערה: מלבד תיוג לא שלם, הבדלים בעוצמות היונים המסוכמות של כתב TMT עלולים להיות תוצאה של צנרת לא מדויקת של דגימת הבדיקה של 1 μL. זה יכול גם לשקף תצפית ביולוגית אמיתית, ובמקרה כזה כל המשכפלים צריכים להציג את אותה התנהגות. - הסר את הדגימות הלא מרווה מאחסון של -80 מעלות צלזיוס והפשר אותן. אם הם אינם מסומנים במלואם, הוסף 1 μL של מגיב TMT המתאים לדוגמה כפי שצוין לעיל, דגירה למשך שעה אחת וחזור על בדיקת התווית TMT. אם הדגימות מסומנות במלואן, המשך לשלב 9.8.
- כאשר הם מסומנים במלואם, מוסיפים 2 μL של 10% הידרוקסילמין (vol/vol) לתגובות ה-TMT כדי להרוות את התווית. דגירה של הדגימות ב- RT למשך 15 דקות. לאחר מרווה, ניתן לאחסן את הדגימות בטמפרטורה של -80 °C (80 °F) למשך מספר חודשים.
- שלבו את כל תעלות ה-TMT המרוות והוסיפו 2 μL של 20% TFA (vol/vol) כדי להעצים את התגובה. בדוק את ה- pH של התגובה המשולבת, וודא שהוא בין pH 2-3. אם לא, הוסיפו אליקוטים קטנים של 20% TFA עד שיגיעו ל-pH הרצוי. זה קריטי להתפלה נכונה.
- הסר ACN על ידי צנטריפוגת ואקום למשך 30 דקות והתפלת הדגימה כמתואר להלן.
10. התפלת הדגימה המשולבת המסומנת ב-TMT
- השתמש בצלחת התפלה SPE C18 עם קיבולת החלבון המתאימה (2 מ"ג סורבנט מספיק בדרך כלל ליישום זה) כדי להתפיל את מגיב TMT המשולב. שיווי המשקל של הבאר עם 200 μL של 60% MeOH (vol/vol) ו-200 μL של 10% MeOH/0.1% TFA (vol/vol).
- טענו את הפפטידים החומציים המסומנים ב-TMT משלב 9.10. על צלחת ההתפלה. שטפו את בארות הדגימה פי 2 עם 200 μL של 10% MeOH/0.1% TFA (vol/vol).
- הקפידו על הפפטידים ב-100 μL של 60% MeOH (vol/vol). מייבשים את הדגימות על ידי צנטריפוגת ואקום. ניתן לאחסן את הדגימה המיובשת עם תווית TMT בטמפרטורה של -80 מעלות צלזיוס למשך מספר חודשים.
- לצורך ניתוח ספקטרומטריית מסות של הדגימה המסומנת ב-TMT, הזריקו מחצית מהדגימה ושמרו את המחצית השנייה אם נדרשת עריכה חוזרת.
הערה: כמויות ההזרקה בספקטרומטריית המסה ישתנו בהתאם לעמודה הספציפית, להגדרת המכשיר ולסוג הדגימה.
11. ניתוח נתונים
הערה: שיטות סינון וניתוח נתונים משתנות והן מעבר להיקף של פרוטוקול זה, אך ההערות הבאות על ניתוח כלולות כדי לספק הדרכה ספציפית לסוג הנתונים הנובעים מפרוטוקול זה.
- חפש נתוני ספקטרומטריית מסות גולמיות מול מסד נתונים של פרוטאומים ספציפיים למין בהתבסס על מקור תאי הדגימה או הרקמה שבהם נעשה שימוש. כאן, שביט שימש כאלגוריתם חיפוש23.
- סנן את תוצאות החיפוש עם FDR של 1% על ידי התאמת הפרמטרים הספציפיים לאלגוריתם החיפוש22. לכימות ללא תוויות, השתמש במדידות שטח שיא של MS1 כדי לכמת את הנתונים. עבור דגימות עם תווית TMT, השתמש בעוצמות יונים של כתב הנגזרות מ-MSn לכימות. למובהקות סטטיסטית, נתחו את הדגימות במשולשים ביולוגיים.
- כדי לזהות דה נובו תת-יחידות PPP ואת האינטראקטיביסטים שלהן, ודא שדגימות ביולוגיות משולשות של דגימות מעוכבות MCLR ומטופלות DMSO מושוות. כדי להשוות את ה- PPPome בתנאים שונים או עם טיפול תרופתי, ודא שנוצרים משולשים ביולוגיים של כל מצב או טיפול תרופתי.
- סנן את הנתונים כך שיהיו רק חלבונים עם ספירת פפטידים כוללת >1 בלפחות שתיים מתוך שלוש דגימות שטופלו בבקרת DMSO. תחרות MCLR לא תמיד מתחרה בכל איגודי תת-היחידות הקטליטיות. כמו כן, חלק מיחידות המשנה הקטליטיות של PPP עשויות להיצמד באופן לא ספציפי לשרף הספרדי. כדי להסביר את אחת האפשרויות בעת סינון חלבונים שאינם נקשרים באופן ספציפי לשרף, הסר חלבונים עם ספירת פפטידים כוללת במצב שטופל ב-MCLR, הגבוהה מזו של כל תת-יחידה קטליטית של PPP.
- לא לכלול מזהמים נפוצים, כגון קרטין, קולגן, 40S ו 60S חלבונים ריבוזומליים, ו ribonucleoproteins גרעיניים הטרוגניים שאינם תת-יחידות PPP, מן הניתוח14.
- ייבוא נתונים מסוננים לפרסאוס על-ידי לחיצה על העלאת מטריצה גנרית במקטעטען 24,25. יומן2 המיר את הנתונים על-ידי מעבר אל > Basic > Transform, בחירת הנתונים וציון פונקציית הטרנספורמציה, במקרה זה log2(x).
- צמצם ערכים חסרים מהתפלגות רגילה על-ידי מעבר ל - Imputation > החלף ערכים חסרים מהתפלגות רגילה, בחירת הנתונים וציון הרוחב (ברירת המחדל 0.3) וההזזה למטה (ברירת המחדל 1.8) עבור החישוב. בצע נורמליזציה של קוונטיזציה על-ידי מעבר לנרמל > הנורמליזציה הקוונטית.
- חישוב יחסי יומן2 וערכי p של מבחן T של התלמיד עבור התנאים המתאימים. ראשית, ביאור הנתונים על-ידי מעבר אל Annot. שורות > שורות ביאור קטגוריאליות. בצע את מבחן ה- T על ידי מעבר לבדיקות > בדיקות דו-מדגמיות, ובחירת הקבוצות להשוואה, הבדיקה לביצוע והשיטה לתיקון בדיקת השערות מרובות כפי שהיא משמשת לחיתוך.
הערה: עבור זיהוי דה נובו , חלבון נחשב לחלבון המתקשר עם PPP אם השפע שלו מובהק סטטיסטית במצב שטופל ב-MCLR לעומת DMSO, עם שינוי של פי2 ביומן גדול מהשינוי המינימלי בקיפול של כל תת-יחידה ידועה ספציפית של PPP.
Access restricted. Please log in or start a trial to view this content.
תוצאות
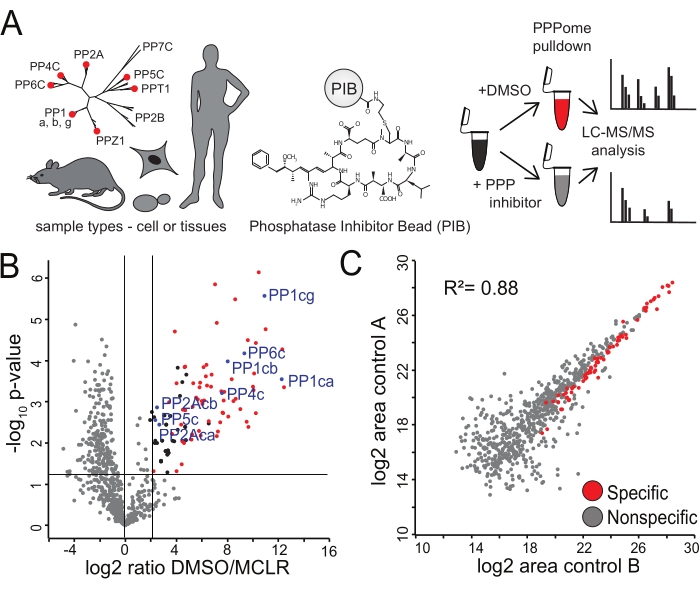
איור 2: זיהוי של קלסרים ספציפיים של PIBs. (A) ניתן לנתח מגוון סוגי רקמות או תאים באמצעות PIB-MS. תאי HeLa במשולש ביולוגי טופלו ב-DMSO או ב-MCLR מעכב ה-PPP, דוגרו באמצעות PIBs, ונותחו באמצעות LC-M...
Access restricted. Please log in or start a trial to view this content.
Discussion
PIB-MS היא גישה של פרוטאומיקה כימית המשמשת לפרופיל כמותי של ה-PPPome ממקורות דגימה שונים באנליזה אחת. עבודה רבה נעשתה באמצעות חרוזי מעכבי קינאז כדי לחקור את הקינום וכיצד הוא משתנה בסרטן ובמצבי מחלה אחרים 10,11,12,13. עם זאת, המחקר ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף ואין ניגודי עניינים.
Acknowledgements
A.N.K. מכיר בתמיכה של NIH R33 CA225458 ו- R35 GM119455. אנו מודים למעבדות קטנבאך וגרבר על הדיון המועיל.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile (ACN) | Honeywell | AH015-4 | CAUTION: ACN is flammable and toxic; wear gloves, and work in a chemical fume hood. |
| Anhydrous Acetonitrile | Sigma-Aldrich | 271004-100ML | CAUTION: ACN is flammable and toxic; wear gloves, and work in a chemical fume hood. |
| Benchtop centrifuge | Eppendorf | model no. 5424 | |
| Beta-glycerophosphoric acid, disodium salt pentahydrate | Acros Organics | 410991000 | |
| Centrifuge | Eppendorf | model no. 5810 R 15 amp version | |
| Distilled water | |||
| DMSO | Fisher Scientific | BP231-100 | |
| Dounce tissue grinder | Fisherbrand Pellet Pestles | 12-141-363 | |
| Empore solid phase extraction disk, C18 | CDS Analytical | 76333-132 | |
| Eppendorf tubes, 1.5 mL | Eppendorf | 22363204 | CRITICAL: Other tubes may leach polymer into sample, contaminating the analysis. |
| Eppendorf tubes, 2 mL | Eppendorf | 22363352 | CRITICAL: Other tubes may leach polymer into sample, contaminating the analysis. |
| Extraction plate manifold | Waters | WAT097944 | |
| Falcon tubes, 50 mL | VWR | 21008 | |
| Generic blunt end needle and plunger | |||
| Generic magnetic separation rack | |||
| HEPES | Sigma-Aldrich | H3375 | |
| Hydrogen chloride (HCl) | VWR Chemicals BDH | BDH3028 | CAUTION: HCl is corrosive; wear gloves and work in a chemical fume hood. |
| Hydroxylamine solution 50% (wt/vol) | Sigma-Aldrich | 467804 | |
| Incubator, 65 °C | VWR | model no. 1380FM | |
| Koptec Pure Ethanol, 200 Proof | Decon Labs | V1001 | |
| Methanol for HPLC (MeOH) | Sigma-Aldrich | 34860-4L-R | CAUTION: MeOH is flammable and toxic; wear gloves, and work in a chemical fume hood. |
| Microcystin LR (MCLR) | Cayman Chemical | 10007188 | CAUTION: MCLR is toxic; wear gloves when handling and avoid skin contact. |
| PBS, 1× without calcium and magnesium, pH 7.4 ± 0.1 | Corning | 21-040-CV | |
| pH test strips, such as MilliporeSigma MColorpHast pH test strips and indicator papers | Fisher Scientific | M1095310001 | |
| PIBs | For protocol for the generation of PIBs, see Moorhead et al., 2007. | ||
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| Pipette tips, 10 μL | Eppendorf | 22491504 | CRITICAL: Other tips may leach polymer into samples, contaminating the analysis. |
| Pipette tips, 1000 μL | Eppendorf | 22491555 | CRITICAL: Other tips may leach polymer into samples, contaminating the analysis. |
| Pipette tips, 200 μL | Eppendorf | 22491539 | CRITICAL: Other tips may leach polymer into samples, contaminating the analysis. |
| plastic syringe, 10 mL | BD | 309604 | |
| Protease inhibitor cocktail III | Research Products International | P50700-1 | |
| Q Exactive Plus Hybrid Quadrupole-Orbitrap Mass Spectrometer, Oribtrap Fusion, Orbitrap Fusion Lumos, or Orbitrap Eclipse Tribrid Mass Spectrometer | Thermo Scientific | ||
| Refrigerated benchtop centrifuge | Eppendorf | model no. 5424 R | |
| Rotator (Labquake Shaker Rotisserie) | Thermo Scientific | 13-687-12Q | 8 rpm rotation |
| Sample collection plate, 96- well, 1 mL | Waters | WAT058957 | |
| SDS | Fisher Scientific | BP1311-1 | |
| Sequencing grade modified trypsin | Promega | V511C | |
| Sodium azide | EMD Chemicals | SX0299-1 | CAUTION: Sodium azide is explosive and toxic; wear gloves, work in a chemical fume hood and avoid contact with metals. |
| Sodium chloride (NaCl) | Fisher Chemical | S27110 | |
| Sonicator (Branson digital sonifier) | model no. SFX 250 | ||
| SPE C18 desalting plate | Waters | 186001828BA | |
| SpeedBeads magnetic carboxylate modified particles (SP3 beads) | Cytiva | 6.51521E+13 | |
| Thermomixer | Eppendorf | model no. 5350 | |
| TMT10plex Isobaric Label Reagent Set plus TMT11-131C Label Reagent, 3 × 0.8 mg per tag | ThermoFisher | A37725 | |
| Trifluoroacetic acid (TFA) | Honeywell | T6508-25ML | CAUTION: TFA is corrosive and will irritate skin on contact. Wear gloves and eye protection, and work in a chemical fume hood. |
| Tris Base | Research Products International | T60040 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Vacuum centrifuge and vapor trap | Thermo Scientific | model nos. SpeedVac SPD120 and RVT5105 | |
| Vortexer (Vortex-Genie 2) | Scientific Industries | ||
| Water LC-MS | Honeywell | LC365-4 |
References
- Nilsson, J. Protein phosphatases in the regulation of mitosis. Journal of Cell Biology. 218 (2), 395-409 (2019).
- Brautigan, D. L. Protein Ser/Thr phosphatases--the ugly ducklings of cell signalling. The FEBS Journal. 280 (2), 324-345 (2013).
- Brautigan, D. L., Shenolikar, S. Protein serine/threonine phosphatases: keys to unlocking regulators and substrates. Annual Review of Biochemistry. 87, 921-964 (2018).
- Janssens, V., Goris, J. Protein phosphatase 2A: A highly regulated family of serine/threonine phosphatases implicated in cell growth and signalling. Biochemical Journal. 353, 417-439 (2001).
- Virshup, D. M., Shenolikar, S. From promiscuity to precision: protein phosphatases get a makeover. Molecular Cell. 33 (5), 537-545 (2009).
- Bollen, M., Peti, W., Ragusa, M. J., Beullens, M. The extended PP1 toolkit: designed to create specificity. Trends in Biochemical Sciences. 35 (8), 450-458 (2010).
- Qian, J., Winkler, C., Bollen, M. 4D-networking by mitotic phosphatases. Current Opinion in Cell Biology. 25 (6), 697-703 (2013).
- Heroes, E., et al. The PP1 binding code: a molecular-lego strategy that governs specificity. The FEBS Journal. 280 (2), 584-595 (2013).
- Eichhorn, P. J., Creyghton, M. P., Bernards, R. Protein phosphatase 2A regulatory subunits and cancer. Biochimica et Biophysica Acta. 1795 (1), 1-15 (2009).
- Bantscheff, M., et al. Quantitative chemical proteomics reveals mechanisms of action of clinical ABL kinase inhibitors. Nature Biotechnology. 25 (9), 1035-1044 (2007).
- Klaeger, S., et al. Chemical proteomics reveals ferrochelatase as a common off-target of kinase inhibitors. ACS Chemical Biology. 11 (5), 1245-1254 (2016).
- Duncan, J. S., et al. Dynamic reprogramming of the kinome in response to targeted MEK inhibition in triple-negative breast cancer. Cell. 149 (2), 307-321 (2012).
- Cooper, M. J., et al. Application of multiplexed kinase inhibitor beads to study kinome adaptations in drug-resistant leukemia. PLoS ONE. 8 (6), 66755(2013).
- Lyons, S. P., et al. A quantitative chemical proteomic strategy for profiling phosphoprotein phosphatases from yeast to humans. Molecular and Cellular Proteomics. 17 (12), 2448-2461 (2018).
- Nasa, I., et al. Quantitative kinase and phosphatase profiling reveal that CDK1 phosphorylates PP2Ac to promote mitotic entry. Science Signaling. 13 (648), (2020).
- Swingle, M., Ni, L., Honkanen, R. E. Small-molecule inhibitors of ser/thr protein phosphatases: specificity, use and common forms of abuse. Methods in Molecular Biology. 365, 23-38 (2007).
- Moorhead, G. B. G., Haystead, T. A. J., MacKintosh, C. Synthesis and use of the protein phosphatase affinity matrices microcystin-sepharose and microcystin-biotin-sepharose. Methods in Molecular Biology. 365, 39-45 (2007).
- Brauer, B. L., Wiredu, K., Mitchell, S., Moorhead, G. B., Gerber, S. A., Kettenbach, A. N. Affinity-based profiling of endogenous phosphoprotein phosphatases by mass spectrometry. Nature Protocols. 16 (10), 4919-4943 (2021).
- Hughes, C. S., Moggridge, S., Müller, T., Sorensen, P. H., Morin, G. B., Krijgsveld, J. Single-pot, solid-phase-enhanced sample preparation for proteomics experiments. Nature Protocols. 14 (1), 68-85 (2019).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nature Protocols. 2 (8), 1896-1906 (2007).
- Zecha, J., et al. TMT labeling for the masses: A robust and cost-efficient, in-solution labeling approach. Molecular and Cellular Proteomics. 18 (7), 1468-1478 (2019).
- Elias, J. E., Gygi, S. P. Target-decoy search strategy for increased confidence in large-scale protein identifications by mass spectrometry. Nature Methods. 4 (3), 207-214 (2007).
- Eng, J. K., Jahan, T. A., Hoopmann, M. R. Comet: an open-source MS/MS sequence database search tool. Proteomics. 13 (1), 22-24 (2013).
- Tyanova, S., et al. The Perseus computational platform for comprehensive analysis of (prote)omics data. Nature Methods. 13 (9), 731-740 (2016).
- Yu, S. H., Ferretti, D., Schessner, J. P., Rudolph, J. D., Borner, G. H. H., Cox, J. Expanding the Perseus software for omics data analysis With custom plugins. Current Protocols in Bioinformatics. 71 (1), 1-29 (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved