A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
טיפים כירורגיים וטריקים לביצוע השתלת לבלב חזיר
In This Article
Summary
מאמר הווידאו מסכם את הטכניקה של כריתת לבלב והשתלת לבלב במודל הישרדות חזירי של 3 ימים עם תיאור שלב אחר שלב של השיטה ודגש על הטיפים והטריקים הכירורגיים להתמודדות עם האנטומיה הקרבית החזירית הרעועה והעדינה.
Abstract
למרות התוצאות המבטיחות של השתלת לבלב בסוכרת מסוג 1 ובתסמונת מטבולית, הדאגה הגדולה ביותר סביב טכניקה חדישה זו נותרה מיעוט האיברים הנחשבים ראויים להשתלה. עמידות תוך וסקולרית גבוהה, מסגרת נימים תוך פרנכימלית עדינה ואנטומיה לובולרית מורכבת סביב כלי הדם המזנטריים הם שהופכים את האיבר הזה לרגיש יותר לפציעה ופחות סובלני לטראומה טריוויאלית בהשוואה לאיברים כמו הכבד והכליות. דיסקציה כירורגית קפדנית וטיפול מושכל ברקמות מהווים את אבן הפינה של כל תרגיל השתלת הלבלב. בשל הדמיון המורפולוגי בין האנטומיה של הלבלב החזירי לכלי הדם המזנטריים שמסביב לבין האיברים בהשוואה לאנטומיה האנושית, הדגמת הטכניקה במודל החזירי יכולה לעזור להסיק זאת בצורה המדויקת ביותר לסביבה אנושית. המאמר הנוכחי נועד לתאר את הטיפים והטריקים הכירורגיים החיוניים שיש לעקוב אחריהם, על מנת להבטיח שיעור הצלחה גבוה יותר של השתלת איבר רגיש מאוד זה במודל הישרדות חזירי של 3 ימים.
Introduction
במהלך העשורים האחרונים, חלה התקדמות משמעותית באסטרטגיות ניהול פריאופרטיביות ובטכניקות כירורגיות שהובילו לאבולוציה של השתלת לבלב לאחת האסטרטגיות המבטיחות ביותר לטיפול בסוכרת עם מחלת כליות סופנית (בדרך כלל בשילוב עם השתלת כליה)1 . עם זאת, סיבוכים כגון דלקת לבלב השתל, פגיעה איסכמיה-רפרפוזיה ופקקת כלי דם נותרו האתגרים הגדולים ביותר שיש להתגבר עליהם כדי להבטיח תוצאות מוצלחות, על אחת כמה וכמה בשתלי הקריטריוניםהמורחבים הפגומים יותר 2. בנוסף, שתלי לבלב הם השתלים הנפוצים ביותר המושלכים מרכש ויש להם את שיעורי הניצול הנמוכים ביותר (9%) עבור כל איבר3. לכן, זילוח מכונה נועד לספק סביבה הומיאוסטטית אופטימלית להשתלת הלבלב במטרה להגדיל את שיעור ניצול השתל, בדומה למה שהושג בהשתלות כבד, כליה וריאות4. האנטומיה של הלבלב החזירי מורכבת מבחינת הארכיטקטורה הלובולרית שלה (הכוללת שלוש אונות), השלוחות שלה סביב ציר המזנטריקו-פורטל, הווריאציות הווסקולריות המזנטריות שלה (ב-40%-50%), ותעלות כלי הדם העדינות שלה לאורך לולאת C של התריסריון5. תכונות אנטומיות אלה תורמות לדיסקציה מאתגרת הן בשליפת שתל הלבלב-תריסריון והן בכריתת הלבלב כדי לגרום למצב סוכרת א-לבלב יאטרוגני, כלומר מצב כירורגי של סוכרת עם רמת גלוקוז בצום מעל 8 mmol / L. בהתבסס על תכונות אלה, כריתת לבלב חזירי עם השתלה מספקת את השכפול הקרוב ביותר האפשרי של הטכניקה שניתן לבצע בבני אדם כטיפול סופי נגד השלב הסופי סוכרת. המאמר הנוכחי נועד לכסות את ההיבטים הבאים: (i) מתווה הטיפול הפרי-ניתוחי בחזיר במהלך כריתת הלבלב והשתלת הלבלב; (ii) פרטים טכניים שלב אחר שלב של כריתת הלבלב והשתלת השתל של הלבלב-תריסריון ו-(iii) טיפים וטריקים של פעולת הלבלב של התורם והמקבל במודלים חזיריים כדי למזער את הפגיעה בשתל ובמקבל.
Protocol
הפרוטוקול קיבל אישור אתי מוועדת הטיפול בבעלי חיים, מכון המחקר הכללי של טורונטו. בעלי חיים קיבלו טיפול הומני בהתאם לאגודה הלאומית למחקר רפואי ומדריך לטיפול בחיות מעבדה, המכון הלאומי לבריאות (NIH), אונטריו, קנדה. לצורך מחקר זה נעשה שימוש בחזיר זכר יורקשייר בן 15 שבועות, במשקל 40-50 ק"ג.
הערה: כל פרוטוקול המחקר מחולק לשלבים העיקריים הבאים: (i) שליפת איברים והכנת שולחן אחורי; (ii) כריתת הפנקטרינה הכוללת של המושתל ו-(iii) השתלת השתל. כל הניתוח של התורם והמקבל נעשה ביום אחד.
1. שאיבת איברים מתורם והכנת שולחן אחורי
הערה: השיטה לאחזור איברים תוארה בפרוטוקול נפרד6. עם זאת, הפרוטוקול, בקצרה, מתואר כאן יחד עם כמה נקודות נוספות ספציפיות לטכניקה הכירורגית (טיפים כירורגיים הרלוונטיים לניתוח תורם).
- בקיצור, מרדימים את החזיר התורם, ומאבטחים את נתיב האוויר ואת הצנתר הוורידי המרכזי (המתואר להלן בסעיף כריתת הלבלב המושתל). חותכים וחושפים את הקרביים. בצע דיסקציה של אבי העורקים וניוד עד הביפורקציה לכלי איליאק.
- טיפול במעיים: המעי הדק החזירי ארוך ומפותל, והמעי הגס ברובו נפוח. הקפידו למקם מחדש את לולאות המעי במקומן האנטומי לאחר כל שלב בניתוח התורם כדי להבטיח זילוח נאות ולמנוע אפשרות של פיתול מזנטרי.
- דיסקציה Hilar: לקשור ולחלק את ענפי העורקים ואת צינור המרה כדי לחשוף את הווריד הפורטלי. יש לנתח את ההילום (רצועת הפטו-תריסריון) גבוהה/דיסטלית ככל האפשר כדי למנוע את הסיכון לפגיעה בתעלות כלי הדם הקטנות המחוררות את האספקט העליון של אזור הלבלב-תריסריון. התחל לשלד את כלי הדם ברצף מימין לשמאל, עד שהמשטח הקדמי של וריד הפורטל חשוף.
- דיסקציה של אבי העורקים: חשוף את החלק האינפרא-סרעפתי העל-כבד של אבי העורקים על ידי חלוקת הקרורה הסרעפתית. הימנעו מדיסקציה של הווריד הנבוב הנחות סביב חורשת הלבלב-תריסריון. השתמש בעורקי הכליה משני הצדדים כגבול העליון המסומן של דיסקציה.
- חשוף את הלבלב על ידי פתיחת השק הקטן יותר. לקשור ולחלק את עורקי הכליה. לערבב את אבי העורקים האינפרא-כלייתי ולהתחבר לפתרון של אוניברסיטת ויסקונסין (UW) לשטיפה.
- לקשור את אבי העורקים העל-כבד ומהדק. סומק עם 1.5 L-2 L של תמיסת UW כדי להבטיח שטיפה נאותה של המעי והלבלב (ניכר על ידי המראה החזותי של חיוורון). במהלך שטיפה באתרו של האיבר, מקמו מחדש את המעי הדק ואת המעי הגס ברצף לקו האמצע כדי להבטיח שאין פיתול מזנטרי. שלב זה מבטיח שטיפה אחידה של המעי והלבלב עם תמיסת UW (אוניברסיטת ויסקונסין) וחשוב לזכור.
- חותכים את הווריד הפורטלי ואת הווריד הוורידי האינפרא-הפטי קאווה בו זמנית לאחר תחילת ההדחה כדי לשחרר את השפכים הוורידים. מכסים את הבטן בקרח כדי להבטיח זילוח קר. לנתח את האיבר (השתלת הלבלב עם חלקים של retroperitoneum, psoas, הטחול, יותרת הכליה) בהמוניהם.
- דיסקציה קרה: מתחילים לנייד את השתל מכיוון רוחבי למדיאלי, מזנב הלבלב ועד לצומת שבין הראש לקורפוס, על ידי דיסקציה חדה של הפאשיה בין הלבלב למעי הגס. בעת ביצוע שלב זה, החזיקו את הלבלב על ידי כיסוי רטרופריטוניאלי שלו במלקחיים ובקשו מהעוזר לתת מתיחה נגדית על המעי הגס לכיוון כף הרגל.
- הידוק מזנטרי: לאחר חלוקת הרקמה הדקה סביב קורפוס הלבלב, הלולאה הדואודנוג'ונלית והמעי הגס, בקשו מהעוזר לסובב את הפדיקל המזנטרי ולמשוך את לולאת המעי הגדול בצורה קאודלית. זה יבטיח תיחום של mesentery ומיקום בטוח של מהדק לחלק את כלי הדם העיקריים mesenteric ברצף מבלי לפגוע parenchyma הלבלב.
- דיסקציה חוץ-צפקית מלאה של השתל: לאחר חלוקת כלי הדם המזנטריים, מתחילים לשלוף את השתל על ידי דיסקציה מהמדיאלי לצדדי נגד כיוון השעון, ומחלקים את הרקמות החוץ-לבלביות, כולל הפאשיה הפאריותרנלית, בלוטת יותרת הכליה, השרוול של IVC, שריר הפסואס והקרוס הסרעפתי. ודא מישור מתאים הרחק מאבי העורקים כדי למנוע פגיעה בעורקים המזנטריים והצליאק העליונים.
- בצעו הכנת שולחן אחורי על קרח. אחסנו את האיבר בקופסת קרח (זמן איסכמיה קרה של 5 שעות).
2. כריתת פנקוטי מושתל
- הכנה טרום ניתוחית
- צום את החיה לפחות 6 שעות לפני זמן הזירוז שנקבע. יש לתת זריקה המכילה מידזולם (0.15 מ"ג/ק"ג), אטרופין (0.04 מ"ג/ק"ג) וקטמין (25 מ"ג/ק"ג) תת עורית (SC), 15 דקות לפני העברת בעל החיים לחדר ניתוח (OR). יש לתת בופרנורפין 0.3 מ"ג הזרקת שחרור מושהה SC 15 דקות לפני ההובלה לחדר הניתוח.
- מיקום: הניחו את בעל החיים בשכיבה על שולחן הניתוחים ורתמו את הגפיים הקדמיות כדי להבטיח תנוחה יציבה במהלך הניתוח.
- דרכי נשימה ואינדוקציה: אווררו את בעל החיים באמצעות שקית ומסכה עם איזופלורן 3%-5% ו-2-3 ליטר חמצן לדקה, תוך חיבור בדיקת דופק אוקסימטר וניטור קצב הלב ורוויה O2 .
- לאחר הרפיה נאותה, שאושרה על ידי הרפיה של הלסתות וריווי חמצן יציב וקצב לב, בקש מהעוזר להחזיק את הפה פתוח עם מתיחה נאותה על הלסתות העליונות והתחתונות הרגועות של החיה, ולדמיין את מיתרי הקול באמצעות הלרינגוסקופ. רססו לידוקאין 2% כדי להרפות את מיתרי הקול כדי למנוע עוויתות הנגרמות על ידי אינטובציה (מיתרי הקול החזיריים הם מאוד וסקולריים ושבריריים!).
- אינטובט באמצעות צינור אנדוטרכאלי 7 מ"מ ולנפח את השרוול באמצעות 3-5 מ"ל אוויר. ודא את מיקום הצינור באמצעות בדיקת CO 2 (ETCO2) וחבר את הצינור למכונת ההנשמה, עם 14-16 נשימות לדקה כדי להשיג נפח גאות של 10-15 מ"ל / ק"ג. הורידו את האיזופלורן ל-2.5% כמינון תחזוקה של הרדמה בשאיפה.
- קו תוך ורידי: להכין את האתר הכירורגי עם betadine ולהניח drape סטרילי. לאחר מכן, זהו את נקודת הציון כדי למקם את הצנתר הוורידי המרכזי, שהוא הצנטרויד של המשולש שנוצר בין תהליך המסטואיד, תהליך האקרומיון וראש עצם הבריח. השתמש במחט 16 גרם כדי לנקב את הווריד; לאחר הבטחת זרימה חופשית של דם ורידי, ניכר על ידי צבע וחוסר פעימה, להציג חוט מנחה באמצעות טכניקת Seldinger.
- מרחיבים את המערכת באמצעות המרחיב המסופק. החלף את חוט ההנחיה והמרחיב בצנתר 8.5 x 10 Fr וקבע את מקומם על ידי תפירה עם מחט חיתוך תפר משי 0-0. חבר את קו העירוי לאנטיביוטיקה תוך ורידית המכילה cefazolin (1 גרם) ו metronidazole (500 מ"ג) ולאחר מכן הרדמה תוך ורידית נעשה על ידי עירוי propofol בקצב של 10 מ"ל / שעה.
- ניטור לחץ דם פולשני: לאחר הכנת אתר הניתוח עם בטדין, מניחים וילון סטרילי ומבצעים חתך מקביל לקנה הנשימה במרחק של 2 ס"מ מקו האמצע. נתחו את סיבי שריר החזה והפאשיה הפארא-טרכאלית על ידי דיסקציה קהה באמצעות מלקחיים ישרי זווית ומלקחיים המוסטטיים של להי.
- לזהות את הווריד הצווארי הצידי לסיבי שרירי הרצועה ולנתח לאורך השריר המדדר אותו מעורק התרדמה מדיאלי באמצעות דיסקציה קהה כמתואר לעיל. זהה את העורק לפי פעימתו, מרקמו (דמוי חוט) ומקלעת כלי הדם. גייסו את הכלי וקלע אותו באמצעות שתי עניבות משי 2-0.
- נקב את כלי הדם עם צנתר אנגיו 16 G עם קצה משופע המצביע כלפי מעלה ולמשוך את הסטיילט הפנימי פעם אחת בתוך הכלי. החליקו את מעטפת הצנתר החיצונית בטכניקת סלדינגר וחברו את השקע למערכת מדידת לחץ הדם העורקי (BP). לפני חיבור צג BP הפולשני, כייל את הקריאה לאפס כדי להבטיח רישום מדויק ולאבטח את הצנתר במקומו באמצעות אזיקוני המשי לרוחב.
- ניטור טמפרטורה והתחממות: הניחו את בדיקת רישום הטמפרטורה דרך הפה. כסו את בעל החיים בשמיכת חימום מחבק Bair והבטיחו טמפרטורה של 37-38 מעלות צלזיוס. לשמן את העיניים עם ג'ל סיכה ניטרלי לעיניים. צביעה וכיסוי של שדה הניתוח
- הליך כירורגי
הערה: העור מוכן באופן אספטי לכל ההליכים הכירורגיים באמצעות פילינג בטאדין ואחריו מיקום וילונות סטריליים.- חתך וחשיפה: בצע חתך קו אמצע מה- xiphisternum ל- symphysis pubis באמצעות מצב חיתוך טהור של האלקטרוקאוטריה של בובי. הקפד לשמור לרוחב השופכה בחלק התחתון של החתך מעבר לפאלוס כדי למנוע פציעה. הניחו את משענת דופן הבטן התומכת בעצמה תוך הקפדה שלא לפגוע בטחול ובכבד, כדי לייעל את החשיפה של שדה הניתוח.
- ניוד ראש הלבלב: כאשר העוזר מספק מתיחה נגדית לחורשת הלבלב-תריסריון, התחל בניתוח לאורך המישור הפאשיאלי האווסקולרי בין פרנכימת הלבלב (אונת התריסריון) לבין IVC אינפרא כבד.
- ניוד טבעת הלבלב: הלבלב החזירי יוצר טבעת סביב ציר המזנטריקו-פורטל (אונה מקשרת). יש לנתח לאורך הפאשיה בכל היבט של וריד הפורטל (PV) כדי להבטיח ניוד מלא של האונה המחברת מה-PV שמעליה. הדרך הבטוחה ביותר היא להתחיל את הדיסקציה לאורך שני צדי וריד הפורטל ולהפריד את הרקמות בכיוון השעון או נגד כיוון השעון.
- גיוס זנב הלבלב: לאחר מכן, זהה את הצומת בין רקמות הלבלב והפאראדרנל (נראה כקו לבן) והתחל לנתח את הזנב מהווריד הטבורי התחתון הנשאר קרוב לפרנכימה . קשרו וחלקו את היובלים הוורידיים הקטנים לפרנכימה תוך הקפדה שלא לפגוע בווריד הטחול באמצעות קשרי משי 3/0.
- גיוס קורפוס הלבלב: חותכים לאורך שכבת הרקמה הדקה המפרידה בין הפרנכימה לבין המעי הגס והקיבה, תוך הקפדה על שימור ארקייד כלי הדם הדק לאורך האזור האינפרא-פילורי.
- ניוד לבלב-תריסריון: לאחר מכן, יש להפריד את הפרנכימה מלולאת C של התריסריון על ידי דיסקציה חדה בחורשת הלבלב-תריסריון על ידי מתיחה נגדית מתיחה, תוך הקפדה על שימור ארקייד כלי הדם הדק לאורך לולאת C של התריסריון.
- חלוקת צינור הלבלב: מזהים את צינור הלבלב, קושרים עם קשרי משי 2-0 ומחלקים תוך שמירה על כ 3-5 מ"מ גדם של הצינור על לולאת התריסריון C, תוך התרחקות מארקדת כלי הדם בתריסריון (ביחס הדוק לצינור).
- הסרת הדגימה: השלם את החלק האחרון של הניוד על ידי ניתוח הפרנכימה מהצומת בין האונה המקשרת, התריסריון והמעי הגס משני צדי וריד הפורטל. חלצו את הדגימה בהמוניהם (איור 1) על-ידי חלוקת האונה המחברת באספקט הקדמי של ה-PV. חלוקת הפרנכימה נדרשת כדי לחלץ את הדגימה החוצה בגלל מיקומה ההיקפי סביב PV.
- ודאו המוסטזיס לאורך אזורי הדיסקציה ובדקו את התריסריון לאיתור כל פציעה וגודש בכלי הדם (איור 2).
- השתלת שתל הלבלב-תריסריון
- הכנת השתל: הכן את השתל PV ואת קצה אבי העורקים הפרוקסימלי על ידי חיתוך הקצוות עבור אנסטומוזיס. הניחו את השתל המוכן בשקית האיברים עם תמיסת UW על אמבט קרח. קח ביופסיות מחט ליבה מזנב הלבלב -לאחסן פורמלין, להקפיא בזק, ולחלץ RNA בשלב מאוחר יותר. תפרו את אתר הביופסיה באמצעות פרולן 6-0 בצורה של 8.
- דיסקציה של אבי העורקים: התחילו בזיהוי השופכן הימני ונתחו לאורך הפאשיה המפרידה בין השופכן לכיסוי הרטרופריטוניאלי מעל הווריד הנבוב התחתון. יש לנתח לאורך הגבול הלטרלי של אבי העורקים כדי לחשוף אותו משריר הפסואס הבסיסי. לאחר מכן, לנתח לאורך חורשת interaortocaval כדי להפריד את אבי העורקים מן IVC.
- בדיקת מהדק: יש לוודא גיוס נאות של אבי העורקים וה- IVC על ידי ניסוי של מיקום מהדק כלי הדם של סטינסקי. החלף מיקום עם העוזר הראשון והכן את שדה הניתוח על ידי משיכת לולאות המעי בצד שמאל כדי לחשוף את כלי הדם העיקריים לאנסטומוזיס. הניחו את מהדקי הניסוי על IVC ואבי העורקים כדי להעריך מחדש גיוס נאות של שני כלי הדם לאנסטומוזיס.
- אנסטומוזה ורידית: לאחר הנחת מהדק נשיכת צד כלי הדם ב- IVC, יש ליצור פתח קטן בדופן הקדמית של כלי הדם ולהרחיב אותו לגודל מתאים (התואם לכלי השתל) באופן גולגולתי וקאודלי באמצעות מספריים של פוט. לשטוף את לומן עם מלוחים heparinized באמצעות נדן גמיש של צינורית IV.
- באמצעות פרולן 6-0 מחט כפולה, לעשות תפרים פינתיים על IVC (מבפנים החוצה) ואת וריד פורטל השתל (מבפנים החוצה). הדקו את התפר הפינתי הקאודלי והעבירו את אחת המחטים לאורך הדופן האחורית של וריד השתל והמקבל באופן רציף. אבטחו את הקיר הקדמי בצורה דומה (מבחוץ-רציפה) ואבטחו את הקשר במרכז הקיר הקדמי לאחר שטיפת לומן האנסטומוזה במי מלח הפריניזציה.
- הסרת הידוק הווריד: הניחו את מהדק כלי הדם של בולדוג על וריד פורטל השתל, הרחק מהאנסטומוזה, ושחררו לאט לאט את המהדק הנושך הצידי מה- IVC הנמען. בדוק אם יש מילוי ורידי וכל דימום גדול מהאנסטומוזיס.
- אנסטומוזה עורקית: הניחו את המהדק הנושך על אבי העורקים תוך הקפדה שלא לפגוע בענפים המותניים לאורך הדופן האחורית של כלי השיט. יש להנחות את המרדים להזריק הפרין (100 U/kg BW) ומתילפרדניזולון (500 מ"ג) דרך הצנתר הוורידי המרכזי.
- עשו פתח בדופן הקדמית של הכלי והרחיבו אותו בצורה גולגולתית וקאודלית תוך הקפדה שלא לנתח לאורך דופן הכלי. לשטוף את לומן עם מלוחים heparinized באמצעות פרולן 6-0 מחט כפולה, לתפור את הקצה הפרוקסימלי של אבי העורקים השתל לפתח אבי העורקים המקבל באופן רציף על ידי טכניקת מצנח. לשטוף את לומן עם מלוחים heparinized לפני קשירת הקשר הסופי על הקיר הקדמי של הכלי.
- רפרפוזיה: טפל בשני ההיבטים הבאים בעת ביצוע שלב זה. ראשית, השינויים ההמודינמיים שבהם מתרחשת נפילה דרסטית בממוצע BP. עקוב אחר BP פולשני דקה לדקה ובצע טיטרציה מינון של כלי הדם (עירוי נוראפינפרין), ועומס מראש של נוזלים כדי לשמור על ממוצע היעד BP בין 45-50 מ"מ כספית.
- שנית, לשמור על המוסטאזיס. לאחר הסרת מהדק הבולדוג מהווריד, להעריך עבור כל דימום גדול מן parenchyma, אזור para-aortic, ואזור peri-portal; לאחר מכן, לשחרר את מהדק אבי העורקים ולבדוק דימום מן האתר anastomotic העורקי. אבטחו את נקודות הדימום באמצעות ליגטורות ותפירה המוסטטית. בקשו מהמרדים להזריק בקבוקון של חומצה טרנקסמית דרך הצנתר הוורידי המרכזי.
הערה: כלל חשוב הוא למזער טיפול אגרסיבי של הלבלב בשלב זה של זילוח (כדי למנוע בצקת השתל והמטומה). - אנסטומוזה של המעי: לאחר שוידאתם שאין פיתול מזנטרי, בודדו לולאה של ג'ג'ונום, במרחק של 40-50 ס"מ מצומת הדואודנוז'ונל, והביאו אותה קרוב לשתל. אנסטומוז את תריסריון השתל לג'ג'ונום המקבל באופן רציף מצד לצד באמצעות תפר פולידיוקסאנון 4-0, תוך הקפדה על קוטר לומינלי נאות של 1.5-2 ס"מ.
- המוסטזיס וביופסיה שלאחר רפרפוזיה: יש לוודא המוסטזיס סביב השתל ובאתרים של אנסטומוזיס. יש ליטול שלוש ביופסיות מחט ליבה מזנב הלבלב1 שעות לאחר אחסון רפרפוזיה בפורמלין, להקפיא במהירות ולחלץ RNA בשלב מאוחר יותר. תפרו את אתר הביופסיה עם פרולן 6-0 בצורה של 8.
- סגירת דופן הבטן: לאחר הערכה של מגבים שמורים ואבטחת המוסטאזיס, תפרו את רקטוס הבטן בצורה רציפה באמצעות מחט פולידיוקסאנון 0 תוך הקפדה על קו האמצע התחתון כדי להתרחק מהשופכה. סגרו את העור באמצעות תפר משי 0 באופן רציף.
הערה: באופן אידיאלי, מומלץ להשתמש בתפרים מונופילמנטים (ניילון); עם זאת, מכיוון שמדובר במודל הישרדות של 3 ימים, משי מקובל במודלים ניסיוניים אלה. - קשירת הצנתר הוורידי המרכזי: יוצרים תעלה תת עורית על הצוואר ומאבטחים את הצנתר הוורידי המרכזי על ידי קבורתו מתחת למנהרה ותפירת העור שמעליו במחט חיתוך משי 0-0.
- הסרת הצנתר העורקי: לאחר הבטחת BP ממוצע יציב (40-50 מ"מ כספית) ומגמת שיפור של רמות pH ולקטט בניתוח גז הדם, יש להסיר את הצנתר העורקי ולקשור את כלי הדם כדי לאבטח המוסטזיס בצוואר. סגרו את העור שמעל העור בתפר משי 0 באופן רציף.
- מקמו את בעל החיים והוצאתו: בכל אמצעי הזהירות הנדרשים, הפכו את עצם החזה של בעל החיים על עגלת הובלה. שימו לב לרוויית O 2 והיפוך ההרדמה (תנועת גפיים, מאמצי נשימה ספונטניים, SpO 2 >95% הנחה על O2, ותמיכה במכונת הנשמה) ובצעו צינור לחיה. יש להעביר למכלאה ולמקם את עצם החזה של בעל החיים ולפקח על המצב ההמודינמי עד ליציבות.
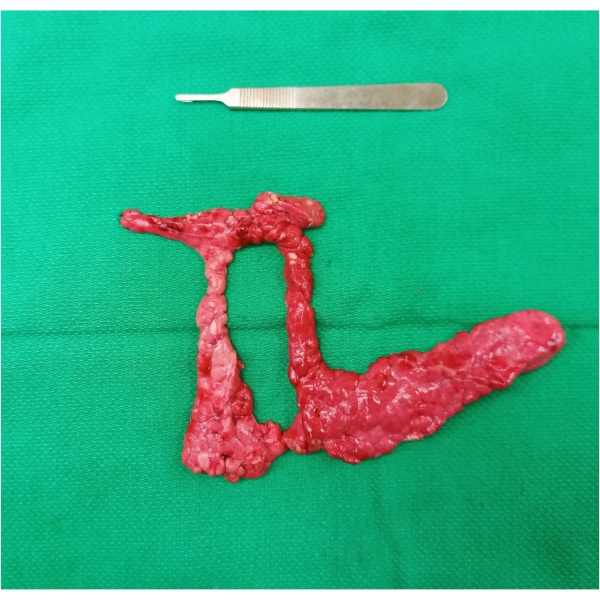
איור 1: דגימת Pancreatectomy שנכרתה בהמוניה. שימו לב לטבעת רקמת הלבלב המקיפה את וריד הפורטל in vivo. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
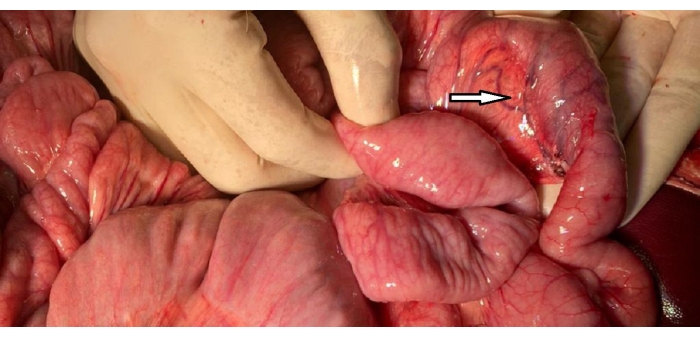
איור 2: תמונה של התריסריון. לולאת C של התריסריון עם ארקייד כלי דם שהשתמר (ראש חץ) בהשוואה ללולאת הג'ג'ונל שמסביב והוערכה לגודש. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
הפרמטרים הביוכימיים הפרי-ניתוחיים והפוסט-ניתוחיים, עד 3 ימים, מחמשת מודלי ההישרדות להשתלת לבלב מסוכמים להלן (ממוספרים כ-PTX 1 עד 5 בכרונולוגיה). מתוך חמש השתלות הלבלב הכוללות, כולן הצליחו היטב במהלך תקופת ההישרדות בת 3 הימים, כפי שניתן לראות ברווחתם הכללית ובמבחני הפגיעה בלבלב והתפקוד האנדוקר...
Discussion
הפרוטוקול הנוכחי בוצע כדי להדגים את הטכניקה ואת ההיתכנות של כריתת לבלב והשתלת לבלב במודלים חזיריים. בעלי החיים נצפו במשך תקופה של 3 ימים לאחר ההשתלה כדי להדגים את האמינות של הטכניקה של pancreatectomy ואת allotransplantation. כל בעלי החיים היו במעקב וטיפול במשך 3 ימים לאחר הניתוח באמצעות פרוטוקול סטנדרטי ל?...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
ללא.
Materials
| Name | Company | Catalog Number | Comments |
| Belzer UW Cold storage solution | Bridge to life Ltd (Columbia, SC, USA) | 4055 | |
| Calcium gluconate (10%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C360019 | |
| Composelect (blood collection bags) | Fresenius Kabi Canada Ltd (Toronto, ON) | PQ31555 | |
| Heparin (10000 IU/10 ml) | Fresenius Kabi Canada Ltd (Toronto, ON) | C504710 | |
| Lactated Ringer's | Baxter (Mississauga, ON, Canada) | JB2324 | |
| Percutaneous Sheath Introducer Set with Integral Hemostasis Valve/side Port for use with 7-7.5 Fr Catheters | Arrow International LLC | SI-09880 | |
| Sodium bicarbonate (8.4%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C908950 | |
| Solu-Medrol | Pfizer Canada Inc. | 52246-14-2 | |
| Surgical retreival and transplant instrument set |
References
- Gruessner, R. W., Gruessner, A. C. The current state of pancreas transplantation. Nature Reviews. Endocrinology. 9 (9), 555-562 (2013).
- Redfield, R. R., Rickels, M. R., Naji, A., Odorico, J. S. Pancreas transplantation in the modern era. Gastroenterology Clinics of North America. 45 (1), 145-166 (2016).
- Canadian Institute for Health Information. Annual Statistics on Organ Replacement in Canada: Dialysis, Tranplantation and Donation, 2009 to 2018. Canadian Institute for Health Information. , (2019).
- Prudhomme, T., et al. Ex-situ perfusion of pancreas for whole-organ transplantation: Is it safe and feasible?A systematic review. Journal of Diabetes Science and Technology. 14 (1), 120-134 (2020).
- Ferrer, J., et al. Pig pancreas anatomy: Implications for pancreas procurement, preservation, and islet isolation. Transplantation. 86 (11), 1503-1510 (2008).
- Parmentier, C., et al. Normothermic ex vivo pancreas perfusion for the preservation of pancreas allografts before transplantation. Journal of Visualized Experiments. , (2022).
- Chaib, E., et al. Total pancreatectomy: Porcine model for inducing diabetes - Anatomical assessment and surgical aspects. European Surgical Research. 46 (1), 52-55 (2011).
- Prudhomme, T., et al. Total pancreatectomy and pancreatic allotransplant in a porcine experimental model. Experimental and Clinical Transplantation. 18 (3), 353-358 (2022).
- Grussner, R., et al. Streptozotocin-induced diabetes mellitus in pigs. Hormone and Metabolic Research. 25 (4), 199-203 (1993).
- Mazilescu, L. I., et al. Normothermic ex situ pancreas perfusion for the preservation of porcine pancreas grafts. American Journal of Transplantation. 22 (5), 1339-1349 (2022).
- Kumar, R., et al. Ex vivo normothermic porcine pancreas: A physiological model for preservation and transplant study. International Journal of Surgery. 54, 206-215 (2018).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments. (101), e52909 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved