JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
돼지 췌장 이식을 위한 수술 요령과 요령
요약
비디오 기사는 돼지 3일 생존 모델에서 췌장 절제술 및 췌장 동종 이식 기술을 요약하고 방법에 대한 단계별 설명과 불안정하고 섬세한 돼지 내장 해부학을 다루기 위한 수술 요령 및 요령에 중점을 둡니다.
초록
제1형 당뇨병 및 대사 증후군에서 췌장 이식의 유망한 결과에도 불구하고 이 최첨단 기술에 대한 가장 큰 우려는 이식에 적합한 것으로 간주되는 장기의 부족입니다. 높은 혈관 내 저항, 섬세한 실질내 모세혈관 골격 및 장간막 혈관 주위의 복잡한 소엽 해부학은 이 기관을 간 및 신장과 같은 기관에 비해 손상에 더 취약하고 사소한 외상에 덜 관대하게 만듭니다. 꼼꼼한 외과적 해부와 신중한 조직 취급은 췌장 이식의 전체 운동의 초석을 형성합니다. 인체 해부학과 비교할 때 돼지 췌장의 해부학적 구조와 주변 장간막 혈관 및 장기 사이의 형태학적 유사성으로 인해 돼지 모델에서 기술을 시연하면 이를 인간 환경에 가장 정확하게 외삽하는 데 도움이 될 수 있습니다. 이 기사는 돼지 3일 생존 모델에서 이 매우 민감한 장기의 이식 성공률을 높이기 위해 따라야 하는 필수 수술 팁과 요령을 간략하게 설명하는 것을 목표로 합니다.
서문
지난 수십 년 동안 수술 전후 관리 전략과 수술 기법이 크게 발전하여 췌장 이식이 말기 신장 질환(일반적으로 신장 이식과 함께)이 있는 당뇨병 치료를 위한 가장 유망한 전략 중 하나로 발전했습니다.1 . 그러나 이식편 췌장염, 허혈 재관류 손상 및 혈관 혈전증과 같은 합병증은 성공적인 결과를 보장하기 위해 극복해야 할 가장 큰 과제로 남아 있으며, 더 손상된 확장 기준 이식편에서 더욱 그렇습니다2. 또한, 췌장 이식편은 조달 과정에서 가장 일반적으로 폐기되는 이식편이며 모든 장기에 대해 이용률이 가장 낮습니다(9%). 따라서 기계 관류는 간, 신장 및 폐 이식에서 달성된 것과 유사한 이식편 이용률을 높이는 것을 목표로 췌장 이식편에 최적의 항상성 환경을 제공하는 것을 목표로 합니다4. 돼지 췌장 해부학은 소엽 구조(3개의 엽으로 구성), 장간막-문맥 축 주변의 확장, 장간막 혈관 변이(40%-50%), 십이지장5의 C 루프를 따라 있는 섬세한 혈관 채널 측면에서 복잡합니다. 이러한 해부학적 특성은 췌장-십이지장 이식편 회수와 수용자 췌장 절제술 모두에서 의원성 췌장 당뇨병 상태, 즉 공복 혈당 수치가 8mmol/L 이상인 외과적으로 유발된 당뇨병 상태를 유도하는 데 도전적인 해부에 기여합니다. 이러한 특징을 바탕으로 이식을 통한 돼지 췌장 절제술은 말기에 대한 최종 치료로 인간에게 수행할 수 있는 기술의 가장 가까운 복제를 제공합니다 당뇨병. 본 기사는 다음과 같은 측면을 다루는 것을 목표로 합니다: (i) 수혜자 췌장 절제술 및 췌장 이식 이식 중 수술 전후 돼지 관리의 개요; (ii) 수혜자 췌장 절제술 및 췌장-십이지장 이식편의 이식에 대한 기술적 단계별 세부 사항 및 (iii) 이식편 및 수혜자 부상을 최소화하기 위한 돼지 모델에서 기증자 및 수혜자 췌장 수술의 팁과 요령.
프로토콜
이 프로토콜은 토론토 종합 연구 기관의 동물 관리위원회로부터 윤리적 승인을 받았습니다. 동물들은 캐나다 온타리오 주 국립 보건원 (NIH)의 국립 의학 연구 협회 (National Society of Medical Research) 및 실험실 동물 관리 가이드 (Guide for the care of laboratory animals)에 따라 인도적 보살핌을 받았습니다. 이 연구에서는 체중이 40-50kg인 15주령의 혈연 관계가 없는 요크셔 수컷 돼지를 사용했습니다.
참고: 연구의 전체 프로토콜은 다음과 같은 주요 단계로 나뉩니다: (i) 장기 회수 및 백테이블 준비; (ii) 수혜자 전체 췌장 절제술 및 (iii) 이식 이식. 기증자와 수혜자의 전체 수술은 1 일 안에 완료됩니다.
1. 기증자 장기 회수 및 백테이블 준비
참고: 장기 적출 방법은 별도의 프로토콜6에 설명되어 있습니다. 그러나 프로토콜은 수술 기술(기증자 수술과 관련된 수술 팁)과 관련된 몇 가지 추가 요점과 함께 여기에 간단히 설명되어 있습니다.
- 간단히 말해서, 기증자 돼지를 마취하고기도와 중심 정맥 카테터를 고정합니다 (아래 수혜자 췌장 절제술 섹션에 설명되어 있음). 내장을 절개하고 노출시킵니다. 장골 혈관으로 분기될 때까지 대동맥 절제 및 동원을 수행합니다.
- 배변 취급 : 돼지 소장은 길고 구불 구불하며 대장은 대부분 팽창합니다. 적절한 관류를 보장하고 장간막 비틀림의 가능성을 피하기 위해 기증자 수술의 모든 단계 후에 장 루프를 해부학적 위치에 재배치해야 합니다.
- Hilar 해부: 동맥 가지와 담관을 Ligate하고 분할하여 문맥을 노출시킵니다. 췌장-십이지장 영역의 상부 측면을 관류하는 작은 혈관 채널이 손상될 위험을 피하기 위해 문(간-십이지장 인대)을 가능한 한 높은/원위까지 해부합니다. 문맥의 앞쪽 표면이 드러날 때까지 오른쪽에서 왼쪽 순서로 혈관을 골격화하기 시작합니다.
- 대동맥-기갑 박리: 횡격막 crura를 분할하여 대동맥의 상-간-하-횡격막 부분을 노출시킵니다. 췌장-십이지장 숲 주변의 하대정맥의 해부를 피하십시오. 양쪽의 신장 동맥을 표시된 절개 상한선으로 사용하십시오.
- 작은 주머니를 열어 췌장을 노출시킵니다. 신장 동맥을 합자하고 나눕니다. 신장하 대동맥을 캐뉼러하고 홍조를 위해 위스콘신 대학교(UW) 용액과 연결합니다.
- supra-hepatic 대동맥을 Ligate and clamp. 장과 췌장의 적절한 홍조를 보장하기 위해 1.5L-2L의 UW 용액으로 세척합니다(창백한 시각적 모양으로 분명함). 장기를 제자리 세척하는 동안 소장과 대장을 정중선에 순서대로 재배치하여 장간막 비틀림이 없도록 합니다. 이 단계는 UW (University of Wisconsin) 용액으로 장과 췌장의 균일 한 홍조를 보장하며 기억하는 것이 중요합니다.
- 플러시를 시작한 후 문맥과 간하정맥을 동시에 절개하여 정맥 유출물을 배출합니다. 차가운 관류를 보장하기 위해 복부를 얼음으로 덮으십시오. 장기 (후 복막, 요근, 비장 및 부신의 일부가있는 췌장 십이지장 이식편)를 한꺼번에 해부하십시오.
- 냉간 해부: 췌장과 대장 사이의 근막을 날카롭게 절개하여 췌장의 꼬리에서 머리와 코퍼스 사이의 접합부까지 측면에서 내측 방향으로 이식편의 동원을 시작합니다. 이 단계를 수행하는 동안 집게로 후복막 덮개로 췌장을 잡고 조수에게 발을 향한 대장에 반대 견인을 하도록 요청하십시오.
- 장간막 클램핑: 췌장, 십이지장공장 루프 및 대장 주변의 얇은 조직을 분할한 후 조수에게 장간막 척추경 주위를 고리로 만들고 대장 루프를 꼬리 방향으로 당기도록 요청합니다. 이렇게 하면 장간막의 윤곽과 클램프의 안전한 배치가 보장되어 췌장 실질을 손상시키지 않고 장간막 주요 혈관을 순서대로 분할할 수 있습니다.
- 이식편의 복막외 절제 완료: 장간막 혈관을 분할한 후 시계 반대 방향으로 내측에서 측면으로 절개하여 이식편 회수를 시작하여 척추근막, 부신, IVC 커프, 요근 및 횡격막을 포함한 췌장외 조직을 분할합니다. 상부 장간막 및 셀리악 동맥이 손상되지 않도록 대동맥에서 적절한 평면을 확보하십시오.
- 얼음 위에서 백 테이블 준비를 수행하십시오. 장기를 아이스 박스에 보관하십시오 (냉 허혈 시간 5 시간).
2. 수상자 췌장 절제술
- 수술 전 준비
- 규정된 유도 시간 전에 최소 6시간 동안 동물을 금식시킵니다. 동물을 수술실로 이송하기 15분 전에 미다졸람(0.15mg/kg), 아트로핀(0.04mg/kg) 및 케타민(25mg/kg)이 포함된 주사를 피하(SC)로 투여합니다(SC). 수술실로 이송하기 15분 전에 부프레노르핀 0.3mg 서방성 주사 SC를 투여합니다.
- 포지셔닝: 동물을 앙와위 수술대에 놓고 앞다리를 활용하여 수술 중 안정적인 위치를 유지합니다.
- 기도 및 유도: 맥박 산소 측정기 프로브를 연결하고 심박수와 O 2 포화도를 모니터링하면서 분당 3%-5% 이소플루란과2-3L 산소가 함유된 백과 마스크를 사용하여 동물을 환기시킵니다.
- 턱의 이완과 안정적인 산소 포화도 및 심박수로 확인 된 적절한 이완 후, 조수에게 동물의 이완 된 위턱과 아래턱에 적절한 견인력으로 입을 벌리고 후두경을 사용하여 성대를 시각화하도록 요청하십시오. 삽관으로 인한 경련을 예방하기 위해 성대를 이완시키기 위해 2% 리도카인을 뿌립니다(돼지 성대는 혈관이 많고 연약합니다!).
- 7mm 기관내관을 사용하여 삽관하고 3-5mL의 공기를 사용하여 커프를 팽창시킵니다. 호기말 CO 2(ETCO2) 프로브를 사용하여 튜브의 위치를 확인하고 분당 14-16회 호흡하여 10-15mL/kg의 일회 호흡량을 달성하도록 튜브를 인공호흡기에 연결합니다. 흡입 마취의 유지 용량으로 isoflurane을 2.5%로 낮춥니다.
- 정맥 주사 라인: 베타딘으로 수술 부위를 무균 상태로 준비하고 멸균 드레이프를 놓습니다. 그런 다음 유양 돌기, 견봉 돌기 및 쇄골 머리 사이에 형성된 삼각형의 중심인 중심 정맥 카테터를 배치할 랜드마크를 식별합니다. 16G 바늘을 사용하여 정맥을 뚫습니다. 정맥혈의 자유로운 흐름을 확인한 후 색상과 박동성 부족으로 알 수 있으며 Seldinger 기술을 사용하여 가이드 와이어를 도입하십시오.
- 제공된 확장기를 사용하여 관을 확장하십시오. 가이드와이어와 확장기를 8.5 x 10 Fr 카테터로 교체하고 0-0 실크 봉합사 절단 바늘로 봉합하여 제자리에 고정합니다. 세파졸린(1gm)과 메트로니다졸(500mg)이 함유된 정맥항생제에 IV 라인을 연결한 후 프로포폴을 10mL/h의 속도로 주입하여 정맥 마취합니다.
- 침습적 혈압 모니터링: 베타딘으로 수술 부위를 무균적으로 준비한 후 멸균 드레이프를 놓고 정중선에서 2cm 떨어진 기관과 평행하게 절개합니다. 흉골 근육과 기관주위 근막의 섬유를 Lahey의 직각 집게와 지혈 집게를 사용하여 둔기로 해부합니다.
- 스트랩 근육의 섬유 측면에있는 경정맥을 확인하고 위에서 설명한대로 둔기 해부를 사용하여 경동맥에서 내측으로 구획화하여 근육을 따라 해부합니다. 맥동, 질감(탯줄 모양) 및 혈관주위 신경총으로 동맥을 식별합니다. 두 개의 실크 2-0 넥타이를 사용하여 선박을 동원하고 슬링하십시오.
- 비스듬한 끝이 위쪽을 향하도록 16G 혈관 카테터로 혈관에 구멍을 뚫고 내부 탐침을 혈관 내부로 한 번 빼냅니다. Seldinger 기술을 사용하여 외부 카테터 덮개를 밀고 출구를 동맥 혈압(BP) 측정 시스템에 연결합니다. 침습적 혈압 모니터를 연결하기 전에 정확한 기록을 보장하기 위해 판독값을 0으로 보정하고 실크 타이를 사용하여 카테터를 제자리에 고정합니다.
- 온도 모니터링 및 온난화: 온도 기록 프로브를 구두로 놓습니다. Bair-hugger 난방 이불로 동물을 덮고 37-38 °C의 온도를 확인하십시오. 중성 눈 윤활제 젤로 눈을 윤활하십시오. 수술 부위에 페인트 칠하고 드레이프하십시오.
- 수술
알림: 피부는 베타 딘 스크럽을 사용하여 모든 수술 절차를 위해 무균 상태로 준비한 다음 멸균 드레이프를 배치합니다.- 절개 및 노출: Bovie 전기 소작의 순수 절단 모드를 사용하여 xiphisternum에서 symphysis pubis까지 정중선 절개를 합니다. 부상을 방지하기 위해 남근 너머 절개 부위의 아래쪽 부분에 있는 요도 측면을 유지해야 합니다. 수술 부위의 노출을 최적화하기 위해 비장과 간을 손상시키지 않도록 주의하면서 자체 유지 복벽 견인기를 배치합니다.
- 췌장 머리의 동원 : 췌장-십이지장 숲에 반대 견인을 제공하는 조수와 함께 췌장 실질 (십이지장엽)과 간하 IVC 사이의 무 혈관 근막 평면을 따라 해부하는 것으로 시작합니다.
- 췌장 고리 동원: 돼지 췌장은 장간막-문맥축(연결엽) 주위에 고리를 형성합니다. 문맥(PV)의 양쪽 측면에서 근막을 따라 해부하여 위에 놓인 PV에서 연결 엽이 완전히 동원되도록 합니다. 가장 안전한 방법은 문맥의 양쪽을 따라 해부를 시작하고 시계 방향 또는 시계 반대 방향으로 원주 방향으로 조직을 분리하는 것입니다.
- 췌장 꼬리 동원: 다음으로, 췌장 조직과 비장 조직 사이의 접합부(흰색 선으로 표시됨)를 식별하고 실질 가까이에 있는 기본 비장 정맥에서 꼬리를 해부하기 시작합니다. 실질 실질에 작은 정맥 지류를 Ligate하고 나누고 실크 3/0 넥타이를 사용하여 비장 정맥을 손상시키지 않도록주의하십시오.
- 췌장 코퍼스 동원: 대장과 위에서 실질을 분리하는 조직의 얇은 층을 따라 해부하여 유문하부 영역을 따라 얇은 혈관 아케이드를 보존하도록 주의합니다.
- 췌장-십이지장 동원: 다음으로, 십이지장의 C 루프를 따라 얇은 혈관 아케이드를 보존하기 위해 주의하면서 견인-카운터 견인에 의해 췌장-십이지장 그로브에서 날카로운 절개로 십이지장의 C 루프에서 실질을 분리합니다.
- 췌관 분열 : 췌관을 식별하고 실크 2-0 넥타이로 결찰하고 십이지장 C 루프에서 덕트의 약 3-5mm 그루터기를 유지하면서 십이지장 혈관 아케이드 (덕트와 밀접한 관계)에서 멀리 떨어 뜨립니다.
- 검체 제거: 문맥 양쪽의 연결엽, 십이지장, 결장 사이의 접합부에서 실질을 해부하여 동원의 마지막 부분을 완료합니다. PV의 전방에서 연결 로브를 분할하여 표본을 한꺼번에 추출합니다(그림 1). 실질의 분할은 PV 주변의 원주 위치 때문에 표본을 추출하는 데 필요합니다.
- 해부 부위를 따라 지혈을 보장하고 십이지장에 부상과 혈관 울혈이 있는지 검사합니다(그림 2).
- 췌장 십이지장 이식편의 이식
- 이식편 준비: 문합을 위해 가장자리를 다듬어 이식편 PV와 근위 대동맥 말단을 준비합니다. 준비된 이식편을 얼음 욕조에 UW 용액과 함께 장기 백에 넣습니다. 췌장 꼬리에서 코어 바늘 생검을 받아 포르말린에 보관하고 스냅 동결하고 나중 단계에서 RNA를 추출합니다. Prolene 6-0을 사용하여 생검 부위를 8 방식으로 봉합합니다.
- 대동맥 박리: 오른쪽 요관을 식별하는 것으로 시작하고 하대정맥 위의 후복막 덮개에서 요관을 분리하는 근막을 따라 해부합니다. 대동맥의 측면 경계를 따라 해부하여 밑에 있는 요근에서 노출시킵니다. 다음으로, interaortocaval grove를 따라 해부하여 IVC에서 대동맥을 분리합니다.
- 클램프 테스트: Satinsky의 혈관 클램프 배치 시험을 통해 대동맥과 IVC의 적절한 동원을 보장합니다. 첫 번째 조수와 자세를 바꾸고 왼쪽의 장 루프를 수축시켜 문합을 위해 주요 혈관을 노출시켜 수술 부위를 준비합니다. 문합을 위한 두 혈관의 적절한 동원을 재평가하기 위해 IVC와 대동맥에 시험 클램프를 놓습니다.
- 정맥 문합: IVC에 혈관 측면 물림 클램프를 배치한 후 혈관 전벽에 작은 구멍을 만들고 Pott의 가위를 사용하여 두개골 및 꼬리 방향으로 적절한 크기(이식편 혈관과 일치)로 확장합니다. IV 캐뉼라의 유연한 덮개를 사용하여 헤파린 처리 식염수로 내강을 세척합니다.
- Prolene 6-0 이중 바늘을 사용하여 IVC(안쪽-바깥쪽)와 이식편 문맥(안쪽-바깥쪽)에 모서리 봉합사를 만듭니다. 꼬리 모서리 봉합사를 고정하고 이식편과 수용 정맥의 후벽을 따라 바늘 중 하나를 연속적으로 실행합니다. 전벽을 유사한(바깥쪽-연속) 방식으로 고정하고 문합의 내강을 헤파린 식염수로 세척한 후 전벽 중앙에 매듭을 고정합니다.
- 정맥 클램핑 해제: 불독의 혈관 클램프를 문합에서 멀리 떨어진 이식 문맥에 놓고 수혜자 IVC에서 측면 물림 클램프를 천천히 놓습니다. 정맥 보충 및 문합으로 인한 주요 출혈을 확인하십시오.
- 동맥 문합: 혈관의 후내벽을 따라 요추 가지가 손상되지 않도록 주의하면서 대동맥에 측면 물림 클램프를 놓습니다. 마취의에게 중심 정맥 카테터를 통해 헤파린(100U/kg BW)과 메틸프레드니솔론(500mg)을 주사하도록 지시합니다.
- 혈관의 전벽에 구멍을 뚫고 혈관 벽을 따라 해부되지 않도록 주의하면서 두개골과 꼬리 쪽으로 확장합니다. 헤파린 처리 식염수로 내강을 세척하고 Prolene 6-0 이중 바늘을 사용하여 이식편 대동맥의 근위 끝을 낙하산 기술로 연속적인 방식으로 수혜자 대동맥 개구부에 봉합합니다. 혈관의 전벽에 마지막 매듭을 묶기 전에 헤파린 처리 된 식염수로 내강을 세척하십시오.
- 재관류: 이 단계를 수행하는 동안 다음 두 가지 측면에 주의하십시오. 첫째, 평균 혈압의 급격한 하락이 발생하는 혈역학적 변화입니다. 침습적 혈압을 분 단위로 모니터링하고 목표 평균 혈압을 45-50mmHg 사이로 유지하기 위해 승압제(노르에피네프린 주입) 및 유체 예압의 용량 적정을 수행합니다.
- 둘째, 지혈을 유지하십시오. 정맥에서 불독 클램프를 제거한 후 실질, 대동맥 주위 부위 및 문맥 주위 부위의 주요 출혈을 평가합니다. 그런 다음 대동맥 클램프를 풀고 동맥 문합 부위에서 출혈이 있는지 확인합니다. 합자와 지혈 봉합으로 출혈 지점을 고정하십시오. 마취 전문의에게 중심 정맥 카테터를 통해 트라넥삼산 바이알을 주사하도록 요청하십시오.
참고: 중요한 규칙은 이 재관류 단계에서 췌장의 공격적인 취급을 최소화하는 것입니다(이식편 부종 및 혈종을 피하기 위해). - 장 문합 : 장간막 비틀림이 없는지 확인한 후 십이지장 접합부에서 40-50cm 떨어진 공장 루프를 분리하여 이식편에 가깝게 가져옵니다. 1.5-2cm의 적절한 내강 직경을 보장하기 위해 주의하면서 Polydioxanone 4-0 봉합사를 사용하여 수혜자 공장에 이식편 십이지장을 좌우로 연속적으로 문합합니다.
- 지혈 및 재관류 후 생검: 이식편 주변과 문합 부위에 지혈을 보장합니다. 재관류 후 췌장 꼬리에서 3개의 코어 바늘 생검을 채취하여 포르말린에 보관하고 스냅 동결하고 나중 단계에서 RNA를 추출합니다. Prolene 6-0으로 생검 부위를 8 방식으로 봉합합니다.
- 복벽 폐쇄: 잔류 걸레를 평가하고 지혈을 확보한 후 요도에서 멀리 떨어지도록 하부 정중선을 주의하면서 Polydioxanone 0 바늘을 사용하여 지속적으로 복직근을 봉합합니다. 실크 0 봉합사를 사용하여 피부를 연속적으로 닫습니다.
참고: 이상적으로는 모노필라멘트 봉합사(나일론)를 사용하는 것이 좋습니다. 그러나 이것은 3일 생존 모델이기 때문에 이러한 실험 모델에서는 실크가 허용됩니다. - 중심 정맥 카테터 묶기: 목에 피하 터널을 만들고 중심 정맥 카테터를 터널 아래에 묻고 실크 0-0 절단 바늘로 그 위에 있는 피부를 봉합하여 고정합니다.
- 동맥 카테터 제거 : 혈액 가스 분석에서 안정적인 평균 혈압 (40-50 mmHg)과 pH 및 젖산 수준의 개선 추세를 확인한 후 동맥 카테터를 제거하고 혈관을 결찰하여 목에 지혈을 확보합니다. 실크 0 봉합사로 덮인 피부를 연속적으로 닫습니다.
- 동물의 위치 지정 및 발관: 필요한 모든 예방 조치에 따라 동물의 흉골을 운반 카트에 싣습니다. O 2 포화 및 마취 역전(팔다리의 움직임, 자발 호흡 노력, SpO2>O2 95% 할인 및 인공호흡기 지원)을 관찰하고 동물을 발관합니다. 펜으로 이동하여 동물을 흉골에 배치하고 안정될 때까지 혈역학적 상태를 모니터링합니다.
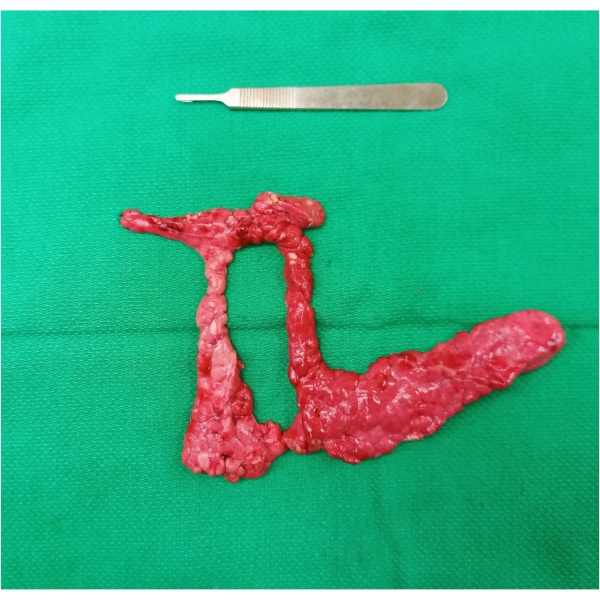
그림 1: 한 꺼번에 절제된 췌장 절제술 표본. 생체 내에서 문맥을 둘러싼 췌장 조직의 고리에 주목하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
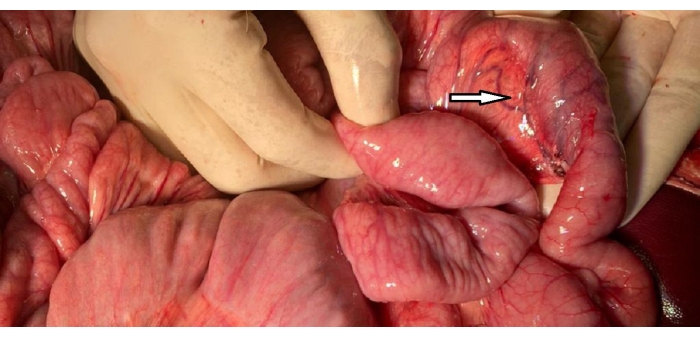
그림 2 : 십이지장 이미지. 보존된 혈관 아케이드(화살촉)가 있는 십이지장의 C 루프를 주변 공장 루프와 비교하고 혼잡에 대해 평가했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
5가지 췌장 이식 생존 모델의 수술 전후 및 수술 후 최대 3일의 생화학적 매개변수가 아래에 요약되어 있습니다(연대순으로 PTX 1에서 5로 번호가 매겨짐). 총 5건의 췌장 이식 중 모두 3일의 생존 기간 동안 잘 지냈으며, 이는 전반적인 건강 상태와 췌장 손상 및 내분비 기능 검사에서 알 수 있습니다. 아래에 묘사된 결과는 이식편의 정적 냉장 보관 후 췌장 동종 이식에 이어 수용자 췌장 절제술의 3?...
토론
현재 프로토콜은 돼지 모델에서 췌장 절제술 및 췌장 동종 이식의 기술과 타당성을 입증하기 위해 수행되었습니다. 동물을 이식 후 3일 동안 관찰하여 췌장 절제술 및 동종 이식 기술의 신뢰성을 입증했습니다. 모든 동물을 항생제, 수액, 진통제, 보충 영양 및 면역억제제(즉, 사이클로스포린)의 표준화된 동물 관리 프로토콜을 사용하여 수술 후 3일 동안 모니터링하고 간호했습니다. 그들은 수술 ?...
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
없음.
자료
| Name | Company | Catalog Number | Comments |
| Belzer UW Cold storage solution | Bridge to life Ltd (Columbia, SC, USA) | 4055 | |
| Calcium gluconate (10%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C360019 | |
| Composelect (blood collection bags) | Fresenius Kabi Canada Ltd (Toronto, ON) | PQ31555 | |
| Heparin (10000 IU/10 ml) | Fresenius Kabi Canada Ltd (Toronto, ON) | C504710 | |
| Lactated Ringer's | Baxter (Mississauga, ON, Canada) | JB2324 | |
| Percutaneous Sheath Introducer Set with Integral Hemostasis Valve/side Port for use with 7-7.5 Fr Catheters | Arrow International LLC | SI-09880 | |
| Sodium bicarbonate (8.4%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C908950 | |
| Solu-Medrol | Pfizer Canada Inc. | 52246-14-2 | |
| Surgical retreival and transplant instrument set |
참고문헌
- Gruessner, R. W., Gruessner, A. C. The current state of pancreas transplantation. Nature Reviews. Endocrinology. 9 (9), 555-562 (2013).
- Redfield, R. R., Rickels, M. R., Naji, A., Odorico, J. S. Pancreas transplantation in the modern era. Gastroenterology Clinics of North America. 45 (1), 145-166 (2016).
- Canadian Institute for Health Information. Annual Statistics on Organ Replacement in Canada: Dialysis, Tranplantation and Donation, 2009 to 2018. Canadian Institute for Health Information. , (2019).
- Prudhomme, T., et al. Ex-situ perfusion of pancreas for whole-organ transplantation: Is it safe and feasible?A systematic review. Journal of Diabetes Science and Technology. 14 (1), 120-134 (2020).
- Ferrer, J., et al. Pig pancreas anatomy: Implications for pancreas procurement, preservation, and islet isolation. Transplantation. 86 (11), 1503-1510 (2008).
- Parmentier, C., et al. Normothermic ex vivo pancreas perfusion for the preservation of pancreas allografts before transplantation. Journal of Visualized Experiments. , (2022).
- Chaib, E., et al. Total pancreatectomy: Porcine model for inducing diabetes - Anatomical assessment and surgical aspects. European Surgical Research. 46 (1), 52-55 (2011).
- Prudhomme, T., et al. Total pancreatectomy and pancreatic allotransplant in a porcine experimental model. Experimental and Clinical Transplantation. 18 (3), 353-358 (2022).
- Grussner, R., et al. Streptozotocin-induced diabetes mellitus in pigs. Hormone and Metabolic Research. 25 (4), 199-203 (1993).
- Mazilescu, L. I., et al. Normothermic ex situ pancreas perfusion for the preservation of porcine pancreas grafts. American Journal of Transplantation. 22 (5), 1339-1349 (2022).
- Kumar, R., et al. Ex vivo normothermic porcine pancreas: A physiological model for preservation and transplant study. International Journal of Surgery. 54, 206-215 (2018).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments. (101), e52909 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유