Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Trucs et astuces chirurgicaux pour effectuer une transplantation du pancréas porcin
Dans cet article
Résumé
L’article vidéo résume la technique de pancréatectomie et d’allotransplantation du pancréas dans un modèle de survie porcine de 3 jours avec une description étape par étape de la méthode et l’accent mis sur les trucs et astuces chirurgicaux pour faire face à l’anatomie viscérale porcine précaire et délicate.
Résumé
Malgré les résultats prometteurs de la transplantation du pancréas dans le diabète sucré de type 1 et le syndrome métabolique, la plus grande préoccupation autour de cette technique de pointe reste la rareté des organes jugés aptes à la transplantation. Une résistance intravasculaire élevée, un cadre capillaire intraparenchymateux délicat et une anatomie lobulaire complexe autour du système vasculaire mésentérique sont ce qui rend cet organe plus sensible aux blessures et moins tolérant aux traumatismes triviaux par rapport à des organes tels que le foie et les reins. Une dissection chirurgicale méticuleuse et une manipulation judicieuse des tissus constituent la pierre angulaire de tout l’exercice de transplantation du pancréas. En raison de la similitude morphologique entre l’anatomie du pancréas porcin et les vaisseaux mésentériques environnants et les organes par rapport à l’anatomie humaine, la démonstration de la technique dans le modèle porcin pourrait aider à extrapoler plus précisément cela à un contexte humain. Le présent article vise à décrire les trucs et astuces chirurgicaux essentiels qui doivent être suivis, afin d’assurer un taux de réussite plus élevé de la transplantation de cet organe très sensible dans un modèle porcin de survie de 3 jours.
Introduction
Au cours des dernières décennies, des progrès significatifs ont été réalisés dans les stratégies de prise en charge périopératoire et les techniques chirurgicales, ce qui a conduit à l’évolution de la transplantation du pancréas en l’une des stratégies les plus prometteuses pour le traitement du diabète sucré avec une insuffisance rénale terminale (généralement en conjonction avec une transplantation rénale)1 . Cependant, les complications telles que la pancréatite du greffon, les lésions d’ischémie-reperfusion et la thrombose vasculaire restent les plus grands défis à surmonter pour assurer des résultats positifs, plus encore dans les greffes à critères étendus plus endommagées2. En outre, les greffes de pancréas sont les greffes les plus couramment rejetées lors de l’approvisionnement et ont les taux d’utilisation les plus faibles (9%) pour tous les organes3. Par conséquent, la perfusion mécanique vise à fournir un milieu homéostatique optimal à la greffe du pancréas dans le but d’augmenter le taux d’utilisation du greffon, similaire à ce qui a été réalisé dans la transplantation hépatique, rénale et pulmonaire4. L’anatomie pancréatique porcine est complexe par son architecture lobulaire (comprenant trois lobes), ses extensions tout autour de l’axe mésentérique-portail, ses variations vasculaires mésentériques (à 40%-50%), et ses canaux vasculaires délicats le long de la boucle C du duodénum5. Ces attributs anatomiques contribuent à une dissection difficile à la fois dans le prélèvement du greffon pancréato-duodénal et dans la pancréatectomie receveuse pour induire un état de diabète apancréatique iatrogène, c’est-à-dire un état de diabète sucré induit chirurgicalement avec une glycémie à jeun supérieure à 8 mmol / L. Sur la base de ces caractéristiques, la pancréatectomie porcine avec transplantation fournit la réplication la plus proche possible de la technique qui pourrait être réalisée chez l’homme comme traitement définitif contre le stade terminal diabète sucré. Le présent article vise à couvrir les aspects suivants: (i) aperçu des soins porcins périopératoires pendant la pancréatectomie receveuse et l’implantation d’une greffe de pancréas; (ii) les détails techniques étape par étape de la pancréatectomie du receveur et de l’implantation du greffon pancréato-duodénal et (iii) les trucs et astuces de l’opération pancréatique du donneur et du receveur dans des modèles porcins pour minimiser les blessures du greffon et du receveur.
Protocole
Le protocole a reçu l’approbation éthique du Comité de protection des animaux de l’Institut de recherche générale de Toronto. Les animaux ont reçu des soins sans cruauté conformément au National Society of Medical Research and Guide for the care of laboratory animals, National Institute of Health (NIH), Ontario, Canada. Pour cette étude, des porcs mâles du Yorkshire âgés de 15 semaines, pesant entre 40 et 50 kg, ont été utilisés.
NOTE: L’ensemble du protocole de l’étude est divisé en les étapes principales suivantes: (i) prélèvement d’organes et préparation de la table arrière; (ii) Pancréatectomie totale du receveur et (iii) Implantation du greffon. Toute la chirurgie du donneur et du receveur se fait en 1 jour.
1. Prélèvement d’organes sur donneur et préparation de la table arrière
NOTE: La méthode de prélèvement d’organes a été décrite dans un protocole séparé6. Cependant, le protocole, en bref, est décrit ici avec quelques points supplémentaires à retenir spécifiques à la technique chirurgicale (conseils chirurgicaux pertinents pour l’opération du donneur).
- En bref, anesthésiez le porc donneur et fixez les voies respiratoires et le cathéter veineux central (décrits ci-dessous dans la section pancréatectomie du receveur). Inciser et exposer les viscères. Effectuer la dissection aortocaval et la mobilisation jusqu’à la bifurcation en vaisseaux iliaques.
- Manipulation de l’intestin: L’intestin grêle porcin est long et tortueux, et le gros intestin est principalement distendu. Assurez-vous de repositionner les anses intestinales dans leur position anatomique après chaque étape de l’opération du donneur pour assurer une perfusion adéquate et éviter la possibilité de torsion mésentérique.
- Dissection hilaire : Libeller et diviser les branches artérielles et le canal biliaire pour exposer la veine porte. Disséquer le hile (ligament hépato-duodénal) le plus haut/distal possible pour éviter le risque de blesser les petits canaux vasculaires qui perfuse l’aspect supérieur de la région pancréato-duodénale. Commencez à squeletter les vaisseaux dans une séquence de droite à gauche, jusqu’à ce que la surface antérieure de la veine porte soit nue.
- Dissection aorto-cavale: Exposer la partie infra-diaphragmatique supra-hépatique de l’aorte en divisant la croûte diaphragmatique. Éviter la dissection de la veine cave inférieure autour du bosquet pancréato-duodénal. Utilisez les artères rénales des deux côtés comme limite supérieure marquée de la dissection.
- Exposez le pancréas en ouvrant le sac inférieur. Litérer et diviser les artères rénales. Canuler l’aorte infrarénale et se connecter à la solution de l’Université du Wisconsin (UW) pour le rinçage.
- Ligate l’aorte supra-hépatique et la pince. Rincer avec 1,5 L-2 L de solution UW pour assurer un rinçage adéquat de l’intestin et du pancréas (évident par l’apparence visuelle de la pâleur). Pendant le rinçage in situ de l’organe, repositionner l’intestin grêle et le gros intestin en séquence jusqu’à la ligne médiane en veillant à ce qu’il n’y ait pas de torsion mésentérique. Cette étape assure un rinçage uniforme de l’intestin et du pancréas avec la solution UW (University of Wisconsin) et est importante à retenir.
- Inciser simultanément la veine porte et la veine cave infrahépatique après le début du rinçage pour laisser sortir l’effluent veineux. Couvrir l’abdomen avec de la glace pour assurer la perfusion froide. Disséquer l’organe (greffe pancréatoduodénale avec des parties de rétropéritoine, de psoas, de rate et de surrénale) en masse.
- Dissection à froid: Début de la mobilisation du greffon de la direction latérale à la direction médiale, de la queue du pancréas à la jonction entre la tête et le corpus, par dissection aiguë du fascia entre le pancréas et le gros intestin. Tout en effectuant cette étape, tenez le pancréas par son revêtement rétropéritonéal avec une pince et demandez à l’assistant de donner une contre-traction sur le gros intestin vers le pied.
- Serrage mésentérique: Après avoir divisé le tissu mince autour du corps du pancréas, de l’anse duodénojéjunale et du gros intestin, demandez à l’assistant de faire une boucle autour du pédicule mésentérique et de tirer le gros crête intestinale par caudale. Cela assurera la délimitation du mésentère et la mise en place sûre de la pince pour diviser les principaux vaisseaux mésentériques en séquence sans blesser le parenchyme pancréatique.
- Dissection extrapéritonéale complète du greffon: Après avoir divisé les vaisseaux mésentériques, commencez à récupérer le greffon par dissection de la médiale à la latérale dans le sens inverse des aiguilles d’une montre, en divisant les tissus extrapancréatiques, y compris le fascia pararénal, la glande surrénale, la coiffe de l’IVC, le muscle psoas et les crus diaphragmatiques. Assurez-vous d’un plan adéquat loin de l’aorte pour éviter de blesser les artères mésentériques et cœliaques supérieures.
- Effectuer la préparation de la table arrière sur la glace. Conserver l’organe dans une glacière (temps d’ischémie froide de 5 h).
2. Pancréatectomie du receveur
- Préparation préopératoire
- Jeûnez l’animal pendant au moins 6 heures avant l’heure d’induction stipulée. Administrer une injection contenant du midazolam (0,15 mg/kg), de l’atropine (0,04 mg/kg) et de la kétamine (25 mg/kg) par voie sous-cutanée (SC), 15 minutes avant de transporter l’animal vers la salle d’opération (RC). Administrer 0,3 mg de buprénorphine injectable à libération prolongée SC 15 minutes avant le transport vers la salle d’opération.
- Positionnement: Placez l’animal couché sur le dos sur la table d’opération et harnachez les membres antérieurs pour assurer une position stable pendant la chirurgie.
- Voies respiratoires et induction : Aérez l’animal à l’aide d’un sac et d’un masque contenant 3 % à 5 % d’isoflurane et 2 à 3 L d’oxygène par minute, tout en connectant la sonde de l’oxymètre de pouls et en surveillant la fréquence cardiaque et la saturation enO2 .
- Après une relaxation adéquate, confirmée par un relâchement des mâchoires et une saturation en oxygène et une fréquence cardiaque stables, demandez à l’assistant de maintenir la bouche ouverte avec une traction adéquate sur les mâchoires supérieure et inférieure détendues de l’animal et visualisez les cordes vocales à l’aide du laryngoscope. Vaporisez 2% de lidocaïne pour détendre les cordes vocales afin de prévenir les spasmes induits par l’intubation (les cordes vocales porcines sont très vasculaires et fragiles!).
- Intuber à l’aide d’un tube endotrachéal de 7 mm et gonfler le brassard à l’aide de 3 à 5 ml d’air. Assurez-vous de la position du tube à l’aide de la sonde de CO 2 en fin de marée (ETCO2) et connectez le tube au ventilateur, avec 14 à 16 respirations par minute pour atteindre un volume courant de 10 à 15 mL/kg. Réduire l’isoflurane à 2,5 % comme dose d’entretien de l’anesthésie inhalée.
- Ligne intraveineuse: préparer de manière aseptique le site chirurgical avec de la bétadine et placer un champ stérile. Ensuite, identifiez le point de repère pour placer le cathéter veineux central, qui est le centroïde du triangle formé entre le processus mastoïdien, le processus acromion et la tête de la clavicule. Utilisez une aiguille de 16 G pour percer la veine; après avoir assuré la libre circulation du sang veineux, apparente par la couleur et l’absence de pulsatilité, introduire un fil guide en utilisant la technique Seldinger.
- Dilatez le tractus à l’aide du dilatateur fourni. Remplacez le fil guide et le dilatateur par un cathéter de 8,5 x 10 Fr et fixez-le en place en suturant avec une aiguille de coupe de suture en soie 0-0. Connectez la ligne IV aux antibiotiques intraveineux contenant de la céfazoline (1 g) et du métronidazole (500 mg) suivie d’une anesthésie intraveineuse effectuée par perfusion de propofol à raison de 10 mL/h.
- Surveillance invasive de la pression artérielle: Après avoir préparé de manière aseptique le site chirurgical avec de la bétadine, placez un champ stérile et faites une incision parallèle à la trachée à 2 cm de la ligne médiane. Disséquer les fibres du muscle sternomastoïde et du fascia paratrachéal par dissection contondante à l’aide des pinces à angle droit et des pinces hémostatiques de Lahey.
- Identifier la veine jugulaire latérale aux fibres des muscles de la sangle et disséquer le long du muscle en le compartimentant médialement de l’artère carotide en utilisant une dissection contondante comme décrit ci-dessus. Identifiez l’artère par sa pulsation, sa texture (en forme de cordon) et son plexus périvasculaire. Mobilisez le récipient et éliminez-le à l’aide de deux liens en soie 2-0.
- Percer le vaisseau à l’aide d’un angiocathéter de 16 G avec une pointe biseautée pointant vers le haut et retirer le stylet interne une fois à l’intérieur du vaisseau. Faites glisser la gaine externe du cathéter à l’aide de la technique Seldinger et connectez la sortie au système de mesure de la pression artérielle (PA). Avant de connecter le moniteur de tension invasif, calibrez la lecture à zéro pour assurer un enregistrement précis et fixez le cathéter en place à l’aide des attaches en soie.
- Surveillance et réchauffement de la température : Placez la sonde d’enregistrement de la température par voie orale. Couvrir l’animal avec la couette chauffante Bair-hugger et assurer une température de 37-38 °C. Lubrifiez les yeux avec un gel lubrifiant neutre pour les yeux. Peindre et draper le champ chirurgical
- Intervention chirurgicale
REMARQUE: La peau est préparée de manière aseptique pour toutes les interventions chirurgicales à l’aide de gommages à la bétadine suivis de la mise en place de champs stériles.- Incision et exposition: Faites une incision médiane du xiphisternum à la symphyse pubienne en utilisant le mode de coupe pure de l’électrocautérisation de Bovie. Assurez-vous de rester latéral à l’urètre dans la partie inférieure de l’incision au-delà du phallus pour éviter les blessures. Placez l’écarteur auto-retenant de la paroi abdominale en prenant soin de ne pas blesser la rate et le foie, afin d’optimiser l’exposition du champ chirurgical.
- Mobilisation de la tête du pancréas : Avec l’assistant assurant la contre-traction au bosquet pancréato-duodénal, commencez par disséquer le long du plan fascial avasculaire entre le parenchyme pancréatique (lobe duodénal) et l’IVC infra-hépatique.
- Mobilisation de l’anneau pancréatique : Le pancréas porcin forme un anneau autour de l’axe mésentérique-portail (lobe de connexion). Disséquer le long du fascia sur l’un ou l’autre aspect de la veine porte (PV) pour assurer une mobilisation complète du lobe de connexion à partir du PV sus-jacent. Le moyen le plus sûr est de commencer la dissection de chaque côté de la veine porte et de séparer les tissus circonférentiellement dans le sens des aiguilles d’une montre ou dans le sens inverse des aiguilles d’une montre.
- Mobilisation de la queue pancréatique : Ensuite, identifiez la jonction entre les tissus pancréatique et pararénal (vue par une ligne blanche) et commencez à disséquer la queue de la veine splénique sous-jacente en restant près du parenchyme. Liférer et diviser les petits affluents veineux au parenchyme, en prenant soin de ne pas blesser la veine splénique à l’aide de liens de soie 3/0.
- Mobilisation du corpus pancréatique : Disséquer la fine couche de tissu séparant le parenchyme du gros intestin et de l’estomac, en prenant soin de préserver la mince arcade vasculaire le long de la région infra-pylorique.
- Mobilisation pancréato-duodénale : Ensuite, séparer le parenchyme de la boucle C du duodénum par dissection aiguë dans le bosquet pancréato-duodénal par traction-contre-traction, en prenant soin de préserver la mince arcade vasculaire le long de la boucle C du duodénum.
- Division du canal pancréatique: Identifier le canal pancréatique, ligaturer avec des liens de soie 2-0 et diviser en gardant environ 3-5 mm de souche du canal sur la boucle C duodénale, en restant à l’écart de l’arcade vasculaire duodénale (en relation étroite avec le canal).
- Retrait de l’échantillon : Complétez la dernière partie de la mobilisation en disséquant le parenchyme de la jonction entre le lobe de connexion, le duodénum et le côlon de chaque côté de la veine porte. Extraire l’échantillon en masse (Figure 1) en divisant le lobe de connexion sur la face antérieure du PV. La division du parenchyme est nécessaire pour extraire l’échantillon en raison de son emplacement circonférentiel autour du PV.
- Assurer l’hémostase le long des zones de dissection et inspecter le duodénum pour détecter toute blessure et congestion vasculaire (figure 2).
- Implantation du greffon pancréato-duodénal
- Préparation du greffon: Préparer la greffe PV et l’extrémité aortique proximale en coupant les bords pour l’anastomose. Placez la greffe préparée dans le sac d’organe avec la solution UW sur un bain de glace. Prélever des biopsies à l’aiguille du tronc pancréatique dans du formol, congeler et extraire l’ARN à un stade ultérieur. Suturer le site de biopsie en utilisant Prolene 6-0 dans un chiffre de 8 mode.
- Dissection aorto-cavale: Commencez par identifier l’uretère droit et disséquez le long du fascia séparant l’uretère de la couverture rétropéritonéale sur la veine cave inférieure. Disséquer le long du bord latéral de l’aorte pour l’exposer du muscle psoas sous-jacent. Ensuite, disséquez le long du bosquet interaortocaval pour séparer l’aorte de l’IVC.
- Test de serrage: Assurer une mobilisation adéquate de l’aorte et de l’IVC par un essai de la mise en place de la pince vasculaire de Satinsky. Changez de position avec le premier assistant et préparez le champ chirurgical en rétractant les anses intestinales du côté gauche pour exposer les principaux vaisseaux à l’anastomose. Placez les pinces d’essai sur IVC et l’aorte pour réévaluer une mobilisation adéquate des deux vaisseaux pour l’anastomose.
- Anastomose veineuse: Après avoir placé la pince vasculaire mordante latérale dans le IVC, faites une petite ouverture dans la paroi antérieure du vaisseau et étendez-la à une taille adéquate (correspondant au vaisseau du greffon) crânienne et caudale à l’aide des ciseaux de Pott. Rincer la lumière avec une solution saline héparinée à l’aide de la gaine flexible d’une canule IV.
- À l’aide de la double aiguille Prolene 6-0, faites des points de coin sur l’IVC (à l’envers) et la veine porte du greffon (à l’envers). Fixez la suture du coin caudale et passez l’une des aiguilles le long de la paroi postérieure de la veine greffée et receveuse de manière continue. Fixez la paroi antérieure de manière similaire (extérieur-en continu) et fixez le nœud au centre de la paroi antérieure après avoir rincé la lumière de l’anastomose avec une solution saline héparinisée.
- Dé-clamper la veine: Placez la pince vasculaire d’un bouledogue sur la veine porte du greffon, loin de l’anastomose, et relâchez lentement la pince mordante latérale du receveur IVC. Vérifiez s’il y a un remplissage veineux et tout saignement majeur de l’anastomose.
- Anastomose artérielle: Placez la pince latérale sur l’aorte en prenant soin de ne pas blesser les branches lombaires le long de la paroi postéromédiale du vaisseau. Demander à l’anesthésiste d’injecter de l’héparine (100 U/kg de poids corporel) et de la méthylprednisolone (500 mg) par le cathéter veineux central.
- Faites une ouverture sur la paroi antérieure du vaisseau et étendez-la crânienne et caudale en prenant soin de ne pas disséquer le long de la paroi du vaisseau. Rincer la lumière avec une solution saline héparinée et, à l’aide de la double aiguille Prolene 6-0, suturer l’extrémité proximale de l’aorte greffée jusqu’à l’ouverture aortique réceptrice de manière continue par la technique du parachute. Rincer la lumière avec une solution saline héparinée avant d’attacher le nœud final sur la paroi antérieure du vaisseau.
- Reperfusion : Prenez soin des deux aspects suivants lors de l’exécution de cette étape. Tout d’abord, les altérations hémodynamiques où une chute drastique de la PA moyenne se produit. Surveiller la PA invasive minute après minute et effectuer un titrage de dose du vasopresseur (perfusion de noradrénaline) et une précharge liquidienne pour maintenir la PA moyenne cible entre 45 et 50 mmHg.
- Deuxièmement, maintenir l’hémostase. Après avoir retiré la pince de bouledogue de la veine, évaluer la présence de saignements majeurs du parenchyme, de la région para-aortique et de la zone péri-portale; Ensuite, relâchez la pince aortique et vérifiez s’il y a un saignement du site anastomotique artériel. Fixez les points de saignement avec des ligatures et des sutures hémostatiques. Demandez à l’anesthésiste d’injecter un flacon d’acide tranexamique par le cathéter veineux central.
NOTE: Une règle importante est de minimiser la manipulation agressive du pancréas pendant cette phase de reperfusion (pour éviter l’œdème de greffe et l’hématome). - Anastomose intestinale : après ne pas s’être assuré de torsion mésentérique, isoler une boucle de jéjunum, à 40-50 cm de la jonction duodénojeunale, et la rapprocher du greffon. Anastomose le duodénum greffé au jéjunum receveur de manière continue côte à côte à l’aide d’une suture Polydioxanone 4-0, en prenant soin d’assurer un diamètre luminal adéquat de 1,5-2 cm.
- Hémostase et biopsie post-reperfusion : Assurer l’hémostase autour du greffon et aux sites d’anastomose. Prélever trois biopsies à l’aiguille de la queue pancréatique 1 h après le stockage de reperfusion dans le formol, congeler et extraire l’ARN à un stade ultérieur. Suturer le site de biopsie avec Prolene 6-0 dans un chiffre de mode 8.
- Fermeture de la paroi abdominale: Après avoir évalué les vadrouilles retenues et sécurisé l’hémostase, suturer le droit de l’abdomen de manière continue à l’aide d’une aiguille Polydioxanone 0 en prenant soin de la ligne médiane inférieure pour rester à l’écart de l’urètre. Fermez la peau à l’aide de la suture de soie 0 de manière continue.
REMARQUE: Idéalement, les sutures monofilament (Nylon) sont recommandées; Cependant, comme il s’agit d’un modèle de survie à 3 jours, la soie est acceptable dans ces modèles expérimentaux. - Sanglage du cathéter veineux central: Créez un tunnel sous-cutané sur le cou et fixez le cathéter veineux central en l’enfouissant sous le tunnel et en suturant la peau sus-jacente avec une aiguille de coupe en soie 0-0.
- Retrait du cathéter artériel: Après avoir assuré une TA moyenne stable (40-50 mmHg) et une tendance à l’amélioration des niveaux de pH et de lactate sur l’analyse des gaz du sang, retirer le cathéter artériel et ligaturer le vaisseau pour assurer l’hémostase dans le cou. Fermez la peau sus-jacente avec la suture de soie 0 de manière continue.
- Positionner l’animal et l’extubation : Sous toutes les précautions nécessaires, tournez le sternal de l’animal sur un chariot de transport. Observer la saturation en O 2 et l’inversion de l’anesthésie (mouvement des membres, efforts respiratoires spontanés, SpO 2 >95% de réduction sur O2 et assistance respiratoire) et extuber l’animal. Transporter vers l’enclos et positionner le sternal de l’animal et surveiller l’état hémodynamique jusqu’à l’établement.
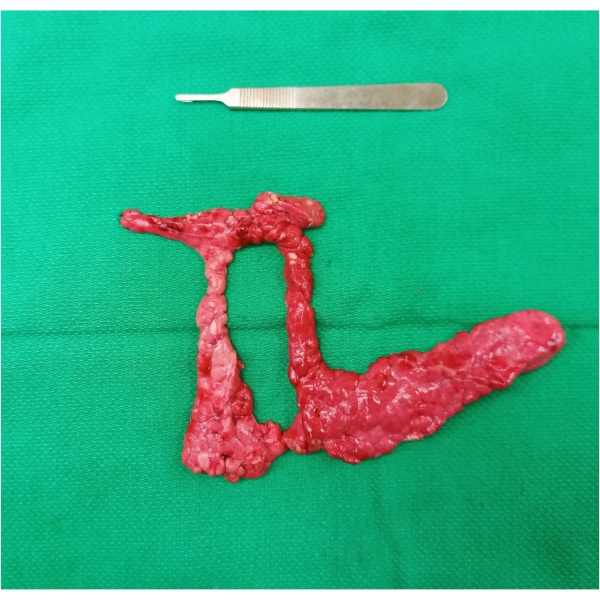
Figure 1 : Échantillon de pancréatectomie réséqué en masse. Notez l’anneau de tissu pancréatique entourant la veine porte in vivo. Veuillez cliquer ici pour voir une version agrandie de cette figure.
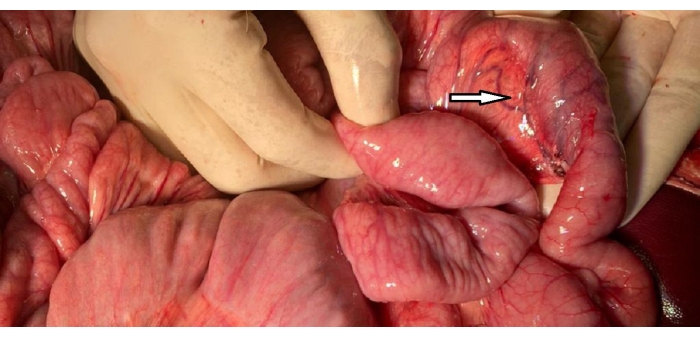
Figure 2 : Image du duodénum. La boucle C du duodénum avec une arcade vasculaire préservée (pointe de flèche) comparée à la boucle jéjunale environnante et évaluée pour la congestion. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Les paramètres biochimiques périopératoires et postopératoires, jusqu’à 3 jours, des cinq modèles de survie à la greffe du pancréas sont résumés ci-dessous (numérotés PTX 1 à 5 dans la chronologie). Sur les cinq greffes totales de pancréas, toutes se sont bien déroulées pendant la période de survie de 3 jours, comme en témoignent leur bien-être général et les tests de lésion pancréatique et de la fonction endocrinienne. Les résultats décrits ci-dessous sont représentatifs de l’expérience d?...
Discussion
Le protocole actuel a été réalisé pour démontrer la technique et la faisabilité de la pancréatectomie et de l’allotransplantation du pancréas dans des modèles porcins. Les animaux ont été observés pendant une période de 3 jours après la transplantation pour démontrer la fiabilité de la technique de pancréatectomie et de l’allotransplantation. Tous les animaux ont été surveillés et soignés pendant 3 jours après la chirurgie à l’aide d’un protocole normalisé de soins aux animaux comprenant d...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| Belzer UW Cold storage solution | Bridge to life Ltd (Columbia, SC, USA) | 4055 | |
| Calcium gluconate (10%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C360019 | |
| Composelect (blood collection bags) | Fresenius Kabi Canada Ltd (Toronto, ON) | PQ31555 | |
| Heparin (10000 IU/10 ml) | Fresenius Kabi Canada Ltd (Toronto, ON) | C504710 | |
| Lactated Ringer's | Baxter (Mississauga, ON, Canada) | JB2324 | |
| Percutaneous Sheath Introducer Set with Integral Hemostasis Valve/side Port for use with 7-7.5 Fr Catheters | Arrow International LLC | SI-09880 | |
| Sodium bicarbonate (8.4%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C908950 | |
| Solu-Medrol | Pfizer Canada Inc. | 52246-14-2 | |
| Surgical retreival and transplant instrument set |
Références
- Gruessner, R. W., Gruessner, A. C. The current state of pancreas transplantation. Nature Reviews. Endocrinology. 9 (9), 555-562 (2013).
- Redfield, R. R., Rickels, M. R., Naji, A., Odorico, J. S. Pancreas transplantation in the modern era. Gastroenterology Clinics of North America. 45 (1), 145-166 (2016).
- Canadian Institute for Health Information. Annual Statistics on Organ Replacement in Canada: Dialysis, Tranplantation and Donation, 2009 to 2018. Canadian Institute for Health Information. , (2019).
- Prudhomme, T., et al. Ex-situ perfusion of pancreas for whole-organ transplantation: Is it safe and feasible?A systematic review. Journal of Diabetes Science and Technology. 14 (1), 120-134 (2020).
- Ferrer, J., et al. Pig pancreas anatomy: Implications for pancreas procurement, preservation, and islet isolation. Transplantation. 86 (11), 1503-1510 (2008).
- Parmentier, C., et al. Normothermic ex vivo pancreas perfusion for the preservation of pancreas allografts before transplantation. Journal of Visualized Experiments. , (2022).
- Chaib, E., et al. Total pancreatectomy: Porcine model for inducing diabetes - Anatomical assessment and surgical aspects. European Surgical Research. 46 (1), 52-55 (2011).
- Prudhomme, T., et al. Total pancreatectomy and pancreatic allotransplant in a porcine experimental model. Experimental and Clinical Transplantation. 18 (3), 353-358 (2022).
- Grussner, R., et al. Streptozotocin-induced diabetes mellitus in pigs. Hormone and Metabolic Research. 25 (4), 199-203 (1993).
- Mazilescu, L. I., et al. Normothermic ex situ pancreas perfusion for the preservation of porcine pancreas grafts. American Journal of Transplantation. 22 (5), 1339-1349 (2022).
- Kumar, R., et al. Ex vivo normothermic porcine pancreas: A physiological model for preservation and transplant study. International Journal of Surgery. 54, 206-215 (2018).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments. (101), e52909 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon