È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Suggerimenti chirurgici e trucchi per eseguire il trapianto di pancreas suino
In questo articolo
Riepilogo
L'articolo video riassume la tecnica di pancreatectomia e allotrapianto del pancreas in un modello di sopravvivenza suina di 3 giorni con una descrizione passo-passo del metodo e l'enfasi sui suggerimenti e trucchi chirurgici per affrontare la precaria e delicata anatomia viscerale suina.
Abstract
Nonostante i risultati promettenti del trapianto di pancreas nel diabete mellito di tipo 1 e nella sindrome metabolica, la più grande preoccupazione intorno a questa tecnica all'avanguardia rimane la scarsità di organi ritenuti idonei al trapianto. L'elevata resistenza intravascolare, la delicata struttura capillare intraparenchimica e la complessa anatomia lobulare intorno alla vascolarizzazione mesenterica sono ciò che rende questo organo più suscettibile alle lesioni e meno tollerante ai traumi banali rispetto a organi come il fegato e i reni. Una meticolosa dissezione chirurgica e una gestione giudiziosa dei tessuti costituiscono la pietra angolare dell'intero esercizio del trapianto di pancreas. A causa della somiglianza morfologica tra l'anatomia del pancreas suino ai vasi mesenterici circostanti e gli organi rispetto all'anatomia umana, la dimostrazione della tecnica nel modello suino potrebbe aiutare a estrapolare più accuratamente questo a un ambiente umano. Il presente articolo si propone di delineare i suggerimenti e i trucchi chirurgici essenziali che devono essere seguiti, al fine di garantire un più alto tasso di successo del trapianto di questo organo altamente suscettibile in un modello di sopravvivenza suina di 3 giorni.
Introduzione
Negli ultimi decenni, ci sono stati progressi significativi nelle strategie di gestione perioperatoria e nelle tecniche chirurgiche che hanno portato all'evoluzione del trapianto di pancreas in una delle strategie più promettenti per il trattamento del diabete mellito con malattia renale allo stadio terminale (di solito in combinazione con il trapianto di rene)1 . Tuttavia, complicazioni come la pancreatite del trapianto, il danno da ischemia-riperfusione e la trombosi vascolare rimangono le maggiori sfide da superare per garantire risultati positivi, soprattutto negli innesti a criteri estesi più danneggiati2. Inoltre, gli innesti di pancreas sono gli innesti più comunemente scartati dall'approvvigionamento e hanno i tassi di utilizzo più bassi (9%) per qualsiasi organo3. Pertanto, la perfusione della macchina mira a fornire un ambiente omeostatico ottimale all'innesto di pancreas con l'obiettivo di aumentare il tasso di utilizzo del trapianto, simile a quanto è stato ottenuto nel trapianto di fegato, reni e polmoni4. L'anatomia pancreatica suina è complessa in termini di architettura lobulare (comprendente tre lobi), estensioni intorno all'asse mesenterico-portale, variazioni vascolari mesenteriche (nel 40%-50%) e delicati canali vascolari lungo l'ansa C del duodeno5. Questi attributi anatomici contribuiscono a una dissezione impegnativa sia nel recupero del trapianto pancreato-duodenale che nella pancreatectomia ricevente per indurre uno stato di diabete apancreatico iatrogeno, cioè uno stato di diabete mellito indotto chirurgicamente con un livello di glucosio a digiuno superiore a 8 mmol / L. Sulla base di queste caratteristiche, la pancreatectomia suina con trapianto fornisce la replicazione più vicina possibile della tecnica che potrebbe essere eseguita nell'uomo come trattamento definitivo contro lo stadio terminale. diabete mellito. Il presente articolo si propone di coprire i seguenti aspetti: (i) cenni alla cura peri-operatoria dei suini durante la pancreatectomia ricevente e l'impianto dell'innesto di pancreas; (ii) dettagli tecnici passo dopo passo della pancreatectomia ricevente e dell'impianto dell'innesto pancreato-duodenale e (iii) suggerimenti e trucchi per l'operazione pancreatica del donatore e del ricevente nei modelli suini per ridurre al minimo l'innesto e la lesione del ricevente.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Il protocollo ha ricevuto l'approvazione etica dal Comitato per la cura degli animali, istituto di ricerca generale di Toronto. Gli animali hanno ricevuto cure umane in conformità con la National Society of Medical Research and Guide for the care of laboratory animals, National Institute of Health (NIH), Ontario, Canada. Per questo studio sono stati utilizzati suini maschi dello Yorkshire di 15 settimane non imparentati, del peso di 40-50 kg.
NOTA: L'intero protocollo dello studio è suddiviso nelle seguenti fasi principali: (i) Prelievo di organi e preparazione del back-table; (ii) pancreatectomia totale del ricevente e (iii) impianto di innesto. L'intero intervento chirurgico del donatore e del ricevente viene eseguito in 1 giorno.
1. Prelievo di organi da donatore e preparazione del back-table
NOTA: Il metodo per il prelievo degli organi è stato descritto in un protocollo separato6. Tuttavia, il protocollo, in breve, è descritto qui insieme ad alcuni punti aggiuntivi da portare a casa specifici per la tecnica chirurgica (suggerimenti chirurgici rilevanti per l'operazione del donatore).
- In breve, anestetizzare il maiale donatore e fissare le vie aeree e il catetere venoso centrale (descritto di seguito nella sezione pancreatectomia ricevente). Incidi ed esponi i visceri. Eseguire la dissezione aortocavale e la mobilizzazione fino alla biforcazione in vasi iliaci.
- Manipolazione dell'intestino: l'intestino tenue suino è lungo e tortuoso e l'intestino crasso è per lo più disteso. Assicurarsi di riposizionare le anse intestinali nella loro posizione anatomica dopo ogni fase dell'operazione del donatore per garantire un'adeguata perfusione ed evitare la possibilità di torsione mesenterica.
- Dissezione ilare: legare e dividere i rami arteriosi e il dotto biliare per esporre la vena porta. Sezionare l'ilo (legamento epato-duodenale) il più alto/distale possibile per evitare il rischio di danneggiare i piccoli canali vascolari che perfondono l'aspetto superiore della regione pancreato-duodenale. Inizia a scheletrare i vasi in una sequenza da destra a sinistra, fino a quando la superficie anteriore della vena porta giace nuda.
- Dissezione aorto-cavale: esporre la parte infra-diaframmatica sopra-epatica dell'aorta dividendo la crura diaframmatica. Evitare la dissezione della vena cava inferiore intorno al boschetto pancreato-duodenale. Utilizzare le arterie renali su entrambi i lati come limite superiore marcato di dissezione.
- Esporre il pancreas aprendo il sacco minore. Litigare e dividere le arterie renali. Cannulare l'aorta infrarenale e connettersi con la soluzione dell'Università del Wisconsin (UW) per il lavaggio.
- Ligate l'aorta e il morsetto sopra-epatici. Sciacquare con 1,5 L-2 L di soluzione UW per garantire un adeguato lavaggio dell'intestino e del pancreas (evidente dall'aspetto visivo del pallore). Durante il lavaggio in situ dell'organo, riposizionare l'intestino tenue e l'intestino crasso in sequenza sulla linea mediana assicurando che non vi sia torsione mesenterica. Questo passaggio garantisce un lavaggio uniforme dell'intestino e del pancreas con la soluzione UW (University of Wisconsin) ed è importante ricordare.
- Incidi contemporaneamente la vena porta e la vena cava infraepatica dopo aver iniziato il lavaggio per far uscire l'effluente venoso. Coprire l'addome con ghiaccio per garantire la perfusione fredda. Sezionare l'organo (innesto pancreatoduodenale con parti di retroperitoneo, psoas, milza e surrene) in massa.
- Dissezione a freddo: iniziare la mobilizzazione dell'innesto dalla direzione laterale a quella mediale, dalla coda del pancreas alla giunzione tra la testa e il corpo, mediante una brusca dissezione della fascia tra il pancreas e l'intestino crasso. Durante l'esecuzione di questo passaggio, tenere il pancreas per la sua copertura retroperitoneale con una pinza e chiedere all'assistente di dare controtrazione sull'intestino crasso verso il piede.
- Bloccaggio mesenterico: dopo aver diviso il tessuto sottile attorno al corpo del pancreas, all'ansa duodenodigiunale e all'intestino crasso, chiedere all'assistente di girare attorno al peduncolo mesenterico e tirare caudalmente l'ansa dell'intestino crasso. Ciò garantirà la delineazione del mesentere e il posizionamento sicuro del morsetto per dividere i vasi principali mesenterici in sequenza senza ferire il parenchima pancreatico.
- Dissezione extra-peritoneale completa dell'innesto: dopo aver diviso i vasi mesenterici, iniziare a recuperare l'innesto mediante dissezione da mediale a laterale in senso antiorario, dividendo i tessuti extrapancreatici, tra cui la fascia pararenale, la ghiandola surrenale, il bracciale di IVC, il muscolo psoas e le cru diaframmatiche. Garantire un piano adeguato lontano dall'aorta per evitare di ferire le arterie mesenterica e celiaca superiore.
- Eseguire la preparazione del tavolo posteriore sul ghiaccio. Conservare l'organo in una ghiacciaia (tempo di ischemia fredda di 5 ore).
2. Pancreatectomia ricevente
- Preparazione pre-operatoria
- Digiunare l'animale per almeno 6 ore prima del tempo di induzione stabilito. Somministrare un'iniezione contenente midazolam (0,15 mg/kg), atropina (0,04 mg/kg) e ketamina (25 mg/kg) per via sottocutanea (SC), 15 minuti prima di trasportare l'animale in sala operatoria (OR). Somministrare buprenorfina 0,3 mg per iniezione a rilascio prolungato SC 15 minuti prima del trasporto in sala operatoria.
- Posizionamento: posizionare l'animale supino sul tavolo operatorio e imbracare gli arti anteriori per garantire una posizione stabile durante l'intervento.
- Vie aeree e induzione: ventilare l'animale usando una borsa e una maschera con isoflurano al 3% -5% e ossigeno 2-3 L al minuto, collegando la sonda pulsossimetrica e monitorando la frequenza cardiaca e la saturazione di O2 .
- Dopo un adeguato rilassamento, confermato dal rilassamento delle mascelle e dalla saturazione stabile di ossigeno e frequenza cardiaca, chiedere all'assistente di tenere aperta la bocca con un'adeguata trazione sulle mascelle superiori e inferiori rilassate dell'animale e visualizzare le corde vocali usando il laringoscopio. Spruzzare lidocaina al 2% per rilassare le corde vocali e prevenire gli spasmi indotti dall'intubazione (le corde vocali suine sono altamente vascolari e fragili!).
- Intubare con un tubo endotracheale da 7 mm e gonfiare il bracciale con 3-5 ml di aria. Garantire la posizione del tubo utilizzando la sonda di CO 2 (ETCO2) e collegare il tubo al ventilatore, con 14-16 respiri al minuto per ottenere un volume corrente di 10-15 ml / kg. Abbassare l'isoflurano al 2,5% come dose di mantenimento dell'anestesia inalatoria.
- Linea endovenosa: preparare asetticamente il sito chirurgico con betadine e posizionare un drappeggio sterile. Quindi, identificare il punto di riferimento per posizionare il catetere venoso centrale, che è il centroide del triangolo formato tra il processo mastoideo, il processo di acromion e la testa della clavicola. Utilizzare un ago da 16 G per perforare la vena; dopo aver assicurato il libero flusso di sangue venoso, evidente dal colore e dalla mancanza di pulsatilità, introdurre un filo guida utilizzando la tecnica Seldinger.
- Dilatare il tratto usando il dilatatore fornito. Sostituire il filo guida e il dilatatore con un catetere 8,5 x 10 Fr e fissarli in posizione suturandoli con un ago da taglio per sutura in seta 0-0. Collegare la linea IV agli antibiotici per via endovenosa contenenti cefazolina (1 g) e metronidazolo (500 mg) seguita da anestesia endovenosa eseguita mediante infusione di propofol alla velocità di 10 ml / h.
- Monitoraggio invasivo della pressione arteriosa: dopo aver preparato asetticamente il sito chirurgico con betadine, posizionare un drappo sterile e praticare un'incisione parallela alla trachea a 2 cm dalla linea mediana. Sezionare le fibre del muscolo sternomastoideo e della fascia paratracheale mediante dissezione smussata usando la pinza ad angolo retto di Lahey e la pinza emostatica.
- Identificare la vena giugulare lateralmente alle fibre dei muscoli della cinghia e sezionare lungo il muscolo compartimentandolo dall'arteria carotide medialmente usando la dissezione smussata come descritto sopra. Identificare l'arteria dalla sua pulsazione, consistenza (simile al cordone) e plesso perivascolare. Mobilitare la nave e fiondarla usando due cravatte di seta 2-0.
- Forare il vaso con un angiocatetere da 16 G con una punta smussata rivolta verso l'alto e ritirare lo stiletto interno una volta all'interno del vaso. Far scorrere la guaina esterna del catetere utilizzando la tecnica Seldinger e collegare l'uscita al sistema di misurazione della pressione arteriosa (BP). Prima di collegare il monitor BP invasivo, calibrare la lettura a zero per garantire una registrazione accurata e fissare il catetere in posizione utilizzando le fascette di seta trasversali.
- Monitoraggio della temperatura e riscaldamento: posizionare la sonda di registrazione della temperatura per via orale. Coprire l'animale con il piumino riscaldante Bair-hugger e garantire una temperatura di 37-38 °C. Lubrificare gli occhi con un gel lubrificante neutro per gli occhi. Dipingi e drappeggi il campo chirurgico
- Procedura chirurgica
NOTA: La pelle viene preparata asetticamente per tutte le procedure chirurgiche utilizzando scrub betadine seguiti dal posizionamento di teli sterili.- Incisione ed esposizione: fare un'incisione della linea mediana dallo xiphisternum alla sinfisi pubica usando la modalità di taglio puro dell'elettrocauterizzazione di Bovie. Assicurarsi di mantenere lateralmente l'uretra nella parte inferiore dell'incisione oltre il fallo per evitare lesioni. Posizionare il divaricatore della parete addominale autotrattenendo facendo attenzione a non ferire la milza e il fegato, per ottimizzare l'esposizione del campo chirurgico.
- Mobilizzazione della testa del pancreas: con l'assistente che fornisce contro-trazione al boschetto pancreato-duodenale, iniziare sezionando lungo il piano fasciale avascolare tra il parenchima pancreatico (lobo duodenale) e l'IVC infra-epatico.
- Mobilizzazione dell'anello pancreatico: il pancreas suino forma un anello attorno all'asse mesenterico-portale (lobo di collegamento). Sezionare lungo la fascia su entrambi gli aspetti della vena porta (PV) per garantire la completa mobilitazione del lobo di collegamento dal PV sovrastante. Il modo più sicuro è iniziare la dissezione lungo entrambi i lati della vena porta e separare i tessuti circonferenzialmente in senso orario o antiorario.
- Mobilizzazione della coda pancreatica: Successivamente, identificare la giunzione tra i tessuti pancreatici e pararenali (vista come una linea bianca) e iniziare a sezionare la coda dalla vena splenica sottostante rimanendo vicino al parenchima. Ligare e dividere i piccoli affluenti venosi al parenchima, facendo attenzione a non ferire la vena splenica utilizzando cravatte di seta 3/0.
- Mobilizzazione del corpo pancreatico: sezionare lungo il sottile strato di tessuto che separa il parenchima dall'intestino crasso e dallo stomaco, avendo cura di preservare la sottile arcata vascolare lungo la regione infrapilorica.
- Mobilizzazione pancreato-duodenale: Successivamente, separare il parenchima dall'ansa C del duodeno mediante una brusca dissezione nel boschetto pancreato-duodenale mediante trazione conta-trazione, avendo cura di preservare la sottile arcata vascolare lungo l'ansa C del duodeno.
- Divisione del dotto pancreatico: identificare il dotto pancreatico, legare con cravatte di seta 2-0 e dividere mantenendo circa 3-5 mm di moncone del dotto sull'ansa C duodenale, stando lontano dall'arcata vascolare duodenale (in stretta relazione con il dotto).
- Rimozione del campione: completare l'ultima parte della mobilizzazione sezionando il parenchima dalla giunzione tra il lobo di collegamento, il duodeno e il colon su entrambi i lati della vena porta. Estrarre il campione in massa (Figura 1) dividendo il lobo di collegamento sull'aspetto anteriore del PV. La divisione del parenchima è necessaria per estrarre il campione a causa della sua posizione circonferenziale attorno al PV.
- Assicurarsi l'emostasi lungo le aree di dissezione e ispezionare il duodeno per eventuali lesioni e congestione vascolare (Figura 2).
- Impianto dell'innesto pancreato-duodenale
- Preparazione dell'innesto: preparare l'innesto PV e l'estremità aortica prossimale tagliando i bordi per l'anastomosi. Posizionare l'innesto preparato nella sacca dell'organo con soluzione UW su un bagno di ghiaccio. Prelevare biopsie con ago dal deposito della coda pancreatica in formalina, congelare a scatto ed estrarre l'RNA in una fase successiva. Suturare il sito di biopsia utilizzando Prolene 6-0 in una figura di 8 modo.
- Dissezione aorto-cavale: iniziare identificando l'uretere destro e sezionare lungo la fascia che separa l'uretere dal rivestimento retroperitoneale sopra la vena cava inferiore. Sezionare lungo il bordo laterale dell'aorta per esporlo dal muscolo psoas sottostante. Quindi, sezionare lungo il boschetto interaortocavale per separare l'aorta dall'IVC.
- Test del morsetto: garantire un'adeguata mobilizzazione dell'aorta e dell'IVC mediante una prova del posizionamento del morsetto vascolare di Satinsky. Cambia posizione con il primo assistente e prepara il campo chirurgico ritraendo le anse intestinali sul lato sinistro per esporre i vasi principali per l'anastomosi. Posizionare i morsetti di prova su IVC e aorta per rivalutare un'adeguata mobilizzazione di entrambi i vasi per l'anastomosi.
- Anastomosi venosa: dopo aver posizionato il morsetto vascolare nell'IVC, fare una piccola apertura nella parete anteriore del vaso ed estenderlo a una dimensione adeguata (abbinata al vaso dell'innesto) cranialmente e caudalmente usando le forbici di Pott. Lavare il lume con soluzione salina eparinizzata utilizzando la guaina flessibile di una cannula IV.
- Utilizzando Prolene 6-0 doppio ago, effettuare suture angolari sull'IVC (inside-out) e innestare la vena porta (inside-out). Fissare la sutura dell'angolo caudale e far scorrere uno degli aghi lungo la parete posteriore dell'innesto e della vena ricevente in modo continuo. Fissare la parete anteriore in modo simile (esterno-continuo) e fissare il nodo al centro della parete anteriore dopo aver lavato il lume dell'anastomosi con soluzione salina eparinizzata.
- De-serrare la vena: posizionare il morsetto vascolare di un Bulldog sulla vena porta dell'innesto, lontano dall'anastomosi, e rilasciare lentamente il morsetto laterale dall'IVC ricevente. Controllare la presenza di riempimento venoso e qualsiasi sanguinamento importante dall'anastomosi.
- Anastomosi arteriosa: posizionare il morsetto mordace laterale sull'aorta facendo attenzione a non ferire i rami lombari lungo la parete posteromediale del vaso. Istruire l'anestesista a iniettare eparina (100 U/kg di peso corporeo) e metilprednisolone (500 mg) attraverso il catetere venoso centrale.
- Fare un'apertura sulla parete anteriore del vaso ed estenderla cranialmente e caudalmente facendo attenzione a non sezionare lungo la parete del vaso. Lavare il lume con soluzione salina eparinizzata e utilizzando Prolene 6-0 doppio ago, suturare l'estremità prossimale dell'aorta dell'innesto all'apertura aortica ricevente in modo continuo con la tecnica del paracadute. Lavare il lume con soluzione salina eparinizzata prima di legare il nodo finale sulla parete anteriore della nave.
- Riperfusione: prenditi cura dei seguenti due aspetti durante l'esecuzione di questo passaggio. In primo luogo, le alterazioni emodinamiche in cui si verifica una drastica caduta della pressione media. Monitorare la pressione arteriosa invasiva minuto per minuto ed eseguire una titolazione della dose del vasopressore (infusione di noradrenalina) e il precarico del fluido per mantenere la pressione arteriosa media target tra 45-50 mmHg.
- In secondo luogo, mantenere l'emostasi. Dopo aver rimosso il morsetto del bulldog dalla vena, valutare eventuali sanguinamenti importanti dal parenchima, dalla regione para-aortica e dall'area periportale; Quindi, rilasciare il morsetto aortico e verificare la presenza di sanguinamento dal sito anastomotico arterioso. Fissare i punti di sanguinamento con legature e sutura emostatica. Chiedere all'anestesista di iniettare una fiala di acido tranexamico attraverso il catetere venoso centrale.
NOTA: Una regola importante è quella di ridurre al minimo la manipolazione aggressiva del pancreas durante questa fase di riperfusione (per evitare edema ed ematoma del trapianto). - Anastomosi intestinale: dopo essersi assicurati che non vi sia torsione mesenterica, isolare un'ansa di digiuno, a 40-50 cm di distanza dalla giunzione duodenojeunal, e avvicinarla all'innesto. Anastomosi il duodeno dell'innesto al digiuno ricevente in modo continuo side-to-side utilizzando la sutura Polydioxanone 4-0, avendo cura di garantire un diametro luminale adeguato di 1,5-2 cm.
- Emostasi e biopsia post-riperfusione: Assicurarsi l'emostasi intorno all'innesto e nei siti di anastomosi. Prelevare tre biopsie con ago dalla coda pancreatica1 h dopo la riperfusione-conservare in formalina, congelare a scatto ed estrarre l'RNA in una fase successiva. Suturare il sito di biopsia con Prolene 6-0 in una figura di 8 modo.
- Chiusura della parete addominale: dopo aver valutato gli stracci trattenuti e aver assicurato l'emostasi, suturare il retto dell'addome in modo continuo utilizzando l'ago Polydioxanone 0 facendo attenzione nella linea mediana inferiore per tenere lontano dall'uretra. Chiudere la pelle con la sutura silk 0 in modo continuo.
NOTA: Idealmente, si raccomandano suture monofilamento (Nylon); Tuttavia, poiché questo è un modello di sopravvivenza di 3 giorni, la seta è accettabile in questi modelli sperimentali. - Legare il catetere venoso centrale: creare un tunnel sottocutaneo sul collo e fissare il catetere venoso centrale seppellendolo sotto il tunnel e suturando la pelle sovrastante con un ago da taglio 0-0 di seta.
- Rimozione del catetere arterioso: dopo aver assicurato una pressione arteriosa media stabile (40-50 mmHg) e una tendenza al miglioramento dei livelli di pH e lattato sull'analisi dei gas del sangue, rimuovere il catetere arterioso e legare il vaso per garantire l'emostasi nel collo. Chiudere la pelle sovrastante con sutura silk 0 in modo continuo.
- Posizionare l'animale ed estubazione: con tutte le precauzioni necessarie, girare l'animale sternale su un carrello di trasporto. Osservare per la saturazione di O 2 e l'inversione dell'anestesia (movimento degli arti, sforzi respiratori spontanei, SpO 2 >95% di sconto su O2 e supporto del ventilatore) ed estubare l'animale. Trasporto al recinto e posizione dello sternale animale e monitoraggio dello stato emodinamico fino alla stabilità.
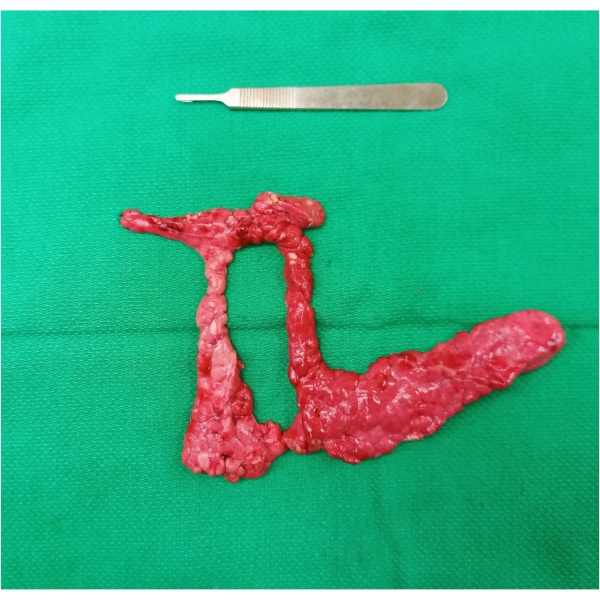
Figura 1: Campione di pancreatectomia resecato in massa. Si noti l'anello di tessuto pancreatico che circonda la vena porta in vivo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
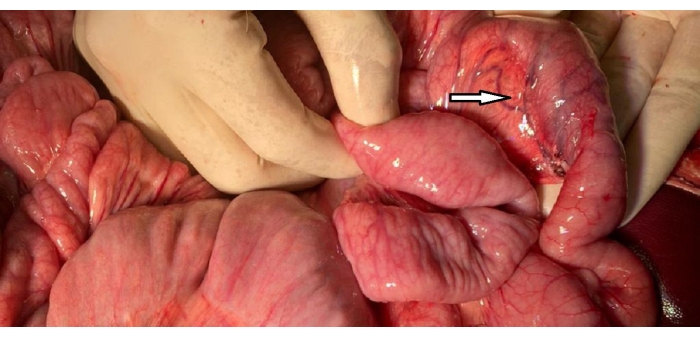
Figura 2: Immagine del duodeno. L'ansa C del duodeno con un'arcata vascolare conservata (punta di freccia) confrontata con l'ansa digiunale circostante e valutata per la congestione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
I parametri biochimici peri-operatori e post-operatori, fino a 3 giorni, dei cinque modelli di sopravvivenza al trapianto di pancreas sono riassunti di seguito (numerati come PTX da 1 a 5 in cronologia). Dei cinque trapianti totali di pancreas, tutti sono andati bene durante il periodo di sopravvivenza di 3 giorni, come evidente dal loro benessere generale e dai test di funzionalità endocrina e di lesione pancreatica. I risultati illustrati di seguito sono rappresentativi dell'esperienza di un modello di sopravvivenza a...
Access restricted. Please log in or start a trial to view this content.
Discussione
L'attuale protocollo è stato eseguito per dimostrare la tecnica e la fattibilità della pancreatectomia e dell'allotrapianto del pancreas in modelli suini. Gli animali sono stati osservati per un periodo di 3 giorni dopo il trapianto per dimostrare l'affidabilità della tecnica di pancreatectomia e dell'allotrapianto. Tutti gli animali sono stati monitorati e allattati per 3 giorni dopo l'intervento chirurgico utilizzando un protocollo standardizzato di cura degli animali di antibiotici, fluidi, analgesici, nutrizione s...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Nessuno.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Belzer UW Cold storage solution | Bridge to life Ltd (Columbia, SC, USA) | 4055 | |
| Calcium gluconate (10%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C360019 | |
| Composelect (blood collection bags) | Fresenius Kabi Canada Ltd (Toronto, ON) | PQ31555 | |
| Heparin (10000 IU/10 ml) | Fresenius Kabi Canada Ltd (Toronto, ON) | C504710 | |
| Lactated Ringer's | Baxter (Mississauga, ON, Canada) | JB2324 | |
| Percutaneous Sheath Introducer Set with Integral Hemostasis Valve/side Port for use with 7-7.5 Fr Catheters | Arrow International LLC | SI-09880 | |
| Sodium bicarbonate (8.4%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C908950 | |
| Solu-Medrol | Pfizer Canada Inc. | 52246-14-2 | |
| Surgical retreival and transplant instrument set |
Riferimenti
- Gruessner, R. W., Gruessner, A. C. The current state of pancreas transplantation. Nature Reviews. Endocrinology. 9 (9), 555-562 (2013).
- Redfield, R. R., Rickels, M. R., Naji, A., Odorico, J. S. Pancreas transplantation in the modern era. Gastroenterology Clinics of North America. 45 (1), 145-166 (2016).
- Canadian Institute for Health Information. Annual Statistics on Organ Replacement in Canada: Dialysis, Tranplantation and Donation, 2009 to 2018. Canadian Institute for Health Information. , Ottawa, ON: CIHI. (2019).
- Prudhomme, T., et al. Ex-situ perfusion of pancreas for whole-organ transplantation: Is it safe and feasible?A systematic review. Journal of Diabetes Science and Technology. 14 (1), 120-134 (2020).
- Ferrer, J., et al. Pig pancreas anatomy: Implications for pancreas procurement, preservation, and islet isolation. Transplantation. 86 (11), 1503-1510 (2008).
- Parmentier, C., et al. Normothermic ex vivo pancreas perfusion for the preservation of pancreas allografts before transplantation. Journal of Visualized Experiments. , (2022).
- Chaib, E., et al. Total pancreatectomy: Porcine model for inducing diabetes - Anatomical assessment and surgical aspects. European Surgical Research. 46 (1), 52-55 (2011).
- Prudhomme, T., et al. Total pancreatectomy and pancreatic allotransplant in a porcine experimental model. Experimental and Clinical Transplantation. 18 (3), 353-358 (2022).
- Grussner, R., et al. Streptozotocin-induced diabetes mellitus in pigs. Hormone and Metabolic Research. 25 (4), 199-203 (1993).
- Mazilescu, L. I., et al. Normothermic ex situ pancreas perfusion for the preservation of porcine pancreas grafts. American Journal of Transplantation. 22 (5), 1339-1349 (2022).
- Kumar, R., et al. Ex vivo normothermic porcine pancreas: A physiological model for preservation and transplant study. International Journal of Surgery. 54, 206-215 (2018).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments. (101), e52909(2015).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon