A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד זקיקים פרה-אנטרליים קטנים משחלת הבקר באמצעות שילוב של פיצול, הומוגניזציה וסינון סדרתי
In This Article
Summary
קידום המחקר של פוליקולוגנזה פרה-אנטרלית דורש שיטות יעילות לבידוד זקיקים משחלות בודדות. מוצג כאן פרוטוקול מכני יעיל לבידוד זקיקים משחלות בקר באמצעות מסוק רקמות והומוגנייזר. שיטה זו מאפשרת איסוף של מספר רב של זקיקים פרה-אנטרליים בני קיימא משחלה אחת.
Abstract
הבנת התהליך המלא של פוליקולוגנזה של יונקים היא חיונית לשיפור טכנולוגיות הרבייה בסיוע בבעלי חיים, בבני אדם ובמינים בסכנת הכחדה. המחקר הוגבל בעיקר לזקיקים פרה-אנטרליים וגדולים בשל קושי בבידוד של זקיקים פרה-אנטרליים קטנים יותר, במיוחד ביונקים גדולים כמו מיני בקר. עבודה זו מציגה גישה יעילה לשליפת מספר גדול של זקיקים פרה-אנטרליים קטנים משחלה אחת של בקר. קליפת המוח של שחלות בקר בודדות נפרסה לקוביות של 500 מיקרומטר באמצעות מסוק רקמות והומוגנית במשך 6 דקות ב-9,000-11,000 סל"ד באמצעות בדיקה של 10 מ"מ. פסולת גדולה הופרדה מההומוגנט באמצעות בד גבינה, ולאחר מכן סינון סדרתי דרך מסנני תאים של 300 מיקרומטר ו-40 מיקרומטר. התכולה שנשמרה במסננת 40 מיקרומטר נשטפה לתוך צלחת חיפוש, שם זוהו זקיקים ונאספו לתוך טיפה של מדיום. הכדאיות של הזקיקים שנאספו נבדקה באמצעות צביעה כחולה טריפאן. שיטה זו מאפשרת בידוד של מספר רב של זקיקים פרה-אנטרליים קטנים בני קיימא משחלת בקר בודדת תוך כ-90 דקות. חשוב לציין ששיטה זו היא מכנית לחלוטין ומונעת שימוש באנזימים לניתוק הרקמה, מה שעלול לפגוע בזקיקים. הזקיקים המתקבלים באמצעות פרוטוקול זה יכולים לשמש ליישומים במורד הזרם כגון בידוד RNA עבור RT-qPCR, אימונולוקליזציה של חלבונים ספציפיים ותרבית חוץ גופית .
Introduction
זקיקי השחלות הם היחידות הפונקציונליות של השחלה, האחראיות על ייצור הגמטה (ביצית) וכן הורמונים קריטיים לתפקוד הרבייה ולבריאות הכללית. זקיקים קדמוניים נוצרים בשחלה במהלך התפתחות העובר או בתקופת היילודים בהתאם למין1, והם מהווים את שמורת השחלות של הנקבה. צמיחת הזקיקים מתחילה בהפעלת זקיקים קדמוניים העוזבים את בריכת המנוחה ונכנסים לשלב הגידול. פוליקולוגנזה פרה-אנטרלית, המקיפה את כל שלבי הזקיקים לפני התפתחות אנטרום, היא תהליך דינמי ביותר הדורש שינויים מורפולוגיים ומטבוליים סינכרוניים בביצית ובתאי הגרנולוזה הסובבים אותה, המונעים על ידי תקשורת הדוקה בין שני סוגי תאים אלה 2,3. זקיקים פרה-אנטרליים מהווים את רוב יחידות הזקיקים הנמצאות בשחלה בכל זמן נתון4. ההתפתחות בשלבים הפרה-אנטרליים של folliculogenesis מוערכת כארוכה בכמה שבועות מהתפתחות אנטרלית 5,6, והפעם היא הכרחית כדי שהביציות והתאים הסומטיים ירכשו בגרות מספקת כדי להיכנס לשלב הסופי של ההתפתחות (כלומר, השלב האנטרלי), ולהתכונן לביוץ, להפריה ולהתפתחות עוברית 7,8,9.
חלק גדול מהידע הנוכחי על פוליקולוגנזה פרה-אנטרלית של השחלות מגיע ממודלים של עכברים10,11,12,13, בין היתר בשל הקלות בהחלמת מספר גדול של זקיקים אלה משחלה קטנה יותר וסיבית פחות. אף על פי שהדיווחים על בידוד של מספר גדול של זקיקים פרה-אנטרליים משחלות בקר מתוארכים לסביבות 30 שנהו-14, הבנה מלאה יותר לגבי התהליכים המסדירים את התפתחותם של זקיקים אלה בשלב מוקדם נותרה בלתי ממומשת, בעיקר בשל היעדר שיטות אופטימליות, יעילות וחוזרות על עצמן כדי לאחזר מספר מספיק של זקיקים פרה-אנטרליים בני קיימא, במיוחד בשלבים מוקדמים של התפתחות. עם העניין הגובר בשימור הרזרבה השחלתית לשימוש עתידי ברבייה בסיוע בבני אדם, פרות הופכות למודל אטרקטיבי בשל מבנה השחלות הדומה יותר שלהן15. עם זאת, שחילת הבקר עשירה יותר בקולגן בהשוואה לשחלה של העכבר16, מה שהופך את הבידוד המכני בשיטות המתוארות עבור העכבר לבלתי יעיל מאוד. המאמצים להרחבת טכניקות שימור הפוריות כוללים גידול חוץ גופי מלא של זקיקים פרה-אנטרליים לשלב האנטרלי, ולאחר מכן הבשלה חוץ גופית (IVM) של הביציות הסגורות, הפריה חוץ גופית (IVF), וייצור והחזרת עוברים17. עד כה, כל התהליך הזה הושג רק בעכברים18. בבקר, ההתקדמות לקראת גידול זקיקים במבחנה מוגבלת למספר דיווחים עם שלבי זקיק משתנים בתחילת התרבית, כמו גם אורך משתנה של תרבית בין פרוטוקולים17,19.
השיטות המתוארות בספרות לקצירת זקיקים פרה-אנטרליים משחלת הבקר השתמשו בעיקר בטכניקות מכניות ואנזימטיות, מבודדות או בשילובשל 2,14,17,20. הדו"ח הראשון של פרוטוקול לבידוד זקיקים פרה-אנטרליים של בקר השתמש בהומוגנייזר רקמות וסינון סדרתי כדי לעבד שחלות שלמות20. בעקבות מחקר זה הגיעו דיווחים ששילבו פרוצדורות מכניות ואנזימטיות שהשתמשו בקולגנאז14. מוטיב חוזר בעת שימוש בקולגנאז לעיכול רקמת השחלות הוא הסיכון הפוטנציאלי לנזק של קרום המרתף הזקיקי, שעלול לפגוע בכדאיות הזקיקים 14,21,22,23. לכן, נעשה שימוש בשילובים שונים של שיטות מכניות, כגון שימוש במסוק רקמות ופיפטינג חוזר או מסוק רקמות בשילוב עם הומוגניזציה20,24,25,26. טכניקה מכנית נוספת שתוארה משתמשת במחטים כדי לנתח זקיקים פרה-אנטרליים ישירות מרקמת השחלות, וזה שימושי במיוחד לבידוד זקיקים משניים גדולים יותר (>200 מיקרומטר). עם זאת, תהליך זה גוזל זמן, אינו יעיל לבידוד זקיקים פרנטרליים קטנים יותר, והוא תלוי בכישורים כאשר מנסים להשתמש בשחלות בקר 19,27,28.
תוך ניצול הטכניקות השונות המתוארות בספרות, פרוטוקול זה נועד לייעל את הבידוד של זקיקים פרה-אנטרליים משחלות בקר בודדות באופן פשוט, עקבי ויעיל המונע דגירה בתמיסות אנזימטיות. שיפור השיטות לבידוד זקיקים פרה-אנטרליים יספק הזדמנות לשפר את ההבנה של שלב זה של פוליקולוגנזה ולאפשר פיתוח של מערכות תרבית יעילות לפיתוח זקיקים פרה-אנטרליים לשלב האנטרלי. הנהלים המפורטים המתוארים כאן לבידוד זקיקים פרה-אנטרליים מיונק גדול כמו מין הבקר יהיו חיוניים לחוקרים השואפים לחקור פוליקולוגנזה מוקדמת במין שאינו מורין הניתן לתרגום לבני אדם.
Protocol
שחלות שור (שור בוס) מקורן באבטואר מקומי והועברו למעבדה תוך 6 שעות מהאוסף. בשל מספרם הרב של בעלי החיים המעובדים במתקן, גילם, גזעם ושלב מחזור האסטרוס של בעלי החיים אינם ידועים. מכיוון שבניסויים אלה לא נעשה שימוש בבעלי חיים, לא היה צורך בפרוטוקול מאושר לטיפול ושימוש בבעלי חיים.
1. הכנת ציוד וריאגנטים
- כסו חלק ברוחב 2 מטרים של ספסל מעבדה בנייר ספסל.
- להשיג ידית אזמל, להב אזמל סטרילי, hemostat, זוג מלקחיים דיסקציה, 20 מ"ל luer-lock מזרק, מחט 18 G, שתי כוסות 200 מ"ל, 500 מ"ל בקבוק Erlenmeyer, משפך פלסטיק בקוטר 104 מ"מ, קרש חיתוך פלסטיק, אחד 22ס" מ 2 שכבה של בד גבינה (את בד הגבינה ניתן לעקר על ידי autoclaving לפני השימוש) לכל שחלה מעובדת, מסננת תאים בקוטר 300 מיקרומטר ומסננת תאים בקוטר 40 מיקרומטר (ראו טבלת חומרים).
- מעבירים את כל הציוד על נייר הספסל.
- השתמש בהמוסטאט כדי לחריץ את להב האזמל על ידית האזמל. יישר את הבסיס הזוויתי של הלהב למחוון הזוויתי שעל הידית, ולאחר מכן החלק את הלהב לתוך החריץ של הידית.
- מכניסים את המשפך לתוך בקבוק ארלנמאייר ומכסים את פתח המשפך בבד הגבינה.
- יש להניח צינור חרוטי אחד של 50 מ"ל לכל שחלה כדי שיעובד במים או באמבט חרוזים שנקבע ל-38.5 מעלות צלזיוס.
- הניחו צלחת פטרי מרובעת אחת בגודל 100 מ"מ x 15 מ"מ לכל שחלה המעובדת על מחמם החלקה המוגדר ל-38.5 מעלות צלזיוס.
- יש להוסיף 10 מ"ל של פניצילין-סטרפטומיצין (PenStrep; 10,000 U/mL פניצילין ו-10,000 מיקרוגרם/מ"ל סטרפטומיצין) ל-1 ליטר של מי מלח עם חציית פוספט (PBS). יש לחמם את PBS + PenStrep במים או באמבט חרוזים בטמפרטורה של 38.5 מעלות צלזיוס לפחות שעתיים לפני עיבוד השחלות.
הערה: תמיסת PBS + PenStrep הכרחית לשטיפת שחלות כאשר זקיקים מבודדים יהיו מתורבתים, ועדיין מומלץ לכל ניסוי במורד הזרם כדי להפחית זיהום מיקרוביאלי. - לאיסוף תסנין שחלות מעובד, השתמש במדיום שטיפת זקיקים (FWM) המורכב מ-TCM199 עם מלחי האנק (ראו טבלת חומרים) המכילים אלבומין בסרום בקר (BSA) של 3 מ"ג/מ"ל, חיץ HEPES של 25 מ"מ, 100 פניצילין UI/100 מיקרוגרם/מ"ל סטרפטומיצין, נתרן פירובט (NaPyr) של 100 ננומטר וחומצות אמינו לא חיוניות (NEAA) של 100 ננומטר.
- העבר TCM199 סטרילי, בקבוק 250 מ"ל וצילינדר מדורג 100 מ"ל לארון בטיחות ביולוגית (BSC). העבר 194 מ"ל של TCM199 לבקבוק.
- הסר את הכוס של TCM199 מן BSC ולהביא צלחת ערבוב. הוסיפו לבקבוק 600 מ"ג BSA, 1.19 גרם של חיץ HEPES וחטיף ערבוב אוטומטי וערבבו עד להמסה.
- לאחר שה-BSA וחיץ ה-HEPES התמוססו לחלוטין, הוסיפו 1 N נתרן הידרוקסידי (NaOH) למדיום עד שהוא מגיע ל-pH של 7.6-7.8, כפי שנמדד על ידי מד pH.
- נגב את בקבוק המדיום, מכשיר סינון ואקום, ארבעה צינורות חרוטיים של 50 מ"ל, ואת בקבוקי PenStrep, NaPyr ו- NEAA עם 70% אתנול לפני המעבר ל- BSC.
- הוסף 2 מ"ל כל אחד של PenStrep (10,000 U/mL פניצילין ו-10,000 מיקרוגרם/מ"ל סטרפטומיצין), 100 mM NaPyr ו-100x NEAA לבקבוק של TCM199 + 3 מ"ג/מ"ל BSA + 25 mM HEPES. סטרילי-לסנן את המדיום הסופי aliquot לתוך צינורות חרוטיים 50 מ"ל. יש לאחסן את המדיום בטמפרטורה של 4°C למשך עד שבועיים.
- לחמם צינור חרוטי אחד של 50 מ"ל של בינוני לכל שתי שחלות באמבט חרוזים שנקבע ל 38.5 מעלות צלזיוס לפחות שעה אחת לפני עיבוד השחלות.
2. התקנת מסוק רקמות
- ודא שמסוק הרקמות (ראה טבלת חומרים) מחובר ומופעל.
- הגדר את עובי הפרוסה ל-500 מיקרומטר, את ידית בקרת כוח הלהב ל-20° ואת ידית בקרת המהירות ל-90° בהתאם למפרט היצרן.
- הכנס צלחת פטרי מפלסטיק בקוטר 60 מ"מ למחזיק הצלחת והכנס את מחזיק הצלחת לבמה שלה.
- הרם את זרוע החיתוך גבוה ככל האפשר על ידי סיבוב ידית ההפעלה הידנית בכיוון השעון.
- באמצעות מלקחיים, יש להניח סכין גילוח בעל קצוות כפולים (ראו טבלת חומרים) על הבורג המוחדר לזרוע החיתוך. מניחים את אבזם הלהב מעל הלהב ומהדקים בעזרת מכונת הכביסה והאגוז. השאירו את האגוז רבע להשתחרר.
- סובבו את ידית ההפעלה הידנית עד שזרוע החיתוך תצמיד את הלהב לצלחת הפטרי. הדקו את האגוז בהמשך הדרך עם האגוז.
- הרם את זרוע החיתוך גבוה ככל שהיא תעבור באמצעות ידית ההפעלה הידנית. הזיזו את ידית שחרור השולחן כל הדרך שמאלה עד שהיא תיכנס למקומה עד שהיא תיכנס למקומה.
3. הכנת השחלה
- העברת השחלות במעבדה לחום (38.5 מעלות צלזיוס) PBS סטרילי + PenStrep.
הערה: מומלץ לעבד את השחלות לבידוד זקיק ברגע שזה אפשרי לאחר ההסרה מהחיה. בפרוטוקול זה, השחלות עובדו תוך 6 שעות מהקטיף. השחלות הועברו מהאבטואר למעבדה בתרמוסים המכילים תמיסת מלח סטרילית של 0.9% בטמפרטורה של כ-38.5 מעלות צלזיוס. - במידת האפשר, בחר שחלות קטנות (≤ 4 ס"מ x 3 ס"מ x 3 ס"מ) המכילות זקיקים אנטרליים קטנים (3-5 מ"מ), ללא זקיקים אנטרליים גדולים (≥8 מ"מ), וללא קורפוס לוטום בולט (איור 1). קריטריונים אלה מומלצים כדי להבטיח שכמות מינימלית של פסולת שאינה זקיקים, כגון תאים סטרומליים ומטריצה חוץ-תאית, תיכלל בצלחת המרובעת המתקבלת המכילה זקיקים מבודדים.
הערה: ניתן לזהות זקיקים אנטרליים כמבנים כדוריים מלאים בנוזל על פני השחלה. ניתן לזהות את Corpora lutea כמבנים נוקשים אדומים, כתומים או צהובים הבולטים מפני השטח של השחלה. - השתמש מספריים כדי להסיר כל רקמת חיבור עודפת ושומן מן השחלות.
- לשטוף את השחלות במשך 30 s ב 70% אתנול בכוס.
- שטפו את השחלות 3x במשך 2 דקות כל אחת בכוסות חמות (38.5 מעלות צלזיוס) PBS + PenStrep, באמצעות PBS טרי + PenStrep לכל כביסה.
- יש לשמור על השחלות בחום (38.5 מעלות צלזיוס) PBS + PenStrep עד שהן מוכנות לעיבוד.
הערה: המרחק בין המעבדה למקור השחלה יכול להיות משתנה. לכן, חשוב להשלים את הפרוטוקול במועד כדי להבטיח שמירה על כדאיות הזקיקים.
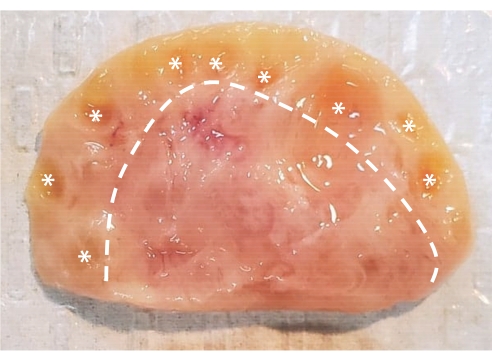
איור 1: אנטומיה של שחלות הבקר. שחלה בקר מורכבת משני אזורים עיקריים הסגורים בשכבת אפיתל. קליפת המוח, המורכבת מהרקמה שמשמאל לקו המקווקו, מכילה זקיקי שחלות מהשלב הראשוני לשלב האנטרלי. זקיקים פרנטרליים קטנים מכדי לראות בעין בלתי; זקיקים אנטרליים מסומנים בכוכביות. המדולה, המורכבת מהרקמה שמימין לקו המקווקו, מכילה כלי דם, כלי לימפה ועצבים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
4. הליך קוצצים
הערה: מעבדים רק שחלה אחת בכל פעם. לעבד את השחלות במהירות כדי למנוע ירידה בטמפרטורה, אשר עשוי להשפיע על הכדאיות של הזקיקים.
- העבירו שחלה אחת לקרש החיתוך שעל נייר הספסל (איור 2A) והכינו את מסוק הרקמות (איור 2B).
- באמצעות מלקחיים ואזמל, חותכים את השחלה לשניים ומסירים את המדולה מכל חצי, ומשאירים רק את קליפת המוח בעובי של כ-1 מ"מ כפי שמוצג באיור 2C.
- חותכים את השחלה לחצי אורך מאתר חיבור רצועה אחת לאתר החיבור הנגדי.
- יש לשמור מחצית אחת של השחלה על קרש החיתוך לעיבוד ולהחזיר את החצי השני של השחלה לחום (38.5 מעלות צלזיוס) PBS + PenStrep.
- כאשר המדולה החשופה פונה כלפי מעלה, פורסים לאורך עקמומיות השחלה במרחק של כ-2 מ"מ מפני השטח של השחלה מבלי לחתוך את קליפת המוח.
- השתמש בפרוסה לאורך העקמומיות של השחלה כמדריך להעמקת הפרוסה, עדיין בעקבות עקמומיות השחלה כדי להפריד את קליפת המוח מהמדולה.
- לנתח ולהשליך כל קורפורה lutea מן השחלה על ידי חיתוך לאורך הגבול של קורפוס לוטום.
- הפוך את השחלה חצי כך שהאפיתל פונה כלפי מעלה והשתמש באזמל כדי לסיים לחתוך את המדולה הרחק מקליפת המוח. יש לחתוך את כל רקמת החיבור הלבנה שנותרה סביב קצה השחלה שהייתה מחוברת לרצועות.
- לאחר הסרת רוב המדולה, השתמש באזמל כדי לחתוך את קליפת המוח לעובי של כ-1 מ"מ. תמרן את האזמל בתנועות קטנות קדימה ואחורה כדי לגלח את שארית המדולה.
הערה: המדולה היא החלק הפנימי של השחלה המכיל כלי דם גדולים. קליפת המוח היא החלק החיצוני של השחלה, השוכב ישירות מתחת לאפיתל פני השטח החיצוניים ביותר. קליפת המוח היא בעובי של כ-1 מ"מ בשחלה של בקר, ולכן חיתוך השחלה לעובי של 1 מ"מ יסיר את המדולה.
- חותכים את קליפת המוח לחתיכות לא יותר מ 2.5 ס"מ x 2.5 ס"מ. שומרים על קליפת המוח בחום (38.5 מעלות צלזיוס) PBS + PenStrep עד שהם מוכנים לקיצוץ.
- למלא עם לפחות 50 מ"ל של חם (38.5 מעלות צלזיוס) PBS + PenStrep ולקבל פיפטה העברת פלסטיק.
- מעבירים חתיכה אחת של קליפת המוח לצלחת פטרי על מסוק הרקמה ומרטיבים את הרקמה בשלוש או ארבע טיפות חמות (38.5 מעלות צלזיוס) PBS + PenStrep.
- החזק את פיסת הרקמה יציבה עם זוג מלקחיים ולחץ על כפתור האיפוס פעם אחת כדי להפעיל את מסוק הרקמות. ייצבו את צלחת הפטרי ביד אחת תוך כדי המשך ייצוב הרקמה עם המלקחיים. הזיזו את המלקחיים שמאלה לאורך הרקמה לפי הצורך כדי למנוע מהלהב לפגוע במלקחיים. הרצועות המתקבלות יהיו באורך של כ-500 מיקרומטר.
- לאחר שכל פיסת קליפת המוח נחתכה לרצועות, השתמש בידית מחזיק הלהב כדי להרים את הלהב מצלחת הפטרי ובמלקחיים כדי להסיר כל רקמה מהלהב.
- סובבו את מחזיק הצלחת ב-90°.
- לחץ על לחצן האיפוס פעם אחת. ייצבו את צלחת הפטרי ביד אחת תוך שימוש במלקחיים כדי לדחוף את רצועות הרקמה לתוך נתיב הלהב.
- מעבירים את הלהב כולו דרך רצועות הרקמה. השתמש בידית מחזיק הלהב כדי להרים את הלהב מצלחת הפטרי ובמלקחיים כדי להסיר כל רקמה מהלהב.
- השתמש פיפטה העברה חם (38.5 °C) PBS + PenStrep כדי לשטוף את הרקמה הקצוצה (גודל סופי של רקמה: 500 μm x 500 μm x 1 מ"מ קוביות) לתוך חימום מראש (38.5 °C) 50 מ"ל חרוטי צינור. החזר את הצינור החרוטי למים או לאמבטיית החרוזים כדי לשמור על הרקמה הקצוצה חמה (38.5 מעלות צלזיוס).
- השתמשו באום כדי להסיר את האגוז מזרוע החיתוך, והסירו את מכונת הכביסה ואת אבזם הלהב. בעזרת מלקחיים, מוציאים את הלהב מזרוע החיתוך, הופכים אותו כך שהקצה שאינו בשימוש פונה לצלחת הפטרי, ומחזירים אותו לזרוע החיתוך. החלף את אבזם הלהב, מכונת הכביסה והאגוז, ואפס את ידית שחרור השולחן כמתואר בשלבים 2.5-2.7.
- חזור על שלבים 4.5-4.12 עבור כל פיסות קליפת המוח הנותרות מהשחלה, והחלף להבים בחדשים לאחר כל קצה חוד החנית.
- יש להשליך את כל הלהבים המשומשים למיכל פלסטיק חדים בעל דופן קשה.
5. הליך הומוגניזציה
- ודא שיחידת ההומוגנייזר (ראו טבלת חומרים) מחוברת לחשמל ושהמהירות מוגדרת לפס השני (9,000-11,000 סל"ד). הכנס את בדיקת הגנרטור 10 מ"מ ליחידה בהתאם למפרט היצרן.
- הגדר טיימר למשך דקה אחת והכנס את הבדיקה לצינור החרוטי של 50 מ"ל המכיל את רקמת קליפת המוח הקצוצה משחלה אחת (שלב 4.11) ומספיק PBS + PenStrep כדי למלא את הצינור לקו 25 מ"ל. העומק שאליו מוכנסת הבדיקה חייב להיות 1/3 מגובה הנוזל הנמדד מתחתית התא. מקם את הבדיקה מעט מחוץ למרכז כדי למזער את המערבולת.
- הפעל את הטיימר והפעל את ההומוגנייזר. ודא שתחתית הבדיקה אינה נוגעת בצינור והחזק את הצינור ללא תזוזה בזמן שההומוגנייזר מופעל.
- לאחר דקה אחת של הומוגניזציה, הסר את הבדיקה מהצינור. באמצעות מלקחיים, יש להסיר כל רקמת חיבור שסותמת את חורי האוורור ואת החלל שבין סכין הרוטור לצינור הרוטור. אם פיסות כלשהן של קליפת המוח תקועות בבדיקה, הסר אותן באמצעות מלקחיים והנח אותן בחזרה לתוך הצינור.
- חזור על שלבים 5.2-5.4 5x נוספים בסך הכל 6 דקות של הומוגניזציה.
- הנח את הצינור עם רקמה הומוגנית לתוך המים או אמבט חרוזים כדי לשמור על הרקמה חמה (38 °C (88 °F). לאחר עיבוד השחלה האחרונה, מיד לפרק, לנקות, ולייבש את הבדיקה הגנרטור על פי מפרט היצרן.
6. הליך סינון
- יוצקים את הרקמה המפוזרת לתוך המשפך המכוסה בבד גבינה המוחדר לתוך בקבוק ארלנמאייר. יש לשטוף את תכולת הצינור לתוך המשפך באמצעות PBS + PenStrep חם (38.5 מעלות צלזיוס) עד שלא יישארו שברי רקמה בצינור.
- מאלצים את שברי הרקמה לעבור דרך חורי הבד על ידי סיבוב בד הגבינה סביב שברי הרקמה וסחיטה עד שכל עודפי הנוזלים והרקמות מוסרים מבד הגבינה.
- פתחו מחדש את מטלית הגבינה מעל המשפך, שטפו את מטלית הגבינה עם PBS + PenStrep באמצעות פיפטה להעברה, ושוב סחטו את כל שברי הרקמה השיורית דרך הבד.
- השתמש בהמוסטאט כדי להחזיק את מסננת התאים בגודל 300 מיקרומטר מעל של 200 מ"ל. יוצקים את התסנין בבקבוק ארלנמאייר דרך מסננת התא. יש לשטוף את תכולת הבקבוקון לתוך מסננת התאים באמצעות PBS חם (38.5 מעלות צלזיוס) + PenStrep עד שלא יישארו שברי רקמות.
- אם מסננת התא נסתמת ברקמה, יש להקיש בעדינות על מסננת התאים כנגד הכוס כדי לוודא שכל הנוזלים הסתננו לתוך הכוס, ולאחר מכן להפוך את מסננת התא ולהקיש את פסולת הרקמה הגדולה על נייר הספסל. מחזירים את מסננת התאים מעל הכוס וממשיכים לשפוך את התסנין דרכה. חזרו על הפעולה לפי הצורך עד שכל התסנין מבקבוק ארלנמאייר עבר סינון.
- השתמשו בהמוסטאט כדי להחזיק את מסננת התאים בקוטר 40 מיקרומטר מעל שנייה של 200 מ"ל. יוצקים את התסנין בכוס הראשונה של 200 מ"ל דרך מסננת התא. יש לשטוף את תכולת הכוס לתוך מסננת התאים באמצעות PBS + PenStrep חם (38.5 מעלות צלזיוס) עד שלא יישארו שברי רקמות. אין להשליך את תכולת מסננת התאים בקוטר 40 מיקרומטר.
- התאימו את מחט ה-18 גרם למזרק של 20 מ"ל. ממלאים את המזרק ב-FWM. הופכים את מסננת התאים בקוטר 40 מיקרומטר על צלחת פטרי מרובעת ומשתמשים במזרק כדי לשטוף את תכולת מסננת התאים לתוך המנה. מלאו את המזרק ושטפו את מסננת התאים לפי הצורך עד שלא יישארו שברי רקמות.
הערה: בדרך כלל, 25 מ"ל של FWM מספיקים כדי לשטוף באופן מלא את התוכן של מסננת התא בגודל 40 מיקרומטר.

איור 2: הגדרת סביבת עבודה לעיבוד השחלות ולזרימת עבודה של פרוטוקול. (A) הגדרת ספסל לחיתוך שחלות לפני החיתוך ולסינון השחלה הומוגנאט. (B) מסוק רקמות והומוגנייזר מוגדרים, עם תמיכה בקלקר להפחתת תנודות של שלב ההומוגנייזר. (C) סכמטית הממחישה את זרימת העבודה לעיבוד של שחלה אחת שלמה. השחלות נחתכות מרקמת חיבור עודפת ואז נחתכות לשניים, והמדולה מוסרת עד שנשארת פרוסה בעובי ~ 1 מ"מ של קליפת המוח. קליפת המוח נחתכת לחתיכות של 2.5 ס"מ על 2.5 ס"מ וקצוצה במסוק רקמות שנקבע למרווח חיתוך של 500 מיקרומטר. לאחר מכן החתיכות עוברות הומוגניות, וההומוגנט מסונן דרך בד גבינה ולאחר מכן סינון דרך מסנני תאים של 300 מיקרומטר ו-40 מיקרומטר. התוכן של מסננת התאים 40 מיקרומטר נשטף לתוך צלחת פטרי מרובע, אשר מחפש זקיקים באמצעות סטריאומיקרוסקופ. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
7. חיפוש ואיסוף זקיקים
- מעבירים את צלחת הפטרי המרובעת (שלב 6.6) לסטריאוסקופ עם במה מחוממת ל-38.5 מעלות צלזיוס. יש להגדיר את ההגדלה הסטריאוסקופית בין 1.25x ל-3.2x בהתאם להעדפת המחפש.
- מזלפים 10 μL טיפות של FWM לתוך צלחת פטרי 60 מ"מ ומכסים את הטיפות בשמן מינרלי למניעת התייבשות. מניחים את צלחת הפטרי עם טיפות מדיה על צלחת חימום שנקבעה ל-38.5 מעלות צלזיוס.
הערה: ניתן להשתמש בצלחת 4 בארות לאיסוף זקיקים. יש להוסיף 500 מיקרון ליטר של מדיית כביסה לבאר אחת או שתיים. מניחים על צלחת החימום להגדיר ל 38.5 מעלות צלזיוס. - השג בוכנה מיקרופיפטה וקצה.
הערה: מיקרופיפטה של זכוכית 1-5 μL (ראו טבלת חומרים) מומלצת מכיוון שהזקיקים נוטים פחות להיצמד לפיפטת הזכוכית וללכת לאיבוד כאשר הם מועברים בין תמיסות. זהו גם מכשיר קטן מספיק כדי לאפשר מיקרומניפולציות קלות ומדויקות יותר של הזקיקים. - מזהים זקיקים מצלחת הפטרי המרובעת ומעבירים לטיפות מדיה (FWM) באמצעות המיקרופיפטה. זקיקים רבים עשויים להיות מוטבעים בפסולת רקמות וניתן לשלוף אותם באחת משתי שיטות כמתואר להלן.
הערה: זקיקים הם כדורים מלבניים ולא מושלמים, ובדרך כלל יש להם ביצית, המוצגת כעיגול לבן מוצק בניגודים כהים יותר, לכיוון מרכז הזקיק (איור 3A-C). היזהרו כדי לא לבלבל זקיקים עם ביציות denuded. ביציות נוטות להיות כדורים מושלמים והן מוקפות בקרום עבה וצלול (zona pellucida). מיקרוסקופ הפוך עם הגדלה של פי 10 (או יותר) יכול לשמש לבדיקה מדוקדקת יותר של זקיקים (איור 3D).- הפרידו בזהירות את הזקיקים מפסולת באמצעות קצה המיקרופיפטה או מחטים עדינות (27 גרם).
- לחלופין, השתמשו בפיפטת פסטר מזכוכית עם נורת גומי כדי לקלוט ולהשפריץ את הפסולת בצלחת מספר פעמים כדי לעקור זקיקים מהפסולת.
- עבוד במהירות, תוך לא יותר מ-30 דקות, כדי לחפש בצלחת הפטרי כדי לסייע בשימור כדאיות הזקיק.
- מניחים לכל היותר חמישה זקיקים לכל טיפה של 10 μL, שכן צפיפות גבוהה יותר יכולה להגדיל את הסבירות שהזקיקים יידבקו זה לזה.
8. מבחן כדאיות ההדרה הכחולה של טריפאן
הערה: השתמש במכסה של צלחת פטרי או צלחת 4 בארות עבור כל השלבים הבאים, מכיוון שהזקיקים נדבקים פחות לפלסטיק של המכסה מאשר לפלסטיק של המנה בפועל.
- הכן PBS + 0.2% פוליוויניל פירולידון (PVP) על ידי המסת 100 מ"ג PVP ב 50 מ"ל של PBS.
הערה: PVP משמש כאן כדי להפחית את הסבירות של זקיקים להיצמד לצלחת. - השתמש במיקרופיפטה כדי להעביר את כל הזקיקים (ממוצע של 40) מטיפות המדיה לטיפה של 50 μL של PBS + 0.2% PVP.
- שטפו את הזקיקים פי 2 על ידי העברתם ברצף לטיפות טריות של 50 μL של PBS + 0.2% PVP.
- מעבירים את הזקיקים לירידה של 285 μL של PBS + 0.2% PVP.
- הוסיפו 15 μL של כחול טריפאן לטיפה של 285 μL של PBS + 0.2% PVP (ריכוז סופי של 0.05% כחול טריפאן) וערבבו בזהירות את הטיפה באמצעות קצה פיפטה של 200 μL שנקבע ל-100 μL.
הערה: אם אתה משתמש בצלחת 4 בארות לבדיקת הכדאיות של טריפאן, הוסף 475 μL של PBS + 0.2% PVP ו- 25 μL של כחול טריפאן לבאר אחת. - לדגום את הזקיקים במשך דקה אחת בטיפה הכחולה טריפאן, ולאחר מכן להעביר את הזקיקים לטיפה 50 μL (או 500 μL היטב) של PBS + 0.2% PVP.
- שטפו את הזקיקים פי 3 לפי שלב 8.3 עם טיפות טריות של 50 מיקרול (או 500 מיקרול לבאר) של PBS + 0.2% PVP.
- השליכו את כל הזקיקים שעדיין נראים כחולים לאחר שלוש כביסות ב-PBS + 0.2% PVP, מכיוון שהם אינם ברי קיימא. כל הזקיקים שאינם שומרים על צבע כחול לאחר שלוש שטיפות הם ברי קיימא וניתן להשתמש בהם לאימונופלואורסצנציה, לתרבית או להליכים אחרים (איור 3E). יש להקפיא את הזקיקים בחנקן נוזלי ולאחסן בטמפרטורה של -80°C עד לשימוש נוסף במידת הצורך.
- בצע ניתוח RT-qPCR והכתמה אימונופלואורסצנטית של הזקיקים כמתואר בשלבים 9 ו-10.

איור 3: זקיקים מבודדים ובדיקת הרחקה של טריפן כחול. (A-C) זקיקים מבודדים צולמו דרך סטריאומיקרוסקופ במספר הגדלות. (A) זקיקים מבודדים בין פסולת בתוך צלחת החיפוש הראשונית. זקיקים בודדים מוקפים באדום. סרגל אבנית = 2,000 מיקרומטר. (B) זקיקים מבודדים ופסולת בתוך טיפה של זקיק לשטוף בינוני מכוסה שמן מינרלי. סרגל קנה מידה = 1,000 מיקרומטר. (C) זקיקים מבודדים ללא פסולת בהגדלה גבוהה יותר. סרגל קנה מידה = 1,000 מיקרומטר. (D) זקיקים מבודדים שצולמו באמצעות מיקרוסקופ שדה בהיר הפוך. סרגל קנה מידה = 100 מיקרומטר. (E) תמונות מייצגות של זקיקים בני קיימא (לא מוכתמים) ולא ברי קיימא (כתם כחול) שצולמו באמצעות מיקרוסקופ שדה בהיר הפוך ומטרה של פי 20. סרגל קנה מידה = 100 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
9. ניתוח RT-qPCR
- לבודד RNA מזקיקים בני קיימא (משלב 8.8) באמצעות מגיב בידוד RNA (ראו טבלת חומרים). יש לטהר את הרנ"א ולטפל ב-DNase באמצעות ערכת ניקוי מסחרית (ראו טבלת חומרים) בהתאם להוראות היצרן.
- להצמיד את הרנ"א עם 14 μL של מים נטולי RNase ולכמת באמצעות ספקטרופוטומטר. ניתן לאחסן את הרנ"א בטמפרטורה של -80 מעלות צלזיוס עד לסינתזת cDNA.
- בצע סינתזת cDNA מכמויות שוות של RNA המופק מזקיקים משניים ראשוניים ובתחילת דרכם, באמצעות ערכת סינתזת cDNA זמינה מסחרית (ראה טבלת חומרים) בהתאם להוראות היצרן. דגירה של תערובת התגובה במשך 5 דקות ב-25 מעלות צלזיוס ואחריה 60 דקות ב-42 מעלות צלזיוס, ואז סיימו את התגובה על ידי חימום ב-70 מעלות צלזיוס למשך 5 דקות.
- בצע RT-qPCR עם cDNA מסונתז (5 ננוגרם לתגובה) ופריימרים (טבלה 1) באמצעות תערובת תגובות זמינה מסחרית (ראה טבלת חומרים). השתמש בתנאי מחזור תרמי: 30 שניות ב-95 מעלות צלזיוס להפעלת פולימראז, ולאחר מכן 40 מחזורי הגברה, כאשר כל מחזור כלל 15 שניות ב-95 מעלות צלזיוס עבור דנטורציה ו-30 שניות ב-60 מעלות צלזיוס לחישול/הארכה. נתח את RT-qPCR על ידי כימות ערכי סף מחזור (Ct) ו / או הצג מוצרי PCR באמצעות אלקטרופורזה של ג'ל אגרוז.
הערה: ביטוי תעתיק של סמן תא הגרנולוזה FSHR וסמן תא הנבט DAZL הוערכו במחקר זה. הגנים הייחוס היו H2A ו-ACTB. - הפעל ניתוח עקומת התכה על ידי הגדלת הטמפרטורה מ 65 °C ב 0.5 °C דרגות כל 5 s עד שהוא מגיע 95 °C (65 °F).
10. ניתוח אימונופלואורסצנציה
- תיקון זקיקים בני קיימא (משלב 8.8) למשך 15 דקות בירידה של 100 μL של 4% (v/v) paraformaldehyde (PFA) בטמפרטורת החדר (RT), ולאחר מכן שטיפה 3x ב 100 μL טיפות של PBS + 0.1% BSA + 0.1% Tween 20.
- חסום את הזקיקים למשך שעה אחת ב-RT במאגר חוסם המורכב מ-PBS אחד + 5% (v/v) סרום חמור רגיל (NDS). לאחר החסימה, דגרו את הזקיקים למשך הלילה בטמפרטורה של 4 מעלות צלזיוס בטיפה של 100 μL של 4 מיקרוגרם/מ"ל נוגדן CX37 נגד אדם או 4 מיקרוגרם/מ"ל איזוטיפ ארנב IgG (בקרה שלילית) מדולל במאגר חוסם.
- לשטוף את הזקיקים 3x ב 100 μL טיפות של PBS + 0.1% BSA + 0.1% Tween 20, ולאחר מכן לדגור אותם במשך 1 שעה ב RT בחושך ב 100 μL טיפה של 2 מיקרוגרם / מ"ל חמור נגד ארנב AlexaFluor 488 נוגדן משני מדולל בחיץ חוסם.
- דגרו את הזקיקים במשך 5 דקות ב-RT בחושך בטיפה של 100 μL של 1 מיקרוגרם/מ"ל Hoechst 33342 מדולל במאגר חוסם כדי לסמן DNA.
- מעבירים את הזקיקים לטיפה של 5 μL של מדיית הרכבה (ראו טבלת חומרים) על גבי מגלשה וכיסוי במיקרוסקופ זכוכית. השאירו את השקופיות לריפוי ב-RT למשך הלילה, ולאחר מכן איטום עם לק. אחסנו אותם בטמפרטורה של 4 מעלות צלזיוס עד להדמיה.
- צלם את כל השקופיות תוך 48 שעות מרגע החלקת הכיסוי. בצע הדמיה באמצעות מיקרוסקופ אפיפלואורסצנטי הפוך (ראה טבלת חומרים) תחת מסנני DAPI (עירור 380 ננומטר ופליטה 450 ננומטר) ו- FITC (עירור 470 ננומטר ופליטה 525 ננומטר).
- תקן את זמן החשיפה עבור שני הערוצים. התאם את זמן החשיפה של FITC (CX37) בהתבסס על הבקרה השלילית של איזוטיפ הארנב. השתמש במטרה של 20x ובערוץ DAPI שהוגדר לזמן חשיפה של 50 אלפיות השנייה כדי לזהות זקיקים המסומנים באיזוטיפ ארנב.
- דמיין זקיקים אלה מתחת לערוץ FITC, והקטן את זמן החשיפה עד שכל האות הירוק ברקע יבוטל. שים לב לזמן חשיפה זה.
- צלם את כל הזקיקים המסומנים בנוגדנים CX37 באמצעות זמן החשיפה שנקבע עבור ערוץ FITC האיזוטיפי וזמן החשיפה של 50 אלפיות השנייה עבור ערוץ DAPI.
- לעבד את עוצמת האות, כפי שהיא נמדדת על ידי שטח אפור ממוצע לאחר הסף, באמצעות תוכנית עיבוד תמונה ממוחשבת29 (ראה טבלת חומרים).
- התאם את קובץ ה- tiff של תמונת DAPI לכל זקיק כך שהזקיק כולו יסומן בקו מתאר. השתמש בפונקציה Analyze Particles של התוכנית כדי לבחור את הזקיק כולו כאזור עניין (ROI).
- פתח את קובץ ה- tiff של תמונת FITC עבור הזקיק המתאים ושכב את ההחזר על ההשקעה שנוצר מתמונת DAPI על גבי תמונת ה- FITC. השתמש בפונקציה Measure של התוכנית כדי לכמת את השטח האפור הממוצע של תמונת FITC, המייצג את עוצמת האות.
תוצאות
סקירה כללית ושלבים קריטיים
באמצעות פרוטוקול זה, ניתן לבודד באופן אמין זקיקים פרה-אנטרליים קטנים של בקר משחלות בודדות במספרים רלוונטיים לניסוי. מתוך סך של 30 שכפולים, התקבלו בממוצע 41 זקיקים לכל שכפול, עם טווח של 11 עד 135 זקיקים (איור 4A). ב-14 שכפולים, הזקיקים אופיינו לש...
Discussion
הפרוטוקול הנוכחי מפרט שיטה הניתנת לשחזור לשליפת זקיקים פרה-אנטרליים בשלב מוקדם, במיוחד בשלבים ראשוניים ומשניים מוקדמים, משחלות הבקר. פרוטוקול זה מסתמך על דוחות קודמים 20,25,30,34,35,36 ומספק אופטימיזציות המביאות לבידוד מספר משמעותי של זקיקים משחלה בודדת.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
פרויקט זה מומן בחלקו על ידי פרויקט רב-מדינתי של USDA W4112 ופרס UC Davis Jastro Shields ל-SM.
המחברים רוצים להרחיב את הערכתם ל-Central Valley Meat, Inc. על אספקת שחלות הבקר המשמשות בכל הניסויים. המחברים גם מודים לאוליביה סילברה על הסיוע בעיבוד השחלות ובבידוד הזקיקים.
Materials
| Name | Company | Catalog Number | Comments |
| 5-3/4" Soda Lime Disposable Glass Pasteur Pipette | Duran Wheaton Kimble | 63A54 | Pasteur pipette that can be used to dislodge follicles from debris while searching within the petri dish |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | Diluted to 4%; fixation of follicles for immunostaining |
| 20 mL Luer-lock Syringe | Fisher Scientific | Z116882-100EA | Syringe used with the 18 G needle to dislodge follicles from the 40 μm cell strainer |
| #21 Sterile Scalpel Blade | Fisher Scientific | 50-365-023 | Used to cut the ovaries and remove the medula |
| 40 μm Cell Strainer | Fisher Scientific | 22-363-547 | Used to filter the filtrate from the 300 μm cell strainer |
| 104 mm Plastic Funnel | Fisher Scientific | 10-348C | Size can vary, but ensure the cheese cloth is cut appropriately and that the ovarian homogenate will not spill over |
| 300 μm Cell Strainer | pluriSelect | 43-50300-03 | Used to filter the filtrate from the cheese cloth |
| 500 mL Erlenmeyer Flask | Fisher Scientific | FB500500 | Funnel and flask used to catch filtrate from the cheese cloth |
| Air-Tite Sterile Needles 18 G | Thermo Fisher Scientific | 14-817-151 | 18 G offers enough pressure to dislodge follicles from the 40 μm cell strainer |
| Air-Tite Sterile Needles 27 G 13 mm | Fisher Scientific | 14-817-171 | Needles that can be used to manipulate any debris in which follicles are stuck |
| BD Hoechst 33342 Solution | Fisher Scientific | BDB561908 | Fluorescent DNA stain |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | Component of follicle wash media |
| Cheese Cloth | Electron Microscopy Sciences | 71748-00 | First filtering step of the ovarian homogenate meant to remove large tissue debris |
| Classic Double Edge Safety Razor Blades | Wilkinson Sword | N/A | Razor blades that fit the best in the McIlwain Tissue Chopper and do not dull quickly |
| Donkey-Anti-Rabbit Secondary Antibody, Alexa Fluor 488 | Fisher Scientific | A-21206 | Secondary antibody for immunostaining |
| Eisco Latex Pipette Bulbs | Fisher Scientific | S29388 | Rubber bulb to use with Pasteur pipettes |
| HEPES Buffer | Sigma-Aldrich | H3375 | Component of follicle wash media |
| Homogenizer | VWR | 10032-336 | Homogenize the ovarian tissue to release follicles |
| ImageJ/Fiji | NIH | v2.3.1 | Software used for analysis of fluorescence-immunolocalization |
| McIlwain Tissue Chopper | Ted Pella | 10184 | Used to cut ovarian tissue small enough for homogenization |
| Microscope - Stereoscope | Olympus | SZX2-ILLT | Dissection microscope used for searching and harvesting follicles from the filtrate |
| Microscope - Inverted | Nikon | Diaphot 300 | Inverted microscope used for high magnification brightfield visualization of isolated follicles |
| Microscope - Inverted | ECHO | Revolve R4 | Inverted microscope used for high magnification brightfield and epifluorescence visualization of isolated follicles |
| Mineral Oil | Sigma-Aldrich | M8410-1L | Oil to cover the drops of follicle wash medium to prevent evaporation during searching |
| Non-essential Amino Acids (NEAA) | Gibco | 11140-050 | Component of follicle wash medium |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-001 | Reagent for immunostaining blocking buffer |
| Nunc 4-well Dishes for IVF | Thermo Fisher Scientific | 144444 | 4-well dishes for follicle isolation and washing |
| Penicillin-Streptomycin Solution 100x | Gibco | 15-140-122 | Component of follicle wash medium |
| Petri Dish 60 mm OD x 13.7 mm | Ted Pella | 10184-04 | Petri dish that fits the best in the McIlwain Tissue Chopper |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP665-1 | Washing buffer for ovaries and follicles |
| Plastic Cutting Board | Fisher Scientific | 09-002-24A | Cutting board of sufficient size to safely cut ovaries |
| Polyvinylpyrrolidone (PVP) | Fisher Scientific | BP431-100 | Addition of PVP (0.1% w/v) to PBS prevents follicles from sticking to the plate or each other |
| ProLong Gold Antifade Mountant | Thermo Fisher Scientific | P36930 | Mounting medium for fluorescently labeled cells or tissue |
| Qiagen RNeasy Micro Kit | Qiagen | 74004 | RNA column clean-up kit |
| R | The R Foundation | v4.1.2 | Statistical analysis software |
| Rabbit-Anti-Human Cx37/GJA4 Polyclonal Antibody | Abcam | ab181701 | Cx37 primary antibody for immunostaining |
| RevertAid RT Reverse Transcription Kit | Thermo Fisher Scientific | K1691 | cDNA synthesis kit |
| Rstudio | RStudio, PBC | v2021.09.2 | Statistical analysis software |
| Sodium Hydroxide Solution (1N/Certified) | Fisher Scientific | SS266-1 | Used to increase media pH to 7.6-7.8 |
| Sodium Pyruvate (NaPyr) | Gibco | 11360-070 | Component of follicle wash medium |
| Square Petri Dish 100 mm x 15 mm | Thermo Fisher Scientific | 60872-310 | Gridded petri dishes allow for more efficient identification of follicles |
| SsoAdvanced Universal SYBR Green Supermix | BioRad | 1725271 | Mastermix for PCR reaction |
| Steritop Threaded Bottle Top Filter | Sigma-Aldrich | S2GPT02RE | Used to sterilize follicle wash medium |
| SYBR-safe DNA gel stain | Thermo Fisher Scientific | S33102 | Staining to visual PCR products on agarose gel |
| TCM199 with Hank’s Salts | Gibco | 12-350-039 | Component of follicle wash medium |
| Triton X-100 | Fisher Scientific | BP151-100 | Detergent for immunostaining permeabilization buffer |
| Trizol reagent | Thermo Fisher Scientific | 15596026 | RNA isolation reagent |
| Trypan Blue Solution, 0.4% | Gibco | 15-250-061 | Used for testing viability of isolated follicles |
| Tween 20 | Detergent for immunostaining wash buffer | ||
| Warmer Plate Universal | WTA | 20931 | Warm plate to keep follicles at 38.5 °C while searching under the microscope |
| Wiretrol II Calibrated Micropipets | Drummond | 50002-005 | Glass micropipettes to manipulate follicles |
References
- Fortune, J. E., Yang, M. Y., Allen, J. J., Herrick, S. L. Triennial reproduction symposium: The ovarian follicular reserve in cattle: What regulates its formation and size. Journal of Animal Science. 91 (7), 3041-3050 (2013).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology. 195 (4), 327-336 (1997).
- Jaffe, L. A., Egbert, J. R. Regulation of mammalian oocyte meiosis by intercellular communication within the ovarian follicle. Annual Review of Physiology. 79, 237-260 (2017).
- Driancourt, M. A., Reynaud, K., Cortvrindt, R., Smitz, J. Roles of KIT and KIT LIGAND in ovarian function. Reviews of Reproduction. 5 (3), 143-152 (2000).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproductive Fertility. 81 (2), 301-307 (1987).
- Aerts, J. M. J., Bols, P. E. J. Ovarian follicular dynamics: a review with emphasis on the bovine species. Part I: Folliculogenesis and preantral follicle development. Reproduction in Domestic Animals. 45 (1), 171-179 (2010).
- Sugiura, K., Pendola, F. L., Eppig, J. J. Oocyte control of metabolic cooperativity between oocytes and companion granulosa cells: energy metabolism. Developmental Biology. 279 (1), 20-30 (2005).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biology of Reproduction. 73 (2), 351-357 (2005).
- Sugimura, S., et al. Amphiregulin co-operates with bone morphogenetic protein 15 to increase bovine oocyte developmental competence: effects on gap junction-mediated metabolite supply. Molecular Human Reproduction. 20 (6), 499-513 (2014).
- Edson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Matzuk, M. M., Burns, K. H. Genetics of mammalian reproduction: modeling the end of the germline. Annual Review of Physiology. 74, 503-528 (2012).
- McGee, E. A., Raj, R. S. Regulators of ovarian preantral follicle development. Seminars in Reproductive Medicine. 33 (3), 179-184 (2015).
- Chen, Y., et al. The factors and pathways regulating the activation of mammalian primordial follicles in vivo. Frontiers in Cell and Developmental Biology. 8, 575706 (2020).
- Figueiredo, J. R., et al. Development of a combined new mechanical and enzymatic method for the isolation of intact preantral follicles from fetal, calf and adult bovine ovaries. Theriogenology. 40 (4), 789-799 (1993).
- Sirard, M. A. The ovarian follicle of cows as a model for human. Animal Models and Human Reproduction. , 127-144 (2017).
- Parkes, W. S., et al. Hyaluronan and collagen are prominent extracellular matrix components in bovine and porcine ovaries. Genes. 12 (8), 1186 (2021).
- Araújo, V. R., Gastal, M. O., Figueiredo, J. R., Gastal, E. L. In vitro culture of bovine preantral follicles: a review. Reproductive Biology and Endocrinology. 12 (1), 1-14 (2014).
- Eppig, J. J., Schroeder, A. C. Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation, and fertilization in vitro. Biology of Reproduction. 41 (2), 268-276 (1989).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Nuttinck, F., Mermillod, P., Massip, A., Dessy, F. Characterization of in vitro growth of bovine preantral ovarian follicles: A preliminary study. Theriogenology. 39 (4), 811-821 (1993).
- Demeestere, I., et al. Effect of preantral follicle isolation technique on in-vitro follicular growth, oocyte maturation and embryo development in mice. Human Reproduction. 17 (8), 2152-2159 (2002).
- Fattahi, A., et al. Optimization of porcine ovarian follicle isolation methods for better developmental potential. Tissue Engineering Part A. 26 (13-14), 712-719 (2020).
- Nagashima, J. B., Hill, A. M., Songsasen, N. In vitro development of mechanically and enzymatically isolated cat ovarian follicles. Reproduction and Fertility. 2 (1), 35-46 (2021).
- Lucci, C. M., Rumpf, R., Figueiredo, J. R., Báo, S. N. Zebu (Bos indicus) ovarian preantral follicles: Morphological characterization and development of an efficient isolation method. Theriogenology. 57 (5), 1467-1483 (2002).
- Langbeen, A., et al. Characterization of freshly retrieved preantral follicles using a low-invasive, mechanical isolation method extended to different ruminant species. Zygote. 23 (5), 683-694 (2014).
- Candelaria, J. I., Denicol, A. C. Characterization of isolated bovine preantral follicles based on morphology, diameter and cell number. Zygote. 28 (2), 154-159 (2020).
- vanden Hurk, R., et al. Ultrastructure and viability of isolated bovine preantral follicles. Human Reproduction Update. 4 (6), 833-841 (1998).
- Paes, V. M., et al. Effect of heat stress on the survival and development of in vitro cultured bovine preantral follicles and on in vitro maturation of cumulus-oocyte complex. Theriogenology. 86 (4), 994-1003 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Aguiar, L. H., Hyde, K. A., Pedroza, G. H., Denicol, A. C. Heat stress impairs in vitro development of preantral follicles of cattle. Animal Reproduction Science. 213, 106277 (2020).
- Kristensen, S. G., Ebbesen, P., Andersen, C. Y. Transcriptional profiling of five isolated size-matched stages of human preantral follicles. Molecular and Cellular Endocrinology. 401, 189-201 (2015).
- Candelaria, J. I., Rabaglino, M. B., Denicol, A. C. Ovarian preantral follicles are responsive to FSH as early as the primary stage of development. Journal of Endocrinology. 247 (2), 153-168 (2020).
- Nuttinck, F., et al. Comparative immunohistochemical distribution of Connexin 37 and Connexin 43 throughout folliculogenesis in the bovine ovary. Molecular Reproduction and Development. 57 (1), 60-66 (2000).
- Itoh, T., Hoshi, H. Efficient isolation and long-term viability of bovine small preantral follicles in vitro. In Vitro Cellular and Developmental Biology-Animal. 36 (4), 235-240 (2000).
- Saha, S., Shimizu, M., Geshi, M., Izaike, Y. In vitro culture of bovine preantral follicles. Animal Reproduction Science. 63 (1-2), 27-39 (2000).
- Bus, A., et al. Preservation of connexin 43 and transzonal projections in isolated bovine pre-antral follicles before and following vitrification. Journal of Assisted Reproduction and Genetics. 38 (2), 479-492 (2021).
- Gougeon, A., Ecochard, R., Thalabard, J. C. Age-related changes of the population of human ovarian follicles: increase in the disappearance rate of non-growing and early-growing follicles in aging women. Biology of Reproduction. 50 (3), 653-663 (1994).
- Xu, D., et al. Raf-ERK1/2 signaling pathways mediate steroid hormone synthesis in bovine ovarian granulosa cells. Reproduction in Domestic Animals. 54 (5), 741-749 (2019).
- Santos, R. R., et al. Cryopreservation of ovarian tissue: an emerging technology for female germline preservation of endangered species and breeds. Animal Reproduction Science. 122 (3-4), 151-163 (2010).
- Leonel, E. C. R., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Bus, A., Langbeen, A., Martin, B., Leroy, J. I. M. R., Bols, P. E. J. Is the pre-antral ovarian follicle the 'holy grail' for female fertility preservation. Animal Reproduction Science. 207, 119-130 (2019).
- Chen, J., et al. Optimization of follicle isolation for bioengineering of human artificial ovary. Biopreservation and Biobanking. , (2021).
- Chiti, M. C., et al. A modified and tailored human follicle isolation procedure improves follicle recovery and survival. Journal of Ovarian Research. 10 (1), 1-9 (2017).
- Kristensen, S. G., Rasmussen, A., Byskov, A. G., Andersen, C. Y. Isolation of pre-antral follicles from human ovarian medulla tissue. Human Reproduction. 26 (1), 157-166 (2011).
- Oktay, K., et al. Isolation and characterization of primordial follicles from fresh and cryopreserved human ovarian tissue. Fertility and Sterility. 67 (3), 481-486 (1997).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved