Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Küçük Preantral Foliküllerin Sığır Yumurtalıktan Parçalanma, Homojenizasyon ve Seri Filtrasyon Kombinasyonu Kullanılarak İzolasyonu
Bu Makalede
Özet
Preantral folikülogenez çalışmasının ilerletilmesi, tek yumurtalıklardan folikül izolasyonu için etkili yöntemler gerektirir. Burada bir doku doğrayıcı ve homojenizatör kullanılarak sığır yumurtalıklarından folikül izolasyonu için modernize edilmiş, mekanik bir protokol sunulmaktadır. Bu yöntem, tek bir yumurtalıktan çok sayıda canlı preantral folikülün toplanmasına izin verir.
Özet
Memeli folikülogenezinin tüm sürecini anlamak, hayvancılıkta, insanlarda ve nesli tükenmekte olan türlerde yardımcı üreme teknolojilerinin geliştirilmesi için çok önemlidir. Araştırmalar, özellikle sığır türleri gibi büyük memelilerde, daha küçük preantral foliküllerin izolasyonundaki zorluk nedeniyle çoğunlukla antral ve büyük preantral foliküllerle sınırlı kalmıştır. Bu çalışma, tek bir sığır yumurtalığından çok sayıda küçük preantral folikül almak için etkili bir yaklaşım sunmaktadır. Bireysel sığır yumurtalıklarının korteksi, bir doku doğrayıcı kullanılarak 500 μm küplere dilimlendi ve 10 mm'lik bir prob kullanılarak 9.000-11.000 rpm'de 6 dakika homojenize edildi. Büyük döküntüler homojenattan bir peynir bezi kullanılarak ayrıldı, ardından 300 μm ve 40 μm hücre süzgeçleri aracılığıyla seri filtreleme yapıldı. 40 μm süzgeçte tutulan içerikler, foliküllerin tanımlandığı ve bir damla ortama toplandığı bir arama kabında durulandı. Toplanan foliküllerin canlılığı tripan mavisi boyama ile test edildi. Bu yöntem, yaklaşık 90 dakika içinde tek bir sığır yumurtalıktan çok sayıda canlı küçük preantral folikülün izole edilmesini sağlar. Önemli olarak, bu yöntem tamamen mekaniktir ve foliküllere zarar verebilecek dokuyu ayırmak için enzimlerin kullanılmasını önler. Bu protokol kullanılarak elde edilen foliküller, RT-qPCR için RNA'nın izolasyonu, spesifik proteinlerin immünolokalizasyonu ve in vitro kültür gibi aşağı akış uygulamaları için kullanılabilir.
Giriş
Yumurtalık folikülleri, gamet (oosit) üretiminin yanı sıra üreme fonksiyonu ve genel sağlık için kritik olan hormonlardan sorumlu olan yumurtalık fonksiyonel birimleridir. İlkel foliküller, fetal gelişim sırasında veyayenidoğan döneminde 1. türe bağlı olarak yumurtalıkta oluşur ve bir dişinin yumurtalık rezervini oluşturur. Foliküler büyüme, dinlenme havuzunu terk eden ve büyüme fazına giren ilkel foliküllerin aktivasyonu ile başlar. Antrum gelişiminden önceki tüm folikül aşamalarını kapsayan preantral folikülogenez, oosit ve çevresindeki granüloza hücrelerinde senkron morfolojik ve metabolik değişiklikler gerektiren, bu ikihücre tipi 2,3 arasındaki sıkı iletişimle yönlendirilen oldukça dinamik bir süreçtir. Preantral foliküller, herhangi bir zamanda yumurtalıkta bulunan foliküler birimlerin çoğunluğunu oluşturur4. Folikülogenezin preantral aşamalarındaki gelişimin, antral gelişimden 5,6'dan birkaç hafta daha uzun olduğu tahmin edilmektedir ve bu süre, oosit ve somatik hücrelerin gelişimin son aşamasına (yani antral aşamaya) girmek ve yumurtlamaya, döllenmeye ve embriyonik gelişime hazırlanmak için yeterli olgunluk kazanmaları için gereklidir 7,8,9.
Yumurtalık preantral folikülogenezi hakkındaki mevcut bilgilerin çoğu, kısmen bu foliküllerin büyük bir kısmının daha küçük ve daha az fibröz bir yumurtalıktan kurtarılmasındaki kolaylıktan dolayı, fare modelleri 10,11,12,13'ten gelmektedir. Sığır yumurtalıklarından çok sayıda preantral folikülün izolasyonuna ilişkin raporlar yaklaşık 30 yıl öncesine dayanmasına rağmen14, bu erken evre foliküllerin gelişimini düzenleyen süreçler hakkında daha eksiksiz bir anlayış, büyük ölçüde, özellikle gelişimin erken aşamalarında, yeterli sayıda canlı preantral folikül elde etmek için optimize edilmiş, verimli ve tekrarlanabilir yöntemlerin bulunmaması nedeniyle gerçekleşmemiştir. İnsanlarda yardımlı üremede gelecekteki kullanım için yumurtalık rezervinin korunmasına olan ilginin artmasıyla birlikte, inekler daha benzer yumurtalık yapıları nedeniyle çekici bir model haline gelmiştir15. Bununla birlikte, sığır yumurtalık, fare yumurtalık16'ya kıyasla kollajen bakımından belirgin şekilde daha zengindir ve fare için açıklanan yöntemleri kullanarak mekanik izolasyonu çok verimsiz hale getirir. Fertilite koruma tekniklerini genişletme çabaları, preantral foliküllerin antral aşamaya kadar tam in vitro büyümesini, ardından kapalı oositlerin in vitro olgunlaşmasını (IVM), in vitro fertilizasyonu (IVF) ve embriyo üretimini ve transferini içerir17. Şimdiye kadar, tüm bu süreç sadecefarelerde 18 elde edildi. Sığırlarda, in vitro folikül büyümesine doğru ilerleme, kültürün başlangıcında değişken folikül aşamalarına veprotokoller 17,19 arasında değişken kültür uzunluğuna sahip birkaç raporla sınırlıdır.
Sığır yumurtalıktan preantral foliküllerin toplanması için literatürde açıklanan yöntemler çoğunlukla izole edilmiş veya kombinasyon halinde mekanik ve enzimatik teknikler kullanmıştır 2,14,17,20. Sığır preantral folikül izolasyonu için bir protokolün ilk raporunda, tüm yumurtalıkları işlemek için bir doku homojenizatörü ve seri filtrasyon kullanılmıştır20. Bu çalışmayı, kollajenaz14'ün kullanıldığı mekanik ve enzimatik prosedürleri birleştiren raporlar izledi. Yumurtalık dokusunu sindirmek için kollajenaz kullanıldığında tekrarlayan bir tema, foliküler bazal membranın hasar görmesi için potansiyel risktir, bu da folikül canlılığını tehlikeye atabilir 14,21,22,23. Bu nedenle, bir doku doğrayıcı ve tekrarlanan pipetleme veya homojenizasyon20,24,25,26 ile birleştirilmiş bir doku doğrayıcı kullanımı gibi farklı mekanik yöntem kombinasyonları kullanılmıştır. Tarif edilen bir başka mekanik teknik, preantral folikülleri doğrudan yumurtalık dokusundan diseke etmek için iğneler kullanır, bu da özellikle daha büyük (>200 μm) sekonder folikülleri izole etmek için yararlıdır. Bununla birlikte, bu süreç zaman alıcıdır, daha küçük preantral folikülleri izole etmek için verimsizdir ve sığır yumurtalıklarında denendiğinde beceri setine bağımlıdır 19,27,28.
Literatürde anlatılan farklı tekniklerden yararlanan bu protokol, enzimatik solüsyonlarda inkübasyonu önleyen basit, tutarlı ve verimli bir şekilde preantral foliküllerin tek sığır yumurtalıklarından izolasyonunu optimize etmeyi amaçlamıştır. Preantral folikülleri izole etme yöntemlerinin geliştirilmesi, folikülogenezin bu aşamasının anlaşılmasını arttırmak ve preantral folikülleri antral aşamaya kadar geliştirmek için etkili kültür sistemlerinin geliştirilmesini sağlamak için bir fırsat sağlayacaktır. Preantral foliküllerin sığır türleri gibi büyük bir memeliden izole edilmesi için burada açıklanan ayrıntılı prosedürler, insanlara çevrilebilen murin olmayan bir türde erken folikülogenezi incelemeyi amaçlayan araştırmacılar için hayati önem taşıyacaktır.
Access restricted. Please log in or start a trial to view this content.
Protokol
Sığır (Bos taurus) yumurtalıkları yerel bir mezbahadan temin edildi ve toplandıktan sonraki 6 saat içinde laboratuvara taşındı. Tesiste işlenen çok sayıda hayvan nedeniyle, hayvanların östrus döngüsünün yaşı, cinsi ve aşaması bilinmemektedir. Bu deneylerde canlı hayvan kullanılmadığından, onaylanmış bir hayvan bakımı ve kullanım protokolü gerekli değildi.
1. Ekipman ve reaktiflerin hazırlanması
- Bir laboratuvar tezgahının 2 ft genişliğindeki bir bölümünü tezgah kağıdı ile örtün.
- İşlenen yumurtalık başına neşter sapı, steril neşter bıçağı, hemostat, diseksiyon forseps çifti, 20 mL luer-lock şırınga, 18 G iğne, iki adet 200 mL beher, 500 mL Erlenmeyer şişesi, 104 mm çapında plastik huni, plastik kesme tahtası, bir adet22 cm2 kat tülbent (tülbent, kullanımdan önce otoklavlama ile sterilize edilebilir) elde edin, 300 μm hücre süzgeci ve 40 μm hücre süzgeci (bkz.
- Tüm ekipmanı tezgah kağıdına aktarın.
- Neşter bıçağını neşter sapına yerleştirmek için hemostatı kullanın. Bıçağın açılı tabanını saptaki açılı göstergeye hizalayın, ardından bıçağı sapın oluğuna kaydırın.
- Hunisini Erlenmeyer şişesine yerleştirin ve huni açıklığını tülbentle örtün.
- 38,5 ° C'ye ayarlanmış bir su veya boncuk banyosunda işlenmek üzere yumurtalık başına bir adet 50 mL konik tüp yerleştirin.
- 38,5 ° C'ye ayarlanmış bir slayt ısıtıcısı üzerine işlenmek üzere yumurtalık başına bir adet 100 mm x 15 mm kare Petri kabı yerleştirin.
- 1 L 1x fosfat tamponlu saline (PBS) 10 mL Penisilin-Streptomisin (PenStrep; 10.000 U/mL penisilin ve 10.000 μg/mL streptomisin) ekleyin. PBS + PenStrep'i yumurtalık işlemeden en az 2 saat önce 38,5 °C'ye ayarlanmış bir su veya boncuk banyosunda ısıtın.
NOT: PBS + PenStrep çözeltisi, izole foliküller kültürlendiğinde yumurtalıkların yıkanması için zorunludur ve mikrobiyal kontaminasyonu azaltmak için herhangi bir aşağı akış deneyi için hala tavsiye edilir. - İşlenmiş yumurtalık filtrasyonunu toplamak için, 3 mg/mL sığır serum albümini (BSA), 25 mM HEPES tamponu, 100 UI penisilin/100 μg/mL streptomisin, 1 mM sodyum piruvat (NaPyr) ve 100 nM esansiyel olmayan amino asitler (NEAA) içeren Hank Tuzları ile TCM199'dan oluşan Folikül Yıkama Ortamı (FWM) kullanın (bkz.
- Steril TCM199'u, 250 mL'lik bir şişeyi ve 100 mL'lik dereceli bir silindiri bir biyogüvenlik kabinine (BSC) aktarın. 194 mL TCM199'u şişeye aktarın.
- TCM199'un kabını BSC'den çıkarın ve bir karıştırma plakasına getirin. Şişeye 600 mg BSA, 1.19 g HEPES tamponu ve otoklavlanmış bir karıştırma çubuğu ekleyin ve eriyene kadar karıştırın.
- BSA ve HEPES tamponu tamamen çözündükten sonra, bir pH metre ile ölçüldüğü gibi 7.6-7.8 pH'a ulaşana kadar ortama 1 N sodyum hidroksit (NaOH) ekleyin.
- BSC'ye aktarmadan önce ortam şişesini, bir vakum filtreleme cihazını, dört adet 50 mL konik tüpü ve PenStrep, NaPyr ve NEAA şişelerini% 70 etanol ile silin.
- TCM199 + 3 mg/mL BSA + 25 mM HEPES şişesine her biri 2 mL PenStrep (10.000 U/mL penisilin ve 10.000 μg/mL streptomisin), 100 mM NaPyr ve 100x NEAA ekleyin. Son ortamı ve alikotu 50 mL konik tüplere sterilize ederek filtreleyin. Ortamı 2 haftaya kadar 4 ° C'de saklayın.
- Yumurtalık işlemeden en az 1 saat önce 38.5 ° C'ye ayarlanmış bir boncuk banyosunda iki yumurtalık başına 50 mL konik bir orta tüp ısıtın.
2. Doku doğrayıcı kurulumu
- Doku doğrayıcının (bkz. Malzeme Tablosu) prize takılı ve açık olduğundan emin olun.
- Üreticinin spesifikasyonlarına göre dilim kalınlığını 500 μm'ye, bıçak kuvveti kontrol düğmesini 20 ° 'ye ve hız kontrol düğmesini 90 ° 'ye ayarlayın.
- Plaka tutucuya 60 mm'lik plastik bir Petri kabı yerleştirin ve plaka tutucuyu sahnesine yerleştirin.
- Manuel çalıştırma düğmesini saat yönünde çevirerek doğrama kolunu gideceği kadar yükseğe kaldırın.
- Forseps kullanarak, doğrama koluna yerleştirilen vidanın üzerine çift kenarlı bir tıraş bıçağı (bkz. Bıçak tokasını bıçağın üzerine yerleştirin ve yıkayıcı ve somun ile sabitleyin. Somunları çeyrek tur gevşetin bırakın.
- Manuel çalıştırma düğmesini, doğrama kolu bıçağı Petri kabının üzerine düz bir şekilde tutturana kadar döndürün. Somunu somun sürücüsü ile yolun geri kalanında sıkın.
- Manuel çalıştırma düğmesini kullanarak doğrama kolunu gideceği kadar yükseğe kaldırın. Masa serbest bırakma düğmesini, yerine oturana kadar sola doğru hareket ettirin.
3. Yumurtalık hazırlığı
- Yumurtalıkları laboratuvarda ısıtmak (38.5 °C) steril PBS + PenStrep'e aktarın.
NOT: Yumurtalıkların, hayvandan çıkarıldıktan sonra mümkün olan en kısa sürede folikül izolasyonu için işlenmesi önerilir. Bu protokolde, yumurtalıklar hasattan sonraki 6 saat içinde işlendi. Yumurtalıklar mezbahadan laboratuvara yaklaşık 38.5 °C'de steril% 0.9 salin çözeltisi içeren termoslarda taşındı. - Mümkünse, küçük (3-5 mm) antral foliküller, büyük (≤8 mm) antral foliküller içermeyen ve belirgin korpus luteum içermeyen küçük (≥ 4 cm x 3 cm x 3 cm) yumurtalıkları seçin (Şekil 1). Bu kriterler, stromal hücreler ve hücre dışı matriks gibi minimum miktarda folikül dışı enkazın izole foliküller içeren ortaya çıkan kare kaba dahil edilmesini sağlamak için önerilir.
NOT: Antral foliküller, yumurtalık yüzeyinde küresel, sıvı dolu veziküler yapılar olarak tanımlanabilir. Corpora lutea, yumurtalık yüzeyinden çıkıntı yapan kırmızı, turuncu veya sarı sert yapılar olarak tanımlanabilir. - Yumurtalıklardaki fazla bağ dokusunu ve yağları çıkarmak için makas kullanın.
- Yumurtalıkları bir beherde% 70 etanol içinde 30 s yıkayın.
- Her yıkama için taze PBS + PenStrep kullanarak, yumurtalıkları ılık (38,5 ° C) PBS + PenStrep beherlerinde 2 dakika boyunca 3x yıkayın.
- İşleme hazır olana kadar yumurtalıkları sıcak (38,5 °C) PBS + PenStrep'te tutun.
NOT: Laboratuvar ile yumurtalık kaynağı arasındaki mesafe değişken olabilir. Bu nedenle, foliküler canlılığın korunmasını sağlamak için protokolün zamanında tamamlanması önemlidir.
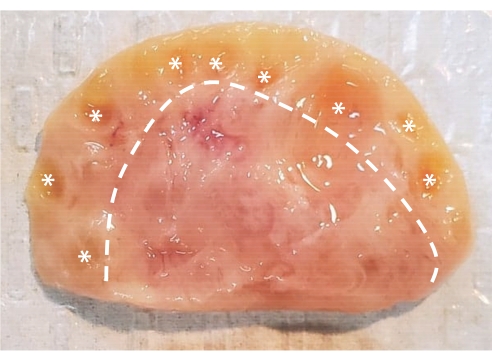
Resim 1: Sığır yumurtalıklarının anatomisi. Sığır yumurtalığı, bir epitel tabakası içine alınmış iki ana bölgeden oluşur. Kesikli çizginin solundaki dokudan oluşan korteks, primordial aşamadan antral aşamaya kadar yumurtalık folikülleri içerir. Preantral foliküller çıplak gözle görülemeyecek kadar küçüktür; antral foliküller yıldız işaretleri ile işaretlenmiştir. Kesikli çizginin sağındaki dokudan oluşan medulla, kan damarları, lenfatik damarlar ve sinirler içerir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. Doğrama prosedürü
NOT: Bir seferde yalnızca bir yumurtalık işleyin. Folikül canlılığını etkileyebilecek sıcaklık düşüşlerini önlemek için yumurtalıkları hızlı bir şekilde işleyin.
- Bir yumurtalığı tezgah kağıdındaki kesme tahtasına aktarın (Şekil 2A) ve doku doğrayıcıyı hazırlayın (Şekil 2B).
- Forseps ve neşter kullanarak, yumurtalıkları ikiye bölün ve medullayı her yarıdan çıkarın, sadece korteksi Şekil 2C'de gösterildiği gibi yaklaşık 1 mm kalınlığında bırakın.
- Yumurtalığı, bir bağ bağlantı bölgesinden karşı bağlantı bölgesine uzunlamasına ikiye bölün.
- Yumurtalıkların bir yarısını işlenecek kesme tahtasında tutun ve yumurtalıkların diğer yarısını tekrar ılık (38.5 ° C) PBS + PenStrep'e yerleştirin.
- Açıkta kalan medulla yukarı bakacak şekilde, yumurtalık eğriliği boyunca korteksten kesmeden yumurtalık yüzeyinden yaklaşık 2 mm uzağa dilimleyin.
- Dilimi derinleştirmek için yumurtalık eğriliği boyunca bir rehber olarak kullanın, korteksi medulladan ayırmak için yumurtalık eğriliğini takip edin.
- Korpus luteumun sınırı boyunca keserek yumurtalıktan herhangi bir corpora lutea'yı parçalayın ve atın.
- Epitel yukarı bakacak şekilde yumurtalıkları yarıya çevirin ve medullayı korteksten kesmeyi bitirmek için neşteri kullanın. Bağlara bağlı yumurtalık parçasının kenarı etrafında kalan beyaz bağ dokusunu kesin.
- Medullanın çoğunluğu çıkarıldıktan sonra, korteksi yaklaşık 1 mm kalınlığa kesmek için neşteri kullanın. Medullanın geri kalanını tıraş etmek için neşteri küçük, ileri geri hareketlerle manipüle edin.
NOT: Medulla, yumurtalıkta büyük kan damarları içeren iç kısımdır. Korteks, ovanın dış kısmıdır ve doğrudan en dış yüzey epitelinin altında yer alır. Korteks, sığır yumurtalığında yaklaşık 1 mm kalınlığındadır ve bu nedenle yumurtalıkların 1 mm kalınlığa kesilmesi medullayı çıkaracaktır.
- Korteksi 2,5 cm x 2,5 cm'den büyük olmayan parçalara ayırın. Korteks parçalarını doğranmaya hazır olana kadar sıcak (38.5 ° C) PBS + PenStrep'te tutun.
- Bir beheri en az 50 mL ılık (38,5 °C) PBS + PenStrep ile doldurun ve plastik bir transfer pipeti elde edin.
- Doku doğrayıcıdaki Petri kabına tek bir korteks parçası aktarın ve dokuyu üç veya dört damla ılık (38.5 ° C) PBS + PenStrep ile ıslatın.
- Doku parçasını bir çift forseps ile sabit tutun ve doku doğrayıcıyı başlatmak için sıfırlama düğmesine bir kez basın. Dokuyu forseps ile stabilize etmeye devam ederken Petri kabını bir elinizle stabilize edin. Bıçağın forsepslere çarpmasını önlemek için forsepsleri doku boyunca sola doğru hareket ettirin. Elde edilen şeritler yaklaşık 500 μm uzunluğunda olacaktır.
- Tüm korteks parçası şeritler halinde kesildikten sonra, bıçağı Petri kabından kaldırmak için bıçak tutucu düğmesini ve bıçaktan herhangi bir dokuyu çıkarmak için forseps kullanın.
- Plaka tutucuyu 90° döndürün.
- Sıfırlama düğmesine bir kez basın. Petri kabını bir elinizle stabilize ederken, doku şeritlerini bıçağın yoluna itmek için forsepsleri kullanın.
- Bıçağı tamamen doku şeritlerinden geçirin. Bıçağı Petri kabından kaldırmak için bıçak tutucu topuzunu ve bıçaktaki herhangi bir dokuyu çıkarmak için forseps kullanın.
- Transfer pipetini ve ılık (38,5 °C) PBS + PenStrep'i kullanarak doğranmış dokuyu (dokunun son boyutu: 500 μm x 500 μm x 1 mm küpler) önceden ısıtılmış (38,5 °C) 50 mL konik bir tüpe yıkayın. Doğranmış dokuyu sıcak tutmak için konik tüpü suya veya boncuk banyosuna geri koyun (38,5 ° C).
- Somunları doğrama kolundan çıkarmak için somun sürücüsünü kullanın ve yıkayıcıyı ve bıçak tokasını çıkarın. Forseps kullanarak, bıçağı doğrama kolundan çıkarın, kullanılmayan kenar Petri kabına bakacak şekilde ters çevirin ve tekrar doğrama koluna yerleştirin. Bıçak tokasını ve rondelayı değiştirin ve masa serbest bırakma düğmesini adım 2.5-2.7'de açıklandığı gibi sıfırlayın.
- Yumurtalıktan kalan tüm korteks parçaları için 4.5-4.12 arasındaki adımları tekrarlayın, her kesici kenar kullanıldıktan sonra bıçakları yenileriyle değiştirin.
- Kullanılmış tüm bıçakları sert duvarlı, plastik keskin bir kaba atın.
5. Homojenizasyon prosedürü
- Homojenizatör ünitesinin (bakınız Malzeme Tablosu) prize takılı olduğundan ve hızın ikinci çubuğa (9.000-11.000 rpm) ayarlandığından emin olun. 10 mm'lik jeneratör probunu üreticinin spesifikasyonlarına göre üniteye yerleştirin.
- 1 dakika boyunca bir zamanlayıcı ayarlayın ve probu, bir yumurtalıktan doğranmış korteks dokusunu içeren 50 mL konik tüpe (adım 4.11) ve tüpü 25 mL hattına doldurmak için yeterli PBS + PenStrep'e yerleştirin. Probun yerleştirildiği derinlik, haznenin dibinden ölçülen sıvı yüksekliğinin 1 / 3'ü olmalıdır. Girdabı en aza indirmek için probu merkezden biraz uzağa yerleştirin.
- Zamanlayıcıyı başlatın ve homojenizatörü açın. Probun tabanının boruya temas etmediğinden emin olun ve homojenizatör açıkken tüpü sabit tutun.
- 1 dakikalık homojenizasyondan sonra, probu tüpten çıkarın. Forseps kullanarak, havalandırma deliklerini ve rotor bıçağı ile rotor tüpü arasındaki boşluğu tıkayan bağ dokusunu çıkarın. Probun içine herhangi bir korteks parçası sıkışmışsa, forseps ile çıkarın ve tekrar tüpe yerleştirin.
- Toplam 6 dakikalık homojenizasyon için 5.2-5.4 arasındaki adımları 5 kat daha tekrarlayın.
- Homojenize dokulu tüpü, dokuyu sıcak tutmak için suya veya boncuk banyosuna (38,5 ° C) yerleştirin. Son yumurtalık işlendikten sonra, jeneratör probunu üreticinin spesifikasyonlarına göre derhal sökün, temizleyin ve kurutun.
6. Filtreleme prosedürü
- Dağınık dokuyu Erlenmeyer şişesine yerleştirilen tülbentle kaplı huniye dökün. Tüpün içeriğini, tüpte hiçbir doku parçası kalmayana kadar ılık (38.5 ° C) PBS + PenStrep kullanarak huni içine durulayın.
- Tülbenti doku parçalarının etrafında bükerek ve tüm fazla sıvı ve doku tülbentten çıkarılana kadar sıkarak doku parçalarını bezin deliklerinden geçmeye zorlayın.
- Tülbenti huninin üzerinde tekrar açın, tülbenti PBS + PenStrep ile bir transfer pipeti kullanarak durulayın ve kalan doku parçalarını bezden tekrar sıkın.
- 300 μm hücre süzgecini 200 mL'lik bir beher üzerinde tutmak için bir hemostat kullanın. Filtratın Erlenmeyer şişesine hücre süzgecinden dökün. Şişenin içeriğini, hiçbir doku parçası kalmayana kadar ılık (38.5 ° C) PBS + PenStrep kullanarak hücre süzgecine durulayın.
- Hücre süzgeci doku ile tıkanırsa, tüm sıvının beherin içine filtrelendiğinden emin olmak için hücre süzgecini beherin üzerine hafifçe vurun ve ardından hücre süzgecini baş aşağı çevirin ve büyük doku kalıntılarını tezgah kağıdına dokunun. Hücre süzgecini beherin üzerine geri getirin ve filtratın içinden dökmeye devam edin. Erlenmeyer şişesindeki tüm sızıntılar filtrelenene kadar gerektiği kadar tekrarlayın.
- 40 μm hücre süzgecini ikinci bir 200 mL beher üzerinde tutmak için bir hemostat kullanın. Filtrasyonu ilk 200 mL beherde hücre süzgecinden dökün. Beherin içeriğini, hiçbir doku parçası kalmayana kadar ılık (38.5 ° C) PBS + PenStrep kullanarak hücre süzgecine durulayın. 40 μm hücre süzgecinin içeriğini atmayın.
- 18 G iğneyi 20 mL şırıngaya takın. Şırıngayı FWM ile doldurun. 40 μm hücre süzgecini kare bir Petri kabının üzerinde baş aşağı çevirin ve hücre süzgecinin içeriğini yemeğe yıkamak için şırıngayı kullanın. Şırıngayı yeniden doldurun ve hücre süzgecini doku parçaları kalmayana kadar gerektiği gibi durulayın.
NOT: Tipik olarak, 40 μm hücre süzgecinin içeriğini tamamen durulamak için 25 mL FWM yeterlidir.

Şekil 2: Yumurtalık işleme ve protokol iş akışı için çalışma alanı kurulumu . (A) Doğramadan önce yumurtalıkları kesmek ve yumurtalık homojenatını filtrelemek için tezgah üstü kurulum. (B) Homojenizatör aşamasının titreşimlerini azaltmak için strafor destekli doku doğrayıcı ve homojenizatör kurulumu. (C) Bütün bir yumurtalığın işlenmesi için iş akışını gösteren şematik. Yumurtalıklar aşırı bağ dokusundan kesilir ve daha sonra ikiye bölünür ve medulla ~ 1 mm kalınlığında bir korteks dilimi kalana kadar çıkarılır. Korteks 2,5 cm x 2,5 cm parçalara bölünür ve 500 μm'lik bir kesme aralığına ayarlanmış bir doku doğrayıcıda doğranır. Parçalar daha sonra homojenize edilir ve homojenat tülbentten süzülür, ardından 300 μm ve 40 μm hücre süzgeçlerinden filtrasyon yapılır. 40 μm hücre süzgecinin içeriği, bir stereomikroskop kullanılarak foliküller için aranan kare bir Petri kabına durulanır. BioRender.com ile oluşturuldu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
7. Foliküllerin aranması ve toplanması
- Kare Petri kabını (adım 6.6), ısıtılmış bir sahne 38.5 ° C'ye ayarlanmış bir stereoskoba aktarın. Stereoskop büyütme, araştırmacının tercihine bağlı olarak 1.25x ile 3.2x arasında ayarlanmalıdır.
- Pipet, 60 mm'lik bir Petri kabına 10 μL FWM damlası damla damlatın ve kurumasını önlemek için damlaları mineral yağ ile örtün. Petri kabını medya damlalarıyla birlikte 38,5 ° C'ye ayarlanmış bir ısıtma plakasına yerleştirin.
NOT: Folikülleri toplamak için 4 delikli bir plaka kullanılabilir. Bir veya iki kuyucuğa 500 μL yıkama ortamı ekleyin. 38.5 °C'ye ayarlanmış ısıtma plakasına yerleştirin. - Bir mikropipet pistonu ve ucu alın.
NOT: Bir cam 1-5 μL mikropipet (bkz. Malzeme Tablosu) önerilir, çünkü foliküllerin cam pipete yapışma ve çözeltiler arasında aktarıldığında kaybolma olasılığı daha düşüktür. Aynı zamanda foliküllerin daha kolay ve daha hassas mikromanipülasyonlarına izin verecek kadar küçük bir araçtır. - Kare Petri kabından folikülleri tanımlayın ve mikropipeti kullanarak medya (FWM) damlalarına aktarın. Birçok folikülün doku kalıntılarına gömülmesi muhtemeldir ve aşağıda açıklandığı gibi iki yöntemden biri kullanılarak alınabilir.
NOT: Foliküller mükemmel kürelerden ziyade dikdörtgendir ve tipik olarak folikülün merkezine doğru daha koyu kontrastlarda katı beyaz bir daire olarak sunulan bir oositi içerir (Şekil 3A-C). Folikülleri inkar edilmiş oositlerle karıştırmaktan kaçınmaya özen gösterin. Oositler mükemmel küreler olma eğilimindedir ve kalın, berrak bir zarla (zona pellucida) çevrilidir. Foliküllerin daha yakından incelenmesi için 10x (veya daha büyük) büyütmeli ters çevrilmiş bir mikroskop kullanılabilir (Şekil 3D).- Mikropipetin ucunu veya ince (27 G) iğneleri kullanarak folikülleri döküntülerden dikkatlice ayırın.
- Alternatif olarak, folikülleri enkazdan çıkarmak için tabaktaki kalıntıları birkaç kez almak ve fışkırtmak için kauçuk ampullü bir cam Pasteur pipeti kullanın.
- Folikül canlılığını korumaya yardımcı olmak için Petri kabını aramak için 30 dakikadan fazla sürmeden hızlı bir şekilde çalışın.
- 10 μL damla başına maksimum sadece beş folikül yerleştirin, çünkü daha yüksek bir yoğunluk foliküllerin birbirine yapışma olasılığını artırabilir.
8. Trypan mavi dışlama uygulanabilirlik testi
NOT: Aşağıdaki tüm adımlar için bir Petri kabının kapağını veya 4 delikli bir tabağı kullanın, çünkü foliküller kapağın plastiğine, gerçek kabın plastiğine olduğundan daha az yapışır.
- 50 mL PBS'de 100 mg PVP'yi çözerek PBS +% 0.2 polivinilpirolidon (PVP) hazırlayın.
NOT: PVP, foliküllerin yemeğe yapışma olasılığını azaltmak için burada kullanılır. - Tüm folikülleri (ortalama 40) ortam damlalarından 50 μL'lik bir PBS + %0,2 PVP damlasına aktarmak için mikropipeti kullanın.
- Folikülleri sırayla taze 50 μL PBS + % 0.2 PVP damlasına aktararak 2 kat yıkayın.
- Folikülleri 285 μL'lik bir PBS + % 0.2 PVP damlasına aktarın.
- 285 μL PBS + %0,2 PVP damlasına (son konsantrasyon %0,05 tripan mavisi) 15 μL tripan mavisi ekleyin ve damlayı 100 μL'ye ayarlanmış 200 μL pipet ucu kullanarak dikkatlice karıştırın.
NOT: Tripan canlılık testi için 4 delikli plaka kullanılıyorsa, bir kuyucuğa 475 μL PBS + %0,2 PVP ve 25 μL tripan mavisi ekleyin. - Folikülleri tripan mavisi damlasında 1 dakika boyunca inkübe edin ve daha sonra folikülleri PBS +% 0.2 PVP'nin 50 μL damlasına (veya 500 μL kuyusuna) aktarın.
- Folikülleri adım 8.3'e göre taze 50 μL damla (veya kuyucuk başına 500 μL) PBS +% 0.2 PVP ile 3 kat yıkayın.
- PBS +% 0.2 PVP'de üç yıkamadan sonra hala mavi görünen folikülleri atın, çünkü bunlar uygun değildir. Üç yıkamadan sonra mavi renklenmeyi korumayan foliküller uygulanabilir ve immünofloresan, kültür veya diğer prosedürler için kullanılabilir (Şekil 3E). Folikülleri sıvı azot içinde çıtçıtlayın ve gerekirse daha fazla kullanana kadar -80 ° C'de saklayın.
- RT-qPCR analizini ve foliküllerin immünofloresan boyamasını adım 9 ve 10'da açıklandığı gibi gerçekleştirin.

Şekil 3: İzole foliküller ve tripan mavisi dışlama testi. (A-C) İzole foliküller stereomikroskop ile çeşitli büyütmelerde görüntülendi. (A) İlk arama kabındaki döküntüler arasında izole foliküller. Bireysel foliküller kırmızı renkte daire içine alınır. Ölçek çubuğu = 2.000 μm. (B) Mineral yağ ile kaplı bir damlacık folikül yıkama ortamı içindeki izole foliküller ve döküntüler. Ölçek çubuğu = 1.000 μm. (C) Daha yüksek büyütmede enkaz içermeyen izole foliküller. Ölçek çubuğu = 1.000 μm. (D) Ters çevrilmiş parlak alan mikroskobu kullanılarak görüntülenen izole foliküller. Ölçek çubuğu = 100 μm. (E) Ters çevrilmiş bir parlak alan mikroskobu ve 20x hedefi kullanılarak görüntülenen canlı (lekesiz) ve canlı olmayan (mavi lekeli) foliküllerin temsili görüntüleri. Ölçek çubuğu = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
9. RT-qPCR analizi
- RNA izolasyon reaktifi kullanarak RNA'yı canlı foliküllerden (adım 8.8'den itibaren) izole edin (bakınız Malzeme Tablosu). RNA'yı saflaştırın ve üreticinin talimatlarına göre ticari olarak temin edilebilen bir temizleme kiti kullanarak DNaz ile tedavi edin ( Malzeme Tablosuna bakınız).
- RNA'yı 14 μL RNaz içermeyen su ile süzün ve bir spektrofotometre kullanarak sayısallaştırın. RNA, cDNA sentezine kadar -80 ° C'de saklanabilir.
- Üreticinin talimatlarına göre, ticari olarak temin edilebilen bir cDNA sentez kiti (bkz. Reaksiyon karışımını 25 °C'de 5 dakika ve ardından 42 °C'de 60 dakika inkübe edin, ardından 5 dakika boyunca 70 °C'de ısıtarak reaksiyonu sonlandırın.
- RT-qPCR'yi, ticari olarak temin edilebilen bir reaksiyon karışımı kullanarak sentezlenmiş cDNA (reaksiyon başına 5 ng) ve primerler (Tablo 1) ile gerçekleştirin (bkz. Termal döngü koşullarını kullanın: polimeraz aktivasyonu için 95 ° C'de 30 s, ardından her döngünün denatürasyon için 95 ° C'de 15 s ve tavlama / uzatma için 60 ° C'de 30 s içerdiği 40 döngü amplifikasyonu. RT-qPCR'yi döngü eşiği (Ct) değerlerini ölçerek analiz edin ve / veya agaroz jel elektroforezi kullanarak PCR ürünlerini görüntüleyin.
NOT: Bu çalışmada granüloza hücre belirteci FSHR ve germ hücre belirteci DAZL'ın transkript ekspresyonu değerlendirildi. Referans genler H2A ve ACTB idi. - Sıcaklığı 65 °C'den 0,5 °C'lik artışlarla 95 °C'ye ulaşana kadar her 5 saniyede bir artırarak erime eğrisi analizi yapın.
10. İmmünofloresan analizi
- Uygulanabilir folikülleri (adım 8.8'den itibaren) oda sıcaklığında (RT) %4'lük (v/v) paraformaldehitin (PFA) 100 μL'lik bir düşüşünde 15 dakika boyunca sabitleyin, ardından 100 μL PBS damlasında 3x'i + %0,1 BSA + %0,1 Ara 20'de yıkayın.
- Folikülleri RT'de 1x PBS +% 5 (v / v) normal eşek serumundan (NDS) oluşan bir bloke tamponunda 1 saat boyunca bloke edin. Bloke ettikten sonra, folikülleri 4 μg / mL tavşan anti-insan CX37 antikoru veya bloke tamponunda seyreltilmiş 4 μg / mL tavşan izotipi IgG'nin (negatif kontrol) 100 μL'lik bir damlasında 4 ° C'de gece boyunca inkübe edin.
- Folikülleri 100 μL PBS + % 0.1 BSA +% 0.1 Tween 20 damlasında 3 kat yıkayın ve daha sonra bloke edici tamponda seyreltilmiş 2 μg / mL eşek-tavşan karşıtı AlexaFluor 488 sekonder antikorunun 100 μL damlasında karanlıkta RT'de 1 saat boyunca inkübe edin.
- Folikülleri karanlıkta RT'de 5 dakika boyunca 1 μg / mL Hoechst 33342'lik 100 μL'lik bir damla içinde inkübe edin, DNA'yı etiketlemek için bloke edici tamponda seyreltin.
- Folikülleri bir cam mikroskop slaytı üzerinde 5 μL'lik bir damla montaj ortamına (bkz. Malzeme Tablosu) aktarın ve bir kapak kayması ile örtün. Slaytları gece boyunca RT'de kürlenmeye bırakın, ardından oje ile kapatın. Görüntülemeye kadar 4 °C'de saklayın.
- Tüm slaytları kapağın kaymasından sonraki 48 saat içinde görüntüleyin. DAPI (uyarma 380 nm ve emisyon 450 nm) ve FITC (uyarma 470 nm ve emisyon 525 nm) filtreleri altında ters çevrilmiş bir epifloresan mikroskop ( Malzeme Tablosuna bakınız) kullanarak görüntüleme gerçekleştirin.
- Her iki kanal için de pozlama süresini düzeltin. FITC (CX37) maruz kalma süresini tavşan izotipi negatif kontrolüne göre ayarlayın. Tavşan izotipi etiketli folikülleri tanımlamak için 20x hedefi ve DAPI kanalını 50 ms maruz kalma süresine ayarlayın.
- Bu folikülleri FITC kanalı altında görüntüleyin ve tüm arka plan yeşil sinyalleri kaldırılana kadar maruz kalma süresini azaltın. Bu pozlama süresine dikkat edin.
- Tüm CX37 antikor etiketli folikülleri, izotip FITC kanalı için ayarlanan maruz kalma süresini ve DAPI kanalı için 50 ms maruz kalma süresini kullanarak görüntüleyin.
- Sinyal yoğunluğunu, eşik değerinden sonra ortalama gri alanla ölçüldüğü şekilde, bir bilgisayar görüntü işleme programı29 kullanarak işleyin (bkz.
- Her folikül için DAPI görüntüsünün tiff dosyasını, tüm folikül ana hatlarıyla belirtilecek şekilde ayarlayın. Tüm folikülü bir ilgi alanı (ROI) olarak seçmek için programın Parçacıkları Analiz Et işlevini kullanın.
- İlgili folikül için FITC görüntüsünün tiff dosyasını açın ve DAPI görüntüsünden oluşturulan YG'yi FITC görüntüsünün üzerine yerleştirin. Sinyal yoğunluğunu temsil eden FITC görüntüsünün ortalama gri alanını ölçmek için programın Ölçüm işlevini kullanın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Genel bakış ve kritik adımlar
Bu protokolü kullanarak, küçük sığır preantral folikülleri, deneysel olarak ilgili sayılarda tek yumurtalıklardan güvenilir bir şekilde izole edilebilir. Toplam 30 replikasyondan, replika başına ortalama 41 folikül elde edildi ve 11 ila 135 folikül aralığında (Şekil 4A). 14 replikasyonda, foliküller, stereomikroskop altında 1 μm mikroskop kalibrasyon slaytı kullanılarak folikül çapının ölçülmesiyle daha önc...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Mevcut protokol, sığır yumurtalığından erken evre preantral folikülleri, özellikle primer ve erken sekonder evrelerde, almak için tekrarlanabilir bir yöntemi detaylandırmaktadır. Bu protokol, önceki raporlara dayanır 20,25,30,34,35,36 ve bireysel bir yumurtalıktan anlamlı sayıda folikülün izolasyonu ile sonuçlanan optimizasyonlar sağlar.
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu proje kısmen USDA Çok Devletli proje W4112 ve UC Davis Jastro Shields SM'ye verilen ödül tarafından finanse edildi.
Yazarlar, tüm deneylerde kullanılan sığır yumurtalıklarını sağladığı için Central Valley Meat, Inc.'e teşekkürlerini sunmak istiyorlar. Yazarlar ayrıca Olivia Silvera'ya yumurtalık işleme ve folikül izolasyonu ile ilgili yardımları için teşekkür eder.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5-3/4" Soda Lime Disposable Glass Pasteur Pipette | Duran Wheaton Kimble | 63A54 | Pasteur pipette that can be used to dislodge follicles from debris while searching within the petri dish |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | Diluted to 4%; fixation of follicles for immunostaining |
| 20 mL Luer-lock Syringe | Fisher Scientific | Z116882-100EA | Syringe used with the 18 G needle to dislodge follicles from the 40 μm cell strainer |
| #21 Sterile Scalpel Blade | Fisher Scientific | 50-365-023 | Used to cut the ovaries and remove the medula |
| 40 μm Cell Strainer | Fisher Scientific | 22-363-547 | Used to filter the filtrate from the 300 μm cell strainer |
| 104 mm Plastic Funnel | Fisher Scientific | 10-348C | Size can vary, but ensure the cheese cloth is cut appropriately and that the ovarian homogenate will not spill over |
| 300 μm Cell Strainer | pluriSelect | 43-50300-03 | Used to filter the filtrate from the cheese cloth |
| 500 mL Erlenmeyer Flask | Fisher Scientific | FB500500 | Funnel and flask used to catch filtrate from the cheese cloth |
| Air-Tite Sterile Needles 18 G | Thermo Fisher Scientific | 14-817-151 | 18 G offers enough pressure to dislodge follicles from the 40 μm cell strainer |
| Air-Tite Sterile Needles 27 G 13 mm | Fisher Scientific | 14-817-171 | Needles that can be used to manipulate any debris in which follicles are stuck |
| BD Hoechst 33342 Solution | Fisher Scientific | BDB561908 | Fluorescent DNA stain |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | Component of follicle wash media |
| Cheese Cloth | Electron Microscopy Sciences | 71748-00 | First filtering step of the ovarian homogenate meant to remove large tissue debris |
| Classic Double Edge Safety Razor Blades | Wilkinson Sword | N/A | Razor blades that fit the best in the McIlwain Tissue Chopper and do not dull quickly |
| Donkey-Anti-Rabbit Secondary Antibody, Alexa Fluor 488 | Fisher Scientific | A-21206 | Secondary antibody for immunostaining |
| Eisco Latex Pipette Bulbs | Fisher Scientific | S29388 | Rubber bulb to use with Pasteur pipettes |
| HEPES Buffer | Sigma-Aldrich | H3375 | Component of follicle wash media |
| Homogenizer | VWR | 10032-336 | Homogenize the ovarian tissue to release follicles |
| ImageJ/Fiji | NIH | v2.3.1 | Software used for analysis of fluorescence-immunolocalization |
| McIlwain Tissue Chopper | Ted Pella | 10184 | Used to cut ovarian tissue small enough for homogenization |
| Microscope - Stereoscope | Olympus | SZX2-ILLT | Dissection microscope used for searching and harvesting follicles from the filtrate |
| Microscope - Inverted | Nikon | Diaphot 300 | Inverted microscope used for high magnification brightfield visualization of isolated follicles |
| Microscope - Inverted | ECHO | Revolve R4 | Inverted microscope used for high magnification brightfield and epifluorescence visualization of isolated follicles |
| Mineral Oil | Sigma-Aldrich | M8410-1L | Oil to cover the drops of follicle wash medium to prevent evaporation during searching |
| Non-essential Amino Acids (NEAA) | Gibco | 11140-050 | Component of follicle wash medium |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-001 | Reagent for immunostaining blocking buffer |
| Nunc 4-well Dishes for IVF | Thermo Fisher Scientific | 144444 | 4-well dishes for follicle isolation and washing |
| Penicillin-Streptomycin Solution 100x | Gibco | 15-140-122 | Component of follicle wash medium |
| Petri Dish 60 mm OD x 13.7 mm | Ted Pella | 10184-04 | Petri dish that fits the best in the McIlwain Tissue Chopper |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP665-1 | Washing buffer for ovaries and follicles |
| Plastic Cutting Board | Fisher Scientific | 09-002-24A | Cutting board of sufficient size to safely cut ovaries |
| Polyvinylpyrrolidone (PVP) | Fisher Scientific | BP431-100 | Addition of PVP (0.1% w/v) to PBS prevents follicles from sticking to the plate or each other |
| ProLong Gold Antifade Mountant | Thermo Fisher Scientific | P36930 | Mounting medium for fluorescently labeled cells or tissue |
| Qiagen RNeasy Micro Kit | Qiagen | 74004 | RNA column clean-up kit |
| R | The R Foundation | v4.1.2 | Statistical analysis software |
| Rabbit-Anti-Human Cx37/GJA4 Polyclonal Antibody | Abcam | ab181701 | Cx37 primary antibody for immunostaining |
| RevertAid RT Reverse Transcription Kit | Thermo Fisher Scientific | K1691 | cDNA synthesis kit |
| Rstudio | RStudio, PBC | v2021.09.2 | Statistical analysis software |
| Sodium Hydroxide Solution (1N/Certified) | Fisher Scientific | SS266-1 | Used to increase media pH to 7.6-7.8 |
| Sodium Pyruvate (NaPyr) | Gibco | 11360-070 | Component of follicle wash medium |
| Square Petri Dish 100 mm x 15 mm | Thermo Fisher Scientific | 60872-310 | Gridded petri dishes allow for more efficient identification of follicles |
| SsoAdvanced Universal SYBR Green Supermix | BioRad | 1725271 | Mastermix for PCR reaction |
| Steritop Threaded Bottle Top Filter | Sigma-Aldrich | S2GPT02RE | Used to sterilize follicle wash medium |
| SYBR-safe DNA gel stain | Thermo Fisher Scientific | S33102 | Staining to visual PCR products on agarose gel |
| TCM199 with Hank’s Salts | Gibco | 12-350-039 | Component of follicle wash medium |
| Triton X-100 | Fisher Scientific | BP151-100 | Detergent for immunostaining permeabilization buffer |
| Trizol reagent | Thermo Fisher Scientific | 15596026 | RNA isolation reagent |
| Trypan Blue Solution, 0.4% | Gibco | 15-250-061 | Used for testing viability of isolated follicles |
| Tween 20 | Detergent for immunostaining wash buffer | ||
| Warmer Plate Universal | WTA | 20931 | Warm plate to keep follicles at 38.5 °C while searching under the microscope |
| Wiretrol II Calibrated Micropipets | Drummond | 50002-005 | Glass micropipettes to manipulate follicles |
Referanslar
- Fortune, J. E., Yang, M. Y., Allen, J. J., Herrick, S. L. Triennial reproduction symposium: The ovarian follicular reserve in cattle: What regulates its formation and size. Journal of Animal Science. 91 (7), 3041-3050 (2013).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology. 195 (4), 327-336 (1997).
- Jaffe, L. A., Egbert, J. R. Regulation of mammalian oocyte meiosis by intercellular communication within the ovarian follicle. Annual Review of Physiology. 79, 237-260 (2017).
- Driancourt, M. A., Reynaud, K., Cortvrindt, R., Smitz, J. Roles of KIT and KIT LIGAND in ovarian function. Reviews of Reproduction. 5 (3), 143-152 (2000).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproductive Fertility. 81 (2), 301-307 (1987).
- Aerts, J. M. J., Bols, P. E. J. Ovarian follicular dynamics: a review with emphasis on the bovine species. Part I: Folliculogenesis and preantral follicle development. Reproduction in Domestic Animals. 45 (1), 171-179 (2010).
- Sugiura, K., Pendola, F. L., Eppig, J. J. Oocyte control of metabolic cooperativity between oocytes and companion granulosa cells: energy metabolism. Developmental Biology. 279 (1), 20-30 (2005).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biology of Reproduction. 73 (2), 351-357 (2005).
- Sugimura, S., et al. Amphiregulin co-operates with bone morphogenetic protein 15 to increase bovine oocyte developmental competence: effects on gap junction-mediated metabolite supply. Molecular Human Reproduction. 20 (6), 499-513 (2014).
- Edson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Matzuk, M. M., Burns, K. H. Genetics of mammalian reproduction: modeling the end of the germline. Annual Review of Physiology. 74, 503-528 (2012).
- McGee, E. A., Raj, R. S. Regulators of ovarian preantral follicle development. Seminars in Reproductive Medicine. 33 (3), 179-184 (2015).
- Chen, Y., et al. The factors and pathways regulating the activation of mammalian primordial follicles in vivo. Frontiers in Cell and Developmental Biology. 8, 575706(2020).
- Figueiredo, J. R., et al. Development of a combined new mechanical and enzymatic method for the isolation of intact preantral follicles from fetal, calf and adult bovine ovaries. Theriogenology. 40 (4), 789-799 (1993).
- Sirard, M. A. The ovarian follicle of cows as a model for human. Animal Models and Human Reproduction. , 127-144 (2017).
- Parkes, W. S., et al. Hyaluronan and collagen are prominent extracellular matrix components in bovine and porcine ovaries. Genes. 12 (8), 1186(2021).
- Araújo, V. R., Gastal, M. O., Figueiredo, J. R., Gastal, E. L. In vitro culture of bovine preantral follicles: a review. Reproductive Biology and Endocrinology. 12 (1), 1-14 (2014).
- Eppig, J. J., Schroeder, A. C. Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation, and fertilization in vitro. Biology of Reproduction. 41 (2), 268-276 (1989).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Nuttinck, F., Mermillod, P., Massip, A., Dessy, F. Characterization of in vitro growth of bovine preantral ovarian follicles: A preliminary study. Theriogenology. 39 (4), 811-821 (1993).
- Demeestere, I., et al. Effect of preantral follicle isolation technique on in-vitro follicular growth, oocyte maturation and embryo development in mice. Human Reproduction. 17 (8), 2152-2159 (2002).
- Fattahi, A., et al. Optimization of porcine ovarian follicle isolation methods for better developmental potential. Tissue Engineering Part A. 26 (13-14), 712-719 (2020).
- Nagashima, J. B., Hill, A. M., Songsasen, N. In vitro development of mechanically and enzymatically isolated cat ovarian follicles. Reproduction and Fertility. 2 (1), 35-46 (2021).
- Lucci, C. M., Rumpf, R., Figueiredo, J. R., Báo, S. N. Zebu (Bos indicus) ovarian preantral follicles: Morphological characterization and development of an efficient isolation method. Theriogenology. 57 (5), 1467-1483 (2002).
- Langbeen, A., et al. Characterization of freshly retrieved preantral follicles using a low-invasive, mechanical isolation method extended to different ruminant species. Zygote. 23 (5), 683-694 (2014).
- Candelaria, J. I., Denicol, A. C. Characterization of isolated bovine preantral follicles based on morphology, diameter and cell number. Zygote. 28 (2), 154-159 (2020).
- vanden Hurk, R., et al. Ultrastructure and viability of isolated bovine preantral follicles. Human Reproduction Update. 4 (6), 833-841 (1998).
- Paes, V. M., et al. Effect of heat stress on the survival and development of in vitro cultured bovine preantral follicles and on in vitro maturation of cumulus-oocyte complex. Theriogenology. 86 (4), 994-1003 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Aguiar, L. H., Hyde, K. A., Pedroza, G. H., Denicol, A. C. Heat stress impairs in vitro development of preantral follicles of cattle. Animal Reproduction Science. 213, 106277(2020).
- Kristensen, S. G., Ebbesen, P., Andersen, C. Y. Transcriptional profiling of five isolated size-matched stages of human preantral follicles. Molecular and Cellular Endocrinology. 401, 189-201 (2015).
- Candelaria, J. I., Rabaglino, M. B., Denicol, A. C. Ovarian preantral follicles are responsive to FSH as early as the primary stage of development. Journal of Endocrinology. 247 (2), 153-168 (2020).
- Nuttinck, F., et al. Comparative immunohistochemical distribution of Connexin 37 and Connexin 43 throughout folliculogenesis in the bovine ovary. Molecular Reproduction and Development. 57 (1), 60-66 (2000).
- Itoh, T., Hoshi, H. Efficient isolation and long-term viability of bovine small preantral follicles in vitro. In Vitro Cellular and Developmental Biology-Animal. 36 (4), 235-240 (2000).
- Saha, S., Shimizu, M., Geshi, M., Izaike, Y. In vitro culture of bovine preantral follicles. Animal Reproduction Science. 63 (1-2), 27-39 (2000).
- Bus, A., et al. Preservation of connexin 43 and transzonal projections in isolated bovine pre-antral follicles before and following vitrification. Journal of Assisted Reproduction and Genetics. 38 (2), 479-492 (2021).
- Gougeon, A., Ecochard, R., Thalabard, J. C. Age-related changes of the population of human ovarian follicles: increase in the disappearance rate of non-growing and early-growing follicles in aging women. Biology of Reproduction. 50 (3), 653-663 (1994).
- Xu, D., et al. Raf-ERK1/2 signaling pathways mediate steroid hormone synthesis in bovine ovarian granulosa cells. Reproduction in Domestic Animals. 54 (5), 741-749 (2019).
- Santos, R. R., et al. Cryopreservation of ovarian tissue: an emerging technology for female germline preservation of endangered species and breeds. Animal Reproduction Science. 122 (3-4), 151-163 (2010).
- Leonel, E. C. R., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Bus, A., Langbeen, A., Martin, B., Leroy, J. I. M. R., Bols, P. E. J. Is the pre-antral ovarian follicle the 'holy grail' for female fertility preservation. Animal Reproduction Science. 207, 119-130 (2019).
- Chen, J., et al. Optimization of follicle isolation for bioengineering of human artificial ovary. Biopreservation and Biobanking. , (2021).
- Chiti, M. C., et al. A modified and tailored human follicle isolation procedure improves follicle recovery and survival. Journal of Ovarian Research. 10 (1), 1-9 (2017).
- Kristensen, S. G., Rasmussen, A., Byskov, A. G., Andersen, C. Y. Isolation of pre-antral follicles from human ovarian medulla tissue. Human Reproduction. 26 (1), 157-166 (2011).
- Oktay, K., et al. Isolation and characterization of primordial follicles from fresh and cryopreserved human ovarian tissue. Fertility and Sterility. 67 (3), 481-486 (1997).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır