JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
단편화, 균질화 및 연속 여과의 조합을 사용하여 소 난소에서 작은 전방 난포의 분리
요약
전후 난포 생성에 대한 연구를 발전시키기 위해서는 단일 난소에서 난포를 분리하는 효율적인 방법이 필요합니다. 여기에 제시된 것은 조직 초퍼와 균질화를 사용하여 소 난소에서 난포를 분리하기위한 간소화 된 기계적 프로토콜입니다. 이 방법은 단일 난소에서 많은 수의 생존 가능한 전방 난포를 수집 할 수있게합니다.
초록
포유류 모낭 생성의 전체 과정을 이해하는 것은 가축, 인간 및 멸종 위기에 처한 종의 보조 생식 기술을 개선하는 데 중요합니다. 연구는 특히 소 종과 같은 대형 포유류에서 더 작은 전방 모낭의 분리가 어렵 기 때문에 대부분 전방 및 큰 전방 모낭으로 제한되었습니다. 이 연구는 단일 소 난소에서 많은 수의 작은 전방 난포를 회수하는 효율적인 접근 방식을 제시합니다. 개별 소 난소의 피질을 조직 초퍼를 사용하여 500μm 입방체로 절단하고 10mm 프로브를 사용하여 9,000-11,000rpm에서 6분 동안 균질화했습니다. 큰 파편은 치즈 천을 사용하여 균질액으로부터 분리하고, 이어서 300 μm 및 40 μm 세포 스트레이너를 통한 연속 여과하였다. 40μm 스트레이너에 남아있는 내용물을 검색 접시로 헹구어 모낭을 식별하고 배지 한 방울로 수집했습니다. 수집된 모낭의 생존력은 트리판 블루 염색을 통해 시험하였다. 이 방법은 약 90 분 안에 단일 소 난소에서 많은 수의 생존 가능한 작은 preantral 난포를 분리 할 수 있습니다. 중요하게도,이 방법은 완전히 기계적이며 모낭을 손상시킬 수있는 조직을 해리하기 위해 효소를 사용하지 않습니다. 이 프로토콜을 사용하여 얻은 난포는 RT-qPCR을 위한 RNA 분리, 특정 단백질의 면역 국소화 및 시험관 내 배양과 같은 다운스트림 응용 분야에 사용할 수 있습니다.
서문
난소 난포는 난소의 기능 단위로, 배우자 (난 모세포)의 생산뿐만 아니라 생식 기능과 전반적인 건강에 중요한 호르몬을 담당합니다. 원시 난포는 태아 발달 중 또는 종1에 따라 신생아기에 난소에서 형성되며 여성의 난소 예비를 구성합니다. 여포 성장은 휴식 풀을 떠나 성장 단계로 들어가는 원시 모낭의 활성화로 시작됩니다. 전두엽 발달 이전의 모든 난포 단계를 포함하는 전안구 모낭 생성은 이 두 세포 유형 2,3 간의 긴밀한 통신에 의해 구동되는 난모세포와 주변 과립막 세포에서 동기식 형태학적 및 대사적 변화를 필요로 하는 매우 역동적인 과정입니다. Preantral 난포는 주어진 시간에 난소에서 발견되는 난포 단위의 대부분을 구성합니다4. 난포 발달 전 단계를 통한 발달은 전방 발달5,6보다 몇 주 더 긴 것으로 추정되며, 이 시기는 난모세포와 체세포가 발달의 최종 단계(즉, 항문 단계)에 진입하고 배란, 수정 및 배아 발달을 준비하기에 충분한 성숙을 얻는 데 필요합니다7,8,9.
난소 전 난포 형성에 대한 현재 지식의 대부분은 마우스 모델10,11,12,13에서 비롯되며, 이는 부분적으로 더 작고 섬유질이 적은 난소에서 많은 수의 난포를 쉽게 회복 할 수 있기 때문입니다. 소 난소에서 많은 수의 전방 난포를 분리했다는 보고는 약 30년 전으로 거슬러 올라갑니다.14, 이러한 초기 단계의 난포의 발달을 조절하는 과정에 대한 보다 완전한 이해는 실현되지 않은 상태로 남아 있습니다., 특히 발달 초기 단계에서 충분한 수의 생존 가능한 전두엽 난포를 회수할 수 있는 최적화되고 효율적이며 반복 가능한 방법이 부족하기 때문입니다. 인간의 보조 생식에 대한 미래의 사용을 위해 난소 예비력을 보존하는 것에 대한 관심이 증가함에 따라, 소는 더 유사한 난소 구조15로 인해 매력적인 모델이됩니다. 그러나, 소 난소는 마우스 난소16에 비해 콜라겐이 현저히 풍부하여, 마우스에 대해 기술된 방법을 사용한 기계적 분리를 매우 비효율적으로 만든다. 생식력 보존 기술을 확장하기 위한 노력에는 전안구 난포의 완전한 시험관 내 성장, 밀폐된 난모세포의 시험관 내 성숙(IVM), 체외 수정(IVF), 배아 생산 및 이식이 포함됩니다17. 지금까지, 이 전체 과정은 마우스18에서만 달성되었다. 소에서, 시험관 내에서 난포 성장을 향한 진전은 배양 시작시 가변 난포 단계와 프로토콜17,19 사이의 다양한 배양 기간을 갖는 몇 가지 보고서로 제한됩니다.
소 난소에서 preantral 난포의 수확을위한 문헌에 설명 된 방법은 대부분 분리 또는 조합된 기계적 및 효소 기술을 사용했습니다 2,14,17,20. 소 전신난포 분리를 위한 프로토콜의 첫 번째 보고는 전체 난소를 처리하기 위해 조직 균질화기 및 직렬 여과를 사용하였다20. 이 연구는 콜라게나제14를 활용한 기계적 및 효소적 절차를 결합한 보고로 이어졌습니다. 난소 조직을 소화하기 위해 콜라게나제를 사용할 때 반복되는 주제는 난포 생존력을 손상시킬 수 있는 난포 기저막의 손상에 대한 잠재적 위험입니다 14,21,22,23. 따라서, 조직 초퍼의 사용 및 반복 피펫팅 또는 균질화20,24,25,26과 결합된 조직 초퍼의 사용과 같은 기계적 방법의 상이한 조합이 사용되었다. 설명된 또 다른 기계적 기술은 바늘을 사용하여 난소 조직에서 직접 전안구 난포를 해부하는데, 이는 더 큰(>200μm) 2차 난포를 분리하는 데 특히 유용합니다. 그러나 이 과정은 시간이 많이 걸리고 더 작은 전엽 난포를 분리하는 데 비효율적이며 소 난소에서 시도할 때 스킬셋에 의존합니다 19,27,28.
문헌에 설명된 다양한 기술을 활용하여 이 프로토콜은 효소 용액에서 배양을 피하는 간단하고 일관되며 효율적인 방식으로 단일 소 난소에서 전후 난포의 분리를 최적화하는 것을 목표로 했습니다. 전방 모낭을 분리하는 방법을 개선하면 이 모낭 형성 단계에 대한 이해를 높이고 전방 난포를 항문 단계로 발전시키는 효과적인 배양 시스템을 개발할 수 있는 기회를 제공할 수 있습니다. 소 종과 같은 대형 포유동물로부터 전치모낭의 단리를 위해 본원에 기재된 상세한 절차는 인간에게 번역될 수 있는 비뮤린 종에서 초기 모낭 발생을 연구하고자 하는 연구자에게 필수적일 것이다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
소(Bos taurus) 난소는 지역 도축장에서 공급되어 수집 후 6시간 이내에 실험실로 이송되었습니다. 시설에서 처리되는 동물의 수가 많기 때문에 동물의 나이, 품종 및 발정주기의 단계를 알 수 없습니다. 이 실험에는 살아있는 동물이 사용되지 않았기 때문에 승인 된 동물 관리 및 사용 프로토콜이 필요하지 않았습니다.
1. 장비 및 시약 준비
- 실험실 벤치의 2피트 너비 부분을 벤치 페이퍼로 덮습니다.
- 메스 손잡이, 멸균 메스 블레이드, 지혈제, 해부 겸자 한 쌍, 20mL 루어 잠금 주사기, 18G 바늘, 200mL 비커 2개, 500mL 삼각 플라스크, 104mm 직경의 플라스틱 깔때기, 플라스틱 도마, 처리 중인 난소당 22cm2 겹의 치즈클로스(치즈천은 사용 전에 오토클레이빙으로 멸균할 수 있음) 1개, 300 μm 세포 스트레이너 및 40 μm 세포 스트레이너 ( 재료 표 참조).
- 모든 장비를 벤치 용지로 옮깁니다.
- 지혈제를 사용하여 메스 칼날을 메스 손잡이에 끼웁니다. 블레이드의 각진 베이스를 핸들의 각진 표시기에 맞춘 다음 블레이드를 핸들의 홈에 밀어 넣습니다.
- 깔때기를 삼각 플라스크에 넣고 깔때기 입구를 치즈 천으로 덮습니다.
- 처리할 난소당 하나의 50mL 원뿔형 튜브를 38.5°C로 설정된 물 또는 비드 배스에 놓습니다.
- 처리중인 난소 당 하나의 100mm x 15mm 정사각형 페트리 접시를 38.5 ° C로 설정된 슬라이드 워머에 놓습니다.
- 10mL의 페니실린-스트렙토마이신(PenStrep; 10,000U/mL 페니실린 및 10,000μg/mL 스트렙토마이신)을 1x 인산염 완충 식염수(PBS) 1L에 추가합니다. PBS + PenStrep을 난소 처리 최소 2시간 전에 38.5°C로 설정된 물 또는 비드 배스에서 따뜻하게 합니다.
참고: PBS + PenStrep 용액은 분리된 난포를 배양할 때 난소를 세척하는 데 필수적이며 미생물 오염을 완화하기 위한 다운스트림 실험에도 여전히 권장됩니다. - 처리된 난소 여과액을 수집하려면 3mg/mL 소 혈청 알부민(BSA), 25mM HEPES 완충액, 100UI 페니실린/100μg/mL 스트렙토마이신, 1mM 나트륨 피루브산염(NaPyr) 및 100nM 비필수 아미노산(NEAA)을 포함하는 행크스 염( 재료 표 참조)과 함께 TCM199로 구성된 난포 세척 배지(FWM)를 사용하십시오.
- 멸균 TCM199, 250mL 병 및 100mL 눈금이 매겨진 실린더를 생물안전 캐비닛(BSC)으로 옮깁니다. 194mL의 TCM199를 병으로 옮깁니다.
- BSC에서 TCM199의 비커를 제거하고 교반 플레이트로 가져옵니다. 600mg의 BSA, 1.19g의 HEPES 버퍼 및 오토클레이브 교반 막대를 병에 넣고 녹을 때까지 저어줍니다.
- BSA와 HEPES 버퍼가 완전히 용해되면 pH 측정기로 측정한 pH 7.6-7.8에 도달할 때까지 1N 수산화나트륨(NaOH)을 배지에 추가합니다.
- BSC로 옮기기 전에 배지 병, 진공 여과 장치, 50mL 원뿔형 튜브 4개, PenStrep, NaPyr 및 NEAA 병을 70% 에탄올로 닦습니다.
- PenStrep (10,000 U / mL 페니실린 및 10,000 μg / mL 스트렙토 마이신), 100 mM NaPyr 및 100x NEAA를 TCM199 + 3 mg / mL BSA + 25 mM hepes 병에 각각 2mL 첨가하십시오. 최종 배지를 멸균 여과하고 50mL 코니컬 튜브에 분취합니다. 배지를 4°C에서 최대 2주 동안 보관하십시오.
- 난소 처리 최소 1시간 전에 38.5°C로 설정된 비드 배스에서 난소 2개당 배지의 50mL 원뿔형 튜브 1개를 따뜻하게 합니다.
2. 티슈 초퍼 설정
- 티슈 초퍼( 재료 표 참조)가 연결되어 있고 켜져 있는지 확인하십시오.
- 제조업체의 사양에 따라 슬라이스 두께를 500μm로, 블레이드 힘 제어 손잡이를 20°로, 속도 제어 손잡이를 90°로 설정합니다.
- 60mm 플라스틱 페트리 접시를 플레이트 홀더에 삽입하고 플레이트 홀더를 스테이지에 삽입합니다.
- 수동 작동 손잡이를 시계 방향으로 돌려 도마를 최대한 높이 올립니다.
- 집게를 사용하여 양날 면도날( 재료 표 참조)을 도마에 삽입된 나사에 놓습니다. 블레이드 걸쇠를 블레이드 위에 놓고 와셔와 너트로 고정합니다. 너트를 1/4 바퀴 느슨하게 두십시오.
- 도마 암이 칼날을 페트리 접시에 평평하게 끼울 때까지 수동 작동 손잡이를 돌립니다. 너트드라이버로 너트를 조입니다.
- 수동 작동 손잡이를 사용하여 도마 암을 최대한 높이 올립니다. 테이블 분리 손잡이가 제자리에 고정될 때까지 왼쪽 끝까지 움직입니다.
3. 난소 준비
- 실험실에서 난소를 따뜻한 (38.5 ° C) 멸균 PBS + PenStrep으로 옮깁니다.
참고 : 동물에서 제거한 후 가능한 한 빨리 난포 분리를 위해 난소를 처리하는 것이 좋습니다. 이 프로토콜에서 난소는 수확 후 6 시간 이내에 처리되었습니다. 난소는 대략 38.5°C에서 멸균된 0.9% 식염수를 함유하는 보온병으로 도축장에서 실험실로 운반되었다. - 가능하면 작은(3-5mm) 제트랄 난포, 큰(≥8mm) 제트랄 난포가 없는 작은 난소(≤ 4cm x 3cm x 3cm) 난소, 두드러진 황체가 없는 난소를 선택하십시오(그림 1). 이러한 기준은 간질 세포 및 세포 외 기질과 같은 최소량의 비 난포 파편이 분리 된 모낭을 포함하는 결과 사각형 접시에 포함되도록하기 위해 권장됩니다.
참고: Antral 난포는 난소 표면에 액체로 채워진 구형의 소포 구조로 식별될 수 있습니다. Corpora lutea는 난소 표면에서 튀어 나온 빨간색, 주황색 또는 노란색 뻣뻣한 구조로 식별 할 수 있습니다. - 가위를 사용하여 난소에서 과도한 결합 조직과 지방을 제거하십시오.
- 비커에서 70 % 에탄올로 난소를 30 초 동안 씻으십시오.
- 따뜻한 (38.5 ° C) PBS + PenStrep의 비커에서 난소를 각각 2 분 동안 3 회 세척하고, 각 세척에 대해 신선한 PBS + PenStrep을 사용합니다.
- 처리 준비가 될 때까지 난소를 따뜻한(38.5°C) PBS + PenStrep에 보관하십시오.
알림: 실험실과 난소 공급원 사이의 거리는 가변적일 수 있습니다. 따라서 난포 생존력의 유지를 보장하기 위해 적시에 프로토콜을 완료하는 것이 중요합니다.
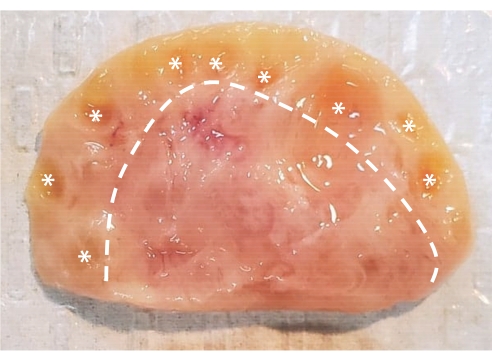
그림 1 : 소 난소의 해부학. 소 난소는 상피층으로 둘러싸인 두 개의 주요 영역으로 구성됩니다. 점선의 왼쪽 조직으로 구성된 피질은 원시 단계부터 대뇌 단계까지의 난소 난포를 포함합니다. Preantral 모낭은 너무 작아서 육안으로 볼 수 없습니다. antral 모낭은 별표로 표시됩니다. 점선의 오른쪽 조직으로 구성된 수질에는 혈관, 림프관 및 신경이 포함되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 절단 절차
참고: 한 번에 하나의 난소만 처리하십시오. 난포 생존력에 영향을 줄 수 있는 온도 감소를 피하기 위해 난소를 빠르게 처리합니다.
- 하나의 난소를 벤치 페이퍼의 도마 (그림 2A)로 옮기고 티슈 초퍼 (그림 2B)를 준비합니다.
- 집게와 메스를 사용하여 난소를 반으로 자르고 각 반쪽에서 수질을 제거하고 그림 1C와 같이 약 2mm 두께의 피질 만 남깁니다.
- 한 인대 부착 부위에서 반대쪽 부착 부위까지 세로로 난소를 반으로 자릅니다.
- 난소의 절반을 처리 할 도마에 놓고 난소의 나머지 절반을 따뜻한 (38.5 ° C) PBS + PenStrep에 다시 놓습니다.
- 노출 된 수질이 위쪽을 향하게하여 피질을 절단하지 않고 난소 표면에서 약 2mm 떨어진 난소의 곡률을 따라 자릅니다.
- 난소의 곡률을 따라 슬라이스를 사용하여 슬라이스를 깊게하고 여전히 난소의 곡률을 따라 피질을 수질에서 분리하십시오.
- 황체의 경계를 따라 절단하여 난소에서 모든 시체 루테아를 해부하고 버립니다.
- 상피가 위쪽을 향하도록 난소를 반으로 뒤집고 메스를 사용하여 피질에서 수질을 자르십시오. 인대에 연결된 난소 조각 가장자리 주위에 남아있는 흰색 결합 조직을 잘라냅니다.
- 수질의 대부분이 제거되면 메스를 사용하여 피질을 약 1mm 두께로 자릅니다. 수질의 나머지 부분을 면도하기 위해 앞뒤로 작은 동작으로 메스를 조작하십시오.
참고: 수질은 큰 혈관을 포함하는 난소의 내부 부분입니다. 피질은 난소의 바깥 부분이며 가장 바깥 쪽 표면 상피 바로 아래에 있습니다. 피질은 소 난소에서 약 1mm 두께이므로 난소를 1mm 두께로 자르면 수질이 제거됩니다.
- 피질을 2.5cm x 2.5cm 이하의 조각으로 자릅니다. 자를 준비가 될 때까지 피질 조각을 따뜻한 (38.5 ° C) PBS + PenStrep에 보관하십시오.
- 비커에 최소 50mL의 따뜻한(38.5°C) PBS + PenStrep을 채우고 플라스틱 이송 피펫을 얻습니다.
- 피질 한 조각을 티슈 초퍼의 페트리 접시에 옮기고 따뜻한 (38.5 ° C) PBS + PenStrep 서너 방울로 티슈를 적시십시오.
- 한 쌍의 집게로 티슈 조각을 안정적으로 잡고 재설정 버튼을 한 번 눌러 티슈 초퍼를 시작합니다. 집게로 조직을 계속 안정화하면서 한 손으로 페트리 접시를 안정화시킵니다. 칼날이 집게에 부딪히지 않도록 필요에 따라 집게를 조직을 따라 왼쪽으로 움직입니다. 결과 스트립의 길이는 약 500μm입니다.
- 전체 피질 조각이 스트립으로 절단되면 블레이드 홀더 손잡이를 사용하여 페트리 접시에서 블레이드를 들어 올리고 집게를 사용하여 블레이드에서 조직을 제거합니다.
- 플레이트 홀더를 90° 돌립니다.
- 재설정 버튼을 한 번 누릅니다. 집게를 사용하여 티슈 스트립을 블레이드의 경로로 밀어 넣는 동안 한 손으로 페트리 접시를 안정화합니다.
- 칼날을 티슈 스트립에 완전히 통과시킵니다. 칼날 홀더 손잡이를 사용하여 페트리 접시에서 칼날을 들어 올리고 집게를 사용하여 칼날에서 티슈를 제거합니다.
- 전사 피펫을 사용하고 따뜻한(38.5°C) PBS + PenStrep을 사용하여 잘게 잘린 조직(조직의 최종 크기: 500μm x 500μm x 1mm 큐브)을 예열된(38.5°C) 50mL 원뿔형 튜브로 세척합니다. 원뿔형 튜브를 물 또는 비드 배스로 되돌려 잘게 잘린 조직을 따뜻하게 유지합니다 (38.5 ° C).
- 너트드라이버를 사용하여 도마에서 너트를 제거하고 와셔와 블레이드 걸쇠를 제거합니다. 집게를 사용하여 도마에서 칼날을 제거하고 사용하지 않은 가장자리가 페트리 접시를 향하도록 뒤집은 다음 다시 도마 위에 놓습니다. 블레이드 걸쇠, 와셔 및 너트를 교체하고 2.5-2.7단계에 설명된 대로 테이블 분리 손잡이를 재설정합니다.
- 난소에서 나머지 모든 피질 조각에 대해 4.5-4.12 단계를 반복하고 각 절삭 날을 사용한 후 블레이드를 새 것으로 교체하십시오.
- 사용한 모든 칼날은 벽이 단단한 플라스틱 날카로운 물건 용기에 폐기하십시오.
5. 균질화 절차
- 균질화기 장치( 재료 표 참조)가 연결되어 있고 속도가 두 번째 막대(9,000-11,000rpm)로 설정되어 있는지 확인하십시오. 제조업체의 사양에 따라 10mm 발전기 프로브를 장치에 삽입합니다.
- 1분 동안 타이머를 설정하고 프로브를 한쪽 난소(단계 4.11)에서 잘게 잘린 피질 조직을 포함하는 50mL 원뿔형 튜브에 삽입하고 튜브를 25mL 라인까지 채우기에 충분한 PBS + PenStrep을 삽입합니다. 프로브가 삽입되는 깊이는 챔버 바닥에서 측정 한 액체 높이의 1/3이어야합니다. 소용돌이를 최소화하기 위해 프로브를 중앙에서 약간 벗어난 위치에 놓습니다.
- 타이머를 시작하고 균질화기를 켭니다. 프로브의 바닥이 튜브에 닿지 않는지 확인하고 균질화기가 켜져 있는 동안 튜브를 계속 유지하십시오.
- 균질화 1 분 후, 튜브에서 프로브를 제거한다. 집게를 사용하여 통풍구를 막고 있는 결합 조직과 로터 나이프와 로터 튜브 사이의 공간을 제거합니다. 피질 조각이 프로브에 붙어 있으면 집게로 제거하고 튜브에 다시 넣으십시오.
- 총 6분의 균질화를 위해 5.2-5.4단계를 추가로 5배 반복합니다.
- 균질화된 조직이 있는 튜브를 물 또는 비드 배스에 넣어 조직을 따뜻하게 유지합니다(38.5°C). 마지막 난소를 처리 한 후 즉시 제조업체의 사양에 따라 발전기 프로브를 분해, 청소 및 건조하십시오.
6. 여과 절차
- 흩어진 조직을 삼각 플라스크에 삽입된 무명천으로 덮인 깔때기에 붓습니다. 튜브에 조직 조각이 남지 않을 때까지 따뜻한(38.5°C) PBS + PenStrep을 사용하여 튜브의 내용물을 깔때기에 헹굽니다.
- 조직 조각 주위에 치즈 천을 비틀고 모든 과도한 액체와 조직이 치즈 천에서 제거 될 때까지 짜서 조직 조각이 천의 구멍을 통과하도록합니다.
- 깔때기 위의 치즈 천을 다시 열고 전사 피펫을 사용하여 PBS + PenStrep으로 치즈 천을 헹구고 천을 통해 잔류 조직 조각을 다시 짜냅니다.
- 지혈제를 사용하여 300mL 비이커 위에 200μm 세포 여과기를 고정합니다. 세포 여과기를 통해 삼각 플라스크에 여과액을 붓습니다. 조직 조각이 남지 않을 때까지 따뜻한 (38.5°C) PBS + PenStrep을 사용하여 플라스크의 내용물을 세포 여과기로 헹굽니다.
- 셀 스트레이너가 티슈로 막히면 셀 스트레이너를 비커에 대고 부드럽게 두드려 모든 액체가 비커로 여과되었는지 확인한 다음 셀 스트레이너를 거꾸로 뒤집고 큰 티슈 파편을 벤치 페이퍼에 두드립니다. 셀 스트레이너를 비커 위로 되돌리고 여과액을 계속 붓습니다. 삼각 플라스크의 모든 여과액이 여과될 때까지 필요에 따라 반복합니다.
- 지혈제를 사용하여 두 번째 200mL 비커에 40μm 세포 여과기를 고정합니다. 세포 여과기를 통해 처음 200mL 비커에 여액을 붓습니다. 조직 조각이 남지 않을 때까지 따뜻한 (38.5 ° C) PBS + PenStrep을 사용하여 비커의 내용물을 셀 스트레이너로 헹굽니다. 40μm 셀 스트레이너의 내용물을 버리지 마십시오.
- 18G 바늘을 20mL 주사기에 맞춥니다. 주사기에 FWM을 채 웁니다. 40μm 세포 여과기를 정사각형 페트리 접시 위에 거꾸로 뒤집고 주사기를 사용하여 세포 여과기의 내용물을 접시로 씻어냅니다. 주사기를 다시 채우고 조직 조각이 남지 않을 때까지 필요에 따라 세포 여과기를 헹굽니다.
참고: 일반적으로 25mL의 FWM은 40μm 세포 여과기의 내용물을 완전히 헹구기에 충분합니다.

그림 2: 난소 처리 및 프로토콜 워크플로를 위한 작업 공간 설정. (A) 절단하기 전에 난소를 절단하고 난소 균질액을 여과하기 위한 벤치 설정. (B) 티슈 초퍼 및 균질화기 설정, 균질화기 단계의 진동을 줄이기 위해 스티로폼 지지대. (C) 하나의 전체 난소의 처리를 위한 워크플로우를 보여주는 개략도. 난소는 과도한 결합 조직을 다듬은 다음 반으로 자르고 ~ 1mm 두께의 피질 조각이 남을 때까지 수질을 제거합니다. 피질은 2.5cm x 2.5cm 조각으로 절단되고 500μm의 절단 간격으로 설정된 조직 초퍼에서 절단됩니다. 이어서, 조각을 균질화하고, 균질액을 치즈클로스를 통해 여과한 다음, 300 μm 및 40 μm 세포 스트레이너를 통해 여과한다. 40μm 세포 여과기의 내용물을 정사각형 페트리 접시로 헹구고 실체 현미경을 사용하여 모낭을 검색합니다. BioRender.com 로 만들었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 모낭 검색 및 수집
- 사각 페트리 접시(단계 6.6)를 38.5°C로 설정된 예열된 스테이지가 있는 입체경으로 옮깁니다. 스테레오스코프 배율은 검색자의 선호도에 따라 1.25x에서 3.2x 사이로 설정해야 합니다.
- FWM 10μL를 60mm 페트리 접시에 떨어뜨리고 건조를 방지하기 위해 방울을 미네랄 오일로 덮습니다. 배지 방울이 있는 페트리 접시를 38.5°C로 설정된 온열 플레이트에 놓습니다.
알림: 4웰 플레이트를 사용하여 모낭을 수집할 수 있습니다. 500μL의 세척 매체를 하나 또는 두 개의 웰에 추가합니다. 38.5°C로 설정된 온난화 플레이트에 놓습니다. - 마이크로피펫 플런저와 팁을 얻는다.
참고: 유리 1-5 μL 마이크로피펫( 재료 표 참조)은 모낭이 유리 피펫에 부착될 가능성이 적고 용액 간에 이동할 때 손실될 가능성이 적기 때문에 권장됩니다. 또한 모낭을보다 쉽고 정확하게 미세 조작 할 수있을만큼 작은 도구입니다. - 사각 페트리 접시에서 모낭을 식별하고 마이크로피펫을 사용하여 배지(FWM) 방울로 옮깁니다. 많은 모낭이 조직 파편에 매립될 가능성이 있으며 아래에 설명된 두 가지 방법 중 하나를 사용하여 회수할 수 있습니다.
참고: 모낭은 완벽한 구체가 아닌 직사각형이며 일반적으로 난포의 중심을 향해 어두운 대조에서 단색의 흰색 원으로 나타나는 난모세포가 있습니다(그림 3A-C). 난포와 탈질된 난모세포를 혼동하지 않도록 주의하십시오. 난 모세포는 완벽한 구체 인 경향이 있으며 두껍고 투명한 막 (zona pellucida)으로 둘러싸여 있습니다. 배율이 10배 이상인 도립 현미경을 사용하여 모낭을 면밀히 검사할 수 있습니다(그림 3D).- 마이크로 피펫 끝이나 미세한 (27G) 바늘을 사용하여 모낭을 파편에서 조심스럽게 분리하십시오.
- 또는 고무 전구가 달린 유리 파스퇴르 피펫을 사용하여 접시의 파편을 여러 번 집어 내고 분출하여 파편에서 모낭을 제거합니다.
- 30 분 이상 걸리지 않고 신속하게 작업하여 페트리 접시를 검색하여 난포 생존력을 보존하십시오.
- 밀도가 높을수록 모낭이 서로 달라붙을 가능성이 높아질 수 있으므로 10μL 방울당 최대 5개의 모낭만 배치하십시오.
8. 트리판 블루 배제 생존력 시험
알림: 모낭이 실제 접시의 플라스틱보다 뚜껑의 플라스틱에 덜 달라붙기 때문에 다음 모든 단계에서 페트리 접시 또는 4웰 접시의 뚜껑을 사용하십시오.
- 100 mg PVP를 50 mL의 PBS에 용해시켜 PBS + 0.2 % 폴리 비닐 피 롤리 돈 (PVP)을 제조한다.
알림: PVP는 모낭이 접시에 부착 될 가능성을 줄이기 위해 여기에 사용됩니다. - 마이크로피펫을 사용하여 배지 방울의 모든 모낭(평균 40개)을 50μL 방울의 PBS + 0.2% PVP로 옮깁니다.
- 모낭을 PBS + 0.2 % PVP의 신선한 50 μL 방울로 순차적으로 옮겨 2 배 세척하십시오.
- 모낭을 285 μL 방울의 PBS + 0.2 % PVP로 옮깁니다.
- 285μL PBS + 0.2% PVP(최종 농도 0.05% 트리판 블루)에 트리판 블루 15μL를 추가하고 100μL로 설정된 200μL 피펫 팁을 사용하여 드롭을 조심스럽게 혼합합니다.
참고: 트립판 생존력 테스트에 4웰 플레이트를 사용하는 경우 475μL의 PBS + 0.2% PVP 및 25μL의 트리판 블루를 한 웰에 추가합니다. - 모낭을 트립판 블루 방울에서 1분 동안 배양한 다음, 모낭을 PBS + 0.2% PVP의 50μL 방울(또는 500μL 웰)로 옮깁니다.
- 8.3 단계에 따라 모낭을 PBS + 0.2 % PVP의 신선한 50 μL 방울 (또는 웰 당 500 μL)로 3 회 세척하십시오.
- PBS + 0.2 % PVP로 세 번 씻은 후에도 여전히 파란색으로 나타나는 모낭은 생존 할 수 없으므로 폐기하십시오. 세 번의 세척 후에도 청색 착색을 유지하지 않는 모낭은 실행 가능하며 면역 형광, 배양 또는 기타 절차에 사용할 수 있습니다 (그림 3E). 모낭을 액체 질소에서 스냅 동결하고 필요한 경우 추가 사용이 될 때까지 -80 ° C에서 보관하십시오.
- 단계 9 및 10에 설명된 바와 같이 모낭의 RT-qPCR 분석 및 면역형광 염색을 수행한다.

그림 3: 분리된 모낭 및 트리판 블루 배제 테스트. (A-C) 분리된 모낭은 실체현미경을 통해 여러 배율로 이미지화되었습니다. (A) 초기 검색 접시 내의 파편 중에서 분리 된 모낭. 개별 모낭은 빨간색 원으로 표시됩니다. 스케일 바 = 2,000 μm. (B) 미네랄 오일로 덮인 여포 세척 배지 방울 내에서 분리 된 모낭 및 파편. 스케일 바 = 1,000 μm. (C) 더 높은 배율에서 파편이없는 분리 된 모낭. 스케일 바 = 1,000 μm. (D) 도립 명시야 현미경을 사용하여 이미징 된 분리 된 모낭. 스케일 바 = 100 μm. (E) 도립 명시야 현미경과 20x 대물렌즈를 사용하여 이미징한 생존 가능한(염색되지 않은) 및 실행 불가능한(파란색 얼룩) 모낭의 대표 이미지. 스케일 바 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
9. RT-qPCR 분석
- RNA 분리 시약을 사용하여 생존 가능한 모낭에서 RNA를 분리합니다 (8.8 단계 에서). RNA를 정제하고 제조업체의 지침에 따라 시중에서 판매되는 클린업 키트( 재료 표 참조)를 사용하여 DNase로 처리합니다.
- RNase가 없는 물 14μL로 RNA를 용리하고 분광 광도계를 사용하여 정량합니다. RNA는 cDNA 합성까지 -80°C에서 저장될 수 있다.
- 제조업체의 지침에 따라 시판되는 cDNA 합성 키트( 재료 표 참조)를 사용하여 1차 및 초기 2차 모낭에서 추출한 동일한 양의 RNA에서 cDNA 합성을 수행합니다. 반응 혼합물을 25°C에서 5분 동안 인큐베이션한 후 42°C에서 60분 동안 인큐베이션한 다음, 70°C에서 5분 동안 가열하여 반응을 종료한다.
- 시판되는 반응 혼합물을 사용하여 합성된 cDNA(반응당 5ng)와 프라이머(표 1)로 RT-qPCR을 수행합니다( 재료 표 참조). 열 사이클링 조건 사용: 중합효소 활성화를 위해 95°C에서 30초, 증폭 40회, 각 사이클에는 변성을 위해 95°C에서 15초, 어닐링/확장을 위해 60°C에서 30초가 포함됩니다. 주기 역치(Ct) 값을 정량화하여 RT-qPCR을 분석하고/하거나 아가로스 겔 전기영동을 사용하여 PCR 산물을 봅니다.
참고: 과립막 세포 마커 FSHR 및 생식 세포 마커 DAZL 의 전사체 발현을 본 연구에서 평가하였다. 참조 유전자는 H2A 및 ACTB였다. - 온도가 65°C에서 95°C에 도달할 때까지 5초마다 0.5°C 단위로 온도를 증가시켜 용융 곡선 해석을 실행합니다.
10. 면역형광 분석
- 실온(RT)에서 4%(v/v) 파라포름알데히드(PFA) 100μL 방울에 생존 가능한 모낭(8.8단계에서)을 15분 동안 고정한 다음 PBS + 0.1% BSA + 0.1% 트윈 20 100μL 방울로 3회 세척합니다.
- 1x PBS + 5%(v/v) 일반 당나귀 혈청(NDS)으로 구성된 차단 완충액에서 RT에서 1시간 동안 모낭을 차단합니다. 차단 후, 블로킹 완충액에 희석된 4μg/mL 토끼 항인간 CX37 항체 또는 4μg/mL 토끼 이소형 IgG(음성 대조군)의 100μL 방울에 모낭을 4°C에서 밤새 배양합니다.
- PBS + 0.1% BSA + 0.1% 트윈 20 100μL 방울로 모낭을 3배 세척한 다음, 블로킹 버퍼에 희석한 2μg/mL 당나귀 항토끼 AlexaFluor 488 2차 항체 100μL 방울에 담아 어둠 속에서 RT에서 1시간 동안 배양합니다.
- DNA를 표지하기 위해 블로킹 완충액에 희석 된 1 μg / mL Hoechst 33342의 100 μL 방울에 어둠 속에서 RT에서 5 분 동안 모낭을 배양합니다.
- 모낭을 유리 현미경 슬라이드의 장착 매체( 재료 표 참조)의 5μL 방울에 옮기고 커버 슬립으로 덮습니다. 슬라이드를 RT에서 밤새 경화시킨 다음 매니큐어로 밀봉하십시오. 이미징이 나타날 때까지 4 ° C에서 보관하십시오.
- 덮개가 미끄러진 후 48시간 이내에 모든 슬라이드를 이미지화합니다. DAPI (여기 380nm 및 방출 450nm) 및 FITC (여기 470nm 및 방출 525nm) 필터에서 도립 에피 형광 현미경 ( 재료 표 참조)을 사용하여 이미징을 수행합니다.
- 두 채널의 노출 시간을 고정합니다. 토끼 이소형형 음성 대조군에 기초하여 FITC (CX37) 노출 시간을 조정한다. 20x 대물렌즈와 50ms 노출 시간으로 설정된 DAPI 채널을 사용하여 토끼 이소형형 표지 난포를 식별합니다.
- FITC 채널 아래에서 이러한 모낭을 이미지화하고 모든 배경 녹색 신호가 사라질 때까지 노출 시간을 줄입니다. 이 노출 시간에 유의하십시오.
- 이소타입 FITC 채널에 설정된 노출 시간 및 DAPI 채널에 대해 50ms 노출 시간을 사용하여 모든 CX37 항체 표지된 난포를 이미지화합니다.
- 임계 후 평균 회색 영역에 의해 측정된 신호 세기를 컴퓨터 이미지 처리 프로그램(29)을 사용하여 처리한다( 재료 표 참조).
- 전체 여포의 윤곽이 표시되도록 각 여포에 대한 DAPI 이미지의 tiff 파일을 조정합니다. 프로그램의 입자 분석 기능을 사용하여 전체 모낭을 관심 영역(ROI)으로 선택합니다.
- 해당 여포에 대한 FITC 이미지의 tiff 파일을 열고 DAPI 이미지에서 생성된 ROI를 FITC 이미지 위에 오버레이합니다. 프로그램의 측정 함수를 사용하여 신호 강도를 나타내는 FITC 영상의 평균 회색 영역을 정량화합니다.
Access restricted. Please log in or start a trial to view this content.
결과
개요 및 중요 단계
이 프로토콜을 사용하면 작은 소 preantral 난포를 실험적으로 관련된 숫자로 단일 난소에서 안정적으로 분리 할 수 있습니다. 총 30 번의 반복에서 복제 당 평균 41 개의 난포가 얻어졌으며 범위는 11-135 개입니다 (그림 4A). 14번의 반복에서, 모낭은 실체현미경 하에 1 μm 현미경 보정 슬라이드를 사용하여 난포 직경을 측정함으로써 앞서
Access restricted. Please log in or start a trial to view this content.
토론
본 프로토콜은 소 난소로부터 초기 단계의 preantral 난포, 특히 1 차 및 초기 2 차 단계에서 회수하는 재현 가능한 방법을 자세히 설명합니다. 이 프로토콜은 이전 보고서 20,25,30,34,35,36을 기반으로 하며 개별 난소에서 의미 있는 수의 난포를 분리하는 최적화를 제공합니다.<...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 프로젝트는 USDA 다중 상태 프로젝트 W4112와 UC Davis Jastro Shields 상을 SM에 의해 부분적으로 자금을 지원받았습니다.
저자는 모든 실험에 사용 된 소 난소를 제공 한 Central Valley Meat, Inc.에 감사를 표하고 싶습니다. 저자는 또한 난소 처리 및 난포 분리에 대한 도움을 준 Olivia Silvera에게 감사드립니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 5-3/4" Soda Lime Disposable Glass Pasteur Pipette | Duran Wheaton Kimble | 63A54 | Pasteur pipette that can be used to dislodge follicles from debris while searching within the petri dish |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | Diluted to 4%; fixation of follicles for immunostaining |
| 20 mL Luer-lock Syringe | Fisher Scientific | Z116882-100EA | Syringe used with the 18 G needle to dislodge follicles from the 40 μm cell strainer |
| #21 Sterile Scalpel Blade | Fisher Scientific | 50-365-023 | Used to cut the ovaries and remove the medula |
| 40 μm Cell Strainer | Fisher Scientific | 22-363-547 | Used to filter the filtrate from the 300 μm cell strainer |
| 104 mm Plastic Funnel | Fisher Scientific | 10-348C | Size can vary, but ensure the cheese cloth is cut appropriately and that the ovarian homogenate will not spill over |
| 300 μm Cell Strainer | pluriSelect | 43-50300-03 | Used to filter the filtrate from the cheese cloth |
| 500 mL Erlenmeyer Flask | Fisher Scientific | FB500500 | Funnel and flask used to catch filtrate from the cheese cloth |
| Air-Tite Sterile Needles 18 G | Thermo Fisher Scientific | 14-817-151 | 18 G offers enough pressure to dislodge follicles from the 40 μm cell strainer |
| Air-Tite Sterile Needles 27 G 13 mm | Fisher Scientific | 14-817-171 | Needles that can be used to manipulate any debris in which follicles are stuck |
| BD Hoechst 33342 Solution | Fisher Scientific | BDB561908 | Fluorescent DNA stain |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | Component of follicle wash media |
| Cheese Cloth | Electron Microscopy Sciences | 71748-00 | First filtering step of the ovarian homogenate meant to remove large tissue debris |
| Classic Double Edge Safety Razor Blades | Wilkinson Sword | N/A | Razor blades that fit the best in the McIlwain Tissue Chopper and do not dull quickly |
| Donkey-Anti-Rabbit Secondary Antibody, Alexa Fluor 488 | Fisher Scientific | A-21206 | Secondary antibody for immunostaining |
| Eisco Latex Pipette Bulbs | Fisher Scientific | S29388 | Rubber bulb to use with Pasteur pipettes |
| HEPES Buffer | Sigma-Aldrich | H3375 | Component of follicle wash media |
| Homogenizer | VWR | 10032-336 | Homogenize the ovarian tissue to release follicles |
| ImageJ/Fiji | NIH | v2.3.1 | Software used for analysis of fluorescence-immunolocalization |
| McIlwain Tissue Chopper | Ted Pella | 10184 | Used to cut ovarian tissue small enough for homogenization |
| Microscope - Stereoscope | Olympus | SZX2-ILLT | Dissection microscope used for searching and harvesting follicles from the filtrate |
| Microscope - Inverted | Nikon | Diaphot 300 | Inverted microscope used for high magnification brightfield visualization of isolated follicles |
| Microscope - Inverted | ECHO | Revolve R4 | Inverted microscope used for high magnification brightfield and epifluorescence visualization of isolated follicles |
| Mineral Oil | Sigma-Aldrich | M8410-1L | Oil to cover the drops of follicle wash medium to prevent evaporation during searching |
| Non-essential Amino Acids (NEAA) | Gibco | 11140-050 | Component of follicle wash medium |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-001 | Reagent for immunostaining blocking buffer |
| Nunc 4-well Dishes for IVF | Thermo Fisher Scientific | 144444 | 4-well dishes for follicle isolation and washing |
| Penicillin-Streptomycin Solution 100x | Gibco | 15-140-122 | Component of follicle wash medium |
| Petri Dish 60 mm OD x 13.7 mm | Ted Pella | 10184-04 | Petri dish that fits the best in the McIlwain Tissue Chopper |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP665-1 | Washing buffer for ovaries and follicles |
| Plastic Cutting Board | Fisher Scientific | 09-002-24A | Cutting board of sufficient size to safely cut ovaries |
| Polyvinylpyrrolidone (PVP) | Fisher Scientific | BP431-100 | Addition of PVP (0.1% w/v) to PBS prevents follicles from sticking to the plate or each other |
| ProLong Gold Antifade Mountant | Thermo Fisher Scientific | P36930 | Mounting medium for fluorescently labeled cells or tissue |
| Qiagen RNeasy Micro Kit | Qiagen | 74004 | RNA column clean-up kit |
| R | The R Foundation | v4.1.2 | Statistical analysis software |
| Rabbit-Anti-Human Cx37/GJA4 Polyclonal Antibody | Abcam | ab181701 | Cx37 primary antibody for immunostaining |
| RevertAid RT Reverse Transcription Kit | Thermo Fisher Scientific | K1691 | cDNA synthesis kit |
| Rstudio | RStudio, PBC | v2021.09.2 | Statistical analysis software |
| Sodium Hydroxide Solution (1N/Certified) | Fisher Scientific | SS266-1 | Used to increase media pH to 7.6-7.8 |
| Sodium Pyruvate (NaPyr) | Gibco | 11360-070 | Component of follicle wash medium |
| Square Petri Dish 100 mm x 15 mm | Thermo Fisher Scientific | 60872-310 | Gridded petri dishes allow for more efficient identification of follicles |
| SsoAdvanced Universal SYBR Green Supermix | BioRad | 1725271 | Mastermix for PCR reaction |
| Steritop Threaded Bottle Top Filter | Sigma-Aldrich | S2GPT02RE | Used to sterilize follicle wash medium |
| SYBR-safe DNA gel stain | Thermo Fisher Scientific | S33102 | Staining to visual PCR products on agarose gel |
| TCM199 with Hank’s Salts | Gibco | 12-350-039 | Component of follicle wash medium |
| Triton X-100 | Fisher Scientific | BP151-100 | Detergent for immunostaining permeabilization buffer |
| Trizol reagent | Thermo Fisher Scientific | 15596026 | RNA isolation reagent |
| Trypan Blue Solution, 0.4% | Gibco | 15-250-061 | Used for testing viability of isolated follicles |
| Tween 20 | Detergent for immunostaining wash buffer | ||
| Warmer Plate Universal | WTA | 20931 | Warm plate to keep follicles at 38.5 °C while searching under the microscope |
| Wiretrol II Calibrated Micropipets | Drummond | 50002-005 | Glass micropipettes to manipulate follicles |
참고문헌
- Fortune, J. E., Yang, M. Y., Allen, J. J., Herrick, S. L. Triennial reproduction symposium: The ovarian follicular reserve in cattle: What regulates its formation and size. Journal of Animal Science. 91 (7), 3041-3050 (2013).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology. 195 (4), 327-336 (1997).
- Jaffe, L. A., Egbert, J. R. Regulation of mammalian oocyte meiosis by intercellular communication within the ovarian follicle. Annual Review of Physiology. 79, 237-260 (2017).
- Driancourt, M. A., Reynaud, K., Cortvrindt, R., Smitz, J. Roles of KIT and KIT LIGAND in ovarian function. Reviews of Reproduction. 5 (3), 143-152 (2000).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproductive Fertility. 81 (2), 301-307 (1987).
- Aerts, J. M. J., Bols, P. E. J. Ovarian follicular dynamics: a review with emphasis on the bovine species. Part I: Folliculogenesis and preantral follicle development. Reproduction in Domestic Animals. 45 (1), 171-179 (2010).
- Sugiura, K., Pendola, F. L., Eppig, J. J. Oocyte control of metabolic cooperativity between oocytes and companion granulosa cells: energy metabolism. Developmental Biology. 279 (1), 20-30 (2005).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biology of Reproduction. 73 (2), 351-357 (2005).
- Sugimura, S., et al. Amphiregulin co-operates with bone morphogenetic protein 15 to increase bovine oocyte developmental competence: effects on gap junction-mediated metabolite supply. Molecular Human Reproduction. 20 (6), 499-513 (2014).
- Edson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Matzuk, M. M., Burns, K. H. Genetics of mammalian reproduction: modeling the end of the germline. Annual Review of Physiology. 74, 503-528 (2012).
- McGee, E. A., Raj, R. S. Regulators of ovarian preantral follicle development. Seminars in Reproductive Medicine. 33 (3), 179-184 (2015).
- Chen, Y., et al. The factors and pathways regulating the activation of mammalian primordial follicles in vivo. Frontiers in Cell and Developmental Biology. 8, 575706(2020).
- Figueiredo, J. R., et al. Development of a combined new mechanical and enzymatic method for the isolation of intact preantral follicles from fetal, calf and adult bovine ovaries. Theriogenology. 40 (4), 789-799 (1993).
- Sirard, M. A. The ovarian follicle of cows as a model for human. Animal Models and Human Reproduction. , 127-144 (2017).
- Parkes, W. S., et al. Hyaluronan and collagen are prominent extracellular matrix components in bovine and porcine ovaries. Genes. 12 (8), 1186(2021).
- Araújo, V. R., Gastal, M. O., Figueiredo, J. R., Gastal, E. L. In vitro culture of bovine preantral follicles: a review. Reproductive Biology and Endocrinology. 12 (1), 1-14 (2014).
- Eppig, J. J., Schroeder, A. C. Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation, and fertilization in vitro. Biology of Reproduction. 41 (2), 268-276 (1989).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Nuttinck, F., Mermillod, P., Massip, A., Dessy, F. Characterization of in vitro growth of bovine preantral ovarian follicles: A preliminary study. Theriogenology. 39 (4), 811-821 (1993).
- Demeestere, I., et al. Effect of preantral follicle isolation technique on in-vitro follicular growth, oocyte maturation and embryo development in mice. Human Reproduction. 17 (8), 2152-2159 (2002).
- Fattahi, A., et al. Optimization of porcine ovarian follicle isolation methods for better developmental potential. Tissue Engineering Part A. 26 (13-14), 712-719 (2020).
- Nagashima, J. B., Hill, A. M., Songsasen, N. In vitro development of mechanically and enzymatically isolated cat ovarian follicles. Reproduction and Fertility. 2 (1), 35-46 (2021).
- Lucci, C. M., Rumpf, R., Figueiredo, J. R., Báo, S. N. Zebu (Bos indicus) ovarian preantral follicles: Morphological characterization and development of an efficient isolation method. Theriogenology. 57 (5), 1467-1483 (2002).
- Langbeen, A., et al. Characterization of freshly retrieved preantral follicles using a low-invasive, mechanical isolation method extended to different ruminant species. Zygote. 23 (5), 683-694 (2014).
- Candelaria, J. I., Denicol, A. C. Characterization of isolated bovine preantral follicles based on morphology, diameter and cell number. Zygote. 28 (2), 154-159 (2020).
- vanden Hurk, R., et al. Ultrastructure and viability of isolated bovine preantral follicles. Human Reproduction Update. 4 (6), 833-841 (1998).
- Paes, V. M., et al. Effect of heat stress on the survival and development of in vitro cultured bovine preantral follicles and on in vitro maturation of cumulus-oocyte complex. Theriogenology. 86 (4), 994-1003 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Aguiar, L. H., Hyde, K. A., Pedroza, G. H., Denicol, A. C. Heat stress impairs in vitro development of preantral follicles of cattle. Animal Reproduction Science. 213, 106277(2020).
- Kristensen, S. G., Ebbesen, P., Andersen, C. Y. Transcriptional profiling of five isolated size-matched stages of human preantral follicles. Molecular and Cellular Endocrinology. 401, 189-201 (2015).
- Candelaria, J. I., Rabaglino, M. B., Denicol, A. C. Ovarian preantral follicles are responsive to FSH as early as the primary stage of development. Journal of Endocrinology. 247 (2), 153-168 (2020).
- Nuttinck, F., et al. Comparative immunohistochemical distribution of Connexin 37 and Connexin 43 throughout folliculogenesis in the bovine ovary. Molecular Reproduction and Development. 57 (1), 60-66 (2000).
- Itoh, T., Hoshi, H. Efficient isolation and long-term viability of bovine small preantral follicles in vitro. In Vitro Cellular and Developmental Biology-Animal. 36 (4), 235-240 (2000).
- Saha, S., Shimizu, M., Geshi, M., Izaike, Y. In vitro culture of bovine preantral follicles. Animal Reproduction Science. 63 (1-2), 27-39 (2000).
- Bus, A., et al. Preservation of connexin 43 and transzonal projections in isolated bovine pre-antral follicles before and following vitrification. Journal of Assisted Reproduction and Genetics. 38 (2), 479-492 (2021).
- Gougeon, A., Ecochard, R., Thalabard, J. C. Age-related changes of the population of human ovarian follicles: increase in the disappearance rate of non-growing and early-growing follicles in aging women. Biology of Reproduction. 50 (3), 653-663 (1994).
- Xu, D., et al. Raf-ERK1/2 signaling pathways mediate steroid hormone synthesis in bovine ovarian granulosa cells. Reproduction in Domestic Animals. 54 (5), 741-749 (2019).
- Santos, R. R., et al. Cryopreservation of ovarian tissue: an emerging technology for female germline preservation of endangered species and breeds. Animal Reproduction Science. 122 (3-4), 151-163 (2010).
- Leonel, E. C. R., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Bus, A., Langbeen, A., Martin, B., Leroy, J. I. M. R., Bols, P. E. J. Is the pre-antral ovarian follicle the 'holy grail' for female fertility preservation. Animal Reproduction Science. 207, 119-130 (2019).
- Chen, J., et al. Optimization of follicle isolation for bioengineering of human artificial ovary. Biopreservation and Biobanking. , (2021).
- Chiti, M. C., et al. A modified and tailored human follicle isolation procedure improves follicle recovery and survival. Journal of Ovarian Research. 10 (1), 1-9 (2017).
- Kristensen, S. G., Rasmussen, A., Byskov, A. G., Andersen, C. Y. Isolation of pre-antral follicles from human ovarian medulla tissue. Human Reproduction. 26 (1), 157-166 (2011).
- Oktay, K., et al. Isolation and characterization of primordial follicles from fresh and cryopreserved human ovarian tissue. Fertility and Sterility. 67 (3), 481-486 (1997).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유