É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento de pequenos folículos pré-antrais do ovário bovino usando uma combinação de fragmentação, homogeneização e filtração seriada
Neste Artigo
Resumo
O avanço do estudo da foliculogênese pré-antral requer métodos eficientes de isolamento do folículo a partir de ovários únicos. Apresenta-se aqui um protocolo mecânico simplificado para isolamento folículo de ovários bovinos usando um cortador de tecido e homogeneizador. Este método permite a coleta de um grande número de folículos pré-antrais viáveis de um único ovário.
Resumo
Compreender todo o processo de foliculogênese de mamíferos é crucial para melhorar as tecnologias de reprodução assistida em gado, humanos e espécies ameaçadas de extinção. A pesquisa tem sido limitada principalmente a folículos pré-antrais grandes e antrais devido à dificuldade no isolamento de folículos pré-antrais menores, especialmente em mamíferos de grande porte, como bovinos. Este trabalho apresenta uma abordagem eficiente para recuperar um grande número de pequenos folículos pré-antrais de um único ovário bovino. O córtex de ovários bovinos individuais foi cortado em cubos de 500 μm usando um helicóptero de tecido e homogeneizado por 6 min a 9.000-11.000 rpm usando uma sonda de 10 mm. Grandes detritos foram separados do homogeneizado com pano de queijo, seguido de filtração seriada através de filtros celulares de 300 μm e 40 μm. O conteúdo retido no filtro de 40 μm foi enxaguado em um prato de busca, onde os folículos foram identificados e coletados em uma gota de meio. A viabilidade dos folículos coletados foi testada por meio da coloração azul de tripano. Este método permite o isolamento de um grande número de pequenos folículos pré-antrais viáveis de um único ovário bovino em aproximadamente 90 min. É importante ressaltar que este método é totalmente mecânico e evita o uso de enzimas para dissociar o tecido, o que pode danificar os folículos. Os folículos obtidos com este protocolo podem ser utilizados para aplicações a jusante, como isolamento de RNA para RT-qPCR, imunolocalização de proteínas específicas e cultura in vitro .
Introdução
Os folículos ovarianos são as unidades funcionais do ovário, responsáveis pela produção do gameta (ovócito), bem como hormônios críticos para a função reprodutiva e a saúde geral. Os folículos primordiais se formam no ovário durante o desenvolvimento fetal ou no período neonatal, dependendo da espécie1, e constituem a reserva ovariana de uma fêmea. O crescimento folicular começa com a ativação de folículos primordiais que deixam a piscina de repouso e entram na fase de crescimento. A foliculogênese pré-antral, abrangendo todos os estágios do folículo antes do desenvolvimento do antro, é um processo altamente dinâmico que requer alterações morfológicas e metabólicas síncronas no ovócito e nas células granulosas circundantes, impulsionadas pela comunicação estreita entre esses dois tipos celulares 2,3. Os folículos pré-antrais constituem a maioria das unidades foliculares encontradas no ovário em um dado momento4. Estima-se que o desenvolvimento através dos estágios pré-antrais da foliculogênese seja várias semanas maior do que o desenvolvimento antral 5,6, e esse tempo é necessário para que o ovócito e as células somáticas adquiram maturidade suficiente para entrar no estágio final de desenvolvimento (ou seja, o estágio antral) e se preparar para a ovulação, fertilização e desenvolvimento embrionário 7,8,9.
Grande parte do conhecimento atual sobre a foliculogênese pré-antral ovariana vem de modelos de camundongos 10,11,12,13, devido em parte à facilidade em recuperar um grande número desses folículos de um ovário menor e menos fibroso. Embora os relatos de isolamento de um grande número de folículos pré-antrais de ovários bovinos remontem a aproximadamente 30 anos14, uma compreensão mais completa sobre os processos que regulam o desenvolvimento desses folículos em estágio inicial permaneceu não realizada, em grande parte devido à falta de métodos otimizados, eficientes e repetíveis para recuperar um número suficiente de folículos pré-antrais viáveis, particularmente nos estágios iniciais de desenvolvimento. Com o crescente interesse em preservar a reserva ovariana para uso futuro na reprodução assistida em humanos, as vacas tornam-se um modelo atraente devido à sua estrutura ovariana mais semelhante15. No entanto, o ovário bovino é marcadamente mais rico em colágeno em comparação com o ovário de camundongo16, tornando o isolamento mecânico usando métodos descritos para o camundongo muito ineficiente. Os esforços para expandir as técnicas de preservação da fertilidade incluem o crescimento in vitro completo dos folículos pré-antrais até o estágio antral, seguido de maturação in vitro (IVM) dos ovócitos fechados, fertilização in vitro (FIV) e produção e transferência de embriões17. Até agora, todo esse processo só foi alcançado em camundongos18. Em bovinos, o progresso em direção ao crescimento do folículo in vitro é limitado a poucos relatos com estágios folículos variáveis no início da cultura, bem como tempo variável de cultura entre os protocolos17,19.
Os métodos descritos na literatura para a colheita de folículos pré-antrais do ovário bovino têm utilizado principalmente técnicas mecânicas e enzimáticas, isoladas ou em combinação 2,14,17,20. O primeiro relato de um protocolo de isolamento do folículo pré-antral bovino utilizou homogeneizador tecidual e filtração seriada para processar ovários inteiros20. Este estudo foi seguido por relatos que combinaram procedimentos mecânicos e enzimáticos que utilizaram colagenase14. Um tema recorrente na utilização da colagenase para digerir o tecido ovariano é o risco potencial de dano da membrana basal folicular, o que pode comprometer a viabilidade do folículo 14,21,22,23. Portanto, diferentes combinações de métodos mecânicos têm sido empregadas, como o uso de um helicóptero de tecido e pipetagem repetida ou um helicóptero de tecido combinado com homogeneização20,24,25,26. Outra técnica mecânica que foi descrita utiliza agulhas para dissecar folículos pré-antrais diretamente do tecido ovariano, o que é especialmente útil para isolar folículos secundários maiores (>200 μm). No entanto, esse processo é demorado, ineficiente para isolar folículos pré-antrais menores e é dependente de habilidades quando tentado em ovários bovinos 19,27,28.
Aproveitando as diferentes técnicas descritas na literatura, este protocolo teve como objetivo otimizar o isolamento de folículos pré-antrais de ovários bovinos únicos de forma simples, consistente e eficiente, evitando a incubação em soluções enzimáticas. Melhorar os métodos para isolar folículos pré-antrais proporcionará uma oportunidade para melhorar a compreensão deste estágio da foliculogênese e permitir o desenvolvimento de sistemas de cultura eficazes para desenvolver folículos pré-antrais para o estágio antral. Os procedimentos detalhados aqui descritos para o isolamento de folículos pré-antrais de um mamífero de grande porte, como a espécie bovina, serão vitais para os pesquisadores que pretendem estudar a foliculogênese precoce em uma espécie não murina que seja traduzível para os seres humanos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Os ovários bovinos (Bos taurus) foram obtidos de um matadouro local e transportados para o laboratório no prazo de 6 h após a recolha. Devido ao grande número de animais processados na instalação, a idade, a raça e o estágio do ciclo do cio dos animais são desconhecidos. Como nenhum animal vivo foi usado nesses experimentos, um protocolo aprovado de cuidado e uso de animais não foi necessário.
1. Preparação de equipamentos e reagentes
- Cubra uma seção de 2 pés de largura de uma bancada de laboratório com papel de bancada.
- Obter um cabo de bisturi, lâmina de bisturi estéril, hemostato, par de pinças de dissecção, seringa luer-lock de 20 mL, agulha de 18 G, dois copos de 200 mL, frasco de Erlenmeyer de 500 mL, funil de plástico de 104 mm de diâmetro, tábua de corte de plástico, uma camada de22 cm 2 de gaze (a gaze pode ser esterilizada por autoclave antes do uso) por ovário a ser processado, um filtro celular de 300 μm e um filtro celular de 40 μm (ver Tabela de Materiais).
- Transfira todo o equipamento para o papel de bancada.
- Use o hemostato para encaixar a lâmina do bisturi na alça do bisturi. Alinhe a base angular da lâmina ao indicador angular na alça e, em seguida, deslize a lâmina para o sulco da alça.
- Colocar o funil no balão de Erlenmeyer e cobrir a abertura do funil com o pano de queijo.
- Colocar um tubo cónico de 50 ml por ovário para ser processado num banho de água ou de contas regulado para 38,5 °C.
- Colocar uma placa de Petri quadrada de 100 mm x 15 mm por ovário a ser processada num aquecedor deslizante regulado para 38,5 °C.
- Adicione 10 mL de Penicilina-Estreptomicina (PenStrep; 10.000 U/mL de penicilina e 10.000 μg/mL de estreptomicina) a 1 L de 1x solução salina tamponada com fosfato (PBS). Aqueça o PBS + PenStrep num banho de água ou grânulos regulado para 38,5 °C pelo menos 2 h antes do processamento do ovário.
NOTA: A solução PBS + PenStrep é imprescindível para lavar os ovários quando folículos isolados serão cultivados, e ainda é recomendada para quaisquer experimentos a jusante para mitigar a contaminação microbiana. - Para coletar filtrado de ovário processado, use Follicle Wash Medium (FWM) consistindo de TCM199 com Sais de Hank (ver Tabela de Materiais) contendo 3 mg/mL de albumina sérica bovina (BSA), tampão HEPES 25 mM, 100 UI penicilina/100 μg/mL estreptomicina, 1 mM de piruvato de sódio (NaPyr) e 100 nM de aminoácidos não essenciais (NEAA).
- Transfira TCM199 estéril, um frasco de 250 mL e um cilindro graduado de 100 mL para um gabinete de biossegurança (BSC). Transfira 194 mL de TCM199 para o frasco.
- Retire o copo do TCM199 do BSC e leve para uma placa de agitação. Adicionar 600 mg de BSA, 1,19 g de tampão HEPES e uma barra de agitação autoclavada ao frasco e mexer até dissolver.
- Uma vez que o tampão BSA e HEPES tenham se dissolvido completamente, adicione 1 N hidróxido de sódio (NaOH) ao meio até atingir um pH de 7,6-7,8, medido por um medidor de pH.
- Limpe o frasco de meio, um dispositivo de filtragem a vácuo, quatro tubos cônicos de 50 mL e os frascos de PenStrep, NaPyr e NEAA com etanol a 70% antes de transferir para o BSC.
- Adicione 2 mL cada de PenStrep (10.000 U/mL de penicilina e 10.000 μg/mL de estreptomicina), 100 mM de NaPyr e 100x NEAA ao frasco de TCM199 + 3 mg/mL BSA + 25 mM HEPES. Filtro estéril do meio final e alíquota para os tubos cônicos de 50 mL. Conservar o meio a 4 °C durante um período máximo de 2 semanas.
- Aqueça um tubo cônico de 50 mL de meio por dois ovários em um banho de contas ajustado a 38,5 °C pelo menos 1 h antes do processamento do ovário.
2. Configuração do helicóptero de tecido
- Certifique-se de que o cortador de tecido (consulte Tabela de materiais) está ligado e ligado.
- Ajuste a espessura da fatia para 500 μm, o botão de controle de força da lâmina para 20° e o botão de controle de velocidade para 90° de acordo com as especificações do fabricante.
- Insira uma placa de Petri de plástico de 60 mm no suporte da placa e insira o suporte da placa no seu palco.
- Levante o braço de corte o mais alto que ele for, girando o botão de operação manual no sentido horário.
- Usando pinças, coloque uma lâmina de barbear de dois gumes (consulte Tabela de materiais) no parafuso inserido no braço de corte. Coloque o fecho da lâmina sobre a lâmina e prenda com a arruela e a porca. Deixe a porca um quarto solta.
- Gire o botão de operação manual até que o braço cortante encaixe a lâmina na placa de Petri. Aperte a porca o resto do caminho com o nutdriver.
- Levante o braço de corte o mais alto que quiser usando o botão de operação manual. Mova o botão de liberação da mesa todo o caminho para a esquerda até que ele entalha no lugar.
3. Preparação do ovário
- Transfira ovários em laboratório para aquecer (38,5 °C) PBS estéril + PenStrep.
NOTA: Recomenda-se processar os ovários para isolamento do folículo assim que for viável após a remoção do animal. Neste protocolo, os ovários foram processados dentro de 6 h após a colheita. Os ovários foram transportados do matadouro para o laboratório em garrafas térmicas contendo solução salina estéril a 0,9% a aproximadamente 38,5 °C. - Se possível, selecione ovários pequenos (≤ 4 cm x 3 cm x 3 cm) contendo folículos antrais pequenos (3-5 mm), sem folículos antrais grandes (≥8 mm) e sem corpo lúteo proeminente (Figura 1). Esses critérios são recomendados para garantir que uma quantidade mínima de detritos não folículos, como células estromais e matriz extracelular, seja incluída na placa quadrada resultante contendo folículos isolados.
NOTA: Os folículos antrais podem ser identificados como estruturas vesiculares esféricas e cheias de líquido na superfície do ovário. Corpora lutea pode ser identificado como estruturas rígidas vermelhas, laranjas ou amarelas que se projetam da superfície do ovário. - Use uma tesoura para remover qualquer excesso de tecido conjuntivo e gordura dos ovários.
- Lave os ovários por 30 s em etanol a 70% em um copo.
- Lave os ovários 3x por 2 min cada um em copos de PBS quente (38,5 °C) + PenStrep, usando PBS + PenStrep fresco para cada lavagem.
- Mantenha os ovários em temperatura (38,5 °C) PBS + PenStrep até estarem prontos para processamento.
NOTA: A distância entre o laboratório e a fonte do ovário pode ser variável. Portanto, é importante completar o protocolo em tempo hábil para garantir a manutenção da viabilidade folicular.
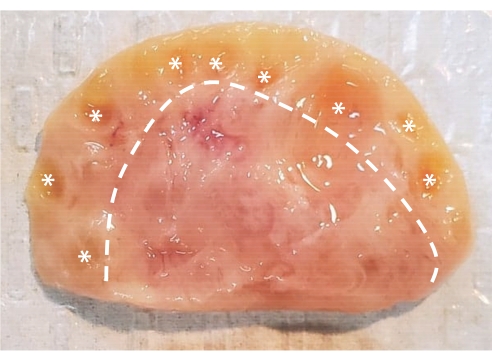
Figura 1: Anatomia do ovário bovino. O ovário bovino é constituído por duas regiões principais delimitadas por uma camada epitelial. O córtex, composto pelo tecido à esquerda da linha tracejada, contém folículos ovarianos desde o estágio primordial até o estágio antral. Os folículos pré-antrais são muito pequenos para serem vistos a olho nu; os folículos antrais são marcados com asteriscos. A medula, composta pelo tecido à direita da linha tracejada, contém vasos sanguíneos, vasos linfáticos e nervos. Por favor, clique aqui para ver uma versão maior desta figura.
4. Procedimento de corte
NOTA: Processe apenas um ovário de cada vez. Processe os ovários rapidamente para evitar diminuições de temperatura, o que pode afetar a viabilidade do folículo.
- Transferir um ovário para a tábua de corte no papel de bancada (Figura 2A) e preparar o cortador de tecido (Figura 2B).
- Usando fórceps e bisturi, corte o ovário ao meio e remova a medula de cada metade, deixando apenas o córtex a uma espessura de aproximadamente 1 mm, como mostra a Figura 2C.
- Corte o ovário ao meio longitudinalmente de um local de fixação ligamentar para o local de fixação oposto.
- Manter metade do ovário na tábua de corte a ser processada e colocar a outra metade do ovário de volta em quente (38,5 °C) PBS + PenStrep.
- Com a medula exposta voltada para cima, corte ao longo da curvatura do ovário a aproximadamente 2 mm de distância da superfície do ovário sem cortar o córtex.
- Use a fatia ao longo da curvatura do ovário como guia para aprofundar a fatia, ainda seguindo a curvatura do ovário para separar o córtex da medula.
- Dissecar e descartar quaisquer corpos lúteos do ovário cortando ao longo da borda do corpo lúteo.
- Vire o ovário pela metade para que o epitélio fique voltado para cima e use o bisturi para terminar de cortar a medula para longe do córtex. Corte qualquer tecido conjuntivo branco restante ao redor da borda da peça do ovário que foi conectada aos ligamentos.
- Uma vez que a maioria da medula é removida, use o bisturi para cortar o córtex para aproximadamente 1 mm de espessura. Manipule o bisturi com pequenos movimentos de ida e volta para raspar o restante da medula.
NOTA: A medula é a porção interna do ovário que contém grandes vasos sanguíneos. O córtex é a porção externa do ovário, situada diretamente abaixo do epitélio superficial mais externo. O córtex tem aproximadamente 1 mm de espessura no ovário bovino e, assim, cortar o ovário a uma espessura de 1 mm removerá a medula.
- Corte o córtex em pedaços não maiores que 2,5 cm x 2,5 cm. Mantenha as peças do córtex em quente (38,5 °C) PBS + PenStrep até que estejam prontas para cortar.
- Encha um copo com, pelo menos, 50 ml de PBS + PenStrep quente (38,5 °C) e obtenha uma pipeta de transferência de plástico.
- Transfira um único pedaço de córtex para a placa de Petri no picador de tecido e molhe o tecido com três ou quatro gotas de PBS + PenStrep quentes (38,5 °C).
- Segure o pedaço de tecido firme com um par de pinças e pressione o botão de reinicialização uma vez para iniciar o cortador de tecido. Estabilize a placa de Petri com uma mão enquanto continua a estabilizar o tecido com a pinça. Mova a pinça deixada ao longo do tecido, conforme necessário, para evitar que a lâmina atinja a pinça. As tiras resultantes terão aproximadamente 500 μm de comprimento.
- Uma vez que todo o pedaço de córtex tenha sido cortado em tiras, use o botão do suporte da lâmina para levantar a lâmina da placa de Petri e a pinça para remover qualquer tecido da lâmina.
- Gire o suporte da placa 90°.
- Pressione o botão de redefinição uma vez. Estabilize a placa de Petri com uma mão enquanto usa a pinça para empurrar as tiras de tecido para o caminho da lâmina.
- Passe a lâmina inteiramente através das tiras de tecido. Use o botão do suporte da lâmina para levantar a lâmina da placa de Petri e a pinça para remover qualquer tecido da lâmina.
- Use a pipeta de transferência e quente (38,5 °C) PBS + PenStrep para lavar o tecido picado (tamanho final do tecido: 500 μm x 500 μm x cubos de 1 mm) em um tubo cônico pré-aquecido (38,5 °C) de 50 mL. Devolver o tubo cónico ao banho de água ou de grânulos para manter o tecido picado quente (38,5 °C).
- Use o nutdriver para remover a porca do braço de corte e remova a lavadora e o fecho da lâmina. Usando fórceps, remova a lâmina do braço cortante, vire-a de modo que a borda não utilizada fique voltada para a placa de Petri e coloque-a de volta no braço de corte. Substitua o fecho, a arruela e a porca da lâmina e redefina o botão de liberação da mesa, conforme descrito nas etapas 2.5-2.7.
- Repita os passos 4.5-4.12 para todos os pedaços restantes de córtex do ovário, substituindo as lâminas por novas após cada aresta de corte ter sido usada.
- Descarte todas as lâminas usadas em um recipiente de plástico de paredes duras para objetos cortantes.
5. Procedimento de homogeneização
- Certifique-se de que a unidade homogeneizadora (consulte Tabela de materiais) esteja conectada e a velocidade esteja ajustada para a segunda barra (9.000-11.000 rpm). Insira a sonda geradora de 10 mm na unidade de acordo com as especificações do fabricante.
- Defina um temporizador para 1 min e insira a sonda no tubo cônico de 50 mL contendo o tecido do córtex picado de um ovário (etapa 4.11) e PBS + PenStrep suficiente para encher o tubo até a linha de 25 mL. A profundidade a que a sonda é inserida deve ser de 1/3 da altura do líquido, medida a partir do fundo da câmara. Posicione a sonda ligeiramente fora do centro para minimizar o vórtice.
- Inicie o temporizador e ligue o homogeneizador. Certifique-se de que a parte inferior da sonda não toque no tubo e mantenha o tubo imóvel enquanto o homogeneizador está ligado.
- Após 1 min de homogeneização, retire a sonda do tubo. Usando pinças, remova qualquer tecido conjuntivo que obstrua os orifícios de ventilação e o espaço entre a faca do rotor e o tubo do rotor. Se algum pedaço de córtex estiver preso na sonda, remova-os com pinça e coloque-os de volta no tubo.
- Repita os passos 5.2-5.4 um adicional de 5x para um total de 6 min de homogeneização.
- Colocar o tubo com tecido homogeneizado no banho de água ou grânulos para manter o tecido quente (38,5 °C). Após o processamento do último ovário, desmonte, limpe e seque imediatamente a sonda do gerador de acordo com as especificações do fabricante.
6. Procedimento de filtração
- Deitar o tecido disperso na ampola coberta de gaze inserida no balão de Erlenmeyer. Enxaguar o conteúdo do tubo no funil utilizando PBS quente (38,5 °C) + PenStrep até que não permaneçam fragmentos de tecido no tubo.
- Força os fragmentos de tecido a passar através dos orifícios do pano, torcendo o pano de queijo em torno dos fragmentos de tecido e apertando até que todo o excesso de fluido e tecido seja removido do pano de queijo.
- Reabra o pano de queijo sobre o funil, lave o pano de queijo com PBS + PenStrep usando uma pipeta de transferência e esprema novamente quaisquer fragmentos de tecido residual através do pano.
- Use um hemostato para segurar o filtro celular de 300 μm sobre um copo de 200 mL. Deitar o filtrado no balão de Erlenmeyer através do coador celular. Enxaguar o conteúdo do balão no coador celular utilizando PBS + PenStrep a quente (38,5 °C) até que não restem fragmentos de tecido.
- Se o filtro celular ficar entupido com tecido, bata suavemente o filtro celular contra o copo para garantir que todo o líquido tenha sido filtrado para o copo e, em seguida, vire o filtro celular de cabeça para baixo e bata os grandes detritos de tecido no papel de bancada. Devolva o filtro celular sobre o copo e continue a derramar o filtrado através dele. Repetir se necessário, até que todo o filtrado do balão de Erlenmeyer tenha sido filtrado.
- Use um hemostato para segurar o filtro celular de 40 μm sobre um segundo copo de 200 mL. Despeje o filtrado no primeiro copo de 200 mL através do filtro celular. Enxaguar o conteúdo do copo no coador celular usando PBS + PenStrep morno (38,5 °C) até que não restem fragmentos de tecido. Não descarte o conteúdo do filtro celular de 40 μm.
- Encaixe a agulha de 18 G na seringa de 20 ml. Encha a seringa com FWM. Vire o filtro celular de 40 μm de cabeça para baixo sobre uma placa de Petri quadrada e utilize a seringa para lavar o conteúdo do filtro celular para o prato. Reabasteça a seringa e lave o filtro celular conforme necessário até que não restem fragmentos de tecido.
NOTA: Normalmente, 25 mL de FWM são suficientes para enxaguar completamente o conteúdo do filtro celular de 40 μm.

Figura 2: Configuração da área de trabalho para processamento de ovário e fluxo de trabalho de protocolo. (A) Configuração de bancada para cortar ovários antes de cortar e para filtrar o homogeneizado do ovário. (B) Configurados como cortador de tecidos e homogeneizador, com suporte de isopor para reduzir as vibrações do estágio do homogeneizador. (C) Esquema que ilustra o fluxo de trabalho para o processamento de um ovário inteiro. Os ovários são aparados de excesso de tecido conjuntivo e, em seguida, cortados ao meio, e a medula é removida até que uma fatia de córtex de ~ 1 mm de espessura permaneça. O córtex é cortado em pedaços de 2,5 cm x 2,5 cm e picado em um cortador de tecido ajustado a um intervalo de corte de 500 μm. As peças são então homogeneizadas, e o homogeneizado é filtrado através de gaze seguido de filtração através de filtros celulares de 300 μm e 40 μm. O conteúdo do filtro celular de 40 μm é enxaguado em uma placa de Petri quadrada, que é procurada por folículos usando um estereomicroscópio. Criado com BioRender.com. Por favor, clique aqui para ver uma versão maior desta figura.
7. Busca e coleta de folículos
- Transfira a placa de Petri quadrada (passo 6.6) para um estereoscópio com um palco aquecido ajustado para 38,5 °C. A ampliação do estereoscópio deve ser definida entre 1,25x e 3,2x, dependendo da preferência do pesquisador.
- Pipete gotas de 10 μL de FWM em uma placa de Petri de 60 mm e cubra as gotas com óleo mineral para evitar a secagem. Coloque a placa de Petri com gotas de meio sobre uma placa de aquecimento ajustada para 38,5 °C.
NOTA: Uma placa de 4 poços pode ser usada para coletar folículos. Adicionar 500 μL de meio de lavagem a um ou dois poços. Colocar na placa de aquecimento regulada para 38,5 °C. - Obtenha um êmbolo e uma ponta de micropipeta.
NOTA: Uma micropipeta de vidro de 1-5 μL (ver Tabela de Materiais) é recomendada porque os folículos são menos propensos a aderir à pipeta de vidro e a serem perdidos quando transferidos entre soluções. É também um instrumento pequeno o suficiente para permitir micromanipulações mais fáceis e precisas dos folículos. - Identifique os folículos da placa de Petri quadrada e transfira para as gotas de meio (FWM) usando a micropipeta. Muitos folículos provavelmente serão incorporados em detritos de tecido e podem ser recuperados usando um dos dois métodos, conforme descrito abaixo.
NOTA: Os folículos são oblongos, em vez de esferas perfeitas, e tipicamente têm um ovócito, apresentando-se como um círculo branco sólido em contrastes mais escuros, em direção ao centro do folículo (Figura 3A-C). Tome cuidado para evitar confundir folículos com ovócitos desnudos. Os ovócitos tendem a ser esferas perfeitas e são cercados por uma membrana espessa e clara (a zona pelúcida). Um microscópio invertido com uma ampliação de 10x (ou maior) pode ser usado para um exame mais detalhado dos folículos (Figura 3D).- Separe cuidadosamente os folículos dos detritos usando a ponta da micropipeta ou agulhas finas (27 G).
- Alternativamente, use uma pipeta Pasteur de vidro com um bulbo de borracha para absorver e esguichar os detritos no prato várias vezes para desalojar os folículos dos detritos.
- Trabalhe rapidamente, não levando mais de 30 minutos, para procurar a placa de Petri para ajudar a preservar a viabilidade do folículo.
- Coloque um máximo de apenas cinco folículos por gota de 10 μL, pois uma densidade mais alta pode aumentar a probabilidade de os folículos aderirem juntos.
8. Teste de viabilidade de exclusão do azul de tripano
NOTA: Use a tampa de uma placa de Petri ou uma placa de 4 poços para todas as etapas a seguir, pois os folículos aderem menos ao plástico da tampa do que ao plástico do prato real.
- Preparar PBS + 0,2% de polivinilpirrolidona (PVP) dissolvendo 100 mg de PVP em 50 mL de PBS.
NOTA: PVP é usado aqui para reduzir a probabilidade de folículos se ligarem ao prato. - Use a micropipeta para transferir todos os folículos (média de 40) das gotas de mídia para uma queda de 50 μL de PBS + PVP de 0,2%.
- Lave os folículos 2x transferindo-os sequencialmente para gotas frescas de 50 μL de PBS + PVP a 0,2%.
- Transfira os folículos para uma queda de 285 μL de PBS + PVP de 0,2%.
- Adicionar 15 μL de azul de tripano à gota de 285 μL de PBS + PVP a 0,2% (concentração final de azul de tripano a 0,05%) e misturar cuidadosamente a gota utilizando uma ponta de pipeta de 200 μL ajustada para 100 μL.
NOTA: Se utilizar a placa de 4 poços para o ensaio de viabilidade do tripano, adicionar 475 μL de PBS + PVP a 0,2% e 25 μL de azul de tripano a um alvéolo. - Incubar os folículos por 1 min na gota azul de tripano e, em seguida, transferir os folículos para uma gota de 50 μL (ou poço de 500 μL) de PBS + PVP a 0,2%.
- Lave os folículos 3x de acordo com a etapa 8.3 com gotas frescas de 50 μL (ou 500 μL por poço) de PBS + PVP a 0,2%.
- Descarte todos os folículos que ainda apareçam azuis após três lavagens em PBS + PVP 0,2%, pois estes são inviáveis. Quaisquer folículos que não retenham a coloração azul após três lavagens são viáveis e podem ser utilizados para imunofluorescência, cultura ou outros procedimentos (Figura 3E). Congelar rapidamente os folículos em azoto líquido e conservar a -80 °C até nova utilização, se necessário.
- Realizar análise RT-qPCR e coloração por imunofluorescência dos folículos, conforme descrito nas etapas 9 e 10.

Figura 3: Folículos isolados e teste de exclusão azul de tripano. (A-C) Os folículos isolados foram fotografados através de um estereomicroscópio em várias ampliações. (A) Folículos isolados entre detritos dentro do prato de busca inicial. Os folículos individuais são circulados em vermelho. Barra de escala = 2.000 μm. (B) Folículos isolados e detritos dentro de uma gota de meio de lavagem de folículo coberto com óleo mineral. Barra de escala = 1.000 μm. (C) Folículos isolados sem detritos com maior ampliação. Barra de escala = 1.000 μm. (D) Folículos isolados fotografados usando um microscópio de campo brilhante invertido. Barra de escala = 100 μm. (E) Imagens representativas de folículos viáveis (não corados) e não viáveis (coloração azul) fotografados usando um microscópio de campo brilhante invertido e uma objetiva de 20x. Barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
9. Análise RT-qPCR
- Isolar o ARN de folículos viáveis (a partir do passo 8.8) utilizando um reagente de isolamento de ARN (ver Tabela de Materiais). Purificar o ARN e tratar com DNase utilizando um kit de limpeza comercialmente disponível (ver Tabela de Materiais) de acordo com as instruções do fabricante.
- Eluir o RNA com 14 μL de água livre de RNase e quantificar usando um espectrofotômetro. O RNA pode ser armazenado a -80 °C até a síntese de cDNA.
- Realize a síntese de cDNA a partir de quantidades iguais de RNA extraído de folículos primários e secundários precoces, usando um kit de síntese de cDNA comercialmente disponível (consulte a Tabela de Materiais) de acordo com as instruções do fabricante. Incubar a mistura de reacção durante 5 min a 25 °C, seguido de 60 min a 42 °C, terminando a reacção por aquecimento a 70 °C durante 5 min.
- Realizar RT-qPCR com o cDNA sintetizado (5 ng por reação) e primers (Tabela 1) usando uma mistura de reação comercialmente disponível (ver Tabela de Materiais). Utilizar condições de ciclagem térmica: 30 s a 95 °C para activação da polimerase, seguidos de 40 ciclos de amplificação, onde cada ciclo incluiu 15 s a 95 °C para desnaturação e 30 s a 60 °C para recozimento / extensão. Analise o RT-qPCR quantificando os valores do limiar de ciclo (Ct) e/ou visualize os produtos de PCR usando eletroforese em gel de agarose.
NOTA: A expressão do transcrito do marcador de células granulosas FSHR e do marcador de células germinativas DAZL foram avaliadas neste estudo. Os genes de referência foram H2A e ACTB. - Execute uma análise de curva de fusão aumentando a temperatura de 65 °C em incrementos de 0,5 °C a cada 5 s até atingir 95 °C.
10. Análise de imunofluorescência
- Fixar folículos viáveis (a partir do passo 8.8) por 15 min em uma queda de 100 μL de paraformaldeído (PFA) a 4% (v/v) à temperatura ambiente (RT), seguido de lavagem de 3x em gotas de 100 μL de PBS + 0,1% BSA + 0,1% Tween 20.
- Bloquear os folículos por 1 h no RT em um tampão de bloqueio composto por 1x PBS + 5% (v/v) soro normal de burro (NDS). Após o bloqueio, incubar os folículos durante a noite a 4 °C numa gota de 100 μL de 4 μg/ml de anticorpo CX37 anti-humano de coelho ou de 4 μg/ml de IgG do isótipo de coelho (controlo negativo) diluído em tampão de bloqueio.
- Lave os folículos 3x em gotas de 100 μL de PBS + 0,1% BSA + 0,1% Tween 20 e, em seguida, incube-os por 1 h em RT no escuro em uma gota de 100 μL de 2 μg/mL de anticorpo secundário AlexaFluor 488 de burro-anti-coelho diluído em tampão de bloqueio.
- Incubar os folículos durante 5 min a RT no escuro numa gota de 100 μL de 1 μg/ml Hoechst 33342 diluída em tampão de bloqueio para etiquetar o ADN.
- Transfira os folículos para uma gota de 5 μL de meio de montagem (ver Tabela de Materiais) em uma lâmina de microscópio de vidro e cubra com uma folha de cobertura. Deixe as lâminas para curar no RT durante a noite, seguido de selamento com esmalte. Armazene-os a 4 °C até à obtenção de imagens.
- Imagem de todos os slides dentro de 48 h de deslizamento da tampa. Realizar imagens utilizando um microscópio de epifluorescência invertida (ver Tabela de Materiais) sob os filtros DAPI (excitação 380 nm e emissão 450 nm) e FITC (excitação 470 nm e emissão 525 nm).
- Corrija o tempo de exposição para ambos os canais. Ajuste o tempo de exposição do FITC (CX37) com base no controle negativo do isotipo coelho. Use uma objetiva de 20x e o canal DAPI definido para 50 ms de tempo de exposição para identificar folículos marcados com isótipo de coelho.
- Imagine esses folículos sob o canal FITC e diminua o tempo de exposição até que todo o sinal verde de fundo seja abolido. Observe este tempo de exposição.
- Fotografe todos os folículos marcados com anticorpos CX37 usando o tempo de exposição definido para o canal FITC do isotipo e o tempo de exposição de 50 ms para o canal DAPI.
- Processar a intensidade do sinal, medida pela área cinzenta média após o limiar, utilizando um programa de processamento de imagens de computador29 (ver Tabela de Materiais).
- Ajuste o arquivo tiff da imagem DAPI para cada folículo de modo que todo o folículo seja delineado. Use a função Analisar partículas do programa para selecionar todo o folículo como uma região de interesse (ROI).
- Abra o arquivo tiff da imagem FITC para o folículo correspondente e sobreponha o ROI gerado a partir da imagem DAPI sobre a imagem FITC. Use a função Medir do programa para quantificar a área cinzenta média da imagem FITC, que representa a intensidade do sinal.
Access restricted. Please log in or start a trial to view this content.
Resultados
Visão geral e etapas críticas
Usando este protocolo, pequenos folículos pré-antrais bovinos podem ser isolados de forma confiável de ovários únicos em números experimentalmente relevantes. De um total de 30 repetições, obteve-se uma média de 41 folículos por repetição, com variação de 11 a 135 folículos (Figura 4A). Em 14 repetições, os folículos foram caracterizados para o estágio de desenvolvimento conforme descrito anteriormente26...
Access restricted. Please log in or start a trial to view this content.
Discussão
O presente protocolo detalha um método reprodutível para recuperar folículos pré-antrais em estágio inicial, especificamente nos estágios primário e secundário inicial, do ovário bovino. Este protocolo baseia-se em relatórios anteriores 20,25,30,34,35,36 e fornece otimizações que resultam no isolamento de um número significativo de folículos de um ovário individual.
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este projeto foi parcialmente financiado pelo projeto multiestadual do USDA W4112 e pelo prêmio UC Davis Jastro Shields à SM.
Os autores gostariam de estender seu apreço à Central Valley Meat, Inc. por fornecer os ovários bovinos usados em todos os experimentos. Os autores também agradecem a Olivia Silvera pela assistência com o processamento do ovário e isolamento do folículo.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 5-3/4" Soda Lime Disposable Glass Pasteur Pipette | Duran Wheaton Kimble | 63A54 | Pasteur pipette that can be used to dislodge follicles from debris while searching within the petri dish |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | Diluted to 4%; fixation of follicles for immunostaining |
| 20 mL Luer-lock Syringe | Fisher Scientific | Z116882-100EA | Syringe used with the 18 G needle to dislodge follicles from the 40 μm cell strainer |
| #21 Sterile Scalpel Blade | Fisher Scientific | 50-365-023 | Used to cut the ovaries and remove the medula |
| 40 μm Cell Strainer | Fisher Scientific | 22-363-547 | Used to filter the filtrate from the 300 μm cell strainer |
| 104 mm Plastic Funnel | Fisher Scientific | 10-348C | Size can vary, but ensure the cheese cloth is cut appropriately and that the ovarian homogenate will not spill over |
| 300 μm Cell Strainer | pluriSelect | 43-50300-03 | Used to filter the filtrate from the cheese cloth |
| 500 mL Erlenmeyer Flask | Fisher Scientific | FB500500 | Funnel and flask used to catch filtrate from the cheese cloth |
| Air-Tite Sterile Needles 18 G | Thermo Fisher Scientific | 14-817-151 | 18 G offers enough pressure to dislodge follicles from the 40 μm cell strainer |
| Air-Tite Sterile Needles 27 G 13 mm | Fisher Scientific | 14-817-171 | Needles that can be used to manipulate any debris in which follicles are stuck |
| BD Hoechst 33342 Solution | Fisher Scientific | BDB561908 | Fluorescent DNA stain |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | Component of follicle wash media |
| Cheese Cloth | Electron Microscopy Sciences | 71748-00 | First filtering step of the ovarian homogenate meant to remove large tissue debris |
| Classic Double Edge Safety Razor Blades | Wilkinson Sword | N/A | Razor blades that fit the best in the McIlwain Tissue Chopper and do not dull quickly |
| Donkey-Anti-Rabbit Secondary Antibody, Alexa Fluor 488 | Fisher Scientific | A-21206 | Secondary antibody for immunostaining |
| Eisco Latex Pipette Bulbs | Fisher Scientific | S29388 | Rubber bulb to use with Pasteur pipettes |
| HEPES Buffer | Sigma-Aldrich | H3375 | Component of follicle wash media |
| Homogenizer | VWR | 10032-336 | Homogenize the ovarian tissue to release follicles |
| ImageJ/Fiji | NIH | v2.3.1 | Software used for analysis of fluorescence-immunolocalization |
| McIlwain Tissue Chopper | Ted Pella | 10184 | Used to cut ovarian tissue small enough for homogenization |
| Microscope - Stereoscope | Olympus | SZX2-ILLT | Dissection microscope used for searching and harvesting follicles from the filtrate |
| Microscope - Inverted | Nikon | Diaphot 300 | Inverted microscope used for high magnification brightfield visualization of isolated follicles |
| Microscope - Inverted | ECHO | Revolve R4 | Inverted microscope used for high magnification brightfield and epifluorescence visualization of isolated follicles |
| Mineral Oil | Sigma-Aldrich | M8410-1L | Oil to cover the drops of follicle wash medium to prevent evaporation during searching |
| Non-essential Amino Acids (NEAA) | Gibco | 11140-050 | Component of follicle wash medium |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-001 | Reagent for immunostaining blocking buffer |
| Nunc 4-well Dishes for IVF | Thermo Fisher Scientific | 144444 | 4-well dishes for follicle isolation and washing |
| Penicillin-Streptomycin Solution 100x | Gibco | 15-140-122 | Component of follicle wash medium |
| Petri Dish 60 mm OD x 13.7 mm | Ted Pella | 10184-04 | Petri dish that fits the best in the McIlwain Tissue Chopper |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP665-1 | Washing buffer for ovaries and follicles |
| Plastic Cutting Board | Fisher Scientific | 09-002-24A | Cutting board of sufficient size to safely cut ovaries |
| Polyvinylpyrrolidone (PVP) | Fisher Scientific | BP431-100 | Addition of PVP (0.1% w/v) to PBS prevents follicles from sticking to the plate or each other |
| ProLong Gold Antifade Mountant | Thermo Fisher Scientific | P36930 | Mounting medium for fluorescently labeled cells or tissue |
| Qiagen RNeasy Micro Kit | Qiagen | 74004 | RNA column clean-up kit |
| R | The R Foundation | v4.1.2 | Statistical analysis software |
| Rabbit-Anti-Human Cx37/GJA4 Polyclonal Antibody | Abcam | ab181701 | Cx37 primary antibody for immunostaining |
| RevertAid RT Reverse Transcription Kit | Thermo Fisher Scientific | K1691 | cDNA synthesis kit |
| Rstudio | RStudio, PBC | v2021.09.2 | Statistical analysis software |
| Sodium Hydroxide Solution (1N/Certified) | Fisher Scientific | SS266-1 | Used to increase media pH to 7.6-7.8 |
| Sodium Pyruvate (NaPyr) | Gibco | 11360-070 | Component of follicle wash medium |
| Square Petri Dish 100 mm x 15 mm | Thermo Fisher Scientific | 60872-310 | Gridded petri dishes allow for more efficient identification of follicles |
| SsoAdvanced Universal SYBR Green Supermix | BioRad | 1725271 | Mastermix for PCR reaction |
| Steritop Threaded Bottle Top Filter | Sigma-Aldrich | S2GPT02RE | Used to sterilize follicle wash medium |
| SYBR-safe DNA gel stain | Thermo Fisher Scientific | S33102 | Staining to visual PCR products on agarose gel |
| TCM199 with Hank’s Salts | Gibco | 12-350-039 | Component of follicle wash medium |
| Triton X-100 | Fisher Scientific | BP151-100 | Detergent for immunostaining permeabilization buffer |
| Trizol reagent | Thermo Fisher Scientific | 15596026 | RNA isolation reagent |
| Trypan Blue Solution, 0.4% | Gibco | 15-250-061 | Used for testing viability of isolated follicles |
| Tween 20 | Detergent for immunostaining wash buffer | ||
| Warmer Plate Universal | WTA | 20931 | Warm plate to keep follicles at 38.5 °C while searching under the microscope |
| Wiretrol II Calibrated Micropipets | Drummond | 50002-005 | Glass micropipettes to manipulate follicles |
Referências
- Fortune, J. E., Yang, M. Y., Allen, J. J., Herrick, S. L. Triennial reproduction symposium: The ovarian follicular reserve in cattle: What regulates its formation and size. Journal of Animal Science. 91 (7), 3041-3050 (2013).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology. 195 (4), 327-336 (1997).
- Jaffe, L. A., Egbert, J. R. Regulation of mammalian oocyte meiosis by intercellular communication within the ovarian follicle. Annual Review of Physiology. 79, 237-260 (2017).
- Driancourt, M. A., Reynaud, K., Cortvrindt, R., Smitz, J. Roles of KIT and KIT LIGAND in ovarian function. Reviews of Reproduction. 5 (3), 143-152 (2000).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproductive Fertility. 81 (2), 301-307 (1987).
- Aerts, J. M. J., Bols, P. E. J. Ovarian follicular dynamics: a review with emphasis on the bovine species. Part I: Folliculogenesis and preantral follicle development. Reproduction in Domestic Animals. 45 (1), 171-179 (2010).
- Sugiura, K., Pendola, F. L., Eppig, J. J. Oocyte control of metabolic cooperativity between oocytes and companion granulosa cells: energy metabolism. Developmental Biology. 279 (1), 20-30 (2005).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biology of Reproduction. 73 (2), 351-357 (2005).
- Sugimura, S., et al. Amphiregulin co-operates with bone morphogenetic protein 15 to increase bovine oocyte developmental competence: effects on gap junction-mediated metabolite supply. Molecular Human Reproduction. 20 (6), 499-513 (2014).
- Edson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Matzuk, M. M., Burns, K. H. Genetics of mammalian reproduction: modeling the end of the germline. Annual Review of Physiology. 74, 503-528 (2012).
- McGee, E. A., Raj, R. S. Regulators of ovarian preantral follicle development. Seminars in Reproductive Medicine. 33 (3), 179-184 (2015).
- Chen, Y., et al. The factors and pathways regulating the activation of mammalian primordial follicles in vivo. Frontiers in Cell and Developmental Biology. 8, 575706(2020).
- Figueiredo, J. R., et al. Development of a combined new mechanical and enzymatic method for the isolation of intact preantral follicles from fetal, calf and adult bovine ovaries. Theriogenology. 40 (4), 789-799 (1993).
- Sirard, M. A. The ovarian follicle of cows as a model for human. Animal Models and Human Reproduction. , 127-144 (2017).
- Parkes, W. S., et al. Hyaluronan and collagen are prominent extracellular matrix components in bovine and porcine ovaries. Genes. 12 (8), 1186(2021).
- Araújo, V. R., Gastal, M. O., Figueiredo, J. R., Gastal, E. L. In vitro culture of bovine preantral follicles: a review. Reproductive Biology and Endocrinology. 12 (1), 1-14 (2014).
- Eppig, J. J., Schroeder, A. C. Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation, and fertilization in vitro. Biology of Reproduction. 41 (2), 268-276 (1989).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Nuttinck, F., Mermillod, P., Massip, A., Dessy, F. Characterization of in vitro growth of bovine preantral ovarian follicles: A preliminary study. Theriogenology. 39 (4), 811-821 (1993).
- Demeestere, I., et al. Effect of preantral follicle isolation technique on in-vitro follicular growth, oocyte maturation and embryo development in mice. Human Reproduction. 17 (8), 2152-2159 (2002).
- Fattahi, A., et al. Optimization of porcine ovarian follicle isolation methods for better developmental potential. Tissue Engineering Part A. 26 (13-14), 712-719 (2020).
- Nagashima, J. B., Hill, A. M., Songsasen, N. In vitro development of mechanically and enzymatically isolated cat ovarian follicles. Reproduction and Fertility. 2 (1), 35-46 (2021).
- Lucci, C. M., Rumpf, R., Figueiredo, J. R., Báo, S. N. Zebu (Bos indicus) ovarian preantral follicles: Morphological characterization and development of an efficient isolation method. Theriogenology. 57 (5), 1467-1483 (2002).
- Langbeen, A., et al. Characterization of freshly retrieved preantral follicles using a low-invasive, mechanical isolation method extended to different ruminant species. Zygote. 23 (5), 683-694 (2014).
- Candelaria, J. I., Denicol, A. C. Characterization of isolated bovine preantral follicles based on morphology, diameter and cell number. Zygote. 28 (2), 154-159 (2020).
- vanden Hurk, R., et al. Ultrastructure and viability of isolated bovine preantral follicles. Human Reproduction Update. 4 (6), 833-841 (1998).
- Paes, V. M., et al. Effect of heat stress on the survival and development of in vitro cultured bovine preantral follicles and on in vitro maturation of cumulus-oocyte complex. Theriogenology. 86 (4), 994-1003 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Aguiar, L. H., Hyde, K. A., Pedroza, G. H., Denicol, A. C. Heat stress impairs in vitro development of preantral follicles of cattle. Animal Reproduction Science. 213, 106277(2020).
- Kristensen, S. G., Ebbesen, P., Andersen, C. Y. Transcriptional profiling of five isolated size-matched stages of human preantral follicles. Molecular and Cellular Endocrinology. 401, 189-201 (2015).
- Candelaria, J. I., Rabaglino, M. B., Denicol, A. C. Ovarian preantral follicles are responsive to FSH as early as the primary stage of development. Journal of Endocrinology. 247 (2), 153-168 (2020).
- Nuttinck, F., et al. Comparative immunohistochemical distribution of Connexin 37 and Connexin 43 throughout folliculogenesis in the bovine ovary. Molecular Reproduction and Development. 57 (1), 60-66 (2000).
- Itoh, T., Hoshi, H. Efficient isolation and long-term viability of bovine small preantral follicles in vitro. In Vitro Cellular and Developmental Biology-Animal. 36 (4), 235-240 (2000).
- Saha, S., Shimizu, M., Geshi, M., Izaike, Y. In vitro culture of bovine preantral follicles. Animal Reproduction Science. 63 (1-2), 27-39 (2000).
- Bus, A., et al. Preservation of connexin 43 and transzonal projections in isolated bovine pre-antral follicles before and following vitrification. Journal of Assisted Reproduction and Genetics. 38 (2), 479-492 (2021).
- Gougeon, A., Ecochard, R., Thalabard, J. C. Age-related changes of the population of human ovarian follicles: increase in the disappearance rate of non-growing and early-growing follicles in aging women. Biology of Reproduction. 50 (3), 653-663 (1994).
- Xu, D., et al. Raf-ERK1/2 signaling pathways mediate steroid hormone synthesis in bovine ovarian granulosa cells. Reproduction in Domestic Animals. 54 (5), 741-749 (2019).
- Santos, R. R., et al. Cryopreservation of ovarian tissue: an emerging technology for female germline preservation of endangered species and breeds. Animal Reproduction Science. 122 (3-4), 151-163 (2010).
- Leonel, E. C. R., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Bus, A., Langbeen, A., Martin, B., Leroy, J. I. M. R., Bols, P. E. J. Is the pre-antral ovarian follicle the 'holy grail' for female fertility preservation. Animal Reproduction Science. 207, 119-130 (2019).
- Chen, J., et al. Optimization of follicle isolation for bioengineering of human artificial ovary. Biopreservation and Biobanking. , (2021).
- Chiti, M. C., et al. A modified and tailored human follicle isolation procedure improves follicle recovery and survival. Journal of Ovarian Research. 10 (1), 1-9 (2017).
- Kristensen, S. G., Rasmussen, A., Byskov, A. G., Andersen, C. Y. Isolation of pre-antral follicles from human ovarian medulla tissue. Human Reproduction. 26 (1), 157-166 (2011).
- Oktay, K., et al. Isolation and characterization of primordial follicles from fresh and cryopreserved human ovarian tissue. Fertility and Sterility. 67 (3), 481-486 (1997).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados