A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
דש ציר עורק אפיגסטרי נחות שטחי לחקר השפעות התניה איסכמית במודל חולדה
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר קציר, תפירה וניטור של דשים פאשיוקוטניים בחולדות המאפשרים הדמיה טובה ומניפולציה של זרימת הדם דרך כלי הדם האפיגסטריים התחתונים השטחיים באמצעות הידוק וקשירת כלי הירך. זה קריטי למחקרים הכוללים התניה מוקדמת איסכמית.
Abstract
דשים פאשיוקוטניים (FCF) הפכו לתקן הזהב לשחזור פגמים מורכבים בניתוחים פלסטיים ושחזוריים. טכניקה זו חוסכת שרירים מאפשרת העברת רקמות כלי דם כדי לכסות כל פגם גדול. FCF יכול לשמש כדשים פדיקלים או כדשים חופשיים; עם זאת, בספרות, שיעורי הכישלון עבור FCF פדיקל ו- FCF חופשי הם מעל 5%, מה שמשאיר מקום לשיפור עבור טכניקות אלה והרחבת ידע נוספת בתחום זה. התניה מוקדמת איסכמית (I.P.) נחקרה באופן נרחב, אך המנגנונים והאופטימיזציה של משטר I.P. טרם נקבעו. תופעה זו אכן נחקרת בצורה גרועה בניתוחים פלסטיים ומשחזרים. כאן, מוצג מודל כירורגי לחקר משטר I.P. במודל דש צירי של חולדה, המתאר כיצד להעריך בבטחה ובאמינות את ההשפעות של I.P. על הישרדות הדש. מאמר זה מתאר את ההליך הכירורגי המלא, כולל הצעות לשיפור האמינות של מודל זה. המטרה היא לספק לחוקרים מודל אמין וניתן לשחזור כדי לבחון משטרי התניה איסכמיים שונים ולהעריך את השפעתם על שרידות הדש.
Introduction
ניתוחים פלסטיים ומשחזרים נמצאים כל הזמן באבולוציה. התפתחות דשי השריר, הפאשיוטניות והמחוררים אפשרה להציע שחזורים איכותיים יותר תוך הפחתת התחלואה. בשילוב הידע האנטומי המשופר הזה עם מיומנויות טכניות משופרות, מנתחים משחזרים יכולים לבצע העברות דש חופשיות כאשר הפגמים אינם קרובים לפתרון מקומי כלשהו. עם זאת, בעוד שניתוח דש מחורר הוא כיום הטכניקה המתקדמת ביותר בניתוחי שחזור, הספרות מדווחת על שיעור כישלון של 5% בהעברות דש חופשי 1,2,3, ועד 20% בשחזור דש פדיקור 4,5,6. כשל חלקי עד מוחלט בדש מתרחש כאשר פדיקור הדש נפגע, ולכן חיוני לחפש ללא הרף שיפורים בטכניקות הנוכחיות. אחת השיטות לשיפור הישרדות הדש היא לקדם את הניאו-וסקולריזציה שלו על מיטת הפצע, ובכך לאפשר זילוח על ידי מקור שאינו הפדיקול. התניה מוקדמת איסכמית (I.P.) תוארה לראשונה במודל לב7, המוכיחה כי איבר שנחשף לאיסכמיה מבוקרת שורד במידה רבה יותר לאחר שאיבד את אספקת הדם העיקרית שלו על ידי ביצוע ניאו-וסקולריזציה הנגרמת על ידי איסכמיה. מספר מחברים חקרו את עקרון אבן הפינה הזה כדי לייעל את הישרדות הדש במודלים פרה-קליניים וקליניים 8,9,10.
היתרון של טכניקה זו על פני שיטות אחרות לשיפור הישרדות הדש הוא קלות היישום שלה, המורכבת מבדיקות מהדק/דקלאמפ של מקור הדם. במודל החולדות, מחברים קודמים השתמשו בדש העורק האפיגסטרי התחתון השטחי (SIEA) כדי לחקור I.P. על ידי הידוק הפדיקל הראשי11,12,13. עם זאת, ניתן להיתקל במספר בעיות טכניות במודל זה, והספרות חסרה פרוטוקולים מתוארים היטב.
לכן, עבודה זו שואפת לספק לחוקרים תיאור מפורט של טכניקת רכישת דש SIEA של חולדה עם דיסקציה מורחבת של כלי הירך כדי לאפשר מחקרי I.P. על מודל דש fasciocutaneous צירית. מודל זה שומר על שלמות כלי הדם האפיגסטריים ובמקום זאת מתפעל את כלי הירך, שהם גמישים יותר. אנו חולקים את הניסיון והכלים שלנו כדי לשפר את המחקר של תופעה זו ולהגדיל את יכולת השכפול של הליך זה.
Protocol
הוועדה המוסדית לטיפול ושימוש בבעלי חיים של בית החולים הכללי של מסצ'וסטס אישרה את פרוטוקול הניסוי (IACUC- protocol #2022N000099). המחברים עקבו אחר רשימת התיוג של ARRIVE (Animal Research: Reporting In Vivo Experiments) עבור עבודה זו. כל בעלי החיים קיבלו טיפול הומני בעקבות מדריך המכון הלאומי לבריאות לטיפול ושימוש בחיות מעבדה. בסך הכל 12 חולדות לואיס זכרים (250-350 גרם, בני 8-10 שבועות) שימשו לכל הניסויים.
1. הכנת בעלי חיים
הערה: לחולדות יש קצב חילוף חומרים גבוה ומאגרי שומן מוגבלים; לכן, אין לצום לפני הניתוח ולעולם אין להגביל מים לפני הניתוח.
- עבור כל ההליכים, להרדים את בעל החיים באמצעות 3%-5% isoflurane בתא של וופורייזר דיוק isoflurane (ראה טבלה של חומרים). כאשר בעל החיים מורדם היטב, להוריד את מינון isoflurane ל 1%-3% דרך חרוט האף.
הערה: חוקר שני חייב לעקוב ברציפות אחר קצב הנשימה ולהתאים את מינון האיזופלורן. - יומיים לפני הניתוח הראשוני, הניחו קולר אלקטרוני מפלסטיק (בגודל של חולדה; ראו טבלת חומרים) על בעל החיים והשתמשו בתפר ניילון 3-0 כדי לאבטח את הצווארון האלקטרוני בצד הגבי והגחוני של צוואר החיה. אפשר יומיים להתאקלמות לצווארון אלקטרוני זה; זה צריך להתאים היטב אבל לא לחסום את נתיב האוויר של החיה.
2. טיפול טרום ניתוחי
- ביום הניתוח הראשוני, יש לגלח את החלק הקדמי התחתון של הבטן, ולפנות את האזור מהחלק הלטרלי של החיה עד מעט מעבר לקו האמצע.
- לאחר מכן, יש להשתמש בתכשיר מסיר שיער (קרם להסרת שיער; ראו טבלת חומרים) כדי להסיר את כל השיער שנותר באזור זה (ההיבט הקדמי התחתון של הבטן כמתואר בשלב הקודם).
- שטפו וייבשו היטב את האזור עם פילינג כירורגי ותמיסת בטאדין (10% פובידון-יוד).
- מתן 0.05 מ"ג / ק"ג של buprenorphine תת עורית.
3. ניטור תוך ניתוחי
- ודא כי בעל החיים נשאר על 1%-3% isoflurane באמצעות וופורייזר מדויק חרוט האף לאורך כל הניתוח. נטרו את קצב הנשימה, הנשימה וריווי החמצן של בעל החיים על ידי תצפית חזותית ומד דופק מכרסם המיועד לחולדה.
הערה: קצב הנשימה האופייני הוא 80-90 מחזורים לדקה14,15. כל תגובה המעידה על הכרה שנצפתה במהלך הניתוח מחייבת הגברת קצב האיזופלורן. - הניחו את בעל החיים על כרית חימום למשך כל הניתוח, שכן טמפרטורת הגוף של מכרסמים מתקררת במהירות תחת הרדמה.
4. קצירת דש אפיגסטרי
- הניחו את בעל החיים במצב שכיבה. יש לגלח את הבטן מתחת לקמט המפשעה עד מעל לרמת תהליך הקסיפואיד.
- באמצעות עט עור סטרילי וסרגל, תחילה לסמן את קו האמצע של הבטן של החיה ולאחר מכן את הקמט המפשעה. חתך לאורך קו הקמט המפשעה חושף את כלי הדם האפיגסטריים הנחותים המסתעפים מכלי הירך.
- לפני החתך, צייר את הדש העתידי כמו אליפסה או מלבן עד 6 ס"מ אנכית ו 3 ס"מ אופקית, המשתרעת גולגולת מן הקמט המפשעה.
- ציירו חמישה או שישה סימנים במרחקים שווים בניצב לגבולות הדש. אלה משמשים כמדריכים ליישור מחדש טוב יותר של העור לאחר שהדש הורם ונתפר בחזרה למקומו (איור 1).
- בעזרת מספריים של רגנל (ראו טבלת חומרים) מבצעים חתך אורכי בקוטר 3-4 ס"מ בקמט המפשעה.
הערה: חוקרים צריכים לנקוט זהירות ולמשוך את העור כלפי מעלה כדי למנוע נזק לכלי הדם. - חשוף וזהה את כלי הירך והאפיגסטרי באמצעות #4 תכשיטנים מלקחיים מיקרוכירורגיים (ראה טבלת חומרים), על ידי פתיחה וסגירה של המלקחיים כדי להפריד את הפאשיה ולקבל גישה לכלי הדם שנמצאים מתחת לכרית השומן המפשעה.
- השתמש בחתך המפשעה כדי להתחיל את חתך הדש באמצעות מספריים Ragnell. שימו לב לערער את העובי המלא של העור ורקמת החיבור מעל שריר הבטן.
- כדי להקל על קצירת הדש, ודא שהמספריים עוקבים אחר מישור הדיסקציה הנכון על ידי דחיפה לכיוון השריר ופיזור להבי המספריים. בצע ערעור דש זה על ידי תנועה בכיוון מתואם סביב ציור הדש.
הערה: כדי לקבוע את המישור המתאים, לא צריכים להישאר מיקרו-כלים מתחת למישור הדיסקציה.
- כדי להקל על קצירת הדש, ודא שהמספריים עוקבים אחר מישור הדיסקציה הנכון על ידי דחיפה לכיוון השריר ופיזור להבי המספריים. בצע ערעור דש זה על ידי תנועה בכיוון מתואם סביב ציור הדש.
- כאשר הקצה הראשוני של הדש משתחרר מהעור שמסביב, המשיכו ברכישת הדש על ידי ערעור מהחלק הדיסטלי לחלק הפרוקסימלי, תוך שימוש בקצות מספריים של רגנל כדי להפריד את הדש מהשריר תוך צריבת כל כלי הדם המחוררים וכלי מקלעת העור סביב הדש. זה מבטיח את כל זרימת הדם לדש דרך כלי הדם האפיגסטריים.
הערה: יש לשים לב לא לפגוע בכלי הדם של הדש על ידי משיכה חזקה מדי או פיתול העור בזמן הקציר של הדש. מומלץ להניח את החלק המשוחרר של הדש בזהירות על האגודל של היד של המנתח תוך כדי עבודה על החלק הפרוקסימלי של הדש. - ברגע שהדש נקטף לחלוטין, הענפים של כלי הדם האפיגסטריים הנחותים השטחיים נראים בהיבט העמוק של העור. המטרה היא לתמצת את כל שני הענפים של SIEA עם הדש על ידי הרמה עדינה של הדש כלפי מעלה כדי לדמיין את הכלים.
- לאחר קצירת הדש, הפרידו את רפידות השומן באספקט התחתון הן בצד המדיאלי והן בצד הצדדי של הדש. השתמשו בצריבה הדו-קוטבית (ראו טבלת חומרים) כדי לצרוב את כריות השומן קרוב לגבול החתך, תוך שימת לב לא לפגוע בפדיקל האפיגסטרי התחתון והשטחי (איור 2).
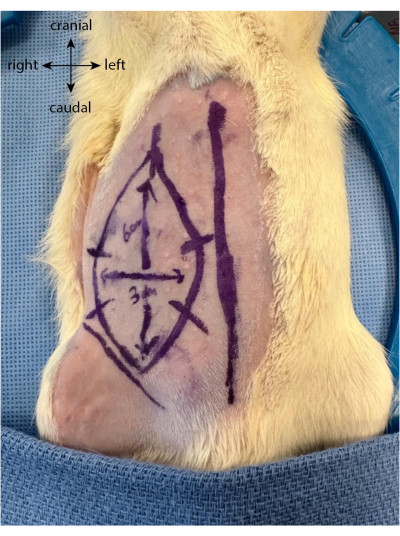
איור 1: ציור דש על בטנה של החיה. קו האמצע משמש כסמן לאיתור מיקום הדש האפיגסטרי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
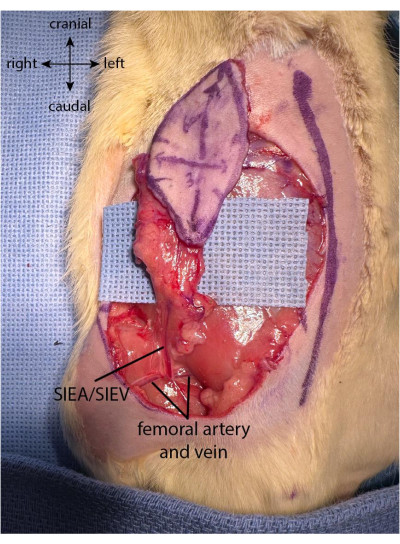
איור 2: דש מוגבה במלואו. כרית השומן נשמרת בחלק הפרוקסימלי של הדש כדי לשמר את כלי הדם המגיעים מהפדיקל האפיגסטרי התחתון השטחי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. הכנת כלי שיט ואינדוקציה איסכמיה
הערה: הדש נקטף כולו בשלב זה, אך הכלים עדיין אינם מוכנים להתניה מוקדמת איסכמית.
- לפני הכנת כלי הירך, להזריק מנה אחת של 17.5 IU של הפרין נתרן דרך וריד הפין.
הערה: הזרקה זו נעשית על ידי חשיפת העטרה, החזקת הפין חיצונית באמצעות מלקחיים אדסון א-טראומטיים, זיהוי וריד הפין, והזרקה שטחית ולאורך וריד הפין באמצעות מזרק 27 גרם. - כדי ליצור חשיפה טובה יותר, מקמו את בעל החיים בתוך משענת השומרת על עצמה של כוכב בודד (ראו טבלת חומרים).
הערה: השהייה האלסטית של Lone Star מושכת את העור הרחק מאתר הניתוח, ומאפשרת תצוגה טובה יותר של כלי הדם. כעת על החוקר לעבוד תחת מיקרוסקופ כירורגי (הגדלה של פי 40). - כדי לחשוף את כלי הדם, השתמש בשני #4 מלקחיים microsurgical לנתח את כלי הירך הן קרוב והן distally להופעתה של כלי אפיגסטרי שטחי. אין להחזיק את כלי הדם ישירות, אלא להשתמש במלקחיים כדי להפריד בעדינות את רקמת החיבור שכבה אחר שכבה על ידי פתיחה וסגירה אנכית של המלקחיים לכלי.
- על כלי הירך הדיסטליים יש לנקות את הפאשיה ולשחרר בעדינות את העצב מהעורק ומהווריד. שימוש ב-8-0 תפר ניילון (ראו טבלת חומרים), קושר את כלי הירך הדיסטליים על-ידי עקיפת מחזיק המחט המיקרוכירורגי מתחת לעורק ולווריד, אחיזת התפר וקשירת כלי הדם האלה (איור 3). אסור לפגוע בעצב או לקשור אותו כדי למזער את התחלואה לאחר הניתוח.
הערה: מנתחים יכולים להשתמש באחד המלקחיים כדי למשוך בעדינות את הפאשיה הצידית לעצב ביד אחת ולהשתמש בזוג אחר כדי להפריד לחלוטין את העצב מכלי הדם. - שימוש ב-8-0 תפר, ligate את כלי הדם הדיסטליים מיד לאחר הופעתם של כלי epigastric, משאיר מרחק 1 מ"מ לאחר מוצא pedicle. זה מבטיח שלא תגיע זרימה הפוכה דרך SIEA מהענפים העמוקים במהלך השלבים האיסכמיים.
הערה: איור 3 מראה את כלי הירך הדיסטליים הקשורים לאחר הופעת פדיקל SIEA. - על כלי הירך הפרוקסימלי, חזור על אותו תהליך של ניקוי רקמת החיבור. עם זאת, להפריד את העורק ואת הווריד אחד מהשני כדי לאפשר הידוק יעיל. ניתן להשיג זאת על ידי הנחת מלקחיים סגורים בעדינות בין העורק לווריד ופתיחה איטית של המלקחיים בכיוון הריצה של כלי הדם.
- כדי לגרום לאיסכמיה לסירוגין, הניחו מהדקים מיקרוכירורגיים בנפרד על כל עורק ווריד הירך הפרוקסימלי (איור 4).
- לאחר השלמת הפציעות האיסכמיות, תפרו את הדש למקומו המקורי, ורפדו את הסימנים כפי שצוירו לפני הניתוח (שלב 4.2.2). תפרו את הדש באמצעות תפר רץ מניילון 3-0 (ראו טבלת חומרים), החל מקמט המפשעה בצורה מדיאלית, סביב הדש, וכלה בקמט המפשעה לרוחב.
הערה: לאורך הקמט המפשעה, ניתן להשתמש באותו תפר כדי למקם תפרים קטועים. זה מאפשר לחוקרים לפתוח את האזור הזה מבלי להשפיע על סגירת הדש. - כדי לוודא את אספקת הדם לדש, הזריקו 0.25 מ"ל נתרן פלואורסצאין סטרילי (10%, ראו טבלת חומרים) לווריד הפין באותה טכניקה וכלים המתוארים להזרקת מי מלח הפרין (שלב 5.1). לאחר 3 דקות, האירו מנורת גלים ארוכים UV-366 ננומטר (אור עירור פלואורסצאין) כדי לחשוף את האזורים הפלואורסצנטיים המתאימים לאזורים המחוררים.
- לאחר הסגירה והאימות, יש לפזר מטרונידזול כתוש (ראו טבלת חומרים) לאורך התפרים כדי למנוע השחתה עצמית, ולרסס תחבושת נוזלית באותו אזור.
- לפני החלמתו של בעל החיים מההרדמה, יש להעביר קרפרופן (2-5 מ"ג/ק"ג) באופן תת-עורי.
- חוקרים יכולים כעת לגשת לכלי הירך, מקור ההזנה היחיד לדש, כדי לבחון משטרי התניה איסכמיים ניסיוניים במשך מספר ימים ברציפות. בכל יום של ניתוח, לספק מינון של 2-5 מ"ג / ק"ג של Carprofen תת עורית.
- בסוף תקופת ההתניה האיסכמית, כדי להסיר את הדש מאספקת הדם האפיגסטרית, צרוב נחות מכרית השומן לאורך הגבול הנחות של הדש.
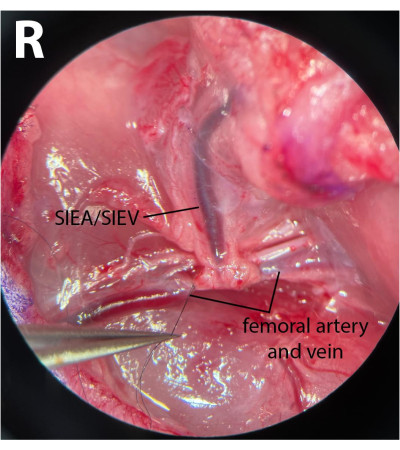
איור 3: מבט מיקרוסקופי על כלי הירך. כלי הירך הדיסטליים קשורים. העצב נשמר. צד הדיסקציה הוא קמט המפשעה הימני (R). הגדלה: פי 40. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
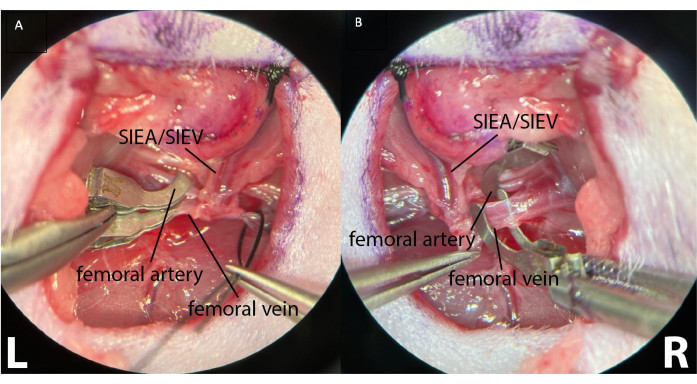
איור 4: הידוק כלי הירך הפרוקסימלי באמצעות שני מלחציים מיקרוכירורגיים נפרדים. זה מאפשר שליטה הידוק טוב יותר, הבטחת היעדר זרימה ורידי עורקי מדרדר. (A) מראה את כלי הירך השמאלי (L) מהודק. כלי הדם האפיגסטריים התחתונים השטחיים נראים לעין (SIEA/SIEV). (B) מראה עורק פמורלי מהודק ווריד עצם הירך לפני הידוק הקמט הימני של בעל החיים (R). הגדלה: פי 40. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. טיפול לאחר הניתוח
- יש לתת קרפרופן (2-5 מ"ג/ק"ג) פעם ביום במשך 4 ימים לאחר הניתוח ופעם אחת לאחר כל סדציה משלימה.
- במשך 24 השעות הראשונות, התבוננו בחיה פעמיים. לאחר מכן, להעריך את החיה ואת הדש לפחות פעם ביום עד סוף המחקר.
הערה: בעל החיים חייב להיות בהיר, ערני ותגובתי. אם יש סימנים לזיהומים אופורטוניסטיים מערכתיים (כלומר, עייפות או ירידה במשקל), יש להרדים את בעל החיים בהתאם לפרוטוקולים מאושרים מוסדיים. - יש לעקוב אחר הדש לנמק מוקדם (לפני קשירה ביום 5 שלאחר הניתוח [POD5]), הלחש באתר הניתוח, זיהום, המטומה, איסכמיה ו/או אוטופגיה של הדש.
- אם יש הלחש באתר הניתוח, יש לכרות את שולי הצלקת, לנקות את האתר עם 10% פובידון-יוד לפני שטיפה יסודית במים סטריליים או מלוחים סטריליים, ולסגור את הפצע באמצעות תפרי ניילון 3-0 קטועים.
- בסוף המחקר, להרדים את החיה עם זריקה IV של 0.1-0.2 מ"ל של 31% נתרן phenobarbital פתרון או עם הפרוטוקול המומלץ על ידי IACUC המקומי. לאשר מוות על ידי היעדר פעימות לב ותנועות נשימה.
תוצאות
כל הדשים היו בני קיימא ב- POD5, והראו כלי דם טובים על ידי SIEA בלבד. איור 5 מראה את הדש לפני ואחרי הזרקת פלואורסצאין בעירוי, ומראה כלי דם מלא.

איור 5: אנגיוגרפיה פלואורסצאין ת?...
Discussion
מאמר זה מתאר מודל דש פשיוקוטוני הניתן לשחזור שנקצר בחולדות, ומאפשר הערכת I.P. פרוטוקול כירורגי שלב אחר שלב זה מעניק לקבוצות מחקר מודל אמין לבדיקת משטרי I.P שונים. על ידי מניעת כל כלי דם מלבד הפדיקול, מודל זה מאפשר לחקור את הניאו-וסקולריזציה של הדש ממיטת הפצע והשוליים. מחקר זה ביצע את הקשירה ב- PO...
Disclosures
לכל המחברים אין אינטרס כלכלי להצהיר.
Acknowledgements
עבודה זו מומנה על ידי בית החולים הכללי של מסצ'וסטס (W.G.A) ו-Shriners Children's Boston (B.U, K.U, C.L.C). Y.B ו- I.F.v.R ממומנים על ידי בתי חולים לילדים (מזהה הצעה: #970280 ו- #857829 בהתאמה).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe Luer-Lok Tip | BD | 309628 | |
| 3-0 Ethilon 18” Black Monofilament Nylon suture | Ethicon | ETH-663H | |
| 8-0 Ethilon 12” Black Monofilament Nylon suture | Ethicon | 1716G | |
| Adson Atraumatic Forceps | Aesculap Surgical Instruments | BD51R | |
| Akorn Fluorescein Injection USP 10% Single Dose Vial 5 mL | Akorn | 17478025310 | |
| Betadine Solution 5% Povidone-Iodine Antiseptic Microbicide | PBS Animal Health | 11205 | |
| Bipolar Cords | ASSI | ASSI.ATK26426 | |
| Buprenorphine Hydrochloride Injection | PAR Pharmaceutical | 3003406C | This concentration needs to be diluted for rodents. |
| Depilatory product – Nair Hair remover lotion | Nair | NC0132811 | |
| Ear tag applier | World Precision Instruments | NC0038715 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | |
| Jewelers Bipolar Forceps Non-Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star elastic stays | Cooper Surgical | 3311-1G | |
| Lone star Self-retaining retractor | Cooper Surgical | 3304G | |
| Metronidazole tablets USP | Teva | 500111-333-06 | |
| Micro spring handle scissors | AROSurgical | 11.603.14 | |
| Microscope (surgical) | Leica | M525 F40 | |
| Microsurgical clamp applying forceps | Ambler Surgical | 31-906 | |
| Microsurgical clamps (x2) | Millennium Surgical | 18-B1V | |
| Microsurgical Dumont #4 forceps | Dumont Swiss made | 1708-4TM-PO | |
| Microsurgical needle holder | ASSI | B-14-8 | |
| Needle holder | World Precision Instruments | 501246 | |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | |
| Pixel analysis software | GNU Image Manipulation Program v2.10 | GIMP | GNU Open licence |
| PrecisionGlide Needle 27 G | BD | 305109 | |
| Ragnell Scissors | Roboz Surgical | RS-6015 | |
| Rimadyl (carprofen) | Zoetis | 10000319 | This concentration needs to be diluted for rodents |
| Scientific Elizabethan collar (e-collar) for Rats | Braintree Scientific | NC9263311 | |
| Small animal ear tag | National Band & Tag Company | Style 1005-1 | |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Sterile towel drape | Dynarex Corporation | 4410 | |
| Sterile water for injection and irrigation | Hospira | 0409488724-1 | |
| Surgical scrub – BD ChloraPrep Hi-Lite Orange 3 mL applicator with Sterile Solution | BD | 930415 | |
| UV lamp | UVP | UVL-56 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
References
- Copelli, C., et al. Management of free flap failure in head and neck surgery. ACTA Otorhinolaryngologica Italica. 37 (5), 387-392 (2017).
- Lese, I., Biedermann, R., Constantinescu, M., Grobbelaar, A. O., Olariu, R. Predicting risk factors that lead to free flap failure and vascular compromise: A single unit experience with 565 free tissue transfers. Journal of Plastic, Reconstructive & Aesthetic Surgery. 74 (3), 512-522 (2021).
- Wang, W., et al. Flap failure and salvage in head and neck reconstruction. Seminars in Plastic Surgery. 34 (4), 314-320 (2020).
- Gabrysz-Forget, F., et al. Free versus pedicled flaps for reconstruction of head and neck cancer defects: a systematic review. Journal of Otolaryngology - Head & Neck Surgery. 48 (1), 13 (2019).
- Sievert, M., et al. Failure of pedicled flap reconstruction in the head and neck area: A case report of a bilateral subclavian artery stenosis. International Journal of Surgery Case Reports. 76, 381-385 (2020).
- Vaienti, L., et al. Failure by congestion of pedicled and free flaps for reconstruction of lower limbs after trauma: the role of negative-pressure wound therapy. Journal of Orthopaedics and Traumatology. 14 (3), 213-217 (2013).
- Murry, C. E., Jennings, R. B., Reimer, K. A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 74 (5), 1124-1136 (1986).
- Akcal, A., et al. Combination of ischemic preconditioning and postconditioning can minimise skin flap loss: experimental study. Journal of Plastic Surgery and Hand Surgery. 50 (4), 233-238 (2016).
- Ulker, P., et al. Does ischemic preconditioning increase flap survival by ADORA2B receptor activation. Clinical Hemorheology and Microcirculation. 75 (2), 151-162 (2020).
- Min, S. -. H., Choe, S. H., Kim, W. S., Ahn, S. -. H., Cho, Y. J. Effects of ischemic conditioning on head and neck free flap oxygenation: a randomized controlled trial. Scientific Reports. 12 (1), 8130 (2022).
- Dacho, A., Lyutenski, S., Aust, G., Dietz, A. Ischemic preconditioning in a rat adipocutaneous flap model. HNO. 57 (8), 829-834 (2009).
- Yildiz, K., et al. Comparison of the flap survival with ischemic preconditioning on different pedicles under varied ischemic intervals in a rat bilateral pedicled flap model. Microsurgery. 34 (2), 129-135 (2014).
- Ottomann, C., Küntscher, M., Hartmann, B., Antonic, V. Ischaemic preconditioning suppresses necrosis of adipocutaneous flaps in a diabetic rat model regardless of the manner of preischaemia induction. Dermatology Research and Practice. 2017, 4137597 (2017).
- Grimaud, J., Murthy, V. N. How to monitor breathing in laboratory rodents: a review of the current methods. Journal of Neurophysiology. 120 (2), 624-632 (2018).
- Strohl, K. P., et al. Ventilation and metabolism among rat strains. Journal of Applied Physiology. 82 (1), 317-323 (1997).
- Mucke, T., et al. Autonomization of epigastric flaps in rats. Microsurgery. 31 (6), 472-478 (2011).
- Hsu, C. -. E., et al. The rat groin flap model redesigned for evaluating treatment effects on ischemia-reperfusion injury. Journal of Surgical Research. 222, 160-166 (2018).
- Mücke, T., et al. Indocyanine green videoangiography-assisted prediction of flap necrosis in the rat epigastric flap using the flow® 800 tool. Microsurgery. 37 (3), 235-242 (2017).
- Wang, D., Chen, W. Indocyanine green angiography for continuously monitoring blood flow changes and predicting perfusion of deep inferior epigastric perforator flap in rats. Journal of Investigative Surgery. 34 (4), 393-400 (2021).
- Berkane, Y., et al. How to secure pedicled flaps using perioperative indocyanine green angiography: a prospective study about 10 cases. World Journal of Surgery and Surgical Research. 4 (1), 1319 (2021).
- Alstrup, T., Christensen, B. O., Damsgaard, T. E. ICG angiography in immediate and delayed autologous breast reconstructions: peroperative evaluation and postoperative outcomes. Journal of Plastic Surgery and Hand Surgery. 52 (5), 307-311 (2018).
- Küntscher, M. V., et al. Ischemic preconditioning by brief extremity ischemia before flap ischemia in a rat model. Plastic and Reconstructive Surgery. 109 (7), 2398-2404 (2002).
- Liu, R. Q., et al. Cost analysis of indocyanine green fluorescence angiography for prevention of anastomotic leakage in colorectal surgery. Surgical Endoscopy. 36 (12), 9281-9287 (2022).
- Cheng, M. H., et al. Devices for ischemic preconditioning of the pedicled groin flap. The Journal of Trauma. 48 (3), 552-557 (2000).
- Xiao, W., et al. An innovative and economical device for ischemic preconditioning of the forehead flap prior to pedicle division: a comparative study. Journal of Reconstructive Microsurgery. 38 (9), 703-710 (2022).
- Küntscher, M. V., Hartmann, B., Germann, G. Remote ischemic preconditioning of flaps: a review. Microsurgery. 25 (4), 346-352 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved