Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Der oberflächliche axiale Lappen der Arteria epigastrica inferior zur Untersuchung ischämischer Präkonditionierungseffekte in einem Rattenmodell
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Entnahme, das Nähen und die Überwachung von fasziokutanen Lappen bei Ratten, die eine gute Visualisierung und Manipulation des Blutflusses durch die oberflächlichen unteren epigastrischen Gefäße durch Klemmen und Ligieren der Oberschenkelgefäße ermöglichen. Dies ist entscheidend für Studien mit ischämischer Präkonditionierung.
Zusammenfassung
Fasciokutane Lappen (FCF) haben sich zum Goldstandard für komplexe Defektrekonstruktionen in der plastischen und rekonstruktiven Chirurgie entwickelt. Diese muskelschonende Technik ermöglicht den Transfer von vaskularisiertem Gewebe, um jeden größeren Defekt abzudecken. FCF kann als gestielte Lappen oder als freie Lappen verwendet werden; In der Literatur liegen die Misserfolgsraten für gestielte FCF und freie FCF jedoch bei über 5%, was Raum für Verbesserungen dieser Techniken und eine weitere Wissenserweiterung in diesem Bereich lässt. Die ischämische Präkonditionierung (I.P.) wurde umfassend untersucht, aber die Mechanismen und die Optimierung des I.P.-Regimes müssen noch bestimmt werden. Dieses Phänomen ist in der plastischen und rekonstruktiven Chirurgie in der Tat wenig erforscht. In dieser Arbeit wird ein chirurgisches Modell vorgestellt, um das I.P.-Regime in einem axialen fasziokutanen Lappenmodell der Ratte zu untersuchen und zu beschreiben, wie die Auswirkungen von I.P. auf das Überleben des Lappens sicher und zuverlässig beurteilt werden können. Dieser Artikel beschreibt den gesamten chirurgischen Eingriff mit Vorschlägen zur Verbesserung der Zuverlässigkeit dieses Modells. Ziel ist es, den Forschern ein reproduzierbares und zuverlässiges Modell zur Verfügung zu stellen, um verschiedene ischämische Präkonditionierungsschemata zu testen und ihre Auswirkungen auf die Überlebensfähigkeit des Lappens zu bewerten.
Einleitung
Die plastische und rekonstruktive Chirurgie entwickelt sich ständig weiter. Die Entwicklung von Muskel-, Fasziokutan- und Perforatorlappen hat es ermöglicht, qualitativ hochwertigere Rekonstruktionen anzubieten und gleichzeitig die Morbidität zu reduzieren. Durch die Kombination dieses verbesserten anatomischen Wissens mit verbesserten technischen Fähigkeiten können rekonstruktive Chirurgen freie Lappentransfers durchführen, wenn sich die Defekte nicht in der Nähe einer lokalen Lösung befinden. Während die Perforatorlappenchirurgie derzeit die fortschrittlichste Technik in der rekonstruktiven Chirurgie ist, berichtet die Literatur von einer Misserfolgsrate von 5 % bei freien Lappentransfers 1,2,3 und bis zu 20 % bei der gestielten Lappenrekonstruktion 4,5,6. Ein teilweises bis vollständiges Versagen des Lappens tritt auf, wenn der Pedikel des Lappens beeinträchtigt ist, daher ist es wichtig, kontinuierlich nach Verbesserungen der aktuellen Techniken zu suchen. Eine der Methoden, um das Überleben des Lappens zu verbessern, besteht darin, die Neovaskularisation auf dem Wundgrund zu fördern und so die Durchblutung durch eine andere Quelle als den Pedikel zu ermöglichen. Die ischämische Präkonditionierung (I.P.) wurde erstmals in einem Herzmodell7 beschrieben, was zeigt, dass ein Organ, das einer kontrollierten Ischämie ausgesetzt ist, in höherem Maße überlebt, nachdem es seine primäre Blutversorgung durch eine Ischämie-induzierte Neovaskularisation verloren hat. Mehrere Autoren haben dieses Grundprinzip untersucht, um das Überleben von Lappen in präklinischen und klinischen Modellen zu optimieren 8,9,10.
Der Vorteil dieser Technik gegenüber anderen Methoden zur Verbesserung des Überlebens des Lappens ist ihre einfache Durchführung, die aus Clamp/Declamp-Tests der Blutquelle besteht. Im Rattenmodell verwendeten frühere Autoren den Lappen der oberflächlichen unteren epigastrischen Arteria (SIEA), um den I.P. zu untersuchen, indem sie den Hauptstiel11,12,13 einklemmten. Nichtsdestotrotz können bei diesem Modell mehrere technische Probleme auftreten, und in der Literatur fehlen gut beschriebene Protokolle.
Daher zielt diese Arbeit darauf ab, den Forschern eine detaillierte Beschreibung einer Ratten-SIEA-Lappenbeschaffungstechnik mit einer erweiterten Dissektion der Femurgefäße zur Verfügung zu stellen, um I.P.-Studien an einem axialen fasziokutanen Lappenmodell zu ermöglichen. Dieses Modell behält die Integrität der epigastrischen Gefäße bei und manipuliert stattdessen die femoralen Gefäße, die widerstandsfähiger sind. Wir teilen unsere Erfahrungen und Werkzeuge, um die Untersuchung dieses Phänomens zu verbessern und die Reproduzierbarkeit dieses Verfahrens zu erhöhen.
Protokoll
Das Massachusetts General Hospital Institutional Animal Care and Use Committee genehmigte das Versuchsprotokoll (IACUC-Protokoll #2022N000099). Die Autoren folgten für diese Arbeit der ARRIVE-Checkliste (Animal Research: Reporting In Vivo Experiments). Alle Tiere wurden gemäß dem Leitfaden des National Institute of Health für die Pflege und Verwendung von Labortieren artgerecht behandelt. Für alle Experimente wurden insgesamt 12 männliche Lewis-Ratten (250-350 g, 8-10 Wochen alt) verwendet.
1. Vorbereitung der Tiere
HINWEIS: Ratten haben eine hohe Stoffwechselrate und begrenzte Fettreserven; Nehmen Sie sie daher vor der Operation nicht schnell ein und schränken Sie das Wasser vor der Operation niemals ein.
- Sedieren Sie das Tier bei allen Verfahren mit 3%-5% Isofluran in der Kammer des Isofluran-Präzisionsverdampfers (siehe Materialtabelle). Wenn das Tier gut sediert ist, senken Sie die Isofluran-Dosis durch einen Nasenkegel auf 1%-3%.
HINWEIS: Ein zweiter Forscher muss die Atemfrequenz kontinuierlich überwachen und die Isofluran-Dosis anpassen. - Legen Sie 2 Tage vor der ersten Operation ein Kunststoff-E-Halsband (in der Größe einer Ratte; siehe Materialtabelle) am Tier an und verwenden Sie eine 3-0-Nylonnaht, um das E-Halsband an der dorsalen und ventralen Seite des Halses des Tieres zu befestigen. Erlauben Sie 2 Tage für die Eingewöhnung an dieses E-Halsband; Es sollte eng anliegen, aber die Atemwege des Tieres nicht behindern.
2. Präoperative Betreuung
- Rasieren Sie am Tag der ersten Operation den unteren vorderen Teil des Bauches und räumen Sie den Bereich vom seitlichen Teil des Tieres bis knapp über die Mittellinie hinaus frei.
- Verwenden Sie dann ein Enthaarungsmittel (Haarentfernungscreme; siehe Materialtabelle), um alle verbleibenden Haare in diesem Bereich (der untere vordere Teil des Bauches, wie im vorherigen Schritt beschrieben) zu entfernen.
- Waschen und trocknen Sie den Bereich gründlich mit chirurgischem Peeling und Betadinlösung (10% Povidon-Jod).
- 0,05 mg/kg Buprenorphin subkutan verabreichen.
3. Intraoperative Überwachung
- Stellen Sie sicher, dass das Tier während der gesamten Operation über einen Präzisionsverdampfer und einen Nasenkegel auf 1%-3% Isofluran bleibt. Überwachen Sie die Atemfrequenz, die Atmung und die Sauerstoffsättigung des Tieres durch visuelle Beobachtung und ein Nagetier-Pulsoximeter, das für eine Ratte entwickelt wurde.
HINWEIS: Die typische Atemfrequenz beträgt 80-90 Zyklen pro Minute14,15. Jede Reaktion, die auf ein während der Operation beobachtetes Bewusstsein hinweist, erfordert eine Erhöhung der Isofluran-Rate. - Legen Sie das Tier für die gesamte Operation auf eine Wärmeunterlage, da die Körpertemperatur der Nagetiere unter Narkose schnell abkühlt.
4. Ernte des epigastrischen Lappens
- Legen Sie das Tier in Rückenlage. Rasieren Sie den Bauch von unterhalb der Leistenfalte bis über das Niveau des Processus xiphoideus.
- Markieren Sie mit einem sterilen Hautstift und Lineal zuerst die Mittellinie des Bauches des Tieres und dann die Leistenfalte. Ein Schnitt entlang der Leistenfalte legt die unteren epigastrischen Gefäße frei, die von den Femurgefäßen abzweigen.
- Zeichnen Sie vor dem Schnitt den zukünftigen Lappen als Oval oder Rechteck bis zu 6 cm vertikal und 3 cm horizontal und kranial von der Leistenfalte aus.
- Zeichne fünf oder sechs äquidistante Markierungen senkrecht zu den Klappenbegrenzungen. Diese dienen als Führungen, um die Haut nach dem Anheben und Wiedervernähen des Lappens besser neu auszurichten (Abbildung 1).
- Machen Sie mit einer Ragnell-Schere (siehe Materialtabelle) einen 3-4 cm langen Schnitt in der Leistenfalte.
Anmerkungen: Forscher sollten vorsichtig sein und die Haut nach oben ziehen, um eine Beschädigung der Gefäße zu vermeiden. - Freilegen und identifizieren Sie die femoralen und epigastrischen Gefäße mit der mikrochirurgischen Pinzette #4 jewelers (siehe Materialtabelle), indem Sie die Pinzette öffnen und schließen, um die Faszien zu trennen und Zugang zu den Gefäßen zu erhalten, die sich unter dem Leistenfettpolster befinden.
- Verwenden Sie den Leistenschnitt, um den Lappenschnitt mit der Ragnell-Schere zu beginnen. Achten Sie darauf, die volle Dicke der Haut und des Bindegewebes über dem Bauchmuskel zu untergraben.
- Um die Lappenentnahme zu erleichtern, stellen Sie sicher, dass die Schere der richtigen Dissektionsebene folgt, indem Sie in Richtung des Muskels drücken und die Klingen der Schere spreizen. Führen Sie diese Klappenuntergrabung durch, indem Sie sich in einer koordinierten Richtung um die Klappenzeichnung bewegen.
Anmerkungen: Um die richtige Ebene zu bestimmen, sollten keine Mikrogefäße unterhalb der Präparierebene vorhanden sein.
- Um die Lappenentnahme zu erleichtern, stellen Sie sicher, dass die Schere der richtigen Dissektionsebene folgt, indem Sie in Richtung des Muskels drücken und die Klingen der Schere spreizen. Führen Sie diese Klappenuntergrabung durch, indem Sie sich in einer koordinierten Richtung um die Klappenzeichnung bewegen.
- Wenn die anfängliche Spitze des Lappens von der umgebenden Haut befreit ist, setzen Sie die Lappenbeschaffung fort, indem Sie vom distalen zum proximalen Teil untergraben, indem Sie die Ragnell-Scherenspitzen verwenden, um den Lappen vom Muskel zu trennen, während Sie alle Perforationsgefäße und dermalen Plexusgefäße um den Lappen herum kauterisieren. Dadurch wird sichergestellt, dass das gesamte Blut über die epigastrischen Gefäße zum Lappen fließt.
Anmerkungen: Es muss darauf geachtet werden, dass das Lappengefäßsystem nicht durch zu starkes Ziehen oder Verdrehen der Haut während der Entnahme des Lappens beschädigt wird. Es wird empfohlen, den befreiten Teil des Lappens vorsichtig über den Daumen der Hand des Chirurgen zu legen, während am proximalen Teil des Lappens gearbeitet wird. - Sobald der Lappen vollständig geerntet ist, sind die Äste der oberflächlichen unteren epigastrischen Gefäße auf der tiefen Seite der Haut sichtbar. Versuchen Sie, die Gesamtheit beider Zweige der SIEA mit der Klappe einzukapseln, indem Sie die Klappe vorsichtig nach oben heben, um die Gefäße zu visualisieren.
- Sobald der Lappen geerntet ist, trennen Sie die Fettpolster auf der unteren Seite sowohl auf der medialen als auch auf der lateralen Seite des Lappens. Verwenden Sie die bipolare Kauterisation (siehe Materialtabelle), um die Fettpolster in der Nähe des Einschnittsrandes zu kauterisieren, wobei darauf zu achten ist, den oberflächlichen unteren epigastrischen Pedikel nicht zu beschädigen (Abbildung 2).
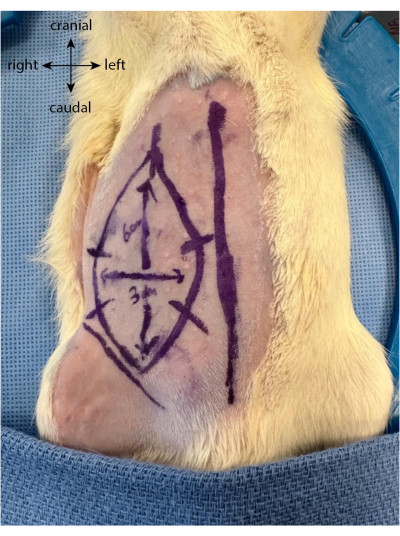
Abbildung 1: Lappenzeichnung auf dem Hinterleib des Tieres. Die Mittellinie wird als Markierung verwendet, um die Position des epigastrischen Lappens zu lokalisieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
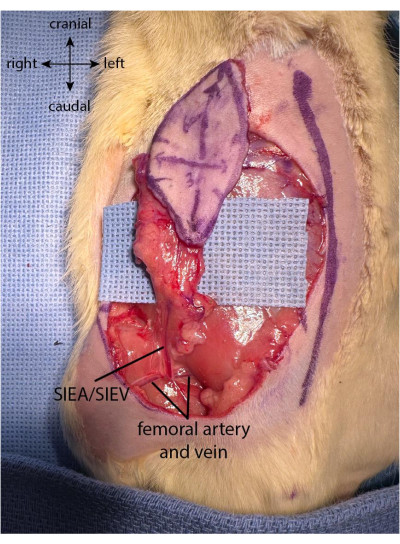
Abbildung 2: Klappe voll hochgeklappt. Das Fettpolster wird im proximalen Teil des Lappens erhalten, um die Vaskularisierung aus dem oberflächlichen unteren epigastrischen Pedikel zu erhalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
5. Gefäßpräparation und Ischämie-Induktion
HINWEIS: Der Lappen ist in diesem Stadium vollständig geerntet, aber die Gefäße sind noch nicht für die ischämische Vorkonditionierung vorbereitet.
- Injizieren Sie vor der Vorbereitung der Hüftgefäße eine Einzeldosis von 17,5 I.E. Natriumheparin über die Penisvene.
HINWEIS: Diese Injektion erfolgt durch Freilegen der Eichel, Halten des Penis von außen mit einer atraumatischen Adson-Pinzette, Identifizierung der Penisvene und Injektion oberflächlich und entlang der Penisvene mit einer 27-G-Spritze. - Um eine bessere Belichtung zu erzielen, legen Sie das Tier in einen selbsthaltenden Lone Star-Retraktor (siehe Materialtabelle).
Anmerkungen: Die elastischen Streben von Lone Star ziehen die Haut von der Operationsstelle weg und ermöglichen so eine bessere Sicht auf die Gefäße. Der Forscher muss nun unter einem Operationsmikroskop (40-fache Vergrößerung) arbeiten. - Um die Gefäße freizulegen, verwenden Sie zwei mikrochirurgische Pinzetten #4, um die Femurgefäße sowohl proximal als auch distal zum Auftreten der oberflächlichen epigastrischen Gefäße zu präparieren. Halten Sie die Gefäße nicht direkt, sondern trennen Sie das Bindegewebe mit der Pinzette sanft Schicht für Schicht, indem Sie die Pinzette senkrecht zu den Gefäßen öffnen und schließen.
- Reinigen Sie an den distalen Femurgefäßen die Faszie und befreien Sie den Nerv sanft von Arterie und Vene. Mit einem 8-0 Nylonnaht (siehe Materialtabelle), ligieren Sie die distalen Femurgefäße durch Umgehung des mikrochirurgischen Nadelhalters unter Arterie und Vene, umklammern Sie die Naht und binden Sie diese Gefäße ab (Abbildung 3). Der Nerv darf weder verletzt noch gebunden werden, um die postoperative Morbidität zu minimieren.
HINWEIS: Chirurgen können eine der Pinzetten verwenden, um die Faszie mit einer Hand sanft seitlich des Nervs zu ziehen, und eine andere Hand verwenden, um den Nerv vollständig von den Gefäßen zu trennen. - Mit einem 8-0 Naht, ligieren Sie die distalen Gefäße direkt nach dem Auftauchen der epigastrischen Gefäße, wobei ein Abstand von 1 mm nach dem Pedikelursprung verbleibt. Dadurch wird sichergestellt, dass während der ischämischen Phasen kein Rückfluss aus den tiefen Ästen durch die SIEA kommt.
HINWEIS: Abbildung 3 zeigt die ligierten distalen Femurgefäße nach dem Auftauchen des SIEA-Pedikels. - Wiederholen Sie an den proximalen Femurgefäßen den gleichen Vorgang der Reinigung des Bindegewebes. Trennen Sie jedoch die Arterie und die Vene voneinander, um eine effiziente Abklemmung zu ermöglichen. Dies kann erreicht werden, indem eine geschlossene Pinzette sanft zwischen Arterie und Vene platziert und die Zange langsam in Laufrichtung der Gefäße geöffnet wird.
- Um eine intermittierende Ischämie zu induzieren, platzieren Sie mikrochirurgische Klemmen separat an jeder proximalen Femoralarterie und -vene (Abbildung 4).
- Wenn die ischämischen Verletzungen abgeschlossen sind, wird der Lappen in seine ursprüngliche Position genäht, wobei die Markierungen wie präoperativ gezeichnet ausgerichtet werden (Schritt 4.2.2). Nähen Sie den Lappen mit einer Laufnaht aus 3-0 Nylon (siehe Materialtabelle), beginnend an der Leistenfalte medial, um den Lappen herum und endend an der Leistenfalte lateral.
HINWEIS: Entlang der Leistenfalte kann dieselbe Naht verwendet werden, um unterbrochene Nähte zu platzieren. Dies ermöglicht es den Forschern, diesen Bereich zu öffnen, ohne den Klappenverschluss zu beeinträchtigen. - Um die Blutversorgung des Lappens zu überprüfen, injizieren Sie 0,25 ml steriles Fluorescein-Natrium (10 %, siehe Materialtabelle) in die Penisvene mit der gleichen Technik und den gleichen Werkzeugen, die für die Injektion von Heparin-Kochsalzlösung (Schritt 5.1) beschrieben sind. Leuchten Sie nach 3 Minuten mit einer langwelligen UV-366 nm-Lampe (Fluorescein-Anregungslicht), um die fluoreszierenden Bereiche freizulegen, die den durchbluteten Bereichen entsprechen.
- Verteilen Sie nach dem Verschluss und der Überprüfung zerkleinertes Metronidazol (siehe Materialtabelle) entlang der Nähte, um eine Selbstverstümmelung zu verhindern, und sprühen Sie einen flüssigen Verband in denselben Bereich.
- Bevor sich das Tier von der Narkose erholt, verabreichen Sie Carprofen (2-5 mg/kg) subkutan.
- Die Forscher können nun auf die Femurgefäße, die einzige Nahrungsquelle für den Lappen, zugreifen, um experimentelle ischämische Präkonditionierungsschemata für mehrere Tage hintereinander zu testen. Verabreichen Sie an jedem Tag der Operation eine Dosis von 2-5 mg/kg Carprofen subkutan.
- Um den Lappen am Ende der ischämischen Präkonditionierungsphase aus der epigastrischen Blutversorgung zu entfernen, wird der Lappen unterhalb des Fettpolsters entlang des unteren Randes des Lappens verätzt.
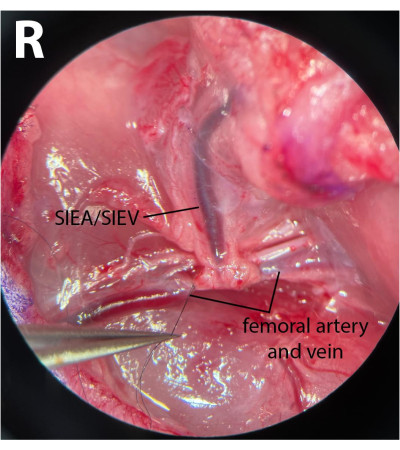
Abbildung 3: Mikroskopische Ansicht der Femurgefäße. Die distalen Femurgefäße werden gebunden. Der Nerv ist erhalten geblieben. Die Präparierseite ist die rechte Leistenfalte (R). Vergrößerung: 40x. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
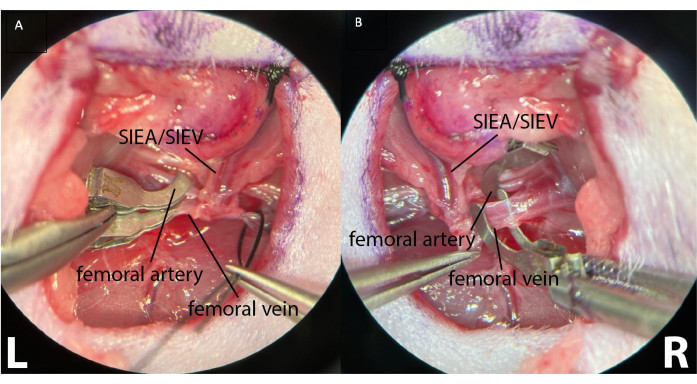
Abbildung 4: Klemmung der proximalen Femurgefäße mit zwei separaten mikrochirurgischen Klemmen. Dies ermöglicht eine bessere Kontrolle der Klemmung und stellt sicher, dass kein arterieller und retrograder venöser Fluss vorhanden ist. (A) zeigt die beiden linken (L) Femurgefäße, die eingespannt sind. Die oberflächlichen inferioren epigastrischen Gefäße sind sichtbar (SIEA/SIEV). (B) zeigt eine abgeklemmte Oberschenkelarterie und eine Oberschenkelvene vor der Klemmung an der rechten Leistenfalte des Tieres (R). Vergrößerung: 40x. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
6. Nachsorge
- Carprofen (2-5 mg/kg) subkutan verabreichen Sie Carprofen (2-5 mg/kg) einmal täglich für 4 Tage postoperativ und einmal nach einer zusätzlichen Sedierung.
- Beobachten Sie das Tier in den ersten 24 Stunden zweimal. Beurteilen Sie dann das Tier und den Lappen mindestens einmal täglich bis zum Ende der Studie.
Anmerkungen: Das Tier muss aufgeweckt, wachsam und reaktiv sein. Wenn es Anzeichen einer systemischen opportunistischen Infektion gibt (z. B. Lethargie oder Gewichtsverlust), sollte das Tier gemäß den von der Einrichtung genehmigten Protokollen eingeschläfert werden. - Überwachen Sie den Lappen auf frühe Nekrose (vor der Ligatur am 5. postoperativen Tag [POD5]), Dehiszenz an der Operationsstelle, Infektionen, Hämatome, Ischämie und/oder Autophagie des Lappens.
- Wenn eine Dehiszenz an der Operationsstelle vorliegt, entfernen Sie die Narbenränder, reinigen Sie die Stelle mit 10 % Povidon-Jod, bevor Sie sie gründlich mit sterilem Wasser oder steriler Kochsalzlösung spülen, und verschließen Sie die Wunde mit unterbrochenen 3-0-Nylonnähten.
- Am Ende der Studie wird das Tier mit einer intravenösen Injektion von 0,1-0,2 ml 31%iger Natrium-Phenobarbital-Lösung oder mit dem von der örtlichen IACUC empfohlenen Protokoll eingeschläfert. Bestätigen Sie den Tod durch das Ausbleiben von Herzschlag und Atembewegungen.
Ergebnisse
Alle Lappen waren auf POD5 lebensfähig und zeigten eine gute Vaskularisation durch die SIEA allein. Abbildung 5 zeigt den Lappen vor und nach der intravenösen Fluorescein-Injektion und zeigt eine vollständige Vaskularisation.

Abbildung 5: Sofortige intravenöse Fluoreszenzangiographie (POD0).
Diskussion
Dieser Artikel beschreibt ein reproduzierbares fasziokutanes Lappenmodell, das bei Ratten geerntet wurde und eine I.P.-Evaluierung ermöglicht. Dieses Schritt-für-Schritt-Operationsprotokoll gibt Forschungsgruppen ein zuverlässiges Modell an die Hand, um verschiedene I.P.-Therapien zu testen. Durch die Verhinderung einer anderen Vaskularisation als des Pedikels ermöglicht dieses Modell die Untersuchung der Neovaskularisation des Lappens vom Wundbett und -rand aus. In dieser Studie wurde die Ligatur an POD5 durchgefüh...
Offenlegungen
Alle Autoren haben kein finanzielles Interesse zu deklarieren.
Danksagungen
Diese Arbeit wurde vom Massachusetts General Hospital (W.G.A.) und Shriners Children's Boston (B.U, K.U, C.L.C.) finanziert. Y.B und I.F.v.R werden von den Shriners Hospitals for Children finanziert (Vorschlags-ID: #970280 bzw. #857829).
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe Luer-Lok Tip | BD | 309628 | |
| 3-0 Ethilon 18” Black Monofilament Nylon suture | Ethicon | ETH-663H | |
| 8-0 Ethilon 12” Black Monofilament Nylon suture | Ethicon | 1716G | |
| Adson Atraumatic Forceps | Aesculap Surgical Instruments | BD51R | |
| Akorn Fluorescein Injection USP 10% Single Dose Vial 5 mL | Akorn | 17478025310 | |
| Betadine Solution 5% Povidone-Iodine Antiseptic Microbicide | PBS Animal Health | 11205 | |
| Bipolar Cords | ASSI | ASSI.ATK26426 | |
| Buprenorphine Hydrochloride Injection | PAR Pharmaceutical | 3003406C | This concentration needs to be diluted for rodents. |
| Depilatory product – Nair Hair remover lotion | Nair | NC0132811 | |
| Ear tag applier | World Precision Instruments | NC0038715 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | |
| Jewelers Bipolar Forceps Non-Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star elastic stays | Cooper Surgical | 3311-1G | |
| Lone star Self-retaining retractor | Cooper Surgical | 3304G | |
| Metronidazole tablets USP | Teva | 500111-333-06 | |
| Micro spring handle scissors | AROSurgical | 11.603.14 | |
| Microscope (surgical) | Leica | M525 F40 | |
| Microsurgical clamp applying forceps | Ambler Surgical | 31-906 | |
| Microsurgical clamps (x2) | Millennium Surgical | 18-B1V | |
| Microsurgical Dumont #4 forceps | Dumont Swiss made | 1708-4TM-PO | |
| Microsurgical needle holder | ASSI | B-14-8 | |
| Needle holder | World Precision Instruments | 501246 | |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | |
| Pixel analysis software | GNU Image Manipulation Program v2.10 | GIMP | GNU Open licence |
| PrecisionGlide Needle 27 G | BD | 305109 | |
| Ragnell Scissors | Roboz Surgical | RS-6015 | |
| Rimadyl (carprofen) | Zoetis | 10000319 | This concentration needs to be diluted for rodents |
| Scientific Elizabethan collar (e-collar) for Rats | Braintree Scientific | NC9263311 | |
| Small animal ear tag | National Band & Tag Company | Style 1005-1 | |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Sterile towel drape | Dynarex Corporation | 4410 | |
| Sterile water for injection and irrigation | Hospira | 0409488724-1 | |
| Surgical scrub – BD ChloraPrep Hi-Lite Orange 3 mL applicator with Sterile Solution | BD | 930415 | |
| UV lamp | UVP | UVL-56 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Referenzen
- Copelli, C., et al. Management of free flap failure in head and neck surgery. ACTA Otorhinolaryngologica Italica. 37 (5), 387-392 (2017).
- Lese, I., Biedermann, R., Constantinescu, M., Grobbelaar, A. O., Olariu, R. Predicting risk factors that lead to free flap failure and vascular compromise: A single unit experience with 565 free tissue transfers. Journal of Plastic, Reconstructive & Aesthetic Surgery. 74 (3), 512-522 (2021).
- Wang, W., et al. Flap failure and salvage in head and neck reconstruction. Seminars in Plastic Surgery. 34 (4), 314-320 (2020).
- Gabrysz-Forget, F., et al. Free versus pedicled flaps for reconstruction of head and neck cancer defects: a systematic review. Journal of Otolaryngology - Head & Neck Surgery. 48 (1), 13 (2019).
- Sievert, M., et al. Failure of pedicled flap reconstruction in the head and neck area: A case report of a bilateral subclavian artery stenosis. International Journal of Surgery Case Reports. 76, 381-385 (2020).
- Vaienti, L., et al. Failure by congestion of pedicled and free flaps for reconstruction of lower limbs after trauma: the role of negative-pressure wound therapy. Journal of Orthopaedics and Traumatology. 14 (3), 213-217 (2013).
- Murry, C. E., Jennings, R. B., Reimer, K. A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 74 (5), 1124-1136 (1986).
- Akcal, A., et al. Combination of ischemic preconditioning and postconditioning can minimise skin flap loss: experimental study. Journal of Plastic Surgery and Hand Surgery. 50 (4), 233-238 (2016).
- Ulker, P., et al. Does ischemic preconditioning increase flap survival by ADORA2B receptor activation. Clinical Hemorheology and Microcirculation. 75 (2), 151-162 (2020).
- Min, S. -. H., Choe, S. H., Kim, W. S., Ahn, S. -. H., Cho, Y. J. Effects of ischemic conditioning on head and neck free flap oxygenation: a randomized controlled trial. Scientific Reports. 12 (1), 8130 (2022).
- Dacho, A., Lyutenski, S., Aust, G., Dietz, A. Ischemic preconditioning in a rat adipocutaneous flap model. HNO. 57 (8), 829-834 (2009).
- Yildiz, K., et al. Comparison of the flap survival with ischemic preconditioning on different pedicles under varied ischemic intervals in a rat bilateral pedicled flap model. Microsurgery. 34 (2), 129-135 (2014).
- Ottomann, C., Küntscher, M., Hartmann, B., Antonic, V. Ischaemic preconditioning suppresses necrosis of adipocutaneous flaps in a diabetic rat model regardless of the manner of preischaemia induction. Dermatology Research and Practice. 2017, 4137597 (2017).
- Grimaud, J., Murthy, V. N. How to monitor breathing in laboratory rodents: a review of the current methods. Journal of Neurophysiology. 120 (2), 624-632 (2018).
- Strohl, K. P., et al. Ventilation and metabolism among rat strains. Journal of Applied Physiology. 82 (1), 317-323 (1997).
- Mucke, T., et al. Autonomization of epigastric flaps in rats. Microsurgery. 31 (6), 472-478 (2011).
- Hsu, C. -. E., et al. The rat groin flap model redesigned for evaluating treatment effects on ischemia-reperfusion injury. Journal of Surgical Research. 222, 160-166 (2018).
- Mücke, T., et al. Indocyanine green videoangiography-assisted prediction of flap necrosis in the rat epigastric flap using the flow® 800 tool. Microsurgery. 37 (3), 235-242 (2017).
- Wang, D., Chen, W. Indocyanine green angiography for continuously monitoring blood flow changes and predicting perfusion of deep inferior epigastric perforator flap in rats. Journal of Investigative Surgery. 34 (4), 393-400 (2021).
- Berkane, Y., et al. How to secure pedicled flaps using perioperative indocyanine green angiography: a prospective study about 10 cases. World Journal of Surgery and Surgical Research. 4 (1), 1319 (2021).
- Alstrup, T., Christensen, B. O., Damsgaard, T. E. ICG angiography in immediate and delayed autologous breast reconstructions: peroperative evaluation and postoperative outcomes. Journal of Plastic Surgery and Hand Surgery. 52 (5), 307-311 (2018).
- Küntscher, M. V., et al. Ischemic preconditioning by brief extremity ischemia before flap ischemia in a rat model. Plastic and Reconstructive Surgery. 109 (7), 2398-2404 (2002).
- Liu, R. Q., et al. Cost analysis of indocyanine green fluorescence angiography for prevention of anastomotic leakage in colorectal surgery. Surgical Endoscopy. 36 (12), 9281-9287 (2022).
- Cheng, M. H., et al. Devices for ischemic preconditioning of the pedicled groin flap. The Journal of Trauma. 48 (3), 552-557 (2000).
- Xiao, W., et al. An innovative and economical device for ischemic preconditioning of the forehead flap prior to pedicle division: a comparative study. Journal of Reconstructive Microsurgery. 38 (9), 703-710 (2022).
- Küntscher, M. V., Hartmann, B., Germann, G. Remote ischemic preconditioning of flaps: a review. Microsurgery. 25 (4), 346-352 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten