Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Поверхностный осевой лоскут нижней эпигастральной артерии для изучения эффектов ишемического прекондиционирования на крысиной модели
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает сбор, наложение швов и мониторинг кожно-фасциальных лоскутов у крыс, которые позволяют хорошо визуализировать и манипулировать кровотоком через поверхностные нижние эпигастральные сосуды посредством пережатия и лигирования бедренных сосудов. Это имеет решающее значение для исследований, связанных с ишемическим прекондиционированием.
Аннотация
Фасциокожные лоскуты (ФКЗ) стали золотым стандартом комплексной реконструкции дефектов в пластической и реконструктивной хирургии. Этот метод сохранения мышц позволяет переносить васкуляризированные ткани для покрытия любого крупного дефекта. FCF можно использовать в виде лоскутов на ножках или в виде свободных лоскутов; однако в литературе частота неудач для педикулярного FCF и свободного FCF превышает 5%, оставляя возможности для улучшения этих методов и дальнейшего расширения знаний в этой области. Ишемическое прекондиционирование (ВП) широко изучено, но механизмы и оптимизация режима ВП еще предстоит определить. Это явление действительно мало изучено в пластической и реконструктивной хирургии. Здесь представлена хирургическая модель для изучения режима внутримышечного введения в модели осевого фасциокожного лоскута крысы, описывающая, как безопасно и надежно оценить влияние внутримышечного вмешательства на выживаемость лоскута. В этой статье описывается вся хирургическая процедура, включая предложения по повышению надежности этой модели. Цель состоит в том, чтобы предоставить исследователям воспроизводимую и надежную модель для тестирования различных схем ишемического прекондиционирования и оценки их влияния на выживаемость лоскута.
Введение
Пластическая и реконструктивная хирургия постоянно развивается. Развитие мышечных, кожно-фасциологических и перфораторных лоскутов позволило проводить более качественные реконструкции при одновременном снижении заболеваемости. Сочетая эти улучшенные анатомические знания с улучшенными техническими навыками, реконструктивные хирурги могут выполнять свободные переносы лоскута, когда дефекты не близки к какому-либо локальному решению. Однако, несмотря на то, что перфораторная лоскутная хирургия в настоящее время является наиболее передовой техникой в реконструктивной хирургии, в литературе сообщается о 5% неудачах при переносе свободного лоскута 1,2,3 и до 20% при реконструкции лоскута на ножке 4,5,6. Частичное или полное разрушение лоскута происходит, когда ножка лоскута скомпрометирована, поэтому важно постоянно искать улучшения в существующих методах. Одним из методов улучшения приживаемости лоскута является содействие его неоваскуляризации на раневом ложе, что позволяет перфузию от источника, отличного от ножки. Ишемическое прекондиционирование (ИП) было первоначально описано на моделисердца 7, демонстрируя, что орган, подвергшийся контролируемой ишемии, выживает в более высокой степени после потери первичного кровоснабжения в результате неоваскуляризации, вызванной ишемией. Несколько авторов изучили этот краеугольный принцип для оптимизации выживаемости лоскутов в доклинических и клинических моделях 8,9,10.
Преимуществом этого метода перед другими методами улучшения выживаемости лоскута является простота его реализации, состоящая из зажимных/деламповых тестов источника крови. В модели крысы предыдущие авторы использовали лоскут поверхностной нижней эпигастральной артерии (SIEA) для изучения I.P. путем зажима главной ножки11,12,13. Тем не менее, с этой моделью можно столкнуться с несколькими техническими проблемами, и в литературе отсутствуют хорошо описанные протоколы.
Таким образом, эта работа направлена на то, чтобы предоставить исследователям подробное описание метода получения лоскута SIEA крысы с расширенным рассечением бедренных сосудов, чтобы позволить проводить внутримышечные исследования на модели осевого фасциокожного лоскута. Эта модель сохраняет целостность эпигастральных сосудов и вместо этого манипулирует бедренными сосудами, которые более устойчивы. Мы делимся своим опытом и инструментами для улучшения изучения этого явления и повышения воспроизводимости этой процедуры.
протокол
Комитет по уходу за животными и их использованию Массачусетской больницы общего профиля одобрил экспериментальный протокол (протокол IACUC #2022N000099). Авторы следовали контрольному списку рекомендаций COME (Animal Research: Reporting In Vivo Experiments) для этой работы. Все животные получали гуманный уход в соответствии с Руководством Национального института здравоохранения по уходу и использованию лабораторных животных. Всего для всех экспериментов использовали 12 самцов крыс Льюиса (250-350 г, возраст 8-10 недель).
1. Подготовка животных
ПРИМЕЧАНИЕ: Крысы имеют высокую скорость метаболизма и ограниченные запасы жира; Поэтому не делайте их быстро перед операцией и никогда не ограничивайте воду перед операцией.
- Для всех процедур успокаивайте животное с помощью 3%-5% изофлурана в камере прецизионного испарителя изофлурана (см. Таблицу материалов). Когда животное хорошо успокоено, понизьте дозу изофлурана до 1-3% через носовой конус.
ПРИМЕЧАНИЕ: Второй исследователь должен постоянно контролировать частоту дыхания и адаптировать дозу изофлурана. - За 2 дня до первоначальной операции наденьте на животное пластиковый электронный ошейник (размером с крысу; см. Таблицу материалов) и используйте нейлоновый шов 3-0, чтобы закрепить электронный ошейник на дорсальной и брюшной сторонах шеи животного. Подождите 2 дня для акклиматизации к этому электронному ошейнику; Он должен плотно прилегать, но не загораживать дыхательные пути животного.
2. Предоперационный уход
- В день первоначальной операции побрейте нижнюю переднюю часть живота, очистив область от боковой части животного до небольшого расстояния за среднюю линию.
- Затем используйте средство для депиляции (крем для удаления волос; см. Таблицу материалов), чтобы удалить все оставшиеся волосы в этой области (нижняя передняя часть живота, как описано на предыдущем шаге).
- Тщательно вымойте и высушите область хирургическим скрабом и раствором бетадина (10% повидон-йод).
- Вводят 0,05 мг/кг бупренорфина подкожно.
3. Интраоперационный мониторинг
- Убедитесь, что животное остается на 1-3% изофлурана с помощью прецизионного испарителя и носового конуса на протяжении всей операции. Контролируйте частоту дыхания, дыхания и уровень насыщения кислородом животного с помощью визуального наблюдения и пульсоксиметра грызунов, сделанного для крысы.
ПРИМЕЧАНИЕ: Типичная частота дыхания составляет 80-90 циклов в минуту14,15. Любая реакция, указывающая на сознание, наблюдаемая во время операции, требует увеличения скорости изофлурана. - Поместите животное на грелку на всю операцию, так как температура тела грызунов быстро охлаждается под наркозом.
4. Забор эпигастрального лоскута
- Поместите животное в положение лежа на спине. Побрейте живот снизу паховой складки до уровня мечевидного отростка.
- Используя ручку из стерильной кожи и линейку, сначала отметьте среднюю линию живота животного, а затем паховую складку. Разрез вдоль линии паховой складки обнажает нижние эпигастральные сосуды, ответвляющиеся от бедренных сосудов.
- Перед разрезом нарисуйте будущий лоскут в виде овала или прямоугольника до 6 см по вертикали и 3 см по горизонтали, вытягиваясь краниально от паховой складки.
- Нарисуйте пять или шесть равноудаленных отметок, перпендикулярных границам закрылка. Они служат направляющими для лучшего выравнивания кожи после того, как лоскут был поднят и сшит обратно на место (рис. 1).
- С помощью ножниц Рагнелля (см. Таблицу материалов) сделайте продольный разрез 3-4 см на паховой складке.
ПРИМЕЧАНИЕ: Исследователи должны соблюдать осторожность и тянуть кожу вверх, чтобы не повредить сосуды. - Обнажите и идентифицируйте бедренные и эпигастральные сосуды с помощью микрохирургических щипцов #4 jewelers (см. Таблицу материалов), открывая и закрывая щипцы, чтобы отделить фасцию и получить доступ к сосудам, которые находятся под паховым жировым пакетом.
- Используйте паховый разрез, чтобы начать разрез лоскута с помощью ножниц Рагнелла. Обратите внимание на подрыв всей толщины кожи и соединительной ткани над мышцами живота.
- Чтобы облегчить сбор лоскутов, убедитесь, что ножницы следуют правильной плоскости рассечения, подталкивая к мышце и раздвигая лезвия ножниц. Выполните этот подрыв закрылка, двигаясь в скоординированном направлении вокруг чертежа закрылка.
ПРИМЕЧАНИЕ: Чтобы определить правильную плоскость, ниже плоскости рассечения не должно оставаться микрососудов.
- Чтобы облегчить сбор лоскутов, убедитесь, что ножницы следуют правильной плоскости рассечения, подталкивая к мышце и раздвигая лезвия ножниц. Выполните этот подрыв закрылка, двигаясь в скоординированном направлении вокруг чертежа закрылка.
- По мере того, как начальный кончик лоскута освобождается от окружающей кожи, продолжайте захват лоскута, подрывая его от дистального отдела к проксимальному отделу, используя кончики ножниц Рагнелла, чтобы отделить лоскут от мышцы, прижигая любые перфораторные сосуды и сосуды дермального сплетения вокруг лоскута. Это обеспечивает приток всей крови к лоскуту через эпигастральные сосуды.
ПРИМЕЧАНИЕ: Необходимо обратить внимание на то, чтобы не повредить сосудистую сеть лоскута, слишком сильно потянув или скрутив кожу во время сбора лоскута. Рекомендуется осторожно поместить освобожденную часть лоскута на большой палец руки хирурга, работая над проксимальной частью лоскута. - После того, как лоскут полностью собран, ветви поверхностных нижних эпигастральных сосудов видны на глубокой стороне кожи. Стремитесь инкапсулировать все обе ветви SIEA с помощью лоскута, осторожно поднимая клапан вверх, чтобы визуализировать сосуды.
- После того, как лоскут собран, отделите жировые подушечки на нижней стороне как на медиальной, так и на латеральной сторонах лоскута. Используйте биполярное прижигание (см. Таблицу материалов), чтобы прижечь жировые подушечки близко к границе разреза, обращая при этом внимание на то, чтобы не повредить поверхностную нижнюю эпигастральную ножку (рис. 2).
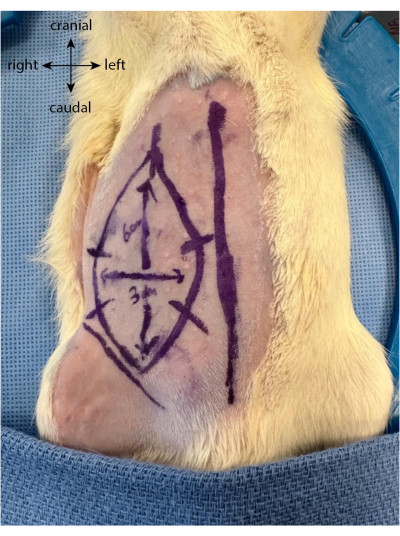
Рисунок 1: Рисунок лоскута на животе животного. Средняя линия используется в качестве маркера для определения местоположения эпигастрального лоскута. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
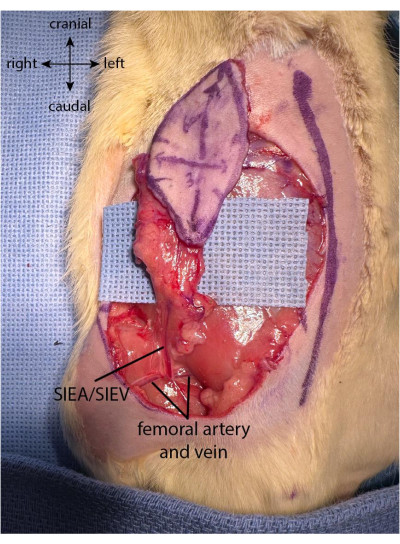
Рисунок 2: Закрылок полностью приподнят. Жировая подушка сохраняется в проксимальной части лоскута, чтобы сохранить васкуляризацию, идущую из поверхностной нижней эпигастральной ножки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Препарирование сосудов и индукция ишемии
ПРИМЕЧАНИЕ: Лоскут полностью собран на этом этапе, но сосуды еще не подготовлены к ишемическому предварительному кондиционированию.
- Перед подготовкой бедренного сосуда введите однократную дозу 17,5 МЕ гепарина натрия через вену полового члена.
ПРИМЕЧАНИЕ: Эта инъекция выполняется путем обнажения головки полового члена, удержания полового члена снаружи с помощью атравматических щипцов Adson, идентификации вены полового члена и введения поверхностно и вдоль вены полового члена с помощью шприца 27 г. - Чтобы создать лучшую экспозицию, поместите животное в самоудерживающийся ретрактор Lone Star (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Эластичные стойки Lone Star оттягивают кожу от места операции, обеспечивая лучший обзор сосудов. Теперь исследователь должен работать под хирургическим микроскопом (40-кратное увеличение). - Чтобы обнажить сосуды, используйте два микрохирургических щипца #4, чтобы рассечь бедренные сосуды как проксимально, так и дистально до появления поверхностных эпигастральных сосудов. Не держите сосуды напрямую, а вместо этого используйте щипцы, чтобы аккуратно отделить соединительную ткань слой за слоем, открывая и закрывая щипцы вертикально по отношению к сосудам.
- На дистальных бедренных сосудах очистите фасцию и аккуратно освободите нерв от артерии и вены. Использование 8-0 нейлоновый шов (см. Таблицу материалов), перевязать дистальные бедренные сосуды, обойдя микрохирургический иглодержатель под артерией и веной, обхватив шов и перевязав эти сосуды (рис. 3). Нерв не должен быть поврежден или перевязан, чтобы свести к минимуму послеоперационную заболеваемость.
ПРИМЕЧАНИЕ: Хирурги могут использовать один из щипцов, чтобы аккуратно потянуть фасцию латерально к нерву одной рукой, и использовать другую пару, чтобы полностью отделить нерв от сосудов. - Использование 8-0 Шов, перевязка дистальных сосудов сразу после появления эпигастральных сосудов, оставляя расстояние в 1 мм после начала ножки. Это гарантирует, что обратный поток не проходит через SIEA из глубоких ветвей во время ишемических фаз.
ПРИМЕЧАНИЕ: На рисунке 3 показаны перевязанные дистальные сосуды бедренной кости после появления ножки SIEA. - На проксимальном отделе бедренных сосудов повторите тот же процесс очистки соединительной ткани. Тем не менее, отделите артерию и вену друг от друга, чтобы обеспечить эффективное пережатие. Этого можно достичь, осторожно поместив закрытые щипцы между артерией и веной и медленно открыв щипцы в направлении движения сосудов.
- Чтобы вызвать перемежающуюся ишемию, установите микрохирургические зажимы отдельно на каждую проксимальную бедренную артерию и вену (рис. 4).
- Когда ишемические повреждения будут завершены, зашите лоскут в исходное положение, выровняв отметины, нарисованные до операции (шаг 4.2.2). Зашить лоскут с помощью бегового шва из нейлона 3-0 (см. Таблицу материалов), начиная с паховой складки медиально, вокруг лоскута и заканчивая паховой складкой сбоку.
ПРИМЕЧАНИЕ: Вдоль паховой складки тот же шов можно использовать для наложения прерывистых швов. Это позволяет исследователям открывать эту область, не влияя на закрытие клапана. - Чтобы проверить кровоснабжение лоскута, введите 0,25 мл стерильного флуоресцеина натрия (10%, см. Таблицу материалов) в вену полового члена, используя ту же технику и инструменты, которые описаны для инъекции физиологического раствора гепарина (этап 5.1). Через 3 минуты посветите длинноволновой лампой УФ-366 нм (флуоресцеиновый возбуждающий свет), чтобы выявить флуоресцентные области, соответствующие перфузируемым участкам.
- После закрытия и проверки распределите измельченный метронидазол (см. Таблицу материалов) вдоль швов, чтобы предотвратить аутоувечье, и распылите жидкую повязку на ту же область.
- До того, как животное оправится от анестезии, введите карпрофен (2-5 мг/кг) подкожно.
- Теперь исследователи могут получить доступ к бедренным сосудам, единственному источнику питания лоскута, чтобы протестировать экспериментальные схемы ишемического предварительного кондиционирования в течение нескольких дней подряд. В каждый день операции вводите 2-5 мг / кг карпрофена подкожно.
- В конце периода ишемического прекондиционирования, чтобы удалить лоскут из эпигастрального кровоснабжения, прижигают нижнюю жировую подушку вдоль нижней границы лоскута.
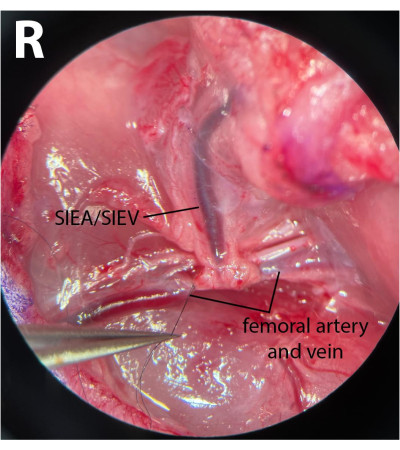
Рисунок 3: Микроскопический вид бедренных сосудов. Дистальные бедренные сосуды перевязываются. Нерв сохранился. Сторона рассечения представляет собой правую паховую складку (R). Увеличение: 40x. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
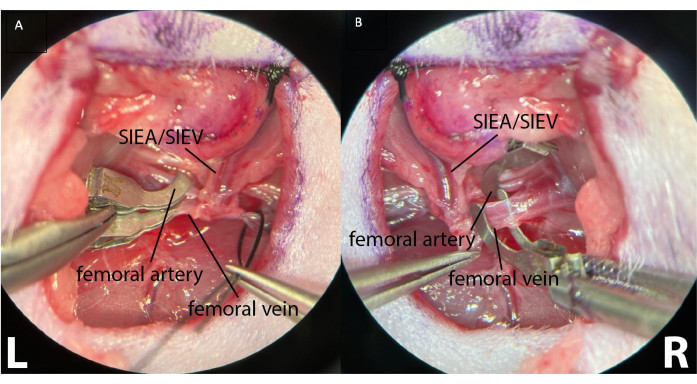
Рисунок 4: Зажим проксимальных бедренных сосудов с помощью двух отдельных микрохирургических зажимов. Это позволяет лучше контролировать зажим, обеспечивая отсутствие артериального и ретроградного венозного кровотока. (А) показывает зажатые оба левых (L) бедренных сосуда. Видны поверхностные нижние эпигастральные сосуды (SIEA/SIEV). (B) показывает зажатую бедренную артерию и бедренную вену до пережатия на правой паховой складке животного (R). Увеличение: 40x. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Послеоперационный уход
- Вводите карпрофен (2-5 мг / кг) подкожно один раз в день в течение 4 дней после операции и один раз после любых дополнительных седативных препаратов.
- В течение первых 24 часов наблюдайте за животным дважды. Затем оценивайте животное и лоскут не реже одного раза в день до конца исследования.
ПРИМЕЧАНИЕ: Животное должно быть ярким, бдительным и реактивным. Если есть признаки системных оппортунистических инфекций (например, летаргия или потеря веса), животное должно быть усыплено в соответствии с утвержденными учреждениями протоколами. - Контролируйте лоскут на предмет раннего некроза (до лигирования на 5-й день послеоперационного периода [POD5]), расхождения в месте операции, инфекции, гематомы, ишемии и/или аутофагии лоскута.
- Если есть расхождение в месте операции, удалите края рубца, очистите место 10% повидон-йодом, прежде чем тщательно промыть стерильной водой или стерильным физиологическим раствором и закройте рану прерывистыми нейлоновыми швами 3-0.
- По окончании исследования усыпьте животное внутривенной инъекцией 0,1-0,2 мл 31% раствора фенобарбитала натрия или протоколом, рекомендованным местным IACUC. Подтверждают смерть по отсутствию сердцебиения и дыхательных движений.
Результаты
Все лоскуты были жизнеспособными на POD5, демонстрируя хорошую васкуляризацию только SIEA. На рисунке 5 показан лоскут до и после внутривенной инъекции флуоресцеина, демонстрирующий полную васкуляризацию.
Обсуждение
В этой статье описывается воспроизводимая модель фасциокожного лоскута, собранная у крыс, что позволяет оценить IP. Этот пошаговый хирургический протокол дает исследовательским группам надежную модель для тестирования различных схем внутримышечного введения. Предотвращая любую васк...
Раскрытие информации
У всех авторов нет финансовой заинтересованности, которую можно было бы заявлять.
Благодарности
Эта работа финансировалась Массачусетской больницей общего профиля (W.G.A.) и Shriners Children's Boston (B.U, K.U, C.L.C). Y.B и I.F.V.R финансируются детскими больницами Shriners (ID предложения: #970280 и #857829 соответственно).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe Luer-Lok Tip | BD | 309628 | |
| 3-0 Ethilon 18” Black Monofilament Nylon suture | Ethicon | ETH-663H | |
| 8-0 Ethilon 12” Black Monofilament Nylon suture | Ethicon | 1716G | |
| Adson Atraumatic Forceps | Aesculap Surgical Instruments | BD51R | |
| Akorn Fluorescein Injection USP 10% Single Dose Vial 5 mL | Akorn | 17478025310 | |
| Betadine Solution 5% Povidone-Iodine Antiseptic Microbicide | PBS Animal Health | 11205 | |
| Bipolar Cords | ASSI | ASSI.ATK26426 | |
| Buprenorphine Hydrochloride Injection | PAR Pharmaceutical | 3003406C | This concentration needs to be diluted for rodents. |
| Depilatory product – Nair Hair remover lotion | Nair | NC0132811 | |
| Ear tag applier | World Precision Instruments | NC0038715 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | |
| Jewelers Bipolar Forceps Non-Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star elastic stays | Cooper Surgical | 3311-1G | |
| Lone star Self-retaining retractor | Cooper Surgical | 3304G | |
| Metronidazole tablets USP | Teva | 500111-333-06 | |
| Micro spring handle scissors | AROSurgical | 11.603.14 | |
| Microscope (surgical) | Leica | M525 F40 | |
| Microsurgical clamp applying forceps | Ambler Surgical | 31-906 | |
| Microsurgical clamps (x2) | Millennium Surgical | 18-B1V | |
| Microsurgical Dumont #4 forceps | Dumont Swiss made | 1708-4TM-PO | |
| Microsurgical needle holder | ASSI | B-14-8 | |
| Needle holder | World Precision Instruments | 501246 | |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | |
| Pixel analysis software | GNU Image Manipulation Program v2.10 | GIMP | GNU Open licence |
| PrecisionGlide Needle 27 G | BD | 305109 | |
| Ragnell Scissors | Roboz Surgical | RS-6015 | |
| Rimadyl (carprofen) | Zoetis | 10000319 | This concentration needs to be diluted for rodents |
| Scientific Elizabethan collar (e-collar) for Rats | Braintree Scientific | NC9263311 | |
| Small animal ear tag | National Band & Tag Company | Style 1005-1 | |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Sterile towel drape | Dynarex Corporation | 4410 | |
| Sterile water for injection and irrigation | Hospira | 0409488724-1 | |
| Surgical scrub – BD ChloraPrep Hi-Lite Orange 3 mL applicator with Sterile Solution | BD | 930415 | |
| UV lamp | UVP | UVL-56 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Ссылки
- Copelli, C., et al. Management of free flap failure in head and neck surgery. ACTA Otorhinolaryngologica Italica. 37 (5), 387-392 (2017).
- Lese, I., Biedermann, R., Constantinescu, M., Grobbelaar, A. O., Olariu, R. Predicting risk factors that lead to free flap failure and vascular compromise: A single unit experience with 565 free tissue transfers. Journal of Plastic, Reconstructive & Aesthetic Surgery. 74 (3), 512-522 (2021).
- Wang, W., et al. Flap failure and salvage in head and neck reconstruction. Seminars in Plastic Surgery. 34 (4), 314-320 (2020).
- Gabrysz-Forget, F., et al. Free versus pedicled flaps for reconstruction of head and neck cancer defects: a systematic review. Journal of Otolaryngology - Head & Neck Surgery. 48 (1), 13 (2019).
- Sievert, M., et al. Failure of pedicled flap reconstruction in the head and neck area: A case report of a bilateral subclavian artery stenosis. International Journal of Surgery Case Reports. 76, 381-385 (2020).
- Vaienti, L., et al. Failure by congestion of pedicled and free flaps for reconstruction of lower limbs after trauma: the role of negative-pressure wound therapy. Journal of Orthopaedics and Traumatology. 14 (3), 213-217 (2013).
- Murry, C. E., Jennings, R. B., Reimer, K. A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 74 (5), 1124-1136 (1986).
- Akcal, A., et al. Combination of ischemic preconditioning and postconditioning can minimise skin flap loss: experimental study. Journal of Plastic Surgery and Hand Surgery. 50 (4), 233-238 (2016).
- Ulker, P., et al. Does ischemic preconditioning increase flap survival by ADORA2B receptor activation. Clinical Hemorheology and Microcirculation. 75 (2), 151-162 (2020).
- Min, S. -. H., Choe, S. H., Kim, W. S., Ahn, S. -. H., Cho, Y. J. Effects of ischemic conditioning on head and neck free flap oxygenation: a randomized controlled trial. Scientific Reports. 12 (1), 8130 (2022).
- Dacho, A., Lyutenski, S., Aust, G., Dietz, A. Ischemic preconditioning in a rat adipocutaneous flap model. HNO. 57 (8), 829-834 (2009).
- Yildiz, K., et al. Comparison of the flap survival with ischemic preconditioning on different pedicles under varied ischemic intervals in a rat bilateral pedicled flap model. Microsurgery. 34 (2), 129-135 (2014).
- Ottomann, C., Küntscher, M., Hartmann, B., Antonic, V. Ischaemic preconditioning suppresses necrosis of adipocutaneous flaps in a diabetic rat model regardless of the manner of preischaemia induction. Dermatology Research and Practice. 2017, 4137597 (2017).
- Grimaud, J., Murthy, V. N. How to monitor breathing in laboratory rodents: a review of the current methods. Journal of Neurophysiology. 120 (2), 624-632 (2018).
- Strohl, K. P., et al. Ventilation and metabolism among rat strains. Journal of Applied Physiology. 82 (1), 317-323 (1997).
- Mucke, T., et al. Autonomization of epigastric flaps in rats. Microsurgery. 31 (6), 472-478 (2011).
- Hsu, C. -. E., et al. The rat groin flap model redesigned for evaluating treatment effects on ischemia-reperfusion injury. Journal of Surgical Research. 222, 160-166 (2018).
- Mücke, T., et al. Indocyanine green videoangiography-assisted prediction of flap necrosis in the rat epigastric flap using the flow® 800 tool. Microsurgery. 37 (3), 235-242 (2017).
- Wang, D., Chen, W. Indocyanine green angiography for continuously monitoring blood flow changes and predicting perfusion of deep inferior epigastric perforator flap in rats. Journal of Investigative Surgery. 34 (4), 393-400 (2021).
- Berkane, Y., et al. How to secure pedicled flaps using perioperative indocyanine green angiography: a prospective study about 10 cases. World Journal of Surgery and Surgical Research. 4 (1), 1319 (2021).
- Alstrup, T., Christensen, B. O., Damsgaard, T. E. ICG angiography in immediate and delayed autologous breast reconstructions: peroperative evaluation and postoperative outcomes. Journal of Plastic Surgery and Hand Surgery. 52 (5), 307-311 (2018).
- Küntscher, M. V., et al. Ischemic preconditioning by brief extremity ischemia before flap ischemia in a rat model. Plastic and Reconstructive Surgery. 109 (7), 2398-2404 (2002).
- Liu, R. Q., et al. Cost analysis of indocyanine green fluorescence angiography for prevention of anastomotic leakage in colorectal surgery. Surgical Endoscopy. 36 (12), 9281-9287 (2022).
- Cheng, M. H., et al. Devices for ischemic preconditioning of the pedicled groin flap. The Journal of Trauma. 48 (3), 552-557 (2000).
- Xiao, W., et al. An innovative and economical device for ischemic preconditioning of the forehead flap prior to pedicle division: a comparative study. Journal of Reconstructive Microsurgery. 38 (9), 703-710 (2022).
- Küntscher, M. V., Hartmann, B., Germann, G. Remote ischemic preconditioning of flaps: a review. Microsurgery. 25 (4), 346-352 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены