Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir sıçan modelinde iskemik ön koşullandırma etkilerini incelemek için yüzeysel inferior epigastrik arter aksiyel flep
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, sıçanlarda, femur damarlarının sıkıştırılması ve bağlanması yoluyla yüzeysel inferior epigastrik damarlardan kan akışının iyi bir şekilde görselleştirilmesine ve manipüle edilmesine izin veren fasyokutanöz fleplerin toplanmasını, dikilmesini ve izlenmesini açıklar. Bu, iskemik ön koşullandırmayı içeren çalışmalar için kritik öneme sahiptir.
Özet
Fasyokutanöz flepler (FCF), plastik ve rekonstrüktif cerrahide kompleks defekt rekonstrüksiyonunda altın standart haline gelmiştir. Bu kas koruyucu teknik, vaskülarize dokuların herhangi bir büyük kusuru örtmek için aktarılmasına izin verir. FCF, pediküllü flepler veya serbest flepler olarak kullanılabilir; Bununla birlikte, literatürde, pediküllü FCF ve serbest FCF için başarısızlık oranları% 5'in üzerindedir ve bu teknikler için iyileştirme ve bu alanda daha fazla bilgi genişlemesi için yer bırakmaktadır. İskemik ön koşullandırma (I.P.) geniş çapta çalışılmıştır, ancak I.P. rejiminin mekanizmaları ve optimizasyonu henüz belirlenmemiştir. Bu fenomen gerçekten de plastik ve rekonstrüktif cerrahide yeterince araştırılmamıştır. Burada, I.P. rejimini sıçan eksenel fasyokutanöz flep modelinde incelemek için I.P.'nin flep sağkalımı üzerindeki etkilerinin güvenli ve güvenilir bir şekilde nasıl değerlendirileceğini açıklayan cerrahi bir model sunulmuştur. Bu makalede, bu modelin güvenilirliğini artırmak için öneriler de dahil olmak üzere tüm cerrahi prosedür açıklanmaktadır. Amaç, araştırmacılara çeşitli iskemik ön koşullandırma rejimlerini test etmek ve flep hayatta kalma kabiliyeti üzerindeki etkilerini değerlendirmek için tekrarlanabilir ve güvenilir bir model sağlamaktır.
Giriş
Plastik ve rekonstrüktif cerrahi sürekli evrim geçirmektedir. Kas, fasyokutanöz ve perforatör fleplerin gelişimi, morbiditeyi azaltırken daha kaliteli rekonstrüksiyonlar sunmayı mümkün kılmıştır. Bu gelişmiş anatomik bilgiyi gelişmiş teknik becerilerle birleştiren rekonstrüktif cerrahlar, defektler herhangi bir lokal çözüme yakın olmadığında serbest flep transferleri yapabilirler. Bununla birlikte, perforatör flep cerrahisi günümüzde rekonstrüktif cerrahide en ileri teknik olmakla birlikte, literatürde serbest fleptransferlerinde %5, pediküllü flep rekonstrüksiyonunda %20'ye varan başarısızlık oranı 4,5,6 bildirilmektedir. Kısmi ila total flep yetmezliği, flebin pedikülü tehlikeye girdiğinde ortaya çıkar, bu nedenle mevcut tekniklerde sürekli iyileştirmeler aramak önemlidir. Flep sağkalımını iyileştirmenin yöntemlerinden biri, yara yatağında neovaskülarizasyonunu teşvik etmek ve böylece pedikül dışında bir kaynak tarafından perfüzyona izin vermektir. İskemik ön koşullandırma (I.P.) başlangıçta bir kalp modeli7'de tanımlanmıştır ve kontrollü iskemiye maruz kalan bir organın, iskemiye bağlı neovaskülarizasyona maruz kalarak birincil kan akışını kaybettikten sonra daha yüksek bir dereceye kadar hayatta kaldığını göstermiştir. Birçok yazar, preklinik ve klinik modellerde flep sağkalımını optimize etmek için bu köşe taşı prensibini incelemiştir 8,9,10.
Bu tekniğin flep sağkalımını iyileştirmek için diğer yöntemlere göre avantajı, kan kaynağının kelepçe / kelepçe testlerinden oluşan uygulama kolaylığıdır. Sıçan modelinde, önceki yazarlar yüzeysel inferior epigastrik arter (SIEA) flebini ana pedikül11,12,13'ü kelepçeleyerek I.P.'yi incelemek için kullandılar. Bununla birlikte, bu modelle ilgili çeşitli teknik sorunlarla karşılaşılabilir ve literatür iyi tanımlanmış protokollerden yoksundur.
Bu nedenle, bu çalışma, araştırmacılara, eksenel fasyokutanöz flep modeli üzerinde I.P. çalışmalarına izin vermek için femoral damarların genişletilmiş bir diseksiyonu ile bir sıçan SIEA flep tedarik tekniğinin ayrıntılı bir tanımını sunmayı amaçlamaktadır. Bu model epigastrik damarların bütünlüğünü korur ve bunun yerine daha esnek olan femur damarlarını manipüle eder. Bu fenomenin çalışmasını geliştirmek ve bu prosedürün tekrarlanabilirliğini artırmak için deneyimlerimizi ve araçlarımızı paylaşıyoruz.
Protokol
Massachusetts Genel Hastanesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi, deneysel protokolü (IACUC- protokol #2022N000099) onayladı. Yazarlar bu çalışma için ARRIVE (Animal Research: Reporting In Vivo Experiments) kılavuz kontrol listesini takip ettiler. Tüm hayvanlar, Ulusal Sağlık Enstitüsü Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'nu takiben insancıl bakım aldı. Tüm deneyler için toplam 12 erkek Lewis sıçanı (250-350 g, 8-10 haftalık) kullanıldı.
1. Hayvan hazırlama
NOT: Sıçanlar yüksek metabolik hıza ve sınırlı yağ rezervlerine sahiptir; Bu nedenle, ameliyattan önce oruç tutmayın ve ameliyattan önce asla suyu kısıtlamayın.
- Tüm prosedürler için, izofluran hassas buharlaştırıcının haznesinde% 3 -% 5 izofluran kullanarak hayvanı sakinleştirin (bakınız Malzeme Tablosu). Hayvan iyi yatıştırıldığında, izofluran dozunu bir burun konisi yoluyla% 1-3'e düşürün.
NOT: İkinci bir araştırmacı solunum hızını sürekli izlemeli ve izofluran dozunu uyarlamalıdır. - İlk ameliyattan 2 gün önce, hayvanın üzerine plastik bir e-yaka (sıçan için boyutlandırılmış; Malzeme Tablosuna bakınız) yerleştirin ve e-tasmayı hayvanın boynunun dorsal ve ventral taraflarına sabitlemek için 3-0 naylon bir dikiş kullanın. Bu e-yakaya alışmak için 2 gün bekleyin; Sıkıca oturmalı, ancak hayvanın hava yolunu engellememelidir.
2. Preoperatif bakım
- İlk ameliyat gününde, karnın alt ön yönünü tıraş edin, bölgeyi hayvanın yanal kısmından orta çizgiyi biraz geçecek şekilde temizleyin.
- Daha sonra, bu bölgede kalan tüm tüyleri çıkarmak için tüy dökücü bir ürün (epilasyon kremi; Malzeme Tablosuna bakınız) kullanın (önceki adımda açıklandığı gibi karnın alt ön yönü).
- Bölgeyi cerrahi ovma ve betadin çözeltisi (% 10 povidon-iyot) ile iyice yıkayın ve kurutun.
- Deri altından 0.05 mg/kg buprenorfin uygulayın.
3. İntraoperatif monitörizasyon
- Ameliyat boyunca hassas bir buharlaştırıcı ve burun konisi ile hayvanın %1-3 izofluran üzerinde kalmasını sağlayın. Hayvanın solunum hızını, nefes almasını ve oksijen doygunluk seviyesini görsel gözlem ve bir sıçan için yapılmış bir kemirgen nabız oksimetresi ile izleyin.
NOT: Tipik solunum hızı dakikada 80-90 döngüdür14,15. Ameliyat sırasında gözlenen bilinci gösteren herhangi bir reaksiyon, izofluran oranının arttırılmasını gerektirir. - Kemirgenlerin vücut ısısı anestezi altında hızla soğuduğundan, hayvanı ameliyatın tamamı için bir ısınma pedine yerleştirin.
4. Epigastrik flep hasadı
- Hayvanı sırtüstü pozisyona getirin. Karnı kasık kıvrımının altından ksifoid işlem seviyesinin üstüne kadar tıraş edin.
- Steril bir cilt kalemi ve cetveli kullanarak, önce hayvanın karnının orta çizgisini ve ardından kasık kırışıklığını işaretleyin. Kasık kırışıklık çizgisi boyunca yapılan bir insizyon, inferior epigastrik damarların femur damarlarından dallanmasını ortaya çıkarır.
- Kesiden önce, gelecekteki flebi kasık kıvrımından kraniyal olarak uzanan, dikey olarak 6 cm ve yatay olarak 3 cm'ye kadar oval veya dikdörtgen olarak çizin.
- Flap sınırlarına dik olarak beş veya altı eşit mesafeli işaret çizin. Bunlar, flep kaldırıldıktan ve tekrar yerine dikildikten sonra cildi daha iyi yeniden hizalamak için kılavuz görevi görür (Şekil 1).
- Ragnell makası kullanarak (bakınız Malzeme Tablosu), kasık kırışıklığı üzerinde 3-4 cm uzunlamasına bir kesi yapın.
NOT: Araştırmacılar dikkatli olmalı ve damarlara zarar vermemek için cildi yukarı doğru çekmelidir. - Femoral ve epigastrik damarları, # 4 kuyumcu mikrocerrahi forseps kullanarak (bakınız Malzeme Tablosu), fasyayı ayırmak ve inguinal yağ yastığının altındaki damarlara erişmek için forsepsleri açıp kapatarak ortaya çıkarın ve tanımlayın.
- Ragnell makası kullanarak flep insizyonunu başlatmak için kasık insizyonunu kullanın. Cildin tam kalınlığını ve karın kası üzerindeki bağ dokusunu zayıflatmaya dikkat edin.
- Flep hasadını kolaylaştırmak için, makasın kaslara doğru iterek ve makasın bıçaklarını yayarak doğru diseksiyon düzlemini takip ettiğinden emin olun. Bu kanat baltalama işlemini, kanat çiziminin etrafında koordineli bir yönde hareket ederek gerçekleştirin.
NOT: Uygun düzlemi belirlemek için, diseksiyon düzleminin altında hiçbir mikrodamar kalmamalıdır.
- Flep hasadını kolaylaştırmak için, makasın kaslara doğru iterek ve makasın bıçaklarını yayarak doğru diseksiyon düzlemini takip ettiğinden emin olun. Bu kanat baltalama işlemini, kanat çiziminin etrafında koordineli bir yönde hareket ederek gerçekleştirin.
- Flebin ilk ucu çevreleyen deriden serbest bırakıldığından, flep etrafındaki perforatör damarları ve dermal pleksus damarlarını koterize ederken, flebi kastan ayırmak için Ragnell makas uçlarını kullanarak, distalden proksimal kısma kadar baltalayarak flep tedarikine devam edin. Bu, tüm kanın epigastrik damarlar yoluyla flebe akmasını sağlar.
NOT: Flep hasat edilirken cildi çok kuvvetli bir şekilde çekerek veya bükerek flep vaskülatürüne zarar vermemeye dikkat edilmelidir. Flebin proksimal kısmı üzerinde çalışırken flebin serbest kalan kısmının cerrahın elinin baş parmağının üzerine dikkatlice yerleştirilmesi önerilir. - Flep tamamen toplandıktan sonra, yüzeysel inferior epigastrik damarların dalları cildin derin kısmında görülebilir. Damarları görselleştirmek için kapağı yavaşça yukarı doğru kaldırarak SIEA'nın her iki kolunun tamamını flep ile kapsüllemeyi hedefleyin.
- Flep toplandıktan sonra, yağ pedlerini alt tarafta, kapağın hem medial hem de lateral taraflarında ayırın. Bipolar koteri kullanın (bakınız Malzeme Tablosu), yüzeysel inferior epigastrik pediküle zarar vermemeye dikkat ederken, insizyon sınırına yakın yağ pedellerini koterize edin (Şekil 2).
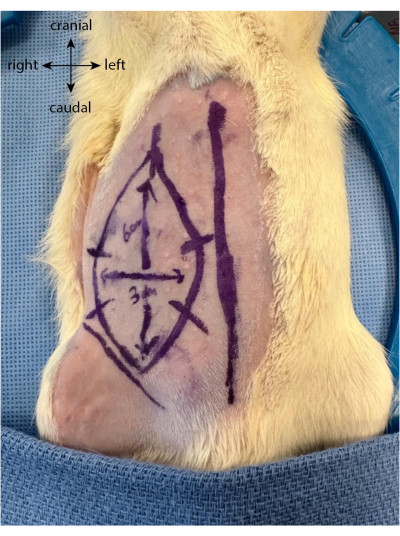
Resim 1: Hayvanın karnına çizilen flep. Orta hat, epigastrik flep lokalizasyonunu bulmak için bir belirteç olarak kullanılır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
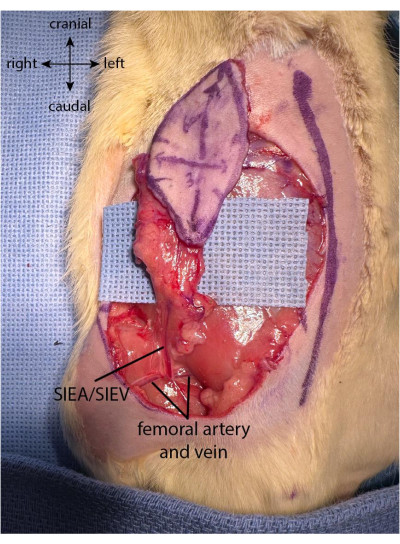
Resim 2: Flap tamamen yükselmiş. Yağ yastığı, yüzeyel inferior epigastrik pedikülden gelen vaskülarizasyonu korumak için flebin proksimal kısmında korunur. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
5. Damar hazırlığı ve iskemi indüksiyonu
NOT: Flep bu aşamada tamamen hasat edilir, ancak damarlar henüz iskemik ön koşullandırma için hazırlanmamıştır.
- Femur damarı hazırlamadan önce, penis damarı yoluyla tek bir doz 17.5 IU sodyum heparin enjekte edin.
NOT: Bu enjeksiyon, glansı açığa çıkararak, atravmatik Adson forseps kullanarak penisi dışarıdan tutarak, penis damarını tanımlayarak ve 27 G şırınga kullanarak yüzeysel olarak ve penis damarı boyunca enjekte ederek yapılır. - Daha iyi bir pozlama oluşturmak için, hayvanı Lone Star kendiliğinden tutan bir retraktörün içine yerleştirin (bkz.
NOT: Lone Star elastik kalıntılar, cildi cerrahi bölgeden uzaklaştırarak damarların daha iyi görülmesini sağlar. Araştırmacı şimdi cerrahi mikroskop altında çalışmalıdır (40x büyütme). - Damarları açığa çıkarmak için, femoral damarları yüzeysel epigastrik damarların ortaya çıkmasına hem yakın hem de distal olarak diseke etmek için iki # 4 mikrocerrahi forseps kullanın. Damarları doğrudan tutmayın, bunun yerine forsepsleri damarlara dikey olarak açıp kapatarak bağ dokusu tabakasını katman katman hafifçe ayırmak için forsepsleri kullanın.
- Distal femoral damarlarda, fasyayı temizleyin ve siniri arter ve damardan yavaşça serbest bırakın. 8-0 kullanarak naylon sütür (bakınız Malzeme Tablosu), mikrocerrahi iğne tutucuyu arter ve ven altından atlatarak, dikişi sıkıştırarak ve bu damarları bağlayarak distal femoral damarları bağlar (Şekil 3). Postoperatif morbiditeyi en aza indirmek için sinir zarar görmemeli veya bağlanmamalıdır.
NOT: Cerrahlar, fasyayı bir eliyle sinire nazikçe çekmek için forsepslerden birini kullanabilir ve siniri damarlardan tamamen ayırmak için başka bir çift kullanabilirler. - 8-0 kullanarak Dikiş, epigastrik damarların ortaya çıkmasından hemen sonra distal damarları bağlayarak pedikül orijininden sonra 1 mm'lik bir mesafe bırakır. Bu, iskemik fazlar sırasında derin dallardan SIEA boyunca ters akış gelmemesini sağlar.
NOT: Şekil 3 , SIEA pedikülünün ortaya çıkmasından sonra bağlanmış distal femoral damarları göstermektedir. - Proksimal femoral damarlarda, bağ dokusunu temizlemek için aynı işlemi tekrarlayın. Bununla birlikte, etkili kelepçelemeye izin vermek için arter ve damarı birbirinden ayırın. Bu, kapalı forsepsleri arter ve ven arasına nazikçe yerleştirerek ve tforsepsleri damarların çalışma yönünde yavaşça açarak sağlanabilir.
- Aralıklı iskemiyi indüklemek için, mikrocerrahi kelepçeleri her proksimal femoral arter ve ven üzerine ayrı ayrı yerleştirin (Şekil 4).
- İskemik yaralanmalar tamamlandığında, flebi orijinal konumuna getirin ve işaretleri ameliyat öncesi çizildiği şekilde sıralayın (adım 4.2.2). 3-0 naylon ile çalışan bir sütür kullanarak flebi dikin (bakınız Malzeme Tablosu), medial olarak kasık kıvrımından başlayarak, flebin etrafında ve lateral olarak kasık kırışıklığında biten.
NOT: Kasık kırışıklığı boyunca, kesilmiş dikişleri yerleştirmek için aynı dikiş kullanılabilir. Bu, araştırmacıların flep kapanmasını etkilemeden bu alanı açmalarını sağlar. - Flebe kan akışını doğrulamak için, heparin salin enjeksiyonu için tarif edilen aynı tekniği ve araçları kullanarak penis damarına 0.25 mL steril floresein sodyum (% 10, bakınız Malzeme Tablosuna bakınız) enjekte edin (adım 5.1). 3 dakika sonra, perfüze edilen alanlara karşılık gelen floresan alanları ortaya çıkarmak için uzun dalga UV-366 nm lamba (floresan uyarma ışığı) parlatın.
- Kapatma ve doğrulamadan sonra, otomatik mutilasyonu önlemek için dikişler boyunca ezilmiş metronidazol ( Malzeme Tablosuna bakınız) yayın ve aynı bölgeye sıvı bandaj püskürtün.
- Hayvanın anesteziden iyileşmesinden önce, deri altından Carprofen (2-5 mg / kg) verin.
- Araştırmacılar artık deneysel iskemik ön koşullandırma rejimlerini birkaç gün üst üste test etmek için flebin tek beslenme kaynağı olan femur damarlarına erişebilirler. Ameliyatın her gününde, deri altından 2-5 mg / kg doz Carprofen sağlayın.
- İskemik ön koşullandırma periyodunun sonunda, flebi epigastrik kan kaynağından çıkarmak için, flebin inferior sınırı boyunca yağ yastığına inferior koterize edin.
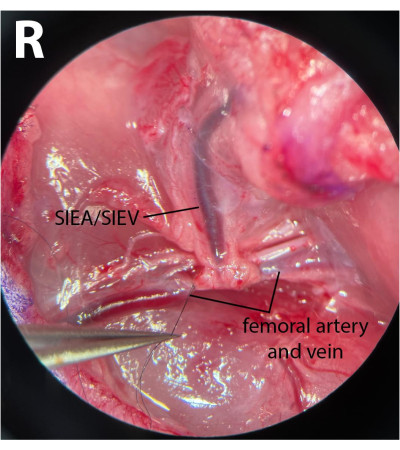
Resim 3: Femur damarlarının mikroskobik görünümü. Distal femoral damarlar bağlanır. Sinir korunmuştur. Diseksiyon tarafı sağ inguinal kırışıklıktır ( R ). Büyütme: 40x. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
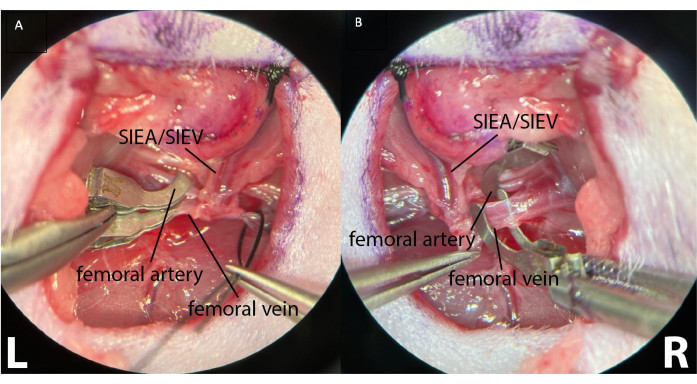
Şekil 4: Proksimal femur damarlarının iki ayrı mikrocerrahi kelepçe kullanılarak sıkıştırılması. Bu, arteriyel ve retrograd venöz akışın olmamasını sağlayarak daha iyi sıkıştırma kontrolü sağlar. (A) her iki sol (L) femoral damarın da kenetlendiğini gösterir. Yüzeyel inferior epigastrik damarlar görülebilir (SIEA/SIEV). (B) kelepçelenmeden önce, hayvanın sağ kasık kıvrımında ( R ) kelepçelenmiş bir femoral arter ve bir femoral ven gösterir . Büyütme: 40x. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
6. Postoperatif bakım
- Carprofen'i (2-5 mg/kg) postoperatif 4 gün boyunca günde bir kez ve herhangi bir ek sedasyondan sonra bir kez deri altından uygulayın.
- İlk 24 saat boyunca hayvanı iki kez gözlemleyin. Daha sonra, hayvanın ve flebin çalışma sonuna kadar günde en az bir kez değerlendirilmesi.
NOT: Hayvan parlak, uyanık ve reaktif olmalıdır. Sistemik fırsatçı enfeksiyon belirtileri varsa (yani, uyuşukluk veya kilo kaybı), hayvan kurumsal onaylı protokolleri izleyerek ötenazi yapılmalıdır. - Flebi erken nekroz (postoperatif 5. günde ligasyondan önce [POD5]), cerrahi alan ayrışması, enfeksiyon, hematom, iskemi ve / veya flebin otofajisi açısından izleyin.
- Cerrahi bölge ayrışması varsa, skar kenarlarını debride edin, steril su veya steril salin ile iyice durulamadan önce% 10 povidon-iyot ile bölgeyi temizleyin ve kesilmiş 3-0 naylon dikişler kullanarak yarayı kapatın.
- Çalışmanın sonunda, hayvanı% 31 sodyum fenobarbital çözeltinin 0.1-0.2 mL'lik bir IV enjeksiyonu veya yerel IACUC tarafından önerilen protokolle ötenazi yapın. Kalp atışı ve solunum hareketlerinin yokluğu ile ölümü onaylayın.
Sonuçlar
Tüm flepler POD5'te yaşayabilirdi ve sadece SIEA tarafından iyi vaskülarizasyon gösterdi. Şekil 5 , IV floresein enjeksiyonundan önce ve sonra flebi tam bir vaskülarizasyon göstererek göstermektedir.

Şekil 5: Hemen intravenöz floresein anjiyografi (POD0). Bu değerlendirme, flebin...
Tartışmalar
Bu makalede, sıçanlarda hasat edilen ve I.P. değerlendirmesine izin veren tekrarlanabilir bir fasyokutanöz flep modeli açıklanmaktadır. Bu adım adım cerrahi protokol, araştırma gruplarına farklı I.P. rejimlerini test etmek için güvenilir bir model sunar. Pedikül dışında herhangi bir vaskülarizasyonu önleyerek, bu model flebin neovaskülarizasyonunu yara yatağından ve marjından incelemeye izin verir. Bu çalışma, POD5 üzerindeki ligasyonu gerçekleştirdi, çünkü önceki çalışmalar POD5-7
Açıklamalar
Tüm yazarların beyan etmek için finansal çıkarları yoktur.
Teşekkürler
Bu çalışma Massachusetts General Hospital (W.G.A) ve Shriners Children's Boston (B.U, K.U, C.L.C) tarafından finanse edildi. Y.B ve I.F.V.R, Shriners Çocuk Hastaneleri tarafından finanse edilmektedir (Teklif Kimliği: sırasıyla #970280 ve #857829).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe Luer-Lok Tip | BD | 309628 | |
| 3-0 Ethilon 18” Black Monofilament Nylon suture | Ethicon | ETH-663H | |
| 8-0 Ethilon 12” Black Monofilament Nylon suture | Ethicon | 1716G | |
| Adson Atraumatic Forceps | Aesculap Surgical Instruments | BD51R | |
| Akorn Fluorescein Injection USP 10% Single Dose Vial 5 mL | Akorn | 17478025310 | |
| Betadine Solution 5% Povidone-Iodine Antiseptic Microbicide | PBS Animal Health | 11205 | |
| Bipolar Cords | ASSI | ASSI.ATK26426 | |
| Buprenorphine Hydrochloride Injection | PAR Pharmaceutical | 3003406C | This concentration needs to be diluted for rodents. |
| Depilatory product – Nair Hair remover lotion | Nair | NC0132811 | |
| Ear tag applier | World Precision Instruments | NC0038715 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | |
| Jewelers Bipolar Forceps Non-Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star elastic stays | Cooper Surgical | 3311-1G | |
| Lone star Self-retaining retractor | Cooper Surgical | 3304G | |
| Metronidazole tablets USP | Teva | 500111-333-06 | |
| Micro spring handle scissors | AROSurgical | 11.603.14 | |
| Microscope (surgical) | Leica | M525 F40 | |
| Microsurgical clamp applying forceps | Ambler Surgical | 31-906 | |
| Microsurgical clamps (x2) | Millennium Surgical | 18-B1V | |
| Microsurgical Dumont #4 forceps | Dumont Swiss made | 1708-4TM-PO | |
| Microsurgical needle holder | ASSI | B-14-8 | |
| Needle holder | World Precision Instruments | 501246 | |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | |
| Pixel analysis software | GNU Image Manipulation Program v2.10 | GIMP | GNU Open licence |
| PrecisionGlide Needle 27 G | BD | 305109 | |
| Ragnell Scissors | Roboz Surgical | RS-6015 | |
| Rimadyl (carprofen) | Zoetis | 10000319 | This concentration needs to be diluted for rodents |
| Scientific Elizabethan collar (e-collar) for Rats | Braintree Scientific | NC9263311 | |
| Small animal ear tag | National Band & Tag Company | Style 1005-1 | |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Sterile towel drape | Dynarex Corporation | 4410 | |
| Sterile water for injection and irrigation | Hospira | 0409488724-1 | |
| Surgical scrub – BD ChloraPrep Hi-Lite Orange 3 mL applicator with Sterile Solution | BD | 930415 | |
| UV lamp | UVP | UVL-56 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Referanslar
- Copelli, C., et al. Management of free flap failure in head and neck surgery. ACTA Otorhinolaryngologica Italica. 37 (5), 387-392 (2017).
- Lese, I., Biedermann, R., Constantinescu, M., Grobbelaar, A. O., Olariu, R. Predicting risk factors that lead to free flap failure and vascular compromise: A single unit experience with 565 free tissue transfers. Journal of Plastic, Reconstructive & Aesthetic Surgery. 74 (3), 512-522 (2021).
- Wang, W., et al. Flap failure and salvage in head and neck reconstruction. Seminars in Plastic Surgery. 34 (4), 314-320 (2020).
- Gabrysz-Forget, F., et al. Free versus pedicled flaps for reconstruction of head and neck cancer defects: a systematic review. Journal of Otolaryngology - Head & Neck Surgery. 48 (1), 13 (2019).
- Sievert, M., et al. Failure of pedicled flap reconstruction in the head and neck area: A case report of a bilateral subclavian artery stenosis. International Journal of Surgery Case Reports. 76, 381-385 (2020).
- Vaienti, L., et al. Failure by congestion of pedicled and free flaps for reconstruction of lower limbs after trauma: the role of negative-pressure wound therapy. Journal of Orthopaedics and Traumatology. 14 (3), 213-217 (2013).
- Murry, C. E., Jennings, R. B., Reimer, K. A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 74 (5), 1124-1136 (1986).
- Akcal, A., et al. Combination of ischemic preconditioning and postconditioning can minimise skin flap loss: experimental study. Journal of Plastic Surgery and Hand Surgery. 50 (4), 233-238 (2016).
- Ulker, P., et al. Does ischemic preconditioning increase flap survival by ADORA2B receptor activation. Clinical Hemorheology and Microcirculation. 75 (2), 151-162 (2020).
- Min, S. -. H., Choe, S. H., Kim, W. S., Ahn, S. -. H., Cho, Y. J. Effects of ischemic conditioning on head and neck free flap oxygenation: a randomized controlled trial. Scientific Reports. 12 (1), 8130 (2022).
- Dacho, A., Lyutenski, S., Aust, G., Dietz, A. Ischemic preconditioning in a rat adipocutaneous flap model. HNO. 57 (8), 829-834 (2009).
- Yildiz, K., et al. Comparison of the flap survival with ischemic preconditioning on different pedicles under varied ischemic intervals in a rat bilateral pedicled flap model. Microsurgery. 34 (2), 129-135 (2014).
- Ottomann, C., Küntscher, M., Hartmann, B., Antonic, V. Ischaemic preconditioning suppresses necrosis of adipocutaneous flaps in a diabetic rat model regardless of the manner of preischaemia induction. Dermatology Research and Practice. 2017, 4137597 (2017).
- Grimaud, J., Murthy, V. N. How to monitor breathing in laboratory rodents: a review of the current methods. Journal of Neurophysiology. 120 (2), 624-632 (2018).
- Strohl, K. P., et al. Ventilation and metabolism among rat strains. Journal of Applied Physiology. 82 (1), 317-323 (1997).
- Mucke, T., et al. Autonomization of epigastric flaps in rats. Microsurgery. 31 (6), 472-478 (2011).
- Hsu, C. -. E., et al. The rat groin flap model redesigned for evaluating treatment effects on ischemia-reperfusion injury. Journal of Surgical Research. 222, 160-166 (2018).
- Mücke, T., et al. Indocyanine green videoangiography-assisted prediction of flap necrosis in the rat epigastric flap using the flow® 800 tool. Microsurgery. 37 (3), 235-242 (2017).
- Wang, D., Chen, W. Indocyanine green angiography for continuously monitoring blood flow changes and predicting perfusion of deep inferior epigastric perforator flap in rats. Journal of Investigative Surgery. 34 (4), 393-400 (2021).
- Berkane, Y., et al. How to secure pedicled flaps using perioperative indocyanine green angiography: a prospective study about 10 cases. World Journal of Surgery and Surgical Research. 4 (1), 1319 (2021).
- Alstrup, T., Christensen, B. O., Damsgaard, T. E. ICG angiography in immediate and delayed autologous breast reconstructions: peroperative evaluation and postoperative outcomes. Journal of Plastic Surgery and Hand Surgery. 52 (5), 307-311 (2018).
- Küntscher, M. V., et al. Ischemic preconditioning by brief extremity ischemia before flap ischemia in a rat model. Plastic and Reconstructive Surgery. 109 (7), 2398-2404 (2002).
- Liu, R. Q., et al. Cost analysis of indocyanine green fluorescence angiography for prevention of anastomotic leakage in colorectal surgery. Surgical Endoscopy. 36 (12), 9281-9287 (2022).
- Cheng, M. H., et al. Devices for ischemic preconditioning of the pedicled groin flap. The Journal of Trauma. 48 (3), 552-557 (2000).
- Xiao, W., et al. An innovative and economical device for ischemic preconditioning of the forehead flap prior to pedicle division: a comparative study. Journal of Reconstructive Microsurgery. 38 (9), 703-710 (2022).
- Küntscher, M. V., Hartmann, B., Germann, G. Remote ischemic preconditioning of flaps: a review. Microsurgery. 25 (4), 346-352 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır