É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Retalho axial da artéria epigástrica superficial inferior para estudo dos efeitos do pré-condicionamento isquêmico em modelo de ratos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve a coleta, sutura e monitorização de retalhos fasciocutâneos em ratos que permitem boa visualização e manipulação do fluxo sanguíneo através dos vasos epigástricos superficiais inferiores por meio de pinçamento e ligadura dos vasos femorais. Isso é fundamental para estudos envolvendo pré-condicionamento isquêmico.
Resumo
Os retalhos fasciocutâneos (FCF) tornaram-se o padrão-ouro para reconstrução de defeitos complexos em cirurgia plástica e reconstrutiva. Esta técnica poupadora de músculo permite transferir tecidos vascularizados para cobrir qualquer grande defeito. FCF pode ser usado como retalhos pediculados ou como retalhos livres; no entanto, na literatura, as taxas de falha para FCF pediculado e FCF livre são superiores a 5%, deixando espaço para aprimoramento dessas técnicas e maior expansão do conhecimento nessa área. O pré-condicionamento isquêmico (PI) tem sido amplamente estudado, mas os mecanismos e a otimização do regime de PI ainda precisam ser determinados. Esse fenômeno é, de fato, pouco explorado na cirurgia plástica e reconstrutiva. Neste estudo, é apresentado um modelo cirúrgico para estudar o regime de PI em um modelo de retalho fáscio-cutâneo axial de ratos, descrevendo como avaliar de forma segura e confiável os efeitos da PI na sobrevida do retalho. Este artigo descreve o procedimento cirúrgico completo, incluindo sugestões para melhorar a confiabilidade desse modelo. O objetivo é fornecer aos pesquisadores um modelo reprodutível e confiável para testar vários regimes de pré-condicionamento isquêmico e avaliar seus efeitos na sobrevida do retalho.
Introdução
A cirurgia plástica e reconstrutiva está em constante evolução. O desenvolvimento dos retalhos muscular, fasciocutâneo e perfurante tem possibilitado reconstruções de melhor qualidade e redução da morbidade. Combinando esse conhecimento anatômico aprimorado com habilidades técnicas aprimoradas, os cirurgiões reconstrutivos podem realizar transferências de retalhos livres quando os defeitos não estão próximos de nenhuma solução local. Entretanto, embora a cirurgia de retalho perfurante seja atualmente a técnica mais avançada em cirurgia reconstrutiva, a literatura relata uma taxa de falha de 5% nas transferências de retalhos livres 1,2,3 e de até 20% para a reconstrução de retalho pediculado 4,5,6. A falha parcial a total do retalho ocorre quando o pedículo do retalho está comprometido, portanto, é essencial a busca contínua de melhorias nas técnicas atuais. Um dos métodos para melhorar a sobrevida do retalho é promover sua neovascularização no leito da ferida, permitindo a perfusão por outra fonte que não o pedículo. O pré-condicionamento isquêmico (PI) foi inicialmente descrito emum modelo cardíaco7, demonstrando que um órgão exposto à isquemia controlada sobrevive em maior grau após perder seu suprimento sanguíneo primário por ser submetido à neovascularização induzida por isquemia. Vários autores têm estudado esse princípio fundamental para otimizar a sobrevida do retalho em modelos pré-clínicos e clínicos 8,9,10.
A vantagem desta técnica sobre outros métodos para melhorar a sobrevida do retalho é a sua facilidade de execução, consistindo em testes de pinça/declamp da fonte sanguínea. No modelo de ratos, autores anteriores utilizaram o retalho da artéria epigástrica superficial inferior (SIEA) para estudar a I.P. por meio do pinçamento do pedículo principal11,12,13. No entanto, vários problemas técnicos podem ser encontrados com esse modelo, e a literatura carece de protocolos bem descritos.
Portanto, este trabalho tem como objetivo fornecer aos pesquisadores uma descrição detalhada de uma técnica de captação de retalhos SIEA de ratos com dissecção ampliada dos vasos femorais para permitir estudos intravenosos em um modelo de retalho fáscio-cutâneo axial. Esse modelo mantém a integridade dos vasos epigástricos e manipula os vasos femorais, que são mais resistentes. Compartilhamos nossa experiência e ferramentas para aprimorar o estudo desse fenômeno e aumentar a replicabilidade desse procedimento.
Protocolo
O Comitê Institucional de Cuidados e Uso de Animais do Hospital Geral de Massachusetts aprovou o protocolo experimental (IACUC- protocolo #2022N000099). Os autores seguiram a lista de verificação de diretrizes ARRIVE (Animal Research: Reporting In Vivo Experiments) para este trabalho. Todos os animais receberam cuidados humanizados seguindo o Guia do Instituto Nacional de Saúde para o Cuidado e Uso de Animais de Laboratório. Um total de 12 ratos Lewis machos (250-350 g, 8-10 semanas de idade) foram usados para todos os experimentos.
1. Preparo dos animais
NOTA: Os ratos têm uma alta taxa metabólica e reservas de gordura limitadas; Portanto, não os faça jejum antes da cirurgia e nunca restrinja água antes da cirurgia.
- Para todos os procedimentos, sedar o animal usando isoflurano a 3%-5% na câmara do vaporizador de precisão de isoflurano (ver Tabela de Materiais). Quando o animal estiver bem sedado, reduza a dose de isoflurano para 1%-3% através de um cone nasal.
NOTA: Um segundo pesquisador deve monitorar continuamente a frequência respiratória e adaptar a dose de isoflurano. - Aos 2 dias antes da cirurgia inicial, colocar um colar eletrônico de plástico (tamanho para um rato; ver Tabela de Materiais) no animal e usar uma sutura de náilon 3-0 para fixar o colar eletrônico nas laterais dorsal e ventral do pescoço do animal. Aguarde 2 dias para aclimatação a este e-collar; Deve caber confortavelmente, mas não obstruir as vias aéreas do animal.
2. Cuidados pré-operatórios
- No dia da cirurgia inicial, raspar a face anterior inferior do abdome, limpando a área da parte lateral do animal para passar ligeiramente além da linha média.
- Em seguida, use um produto depilatório (creme depilatório; ver Tabela de Materiais) para remover todos os pelos restantes nesta área (a face anterior inferior do abdômen, conforme descrito na etapa anterior).
- Lave e seque bem a área com esfoliação cirúrgica e solução de betadina (iodopovidona a 10%).
- Administrar 0,05 mg/kg de buprenorfina por via subcutânea.
3. Monitorização intraoperatória
- Certifique-se de que o animal permaneça com isoflurano a 1%-3% através de um vaporizador de precisão e cone nasal durante toda a cirurgia. Monitore a frequência respiratória, a respiração e o nível de saturação de oxigênio do animal por observação visual e um oxímetro de pulso de roedor feito para um rato.
OBS: A frequência respiratória típica é de 80-90 ciclos por minuto14,15. Qualquer reação que indique consciência observada durante a cirurgia requer o aumento da taxa de isoflurano. - Coloque o animal em uma almofada de aquecimento durante toda a cirurgia, pois a temperatura corporal dos roedores esfria rapidamente sob anestesia.
4. Retirada do retalho epigástrico
- Coloque o animal em decúbito dorsal. Faça a barba do abdome abaixo da prega inguinal até acima do nível do processo xifoide.
- Usando uma caneta de pele estéril e régua, marque primeiro a linha média do abdômen do animal e, em seguida, a prega inguinal. Uma incisão ao longo da linha da prega inguinal expõe o ramo inferior dos vasos epigástricos dos vasos femorais.
- Antes da incisão, desenhar o futuro retalho em forma oval ou retangular até 6 cm na vertical e 3 cm na horizontal, estendendo-se cranialmente a partir da prega inguinal.
- Desenhar cinco ou seis marcas equidistantes perpendiculares aos limites do retalho. Estes servem como guias para melhor realinhamento da pele após o retalho ter sido levantado e ser suturado novamente no local (Figura 1).
- Usando tesoura de Ragnell (ver Tabela de Materiais), faça uma incisão longitudinal de 3-4 cm na prega inguinal.
NOTA: Os pesquisadores devem ter cuidado e puxar a pele para cima para evitar danificar os vasos. - Expor e identificar os vasos femorais e epigástricos usando pinças microcirúrgicas #4 joalheiros (ver Tabela de Materiais), abrindo e fechando a pinça para separar a fáscia e ter acesso aos vasos que estão abaixo do coxim gorduroso inguinal.
- Utilizar a incisão inguinal para iniciar a incisão do retalho com tesoura de Ragnell. Preste atenção para minar a espessura total da pele e do tecido conjuntivo sobre o músculo abdominal.
- Para facilitar a colheita do retalho, certifique-se de que a tesoura siga o plano de dissecção correto, empurrando em direção ao músculo e espalhando as lâminas da tesoura. Execute esse descolamento do retalho movendo-se em uma direção coordenada ao redor do desenho do retalho.
NOTA: Para determinar o plano adequado, nenhum microvaso deve permanecer presente abaixo do plano de dissecção.
- Para facilitar a colheita do retalho, certifique-se de que a tesoura siga o plano de dissecção correto, empurrando em direção ao músculo e espalhando as lâminas da tesoura. Execute esse descolamento do retalho movendo-se em uma direção coordenada ao redor do desenho do retalho.
- À medida que a ponta inicial do retalho é liberada da pele circundante, continuar a captação do retalho descolando da parte distal para a proximal, usando as pontas tesoura de Ragnell para separar o retalho do músculo enquanto cauteriza os vasos perfurantes e os vasos do plexo dérmico ao redor do retalho. Isso garante que todo o sangue flua para o retalho através dos vasos epigástricos.
NOTA: Deve-se ter atenção para não danificar a vasculatura do retalho puxando com muita força ou torcendo a pele enquanto o retalho está sendo retirado. Sugere-se colocar a porção livre do retalho cuidadosamente sobre o polegar da mão do cirurgião enquanto se trabalha a parte proximal do retalho. - Uma vez retirado o retalho, os ramos dos vasos epigástricos superficiais inferiores são visíveis na face profunda da pele. Procure encapsular a totalidade de ambos os ramos do SIEA com o retalho, levantando suavemente o retalho para cima para visualizar os vasos.
- Uma vez colhido o retalho, separar os coxins gordurosos da face inferior, tanto na face medial quanto na lateral do retalho. Utilizar o cautério bipolar (ver Tabela de Materiais) para cauterizar os coxins gordurosos próximos à borda da incisão, atentando-se para não lesar o pedículo epigástrico superficial inferior (Figura 2).
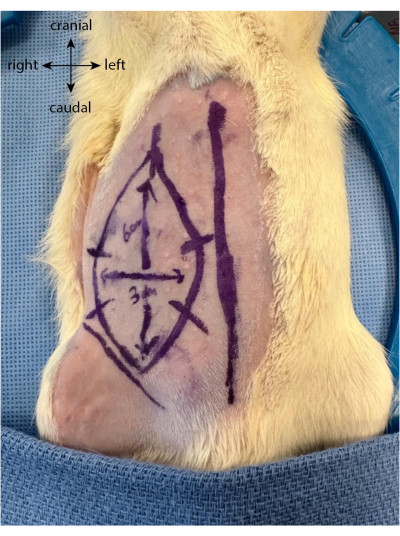
Figura 1: Desenho do retalho no abdome do animal. A linha média é utilizada como marcador para localizar a localização do retalho epigástrico. Clique aqui para ver uma versão maior desta figura.
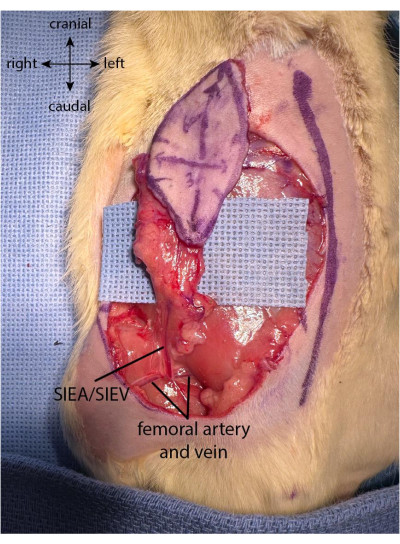
Figura 2: Retalho totalmente elevado. O coxim gorduroso é preservado na parte proximal do retalho para preservar a vascularização proveniente do pedículo epigástrico superficial inferior. Clique aqui para ver uma versão maior desta figura.
5. Preparo do vaso e indução de isquemia
OBS: O retalho é totalmente colhido nesta fase, mas os vasos ainda não estão preparados para o pré-condicionamento isquêmico.
- Antes da preparação dos vasos femorais, injetar uma dose única de 17,5 UI de heparina sódica através da veia peniana.
NOTA: Esta injeção é feita expondo a glande, segurando o pênis externamente usando pinça de Adson atraumática, identificando a veia peniana e injetando superficialmente e ao longo da veia peniana usando uma seringa 27G. - Para criar uma melhor exposição, coloque o animal dentro de um afastador auto-retentor Lone Star (consulte a Tabela de Materiais).
OBS: As estadas elásticas Lone Star afastam a pele do local cirúrgico, permitindo uma melhor visualização dos vasos. O pesquisador agora deve trabalhar sob microscópio cirúrgico (aumento de 40x). - Para exposição dos vasos, utilizar duas pinças microcirúrgicas #4 para dissecar os vasos femorais proximal e distalmente à emergência dos vasos epigástricos superficiais. Não segure os vasos diretamente, mas use a pinça para separar suavemente o tecido conjuntivo camada por camada, abrindo e fechando a pinça verticalmente para os vasos.
- Nos vasos femorais distais, limpe a fáscia e libere suavemente o nervo da artéria e da veia. Usando um 8-0 sutura com náilon (ver Tabela de Materiais), ligadura dos vasos femorais distais contornando o porta-agulha microcirúrgico sob a artéria e veia, apertando a sutura e amarrando esses vasos (Figura 3). O nervo não deve ser lesado nem amarrado para minimizar a morbidade pós-operatória.
NOTA: Os cirurgiões podem usar uma das pinças para puxar suavemente a fáscia lateral ao nervo com uma mão e usar outro par para separar totalmente o nervo dos vasos. - Usando um 8-0 suturar, ligadura dos vasos distais logo após a emergência dos vasos epigástricos, deixando uma distância de 1 mm após a origem do pedículo. Isso garante que nenhum fluxo reverso venha através do SIEA dos ramos profundos durante as fases isquêmicas.
OBS: A Figura 3 mostra a ligadura dos vasos femorais distais após a emergência do pedículo da SIEA. - Nos vasos femorais proximais, repetir o mesmo processo de limpeza do tecido conjuntivo. No entanto, separe a artéria e a veia uma da outra para permitir um pinçamento eficiente. Isso pode ser conseguido colocando-se suavemente pinças fechadas entre a artéria e a veia e abrindo lentamente as pinças na direção de corrida dos vasos.
- Para induzir isquemia intermitente, colocar pinças microcirúrgicas separadamente em cada artéria e veia femoral proximal (Figura 4).
- Ao término das lesões isquêmicas, sutura do retalho à sua posição original, alinhando-se as marcações conforme traçado no pré-operatório (passo 4.2.2). Sutura do retalho com fio de náilon 3-0 (ver Tabela de Materiais), iniciando-se na prega inguinal medialmente, ao redor do retalho, e terminando na prega inguinal lateralmente.
OBS: Ao longo da prega inguinal, pode-se utilizar a mesma sutura para colocação de pontos interrompidos. Isso permite que os pesquisadores abram essa área sem afetar o fechamento do retalho. - Para verificar o suprimento sanguíneo para o retalho, injetar 0,25 mL de fluoresceína sódica estéril (10%, ver Tabela de Materiais) na veia peniana usando a mesma técnica e ferramentas descritas para a injeção de solução salina de heparina (passo 5.1). Após 3 min, ilumine uma lâmpada UV-366 nm de onda longa (luz de excitação fluoresceína) para revelar as áreas fluorescentes correspondentes às áreas perfundidas.
- Após o fechamento e verificação, espalhe metronidazol triturado (ver Tabela de Materiais) ao longo das suturas para evitar automutilação e borrife atadura líquida na mesma área.
- Antes da recuperação do animal da anestesia, administrar Carprofeno (2-5 mg/kg) por via subcutânea.
- Os pesquisadores agora podem acessar os vasos femorais, a única fonte de alimentação para o retalho, para testar regimes experimentais de pré-condicionamento isquêmico por vários dias seguidos. Em cada dia de cirurgia, fornecer uma dose de 2-5 mg/kg de Carprofeno por via subcutânea.
- Ao final do período de pré-condicionamento isquêmico, para retirar o retalho do suprimento sanguíneo epigástrico, cauterizar inferior ao coxim gorduroso ao longo da borda inferior do retalho.
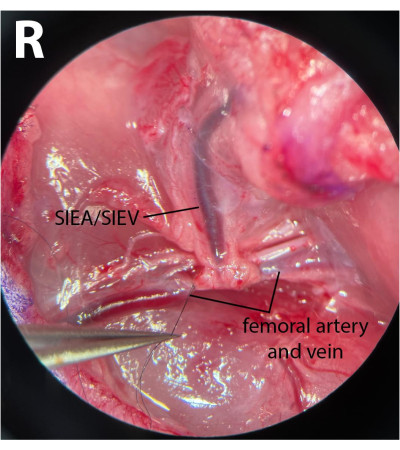
Figura 3: Visão microscópica dos vasos femorais. Os vasos femorais distais estão amarrados. O nervo foi preservado. O lado da dissecção é a prega inguinal direita (R). Ampliação: 40x. Clique aqui para ver uma versão maior desta figura.
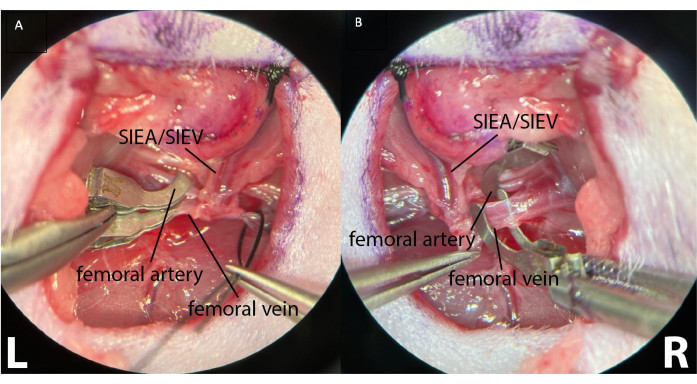
Figura 4: Pinçamento dos vasos femorais proximais com duas pinças microcirúrgicas separadas. Isso permite um melhor controle do clampeamento, garantindo a ausência de fluxo arterial e venoso retrógrado. (A) mostra ambos os vasos femorais esquerdos (L) pinçados. Os vasos epigástricos superficiais inferiores são visíveis (SIEA/SIEV). (B) mostra artéria femoral pinçada e veia femoral antes do pinçamento, na prega inguinal direita do animal (R). Ampliação: 40x. Clique aqui para ver uma versão maior desta figura.
6. Cuidados pós-operatórios
- Administrar Carprofeno (2-5 mg/kg) por via subcutânea uma vez ao dia por 4 dias de pós-operatório e uma vez após qualquer sedação suplementar.
- Durante as primeiras 24 h, observe o animal duas vezes. Em seguida, avaliar o animal e o retalho pelo menos uma vez ao dia até o final do estudo.
NOTA: O animal deve estar brilhante, alerta e reativo. Se houver sinais de infecções oportunistas sistêmicas (isto é, letargia ou perda de peso), o animal deve ser sacrificado seguindo protocolos aprovados pela instituição. - Monitorar o retalho quanto à necrose precoce (antes da ligadura no 5º dia de pós-operatório [DPO5]), deiscência do sítio cirúrgico, infecção, hematoma, isquemia e/ou autofagia do retalho.
- Se houver deiscência do sítio cirúrgico, desbridar as margens da cicatriz, limpar o local com iodopovidona a 10% antes de enxaguar abundantemente com água estéril ou soro fisiológico estéril e fechar a ferida com pontos de náilon 3-0 interrompidos.
- Ao final do estudo, sacrificar o animal com uma injeção IV de 0,1-0,2 mL de solução de fenobarbital sódico a 31% ou com o protocolo recomendado pela IACUC local. Confirmar a morte pela ausência de batimentos cardíacos e movimentos respiratórios.
Resultados
Todos os retalhos foram viáveis no POD5, mostrando boa vascularização pelo SIEA isoladamente. A Figura 5 mostra o retalho antes e após a injeção IV de fluoresceína, mostrando vascularização completa.

Figura 5: Angiofluoresceinografia intravenosa imediata (DPO0). Essa avaliação most...
Discussão
Este artigo descreve um modelo de retalho fasciocutâneo reprodutível colhido em ratos, permitindo a avaliação da I.P. Este protocolo cirúrgico passo a passo fornece aos grupos de pesquisa um modelo confiável para testar diferentes regimes de IP. Ao impedir qualquer vascularização que não seja o pedículo, esse modelo permite estudar a neovascularização do retalho a partir do leito e margem da ferida. Este estudo realizou a ligadura no DPO5, pois estudos prévios observaram a autonomização deste retalho em ra...
Divulgações
Todos os autores não têm interesse financeiro em declarar.
Agradecimentos
Este trabalho foi financiado pelo Massachusetts General Hospital (W.G.A) e Shriners Children's Boston (B.U, K.U, C.L.C). Y.B e I.F.v.R são financiados pelo Shriners Hospitals for Children (ID da proposta: #970280 e #857829 respectivamente).
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe Luer-Lok Tip | BD | 309628 | |
| 3-0 Ethilon 18” Black Monofilament Nylon suture | Ethicon | ETH-663H | |
| 8-0 Ethilon 12” Black Monofilament Nylon suture | Ethicon | 1716G | |
| Adson Atraumatic Forceps | Aesculap Surgical Instruments | BD51R | |
| Akorn Fluorescein Injection USP 10% Single Dose Vial 5 mL | Akorn | 17478025310 | |
| Betadine Solution 5% Povidone-Iodine Antiseptic Microbicide | PBS Animal Health | 11205 | |
| Bipolar Cords | ASSI | ASSI.ATK26426 | |
| Buprenorphine Hydrochloride Injection | PAR Pharmaceutical | 3003406C | This concentration needs to be diluted for rodents. |
| Depilatory product – Nair Hair remover lotion | Nair | NC0132811 | |
| Ear tag applier | World Precision Instruments | NC0038715 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | |
| Jewelers Bipolar Forceps Non-Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star elastic stays | Cooper Surgical | 3311-1G | |
| Lone star Self-retaining retractor | Cooper Surgical | 3304G | |
| Metronidazole tablets USP | Teva | 500111-333-06 | |
| Micro spring handle scissors | AROSurgical | 11.603.14 | |
| Microscope (surgical) | Leica | M525 F40 | |
| Microsurgical clamp applying forceps | Ambler Surgical | 31-906 | |
| Microsurgical clamps (x2) | Millennium Surgical | 18-B1V | |
| Microsurgical Dumont #4 forceps | Dumont Swiss made | 1708-4TM-PO | |
| Microsurgical needle holder | ASSI | B-14-8 | |
| Needle holder | World Precision Instruments | 501246 | |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | |
| Pixel analysis software | GNU Image Manipulation Program v2.10 | GIMP | GNU Open licence |
| PrecisionGlide Needle 27 G | BD | 305109 | |
| Ragnell Scissors | Roboz Surgical | RS-6015 | |
| Rimadyl (carprofen) | Zoetis | 10000319 | This concentration needs to be diluted for rodents |
| Scientific Elizabethan collar (e-collar) for Rats | Braintree Scientific | NC9263311 | |
| Small animal ear tag | National Band & Tag Company | Style 1005-1 | |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Sterile towel drape | Dynarex Corporation | 4410 | |
| Sterile water for injection and irrigation | Hospira | 0409488724-1 | |
| Surgical scrub – BD ChloraPrep Hi-Lite Orange 3 mL applicator with Sterile Solution | BD | 930415 | |
| UV lamp | UVP | UVL-56 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Referências
- Copelli, C., et al. Management of free flap failure in head and neck surgery. ACTA Otorhinolaryngologica Italica. 37 (5), 387-392 (2017).
- Lese, I., Biedermann, R., Constantinescu, M., Grobbelaar, A. O., Olariu, R. Predicting risk factors that lead to free flap failure and vascular compromise: A single unit experience with 565 free tissue transfers. Journal of Plastic, Reconstructive & Aesthetic Surgery. 74 (3), 512-522 (2021).
- Wang, W., et al. Flap failure and salvage in head and neck reconstruction. Seminars in Plastic Surgery. 34 (4), 314-320 (2020).
- Gabrysz-Forget, F., et al. Free versus pedicled flaps for reconstruction of head and neck cancer defects: a systematic review. Journal of Otolaryngology - Head & Neck Surgery. 48 (1), 13 (2019).
- Sievert, M., et al. Failure of pedicled flap reconstruction in the head and neck area: A case report of a bilateral subclavian artery stenosis. International Journal of Surgery Case Reports. 76, 381-385 (2020).
- Vaienti, L., et al. Failure by congestion of pedicled and free flaps for reconstruction of lower limbs after trauma: the role of negative-pressure wound therapy. Journal of Orthopaedics and Traumatology. 14 (3), 213-217 (2013).
- Murry, C. E., Jennings, R. B., Reimer, K. A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 74 (5), 1124-1136 (1986).
- Akcal, A., et al. Combination of ischemic preconditioning and postconditioning can minimise skin flap loss: experimental study. Journal of Plastic Surgery and Hand Surgery. 50 (4), 233-238 (2016).
- Ulker, P., et al. Does ischemic preconditioning increase flap survival by ADORA2B receptor activation. Clinical Hemorheology and Microcirculation. 75 (2), 151-162 (2020).
- Min, S. -. H., Choe, S. H., Kim, W. S., Ahn, S. -. H., Cho, Y. J. Effects of ischemic conditioning on head and neck free flap oxygenation: a randomized controlled trial. Scientific Reports. 12 (1), 8130 (2022).
- Dacho, A., Lyutenski, S., Aust, G., Dietz, A. Ischemic preconditioning in a rat adipocutaneous flap model. HNO. 57 (8), 829-834 (2009).
- Yildiz, K., et al. Comparison of the flap survival with ischemic preconditioning on different pedicles under varied ischemic intervals in a rat bilateral pedicled flap model. Microsurgery. 34 (2), 129-135 (2014).
- Ottomann, C., Küntscher, M., Hartmann, B., Antonic, V. Ischaemic preconditioning suppresses necrosis of adipocutaneous flaps in a diabetic rat model regardless of the manner of preischaemia induction. Dermatology Research and Practice. 2017, 4137597 (2017).
- Grimaud, J., Murthy, V. N. How to monitor breathing in laboratory rodents: a review of the current methods. Journal of Neurophysiology. 120 (2), 624-632 (2018).
- Strohl, K. P., et al. Ventilation and metabolism among rat strains. Journal of Applied Physiology. 82 (1), 317-323 (1997).
- Mucke, T., et al. Autonomization of epigastric flaps in rats. Microsurgery. 31 (6), 472-478 (2011).
- Hsu, C. -. E., et al. The rat groin flap model redesigned for evaluating treatment effects on ischemia-reperfusion injury. Journal of Surgical Research. 222, 160-166 (2018).
- Mücke, T., et al. Indocyanine green videoangiography-assisted prediction of flap necrosis in the rat epigastric flap using the flow® 800 tool. Microsurgery. 37 (3), 235-242 (2017).
- Wang, D., Chen, W. Indocyanine green angiography for continuously monitoring blood flow changes and predicting perfusion of deep inferior epigastric perforator flap in rats. Journal of Investigative Surgery. 34 (4), 393-400 (2021).
- Berkane, Y., et al. How to secure pedicled flaps using perioperative indocyanine green angiography: a prospective study about 10 cases. World Journal of Surgery and Surgical Research. 4 (1), 1319 (2021).
- Alstrup, T., Christensen, B. O., Damsgaard, T. E. ICG angiography in immediate and delayed autologous breast reconstructions: peroperative evaluation and postoperative outcomes. Journal of Plastic Surgery and Hand Surgery. 52 (5), 307-311 (2018).
- Küntscher, M. V., et al. Ischemic preconditioning by brief extremity ischemia before flap ischemia in a rat model. Plastic and Reconstructive Surgery. 109 (7), 2398-2404 (2002).
- Liu, R. Q., et al. Cost analysis of indocyanine green fluorescence angiography for prevention of anastomotic leakage in colorectal surgery. Surgical Endoscopy. 36 (12), 9281-9287 (2022).
- Cheng, M. H., et al. Devices for ischemic preconditioning of the pedicled groin flap. The Journal of Trauma. 48 (3), 552-557 (2000).
- Xiao, W., et al. An innovative and economical device for ischemic preconditioning of the forehead flap prior to pedicle division: a comparative study. Journal of Reconstructive Microsurgery. 38 (9), 703-710 (2022).
- Küntscher, M. V., Hartmann, B., Germann, G. Remote ischemic preconditioning of flaps: a review. Microsurgery. 25 (4), 346-352 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados