A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
כימות ציטוטוקסיות תאית תלוית נוגדנים במודל ספרואידי גידול: יישום לגילוי תרופות
In This Article
Summary
במאמר זה אנו מציגים שיטה לזיהוי תרכובות המווסתות את מנגנון ADCC, מנגנון חשוב להרג תאים סרטניים של נוגדנים אנטי-סרטניים. ההשפעה ציטוטוקסית של תאי NK נמדדת בספרואידים של תאי סרטן השד בנוכחות Trastuzumab. ניתוח תמונה מזהה רוצחים חיים ומתים ותאי מטרה בספרואידים.
Abstract
אימונותרפיה מבוססת נוגדנים חד-שבטיים המכוונת לאנטיגנים סרטניים היא כיום עמוד התווך של הטיפול בסרטן. אחד ממנגנוני הפעולה הרלוונטיים מבחינה קלינית של הנוגדנים הוא ציטוטוקסיות תאית תלוית נוגדנים (ADCC), שבה הנוגדן נקשר לתאים הסרטניים ומפעיל את המרכיב התאי של מערכת החיסון, למשל תאי הרג טבעי (NK), כדי להרוג את תאי הגידול. ניתן לשפר את יעילותם של טיפולים אלה על ידי זיהוי תרכובות אדג'ובנטיות המגבירות את הרגישות של התאים הסרטניים או את עוצמת תאי החיסון. בנוסף, אינטראקציות בין תרופתיות שלא התגלו בחולי סרטן שקיבלו טיפול תרופתי משותף למצבים קודמים או תסמינים הקשורים לסרטן עשויות לקבוע את הצלחת הטיפול בנוגדנים; לכן, אינטראקציות לא רצויות כאלה בין תרופתיות צריכות להיות מסולקות. מתוך מחשבה על מטרות אלה, יצרנו מודל ADCC לסרטן ואנו מתארים כאן פרוטוקול פשוט למציאת תרופות המווסתות ADCC. מכיוון שמודלים תלת-ממדיים כגון ספרואידים של תאים סרטניים עדיפים על תרביות דו-ממדיות בניבוי תגובות in vivo של גידולים לטיפולים אנטי-סרטניים, תרביות משותפות של תאי סרטן שד המבטאים EGFP HER2+ JIMT-1 ו-NK92. קווי תאים CD16 הוקמו והושרו עם Trastuzumab, נוגדן חד שבטי שאושר קלינית נגד סרטן שד חיובי ל- HER2. ספרואידים מסוג JIMT-1 הורשו להיווצר בלוחות דוחי תאים מסוג U 96 בארות. ביום השלישי נוספו תאי NK וטרסטוזומאב. לאחר מכן הוכתמו הספרואידים ב-Annexin V-Alexa 647 כדי למדוד מוות של תאים אפופטוטיים, אשר כומת באזור ההיקפי של הספרואידים באמצעות מיקרוסקופ אוטומטי. היישום של הבדיקה שלנו לזיהוי מולקולות אפנון ADCC מודגם על ידי מראה כי Sunitinib, מעכב קולטן טירוזין קינאז שאושר על ידי ה- FDA נגד סרטן גרורתי, מבטל כמעט לחלוטין ADCC. הדור של הספרואידים וצינורות רכישת התמונה והניתוח תואמים לבדיקות סקר בתפוקה גבוהה עבור תרכובות מווסתות ADCC בספרואידים של תאים סרטניים.
Introduction
ספרואידים רב-תאיים של גידולים (MCTS) נמצאים בשימוש נרחב במודלים תלת-ממדיים (תלת-ממדיים) הנוצרים עקב נטייתם של תאים דבקים להצטבר ומייצגים כלי חשוב להשגת תובנה מכניסטית בביולוגיה של התא הסרטני. הם יכולים להיווצר ממגוון רחב של סוגי תאים על ידי טכניקות רבות, כגון תרביות תלת ממד מבוססות נוזל ופיגומים1. היתרון העיקרי שלהם על פני מודלים דו-ממדיים חד-שכבתיים הוא שהם משחזרים את המאפיינים העיקריים של גידולי in vivo , כלומר ארגון מבני והיפוקסיה, על ידי חיקוי ההתנהגות הביולוגית של תאי הגידול, במיוחד המנגנונים המובילים לבריחה טיפולית ועמידות לתרופות2. לכן, מאחר ש-MCTS יכולים לשפר את יכולת החיזוי של רעילות ורגישות לתרופות, הם נמצאים בשימוש נרחב לחקר סרטן בתלת-ממד ויכולים לשפר את הפיתוח של תרופות יעילות לסוגים שונים של סרטן3.
כדי לחקור כל מחלה, יש צורך קריטי מודלים רלוונטיים ונוחים. הקמת מודלים למחקרי אימונולוגיה של סרטן היא מאתגרת מכיוון שמערכת החיסון מורכבת ממספר סוגי תאים. לכל סוג תא יש מספר תת-סוגים וספקטרום רחב של מצבי שפעול. סוגי תאי חיסון שונים אלה מתקשרים עם תאים סרטניים ומרכיבים סרטניים אחרים, ובסופו של דבר משפיעים על תוצאות המחלה. שיטות דו-ממדיות של תרביות תאים במבחנה אינן מצליחות לשחזר אינטראקציות תאיות מורכבות אלה, מכיוון שהן חסרות יכולת תרגום ואינן מסוגלות לחזות את פעולת התרופה ברמת המערכת (למשל, ברקמות)4,5. יתר על כן, מודלים עכברים יש גם מגבלות חמורות בשל ההבדלים הבסיסיים בין המערכת החיסונית האנושית ו murine. מערכות תרבית תלת-ממדיות יכולות, אם כן, למלא את הפערים הנוכחיים במודלים הזמינים, לספק שיטה חלופית ולשפר את הבנתנו את האימונולוגיה של סרטן6. באופן ספציפי, מודלים ספרואידים עשויים לשמש לבדיקת אימונותרפיה, בעיקר כדי להעריך את היעילות של בדיקת תרופות ונוגדנים טיפוליים לשיפור חדירת תאי מערכת החיסון והשפעות אנטי-גידוליות נגד מטרות הספרואידים7. יתר על כן, הפוטנציאל של MCTS המורכב מתאים במצבים מטבוליים ושגשוגיים שונים לחקור את יחסי הגומלין בין תאי סטרומה (למשל, לימפוציטים, מקרופאגים, פיברובלסטים) ותאים סרטניים ולפיתוח אסטרטגיות אנטי-סרטניות חדשות הוכח היטב8. לפיכך, יש צורך חיוני לאשש פלטפורמות חיזוי ומדויקות על מנת להגביר את תהליך בדיקת התרופות, תוך התחשבות בפתופיזיולוגיה של המיקרו-סביבה של הגידול.
סרטן השד (BC) הוא הסרטן השכיח ביותר המאובחן בעולם אצל נשים. הסיווג הקליני של מחלה הטרוגנית זו מבוסס על נוכחותם של קולטנים טרנסממברנליים כגון קולטני אסטרוגן (ER) ופרוגסטרון (PR) (הנקראים ביחד קולטני הורמונים, HR) יחד עם ביטוי יתר או הגברה של קולטן גורם גדילה אפידרמלי אנושי 2 (HER2) חלבון/אונקוגן . בהתבסס על הביטוי האימונוהיסטוכימי של קולטנים אלה, ארבעה תת-סוגים מוכרים בדרך כלל: לומינלי A (HR+/HER2-), לומינלי B (HR+/HER2+), HER2-חיובי (HR-/HER2+) וסרטן שד טריפל נגטיב (HR-/HER2-). קבוצת HER2+ מהווה 10-15% ממקרי BC ומאופיינת בביטוי HER2 גבוה עם היעדר ER ו- PR, בעלת פרוגנוזה גרועה יותר בהשוואה לגידולים לומינליים ודורשת תרופות ספציפיות המכוונות נגד חלבון HER2/neu9.
התפתחות BC היא תהליך רב שלבי, ואבחון מוקדם חיוני לטיפול מוצלח במחלה10. עם זאת, למרות אפשרויות טיפול BC מותאמות אישית שהתגלו לאחרונה (למשל, טיפולים אנדוקריניים ונוגדנים נגד HER2), BC ממשיך לאתגר אונקולוגים. בדיוק כמו ניתוחים, כימותרפיה והקרנות, גם לטיפולים מותאמים אישית אלה יכולות להיות תופעות לוואי חמורות וחולים יכולים לפתח עמידות לחומרים אלה, מה שהופך את קביעת האסטרטגיה הטובה ביותר11,12 לאתגר ארוך טווח. לפיכך, הבנה משופרת של יחסי הגומלין בין הגידול לבין המיקרו-סביבה שלו חיונית וצפויה לספק כיוונים חדשים לפיתוח טיפולים חדשניים הלוקחים בחשבון את הספציפיות של תת-הסוגים השונים של BC13. גל חדש של אימונותרפיה, כגון תרופות מצומדות נוגדנים, טיפולים מאומצים בתאי T, חיסונים ונוגדנים חד-שבטיים חדשניים (mAbs) מכווני HER2 נחקרים באוכלוסייה רחבה של חולים עם גידולים המבטאים HER214.
Trastuzumab, למשל, מייצג שיטת טיפול יעילה עבור HER2+ BC. כחלק מאופן הפעולה שלו, Trastuzumab מתווך פעילויות תלויות קולטן גמא גבישי פרגמנט (FcγR). FcγRs נבדלים על ידי זיקתם למקטע Fc והתגובה החיסונית שהם יוזמים. הפעלת FcγRIIIa (CD16A) על תאי הרג טבעי (NK) חיונית לתיווך ציטוטוקסיות תאית תלוית נוגדנים (ADCC), ואילו הפעלת FcγRIIa (CD32A) ו-FcγRIIIa על מקרופאגים גורמת לפאגוציטוזה תאית תלוית נוגדנים (ADCP)15. מחקרים על מודלים של בעלי חיים הראו כי עכברים ללא קולטני FcγRI (CD64) ו-FcγRIII (CD16) לא היו מסוגלים ליזום תגובות חיסוניות מגינות נגד אנטיגנים ספציפיים לגידול, מה שחשף כי ADCC הוא ככל הנראה מנגנון פעולה עיקרי עבור mAb Trastuzumab16.
מאחר שתאי NK משתמשים ב-ABS הקשור לתאי הגידול לצורך הרג תאים סרטניים על-ידי ADCC, ביטוי קולטני Fc הוא קריטי לטיפול יעיל ב-Trastuzumab17 (איור 1). יתר על כן, פעולתם מאוזנת ביעילות על ידי גירוי של קולטנים מפעילים ומעכבים, למשל, קולטנים דמויי אימונוגלובולינים של תאי הרג (KIR)18.
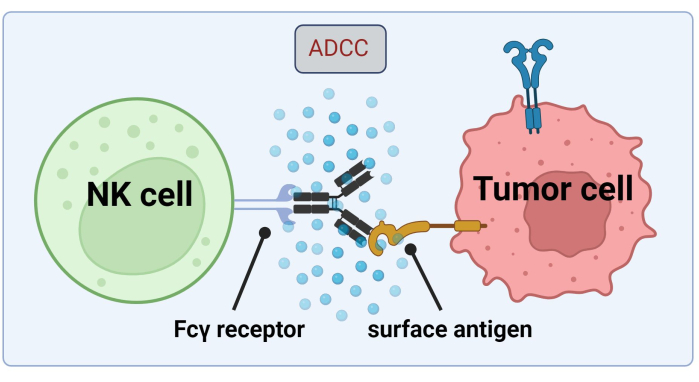
איור 1. מנגנון של ADCC בהקשר של תגובה אנטי-סרטנית. קולטן Fcγ של תא הרג טבעי (NK) מזהה את אזור Fc של נוגדן, אשר קודם לכן נקשר לאנטיגן פני השטח על תא סרטני. סינפסה אימונולוגית זו מובילה לדגרנולציה של תא NK, אשר משחרר מתווכים ציטוטוקסיים כגון גראנזימים ופרפורין. מולקולות אלה תורמות להיווצרות נקבוביות בקרום התא ומפעילות מסלולים אפופטוטיים הגורמים למוות תאי מתוכנת של תא המטרה (תמונה שנוצרה באמצעות Biorender.com). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
פיתוח אימונותרפיה עבור HER2+ BC מייצג תחום מתפתח. במקרה זה, יש לשקול אינטראקציות בין מרכיבים שונים של המערכת החיסונית. יתר על כן, פרסומים קודמים בחנו בהרחבה טיפולים משולבים הכוללים את כל סוגי הטיפולים המסורתיים, חיסוניים או תאיים כדי לזהות שילובים סינרגטיים19.
מספר מודלים תלת-ממדיים של HER2+ BC שימשו בעבר לגילוי תרופות. לדוגמה, Balalaeva et al. השתמשו בספרואידים SKBR-3 המבטאים יתר על המידה את HER2 כדי להעריך את ציטוטוקסיות הרעלן החיסוני ממוקד HER2 4D5scFv-PE4020. במחקר אחר, הוקמה מערכת תרבית תלת-ממדית מבוססת מטריג'ל HER2+ BC כדי למדוד את גדילת התאים בתגובה לטרסטוזומאב ולסוכנים אנדוקריניים21. מחקרים אלה מדגישים את החשיבות של מודלים ספרואידים סרטניים של HER2 המבטאים יתר על המידה תאים סרטניים בייצוג אסטרטגיה יעילה לשיפור קליני של תגובות טיפוליות22.
הקבוצה שלנו זיהתה בעבר את Sunitinib, מעכב טירוזין קינאז רב-ממוקד, כמעכב ADCC תלוי Trastuzumab בתאי JIMT-1 HER2+ BC בבדיקת תרבית דו-ממדית. המחקר גילה כי סוניטיניב גורם לאוטופגיה ופוגע בתפקוד ההרג של תאי NK, מוריד את יכולת הביטוי של HER2 ומשפר את חיבור פני השטח של תאי JIMT-117.
כאן הקמנו מודל ADCC תלת-ממדי ספרואידי חדשני (NK.92.CD16+Trastuzumab+JIMT-1-EGFP תאים סרטניים) שישמש ליישומי סינון בעלי תפוקה גבוהה, ועל מנת לאמת את הממצאים הנ"ל, סוניטיניב שימש כתרכובת מודל. ראשית, יצרנו EGFP המבטא תאי JIMT-117 וגידלנו ספרואידים מתאים אלה. ADCC הושרה על-ידי תאי NK יחד עם Trastuzumab, וספרואידים נשמרו בתרבית בנוכחות או היעדר תרכובות בדיקה במשך 24 שעות (איור 2). כימות ADCC מבוסס על זיהוי מוות של תאי סרטן אפופטוטיים (צביעת Annexin V) באמצעות מערכת ניתוח תוכן גבוה.
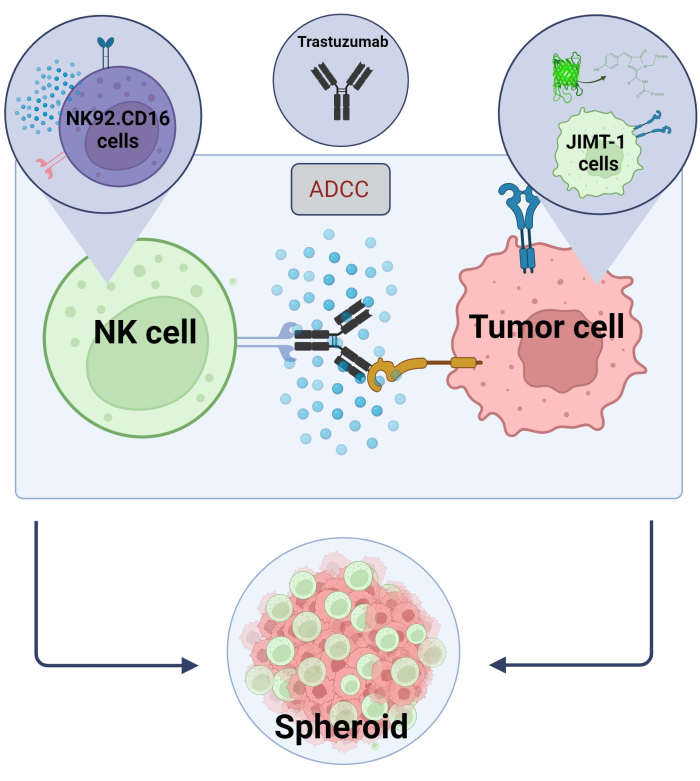
איור 2. ADCC במערכת תרבית משותפת ספרואידית תלת-ממדית. הגדרות הניסוי שלנו מבוססות על מערכת ספרואידית תלת-ממדית שיכולה למדל בצורה מדויקת יותר את המיקרו-סביבה in vivo בהשוואה למודלים דו-ממדיים. תאי סרטן השד JIMT-1 EGFP נזרעו על קרקעית קעורה דוחה תאים ליצירת צביר תאי בצורת עגול, הנקרא ספרואיד. ADCC החלה אז על ידי הוספת NK92. תאי הרג טבעיים CD16 (יחס E:T = 20:1) ונוגדן חד שבטי אנטי-HER2, Trastuzumab. המודל הניסיוני הוכח כיעיל וקל ליישום לזיהוי תרכובות בדיקה לשינוי ADCC (התמונה נוצרה באמצעות Biorender.com). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הוכחנו כי השגת נתונים באופן זה יכולה להיעשות בזמן אמת והיא איתנה סטטיסטית לשימוש בבדיקות סקר בעלות תוכן גבוה בגילוי תרופות לסרטן. חשוב לציין, מודל זה מאפשר אימות מורחב של קבוצה גדולה יותר של תרכובות, וניתן ליישם אותו על מספר בדיקות מעניינות.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הגדרת מודל ספרואיד של חלבון פלואורסצנטי משופר JIMT-1 (EGFP)
- כדי ליצור תחתית דוחה תאים בצורת U, צפו את הצלחת בעלת 96 הבארות בתמיסת אגרוז-PBS של 0.5% (30 μL/well). דוגרים על הצלחת בטמפרטורת החדר כ-30-45 דקות.
- שטפו את תאי JIMT-1-EGFP פעמיים עם 2 מ"ל של PBS סטרילי (יצירת קו תאי JIMT1-EGFP דווחה בפרסום קודם17). יש להשתמש בצלוחיות תרבית רקמה מסוג T25 ובמדיה JIMT-1 (DMEM/F-12 בינוני בתוספת 20% סרום בקר עוברי (FBS), אינסולין 0.3 U/mL (100 IU/mL, Humulin R) ו-1% פניצילין-סטרפטומיצין) לתרבית תאים.
- הוסף 2 מ"ל של טריפסין-EDTA לבקבוק ודגר אותו במשך 10 דקות באינקובטור CO2 .
- הקש על הבקבוק כדי לבדוק אם תאי JIMT-1 התנתקו לאחר זמן הדגירה.
- השתמש 2 מ"ל של מדיום JIMT-1 כדי לעצור את העיכול ולאסוף את תרחיף התא לתוך צינור 15 מ"ל.
- ספרו את התאים בתא Bürker עם 0.4% טריפאן כחול (80 μL של הצבע + 20 μL של תרחיף התא) והתאימו את מספר התא ל-20,000 תאים/מ"ל.
- פיפטה 100 μL של תרחיף התא (2000 תאים / באר) לכל באר של צלחת 96 באר (מצופה מראש בתמיסת 0.5% agarose-PBS כמצוין ב 1.1).
- אפשרו לתאים להתקבץ יחד במהלך זמן דגירה של 3 ימים בטמפרטורה של 37°C באינקובטורCO2 .
- בדוק באופן קבוע את הגודל והצורה של ספרואידים עם מיקרוסקופ הפוך.
2. ציפוי צלחת HCS
הערה: כדי למנוע חיבור של כדורי JIMT-1-EGFP למשטח הזכוכית של הצלחת, ציפוי צלחת סינון התוכן הגבוה (HCS) הוא חיוני (אחרת ניתוח תוכן גבוה לא היה אפשרי).
- ביום השלישי לאחר השראת הספרואידים, צפו את צלחת ההקרנה בעלת 96 הבארות בעלות התוכן הגבוה בפלורוניק-F127 (0.5% ב-DMSO, 50 מיקרוליטר/באר) ודגרו על הצלחת במשך 45 דקות בטמפרטורת החדר.
- שאפו את תמיסת הציפוי ושטפו את הבארות פעמיים במדיום נטול DMEM/F-12 בסרום (100 מיקרוליטר/באר).
3. העברת ספרואידים לצלחת HCS
- באמצעות פיפטה 1 מ"ל, להעביר את spheroids ב triplicates לתחתית זכוכית 96-באר HCS לוחית.
4. טיפול מקדים בכדורי JIMT-1 EGFP עם תרכובות בדיקה
- הוסף את תרכובת הבדיקה (למשל, Sunitinib מדולל ב- DMSO בריכוז של 40 μM) על ידי pipetting 10 μL / באר ולהוסיף 10 μL של מדיום JIMT-1 טרי לבארות הבקרה (CTL).
- לדגור את הצלחת במשך 1 שעה באינקובטור CO2 ב 37 ° C.
5. אינדוקציה של ADCC על ידי הוספת תאי האפקט
הערה: תאי CD16.176V.NK92 (להלן תאי NK) גודלו בתרבית ב-α-MEM בתוספת 20% FBS, 1% MEM-NEAA, 1% Na-פירובט, 1% גלוטמין, 1% פניצילין-סטרפטומיצין ו-100 IU/mL של IL-2.
- לאסוף את תאי NK בבקבוק לתוך צינור 15 מ"ל. ספור את התאים עם כחול טריפאן (80 μL של הצבע + 20 μL של תרחיף התא) והתאם את צפיפות התא ליחס של 20:1 אפקט למטרה (E:T) (40,000 תאי NK/באר).
- צבעו את תאי ה-NK ב-10 μM Cell Tracker Blue (CTB, 1 μL ב-1 מ"ל של מדיום NK α-MEM) והכניסו אותם לאינקובטור CO2 בטמפרטורה של 37°C למשך שעה אחת.
- צנטריפוגו את תאי ה-NK בטמפרטורה של 150 x גרם למשך 3 דקות בטמפרטורת החדר פעמיים כדי לשטוף את עודפי הצבע עם 1 מ"ל של מדיום α-MEM.
- להשעות מחדש את גלולת תא NK ב 1 מ"ל של מדיום JIMT-1 טרי.
- הוסף את תאי ה- NK המוכתמים יחד עם נוגדן האנטי-HER2 (Ab) (Trastuzumab, מומס ב- H2O מזוקק סטרילי) לספרואידים היעד JIMT-1 על ידי פיפטציה של 55 μL / well של תאי NK מוכתמים ב- CTB ו- 55 μL / well של 10 μg / mL Ab בתווך JIMT-1 (נפח הטיפול הכולל שנוסף עבור ADCC הוא 110 μL / well והריכוז הסופי של Sunitinib הוא 20 μM).
הערה: לבחירת ריכוז Ab ויחס E:T, הסתמכנו על הפרסום הקודם שלנו17. ניסויים ראשוניים בוצעו עם יחסי E:T שונים וריכוזים שונים של Trastuzumab כדי להעריך איזה מהם היה היעיל ביותר בגרימת ADCC בספרואידים (איור משלים S1). - הוסף 110 μL / באר של בארות JIMT-1 בינוני טרי לבקרה (CTL).
- לדגור את הצלחת במשך 24 שעות באינקובטור CO2 ב 37 ° C.
הערה: מכיוון שתאי NK92 ידועים כמפעילים פונקציות ציטוטוקסיות לא ספציפיות, לבקרה יש להשתמש בתאי JIMT-1 המודגרים יחד עם שני תאי NK בלבד ועם בקרת איזוטיפ או F(ab')2 Ab. כאן F(ab')2-Trastuzumab (TR-F(ab')2) שימש CTL שלילי. קטע TR-F(ab')2 הוכן כפי שדווח על ידי Tóth et al.19 ונוסף באותו נפח כמו Trastuzumab יחד עם תאי NK כמתואר ב-5.5. הריכוז הותאם ל-6.6 מיקרוגרם/מ"ל בהתאמה לריכוז שווה משקל עם טרסטוזומאב23.
6. נספח V-647 צביעת ספרואידים
- כדי למדוד מוות של תאים אפופטוטיים, הכתימו את הספרואידים עם Annexin V-Alexa Fluor 647 מצומדים למשך שעה בתווך JIMT-1 (1:100) על ידי פיפטציה של 50 μL/באר.
7. הדמיה
הערה: הלוח מצולם במהירות של 24 שעות לאחר הוספת תאי אפקט NK לתאי היעד. עבור הדמיה, מנתח תוכן גבוה ותוכנה לניתוח תמונה משמשים.
- בחרו את סוג המיקרו-לוחית מרשימת הלוחות באמצעות האפשרות 'סוג לוחית '. השתמש בלוח סינון תוכן גבוה (HCS) של 96 בארות.
- בחר מיקוד אוטומטי Two Peak כאשר הבדיקה מתבצעת בלוחות עם יעד 10x עם צמצם מספרי 0.3 (NA), באמצעות האפשרויות מיקוד אוטומטי ואובייקטיבי, בהתאמה. בחר מצב קונפוקלי עם האפשרות Opt. Mode והחל Binning 2 באמצעות האפשרות Binning.
- להדמיית ספרואידים, בחרו בערוצים המתאימים בעזרת האפשרות 'בחירת ערוץ '. כדי לזהות תאי JIMT-1 מותמרים של EGFP, בחר EGFP (זמן אינטגרציה 200 אלפיות השנייה, עוצמת לייזר 50%, גובה מחסנית 2.0 מיקרומטר; לדוגמה: 488 ננומטר em: 500-550 ננומטר), וכדי לזהות תאים אפופטוטיים השתמש ב- Alexa 647 (זמן שילוב 100 אלפיות השנייה, עוצמת לייזר 50%, גובה מחסנית 10.0 מיקרומטר; לדוגמה: 640 ננומטר em: 650-760 ננומטר). כדי להמחיש את תאי ה- NK בתוך הספרואידים, בחר את הערוץ הבא: DAPI (זמן שילוב 100 אלפיות השנייה, עוצמת לייזר 50%, גובה מחסנית 2.0 מיקרומטר; לדוגמה: 405 ננומטר em: 435-480 ננומטר).
- באפשרות 'בחירת פריסה ', בחרו 'ערימות Z', מכיוון שתאים בכדוריות נוטים להימצא במישורי מוקד שונים של המיקרוסקופ. 10 מטוסים (עם מרחק של 10 מיקרומטר) מספיקים כדי לכסות את כל האזור הספרואידי. הגדר את ערכי המישור הראשון והמישור האחרון על 0 מיקרומטר ו- 90 מיקרומטר, בהתאמה.
הערה: לפני תחילת המדידה, ניתן לצלם תמונות לדוגמה באמצעות פונקציית התמונה כדי לבדוק את ההגדרות הנכונות. - הגדר את מספר הבארות והשדות להדמיה באמצעות האפשרות Define Layout .
8. ניתוח תוכן גבוה (HCA)
הערה: נתח את התמונות באמצעות תוכנת הרמוניה או ייצא תמונות לניתוח באמצעות תוכנת צד שלישי מועדפת. לצורך ניתוח יעילות ADCC, נמדדת עוצמת הפלואורסצנטיות של Annexin V 647. תאי מטרה שנהרגים על ידי ADCC מופיעים באזור ההיקפי של הספרואידים. לכן, התאים החיוביים של Annexin V נמדדים ב"טבעת" ספרואידית זו. על מנת לאמת שיטה זו, בוצעו ניתוחים עם פרמטרים שונים כדי להעריך מי מהם היה האמין ביותר והניב את התוצאות הטובות ביותר (תרשים משלים S2). באר ADCC מוצגת בסרטון על מנת להדגים שלב אחר שלב את תהליך ניתוח התמונה.
- זהה את הספרואידים לפי פלואורסצנטיות EGFP של תאי JIMT-1 באמצעות האפשרות Find Texture Regions וסנן אותם לפי גודל (> 25,000 מיקרומטר2).
- הסר אובייקטי גבול לפי האפשרות בחר אוכלוסייה .
- מכיוון שתאי Annexin V חיוביים (אפופטוטיים) מופיעים בשולי הספרואידים, מדדו את עוצמת Annexin ב"טבעת" אפופטוטית זו, שנבחרה על ידי האפשרות Select Region (גבול חיצוני -90%) כדי לקבוע מוות של תאים אפופטוטיים.
- ערכי עוצמת Express Annexin V כעוצמה ממוצעת.
Access restricted. Please log in or start a trial to view this content.
תוצאות
נוצרו תאי EGFP המבטאים תאי JIMT-1, ותאים אלה גדלו ספרואידים. Sunitinib שימש כתרכובת בדיקה כפי שהוכח בעבר להשפיע על מהלך ADCC17. ספרואידים הורשו להתגבש במשך 72 שעות. ביום השלישי, 10 מיקרוגרם/מ"ל של Trastuzumab (או שווה ערך 6.6 מיקרוגרם/מ"ל TR-F(ab')219) ותאי NK (20:1) נוספו לכדורואידים בנוכחו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
למרות שיפורים משמעותיים בטיפול ב- BC במהלך העשורים האחרונים, חולים עדיין מפתחים באופן קבוע עמידות לתרופות או חווים תופעות לוואי שליליות24. התחלואה והתמותה הגבוהות הקשורות לפנה"ס מחייבות חקירה מתמשכת של המנגנונים המולקולריים העומדים בבסיסן, בדיוק כמו פלטפורמות סינון חזקות לזי...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים לא הצהירו על ניגוד עניינים.
Acknowledgements
LV קיבלה מימון ממענקי המשרד הלאומי למחקר, פיתוח וחדשנות GINOP-2.3.2-15-2016-00010 TUMORDNS", GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 ו-K147482. פרויקט זה קיבל מימון מרשת המחקר ההונגרית HUN-REN. תאי CD16.176V.NK-92 התקבלו מד"ר קרי ס. קמפבל (מרכז פוקס צ'ייס, פילדלפיה, פנסילבניה, מטעם Brink Biologics, lnc. סן דייגו, קליפורניה), מוגנים על ידי פטנטים ברחבי העולם, וקיבלו רישיון על ידי Nantkwest, lnc. (www.nantkwest.com). המחברים מודים לגיורגי ורב ולארפד שור על עזרתם בשימוש בקו התאים NK-92 וב-TR-F(ab')2, ועל הייעוץ הטכני.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) | for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r | Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
References
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155(2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293(2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926(2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744(2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186(2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56(2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103(2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640(2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315(2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105(2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849(2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808(2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10(2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171(2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307(2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. aI., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232(2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345(2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491(2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18(2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved