Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Quantification de la cytotoxicité cellulaire dépendante des anticorps dans un modèle sphéroïde tumoral : application à la découverte de médicaments
Dans cet article
Résumé
Ici, nous présentons une méthode pour identifier les composés qui modulent le mécanisme ADCC, un mécanisme important de destruction des cellules cancéreuses des anticorps antitumoraux. L’effet cytotoxique des cellules NK est mesuré dans les sphéroïdes des cellules cancéreuses du sein en présence de trastuzumab. L’analyse d’images permet d’identifier les cellules tueuses et cibles vivantes et mortes dans les sphéroïdes.
Résumé
L’immunothérapie à base d’anticorps monoclonaux ciblant les antigènes tumoraux est désormais un pilier du traitement du cancer. L’un des mécanismes d’action cliniquement pertinents des anticorps est la cytotoxicité cellulaire dépendante des anticorps (ADCC), où l’anticorps se lie aux cellules cancéreuses et engage la composante cellulaire du système immunitaire, par exemple les cellules tueuses naturelles (NK), pour tuer les cellules tumorales. L’efficacité de ces thérapies pourrait être améliorée en identifiant des composés adjuvants qui augmentent la sensibilité des cellules cancéreuses ou la puissance des cellules immunitaires. De plus, des interactions médicamenteuses non découvertes chez des patients cancéreux co-médicamentés pour des affections antérieures ou des symptômes associés au cancer peuvent déterminer le succès du traitement par anticorps ; Par conséquent, ces interactions médicamenteuses indésirables doivent être éliminées. Avec ces objectifs à l’esprit, nous avons créé un modèle d’ADCC contre le cancer et décrivons ici un protocole simple pour trouver des médicaments modulateurs de l’ADCC. Étant donné que les modèles 3D tels que les sphéroïdes de cellules cancéreuses sont supérieurs aux cultures 2D pour prédire les réponses in vivo des tumeurs aux thérapies anticancéreuses, les co-cultures sphéroïdes de cellules cancéreuses du sein HER2+ JIMT-1 exprimant l’EGFP et le NK92 sont supérieures. Des lignées cellulaires CD16 ont été mises en place et induites avec du trastuzumab, un anticorps monoclonal cliniquement approuvé contre le cancer du sein HER2 positif. Les sphéroïdes JIMT-1 ont été autorisés à se former dans des plaques à fond en U à 96 puits. Le jour 3, des cellules NK et du trastuzumab ont été ajoutés. Les sphéroïdes ont ensuite été colorés avec de l’annexine V-Alexa 647 pour mesurer la mort cellulaire apoptotique, qui a été quantifiée dans la zone périphérique des sphéroïdes à l’aide d’un microscope automatisé. L’applicabilité de notre test pour identifier les molécules modulatrices de l’ADCC est démontrée en montrant que le sunitinib, un inhibiteur du récepteur tyrosine kinase approuvé par la FDA contre le cancer métastatique, abolit presque complètement l’ADCC. La génération des sphéroïdes et les pipelines d’acquisition et d’analyse d’images sont compatibles avec le criblage à haut débit des composés modulateurs de l’ADCC dans les sphéroïdes des cellules cancéreuses.
Introduction
Les sphéroïdes tumoraux multicellulaires (SCTM) sont des modèles tridimensionnels (3D) largement utilisés qui se forment en raison de la tendance des cellules adhérentes à s’agréger et représentent un outil important pour obtenir un aperçu mécanistique de la biologie des cellules cancéreuses. Ils peuvent être générés à partir d’un large éventail de types de cellules par de nombreuses techniques, telles que les cultures 3D à base de liquide et d’échafaudage1. Leur principal avantage par rapport aux modèles 2D monocouches est qu’ils récapitulent les principales caractéristiques des tumeurs in vivo , à savoir l’organisation structurale et l’hypoxie, en imitant le comportement biologique des cellules tumorales, en particulier les mécanismes conduisant à l’échappement thérapeutique et à la résistance auxmédicaments2. Ainsi, étant donné que les SCTM peuvent améliorer la prévisibilité de la toxicité et de la sensibilité aux médicaments, ils sont largement utilisés pour étudier les cancers en 3D et pourraient améliorer la mise au point de médicaments efficaces pour différents types de cancer3.
Pour étudier n’importe quelle maladie, il y a un besoin critique de modèles pertinents et pratiques. La mise en place de modèles pour les études d’immunologie du cancer est difficile car le système immunitaire est constitué de plusieurs types de cellules. Chaque type de cellule possède plusieurs sous-types et un large spectre d’états d’activation. Ces différents types de cellules immunitaires interagissent avec les cellules cancéreuses et d’autres composants tumoraux, influençant finalement l’issue de la maladie. Les méthodes de culture cellulaire in vitro 2D ne parviennent pas à récapituler ces interactions cellulaires complexes, car elles manquent de traduisibilité et sont incapables de prédire l’action d’un médicament au niveau du système (par exemple, dans les tissus)4,5. De plus, les modèles murins présentent également de graves limitations en raison des différences fondamentales entre les systèmes immunitaires humain et murin. Les systèmes de culture 3D peuvent donc combler les lacunes actuelles des modèles disponibles, en fournissant une méthode alternative et en améliorant notre compréhension de l’immunologie du cancer6. Plus précisément, les modèles sphéroïdes pourraient être utilisés pour tester les immunothérapies, principalement pour évaluer l’efficacité du criblage de médicaments et des anticorps thérapeutiques pour améliorer l’infiltration des cellules immunitaires et les effets antitumoraux contre les cibles sphéroïdes7. De plus, le potentiel des TCM, composés de cellules dans différents états métaboliques et prolifératifs, pour étudier les interactions entre les cellules du stroma (par exemple, les lymphocytes, les macrophages, les fibroblastes) et les cellules cancéreuses et pour le développement de nouvelles stratégies anticancéreuses a été amplement démontré8. Il est donc essentiel de corroborer les plateformes prédictives et précises afin de stimuler le processus de dépistage des médicaments, en tenant compte de la physiopathologie du microenvironnement tumoral.
Le cancer du sein (BC) est le cancer le plus fréquemment diagnostiqué chez la femme dans le monde. La classification clinique de cette maladie hétérogène est basée sur la présence de récepteurs transmembranaires, par exemple les récepteurs de l’œstrogène (RE) et de la progestérone (PR) (collectivement appelés récepteurs hormonaux, HR), ainsi que sur la surexpression ou l’amplification de la protéine/oncogène du récepteur 2 du facteur de croissance épidermique humain (HER2). Sur la base de l’expression immunohistochimique de ces récepteurs, quatre sous-types sont communément reconnus : le cancer du sein luminal A (HR+/HER2-), le luminal B (HR+/HER2+), le cancer du sein HER2-positif (HR-/HER2+) et le cancer du sein triple négatif (HR-/HER2-). Le groupe HER2+ constitue 10 à 15 % des cas de BC et se caractérise par une expression élevée de HER2 en absence de RE et de PR, un pronostic plus sombre que les tumeurs luminales et nécessitant des médicaments spécifiques dirigés contre la protéine HER2/neu9.
Le développement de la BC est un processus en plusieurs étapes, et un diagnostic précoce est essentiel pour un traitement réussi de la maladie10. Cependant, malgré l’émergence récente d’options de traitement personnalisées de la Colombie-Britannique (p. ex., thérapies par anticorps endocriniens et anti-HER2), la Colombie-Britannique continue de poser des défis aux oncologues. Tout comme la chirurgie, la chimiothérapie et la radiothérapie, ces thérapies personnalisées peuvent également avoir des effets indésirables graves et les patients peuvent développer une résistance à ces agents, ce qui en fait un défi à long terme pour déterminer la meilleure stratégie11,12. Par conséquent, une meilleure compréhension de l’interaction entre la tumeur et son microenvironnement est essentielle et devrait fournir de nouvelles orientations pour le développement de nouveaux traitements qui tiennent compte des spécificités des différents sous-types de BC13. Une nouvelle vague d’immunothérapies, telles que les conjugués anticorps-médicaments, les thérapies adoptives à base de lymphocytes T, les vaccins et les nouveaux anticorps monoclonaux (mAb) dirigés contre HER2, sont à l’étude dans une large population de patients atteints de tumeurs exprimant HER214.
Le trastuzumab, par exemple, représente une modalité de traitement efficace pour HER2+ BC. Dans le cadre de son mode d’action, le trastuzumab intervient dans les activités dépendantes des récepteurs gamma cristallisables (FcγR) par fragment. Les FcγR se distinguent par leur affinité pour le fragment Fc et la réponse immunitaire qu’ils initient. L’activation de FcγRIIIa (CD16A) sur les cellules tueuses naturelles (NK) est cruciale pour la médiation de la cytotoxicité cellulaire dépendante des anticorps (ADCC), tandis que le déclenchement de FcγRIIa (CD32A) et FcγRIIIa sur les macrophages induit une phagocytose cellulaire dépendante des anticorps (ADCP)15. Des études sur des modèles animaux ont montré que les souris dépourvues de récepteurs FcγRI (CD64) et FcγRIII (CD16) étaient incapables d’initier des réponses immunitaires protectrices contre les antigènes spécifiques de la tumeur, révélant que l’ADCC est probablement un mécanisme d’action majeur pour le mAb Trastuzumab16.
Étant donné que les cellules NK ont recours aux Abs liés aux cellules tumorales pour tuer les cellules cancéreuses par ADCC, l’expression des récepteurs Fc est essentielle pour un traitement efficace avec le trastuzumab17 (Figure 1). De plus, leur action est efficacement équilibrée par une stimulation des récepteurs activateurs et inhibiteurs, par exemple, les récepteurs de type immunoglobuline des cellules tueuses (KIR)18.
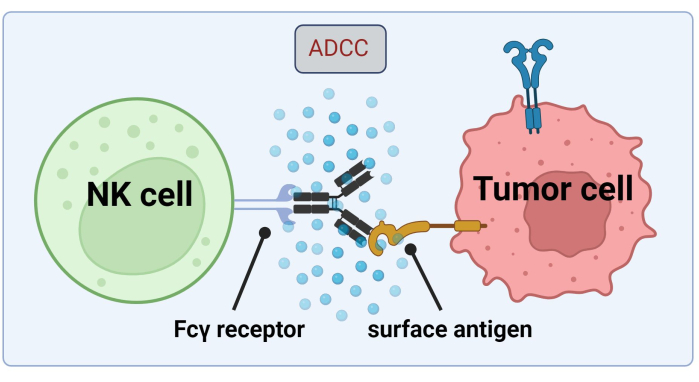
Graphique 1. Mécanisme de l’ADCC dans le cadre d’une réponse antitumorale. Le récepteur Fcγ d’une cellule tueuse naturelle (NK) reconnaît la région Fc d’un anticorps, qui s’était auparavant lié à un antigène de surface sur une cellule cancéreuse. Cette synapse immunologique conduit à la dégranulation de la cellule NK qui libère des médiateurs cytotoxiques tels que les granzymes et la perforine. Ces molécules contribuent à la formation de pores dans la membrane cellulaire et activent les voies apoptotiques provoquant la mort cellulaire programmée de la cellule cible (image créée avec Biorender.com). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le développement de l’immunothérapie pour HER2+ BC représente un domaine en pleine évolution. Dans ce cas, il faut tenir compte des interactions entre les différents composants du système immunitaire. De plus, des publications antérieures ont largement testé des thérapies combinées impliquant tous les types de thérapies traditionnelles, immunitaires ou cellulaires afin d’identifier des combinaisons synergiques19.
Plusieurs modèles 3D de HER2+ BC ont déjà été utilisés pour la découverte de médicaments. Par exemple, Balalaeva et al. ont utilisé des sphéroïdes SKBR-3 surexprimant HER2 pour évaluer la cytotoxicité de l’immunotoxine 4D5scFv-PE4020 ciblant HER2. Dans une autre étude, un système de culture HER2+ BC 3D à base de Matrigel a été établi pour mesurer la croissance cellulaire en réponse au trastuzumab et aux agents endocriniens21. Ces études soulignent l’importance des modèles sphéroïdes tumoraux de cellules cancéreuses surexprimant HER2 dans la représentation d’une stratégie efficace pour améliorer cliniquement les réponses thérapeutiques22.
Notre groupe a précédemment identifié Sunitinib, un inhibiteur multiciblé de la tyrosine kinase, comme un inhibiteur de l’ADCC dépendant du trastuzumab dans les cellules JIMT-1 HER2+ BC dans un test de culture 2D. L’étude a révélé que le sunitinib induit l’autophagie et altère la fonction de destruction des cellules NK, régulant à la baisse l’expression de HER2 et améliorant la fixation de surface des cellules JIMT-117.
Ici, nous avons établi un nouveau modèle 3D d’ADCC sphéroïde (cellules cancéreuses NK.92.CD16+Trastuzumab+JIMT-1-EGFP) à utiliser pour des applications de criblage à haut débit et, afin de valider les résultats mentionnés ci-dessus, le sunitinib a été utilisé comme composé modèle. Tout d’abord, nous avons généré de l’EGFP exprimant les cellules JIMT-117 et cultivé des sphéroïdes à partir de ces cellules. L’ADCC a été induit par les cellules NK en association avec le trastuzumab, et les sphéroïdes ont été maintenus en culture en présence ou en l’absence de composés d’essai pendant 24 h (Figure 2). La quantification de l’ADCC est basée sur la détection de la mort apoptotique des cellules cancéreuses (coloration à l’annexine V) à l’aide d’un système d’analyse à haut contenu.
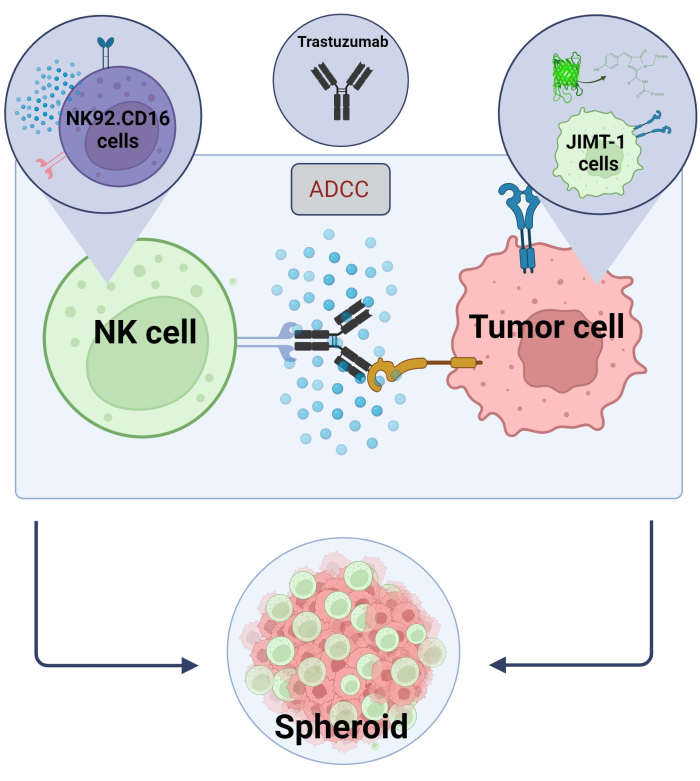
Graphique 2. ADCC dans un système de co-culture sphéroïde 3D. Nos paramètres expérimentaux sont basés sur un système sphéroïde 3D qui permet de modéliser plus précisément le microenvironnement in vivo par rapport aux modèles 2D. Les cellules cancéreuses du sein JIMT-1 EGFP ont été ensemencées sur un fond répulsif concave pour former un amas cellulaire de forme ronde, appelé sphéroïde. L’ADCC a ensuite été initié par l’ajout de NK92. cellules tueuses naturelles CD16 (rapport E :T = 20 :1) et un anticorps monoclonal anti-HER2, le trastuzumab. Le modèle expérimental s’est avéré efficace et facilement applicable pour l’identification des composés d’essai modifiant l’ADCC (image créée avec Biorender.com). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Nous avons démontré que l’acquisition de données de cette manière peut se faire en temps réel et qu’elle est statistiquement robuste pour une utilisation dans le criblage à haut contenu dans la découverte de médicaments anticancéreux. Il est important de noter que ce modèle permet une validation étendue d’un ensemble plus large de composés et qu’il peut être appliqué à plusieurs essais d’intérêt.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Mise en place du modèle sphéroïde de protéine fluorescente améliorée par JIMT-1 (EGFP)
- Pour former un fond acellulaire en forme de U, enduisez la plaque à 96 puits d’une solution d’agarose-PBS à 0,5 % (30 μL/puits). Incubez l’assiette à température ambiante pendant environ 30 à 45 minutes.
- Laver les cellules JIMT-1-EGFP deux fois avec 2 mL de PBS stérile (la génération de la lignée cellulaire JIMT1-EGFP a été rapportée dans une publication précédente17). Utiliser des flacons de culture tissulaire T25 et un milieu JIMT-1 (milieu DMEM/F-12 complété par 20 % de sérum de veau fœtal (FBS), 0,3 U/mL d’insuline (100 UI/mL, Humulin R) et 1 % de pénicilline-streptomycine) pour la culture cellulaire.
- Ajouter 2 mL de trypsine-EDTA dans le flacon et l’incuber pendant 10 min dans un incubateur de CO2 .
- Appuyez sur la fiole pour vérifier si les cellules JIMT-1 se sont détachées après le temps d’incubation.
- Utilisez 2 mL de milieu JIMT-1 pour arrêter la digestion et recueillir la suspension cellulaire dans un tube de 15 mL.
- Comptez les cellules dans une chambre de Bürker avec 0,4 % de bleu de trypan (80 μL de colorant + 20 μL de suspension cellulaire) et ajustez le nombre de cellules à 20 000 cellules/mL.
- Pipeter 100 μL de la suspension cellulaire (2000 cellules/puits) dans chaque puits de la plaque à 96 puits (pré-enrobée d’une solution d’agarose-PBS à 0,5 %, comme indiqué au point 1.1).
- Laisser les cellules s’agglutiner pendant une période d’incubation de 3 jours à 37 °C dans un incubateur de CO2 .
- Vérifiez régulièrement la taille et la forme des sphéroïdes à l’aide d’un microscope inversé.
2. Revêtement de la plaque HCS
REMARQUE : Pour empêcher la fixation des sphéroïdes JIMT-1-EGFP à la surface du verre de la plaque, il est crucial de recouvrir la plaque de criblage à haut contenu (HCS) (sinon l’analyse à haute teneur ne serait pas possible).
- Le jour 3 après l’induction des sphéroïdes, enduire la plaque de criblage à haute teneur en 96 puits de Pluronic-F127 (0,5 % dans le DMSO, 50 μL/puits) et incuber la plaque pendant 45 min à température ambiante.
- Aspirer la solution de revêtement et laver les puits deux fois avec un milieu libre de sérum DMEM/F-12 (100 μL/puits).
3. Transfert des sphéroïdes sur la plaque HCS
- À l’aide d’une pipette de 1 ml, transférer les sphéroïdes en trois exemplaires dans la plaque HCS à 96 puits à fond de verre.
4. Prétraitement des sphéroïdes JIMT-1 EGFP avec des composés d’essai
- Ajouter le composé d’essai (p. ex., le sunitinib dilué dans du DMSO à une concentration de 40 μM) en pipetant 10 μL/puits et ajouter 10 μL de milieu JIMT-1 frais dans les puits témoins (CTL).
- Incuber la plaque pendant 1 h dans un incubateur de CO2 à 37 °C.
5. Induction de l’ADCC par l’ajout des cellules effectrices
NOTA : Les cellules CD16.176V.NK92 (ci-après dénommées cellules NK) ont été cultivées dans du α-MEM additionné de 20 % de FBS, 1 % de MEM-NEAA, 1 % de Na-pyruvate, 1 % de glutamine, 1 % de pénicilline-streptomycine et 100 UI/mL d’IL-2.
- Prélever les cellules NK dans le flacon dans un tube de 15 ml. Comptez les cellules avec du bleu de trypan (80 μL du colorant + 20 μL de la suspension cellulaire) et ajustez la densité cellulaire à un rapport effecteur/cible (E :T) de 20 :1 (40 000 cellules NK/puits).
- Colorer les cellules NK avec 10 μM Cell Tracker Blue (CTB, 1 μL dans 1 mL de milieu α-MEM NK) et les placer dans un incubateur de CO2 à 37 °C pendant 1 h.
- Centrifuger les cellules NK à 150 x g pendant 3 min à température ambiante deux fois pour laver l’excédent de colorant avec 1 mL de milieu α-MEM.
- Remettre en suspension la pastille de cellules NK dans 1 mL de milieu JIMT-1 frais.
- Ajouter les cellules NK colorées ainsi que l’anticorps anti-HER2 (Ab) (trastuzumab, dissous dans du H2O distillé stérile) aux sphéroïdes JIMT-1 cibles en pipetant 55 μL/puits de cellules NK colorées par CTB et 55 μL/puits de 10 μg/mL Ab dans le milieu JIMT-1 (le volume total de traitement ajouté pour l’ADCC est de 110 μL/puits et la concentration finale de Sunitinib est de 20 μM).
NOTE : Pour le choix de la concentration Ab et du rapport E :T, nous nous sommes appuyés sur notre publication précédente17. Des expériences préliminaires ont été réalisées avec différents rapports E :T et concentrations de trastuzumab afin d’évaluer lequel était le plus efficace pour induire l’ADCC dans les sphéroïdes (figure supplémentaire S1). - Ajouter 110 μL/puits de milieu JIMT-1 frais dans les puits témoins (CTL).
- Incuber la plaque pendant 24 h dans un incubateur de CO2 à 37 °C.
NOTE : Comme les cellules NK92 sont connues pour exercer des fonctions cytotoxiques non spécifiques, pour le contrôle, utiliser des cellules JIMT-1 co-incubées avec des cellules NK seules et avec un témoin isotype ou un F(ab')2 Ab. Dans ce cas, le F(ab')2-trastuzumab (TR-F(ab')2) a été utilisé comme CTL négatif. Le fragment TR-F(ab')2 a été préparé comme indiqué par Tóth et al.19 et ajouté dans le même volume que le trastuzumab avec les cellules NK comme décrit en 5.5. La concentration a été ajustée à 6,6 μg/mL, ce qui correspond à une concentration équimolaire avec le trastuzumab23.
6. Coloration des sphéroïdes par l’annexine V-647
- Pour mesurer la mort cellulaire apoptotique, colorer les sphéroïdes avec le conjugué Annexin V-Alexa Fluor 647 pendant 1 h dans un milieu JIMT-1 (1 :100) en pipetant 50 μL/puits.
7. Imagerie
REMARQUE : La plaque est imagée 24 h après l’ajout des cellules effectrices NK aux cellules cibles. Pour l’imagerie, un analyseur à haut contenu et un logiciel d’analyse d’images sont utilisés.
- Sélectionnez le type de microplaque dans la liste des plaques à l’aide de l’option Type de plaque . Utilisez une plaque de criblage à haut contenu (HCS) à 96 puits.
- Sélectionnez l’autofocus à deux pics car le test est effectué sur des plaques avec un objectif 10x avec une ouverture numérique (NA) de 0,3, en utilisant les options Autofocus et Objectif , respectivement. Choisissez le mode confocal avec l’option Mode opt. et appliquez Binning 2 à l’aide de l’option Binning .
- Pour l’imagerie des sphéroïdes, sélectionnez les canaux appropriés à l’aide de l’option Sélection des canaux . Pour détecter les cellules JIMT-1 transduites par EGFP, choisissez EGFP (temps d’intégration 200 ms, puissance laser 50%, hauteur d’empilement 2,0 μm ; ex : 488 nm em : 500-550 nm), et pour détecter les cellules apoptotiques, utilisez Alexa 647 (temps d’intégration 100 ms, puissance laser 50%, hauteur de pile 10,0 μm ; ex : 640 nm em : 650-760 nm). Pour visualiser les cellules NK au sein des sphéroïdes, choisissez le canal suivant : DAPI (temps d’intégration 100 ms, puissance laser 50%, hauteur d’empilement 2,0 μm ; ex : 405 nm em : 435-480 nm).
- Dans l’option Sélection de la mise en page , sélectionnez les empilements Z, car les cellules des sphéroïdes ont tendance à se trouver sur des plans focaux différents du microscope. 10 plans (avec une distance de 10 μm) suffisent pour couvrir toute la région sphéroïdale. Définissez les valeurs du premier plan et du dernier plan sur 0 μm et 90 μm, respectivement.
REMARQUE : Avant de commencer la mesure, des échantillons d’images peuvent être pris avec la fonction d’instantané afin de vérifier les paramètres corrects. - Définissez le nombre de puits et de champs pour l’imagerie à l’aide de l’option Définir la mise en page .
8. Analyse à haut contenu (HCA)
REMARQUE : Analysez les images à l’aide du logiciel Harmony ou exportez les images à des fins d’analyse à l’aide d’un logiciel tiers de votre choix. Pour l’analyse de l’efficacité de l’ADCC, l’intensité de fluorescence de l’annexine V 647 est mesurée. Les cellules cibles tuées par l’ADCC apparaissent dans la zone périphérique des sphéroïdes. Par conséquent, les cellules positives de l’annexine V sont mesurées dans cet « anneau » sphéroïde. Afin de valider cette méthode, des analyses ont été effectuées avec différents paramètres afin d’évaluer lequel était le plus fiable et produisait les meilleurs résultats (figure supplémentaire S2). Un puits ADCC est montré dans la vidéo afin de démontrer étape par étape le processus d’analyse d’image.
- Identifiez les sphéroïdes par fluorescence EGFP des cellules JIMT-1 à l’aide de l’option Rechercher des régions de texture et filtrez-les par taille (> 25 000 μm2).
- Supprimez les objets de bordure à l’aide de l’option Sélectionner une population .
- Étant donné que les cellules positives à l’annexine V (apoptotiques) apparaissent à la périphérie des sphéroïdes, mesurez l’intensité de l’annexine dans cet « anneau » apoptotique, sélectionné par l’option Sélectionner une région (bordure extérieure -90 %) pour déterminer la mort cellulaire apoptotique.
- Exprimez les valeurs d’intensité de l’annexe V en tant qu’intensité moyenne.
Access restricted. Please log in or start a trial to view this content.
Résultats
Des cellules exprimant l’EGFP JIMT-1 ont été générées et des sphéroïdes ont été cultivés à partir de ces cellules. Le sunitinib a été utilisé comme composé d’essai, car il a déjà été démontré qu’il influençait l’évolution de l’ADCC17. Les sphéroïdes ont été autorisés à s’agglutiner pendant 72 h. Au jour 3, 10 μg/mL de trastuzumab (ou 6,6 μg/mL de TR-F(ab')219) et des cellules NK (20 :1) ont été ajoutés aux sphéroïd...
Access restricted. Please log in or start a trial to view this content.
Discussion
Malgré des améliorations significatives dans le traitement de la Colombie-Britannique au cours des dernières décennies, les patients développent encore régulièrement une résistance aux médicaments ou éprouvent des effets secondaires négatifs24. La morbidité et la mortalité élevées liées à la BC exigent une recherche continue sur les mécanismes moléculaires sous-jacents, tout comme des plateformes de criblage robustes pour identifier de nouvelles molécules exploitables pour le d...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont déclaré aucun conflit d’intérêts.
Remerciements
LV a reçu un financement de l’Office national de la recherche, du développement et de l’innovation des subventions GINOP-2.3.2-15-2016-00010 TUMORDNS", GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 et K147482. Ce projet a reçu un financement du réseau de recherche hongrois HUN-REN. Les cellules CD16.176V.NK-92 ont été obtenues auprès du Dr Kerry S. Campbell (Fox Chase Center, Philadelphie, Pennsylvanie, pour le compte de Brink Biologics, lnc. San Diego, CA), sont protégés par des brevets dans le monde entier et ont été licenciés par Nantkwest, lnc. (www.nantkwest.com). Les auteurs remercient György Vereb et Árpád Szöőr pour leur aide dans l’utilisation de la lignée cellulaire NK-92 et de la lignée TR-F(ab')2, ainsi que pour leurs conseils techniques.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) | for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r | Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
Références
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155(2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293(2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926(2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744(2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186(2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56(2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103(2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640(2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315(2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105(2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849(2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808(2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10(2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171(2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307(2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. aI., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232(2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345(2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491(2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18(2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon