A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פרוטוקול כימות חדשני להתקדמות הסתיידות לב וכלי דם באמצעות תמונות MicroPET/MicroCT אורכיות
In This Article
Summary
פרוטוקול חדשני זה כולל את כימות התקדמות ההסתיידות הקרדיווסקולרית מטומוגרפיה טורית של פליטת מיקרו פוזיטרונים (PET)/טומוגרפיה ממוחשבת מיקרו (CT) בחיות מחקר קטנות.
Abstract
טומוגרפיה של פליטת מיקרו פוזיטרונים (PET) והדמיית טומוגרפיה ממוחשבת זעירה (CT) הם כלי מחקר חזקים ואידיאליים למעקב אחר התקדמות ההסתיידות הקרדיווסקולרית. בשל טבען הלא פולשני, ניתן לצלם חיות מחקר קטנות במספר נקודות זמן. האתגר טמון בכימות מדויק של הסתיידות לב וכלי דם. כאן, אנו מספקים פרוטוקול, תוך שימוש בתמונות משלבי המחלה המאוחרים כתבנית, כדי לכמת במדויק את התקדמות ההסתיידות הקרדיווסקולרית במחקרי אורך. הפרוטוקול כולל 1) יישור אזור החזה במספר תמונות מאותה חיה במהלך מחקר אורך כצעד הראשון, 2) הגדרת אזור עניין (ROI) הממוקם בתוך הלב ואבי העורקים באתר של משקעי סידן גדולים יותר שמתגלים בתמונות מאוחרות יותר, ו-3) פילוח וכימות בו זמנית של משקעי סידן על פני כל התמונות שנרכשו במהלך מחקר האורך. שיטה יעילה זו משפרת את הדיוק של ניתוח תמונה בעקבות התקדמות ההסתיידות הקרדיווסקולרית על ידי שיפור הדיוק של הגדרת החזר ההשקעה והפחתת השונות הקשורה לטכניקות מוקדמות יותר המנתחות סריקות בודדות באופן עצמאי.
Introduction
מחלות לב וכלי דם הן גורם עולמי מוביל לתחלואה ולתמותה, הדורש חקירה קפדנית כדי לחשוף את מנגנוניו ולתכנן אסטרטגיות מניעה וטיפול יעילות. הסתיידות עורקים כליליים (CAC) מוכרת באופן נרחב על ידי המומחים בתחום כגורם מנבא למחלות לב וכלי דם, ומעלה באופן משמעותי את הסיכון לתמותה קרדיווסקולרית 1,2,3,4,5. הסתיידויות מיקרוסקופיות נחשבות לשלבים המוקדמים ביותר של טרשת עורקים, והמונח "מיקרו-הסתיידויות" שימש להתייחסות למשקעי סידן בקוטר0.5 עד 50 מיקרומטר 6,7,8,9. מאמינים כי הסתיידויות קטנות אלה מתגבשות ליצירת משקעי סידן גדולים יותר, מה שמזין את ההתקדמות של רובד הקלציפי 6,7.
טומוגרפיית פליטת פוזיטרונים (PET) וטומוגרפיה ממוחשבת (CT) משמשים ככלי מחקר רב ערך, המשמשים לעתים קרובות להערכה לא פולשנית של הסתיידות לב וכלי דם in vivo 5,10,11,12,13,14,15,16,17,18,19 . שיטות הדמיה אלה מתגלות כמועילות במיוחד למעקב אחר התקדמות הסתיידות כלי הדם במחקרי אורך הכוללים חיות מחקר קטנות 11,12,13,19. הדמיית MicroCT הוכיחה יעילות במתן תמונות אנטומיות של משקעי סידן גדולים יחסית 11,12,13,19,20.עם זאת, התועלת שלו להדמיית משקעי סידן קטנים בבעלי חיים מוגבלת על ידי הרזולוציה המרחבית של ~100 מיקרומטר 8,14, מה שהופך אותו למאתגר לחקור הסתיידות בשלבים הראשונים שלה.
התקדמות ראויה לציון היא אימוץ הדמיית microPET/microCT משולבת עם נותב PET, נתרן פלואוריד עם תווית פלואוריד 18 (18F-NaF), כשיטה הסטנדרטית לזיהוי הסתיידות בהתבסס על קשירתה לשטח הפנים של המינרל. גישה זו משתמשת בתווית רדיו 18F-NaF, שהוכחה כמזהה את פני השטח של מינרל הסידן10,13 כאשר יוני הפלואוריד נקשרים באופן קוולנטי לסידן הידרוקסיאפטיט, ומחליפים קבוצות הידרוקסיל ליצירת פלואורואפטיט21. בהתאם לשער החליפין האיטי יותר ביחס לדעיכה הרדיואקטיבית של 18F (זמן מחצית חיים ~110 דקות) ולפינוי הנותב דרך כליות22, אירקל ועמיתיו13 מצאו כי 18F-NaF שנקשר לדגימות קרוטיד מסויד היה מוגבל לפני השטח בזמן הגילוי. לכן, ספיגת נותב צריכה להתייחס ישירות עם שטח הפנים של מינרלים, שהוא גדול יותר כאשר כמות נתונה של מינרל מתרחשת במספר מוקדים קטנים או בצורה נקבובית מאשר כאשר קיים בפיקדונות מעטים, גדולים ומוצקים. על ידי הדגשת השלבים המוקדמים ביותר של מינרליזציה עם רגישות גבוהה, 18הדמיית F-NaF PET עשויה לספק תובנות חשובות לגבי השלבים המוקדמים של המחלה, מה שהופך אותה לשימושית במיוחד בחקר אסטרטגיות מניעה כמו גם טיפוליות 13,14,15.
אפילו עם ההתקדמות האחרונה בהדמיה משולבת של microPET/microCT של הסתיידות כלי דם, ישנן הזדמנויות לשיפור הדיוק של ניתוח תמונה במחקרי הסתיידות אורכיים וקרדיווסקולריים. גישות קונבנציונליות משתמשות בתיחום ידני עתיר עבודה של אזורי עניין (ROI) סביב כל אזור מסויד נראה לעין בכל עכבר בכל נקודת זמן בודדת לאורך מחקר האורך. שיטה זו מפחיתה את הדיוק, במיוחד בשלבי המחלה המוקדמים כאשר גודלם של מרבצי הסידן מתקרב לגבולות הזיהוי של הסורקים, מה שעלול להפוך אזורים מסוימים עם משקעים זעירים לבלתי נראים המסודרים בצפיפות נמוכה.
בתחום ההדמיה, יישור מתייחס בדרך כלל ליישור מרחבי של סדרת תמונות. השיטה המוצעת שלנו, המציגה את היישור כפתרון חדשני לאתגרים הקיימים, מאפשרת לחוקרים להשתמש במיקום עקבי למעקב אחר התקדמות ההסתיידות בתמונות סדרתיות מנבדקים בודדים לאורך מחקר אורך. בהתחשב בכך שהסתיידות רקמות ידועה כנובעת משלפוחיות מטריצה בגודל ננומטרי (50-150 ננומטר), אשר מתמזגות ליצירת מינרל הידרוקסיאפטיט מיקרוסקופי, ואז מקרוסקופי הידרוקסיאפטיט23, ניתן לזהות בדיעבד היכן מיקרו-הסתיידויות היו ממוקמות בתמונות מוקדמות לפני שניתן היה להבחין בהן.
מעקב אחר אותו מיקום לאורך זמן, המתאפשר על ידי יישור תמונה, הוא הבסיס לשיטה זו. זה מייתר את הצורך לזהות את שלבי ההסתיידות המוקדמים ביותר ישירות, מכיוון שההחזר על ההשקעה מוקצה על סמך השלבים האחרונים שבהם מינרליזציה מזוהה בקלות. בפרוטוקול זה אנו מציגים שיטת ניתוח נתונים משופרת ויעילה המשלבת יישור של סדרת זמן של תמונות כשלב חיוני, ומגבירה את הכימות המדויק של שקיעת הסידן במחקרי הדמיה אורכיים, משולבים, microPET/microCT (איור 1). בעוד שאנו משתמשים בניתוח נתוני PET/CT כדוגמה, שיטה זו יכולה להיות מיושמת בניתוחים של נתוני דימות אורכיים אחרים, כולל טומוגרפיה ממוחשבת של פליטת פוטון בודד (SPECT), דימות תהודה מגנטית (MRI) והדמיה אופטית24.
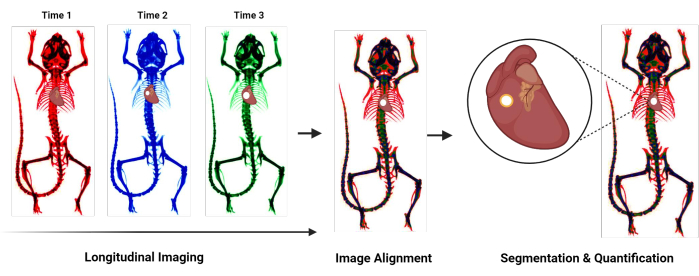
איור 1: תרשים זרימה של סקירת פרוטוקול. תרשים זרימה המסכם את הפרוטוקול החדשני לכימות הסתיידות קרדיווסקולרית. השלבים הכלליים כוללים הדמיה אורכית, יישור תמונות שנרכשו בנקודות זמן שונות, וסגמנטציה וכימות של האזור המסויד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
התמונות המייצגות מציגות נקבת עכבר חסר אפוליפופרוטאין-E (Apoe-/-). פרוטוקולים ניסיוניים נבדקו ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת קליפורניה, לוס אנג'לס.
1. סריקת בעלי חיים
- בין שתי רכישות התמונה, להאכיל את העכבר עם דיאטה סטנדרטית ללא כל התערבות. עם זאת, לפני התמונה הראשונה בגיל 15 חודשים, עברו לתזונה מערבית (21% שומן, 0.2% כולסטרול) מגיל 12 עד 14 חודשים כדי לגרום להסתיידות בסיסית באבי העורקים.
- ודא שסורק ה-microPET/CT מכויל באופן שגרתי לרכישה מיטבית של נתוני PET ולרישום משותף של CT. בצע את הכיולים בהתאם להוראות היצרן.
- מרדימים את העכבר באמצעות גז איזופלורן 2% בתא למשך 10 דקות לפני ההדמיה. אשר את ההרדמה על ידי צביטת הבוהן של בעל החיים ללא תגובה.
- השג תמונות microPET (350-650 keV, זמן סריקה של 10 דקות) ו-microCT של 100 מיקרומטר (80 kVp, 150 μA, הקרנה של 720, זמן סריקה של דקה) בסורק microPET/CT משולב 60 דקות לאחר הזרקה תוך ורידית של 3.7 MBq של 18F-NaF. רכשו את סריקות ה-microCT מיד לאחר סריקות ה-microPET.
הערה: מיטת הסורק העבירה את בעל החיים ממודאל ה-PET למודאל ה-CT בזמן שהחיה נשארה תחת הרדמה ובאותה תנוחה. - בנה מחדש תמונות microPET באמצעות אלגוריתם מקסום ציפייה של תת-קבוצה מסודרת בתלת-ממד (24 תת-קבוצות ו-3 חזרות), עם תיקון אקראי, הנחתה ודעיכה. שחזר את תמונות ה- CT באמצעות אלגוריתם פלדקמפ שונה.
הערה: לאחר ההדמיה, העכבר היה במעקב עד שהוא חזר להכרה מספקת כדי לשמור על עצם החזה. בסוף מחקר האורך, כל העכברים עברו המתת חסד.
2. ייבוא קובצי DICOM בתוכנת מציג DICOM
הערה: בעוד שפרוטוקול מייצג זה משתמש בתוכנת ORS Dragonfly תחת רישיון לא מסחרי, גמישותו מתרחבת לאפשרויות אחרות של תוכנת מציג DICOM.
- הפעל את תוכנת מציג DICOM על ידי לחיצה כפולה על היישום.
- נווט אל קובץ בפינה הימנית העליונה. בתפריט הנפתח, בחר Import DICOM Images... כדי להציג את המראה של החלון Manage DICOM Images (קובץ משלים 1- איור משלים S1A).
- בחלון Manage DICOM Images , לחץ על הכרטיסייה Folder Content . בצד ימין, בחר פתח תיקיה... כדי לבחור את התיקיות המכילות את קובצי DICOM המעניינים במחקר אורך (קובץ משלים 1- איור משלים S1B).
- זהה את התיקיות המכילות את קובצי DICOM. לחצו על 'בחר תיקייה ' כדי לייבא את התיקייה הראשונה לחלון 'ניהול תמונות DICOM ' (קובץ משלים 1- איור משלים S1C).
- בחר בקובצי DICOM מסוג PET ("PT") ו- CT ("CT") בחלון Manage DICOM Images . לאחר מכן, לחץ על הצג מחקר בצד ימין כדי לפתוח את כל תמונות DICOM המיובאות (קובץ משלים 1- איור משלים S1D).
- חזור על שלבים 2.4 ו- 2.5 עבור כל תיקייה הכוללת תמונות DICOM הקשורות לאותו נושא יחיד במחקר האורך.
3. התאם את הגדרות מציג DICOM כדי למטב את התצוגה החזותית של התמונה
- שנה את הפריסה כך שתציג ארבע תצוגות (תלת-ממד, רוחבי, קורונלי, קשת), כפי שמודגם בקובץ משלים 1- איור משלים S2. ברשימה הנפתחת פריסה בצד ימין, חפש תצוגות (בסצינה שנבחרה) ובחר פריסה המציגה ארבע תצוגות.
- שנו שמות של תמונות כדי לציין נקודות זמן ואם הן תמונות PET או CT. בחר את שם התמונה ולחץ פעמיים כדי לשנות את השם של כל תמונה.
- הפעל תמונה על-ידי גישה לרשימה הנפתחת מאפייני נתונים והגדרות בצד שמאל. לחץ על סמל העין משמאל לכל שם תמונה כדי להחליף את התצוגה (קובץ משלים 1- איור משלים S2)
- התאם את הבהירות והניגודיות בכל תמונת CT, בנפרד.
הערה: טווח הבהירות והניגודיות המיטבי של CT עשוי להשתנות בהתאם לנושא, פרוטוקול ההדמיה, הסורק ופרמטרי השחזור25,26; עם זאת, כל ההתאמות צריכות להיות עקביות עבור נושא אחד במחקר אורך.- בחר והפעל תמונת CT אחת על ידי לחיצה על שם התמונה תחת מאפייני נתונים והגדרות (קובץ משלים 1- איור משלים S2).
- מצא את ההיסטוגרמה בתפריט הנפתח החלקת חלון הממוקמת בכרטיסיה ראשי בצד שמאל של מסך התצוגה. הפעל LogY מעל ההיסטוגרמה; לאחר מכן, המשך ללחוץ ולהחליק את מחווני הטווח הצהובים כדי להקיף לחלוטין את השיא השני בהיסטוגרמה (קובץ משלים 1- איור משלים S3A). בצע התאמות קלות עד להשגת בהירות/ניגודיות אופטימלית; ראו איור 2B לדוגמה של תמונת CT מותאמת בהירות/ניגודיות.
- מצא את התיבה טווח נבחר תחת היסטוגרמה של החלקת חלון (קובץ משלים 1- איור משלים S3B). שים לב לערכי הטווח שנבחר לשימוש בשלבים הבאים.
- בחר והפעל תמונת CT שנייה (קובץ משלים 1- איור משלים S3C). הזן את ערכי הטווח שנבחרו מתמונת ה- CT הראשונה לתיבה טווח נבחר עבור תמונת ה- CT השנייה (קובץ משלים 1- איור משלים S3B-S3D). חזרו על הפעולה לכל התמונות העוקבות.
- מקד כל תמונת PET על-ידי התאמת מסנן טבלת בדיקת המידע בנפרד.
הערה: טווח הצבעים האופטימלי של PET עשוי להשתנות בהתאם לנושא, פרוטוקול ההדמיה, הסורק ופרמטרי השחזור27; עם זאת, כל ההתאמות צריכות להיות עקביות עבור נושא אחד במחקר אורך.- בחר והפעל תמונת PET אחת על ידי לחיצה על שם התמונה תחת מאפייני נתונים והגדרות (קובץ משלים 1- איור משלים S2).
- תחת התפריט הנפתח החלקת חלונות בכרטיסיה ראשי , אתר את טבלת בדיקת מידע (LUT) וגלול כדי למצוא את PET תחת התפריט הנפתח LUT ובחר את מסנן PET (קובץ משלים 1 - איור משלים S4A).
- כוונן את הטווח שנבחר באמצעות ההיסטוגרמה תחת התפריט הנפתח החלקת חלונות כדי להשיג תצוגה חזותית מיטבית. הפעל LogY מעל ההיסטוגרמה; לאחר מכן, המשך ללחוץ ולהחליק מחווני טווח צהובים לכיוון המיקום המוצג באיור משלים S4B (קובץ משלים 1). בצע התאמות קלות עד להשגת טווח נבחר אופטימלי לתצוגה חזותית של תמונת PET; הפניה לאיור 2D לדוגמה של תמונת PET/CT המותאמת לטווח שנבחר באופן מיטבי.
- מצא את התפריט הנפתח טווח נבחר תחת היסטוגרמה של החלקת חלון (קובץ משלים 1- איור משלים S4B). שים לב לערכי הטווח שנבחרו לשימוש בשלבים עוקבים.
- בחר והפעל תמונת PET שנייה (קובץ משלים 1- איור S4C). חזור על שלב 3.5.2 עבור התמונה השניה.
- הזינו את ערכי הטווח שנבחרו מתמונת ה-PET הראשונה לתיבה 'טווח נבחר' עבור תמונת ה-PET השנייה (קובץ משלים 1- איור S4B-S4D). חזרו על הפעולה לכל התמונות העוקבות.
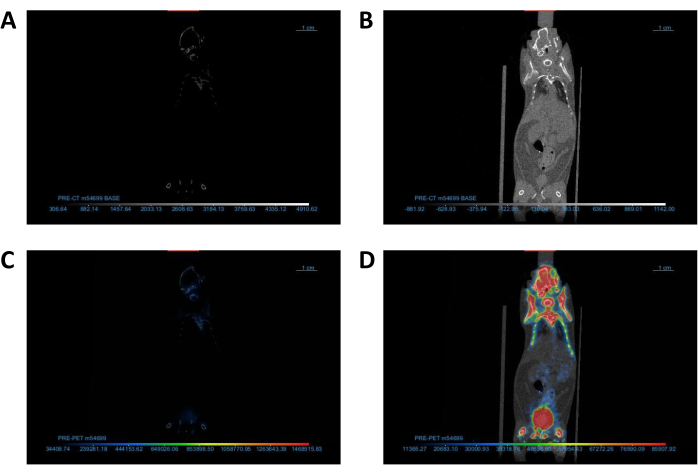
איור 2: התאמת הגדרות מציג DICOM כדי למטב את התצוגה החזותית של התמונה. (א,ב) תצוגה קורונלית של תמונות CT (A) לפני ו-(B) לאחר התאמת ניגודיות/בהירות. (ג,ד) תצוגה קורונלית של תמונות PET/CT (C) לפני ו-(D) אחרי התאמת טבלת בדיקת מידע. קיצורים: CT = טומוגרפיה ממוחשבת; PET = טומוגרפיה של פליטת פוזיטרונים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. יישור אזור החזה בצילומי CT
הערה: לשם הפשטות, תמונת CT אחת תשמש כתמונת "בסיס" ולא תתורגם או תסובב. תמונת ה-CT השנייה (ובסופו של דבר התמונות הטוריות הבאות) תתורגם ו/או תסובב כדי ליישר קו עם תמונת הבסיס; זה ייקרא תמונת "שכבת-על" לצורך ההפגנה. במהלך היישור, חשוב להבחין בין תמונת הבסיס לבין כל שאר תמונות הכיסוי.
- כבה את כל תמונות ה- PET והפעל את תמונת ה- CT הבסיסית על-ידי לחיצה על סמל העין משמאל לכל שם תמונה תחת התפריט הנפתח מאפייני נתונים והגדרות .
- שנה את האטימות של תמונת ה- CT ל~50%. לחץ על אחת התצוגות הדו-ממדיות. תחת התיבה החלקת חלון , אתר את התפריט הנפתח מיפוי אטימות והחלק את קנה המידה של אטימות למרכז (קובץ משלים 1- איור S5).
- הפעל את תמונת CT שכבת-העל וחזור על שלב 4.2.
- שנה את המסנן של תמונת CT שכבת-על כדי להבחין בין תמונת CT הבסיסית לתמונת CT שכבת-על. תחת הרשימה הנפתחת החלקת חלונות בכרטיסיה ראשי , אתר את טבלת בדיקת מידע (LUT). תחת התפריט הנפתח LUT, גלול ולחץ על המסנן האדום .
הערה: כעת אמורות להיות שתי תמונות CT בכל תצוגה כפי שמודגם באיור משלים S5 (קובץ משלים 1). - השתמשו בכלי תרגום/סיבוב בתצוגות דו-ממדיות כדי ליישר את אזור החזה בתמונת הכיסוי קרוב ככל האפשר לאזור שבתמונת הבסיס. יש להתייחס לכלוב בית החזה, עמוד השדרה העליון ועצם החזה כאינדיקטורים ליישור החזה בתמונת CT.
הערה: ניתן לבצע את הפעולות הבאות רק בתצוגות דו-ממדיות (רוחביות, קורונליות או קשת) (קובץ משלים 1- איור משלים S1). לקבלת התוצאה הטובה ביותר, עבור בין כל שלוש התצוגות הדו-ממדיות והשתמש בכלי התרגום/סיבוב כדי ליישר את אזור החזה בכל תצוגה.- בחר את תמונת הכיסוי בתפריט הנפתח מאפייני נתונים והגדרות ולחץ פעם אחת כדי לבחור אחת מהתצוגות הדו-ממדיות.
- מצא את התפריט הנפתח תרגום/סיבוב תחת הכרטיסייה הראשית ולחץ על סמל החלף (קובץ משלים 1- איור S6A).
- לחץ וגרור בתיבת התרגום בפינה השמאלית התחתונה וסובב את נקודת הציר במרכז התצוגה הדו-ממדית שנבחרה כדי להזיז את תמונת הכיסוי כך שתתיישר בערך עם תמונת הבסיס (קובץ משלים 1 - איור משלים S6B). עיין במבני עצם להתייחסות ליישור.
- מצא את הכלי מעקב תחת התפריט הנפתח מניפולציה והזז את הציר לאזור החזה על-ידי לחיצה וגרירה של מרכז הציר. התקרב לאזור החזה על-ידי לחיצה על לחצן הגלילה האמצעי בעכבר המחשב וגרירת העכבר הרחק מהמסך (קובץ משלים 1 - איור משלים S6C).
- כוונן את היישור למיקום מדויק עם מבני החזה כגון כלוב בית החזה, עמוד השדרה העליון ועצם החזה באמצעות תרגומים נוספים והתאמות סיבוב. עבור בין תצוגות דו-ממדיות וחזור על שלבים 4.5.3-4.5.4 עד ששתי התמונות מיושרות כך שיהיו דומות לאיור 3.
- לאחר יישור תמונות CT בשכבת-העל הבסיסית ובשכבת-העל הראשונה, שנה את המסנן של תמונת CT שכבת-העל בחזרה לגווני אפור תחת התפריט הנפתח LUT. חזור על סעיף 4 עבור כל שכבת-העל של תמונות CT מאותה חיה, באמצעות תמונת בסיס קבועה.
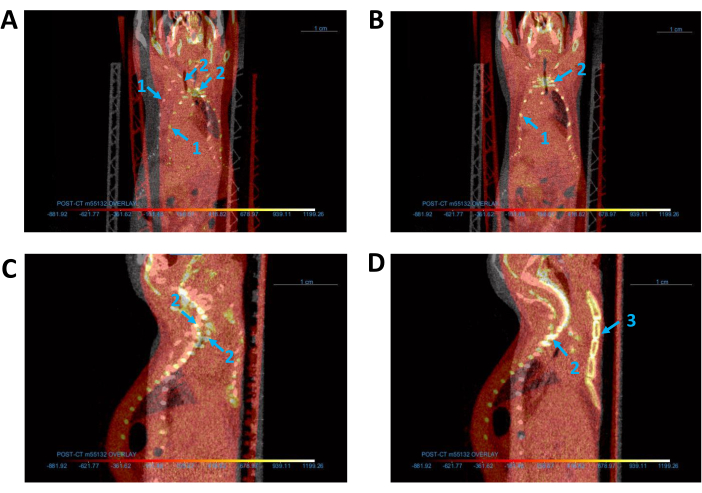
איור 3: יישור של כל תמונות ה-CT. (א,ב) תצוגה קורונלית של בסיס (אפור) וכיסוי (אדום) של תמונות CT (A) לפני ו-(B) אחרי היישור. (ג,ד) מבט קשת על תמונות CT (C) לפני ו-(D) אחרי היישור. חיצים כחולים מציינים את העכבר (1) כלוב בית החזה, (2) עמוד השדרה ו-(3) עצם החזה. קיצור: CT = טומוגרפיה ממוחשבת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. רישום משותף של תמונות PET עם תמונות CT תואמות
הערה: יישור תמונת ה-CT של שכבת-העל ותמונת ה-CT הבסיסית יגרום בתחילה לחוסר התאמה של תמונת ה-CT של שכבת-העל עם תמונת ה-PET המתאימה שלה באיור 4. יש לרשום שוב את תמונת ה-PET עם תמונת ה-CT המתאימה לה.
- הפעל את תמונת CT שכבת-העל ואת תמונת ה-PET המתאימה לה על-ידי לחיצה על סמל העין משמאל לכל שם תמונה.
- שנה את האטימות של תמונות PET ו- CT ל~50%. תחת התפריט הנפתח החלקת חלון , אתר את התפריט הנפתח מיפוי אטימות והחלק את קנה המידה של אטימות למרכז (קובץ משלים 1 - איור משלים S5).
- השתמש בכלי תרגום/סיבוב בתצוגות דו-ממדיות כדי ליישר את תמונת ה-PET לתמונת ה-CT המתאימה לה, בהתבסס על מבנה העצם בתמונת ה-CT ומשטח העצם 18F-NaF בתמונת ה-PET.
- בחר את תמונת PET המתאימה לתמונת CT של שכבת-העל בתפריט הנפתח מאפייני נתונים והגדרות ולחץ פעם אחת כדי לבחור אחת מהתצוגות הדו-ממדיות.
- מצא את התפריט הנפתח תרגום/סיבוב תחת הכרטיסייה הראשית ולחץ על החלף סמל (קובץ משלים 1 - איור משלים S6A).
- לחץ וגרור בתיבת התרגום בפינה השמאלית התחתונה וסובב את נקודת הציר במרכז התצוגה הדו-ממדית שנבחרה (קובץ משלים 1 - איור משלים S6B) כדי להזיז את תמונת ה-PET לרישום משותף עם תמונת ה-CT.
- חזור על סעיף 5 עבור כל תמונות ה-PET וה-CT שאינן רשומות במשותף עם תמונות ה-CT שלהן.
הערה: אם הרישום המשותף הושלם, יש ליישר את תמונות ה-PET/CT המתאימות לכל אורך הגוף, כפי שמוצג באיור 4.
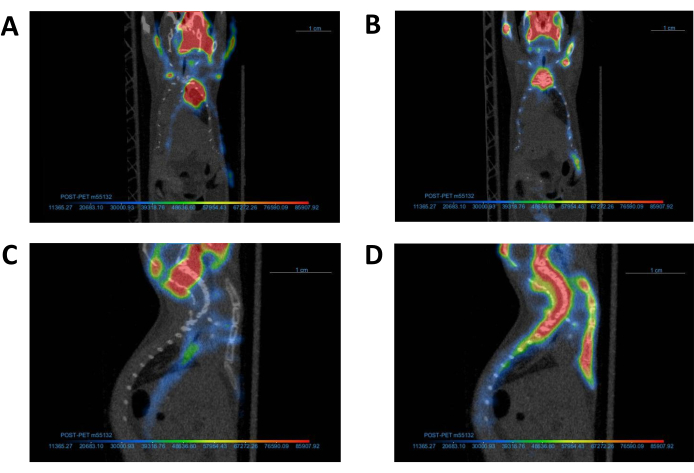
איור 4: יישור תמונות PET עם תמונת CT תואמת. תמונת PET מייצגת ותמונת CT תואמת (A, C) לפני ו-(B, D) לאחר רישום משותף. לאחר השלמת הרישום המשותף, יש ליישר את תמונות ה-PET וה-CT כפי שמודגם בלוח B. קיצורים: CT = טומוגרפיה ממוחשבת; PET = טומוגרפיה של פליטת פוזיטרונים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. זיהוי הסתיידות לב וכלי דם
- זהה את נקודת הזמן עם האזורים המסוידים החזויים הגדולים ביותר במחקר האורך (כלומר, נקודת זמן הסתיידות מאוחרת או נבדקים שטופלו מראש). בחר את התמונה המתאימה לנקודת זמן זו שתשמש כתמונת "ייחוס", תוך הדגשת ההסתיידות הבולטת ביותר. תמונה זו שנבחרה תתפקד כתבנית להשוואה עם כל התמונות האחרות המכילות אזורי הסתיידות קטנים יותר בנקודות זמן שונות.
- הפעל את תמונת CT הייחוס על-ידי לחיצה על סמל העין משמאל לתמונה. בחר את הכלי מעקב תחת התפריט הנפתח מניפולציה והזז את מרכז הציר סביב אזור הלב.
- התקרבו כדי למצוא את האזורים המסוידים (אתרים קטנים וצפופים בהירים) מעל צללית הלב שבין כלוב בית החזה, עצם החזה ועמוד השדרה (איור 5). אם האזורים המסוידים אינם גלויים מיד, גללו בין השכבות של כל תמונה באמצעות בחירת תצוגה דו-ממדית וגלילה באמצעות העכבר.
- הזז את ציר המסלול כדי לרחף מעל האזור המסויד, ולהבטיח את הניראות שלו בכל התצוגות הדו-ממדיות. להתייחסות חזותית של אזורי הסתיידות בתמונת CT של עכבר, עיין באיור 5.
- הפעל את תמונת ה- PET המתאימה כדי לאמת את נוכחות ההסתיידות.
הערה: אם הגדרות תמונת ה-PET והרישום המשותף הותאמו כראוי, תמונת ה-PET אמורה להציג פעילות סביב האזור המסויד, כפי שמודגם באיור 5D.
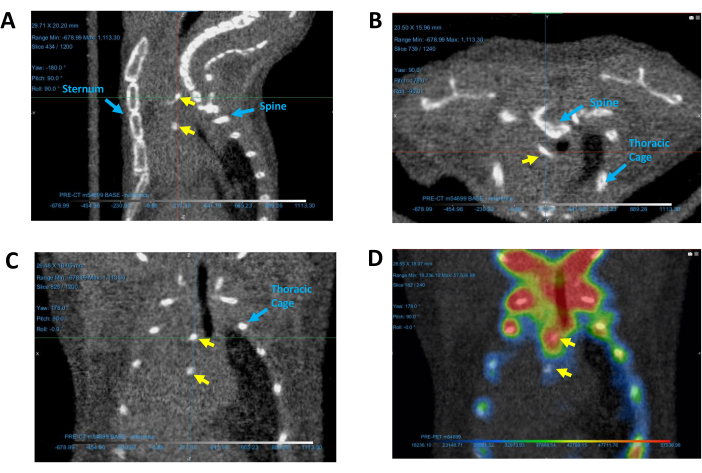
איור 5: זיהוי אזורים מסוידים בלב. אזורי הסתיידות המתוארים בתמונות CT מייצגות (A) קשת, (B) רוחביות ו-(C) קורונליות CT, וכן (D) תמונת PET/CT קורונלית. חיצים צהובים מציינים משקעי סידן. חיצים כחולים מזהים מבני ייחוס המשמשים לקביעת מיקום ההסתיידות. קיצורים: CT = טומוגרפיה ממוחשבת; PET = טומוגרפיה של פליטת פוזיטרונים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
7. ציירו ROI סביב האזורים המסוידים
- כבו את תמונת ההפניה ל-PET. הפעל רק את תמונת ההפניה ל- CT על-ידי לחיצה על סמל העין משמאל לתמונה.
- מצא את הרשימה הנפתחת צורות ובחר את צורת הכדור (קובץ משלים 1 - איור משלים S7). התאם את מידות הכדור על-ידי לחיצה וגרירה של הקצוות שלו כדי לשנות גודל. מקם מחדש את הכדור על-ידי לחיצה וגרירה של הריבוע המרכזי.
- נווט בין התצוגות הדו-ממדיות כדי למקם בזהירות את הכדור. הכדור צריך לתמצת את כל אזור ההסתיידות שזוהה וחלק מהאזור שמסביב, אך להימנע מכל העצמות שמסביב. לקבלת מדריך חזותי על ציור כדור אופטימלי, עיין באיור משלים S7 (קובץ משלים 1) למיקום נכון של הכדור.
- בתפריט הנפתח מאפייני נתונים והגדרות , לחץ באמצעות לחצן העכבר הימני על שם הכדור ובחר הוסף ל- ROI... (קובץ משלים 1 - איור משלים S8A), ואחריו בחירת ROI חדש (קובץ משלים 1 - איור משלים S8B).
- הקצה שם מתאים ל- ROI החדש שנוצר. תחת גיאומטריה, בחר את תמונת ה- CT שעבורה יש ליצור החזר השקעה (קובץ משלים 1 - איור משלים S8C).
- הפעל את החזר ההשקעה על-ידי לחיצה על סמל העין משמאל לשם החזר ההשקעה והתבונן בהחזר השקעה צבעוני המתאים לגודל הכדור שצויר קודם לכן, כפי שמודגם באיור משלים S8D (קובץ משלים 1).
- מצאו את הכרטיסייה Segment משמאל למסך התצוגה, לצד הכרטיסייה הראשית (איור 6A). הכרטיסייה Segment מאפשרת יצירה ועריכה של ROIs.
הערה: שלושת השלבים הבאים מכוונים ליצירת החזר השקעה בדיוק המדגיש באופן בלעדי אזורים מסוידים בתוך התחום המיועד.- בחר את החזר ההשקעה על ההפניה ב - Data Properties and Settings ואתר את התפריט הנפתח Range תחת הכרטיסיה Segment . לחץ כדי לבדוק את הגדר טווח (איור 6A).
- שנה את הטווח המוגדר באמצעות התיבה טווח נבחר (איור 6A). ודא שהטווח שהוגדר מכיל את כל הפיקסלים שאינם מסוידים עם ערכי יחידת Hounsfield (HU) מתחת לסף הסידן. הדגמה זו משתמשת בסף של 300 HU עבור סידן, והפיקסל בצפיפות הנמוכה ביותר בתמונה זו הוא -2,626; לכן, הטווח שנבחר הוא -2,626-300 HU.
- לאחר קביעת התצורה של הטווח שנבחר, לחצו על 'הסר ' (איור 6A) כדי לסלק את כל הפיקסלים מתחת לסף שצוין מההחזר על ההשקעה על הכדור.
הערה: פעולה זו מביאה להחזר השקעה חדש שמדגיש באופן בלעדי את האזורים המסוידים בתוך הכדור, ומייעל את המיקוד לניתוח נוסף. החזר השקעה שהושלם צריך להיות דומה להחזר ההשקעה המתואר באיור 6B.
- חזור על שלבים 7.3-7.4 עבור כל תמונות ה- CT העוקבות כדי ליצור החזר השקעה חדש וייחודי באמצעות כדור ייחוס משותף. תן שם לכל החזר השקעה כך שיתאים לזיהוי תמונת ה- CT הספציפית שלו, ומבטיח ניתוח תמציתי ומאורגן.
הערה: אין צורך ליצור כדור חדש לניתוח החזר ההשקעה של כל תמונה מכיוון שכדור הייחוס צריך לתמצת את האזור המסויד הגדול ביותר מכל התמונות, בהנחה שהיישור מדויק.
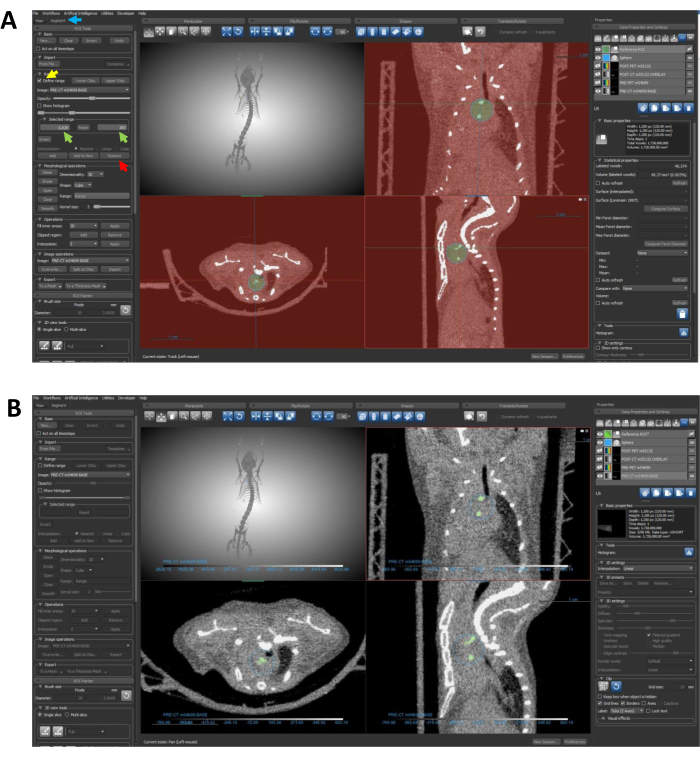
איור 6: שימוש בסגמנטציה כדי להגביל את החזר ההשקעה לאזורים מסוידים. (A) החצים מנחים את השלבים הדרושים לסילוק נתוני צפיפות בלתי רצויים מההחזר על ההשקעה. החץ הכחול מצביע על הכרטיסיה Segment ; החץ הצהוב מסמן את התכונה 'הגדר טווח '; חצים ירוקים מציינים את קלט הטווח שנבחר; והחץ האדום מצביע על לחצן הסר . (ב) לאחר השלמת שלבי הפרוטוקול 7.4-7.4.3, החזר ההשקעה צריך לתחום באופן ספציפי את האזורים המסוידים, כפי שמתואר בלוח זה. קיצור: החזר השקעה = אזור עניין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
8. כמת את החזר ההשקעה עבור כל תמונה
- בחר את החזר ההשקעה לכימות תחת התפריט הנפתח מאפייני נתונים והגדרות .
- מצא את התפריט הנפתח מאפיינים סטטיסטיים בצד ימין מתחת לרשימה הנפתחת מאפיינים בסיסיים (איור 7).
- אתר את טבלת ערכת הנתונים תחת מאפיינים סטטיסטיים. באמצעות התפריט הנפתח מימין, בחר את ערכת נתוני ההדמיה המתאימה המתאימה להחזר ההשקעה שיש לכמת (איור 7).
- בעת כימות נתוני ה- CT בתוך החזר ההשקעה, בחר את שם תמונת ה- CT המתואם עם החזר ההשקעה.
- בעת כימות נתוני הבחינה הפסיכומטרית בתוך החזר ההשקעה, בחר את שם תמונת ה-PET המתאים להחזר ההשקעה.
- לחצו על 'רענן ' לקבלת ערכים מכומתים של האזור המסויד שנבחר. שים לב לערכים מינימום, מקסימום וממוצע בהתאם לטבלת ערכת הנתונים. השתמש בערכי הממוצע לכימות (איור 7).
- אתר את חישוב אמצעי האחסון בחלק העליון של התיבה מאפיינים סטטיסטיים . השתמשו באמצעי אחסון זה לכימות (איור 7).
- עבור ערכות נתונים של CT, הערכים מדווחים ב- HU. חשב את תכולת הסידן הנפחית (vHU) באמצעות המכפלה של ערך החזר ההשקעה הממוצע (HU) והנפח של החזר ההשקעה (מ"מ3)12.
- עבור ערכות נתונים של PET, הערכים מדווחים ב- Becquerels (Bq), התואמים לדעיכה לשנייה. המר ל- Bq/mm3 על-ידי חלוקת ערך החזר ההשקעה הממוצע (Bq) בנפח החזר ה- ROI (מ"מ3), עבור ריכוז ספיגת נותב.

תרשים 7: כימות החזר ההשקעה. הכרטיסיה מאפיינים סטטיסטיים עבור החזר השקעה שנבחר. החיצים האדומים ממחישים את השלבים הנדרשים להשגת מידע סטטיסטי עבור מערך נתונים המבוסס על החזר ההשקעה. התיבות האדומות מזהות את הנפח ואת ערך יחידת Hounsfield הממוצע, חיוני לחישובי ניתוח נוספים. קיצור: החזר השקעה = אזור עניין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
שיטות ניתוח
חלק זה ממחיש ניצול מוצלח באמצעות תוצאות מייצגות. כאן, אנו מציגים את תמונת המיקרו-PET/microCT המשולבת של עכבר יחיד שנסרק בגיל 15 ו-18 חודשים, לאחר שעבר דיאטה מערבית (21% שומן, 0.2% כולסטרול) מגיל 12 עד 14 חודשים. בהתאם לפרוטוקול סעיפים 2-8 לכימות הסתיידות, ארבעה חוקר...
Discussion
פרוטוקול חדשני זה הוא גישה משופרת לכימות הסתיידות לב וכלי דם. בשל האופי הלא פולשני של הדמיה, ניתן לרכוש תמונות microCT אורכיות כדי לעקוב אחר התקדמות הסתיידות הלב וכלי הדם בבעלי חיים קטנים. למרות שתמונות microCT לבדן יכולות להראות את התקדמות תכולת הסידן, תמונות microPET, כאשר הן זמינ...
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
אנו מודים לכל חברי המרכז לטכנולוגיית הדמיה פרה-קלינית Crump של UCLA על עזרתם באיסוף נתונים ותהלוכה, כמו גם בתחזוקת ציוד ותשתיות. אנו מודים לג'פרי קולינס על עזרתו בתפעול ציקלוטרון ובסינתזת 18F-NaF. אנו מודים לקבוצת הייעוץ הסטטיסטי של UCLA על עזרתם בניתוח סטטיסטי. עבודה זו נתמכת על ידי מענק התמיכה של מרכז הסרטן NIH (2 P30 CA016042-44 ל- MT) והמכונים הלאומיים לבריאות, לב, ריאות ומכון הדם (HL137647 ו- HL151391 ל- YT ו- LLD). סורק GNEXT PET/CT מומן על ידי NIH S10 Shared Instrumentation for Animal Research Grant (1S10OD026917-01A1 to Arion Chatziioannou).
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 cc Sterile Insulin Syringes | Exel International | #26028 | Used for IV injection of 18F-NaF PET Tracer |
| 18F-NaF PET Tracer | CNSI Cyclotron | ||
| Biorender | Biorender | Used for figure 1 | |
| Female Apoe-/- mouse | Jackson Laboratories | #002052 | B6.129P2-Apoetm1Unc/J |
| GNEXT PET/CT | Sofie Biosciences, Dulles, Virginia | ||
| Isoflurane | Piramal Critical Care | Used as anesthesia for mouse imaging | |
| ORS Dragonfly | Comet Technologies Canada Inc. | ||
| SPSS Statistics | IBM | ||
| Western diet for mice | Envigo | #TD88139 | 21% fat, 0.2% cholesterol |
References
- Rennenberg, R. J. M. W., et al. Vascular calcifications as a marker of increased cardiovascular risk: A meta-analysis. Vasc Health Risk Man. 5, 185-197 (2009).
- Budoff, M. J., et al. Long-term prognosis associated with coronary calcification - observations from a registry of 25,253 patients. J Am Coll Cardiol. 49 (18), 1860-1870 (2007).
- Polonsky, T. S., et al. Coronary artery calcium score and risk classification for coronary heart disease prediction. JAMA. 303 (16), 1610-1616 (2010).
- Gepner, A. D., et al. Comparison of coronary artery calcium presence, carotid plaque presence, and carotid intima-media thickness for cardiovascular disease prediction in the multi-ethnic study of atherosclerosis. Circ Cardiovasc Imaging. 8 (1), e002262 (2015).
- Pillai, I. C. L., et al. Cardiac fibroblasts adopt osteogenic fates and can be targeted to attenuate pathological heart calcification. Cell Stem Cell. 20 (2), 218-232.e5 (2017).
- Mori, H., et al. Coronary artery calcification and its progression: What does it really mean. JACC Cardiovasc Imaging. 11 (1), 127-142 (2018).
- Mohan, J., Bhatti, K., Tawney, A., Zeltser, R. . StatPearls [Internet]. , (2023).
- Wang, Y., Osborne, M. T., Tung, B., Li, M., Li, Y. Imaging cardiovascular calcification. J Am Heart Assoc. 7 (13), e008564 (2018).
- Fletcher, A. J., et al. Quantifying microcalcification activity in the thoracic aorta. J Nucl Cardiol. 29 (3), 1372-1385 (2022).
- Derlin, T., et al. Feasibility of 18F-sodium fluoride PET/CT for imaging of atherosclerotic plaque. J Nucl Med. 51 (6), 862-865 (2010).
- Hsu, J. J., et al. Changes in microarchitecture of atherosclerotic calcification assessed by 18F-NaF PET and CT after a progressive exercise regimen in hyperlipidemic mice. J Nucl Cardiol. 28 (5), 2207-2214 (2021).
- Hsu, J. J., et al. Effects of teriparatide on morphology of aortic calcification in aged hyperlipidemic mice. Am J Physiol Heart Circ Physiol. 314 (6), H1203-H1213 (2018).
- Irkle, A., et al. Identifying active vascular microcalcification by 18F-sodium fluoride positron emission tomography. Nat Commun. 6, 7495 (2015).
- Syed, M. B. J., Doris, M., Dweck, M., Forsythe, R., Newby, D. E. Chapter 9 - Imaging vascular calcification: Where are we headed. Coronary Calcium: A Comprehensive Understanding of Its Biology, Use in Screening, and Interventional Management. , (2019).
- Joshi, N. V., et al. 18F-fluoride positron emission tomography for identification of ruptured and high-risk coronary atherosclerotic plaques: A prospective clinical trial. Lancet. 383 (9918), 705-713 (2014).
- Fiz, F., et al. 18F-NaF uptake by atherosclerotic plaque on PET/CT imaging: Inverse correlation between calcification density and mineral metabolic activity. J Nucl Med. 56 (7), 1019-1023 (2015).
- Kruithof, B. P., et al. An in vivo map of bone morphogenetic protein 2 post-transcriptional repression in the heart. Genesis. 49 (11), 841-850 (2011).
- Sheen, C. R., et al. Pathophysiological role of vascular smooth muscle alkaline phosphatase in medial artery calcification. J Bone Miner Res. 30 (5), 824-836 (2015).
- Tsai, M. T., Chen, Y. Y., Chang, W. J., Li, S. Y. Warfarin accelerated vascular calcification and worsened cardiac dysfunction in remnant kidney mice. J Chin Med Assoc. 81 (4), 324-330 (2018).
- Wait, J. M., et al. Detection of aortic arch calcification in apolipoprotein e-null mice using carbon nanotube-based micro-ct system. J Am Heart Assoc. 2 (1), e003358 (2013).
- White, D. J., et al. 19F MAS-NMR and solution chemical characterization of the reactions of fluoride with hydroxyapatite and powdered enamel. Acta Odontol Scand. 46 (6), 375-389 (1988).
- Czernin, J., Satyamurthy, N., Schiepers, C. Molecular mechanisms of bone 18F-NaF deposition. J Nucl Med. 51 (12), 1826-1829 (2010).
- Chen, N. X., O'neill, K. D., Dominguez, J. M., Moe, S. M. Regulation of reactive oxygen species in the pathogenesis of matrix vesicles induced calcification of recipient vascular smooth muscle cells. Vasc Med. 26 (6), 585-594 (2021).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262 (2018).
- Chen-Mayer, H. H., et al. Standardizing ct lung density measure across scanner manufacturers. Med Phys. 44 (3), 974-985 (2017).
- Coxson, H. O. Sources of variation in quantitative computed tomography of the lung. J Thorac Imaging. 28 (5), 272-279 (2013).
- Rogasch, J. M. M., et al. Influences on pet quantification and interpretation. Diagnostics (Basel). 12 (2), 451 (2022).
- Liljequist, D., Elfving, B., Skavberg Roaldsen, K. Intraclass correlation - a discussion and demonstration of basic features. PLoS One. 14 (7), e0219854 (2019).
- Koo, T. K., Li, M. Y. A guideline of selecting and reporting intraclass correlation coefficients for reliability research. J Chiropr Med. 15 (2), 155-163 (2016).
- Moss, A. J., et al. Molecular coronary plaque imaging using (18)f-fluoride. Circ Cardiovasc Imaging. 12 (18), e008574 (2019).
- Moss, A., et al. Coronary atherosclerotic plaque activity and future coronary events. JAMA Cardiol. 8 (8), 755-764 (2023).
- Badea, C., Hedlund, L. W., Johnson, G. A. Micro-ct with respiratory and cardiac gating. Med Phys. 31 (12), 3324-3329 (2004).
- Yang, Y., Rendig, S., Siegel, S., Newport, D. F., Cherry, S. R. Cardiac pet imaging in mice with simultaneous cardiac and respiratory gating. Phys Med Biol. 50 (13), 2979-2989 (2005).
- Liao, W., Deserno, T. M., Spitzer, K. Evaluation of free non-diagnostic dicom software tools. Proc Spie. 6919, (2008).
- Haak, D., Page, C. E., Deserno, T. M. A survey of dicom viewer software to integrate clinical research and medical imaging. J Digit Imaging. 29 (2), 206-215 (2016).
- Aiello, M., et al. How does dicom support big data management? Investigating its use in medical imaging community. Insights Imaging. 12 (1), 164 (2021).
- Kristanto, W., Van Ooijen, P. M., Groen, J. M., Vliegenthart, R., Oudkerk, M. Small calcified coronary atherosclerotic plaque simulation model: Minimal size and attenuation detectable by 64-MDCT and microCT. Int J Cardiovasc Imaging. 28 (4), 843-853 (2012).
- Dehmeshki, J., et al. Volumetric quantification of atherosclerotic plaque in ct considering partial volume effect. IEEE Trans Med Imaging. 26 (3), 273-282 (2007).
- Demer, L. L., Tintut, Y., Nguyen, K. L., Hsiai, T., Lee, J. T. Rigor and reproducibility in analysis of vascular calcification. Circ Res. 120 (8), 1240-1242 (2017).
- Alluri, K., et al. Scoring of coronary artery calcium scans: History, assumptions, current limitations, and future directions. Atherosclerosis. 239 (1), 109-117 (2015).
- Zhang, L., et al. Advances in CT techniques in vascular calcification. Front Cardiovasc Med. 8, 716822 (2021).
- Achenbach, S., Raggi, P. Imaging of coronary atherosclerosis by computed tomography. Eur Heart J. 31 (12), 1442-1448 (2010).
- Agatston, A. S., et al. Quantification of coronary artery calcium using ultrafast computed tomography. J Am Coll Cardiol. 15 (4), 827-832 (1990).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved