JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
종방향 MicroPET/MicroCT 이미지를 사용한 심혈관 석회화 진행을 위한 새로운 정량화 프로토콜
요약
이 새로운 프로토콜은 소형 연구 동물의 연속 마이크로 양전자 방출 단층 촬영(PET)/마이크로 컴퓨터 단층 촬영(CT) 이미지에서 심혈관 석회화 진행을 정량화하는 것을 수반합니다.
초록
마이크로 양전자 방출 단층 촬영(PET) 및 마이크로 컴퓨터 단층 촬영(CT) 영상은 심혈관 석회화의 진행을 추적하기 위한 강력하고 이상적인 연구 도구입니다. 비침습적 특성으로 인해 작은 연구 동물은 여러 시점에서 이미징할 수 있습니다. 문제는 심혈관 석회화의 정확한 정량화에 있습니다. 여기에서는 종단 연구에서 심혈관 석회화의 진행을 정확하게 정량화하기 위해 후기 질병 단계의 이미지를 템플릿으로 사용하는 프로토콜을 제공합니다. 이 프로토콜에는 1) 첫 번째 단계와 같은 종단 연구 중 동일한 동물의 여러 이미지에서 흉부 부위의 정렬, 2) 이후 이미지에서 명백해지는 더 큰 칼슘 침착 부위의 심장 및 대동맥 내에 위치한 관심 영역(ROI)의 정의, 3) 종단 연구 중에 획득한 모든 이미지에서 칼슘 침전물의 동시 분할 및 정량화가 포함됩니다. 이 간소화된 방법은 ROI 정의의 정밀도를 개선하고 개별 스캔을 독립적으로 분석하는 이전 기술과 관련된 변동성을 줄임으로써 심혈관 석회화의 진행을 추적할 때 이미지 분석의 정확도를 향상시킵니다.
서문
심혈관 질환은 전 세계적으로 이환율과 사망률의 주요 원인이며, 그 메커니즘을 밝히고 효과적인 예방 및 치료 전략을 고안하기 위해서는 엄격한 연구가 필요합니다. 관상동맥 석회화(CAC)는 심혈관 질환의 예측 인자로 이 분야의 전문가들에 의해 널리 인정받고 있으며, 심혈관 질환으로 인한 사망률의 위험을 크게 높입니다 1,2,3,4,5. 현미경적 석회화는 석회화 죽상동맥경화증의 초기 단계로 간주되며, "미세석회화"라는 용어는 직경이 0.5에서 50μm 6,7,8,9 사이의 칼슘 침전물을 지칭하는 데 사용되었습니다. 이러한 작은 석회화는 합쳐져 더 큰 칼슘 침전물을 형성하여 석회질 플라크 6,7의 진행을 촉진하는 것으로 믿어집니다.
양전자 방출 단층 촬영(PET) 및 컴퓨터 단층 촬영(CT)은 생체 내 심혈관 석회화의 비침습적 평가에 자주 사용되는 귀중한 연구 도구 역할을 합니다 5,10,11,12,13,14,15,16,17,18,19 . 이러한 이미징 양식은 소규모 연구 동물을 포함하는 종단 연구에서 혈관 석회화 진행을 추적하는 데 특히 유리한 것으로 입증되었습니다 11,12,13,19. MicroCT 이미징은 상대적으로 큰 칼슘 침 전물 11,12,13,19,20의 해부학적 이미지를 제공하는 데 효과가 있음이 입증되었습니다.그러나 살아있는 동물의 작은 칼슘 침전물을 이미징하기 위한 유용성은 ~100 μm 8,14의 공간 해상도로 인해 제한되어 초기 단계에서 석회화를 조사하기가 어렵습니다.
주목할 만한 발전은 광물 표면적에 대한 결합을 기반으로 한 석회화 검출을 위한 표준 방법으로 PET 추적자인 불소-18 표지 불화나트륨(18F-NaF)과 결합된 microPET/microCT 이미징을 채택한 것입니다. 이 접근법은 방사성 표지된 18F-NaF를 사용하며, 불소 이온이 칼슘 하이드록시아파타이트에 공유 결합하여 하이드록실 그룹을 대체하여 플루오로아파타이트21을 형성할 때 칼슘 미네랄 표면10,13을 식별하는 것으로 나타났습니다. 18F의 방사성 붕괴 (반감기 ~ 110 분)에 비해 느린 환율과 신장22를 통한 추적자의 제거와 일치하게, Irkle과 동료13는 석회화 된 경동맥 표본에 대한 18F-NaF 결합이 검출 당시 표면으로 제한된다는 것을 발견했습니다. 따라서 추적자 흡수는 광물 표면적과 직접 관련되어야 하며, 이는 주어진 양의 광물이 소수의 크고 단단한 침전물에 존재할 때보다 여러 개의 작은 초점 또는 다공성 형태로 발생할 때 더 큽니다. 18F-NaF PET 이미징은 높은 감도로 광물화의 초기 단계를 강조함으로써 질병의 초기 단계에 대한 귀중한 통찰력을 제공할 수 있으며, 예방 및 치료 전략을 연구하는 데 특히 유용합니다 13,14,15.
최근 혈관 석회화의 microPET/microCT 결합 이미징이 발전했음에도 불구하고 종단 심혈관 석회화 연구에서 이미지 분석의 정확도를 개선할 수 있는 기회가 있습니다. 기존 접근 방식은 종단 연구 전반에 걸쳐 각 개별 시점에서 모든 마우스에서 눈에 보이는 각 석회화 영역 주변의 관심 영역(ROI)을 노동 집약적으로 수동으로 묘사하는 방법을 사용합니다. 이 방법은 특히 칼슘 침전물의 크기가 스캐너의 검출 한계에 근접할 때 초기 질병 단계에서 정밀도를 감소시켜 저밀도로 배열된 미세한 침전물이 있는 일부 영역을 보이게 할 수 있습니다.
이미징 영역에서 정렬은 일반적으로 일련의 이미지의 공간 정렬을 나타냅니다. 기존 문제에 대한 새로운 솔루션으로 정렬을 도입한 우리가 제안한 방법을 통해 조사자는 종단 연구 전반에 걸쳐 개별 피험자의 연속 이미지에서 석회화 진행을 추적하기 위해 일관된 위치를 사용할 수 있습니다. 조직 석회화가 나노 크기의 기질 소포(50-150 nm)에서 발생하는 것으로 알려져 있으며, 이 소포가 합쳐져 미시적이고 거시적인 하이드록시아파타이트 미네랄23을 형성한다는 점을 감안할 때, 미세 석회화가 식별되기 전에 초기 이미지에서 어디에 위치했는지 후향적으로 식별할 수 있습니다.
이미지 정렬을 통해 가능해진 시간이 지남에 따라 동일한 위치를 따르는 것이 이 방법의 기초입니다. 광물화가 쉽게 식별되는 가장 늦은 단계를 기반으로 ROI가 할당되기 때문에 가장 초기의 석회화 단계를 직접 식별할 필요가 없습니다. 이 프로토콜에서는 시계열 이미지의 정렬을 중요한 단계로 통합하여 종단, 결합, microPET/microCT 이미징 연구에서 칼슘 침착의 정확한 정량화를 향상시키는 개선되고 간소화된 데이터 분석 방법을 제시합니다(그림 1). PET/CT 데이터 분석을 예로 들었지만, 이 방법은 단일 광자 방출 컴퓨터 단층 촬영(SPECT), 자기 공명 영상(MRI) 및 광학 영상24을 포함한 다른 종단 영상 데이터 분석에 적용할 수 있습니다.
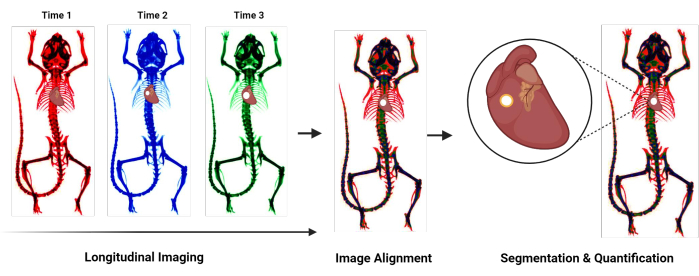
그림 1: 프로토콜 개요 순서도. 심혈관 석회화를 정량화하기 위한 새로운 프로토콜을 요약한 흐름도. 일반적인 단계에는 종적 이미징, 서로 다른 시점에서 획득한 이미지의 정렬, 석회화된 영역의 분할 및 정량화가 포함됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
대표적인 이미지는 암컷 아포지단백-E-결핍(Apoe-/-) 마우스입니다. 실험 프로토콜은 캘리포니아 대학교 로스 앤젤레스 (University of California, Los Angeles)의 기관 동물 보호 및 사용 위원회 (Institutional Animal Care and Use Committee)에서 검토하고 승인했습니다.
1. 동물 스캐닝
- 두 가지 이미지 획득 사이에 어떠한 개입 없이 마우스에게 표준 식단을 공급합니다. 그러나 생후 15개월에 첫 번째 이미지를 보기 전에 12개월에서 14개월 사이에 서양식 식단(지방 21%, 콜레스테롤 0.2%)으로 전환하여 기준선 대동맥 석회화를 유도하십시오.
- 최적의 PET 데이터 수집 및 CT 공동 정합을 위해 microPET/CT 스캐너를 정기적으로 보정해야 합니다. 제조업체의 지침에 따라 보정을 수행하십시오.
- 이미징하기 전에 챔버에서 2% 이소플루란 가스를 사용하여 10분 동안 마우스를 마취합니다. 반응이 없는 동물의 발가락을 꼬집어 마취를 확인합니다.
- 18F-NaF의 3.7 MBq를 정맥 주사 한 후 60분 후에 결합된 microPET/CT 스캐너에서 microPET(350-650keV, 스캔 시간 10분) 및 100μm microCT(80kVp, 150μA, 720 투영, 1분 스캔 시간) 이미지를 획득합니다. microPET 스캔 직후 microCT 스캔을 획득합니다.
참고: 스캐너 베드는 동물이 마취 상태에서 동일한 위치에 있는 동안 동물을 PET 모달에서 CT 모달로 이동시켰습니다. - 3D 순서의 subset 기대값 최대화 알고리즘(24개의 subset 및 3회 반복)을 사용하여 무작위, 감쇠 및 감쇠 보정과 함께 microPET 이미지를 재구성합니다. Modified Feldkamp 알고리즘을 사용하여 CT 영상을 재구성합니다.
참고: 이미징 후 쥐는 흉골 누운 상태를 유지하기에 충분한 의식을 회복할 때까지 모니터링되었습니다. 종단 연구가 끝날 무렵, 모든 쥐는 안락사되었다.
2. DICOM 뷰어 소프트웨어에서 DICOM 파일 가져오기
참고: 이 대표 프로토콜은 비상업적 라이선스에 따라 ORS Dragonfly 소프트웨어를 사용하지만 그 유연성은 다른 DICOM 뷰어 소프트웨어 옵션으로 확장됩니다.
- 응용 프로그램을 두 번 클릭하여 DICOM 뷰어 소프트웨어를 시작합니다.
- 왼쪽 상단 모서리에 있는 파일로 이동합니다. 드롭다운 메뉴에서 DICOM 이미지 가져오기... 를 선택하여 DICOM 이미지 관리 창(추가 파일 1- 추가 그림 S1A)의 표시를 표시합니다.
- Manage DICOM Images(DICOM 이미지 관리) 창에서 Folder Contents(폴더 내용) 탭을 클릭합니다. 오른쪽에서 폴더 열기...를 선택하여 종단 연구에서 관심 있는 DICOM 파일이 포함된 폴더를 선택합니다(보충 파일 1- 보충 그림 S1B).
- DICOM 파일이 포함된 폴더를 식별합니다. 폴더 선택을 클릭하여 첫 번째 폴더를 DICOM 이미지 관리 창(보충 파일 1- 보충 그림 S1C)으로 가져옵니다.
- DICOM 이미지 관리 창에서 PET("PT") 및 CT("CT") DICOM 파일을 모두 선택합니다. 그런 다음 오른쪽의 View Study를 클릭하여 가져온 모든 DICOM 이미지(보충 파일 1- 보충 그림 S1D)를 엽니다.
- 종단 연구에서 동일한 단일 피사체와 관련된 DICOM 이미지가 포함된 각 폴더에 대해 2.4단계와 2.5단계를 반복합니다.
3. DICOM 뷰어 설정을 조정하여 이미지 시각화 최적화
- 보충 파일 1- 보충 그림 S2에 설명된 대로 4개의 보기(3D, 횡, 관상, 시상)를 표시하도록 레이아웃을 변경합니다. 왼쪽의 레이아웃(Layout) 드롭다운에서 선택한 장면의 뷰(Views)를 찾아 4개의 뷰를 표시하는 레이아웃을 선택합니다.
- 영상의 이름을 바꿔 시점을 나타내고 PET 영상인지 CT 영상인지를 나타냅니다. 이미지 이름을 선택하고 두 번 클릭하여 각 이미지의 이름을 바꿉니다.
- 오른쪽에 있는 데이터 속성 및 설정 드롭다운에 액세스하여 이미지를 켭니다. 각 이미지 이름 왼쪽에 있는 눈 아이콘을 클릭하여 가시성을 전환합니다(보충 파일 1- 추가 그림 S2).
- 각 CT 이미지의 밝기와 대비를 개별적으로 조정합니다.
참고: 최적의 CT 밝기 및 대비 범위는 피사체, 이미징 프로토콜, 스캐너 및 재구성 매개변수25,26에 따라 달라질 수 있습니다. 그러나 모든 조정은 종단 연구에서 단일 주제에 대해 일관되어야 합니다.- 데이터 속성 및 설정(추가 파일 1- 추가 그림 S2)에서 이미지 이름을 클릭하여 하나의 CT 이미지를 선택하고 켭니다.
- 디스플레이 화면 왼쪽의 Main 탭에 있는 Window Leveling 드롭다운에서 히스토그램을 찾습니다. 히스토그램 위의 LogY를 활성화합니다. 그런 다음 노란색 범위 표시기를 클릭하고 밀어 히스토그램의 두 번째 피크를 완전히 둘러쌉니다(보충 파일 1- 보충 그림 S3A). 최적의 밝기/대비에 도달할 때까지 약간 조정하십시오. 밝기/대비 조정 CT 이미지의 예는 그림 2B를 참조하십시오.
- 창 레벨링 히스토그램(보충 파일 1- 보충 그림 S3B)에서 선택한 범위 상자를 찾습니다. 다음 단계에서 사용할 선택한 범위 값을 기록해 둡니다.
- 두 번째 CT 영상(보충 파일 1- 보충 그림 S3C)을 선택하고 켭니다. 첫 번째 CT 영상에서 선택한 범위 값을 두 번째 CT 영상의 선택 범위 상자에 입력합니다(보충 파일 1-보충 그림 S3B-S3D). 모든 연속 이미지에 대해 반복합니다.
- 룩업 테이블 필터를 개별적으로 조정하여 각 PET 이미지를 정제합니다.
참고: 최적의 PET 색상 스케일 범위는 피사체, 이미징 프로토콜, 스캐너 및 재구성 매개변수에 따라 달라질 수 있습니다27; 그러나 모든 조정은 종단 연구에서 단일 주제에 대해 일관되어야 합니다.- 데이터 속성 및 설정(추가 파일 1- 추가 그림 S2)에서 이미지 이름을 클릭하여 하나의 PET 이미지를 선택하고 켭니다.
- 메인 탭의 창 레벨링 드롭다운에서 룩업 테이블(LUT)을 찾아 스크롤하여 LUT 드롭다운에서 PET를 찾은 다음 PET 필터를 선택합니다(보충 파일 1- 보충 그림 S4A).
- Window Leveling 드롭다운 아래의 히스토그램을 사용하여 선택한 범위를 미세 조정하여 최적의 시각화를 달성합니다. 히스토그램 위의 LogY를 활성화합니다. 그런 다음 노란색 범위 표시기를 클릭하여 보충 그림 S4B(보충 파일 1)에 표시된 위치로 밉니다. PET 이미지 시각화를 위해 최적의 선택 범위에 도달할 때까지 약간의 조정을 수행합니다. 최적의 선택 범위에 맞게 조정된 PET/CT 이미지의 예는 그림 2D를 참조하십시오.
- 창 레벨링 히스토그램에서 선택한 범위 드롭다운을 찾습니다(보충 파일 1- 보충 그림 S4B). 다음 단계에서 사용할 선택한 범위 값을 기록해 둡니다.
- 두 번째 PET 이미지(보충 파일 1- 그림 S4C)를 선택하고 켭니다. 두 번째 이미지에 대해 3.5.2단계를 반복합니다.
- 첫 번째 PET 이미지에서 선택한 범위 값을 두 번째 PET 이미지의 선택 범위 상자에 입력합니다(보충 파일 1-그림 S4B-S4D). 모든 연속 이미지에 대해 반복합니다.
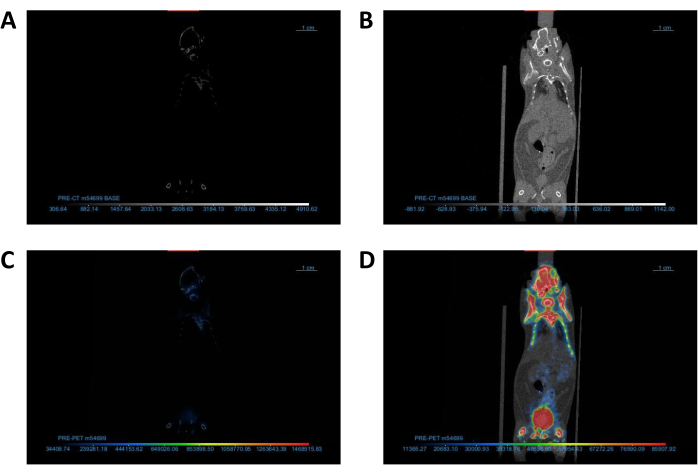
그림 2: 이미지 시각화를 최적화하기 위한 DICOM 뷰어 설정 조정. (ᅡ,ᄂ) 콘트라스트/밝기 조정 전(A)과 (B) CT 이미지의 코로나 뷰. (씨,디) 룩업 테이블 조정 전(C)과 룩업 테이블 조정 후(D)의 PET/CT 영상의 코로나 뷰. 약어: CT = 컴퓨터 단층 촬영; PET = 양전자 방출 단층 촬영. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. CT 영상에서 가슴 부위를 정렬합니다.
참고: 단순화를 위해 하나의 CT 이미지가 "기본" 이미지로 사용되며 변환되거나 회전되지 않습니다. 두 번째 CT 이미지(및 최종적으로 후속 연속 이미지)는 기본 이미지에 맞게 변환 및/또는 회전됩니다. 이것은 데모의 목적을 위해 "오버레이" 이미지라고 합니다. 정렬하는 동안 기본 이미지와 다른 모든 오버레이 이미지를 구별하는 것이 중요합니다.
- 데이터 속성 및 설정 드롭다운에서 각 이미지 이름 왼쪽에 있는 눈 아이콘을 클릭하여 모든 PET 이미지를 끄고 기본 CT 이미지를 켭니다.
- CT 이미지의 불투명도를 ~50%로 변경합니다. 2D 뷰 중 하나를 클릭합니다. Window Leveling 상자 아래에서 Opacity Mapping 드롭다운을 찾아 Opacity 스케일을 중앙으로 밉니다(보충 파일 1- 그림 S5).
- 오버레이 CT 이미지를 켜고 4.2단계를 반복합니다.
- 오버레이 CT 영상의 필터를 변경하여 기본 CT 영상과 오버레이 CT 영상을 구분합니다. 메인 탭의 창 평준화 드롭다운에서 룩업 테이블(LUT)을 찾습니다. LUT 드롭다운에서 스크롤하여 빨간색 필터를 클릭합니다.
참고: 이제 보충 그림 S5 (보충 파일 1)와 같이 각 보기에 두 개의 CT 이미지가 있어야 합니다. - 2D 뷰에서 평행 이동/회전 도구를 사용하여 오버레이 이미지의 가슴 영역을 기본 이미지의 가슴 영역과 최대한 가깝게 정렬합니다. CT 영상에서 흉곽, 상부 척추 및 흉골을 흉부 정렬 지표로 참조합니다.
참고: 다음 작업은 2D 뷰(가로, 코로나 또는 궁수)에서만 실행할 수 있습니다(보충 파일 1- 보충 그림 S1). 최상의 결과를 얻으려면 세 가지 2D 보기 사이를 모두 전환하고 변환/회전 도구를 사용하여 각 보기에서 가슴 영역을 정렬합니다.- 데이터 속성 및 설정 드롭다운에서 오버레이 이미지를 선택하고 한 번 클릭하여 2D 보기 중 하나를 선택합니다.
- Main 탭에서 Translate/Rotate 드롭다운을 찾아 변위 아이콘(보충 파일 1- 그림 S6A)을 클릭합니다.
- 왼쪽 하단 모서리에 있는 변환 상자를 클릭하고 드래그한 다음 선택한 2D 뷰의 중앙에 있는 피벗 포인트를 회전하여 오버레이 이미지를 기본 이미지와 대략적으로 정렬하도록 이동합니다(추가 파일 1 - 추가 그림 S6B). 정렬을 참조하기 위해 bone structures를 참조하십시오.
- Manipulate 드롭다운에서 Track 도구를 찾아 축의 중심을 클릭하고 드래그하여 축을 가슴 영역으로 이동합니다. 컴퓨터 마우스의 중간 스크롤 버튼을 클릭하고 마우스를 화면에서 멀리 끌어 가슴 부분을 확대합니다(보충 파일 1 - 보충 그림 S6C).
- 추가 평행 이동 및 회전 조정을 통해 흉곽, 상부 척추 및 흉골과 같은 흉부 구조와 정확한 위치를 지정하기 위해 정렬을 미세 조정합니다. 2D 보기 간에 전환하고 두 이미지가 그림 4.5.3과 같이 정렬될 때까지 4.5.5.4-3단계를 반복합니다.
- 기본 및 첫 번째 오버레이 CT 이미지를 정렬한 후 LUT 드롭다운에서 오버레이 CT 이미지의 필터를 다시 회색조 로 변경합니다. 일정한 기본 이미지를 사용하여 동일한 동물의 모든 오버레이 CT 이미지에 대해 섹션 4를 반복합니다.
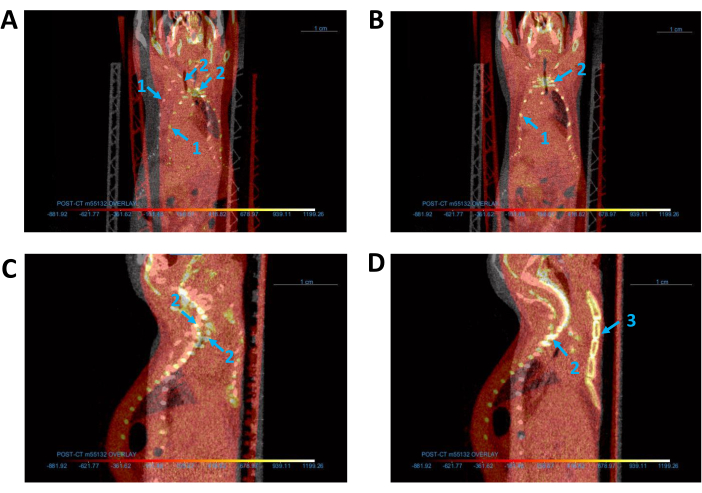
그림 3: 모든 CT 이미지의 정렬. (ᅡ,ᄂ) 베이스(회색) 및 오버레이(빨간색) CT 이미지(A) 정렬 전과 후(B)의 관상 보기. (씨,디) 정렬 전과 (D) CT 이미지의 시상도(C). 파란색 화살표는 마우스의 (1) 흉곽, (2) 척추 및 (3) 흉골을 나타냅니다. 약어: CT = 컴퓨터 단층 촬영. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. PET 영상과 해당 CT 영상 동시 등록
참고: 오버레이 CT 이미지와 기본 CT 이미지를 정렬하면 처음에는 그림 4에서 볼 수 있는 해당 PET 이미지와 오버레이 CT 이미지가 잘못 정렬됩니다. PET 영상은 해당 CT 영상과 다시 한 번 공동 등록해야 합니다.
- 각 이미지 이름 왼쪽에 있는 눈 아이콘을 클릭하여 오버레이 CT 이미지와 해당 PET 이미지를 켭니다.
- PET 및 CT 이미지의 불투명도를 ~50%로 변경합니다. Window Leveling 드롭다운에서 Opacity Mapping 드롭다운을 찾아 Opacity 스케일을 중앙으로 밉니다(추가 파일 1 - 추가 그림 S5).
- 2D 보기에서 변환/회전 도구를 사용하여 CT 이미지의 뼈 구조와 PET 이미지의 18F-NaF 뼈 표면을 기반으로 PET 이미지를 해당 CT 이미지에 정렬합니다.
- 데이터 속성 및 설정 드롭다운에서 오버레이 CT 이미지에 해당하는 PET 이미지를 선택하고 한 번 클릭하여 2D 보기 중 하나를 선택합니다.
- 메인 탭에서 변환/회전 드롭다운을 찾아 디스플레이스 아이콘(보충 파일 1 - 보충 그림 S6A)을 클릭합니다.
- 왼쪽 하단의 변환 상자를 클릭하고 드래그한 다음 선택한 2D 뷰(보충 파일 1 - 보충 그림 S6B)의 중앙에 있는 피벗 포인트를 회전하여 PET 이미지를 CT 이미지와 공동 등록하도록 이동합니다.
- CT 이미지와 공동 등록되지 않은 모든 오버레이 PET 및 CT 이미지에 대해 섹션 5를 반복합니다.
참고: 공동 정합이 완료되면 그림 4와 같이 해당 PET/CT 이미지가 신체의 전체 길이를 따라 정렬되어야 합니다.
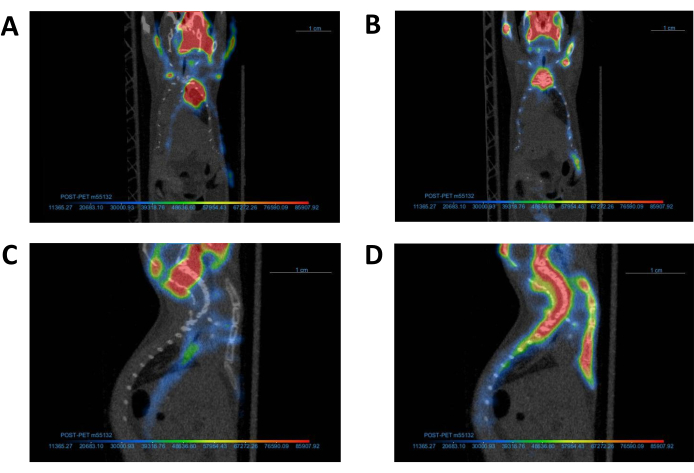
그림 4: PET 이미지와 해당 CT 이미지의 정렬. 대표 PET 영상과 이에 해당하는 CT 영상(A, C) 전과 후(B, D) 공동 정합 후. 공동 등록이 완료된 후 PET 및 CT 이미지는 패널 B에 표시된 대로 정렬되어야 합니다. 약어: CT = 컴퓨터 단층 촬영; PET = 양전자 방출 단층 촬영. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 심혈관 석회화 확인
- 종단 연구에서 가장 큰 예측된 석회화 영역이 있는 시점을 식별합니다(즉, 후기 석회화 시점 또는 전처리된 피험자). 이 시점에 해당하는 이미지를 "참조" 이미지로 선택하여 가장 뚜렷하게 보이는 석회화를 강조합니다. 이 선택한 이미지는 서로 다른 시점에서 더 작은 석회화 영역을 포함하는 다른 모든 이미지와 비교하기 위한 템플릿으로 작동합니다.
- 이미지 왼쪽에 있는 눈 아이콘을 클릭하여 참조 CT 이미지를 켭니다. 조작(Manipulate) 드롭다운에서 추적(Track) 도구를 선택하고 심장 영역 주위로 축 중심을 이동합니다.
- 확대하여 흉곽, 흉골 및 척추 사이의 심장 실루엣 위에 겹쳐진 석회화된 영역(작고 밝고 밀집된 부위)을 찾습니다(그림 5). 석회화된 영역이 즉시 보이지 않으면 2D 보기를 선택하고 마우스로 스크롤하여 각 이미지의 레이어를 스크롤합니다.
- 추적 축을 이동하여 석회화된 영역 위로 마우스를 가져가면 모든 2D 뷰에서 가시성이 확보됩니다. 마우스 CT 영상의 석회화 영역에 대한 시각적 참조는 그림 5를 참조하십시오.
- 해당 PET 이미지를 켜서 석회화의 존재를 확인합니다.
참고: PET 이미지 설정 및 공동 정합이 적절하게 조정된 경우, PET 이미지는 그림 5D와 같이 석회화된 영역 주변의 활동을 표시해야 합니다.
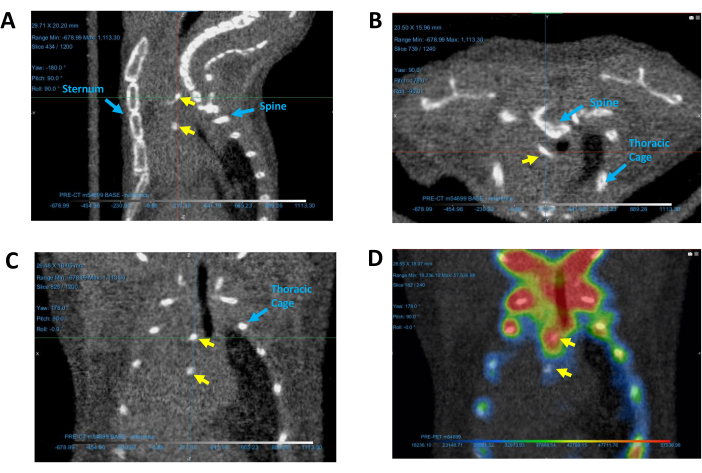
그림 5: 심장의 석회화된 부위 식별. 대표적인 (A) 시상, (B) 횡방향 및 (C) 관상 CT 영상 및 (D) 관상 PET/CT 영상에 표시된 석회화 영역. 노란색 화살표는 칼슘 침전물을 나타냅니다. 파란색 화살표는 석회화 위치를 결정하는 데 사용되는 기준 구조를 식별합니다. 약어: CT = 컴퓨터 단층 촬영; PET = 양전자 방출 단층 촬영. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 석회화된 영역 주변에 ROI를 그립니다.
- PET 참조 이미지를 끕니다. 이미지 왼쪽에 있는 눈 아이콘을 클릭하여 CT 참조 이미지만 켭니다.
- 셰이프(Shapes) 드롭다운을 찾아 구(Sphere) 셰이프를 선택합니다(보충 파일 1 - 보충 그림 S7). 구의 가장자리를 클릭하고 드래그하여 크기를 수정하여 구의 치수를 조정합니다. 가운데 사각형을 클릭하고 드래그하여 구의 위치를 변경합니다.
- 2D 뷰를 탐색하여 구를 신중하게 배치합니다. 구는 식별된 전체 석회화 영역과 일부 주변 영역을 캡슐화해야 하지만 주변 뼈는 피해야 합니다. 최적의 구 그리기에 대한 시각적 안내는 구의 적절한 배치를 위해 보충 그림 S7 (보충 파일 1)을 참조하십시오.
- Data Properties and Settings(데이터 속성 및 설정) 드롭다운에서 구 이름을 마우스 오른쪽 버튼으로 클릭하고 Add to ROI... (보충 파일 1 - 보충 그림 S8A)를 선택한 다음 새 ROI(보충 파일 1 - 보충 그림 S8B)를 선택합니다.
- 새로 생성된 ROI에 적절한 이름을 지정합니다. Geometry에서 ROI를 생성할 CT 이미지를 선택합니다(보충 파일 1 - 보충 그림 S8C).
- ROI 이름 왼쪽에 있는 눈 아이콘을 클릭하여 ROI를 켜고 보충 그림 S8D (보충 파일 1)와 같이 이전에 그린 구의 크기에 해당하는 컬러 ROI를 관찰합니다.
- 디스플레이 화면 왼쪽의 메인 탭 옆에 있는 세그먼트 탭을 찾습니다(그림 6A). 세그먼트 탭에서는 ROI를 만들고 편집할 수 있습니다.
참고: 다음 세 단계는 지정된 구 내의 석회화된 영역만 강조하는 정밀도로 ROI를 생성하기 위한 것입니다.- 데이터 속성 및 설정에서 참조 ROI를 선택하고 세그먼트 탭에서 범위 드롭다운을 찾습니다. Define range(범위 정의)를 클릭하여 확인합니다(그림 6A).
- Selected Range(선택한 범위) 상자를 사용하여 정의된 범위를 변경합니다(그림 6A). 정의된 범위가 칼슘 임계값 미만의 Hounsfield 단위(HU) 값으로 석회화되지 않은 모든 픽셀을 캡슐화하는지 확인합니다. 이 데모에서는 칼슘에 대해 300HU의 임계값을 사용하며 이 이미지에서 가장 낮은 밀도 픽셀은 -2,626입니다. 따라서 선택한 범위는 -2,626-300HU입니다.
- 선택한 범위가 구성되면 제거 (그림 6A)를 클릭하여 구 ROI에서 지정된 임계값 미만의 모든 픽셀을 제거합니다.
참고: 이 작업은 구 내의 석회화된 영역을 독점적으로 강조하는 새로운 ROI를 생성하여 추가 분석을 위한 초점을 간소화합니다. 완료된 ROI는 그림 6B에 표시된 ROI와 유사해야 합니다.
- 모든 연속 CT 이미지에 대해 7.3-7.4단계를 반복하여 공통 참조 구를 사용하여 고유한 새 ROI를 생성합니다. 특정 CT 이미지의 식별에 따라 각 ROI의 이름을 지정하여 간결하고 체계적인 분석을 보장합니다.
참고: 정렬이 정확하다고 가정할 때 참조 구는 모든 이미지에서 가장 큰 석회화 영역을 캡슐화해야 하기 때문에 각 이미지의 ROI 분석을 위해 새 구를 만들 필요가 없습니다.
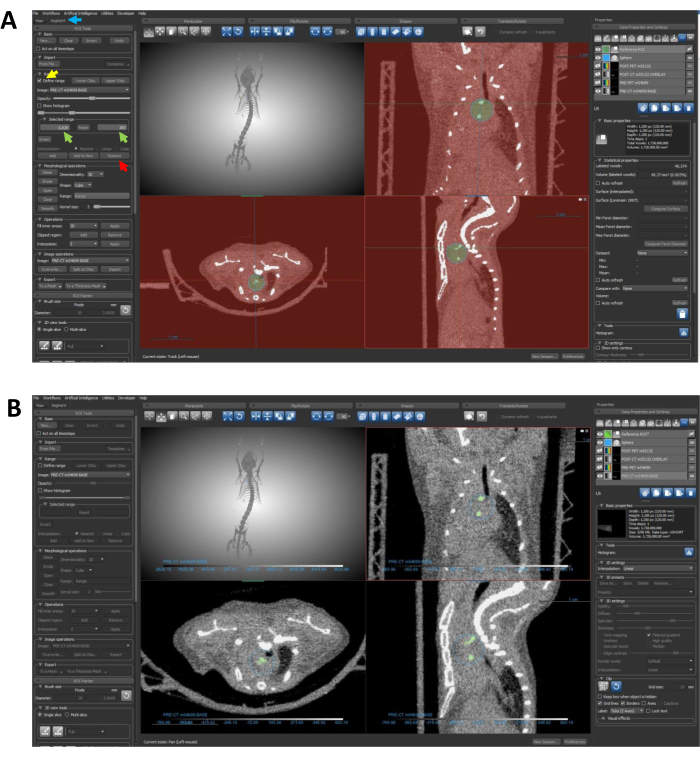
그림 6: 세그멘테이션을 사용하여 ROI를 석회화된 영역으로 제한. (A) 화살표는 ROI에서 원치 않는 밀도 데이터를 제거하는 데 필요한 단계를 안내합니다. 파란색 화살표는 세그먼트 탭을 가리킵니다. 노란색 화살표는 Define Range 기능을 강조 표시합니다. 녹색 화살표는 선택한 범위 입력을 나타냅니다. 빨간색 화살표는 제거 버튼을 가리킵니다. (B) 프로토콜 단계 7.4-7.4.3을 완료한 후 ROI는 이 패널에 표시된 대로 석회화된 영역을 구체적으로 설명해야 합니다. 약어: ROI = 관심 영역. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 각 이미지에 대한 ROI 정량화
- Data Properties and Settings 드롭다운에서 정량화할 ROI를 선택합니다.
- Basic Properties(기본 속성) 드롭다운 아래의 오른쪽에서 Statistical properties(통계적 속성) 드롭다운을 찾습니다(그림 7).
- Statistical Properties(통계 속성)에서 Dataset(데이터셋) 테이블을 찾습니다. 오른쪽의 드롭다운 메뉴를 사용하여 정량화할 ROI와 상관 관계가 있는 적절한 이미징 데이터 세트를 선택합니다(그림 7).
- ROI 내에서 CT 데이터를 정량화할 때 ROI와 상관 관계가 있는 CT 이미지 이름을 선택합니다.
- ROI 내에서 PET 데이터를 정량화할 때 ROI에 해당하는 PET 이미지 이름을 선택합니다.
- 새로 고침(Refresh)을 클릭하여 선택한 석회화 영역의 정량화된 값을 얻습니다. 데이터 세트 테이블에 따라 Min, Max 및 Mean 값을 기록해 둡니다. 정량화를 위해 평균 값을 사용합니다(그림 7).
- Statistical Properties(통계 속성) 상자의 맨 위에서 부피 계산을 찾습니다. 이 볼륨을 사용하여 정량화하십시오(그림 7).
- CT 데이터 세트의 경우 값은 HU로 보고됩니다. 평균 ROI 값(HU)과 ROI 부피 (mm3)의 곱을 사용하여 부피 칼슘 함량(vHU)을 계산합니다12.
- PET 데이터 세트의 경우 값은 decays/second에 해당하는 Becquerels(Bq)로 보고됩니다. 추적자 흡수 집중을 위해 평균 ROI 값(Bq)을 ROI의 부피(mm3)로 나누어 Bq/mm3 로 변환합니다.

그림 7: ROI 정량화. 선택한 ROI에 대한 통계적 속성 탭입니다. 빨간색 화살표는 ROI를 기반으로 데이터 세트에 대한 통계 정보를 얻는 데 필요한 단계를 나타냅니다. 빨간색 상자는 부피와 평균 Hounsfield 단위 값을 식별하며, 이는 추가 분석 계산에 필수적입니다. 약어: ROI = 관심 영역. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
분석 방법
이 섹션에서는 대표 결과를 통한 성공적인 활용을 보여줍니다. 여기에서는 생후 12개월에서 14개월 사이에 서양식 식단(지방 21%, 콜레스테롤 0.2%)을 섭취한 후 생후 15개월과 18개월에 스캔한 단일 마우스의 microPET/microCT 결합 이미지를 보여줍니다. 석회화 정량화를 위한 프로토콜 섹션 2-8에 따라 4명의 독립적인 연구원이 15개월 및 18개월 시점에서 ?...
토론
이 새로운 프로토콜은 심혈관 석회화의 정량화에 대한 개선된 접근 방식입니다. 이미징의 비침습적 특성으로 인해 작은 동물에서 심혈관 석회화의 진행을 추적하기 위해 종방향 microCT 이미지를 획득할 수 있습니다. microCT 이미지만으로도 칼슘 함량의 진행 상황을 보여줄 수 있지만, 사용 가능한 경우 microPET 이미지는 추가적인 수준의 정보를 제공할 수 있으며, 특히 표면?...
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
데이터 수집 및 처리, 장비 및 인프라 유지 관리에 도움을 주신 UCLA Crump Preclinical Imaging Technology Center의 모든 구성원에게 감사드립니다. 사이클로트론 작동 및 18F-NaF 합성에 도움을 주신 Jeffrey Collins에게 감사드립니다. 통계 분석에 도움을 주신 UCLA Statistical Consulting Group에 감사드립니다. 이 연구는 NIH 암 센터 지원 보조금(2 P30 CA016042-44 MT) 및 미국 국립보건원, 심장, 폐, 혈액 연구소(HL137647 및 HL151391 YT 및 LLD)의 지원을 받습니다. GNEXT PET/CT 스캐너는 NIH S10 Shared Instrumentation for Animal Research Grant(1S10OD026917-01A1에서 Arion Chatziioannou)의 자금 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.5 cc Sterile Insulin Syringes | Exel International | #26028 | Used for IV injection of 18F-NaF PET Tracer |
| 18F-NaF PET Tracer | CNSI Cyclotron | ||
| Biorender | Biorender | Used for figure 1 | |
| Female Apoe-/- mouse | Jackson Laboratories | #002052 | B6.129P2-Apoetm1Unc/J |
| GNEXT PET/CT | Sofie Biosciences, Dulles, Virginia | ||
| Isoflurane | Piramal Critical Care | Used as anesthesia for mouse imaging | |
| ORS Dragonfly | Comet Technologies Canada Inc. | ||
| SPSS Statistics | IBM | ||
| Western diet for mice | Envigo | #TD88139 | 21% fat, 0.2% cholesterol |
참고문헌
- Rennenberg, R. J. M. W., et al. Vascular calcifications as a marker of increased cardiovascular risk: A meta-analysis. Vasc Health Risk Man. 5, 185-197 (2009).
- Budoff, M. J., et al. Long-term prognosis associated with coronary calcification - observations from a registry of 25,253 patients. J Am Coll Cardiol. 49 (18), 1860-1870 (2007).
- Polonsky, T. S., et al. Coronary artery calcium score and risk classification for coronary heart disease prediction. JAMA. 303 (16), 1610-1616 (2010).
- Gepner, A. D., et al. Comparison of coronary artery calcium presence, carotid plaque presence, and carotid intima-media thickness for cardiovascular disease prediction in the multi-ethnic study of atherosclerosis. Circ Cardiovasc Imaging. 8 (1), e002262 (2015).
- Pillai, I. C. L., et al. Cardiac fibroblasts adopt osteogenic fates and can be targeted to attenuate pathological heart calcification. Cell Stem Cell. 20 (2), 218-232.e5 (2017).
- Mori, H., et al. Coronary artery calcification and its progression: What does it really mean. JACC Cardiovasc Imaging. 11 (1), 127-142 (2018).
- Mohan, J., Bhatti, K., Tawney, A., Zeltser, R. . StatPearls [Internet]. , (2023).
- Wang, Y., Osborne, M. T., Tung, B., Li, M., Li, Y. Imaging cardiovascular calcification. J Am Heart Assoc. 7 (13), e008564 (2018).
- Fletcher, A. J., et al. Quantifying microcalcification activity in the thoracic aorta. J Nucl Cardiol. 29 (3), 1372-1385 (2022).
- Derlin, T., et al. Feasibility of 18F-sodium fluoride PET/CT for imaging of atherosclerotic plaque. J Nucl Med. 51 (6), 862-865 (2010).
- Hsu, J. J., et al. Changes in microarchitecture of atherosclerotic calcification assessed by 18F-NaF PET and CT after a progressive exercise regimen in hyperlipidemic mice. J Nucl Cardiol. 28 (5), 2207-2214 (2021).
- Hsu, J. J., et al. Effects of teriparatide on morphology of aortic calcification in aged hyperlipidemic mice. Am J Physiol Heart Circ Physiol. 314 (6), H1203-H1213 (2018).
- Irkle, A., et al. Identifying active vascular microcalcification by 18F-sodium fluoride positron emission tomography. Nat Commun. 6, 7495 (2015).
- Syed, M. B. J., Doris, M., Dweck, M., Forsythe, R., Newby, D. E. Chapter 9 - Imaging vascular calcification: Where are we headed. Coronary Calcium: A Comprehensive Understanding of Its Biology, Use in Screening, and Interventional Management. , (2019).
- Joshi, N. V., et al. 18F-fluoride positron emission tomography for identification of ruptured and high-risk coronary atherosclerotic plaques: A prospective clinical trial. Lancet. 383 (9918), 705-713 (2014).
- Fiz, F., et al. 18F-NaF uptake by atherosclerotic plaque on PET/CT imaging: Inverse correlation between calcification density and mineral metabolic activity. J Nucl Med. 56 (7), 1019-1023 (2015).
- Kruithof, B. P., et al. An in vivo map of bone morphogenetic protein 2 post-transcriptional repression in the heart. Genesis. 49 (11), 841-850 (2011).
- Sheen, C. R., et al. Pathophysiological role of vascular smooth muscle alkaline phosphatase in medial artery calcification. J Bone Miner Res. 30 (5), 824-836 (2015).
- Tsai, M. T., Chen, Y. Y., Chang, W. J., Li, S. Y. Warfarin accelerated vascular calcification and worsened cardiac dysfunction in remnant kidney mice. J Chin Med Assoc. 81 (4), 324-330 (2018).
- Wait, J. M., et al. Detection of aortic arch calcification in apolipoprotein e-null mice using carbon nanotube-based micro-ct system. J Am Heart Assoc. 2 (1), e003358 (2013).
- White, D. J., et al. 19F MAS-NMR and solution chemical characterization of the reactions of fluoride with hydroxyapatite and powdered enamel. Acta Odontol Scand. 46 (6), 375-389 (1988).
- Czernin, J., Satyamurthy, N., Schiepers, C. Molecular mechanisms of bone 18F-NaF deposition. J Nucl Med. 51 (12), 1826-1829 (2010).
- Chen, N. X., O'neill, K. D., Dominguez, J. M., Moe, S. M. Regulation of reactive oxygen species in the pathogenesis of matrix vesicles induced calcification of recipient vascular smooth muscle cells. Vasc Med. 26 (6), 585-594 (2021).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262 (2018).
- Chen-Mayer, H. H., et al. Standardizing ct lung density measure across scanner manufacturers. Med Phys. 44 (3), 974-985 (2017).
- Coxson, H. O. Sources of variation in quantitative computed tomography of the lung. J Thorac Imaging. 28 (5), 272-279 (2013).
- Rogasch, J. M. M., et al. Influences on pet quantification and interpretation. Diagnostics (Basel). 12 (2), 451 (2022).
- Liljequist, D., Elfving, B., Skavberg Roaldsen, K. Intraclass correlation - a discussion and demonstration of basic features. PLoS One. 14 (7), e0219854 (2019).
- Koo, T. K., Li, M. Y. A guideline of selecting and reporting intraclass correlation coefficients for reliability research. J Chiropr Med. 15 (2), 155-163 (2016).
- Moss, A. J., et al. Molecular coronary plaque imaging using (18)f-fluoride. Circ Cardiovasc Imaging. 12 (18), e008574 (2019).
- Moss, A., et al. Coronary atherosclerotic plaque activity and future coronary events. JAMA Cardiol. 8 (8), 755-764 (2023).
- Badea, C., Hedlund, L. W., Johnson, G. A. Micro-ct with respiratory and cardiac gating. Med Phys. 31 (12), 3324-3329 (2004).
- Yang, Y., Rendig, S., Siegel, S., Newport, D. F., Cherry, S. R. Cardiac pet imaging in mice with simultaneous cardiac and respiratory gating. Phys Med Biol. 50 (13), 2979-2989 (2005).
- Liao, W., Deserno, T. M., Spitzer, K. Evaluation of free non-diagnostic dicom software tools. Proc Spie. 6919, (2008).
- Haak, D., Page, C. E., Deserno, T. M. A survey of dicom viewer software to integrate clinical research and medical imaging. J Digit Imaging. 29 (2), 206-215 (2016).
- Aiello, M., et al. How does dicom support big data management? Investigating its use in medical imaging community. Insights Imaging. 12 (1), 164 (2021).
- Kristanto, W., Van Ooijen, P. M., Groen, J. M., Vliegenthart, R., Oudkerk, M. Small calcified coronary atherosclerotic plaque simulation model: Minimal size and attenuation detectable by 64-MDCT and microCT. Int J Cardiovasc Imaging. 28 (4), 843-853 (2012).
- Dehmeshki, J., et al. Volumetric quantification of atherosclerotic plaque in ct considering partial volume effect. IEEE Trans Med Imaging. 26 (3), 273-282 (2007).
- Demer, L. L., Tintut, Y., Nguyen, K. L., Hsiai, T., Lee, J. T. Rigor and reproducibility in analysis of vascular calcification. Circ Res. 120 (8), 1240-1242 (2017).
- Alluri, K., et al. Scoring of coronary artery calcium scans: History, assumptions, current limitations, and future directions. Atherosclerosis. 239 (1), 109-117 (2015).
- Zhang, L., et al. Advances in CT techniques in vascular calcification. Front Cardiovasc Med. 8, 716822 (2021).
- Achenbach, S., Raggi, P. Imaging of coronary atherosclerosis by computed tomography. Eur Heart J. 31 (12), 1442-1448 (2010).
- Agatston, A. S., et al. Quantification of coronary artery calcium using ultrafast computed tomography. J Am Coll Cardiol. 15 (4), 827-832 (1990).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유