Method Article
נומוגרמה בסיכון מתחרה לחיזוי הישרדות ספציפית לסרטן במספר חולי סרטן המעי הגס לאחר ניתוח
In This Article
Summary
המחקר מצא כי מין זכר, דרגת גידול ירודה ושלב גרורות מתקדם בבלוטת הגידול היו קשורים להישרדות נמוכה יותר של סרטן ספציפי לסרטן (CSS) בחולי סרטן המעי הגס הראשוני (MPCC) לאחר הניתוח. פיתחנו נומוגרמה כדי לחזות את ה-CSS של חולי MPCC ולתרום לקבלת החלטות בטיפול קליני.
Abstract
הישרדות ספציפית לסרטן (CSS) בחולי סרטן המעי הגס הראשוני (MPCC) מושפעת באופן תחרותי ממוות מסיבות אחרות. מחקר זה נועד לחקור CSS וגורמי סיכון קשורים על ידי ניתוח סיכונים מתחרים בחולי MPCC. הנתונים של מחקר זה הם ממסד הנתונים של SEER. באמצעות ניתוח חד-משתנה ורב-משתני של מודל הסיכון התחרותי כדי להחליש את ההשפעה של אירועים תחרותיים, הוא בוחן את גורמי הסיכון של CSS ומפתח מודל נומוגרמה. לאחר מכן, ביצועי המודל מאומתים על ידי עקומת ROC, עקומת כיול ו-DCA. המחקר מקיף בסך הכל 8931 חולים, עם 6255 בקבוצת האימון ו-2676 בקבוצת האימות. ניתוחים חד-משתנים ורב-משתנים הראו כי מין, שלב גרורות בלוטת הגידול (TNM) ודרגת הגידול הם גורמי סיכון בלתי תלויים להישרדות ספציפית לסרטן בחולי MPCC. בהתבסס על גורמי הסיכון, פיתחנו מודל דיאגרמה לחיזוי CSS. עקומת ROC, עקומת כיול ו-DCA מראים גם תוצאות טובות. לסיכום, פותחה נומוגרמה המשמשת ככלי רב ערך לחיזוי CSS בחולי MPCC, ומספקת לקלינאים תובנות חיוניות לתכנון טיפול מותאם אישית.
Introduction
סרטן המעי הגס, כאחד הגידולים הנפוצים ביותר במערכת העיכול בעולם, ראה עלייה מתמשכת בשכיחותו בעשורים האחרונים. שיעורי ההיארעות והתמותה הגבוהים בהתמדה משכו תשומת לב משמעותית. על פי הסטטיסטיקה העדכנית ביותר, סרטן המעי הגס מדורג במקום השלישי מבין הגידולים הממאירים הנפוצים ברחבי העולם, כאשר שיעור התמותה שלו מדורג במקום השני בעולם1. סרטן המעי הגס הראשוני הנפוץ (MPCC) הוא תת-סוג מיוחד של סרטן המעי הגס שזכה לתשומת לב הולכת וגוברת מצד חוקרים בשנים האחרונות. זה מוגדר כאבחנה של שני נגעים או יותר עצמאיים של סרטן המעי הגס באותו מטופל, עם מרחק של יותר מ -5 ס"מ בין שולי הנגעים. ב-MPCC, כאשר מספר גידולים מאובחנים בו זמנית או תוך פחות מ-6 חודשים, הוא מוגדר כסרטן המעי הגס הסינכרוני (SCRC), בעוד שאם המרווח בין האבחונים גדול מ-6 חודשים, הוא מוגדר כסרטן המעי הגס (MCRC)2,3,4,5.
שיעור MPCC בכל סרטן המעי הגס נמוך יחסית, והדיווחים על שכיחותו משתנים בין אזורים ומחקרים שונים. מחקרים אחרונים דיווחו כי MPCC מהווה בין 2%-10% מסרטן המעי הגס 2,3,4,5. בהשוואה לסרטן המעי הגס הבודד, ל-MPCC יש פרוגנוזה גרועה יותר 3,6. נכון לעכשיו, הערכה קלינית של פרוגנוזה של MPCC מסתמכת בעיקר על מערכת השלב של גרורות בלוטות הלימפה של הגידול (TNM) של הוועדה האמריקאית המשותפת לסרטן, המשתמשת בשלב המתקדם ביותר של נגעים מרובים כשלב האמיתי של MPCC. עם זאת, ביסוס תחזיות פרוגנוזה אך ורק על שלב TNM אינו מספיק. עדיין חסר כלי יעיל לחיזוי הפרוגנוזה של MPCC לאחר הניתוח. בעידן הנוכחי של רפואה מדויקת, מודלים לחיזוי קליני לכימות סיכון נמצאים בשימוש נרחב בקבלת החלטות קליניות והערכת פרוגנוזה של מטופלים 7,8. בשנים האחרונות, נומוגרמות המבוססות על גורמי סיכון פרוגנוסטיים עצמאיים מקובלות באופן נרחב לחיזוי פרוגנוזה של גידול9. נומוגרמות יכולות לדמיין מודלים סטטיסטיים מורכבים, מה שמקל על יישומם במסגרות קליניות. בהערכת פרוגנוזה של גידול, הישרדות כוללת (OS) והישרדות ספציפית לסרטן (CSS) הם מדדי תוצאה נפוצים9. OS מתייחס לזמן מאישור סרטן בחולה ועד מוות מכל סיבה שהיא. CSS מתייחס לזמן מאבחון הגידול ועד למוות שנגרם ספציפית על ידי הסרטן, ומציע שיקוף מדויק יותר של הסיכון למוות עקב הסרטן. כאשר CSS משמש כאינדיקטור לתוצאה, מקרי מוות הנגרמים על ידי גורמים אחרים יכולים להשפיע על ההסתברות לתמותה ספציפית לסרטן, ולהציג יחסי סיכון מתחרים בין שני האירועים10,11. לכן, מחקרים על הישרדות ספציפית לגידול צריכים להשתמש במודלים מתחרים של סיכון כדי לבטל את ההשפעה של אירועים מתחרים. מחקרים קודמים בנו מודלים לחיזוי הפרוגנוזה של MPCC, אך אלה הוגבלו לסרטן המעי הגס הסינכרוני ולא השתמשו במודלים מתחרים של סיכון כדי להסביר את ההשפעה של אירועים מתחרים על CSS 12,13,14.
במחקר זה, חקרנו את גורמי הסיכון העצמאיים המתחרים המשפיעים על ההישרדות הספציפית לסרטן עבור MPCC לאחר ניתוח. הרציונל לשימוש במודל סיכונים מתחרים נובע מיכולתו להסביר את האפשרות שחולים עלולים למות מסיבות אחרות מלבד סרטן, שהיא קריטית להשגת הערכות הישרדות בלתי מוטות15,16. טכניקות ניתוח הישרדות מסורתיות, כגון מודל קוקס, עשויות להעריך יתר על המידה את הסתברויות ההישרדות בנוכחות אירועים מתחרים, מה שהופך את השימוש במודלים מתחרים למתאים יותר בתרחישים אלה17.
בהתבסס על גורמי הסיכון הבלתי תלויים שזוהו, בנינו נומוגרמה כדי לחזות את הסתברות ההישרדות ואימתנו את ביצועיה. נומוגרמות צברו פופולריות במסגרות קליניות מכיוון שהן מספקות ייצוג גרפי ידידותי למשתמש של מודלים סטטיסטיים מורכבים, ומאפשרים לקלינאים לחשב בקלות ציוני סיכון אינדיבידואליים18,19. בניגוד לכלי חיזוי אחרים, נומוגרמות משלבות גורמי סיכון מרובים ומספקות הערכות פרוגנוזה מדויקות ומותאמות אישית יותר. גישה זו אומתה יותר ויותר בסוגי סרטן שונים, והדגימה ביצועים טובים יותר על פני מערכות שלב מסורתיות 20,21,22. הכלי שלנו נועד לסייע לרופאים לבצע הערכות פרוגנוזה מותאמות אישית ומדויקות יותר במהלך האבחון והטיפול, ובכך לשפר את קבלת ההחלטות בניהול MPCC.
Protocol
מחקר זה כולל שני שלבים. ראשית, נתונים קליניים והישרדות של MPCC התקבלו ממסד הנתונים של SEER. לאחר מכן, נעשה שימוש בתוכנת R (גרסה 4.3.3) כדי לנתח ולבנות מודל סיכון מתחרה. דיאגרמת זרימת העבודה של המחקר מוצגת באיור 1. מחקר זה אינו דורש אישור אתי והסכמה להשתתף. הנתונים ששימשו במחקר זה התקבלו ממאגרי מידע.
1. רכישת נתונים
- הורד את ה-SEER. תוכנת סטאט 8.4.3 מאתר מסד הנתונים של SEER (http://seer.cancer.gov/about/overview.html). הירשם והיכנס ל-SEER. סטטיסטיקה 8.4.3 כדי לקבל נתוני מטופלים רלוונטיים.
- לאחר הכניסה ל-SEER. סטטיסטיקה 8.4.3, לחץ על נתוני מפגש רישום המקרים > ובחר את נתוני המחקר SEER השכיחות, 17 רישומים, נובמבר 2022 תת נתונים (2000-2020).
- לחץ על בחירה > עריכה ובחר {גזע, מין, שנת Dx. שנת אבחון} = '2004', '2005', '2006', '2007', '2008', '2009', '2010', '2011', '2012', '2013', '2014', '2015' ו-{אתר ומורפולוגיה. קידוד האתר ICD-O-3/WHO 2008} = 'המעי הגס והחלחולת' ו-{אתר ומורפולוגיה. אישור אבחון} = 'היסטולוגיה חיובית' ו- {שדות ראשוניים מרובים. מספר רצף}! = 'ראשי אחד בלבד'.
- לחץ על אישור ושמור את הבחירה. לחץ על טבלה, ובממשק המשתנים הזמינים, בחר קידוד מחדש של גיל עם גילאים בודדים ו-85+, מין, קידוד מחדש של אתר ICD-O-3/WHO 2008, גודל גידול CS, קידוד מחדש של דרגה (עד 2017), נגזר AJCC T, מהדורה שישית (2004-2015), נגזר AJCC N, מהדורה שישית (2004-2015), נגזר AJCC M, מהדורה שישית (2004-2015), קידוד מחדש של קרינה, קידוד מחדש של כימותרפיה (כן, לא/unk), סיווג מוות ספציפי לגורם SEER, SEER סיווג סיבת מוות אחרת, חודשי הישרדות, מזהה מטופל, RX Summ-Surg Prim Site (1998+) ולחץ על עמודה.
- לחץ על פלט, תן שם לנתונים ולחץ על ביצוע כדי להפיק ולשמור את הנתונים.
- מסד הנתונים של SEER אינו מספק מידע ישירות על האם למטופל יש MPCC. לאחר השלמת הורדת הנתונים כמתואר לעיל, השתמש במזהה המטופל כדי לסנן חולים עם MPCC, כלומר אלה שאובחנו עם שני מופעים או יותר. לאחר זיהוי חולי MPCC, חשב את המרווח בין אבחנות הגידול על סמך זמני ההישרדות שלהם. באמצעות 6 חודשים כחתך, סווג את המטופלים ל-SMPCC ו-MMPCC.
- בהתבסס על גילם בזמן האבחנה הראשונית, יש לסווג את גילאי המטופלים כ- = 65 שנים ו> 65 שנים. עבור דרגת גידול, דרגה I מתאימה להתמיינות טובה, דרגה II מתאימה להתמיינות בינונית, דרגה III מתאימה להתמיינות נמוכה ודרגה IV מתאימה לאי-התמיינות. סווג את מיקום הגידול על סמך התפלגות הגידולים המרובים כמו המעי הגס הימני, המעי הגס השמאלי והמעי הגס כולו.
- ישנם הבדלים ברורים בהתפתחות העוברית ובמאפיינים הביולוגיים בין המעי הגס הפרוקסימלי והדיסטלי, חלקו את מיקום הגידול על סמך כיפוף הטחול23. המעי הגס הימני מוגדר כפרוקסימלי לכיפוף הטחול, כולל הצקום, המעי הגס העולה, כיפוף הכבד והמעי הגס הרוחבי, ואילו המעי הגס השמאלי כולל את כיפוף הטחול, המעי הגס היורד, המעי הגס הסיגמואידי, צומת הרקטוסיגמואיד והחלחולת. אם הגידולים של המטופל ממוקמים לחלוטין במעי הגס הימני, הגדירו את מיקום הגידול כמעי הגס הימני; אם כל הגידולים ממוקמים במעי הגס השמאלי, הגדר את המיקום כמעי גס שמאלי; אם יש גידולים גם במעי הגס הימני וגם במעי הגס השמאלי, הגדירו את המיקום כמעי הגס כולו.
- קבע את גודל הגידול על ידי בחירת קוטר הגידול הגדול ביותר מבין מספר גידולים באותו מטופל. בהתבסס על קוטר הגידול, סווג את הגודל כ= 5 ס"מ או >5 ס"מ. בסך הכל נכללו במחקר 8,931 חולים. כדי ליצור קבוצת הדרכה וקבוצת אימות, חלקו באופן אקראי את כל המקרים ביחס של 7:3.
2. בניית מודל
- הורד את תוכנת RStudio (2023.12.1+402) ו-R (4.3.3). פתח את RStudio כדי להריץ תוכנת R. לחץ על קובץ חדש ובחר R Script כדי ליצור ממשק תכנות R חדש. הזן את הקוד הרלוונטי בעורך הקוד ולחץ על הפעל כדי לבצע את הקוד.
הערה: שפת R והפונקציות שלה מציעות מגוון רחב של פרמטרים. הוספה או שינוי של פרמטרים אלה יכולים לשפר את ניתוח הנתונים וההדמיה. - השתמש בקוד הבא כדי לבצע ניתוח חד-משתני ולשרטט את עקומת ה-CIF.
ספרייה (tidycmprsk)
ספרייה(gtSummary)
ספרייה (ggsurvfit)
ספרייה (ggprism)
נתונים <-read.csv('data.csv')"
data$status<-factor(data$status, levels=c(0,1,2),labels=c("0","CSS","OCS"))
CIF <- tidycmprsk::cuminc(Surv(time, status) ~ מין, נתונים = נתונים)
ggcuminc(CIF,תוצאה= c("CSS", "OCS"),size=1.5)
כאשר data.csv נתונים המתקבלים ממסד הנתונים של SEER. - לאחר הפעלת הקוד לעיל, לחץ על ייצוא, לאחר מכן לחץ על שמור כתמונה, ולבסוף לחץ על שמור כדי לשמור את התמונה. השיטה לשמירת התמונות הבאות תהיה זהה לשלב זה. החלף את המין בקוד לעיל בזה אחר זה בגורמים אחרים כדי לבצע ניתוח חד משתני עבור כל הגורמים.
- השתמש בקוד הבא כדי לבצע ניתוח ותצוגה חזותית של BSR ומשתנים מרובים.
ספרייה (קפיצות)
library(riskRegression)
ספרייה (prodlim)
ספרייה(חלקת יער)
leaps<-regsubsets(status==0~Sex+Size+Grade+T+N+M,data = data)
plot(leaps,scale="adjr2")
רב <- FGR(Hist(time,status)~Sex + T + N + M +Grade+ Size,cause=1,data=data)
סיכום (מרובה)
ריבוי <- read.csv("multi.csv", כותרת = T)
forestplot(labeltext=as.matrix(Multi [,1:4]), mean= Multi $HR_mean, ower= Multi $HR_1, upper= Multi $HR_2)
כאשר הנתונים ב-multi.csv מגיעים מהתוצאות של הקוד הקודם. - בצע את שלב 2.3. כדי לשמור את התמונה.
- השתמש בקוד הבא כדי להתוות את הנומוגרמה, עקומת ה-ROC, עקומת הכיול ועקומת DCA.
ספרייה (QHScrnomo)
ספרייה (RMS)
library(riskRegression)
ספרייה (prodlim)
נתונים <- read.csv("data.csv")
d <- datadist(data)
options(datadist = "d")
e <-cph(Surv(time,status==1)~Sex + T + N + M +Grade,data = data,
x=T, y=T, surv=T,time.inc=60)
nomo <- crr.fit(e,failcode=1,cencode = 0)
nomogram.crr(fit = nomo, lp = F, xfrac = 0.5, fun.at = seq(from=0, to=1, by= 0.1) , failtime =c(12,36,60),funlabel = c("שכיחות מצטברת של CSS לשנה אחת", "שכיחות מצטברת של CSS ל-3 שנים","שכיחות מצטברת של CSS ל-5 שנים"))
סט.זרע(123)
data$pro <- tenf.crr(m3,time = 60)
groupci(x=data$pro, ftime = data$time, fstatus = data$status, failcode = 1, cencode = 0, ci = TRUE)
f <- CSC(Hist(time,status)~Sex + T + N + M +Grade,data = data)
x <- Score(list(model1=f), Hist(time,status)~1, data=data=cause=1, times=c(12,36,60), se.fit=1L, plots="roc", metrics="auc")
g <- as.data.frame(x$AUC$score)
h <- g[g$times %in% c(12,36,60),]
col = c("darkcyan","tomato","purple")
plotROC(x, xlab="1-Specificity", ylab="רגישות",col=col[1], cex=1.5, legend="", auc.in.legend = F, times = 12)
plotROC(x,col=col[2],legend = '', cex=1.5,times =36,auc.in.legend = F,add=T)
plotROC(x,col=col[3], פעמים = 60, add=T, cex=1.5, legend = '',auc.in.legend = F)
leg <- paste0(c("1-Year: ","3-Year: ","5-Year: "),substr(a$AUC,1,5)) - בצע את שלב 2.3. כדי לשמור את התמונה.
- השתמש בחבילת ggscidca כדי להתוות את עקומת ה-DCA.
ספרייה (ggscidca)
df_surv<-read.csv("data.csv", כותרת = T)
cox_model <- coxph(Surv(time,status==1)~Sex + T + N+ M +Grade, data = df_surv)
cox_model1<-newcrr(cox_model)
scidca(cox_model1, newdata= df_surv,threshold.line = T,threshold.text = T)
כאשר data.csv נתונים המתקבלים ממסד הנתונים של SEER. - בצע את שלב 2.3. כדי לשמור את התמונה.
תוצאות
מאפייני המטופל
בסך הכל נכללו במחקר 8,931 חולים. מבחינת התפלגות המין, היה שיעור גבוה יותר של מטופלים גברים (56%) בהשוואה לנשים (44%). לגבי התפלגות מיקום הגידול, רוב הגידולים היו מפוזרים על פני המעי הגס הכולל, בעוד שהכי פחות גידולים היו ממוקמים במעי הגס הימני (21%). מבחינת דרגת הגידול, הדרגה השכיחה ביותר הייתה דרגה II, עם 6,251 חולים, המהווים 70% מכלל החולים; אחריה הגיעה דרגה III, עם 2,026 חולים (23%). בכיתות I ו-IV היו 355 ו-299 חולים, בהתאמה, המהווים 4% ו-3.3% מכלל המטופלים. מבחינת פלישת הגידול, שלבי T3 ו-T4 היו הנפוצים ביותר. יותר ממחצית מהחולים לא סבלו מגרורות בבלוטות הלימפה, בעוד ש-17% מהחולים חוו גרורות מרוחקות. טיפולי הקרנות קיבלו 1,446 חולים (16%), וכימותרפיה ניתנה ל-3,843 חולים (43%). SCRC היה נפוץ יותר, עם 5,327 חולים שהיוו 60% מהסך הכל; היו 3,604 חולים עם סרטן המעי הגס המטאכרוני, המהווים 40%. המטופלים חולקו באופן אקראי לערכות אימון ואימות ביחס של 7:3. לא היו הבדלים מובהקים סטטיסטית בנתוני הבסיס בין קבוצות האימון והאימות, כפי שמוצג בטבלה 1.
ניתוח חד משתנה
לאחר שליטה בהשפעת אירועים תחרותיים, תוצאות הניתוח החד-משתני הראו מין, דרגת הגידול וגודלו, שלב TNM, הקרנות, כימותרפיה, מצב סינכרוני או מטכרוני ומיקום הגידול היו הגורמים הפרוגנוסטיים המשפיעים על CSS בחולי MPCC. רק גיל אינו גורם פרוגנוסטי ל-CSS בחולי MPCC. נציין כי יש הצטלבות משמעותית של CIF בקרינה, כימותרפיה, מיקום ומצב סינכרוני או מטכרוני, מה שמצביע על כך שההשפעות הפרוגנוסטיות לטווח הקצר והארוך של קרינה על חולי MPCC היו שונות, וכך גם כימותרפיה, מיקום ומצב סינכרוני או מטכרוני. עקומת הסיכון המצטברת של כל תת-קבוצה מוצגת באיור 2.
ניתוח רב משתנים
הגורמים הפרוגנוסטיים שהתקבלו על ידי ניתוח חד-משתנה שולבו ברגרסיה הטובה ביותר של תת-קבוצות (BSR) ובניתוח רב-משתני של מודל הסיכון התחרותי. ביניהם, הקרנות, כימותרפיה, מיקום ומצב סינכרוני או מטכרוני אינם נכללים בגלל השפעותיהם הכפולות על הפרוגנוזה. תוצאות ה-BSR והניתוח הרב-משתני הראו שניהם כי מין, שלב TNM ודרגת הגידול היו גורמי סיכון בלתי תלויים ל-CSS בחולי MPCC. (איור 2)
בנייה ואימות של נומוגרמה
בהתבסס על גורמי הסיכון הבלתי תלויים המתקבלים על ידי ניתוח רב-משתנים, אנו בונים נומוגרמה קו כדי לחזות CSS ולאמת את הביצועים של מודל החיזוי (איור 3). לאחר מכן, אנו משתמשים בעקומת ROC, עקומת כיול ו-DCA כדי להעריך את המודל. עקומת ה-ROC הראתה כי ה-AUCs של עוקבת ההכשרה לשנה, 3 שנים ו-5 שנים היו 0.762, 0.742 ו-0.734, וה-AUCs של שנה, 3 שנים ו-5 שנים של קבוצת האימות היו 0.801, 0.740 ו-0.743. בקבוצת ההכשרה ובקבוצת האימות, עקומת הכיול הראתה הסכמה גבוהה בין ההסתברות החזויה לנתונים בפועל (איור 4). על מנת לאמת את ביצועי המודל ביישום קליני, השתמשנו ב-DCA כדי להעריך את הערך הקליני של המודל. התוצאות מראות שהמודל מראה תועלת נטו טובה (איור 5).
איור 1: דיאגרמת זרימת עבודה של המחקר. מחקר זה מורכב משני שלבים: ראשית, הנתונים התקבלו באמצעות SEER. סטטיסטיקה, ולאחר מכן ניתוח נתונים והדמיה בוצעו באמצעות R. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
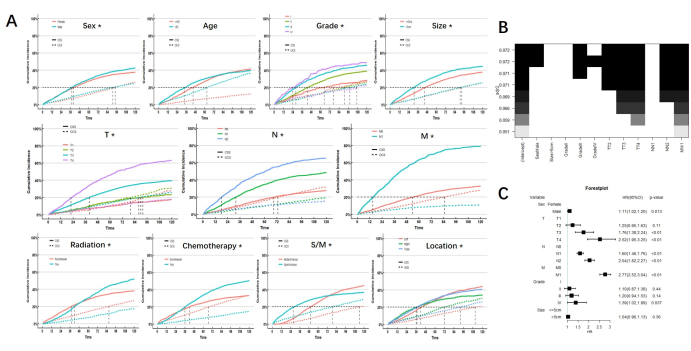
איור 2: תוצאות ניתוח. (A) CIF של תת-קבוצות. * מציין p <0.05. (ב) הרגרסיה הטובה ביותר של תת-קבוצות. תחת הטוב ביותר של התאמה, מין, דרגה ושלב TNM נשקלו להכללה (מוצגים כקוביות שחורות בחלק העליון). (C) ניתוח רב-משתני הראה גם שמין, דרגה ושלב TNM הם גורמי סיכון בלתי תלויים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
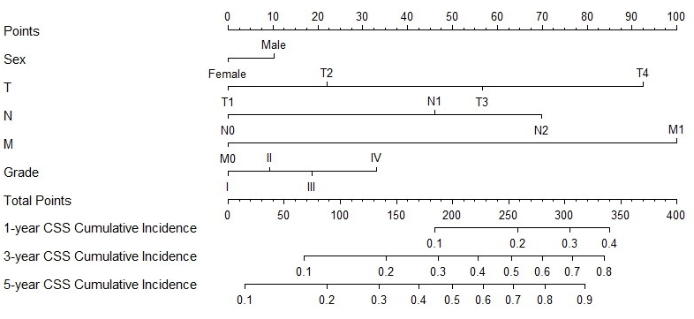
איור 3: נומוגרמה עבור CSS בחולי MPCC. ניתן לחשב את הציון הכולל של המטופל על ידי הוספת הציונים המתאימים לכל גורם. בהתבסס על הציון הכולל, ניתן לחזות את ההסתברות למוות ספציפי לסרטן ב-1, 3 ו-5 שנים אנא לחץ כאן לצפייה בגרסה גדולה יותר של נתון זה.
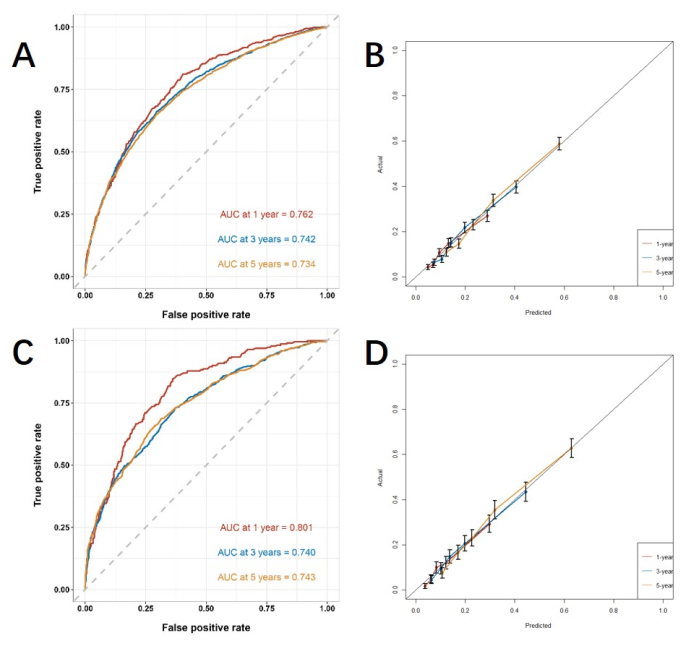
איור 4: עקומת ROC ועקומת כיול. (A, B) העקומות בקבוצת האימון (n=6255) ו-(C, D) עוקבת אימות (n=2676). ככל שערך ה-AUC קרוב יותר ל-1, כך ביצועי הסיווג של המודל טובים יותר. קווי השגיאה מציגים את רווח בר-סמך של 95% עבור ההסתברות להתרחשות האירוע בפועל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
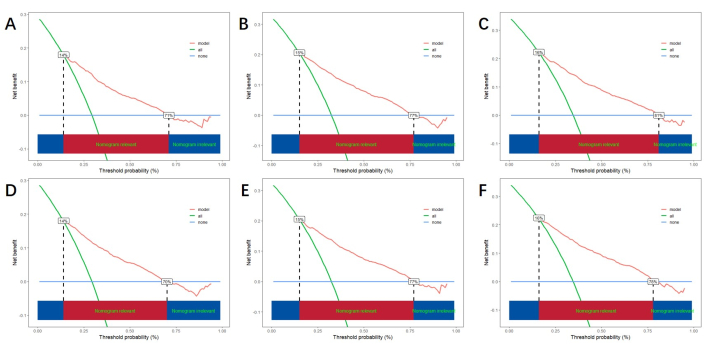
איור 5: DCA עבור שנה, 3 שנים ו-5 שנים. (A, B, C) DCA בקבוצת הכשרה וקבוצת אימות (D, E, F). הקו הירוק מייצג את התועלת נטו של כל החיוביים, הקו הכחול מייצג את התועלת נטו של אף חיובי, והקו האדום מציין את התועלת נטו של המודל. האזור האדום שלהלן מייצג את התועלת של המודל העולה על זו של כל החיוביים וללא חיוביים, מה שמציין את טווח התועלת בפועל של המודל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
טבלה 1: מאפיינים קליניים-פתולוגיים ובסיסיים של חולים. אנא לחץ כאן להורדת טבלה זו.
Discussion
כגידול נפוץ במערכת העיכול, גורמים המשפיעים על הפרוגנוזה של סרטן המעי הגס הבודד נחקרו ואושרו במחקרים קודמים24. עם זאת, היה מחקר מוגבל על גורמים פרוגנוסטיים עבור חולי MPCC. מחקר זה כלל 8,931 חולי MPCC שעברו ניתוח ממסד הנתונים של SEER בין השנים 2004 ל-2015. השתמשנו במודל סיכון מתחרה כדי לחקור את גורמי הסיכון המשפיעים על CSS ובנינו מודל חיזוי. במחקר זה, 39.1% מהחולים שנפטרו מתו מסיבות אחרות מלבד סרטן, תוך הדגשת הצורך בשימוש במודל סיכון מתחרה לניתוח גורמי סיכון ל-CSS.
מחקר קודם מצא כי גיל מתקדם הוא גורם סיכון המשפיע על מערכת ההפעלה של חולי MPCC12. אולם במחקר הזה מצאנו שגיל לא היה גורם סיכון ל-CSS. חולים קשישים מציגים לעתים קרובות מצבים בריאותיים בסיסיים גרועים יותר ויותר מחלות נלוות, מה שעלול להוביל למערכת הפעלה קצרה יותר בהשוואה לחולים צעירים יותר. קשישים גם נוטים יותר למות מסיבות אחרות, כגון אירועים קרדיווסקולריים וזיהומים קשים, מה שהופך אותם לרגישים יותר לגורמים אלה מאשר חולים צעירים יותר. במחקר זה התמקדנו בקשר המתחרה בין מקרי מוות מסיבות אחרות לבין מקרי מוות כתוצאה מהסרטן עצמו. על ידי שימוש במודל סיכון מתחרה ושלילת התערבות של מקרי מוות שנגרמו מסיבות אחרות, מצאנו כי בתנאים אלה, גיל מתקדם כבר לא היה גורם סיכון ל-CSS של MPCC. זה מצביע על כך שחולי MPCC בקבוצות גיל שונות עשויים להתמודד עם עומסי גידול דומים. בסך הכל, לחולים צעירים וקשישים עם מחלה זו יש CSS דומה, המספק הדרכה חשובה לפיתוח אסטרטגיות טיפול מותאמות אישית.
מחקר זה מצא גם כי השכיחות והפרוגנוזה של MPCC מציגות נטיות הקשורות למגדר, עם שיעור גבוה יותר ו-CSS גרוע יותר של מטופלים גברים. זה עולה בקנה אחד עם המצב שנצפה בסרטן המעי הגס הבודד. מחקרים קודמים הראו כי סרטן המעי הגס הבודד שכיח יותר בקרב גברים, ולחולים גברים יש פרוגנוזה גרועה יותר מאשר חולות נשים. ייתכן שהסיבה לכך היא השפעת האסטרוגן על התרחשות והתקדמות סרטן המעי הגס25. בנוסף, מחקרים אחרים הציעו כי מיקרוביוטת המעיים ומטבוליטים של המעיים בחולים גברים עשויים להיות אחת הסיבות להבדלים המגדריים שנצפו בחולי סרטן המעי הגס26. מחקר בגרמניה מצא כי לסוכרת מסוג 2 יש השפעה גדולה יותר על סרטן המעי הגס אצל נשים27. יתרה מכך, לוויטמין D יש השפעה מגנה מפני ניאופלזיה של המעי הגס אצל נשים, אך לא נמצאו ממצאים דומים אצל גברים28.
ניתוח חד-משתני מתחרה מצא כי חולי MPCC עם גדלי גידול גדולים יותר היו בעלי CSS גרוע יותר. במחקרים קודמים, גודל הגידול נחשב לעתים קרובות כאינדיקטור לאגרסיביות הגידול 29,30,31. עם זאת, התוצאות מניתוחים רב-משתנים מתחרים לא תמכו בגודל הגידול כגורם סיכון עצמאי. זה מצביע על כך שבאיברים חלולים כמו המעי הגס, לגודל הגידול עשויה להיות יכולת מוגבלת לשקף את אגרסיביות הגידול. תופעה זו עשויה לנבוע מגורמים שונים, כולל המורכבות של הביולוגיה של הגידול והדפוסים השונים של גדילת הגידול והתפשטותו על פני איברים שונים.
דרגת גידול גרועה מצביעה על יכולות פולשניות ונדידה חזקות יותר של תאי הגידול, מה שעולה בקנה אחד עם מסקנות מחקר זה: דרגת גידול גרועה יותר מצביעה על CSS גרוע יותר עבור חולי MPCC. שלב TNM הוא השיטה הקלינית הנפוצה ביותר להנחיית טיפול בחולים ולניבוי פרוגנוזה32,33. מחקר זה מצא שככל שחדירת הגידול עמוקה יותר, ככל שמספר בלוטות הלימפה הגרורתיות גדול יותר, ונוכחות של גרורות באיברים, כך ההישרדות הספציפית של המטופל לסרטן גרועה יותר. זה תואם לחלוטין את הקונצנזוס הקליני.
בסרטן המעי הגס, הפרוגנוזה משתנה בהתאם למיקום הגידול. מחקרים רבים מצאו כי למעי הגס הימני יש פרוגנוזה גרועה יותר בהשוואה למעי הגס השמאלי 34,35,36,37. עם זאת, מחקרים מסוימים מצביעים על כך שבסרטן המעי הגס הניתן לכריתה, הצד של מיקום הגידול אינו משפיע על הפרוגנוזה ארוכת הטווח38. במחקר זה, ל-MPCC הממוקם במעי הגס הימני היה CSS גרוע יותר בטווח הקצר אך פרוגנוזה טובה יותר לטווח הארוך. באופן דומה, לחולי MPCC שקיבלו הקרנות וכימותרפיה היה CSS טוב יותר לטווח קצר אך CSS גרוע יותר לטווח ארוך. ל-SCRC היה CSS גרוע יותר לטווח קצר בהשוואה ל-MCRC אך CSS טוב יותר לטווח ארוך. הסיבות להשפעות הכפולות הללו על הפרוגנוזה עדיין אינן ברורות.
למחקר זה יש כמה מגבלות. בשל האילוצים האינהרנטיים של מסד הנתונים של SEER, לא יכולנו להשיג או לנתח כמה אינדיקטורים פרוגנוסטיים ידועים, כגון רמות אנטיגן קרצינו-עוברי (CEA) ומצב מיקרו-לוויינים. יתר על כן, לא יכולנו לשלול חולים עם מחלת מעי דלקתית, סרטן מעי גס תורשתי שאינו פוליפוזיס ופוליפוזיס אדנומטי משפחתי שיש להם סיכון גבוה יותר ל-MPCC39. בנוסף, אימונותרפיה הפכה להיבט חשוב יותר ויותר בטיפול בסרטן המעי הגס, אך לא הצלחנו להשיג נתונים על כך. האופי הרטרוספקטיבי של הניתוח שלנו וההסתמכות על מערך נתונים יחיד עלולים להציג הטיות מובנות.
המחקר המבוסס על מסד הנתונים של SEER מצא כי מין זכר, דרגת גידול ירודה ושלב TNM מתקדם היו קשורים ל-CSS גרוע יותר בחולי MPCC לאחר הניתוח. חשוב לשים לב היטב לחולים עם גורמי סיכון אלו במהלך האבחון והטיפול. יתר על כן, מחקר זה פיתח נומוגרמה לחיזוי CSS של חולי MPCC, שיכולה לחזות במדויק את הפרוגנוזה ולתרום לקבלת החלטות טיפול קליני.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ללא.
Materials
| Name | Company | Catalog Number | Comments |
| forestplot package | Comprehensive R Archive Network (CRAN) | forest plot 3.1.3 | A forest plot that allows for multiple confidence intervals per row, custom fonts for each text element, custom confidence intervals, text mixed with expressions, and more. |
| ggprism package | Comprehensive R Archive Network (CRAN) | ggprism 1.0.5 | The ggprism package provides various themes, palettes, and other useful functions to customise ggplots and give them the ‘GraphPad Prism’ look. |
| ggscidca package | Comprehensive R Archive Network (CRAN) | ggscidca package | The 'ggscidca' package adds coloured bars of discriminant relevance to the traditional decision curve. Improved practicality and aesthetics. |
| ggsurvfit package | Comprehensive R Archive Network (CRAN) | ggsurvfit 1.1.0 | The ggsurvfit package eases the creation of time-to-event (aka survival) summary figures with ggplot2. The concise and modular code creates images that are ready for publication or sharing. |
| gtsummary package | Comprehensive R Archive Network (CRAN) | gtsummary 2.0.0 | The gtsummary package provides an elegant and flexible way to create publication-ready analytical and summary tables using the R programming language. The {gtsummary} package summarizes data sets, regression models, and more, using sensible defaults with highly customizable capabilities. |
| QHScrnomo package | Comprehensive R Archive Network (CRAN) | QHScrnomo 3.0.1 | The goal of QHScrnomo is to provide functionality to construct nomograms in the context of time-to-event (survival) analysis in the presence of competing risks. It also contains functions to build, validate, and summarize these models. |
| R Software | R Core Team | R 4.3.3 | Free software environment for statistical computing and graphics |
| riskRegression package | Comprehensive R Archive Network (CRAN) | riskRegression 1.3.7 | Risk Regression Models and Prediction Scores for Survival Analysis with Competing Risks |
| rms package | Comprehensive R Archive Network (CRAN) | rms 6.8-1 | rms does regression modeling, testing, estimation, validation, graphics, prediction, and typesetting by storing enhanced model design attributes in the fit. |
| RStudio | RStudio, Public Benefit Corporation(PBC) | Rstudio 2023.12.1+402 | Integrated Development Environment (IDE) used for running R scripts, data analysis, and model development. Provides a user-friendly interface for R programming with advanced features like script editing, debugging, and version control. |
| SEERstat | National Cancer Institute (NCI) | SEERstat 8.4.3 | Software for statistical analysis of SEER and other cancer-related databases |
| tidycmprsk package | Comprehensive R Archive Network (CRAN) | tidycmprsk 1.0.0 | The tidycmprsk package provides an intuitive interface for working with the competing risk endpoints |
References
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Derwinger, K., Gustavsson, B. A study of aspects on gender and prognosis in synchronous colorectal cancer. Clin Med Insights Oncol. 5, 259-264 (2011).
- Chin, C. C., Kuo, Y. H., Chiang, J. M. Synchronous colorectal carcinoma: predisposing factors and characteristics. Colorectal Dis. 21 (4), 432-440 (2019).
- Nikoloudis, N., et al. Synchronous colorectal cancer. Tech Coloproctol. 8 (Suppl 1), s177-s179 (2004).
- Huang, C. S., et al. Synchronous and metachronous colorectal cancers: Distinct disease entities or different disease courses. Hepatogastroenterology. 62 (140), 838-842 (2015).
- He, W., et al. Prognosis of synchronous colorectal carcinoma compared to solitary colorectal carcinoma: a matched pair analysis. Eur J Gastroenterol Hepatol. 31 (12), 1489-1495 (2019).
- Ranstam, J., Cook, J. A., Collins, G. S. Clinical prediction models. Br J Surg. 103 (13), 1886 (2016).
- Smith, T., et al. Comparison of prognostic models to predict the occurrence of colorectal cancer in asymptomatic individuals: a systematic literature review and external validation in the EPIC and UK Biobank prospective cohort studies. Gut. 68 (4), 672-683 (2019).
- Iasonos, A., Schrag, D., Raj, G. V., Panageas, K. S. How to build and interpret a nomogram for cancer prognosis. J Clin Oncol. 26 (8), 1364-1370 (2008).
- Conroy, T., et al. Five-year outcomes of FOLFIRINOX vs Gemcitabine as adjuvant therapy for pancreatic cancer: A randomized clinical trial. JAMA Oncol. 8 (11), 1571-1578 (2022).
- Zhong, M., et al. Impact of lung metastasis versus metastasis of bone, brain, or liver on overall survival and thyroid cancer-specific survival of thyroid cancer patients: A population-based study. Cancers. 14 (13), 3133 (2022).
- Xu, Y., Wang, X., Huang, Y., Ye, D., Chi, P. A LASSO-based survival prediction model for patients with synchronous colorectal carcinomas based on SEER. Transl Cancer Res. 11 (8), 2795-2809 (2022).
- Zhang, X., Zhao, L., Hu, Y., Deng, K., Ren, W. A novel risk prediction nomogram for early death in patients with resected synchronous multiple primary colorectal cancer based on the SEER database. Int J Colorectal Dis. 38 (1), 130 (2023).
- Zhang, X., et al. Developing prognostic nomograms to predict overall survival and cancer-specific survival in synchronous multiple primary colorectal cancer based on the SEER database. J Cancer Res Clin Oncol. 149 (15), 14057-14070 (2023).
- Austin, P. C., Lee, D. S., Fine, J. P. Introduction to the analysis of survival data in the presence of competing risks. Circulation. 133 (6), 601-609 (2016).
- Lau, B., Cole, S. R., Gange, S. J. Competing risk regression models for epidemiologic data. Am J Epidemiol. 170 (2), 244-256 (2009).
- Nolan, E. K., Chen, H. Y. A comparison of the Cox model to the Fine-Gray model for survival analyses of re-fracture rates. Arch Osteoporos. 15 (1), 86 (2020).
- Park, S. Y. Nomogram: An analogue tool to deliver digital knowledge. J Thorac Cardiovasc Surg. 155 (4), 1793 (2018).
- Balachandran, V. P., Gonen, M., Smith, J. J., DeMatteo, R. P. Nomograms in oncology: more than meets the eye. Lancet Oncol. 16 (4), e173-e180 (2015).
- Liang, W., et al. Development and validation of a nomogram for predicting survival in patients with resected non-small-cell lung cancer. J Clin Oncol. 33 (8), 861-869 (2015).
- Chen, D., et al. Predicting postoperative peritoneal metastasis in gastric cancer with serosal invasion using a collagen nomogram. Nat Commun. 12 (1), 179 (2021).
- Niu, X., et al. A prognostic nomogram for patients with newly diagnosed adult thalamic glioma in a surgical cohort. Neuro Oncol. 23 (2), 337-338 (2021).
- Luo, S., et al. Comparison of left- and right-sided colorectal cancer to explore prognostic signatures related to pyroptosis. Heliyon. 10 (7), e28091 (2024).
- Keum, N., Giovannucci, E. Global burden of colorectal cancer: emerging trends, risk factors and prevention strategies. Nat Rev Gastroenterol Hepatol. 16 (12), 713-732 (2019).
- Foster, P. A. Oestrogen and colorectal cancer: mechanisms and controversies. Int J Colorectal Dis. 28 (6), 737-749 (2013).
- Wang, L., et al. Male-biased gut microbiome and metabolites aggravate colorectal cancer development. Adv Sci. 10 (25), e2206238 (2023).
- Krämer, H. U., et al. Type 2 diabetes mellitus and gender-specific risk for colorectal neoplasia. Eur J Epidemiol. 27 (5), 341-347 (2012).
- Aigner, E., et al. Gender- and site-specific differences of colorectal neoplasia relate to vitamin D. Aliment Pharmacol Ther. 40 (11-12), 1341-1348 (2014).
- Dai, W., et al. Does tumor size have its prognostic role in colorectal cancer? Re-evaluating its value in colorectal adenocarcinoma with different macroscopic growth pattern. Int J Surg. 45, 105-112 (2017).
- Rössler, O., et al. Tumor size, tumor location, and antitumor inflammatory response are associated with lymph node size in colorectal cancer patients. Mod Pathol. 30 (6), 897-904 (2017).
- Zhang, Q., et al. Prognostic impact of tumor size on patients with metastatic colorectal cancer: a large SEER-based retrospective cohort study. Updates Surg. 75 (5), 1135-1147 (2023).
- Greene, F. L. TNM: our language of cancer. CA Cancer J Clin. 54 (3), 129-130 (2004).
- Ueno, H., et al. Optimal colorectal cancer staging criteria in TNM classification. J Clin Oncol. 30 (13), 1519-1526 (2012).
- Yahagi, M., Okabayashi, K., Hasegawa, H., Tsuruta, M., Kitagawa, Y. The worse prognosis of right-sided compared with left-sided colon cancers: a systematic review and meta-analysis. J Gastrointest Surg. 20 (3), 648-655 (2016).
- Holch, J. W., Ricard, I., Stintzing, S., Modest, D. P., Heinemann, V. The relevance of primary tumour location in patients with metastatic colorectal cancer: A meta-analysis of first-line clinical trials. Eur J Cancer. 70, 87-98 (2017).
- Petrelli, F., et al. Prognostic survival associated with left-sided vs right-sided colon cancer: A systematic review and meta-analysis. JAMA Oncol. 3 (2), 211-219 (2017).
- Zheng, C., Jiang, F., Lin, H., Li, S. Clinical characteristics and prognosis of different primary tumor location in colorectal cancer: a population-based cohort study. Clin Transl Oncol. 21 (11), 1524-1531 (2019).
- Karim, S., Brennan, K., Nanji, S., Berry, S. R., Booth, C. M. Association between prognosis and tumor laterality in early-stage colon cancer. JAMA Oncol. 3 (10), 1386-1392 (2017).
- Lindberg, L. J., et al. Risk of multiple colorectal cancer development depends on age and subgroup in individuals with hereditary predisposition. Fam Cancer. 18 (2), 183-191 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved