Method Article
Номограмма конкурирующего риска для прогнозирования специфической для рака выживаемости у пациентов с множественным первичным колоректальным раком после хирургического вмешательства
В этой статье
Резюме
Исследование показало, что мужской пол, плохая степень опухоли и прогрессирующая стадия метастазирования опухолевых узлов были связаны с более низкой выживаемостью при раке (CSS) у пациентов с множественным первичным колоректальным раком (MPCC) после операции. Мы разработали номограмму для прогнозирования CSS у пациентов с МПХК и содействия принятию решений о клиническом лечении.
Аннотация
На специфическую для рака выживаемость (ЦСС) у пациентов с множественным первичным колоректальным раком (ПДКК) конкурентно влияет смерть от других причин. Это исследование было направлено на изучение CSS и связанных с ним факторов риска путем конкурирующего анализа риска у пациентов с MPCC. Данные данного исследования взяты из базы данных SEER. Используя одномерный и многомерный анализ модели конкурентного риска для ослабления влияния конкурентных событий, исследуются факторы риска КСС и разрабатывается модель номограммы. Затем производительность модели проверяется с помощью кривой ROC, калибровочной кривой и DCA. В исследовании приняли участие 8931 пациент, из них 6255 в обучающей когорте и 2676 в валидационной когорте. Однофакторный и многофакторный анализы показали, что пол, стадия метастазирования в опухолевый узел (TNM) и степень опухоли являются независимыми факторами риска для специфической для рака выживаемости у пациентов с MPCC. На основе факторов риска мы разработали схематическую модель для прогнозирования CSS. Кривая ROC, калибровочная кривая и DCA также показывают хорошие результаты. В заключение разрабатывается номограмма, которая служит ценным инструментом для прогнозирования CSS у пациентов с MPCC, предоставляя клиницистам важнейшую информацию для персонализированного планирования лечения.
Введение
Колоректальный рак, как одна из наиболее распространенных опухолей пищеварительной системы во всем мире, в течение последних нескольких десятилетий постоянно растет. Устойчиво высокие показатели заболеваемости и смертности привлекли значительное внимание. Согласно последним статистическим данным, колоректальный рак занимает третье место среди распространенных злокачественных опухолей во всем мире, а его смертность занимает второе место в мире1. Множественный первичный колоректальный рак (МПКК) — это особый подтип колоректального рака, который в последние годы привлекает все большее внимание исследователей. Он определяется как диагноз двух или более независимых поражений колоректального рака у одного и того же пациента, с расстоянием более 5 см между краями поражений. При МПКК, когда множественные опухоли диагностируются одновременно или в течение менее 6 месяцев, это определяется как синхронный колоректальный рак (ПКРК), в то время как если интервал между диагнозами превышает 6 месяцев, он определяется как метахронный колоректальный рак (MCRC)2,3,4,5.
Доля ПДХК при всех колоректальных раках относительно низка, и отчеты о ее заболеваемости варьируются в зависимости от региона и исследования. Недавние исследования показали, что на долю MPCC приходится от 2% до 10% случаев колоректального рака. По сравнению с одиночным колоректальным раком, МПХК имеет худший прогноз 3,6. В настоящее время клиническая оценка прогноза МПХК в основном опирается на систему стадирования метастазов в опухолевые лимфатические узлы (TNM) Американского объединенного комитета по раку, которая использует наиболее запущенную стадию множественных поражений в качестве фактической стадии МПКК. Тем не менее, основывать прогнозы исключительно на стадии TNM недостаточно. До сих пор не существует эффективного инструмента для прогнозирования прогноза развития МПХК после операции. В современную эпоху прецизионной медицины модели клинического прогнозирования для количественной оценки риска широко используются при принятии клинических решений и оценке прогноза пациента 7,8. В последние годы номограммы, основанные на независимых прогностических факторах риска, получили широкое распространение для прогнозирования прогноза опухоли9. Номограммы могут визуализировать сложные статистические модели, что облегчает их применение в клинических условиях. При оценке прогноза опухоли обычноиспользуются показатели общей выживаемости (ОВ) и специфической для рака выживаемости (CSS) 9. Под ОС понимается время от подтверждения онкологического заболевания у пациента до смерти от любой причины. CSS относится к времени от постановки диагноза опухоли до смерти, вызванной именно раком, предлагая более точное отражение риска смерти от рака. Когда CSS используется в качестве индикатора исхода, смертность, вызванная другими факторами, может повлиять на вероятность смертности от рака, вводя конкурирующую зависимость риска между двумя событиями10,11. Таким образом, в исследованиях опухолеспецифической выживаемости следует использовать конкурирующие модели риска для устранения влияния конкурирующих событий. В предыдущих исследованиях были построены модели для прогнозирования прогноза ПДКК, но они были ограничены синхронным колоректальным раком и не использовали конкурирующие модели риска для учета влияния конкурирующих событий на CSS 12,13,14.
В этом исследовании мы изучили конкурирующие независимые факторы риска, влияющие на специфичную для рака выживаемость при МПХК после хирургического вмешательства. Обоснование использования конкурирующей модели рисков проистекает из ее способности учитывать возможность того, что пациенты могут умереть от причин, отличных от рака, что имеет решающее значение для получения объективныхоценок выживаемости. Традиционные методы анализа выживаемости, такие как модель Кокса, могут переоценивать вероятности выживания при наличии конкурирующих событий, что делает использование конкурирующих моделей риска более целесообразным в этихсценариях.
На основе выявленных независимых факторов риска мы построили номограмму для прогнозирования вероятности выживания и валидировали ее эффективность. Номограммы завоевали популярность в клинических условиях, поскольку они обеспечивают удобное графическое представление сложных статистических моделей, позволяя клиницистам легко рассчитывать индивидуальные оценки риска18,19. В отличие от других прогностических инструментов, номограммы учитывают множественные факторы риска и предоставляют более точные, персонализированные прогнозные оценки. Этот подход все чаще проверяется на различных видах рака, демонстрируя превосходную производительность по сравнению с традиционными системами определения стадий 20,21,22. Наш инструмент призван помочь клиницистам в составлении персонализированных и более точных оценок прогноза во время диагностики и лечения, тем самым улучшая процесс принятия решений при лечении МПХК.
протокол
Это исследование включает в себя два этапа. Во-первых, клинические данные и данные о выживаемости МПХК были получены из базы данных SEER. Затем программное обеспечение R (версия 4.3.3) было использовано для анализа и построения конкурирующей модели риска. Схема рабочего процесса исследования представлена на рисунке 1. Данное исследование не требует этического одобрения и согласия на участие. Данные, использованные в данном исследовании, были получены из баз данных.
1. Сбор данных
- Загрузите SEER. Программное обеспечение Stat 8.4.3 с веб-сайта базы данных SEER (http://seer.cancer.gov/about/overview.html). Зарегистрируйтесь и авторизуйтесь в SEER. Stat 8.4.3 для получения соответствующих данных о пациенте.
- После входа в SEER. Stat 8.4.3, нажмите на Case Listing Session > Data и выберите базу данных Incidence SEER Research Data, 17 Registries, Nov 2022 Sub (2000-2020).
- Нажмите на Выбор > Редактировать и выберите {Раса, Пол, Год Dx. Год диагностики} = '2004', '2005', '2006', '2007', '2008', '2009', '2010', '2011', '2012', '2013', '2014', '2015' И {Сайт и морфология. Рекод сайта ICD-O-3/WHO 2008} = 'Толстая и прямая кишка' И {Сайт и морфология. Подтверждение диагноза} = 'Положительная гистология' И {несколько первичных полей. Порядковый номер}! = «Только один первичный».
- Нажмите на OK и сохраните выделение. Нажмите на «Таблицу» и в интерфейсе «Доступные переменные» выберите «Возрастная кодировка с одинокими возрастами и 85+», «Пол», «Рекод места ICD-O-3/WHO 2008», «Размер опухоли CS», «Рекод степени» (до 2017 года), Производный AJCC T, 6-е издание (2004-2015), Производный AJCC N, 6-е издание (2004-2015), Производный AJCC M, 6-е издание (2004-2015), Перекодирование лучевой терапии, Перекодирование химиотерапии (да, нет/unk), Классификация смертности по конкретным причинам SEER, SEER другая классификация причин смерти, месяцы выживаемости, идентификатор пациента, RX Summ-Surg Prim Site (1998+) и нажмите на столбец.
- Нажмите « Вывод», присвойте данные имя и нажмите « Выполнить », чтобы вывести и сохранить данные.
- База данных SEER напрямую не предоставляет информацию о том, есть ли у пациента MPCC. После завершения загрузки данных, как описано выше, используйте идентификатор пациента для фильтрации пациентов с MPCC, то есть тех, у кого диагностировано два или более случаев. После выявления пациентов с МПХК рассчитайте интервал между диагностикой опухолей на основе времени их выживаемости. Используя 6 месяцев в качестве порога, классифицируйте пациентов на SMPCC и MMPCC.
- Основываясь на возрасте пациентов на момент постановки первоначального диагноза, классифицируйте их возраст как = 65 лет и> 65 лет. Для степени опухоли степень I соответствует хорошей дифференцировке, степень II соответствует умеренной дифференцировке, степень III соответствует низкой дифференцировке, а степень IV соответствует недифференцировке. Классифицируйте локализацию опухоли на основе распределения множественных опухолей как правая толстая кишка, левая толстая кишка и вся толстая кишка.
- Существуют очевидные различия в эмбриональном развитии и биологических характеристиках между проксимальным и дистальным отделами толстой кишки, разделяют расположение опухоли на основе изгиба селезенки23. Правая ободочная кишка определяется как проксимальная к селезеночному изгибу, включая слепую кишку, восходящую ободочную кишку, печеночный изгиб и поперечную ободочную кишку, в то время как левая толстая кишка включает в себя селезеночный изгиб, нисходящую ободочную кишку, сигмовидную кишку, ректосигмоидное соединение и прямую кишку. Если опухоли пациента полностью расположены в правой ободочной кишке, определите расположение опухоли как правая ободочная кишка; если все опухоли расположены в левой толстой кишке, определите расположение как левая толстая кишка; Если опухоли есть как в правой толстой кишке, так и в левой толстой кишке, определите место как весь колоректум.
- Определите размер опухоли, выбрав самый большой диаметр опухоли среди нескольких опухолей у одного пациента. В зависимости от диаметра опухоли классифицируйте размер как = 5 см или >5 см. Всего в исследование был включен 8 931 пациент. Чтобы создать обучающую когорту и когорту проверки, случайным образом разделите все случаи в соотношении 7:3.
2. Построение модели
- Загрузите RStudio (2023.12.1+402) и программное обеспечение R (4.3.3). Откройте RStudio для запуска программного обеспечения R. Нажмите « Новый файл » и выберите «Скрипт R », чтобы создать новый программный интерфейс R. Введите соответствующий код в редакторе кода и нажмите « Выполнить », чтобы выполнить код.
ПРИМЕЧАНИЕ: Язык R и его функции предлагают широкий спектр параметров. Добавление или изменение этих параметров может улучшить анализ и визуализацию данных. - Используйте следующий код для выполнения одномерного анализа и построения кривой CIF.
Библиотека (Tidycmprsk)
библиотека(gtsummary)
Библиотека (ggsurvfit)
Библиотека (GGPRISM)
data <-read.csv('data.csv')"
data$status<-factor(data$status, levels=c(0,1,2),labels=c("0","CSS","OCS"))
CIF <- tidycmprsk::cuminc(Surv(time, status) ~ Пол, данные = данные)
ggcuminc(CIF,outcome= c("CSS", "OCS"),size=1.5)
где data.csv – данные, полученные из базы данных SEER. - После выполнения приведенного выше кода нажмите «Экспорт», затем нажмите «Сохранить как изображение» и, наконец, нажмите «Сохранить », чтобы сохранить изображение. Способ сохранения последующих изображений будет таким же, как и на этом шаге. Замените пол в приведенном выше коде один за другим другими факторами, чтобы выполнить одномерный анализ всех факторов.
- Используйте следующий код для выполнения BSR и многомерного анализа и визуализации.
библиотека(скачки)
библиотека(рискРегрессия)
библиотека(prodlim)
библиотека (лесной участок)
leaps<-regsubsets(status==0~Sex+Size+Grade+T+N+M,data = data)
plot(leaps,scale="adjr2")
multi <- FGR(Hist(time,status)~Sex + T + N + M +Grade+ Size,cause=1,data=data)
Резюме (несколько)
Multi <- read.csv("multi.csv",header = T)
forestplot(labeltext=as.matrix(Multi [,1:4]), mean= Multi $HR_mean, ower= Multi $HR_1, upper= Multi $HR_2)
где данные в multi.csv берутся из результатов предыдущего кода. - Выполните шаг 2.3. , чтобы сохранить изображение.
- Используйте следующий код для построения номограммы, кривой ROC, калибровочной кривой и кривой DCA.
библиотека(QHScrnomo)
Библиотека (RMS)
библиотека(рискРегрессия)
библиотека(prodlim)
данные <- read.csv("data.csv")
d <- datadist(data)
options(datadist = "d")
e <-cph(Surv(time,status==1)~Sex + T + N + M +Grade,data = data,
x=T, y=T, surv=T,time.inc=60)
nomo <- crr.fit(e,failcode=1,cencode = 0)
nomogram.crr(fit =nomo, lp = F, xfrac = 0.5, fun.at =seq(from=0, to=1, by= 0.1) , failtime =c(12,36,60),funlabel = c("1-year CSS Cumulative Incigence", "3-year CSS Cumulative Incigence","5-year CSS Cumulative Incigence"))
set.seed(123)
data$pro <- tenf.crr(m3,time = 60)
groupci(x=data$pro, ftime = data$time, fstatus = data$status, failcode = 1, cencode = 0, ci = TRUE)
f <- CSC(Hist(time,status)~Sex + T + N + M +Grade,data = data)
x <- Score(list(model1=f), Hist(time,status)~1, data=data, cause=1, times=c(12,36,60), se.fit=1L, plots="roc", metrics="auc")
g <- as.data.frame(x$AUC$score)
h <- g[g$times %in% c(12,36,60),]
col = c("darkcyan","помидор","фиолетовый")
plotROC(x, xlab="1-Специфичность", ylab="Чувствительность",col=col[1], cex=1.5, legend="", auc.in.legend = F, times = 12)
plotROC(x,col=col[2],legend = '', cex=1.5,times =36,auc.in.legend = F,add=T)
plotROC(x,col=col[3], times =60, add=T, cex=1.5, legend = '',auc.in.legend = F)
leg <- paste0(c("1-Year: ","3-Year: ","5-Year: "),substr(a$AUC,1,5)) - Выполните шаг 2.3. , чтобы сохранить изображение.
- Используйте пакет ggscidca для построения кривой DCA.
Библиотека (GGSCIDCA)
df_surv<-read.csv("data.csv",header = T)
cox_model <- coxph(Surv(time,status==1)~Пол + T + N+ M +Grade, data = df_surv)
cox_model1<-newcrr(cox_model)
scidca(cox_model1, newdata= df_surv,threshold.line = T,threshold.text = T)
где data.csv – данные, полученные из базы данных SEER. - Выполните шаг 2.3. , чтобы сохранить изображение.
Результаты
Характеристика пациента
Всего в исследование был включен 8 931 пациент. С точки зрения полового распределения, доля пациентов мужского пола была выше (56%) по сравнению с пациентами женского пола (44%). Что касается распределения локализации опухоли, то большинство опухолей было распределено по всей толстой кишке, в то время как наименьшее количество опухолей было расположено в правой толстой кишке (21%). С точки зрения степени опухоли, наиболее распространенной степенью была II степень, с 6 251 пациентом, что составляет 70% от общего числа; за ней последовала III степень с 2 026 пациентами (23%). В I и IV степенях было 355 и 299 пациентов соответственно, что составляет 4% и 3,3% от общего числа. С точки зрения инвазии опухоли наиболее распространенными были стадии Т3 и Т4. Более чем у половины пациентов не было метастазов в лимфатические узлы, в то время как у 17% пациентов наблюдались отдаленные метастазы. Лучевую терапию получили 1 446 пациентов (16%), химиотерапию – 3 843 пациента (43%). ПКРК встречался чаще, 5 327 пациентов, что составляло 60% от общего числа; Было 3604 пациента с метахронным колоректальным раком, что составляет 40%. Пациенты были случайным образом разделены на обучающие и валидационные наборы в соотношении 7:3. Статистически значимых различий в исходных данных между когортами обучения и валидации не было, как показано в таблице 1.
Одномерный анализ
После контроля влияния конкурентных событий результаты однофакторного анализа показали, что пол, степень и размер опухоли, стадия TNM, лучевая терапия, синхронный или метахронный статус и расположение опухоли были прогностическими факторами, влияющими на ССС у пациентов с МПКК. Только возраст не является прогностическим фактором для ССС у пациентов с МПКК. Мы отмечаем, что существует значительное пересечение CIF в лучевой терапии, химиотерапии, локализации и синхронном или метахронном статусе, что указывает на то, что краткосрочные и долгосрочные прогностические эффекты облучения у пациентов с МПХК были различными, как и химиотерапия, локализация и синхронный или метахронный статус. Кумулятивная кривая риска каждой подгруппы показана на рисунке 2.
Многомерный анализ
Прогностические факторы, полученные с помощью однофакторного анализа, были включены в регрессию наилучших подмножеств (BSR) и многофакторный анализ модели конкурентного риска. Среди них лучевая терапия, химиотерапия, локализация и синхронный или метахронный статус исключаются из-за их двойного влияния на прогноз. Результаты BSR и многофакторного анализа показали, что пол, стадия TNM и степень опухоли являются независимыми факторами риска развития CSS у пациентов с MPCC. (Рисунок 2)
Построение и верификация номограммы
На основе независимых факторов риска, полученных с помощью многофакторного анализа, мы строим линейную номограмму для прогнозирования CSS и верифицируем производительность модели прогнозирования (рис. 3). Затем мы используем кривую ROC, калибровочную кривую и DCA для оценки модели. Кривая ROC показала, что AUC 1-го, 3-летнего и 5-летнего обучения когорты составили 0,762, 0,742 и 0,734, а AUC 1-го, 3-летнего и 5-летнего курсов верификационной когорты составили 0,801, 0,740 и 0,743. В обучающей когорте и когорте верификации калибровочная кривая показала высокое соответствие между прогнозируемой вероятностью и фактическими данными (рис. 4). Чтобы проверить работоспособность модели в клиническом применении, мы использовали DCA для оценки клинической ценности модели. Результаты показывают, что модель показывает хорошую чистую выгоду (рисунок 5).
Рисунок 1: Схема рабочего процесса исследования. Данное исследование состоит из двух этапов: во-первых, данные были получены с помощью SEER. Stat, а затем анализ и визуализация данных были выполнены с помощью R. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
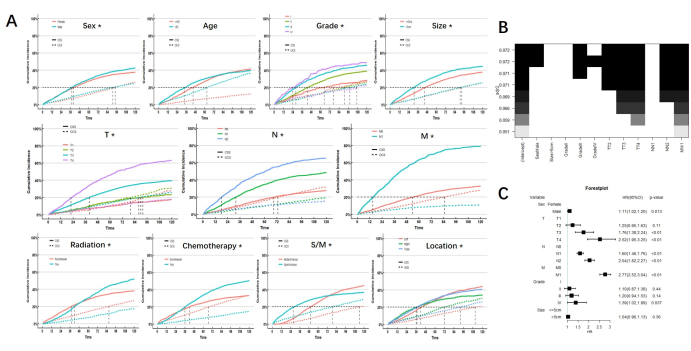
Рисунок 2: Результаты анализа. (А) КИФ подгрупп. * обозначает p <0,05. (B) Регрессия наилучших подмножеств. В соответствии с наилучшей пригодностью, полом, классом и стадией TNM рассматривались для включения (показаны черными блоками вверху). (C) Многофакторный анализ также показал, что пол, степень и стадия TNM являются независимыми факторами риска. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
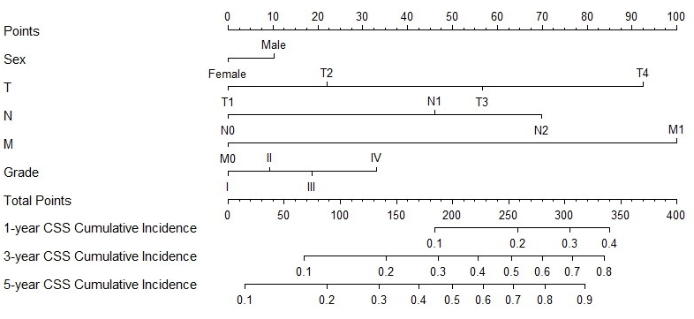
Рисунок 3: Номограмма для КСС у пациентов с МПКК. Общий балл пациента можно рассчитать, сложив баллы, соответствующие каждому фактору. На основе общего балла можно предсказать вероятность смерти от рака через 1, 3 и 5 лет Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
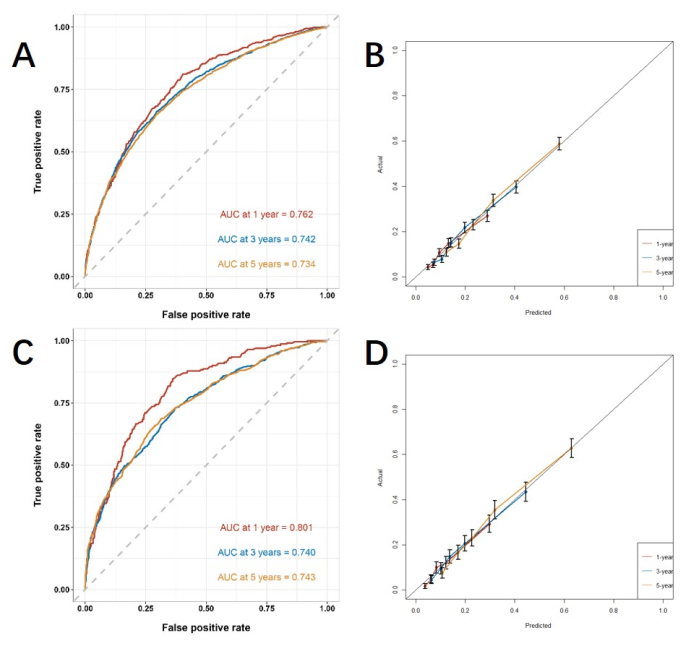
Рисунок 4: Кривая ROC и калибровочная кривая. (A, B) Кривые в обучающей когорте (n=6255) и (C, D) валидационной когорте (n=2676). Чем ближе значение AUC к 1, тем лучше классификационная производительность модели. Полосы погрешностей показывают 95% доверительный интервал для вероятности фактического наступления события. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
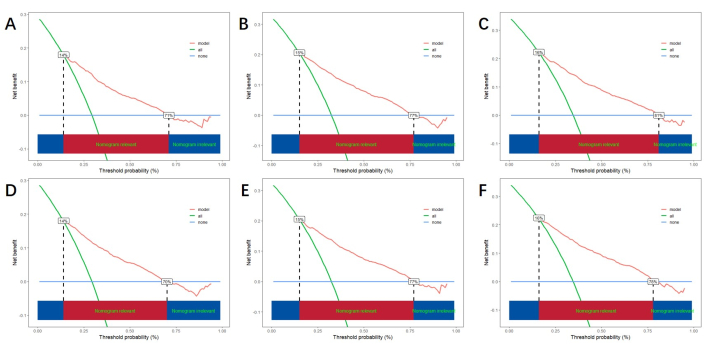
Рисунок 5: DCA для 1, 3 и 5 лет. (A, B, C) DCA в обучающей когорте и (D, E, F) валидационной когорте. Зеленая линия представляет чистую выгоду от всех положительных результатов, синяя линия представляет чистую выгоду от отсутствия положительных результатов, а красная линия указывает на чистую выгоду модели. В красной области ниже показано преимущество модели, превышающее все положительные и ни одного положительного результата, что указывает на фактический диапазон преимуществ модели. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Клинико-патологические и исходные характеристики пациентов. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Поскольку рак пищеварительной системы является распространенной опухолью пищеварительной системы, факторы, влияющие на прогноз одиночного колоректального рака, были изучены и подтверждены в предыдущих исследованиях24. Тем не менее, исследования прогностических факторов у пациентов с МПХК были ограничены. В это исследование был включен 8 931 пациент с МПКК, перенесших хирургическое вмешательство из базы данных SEER в период с 2004 по 2015 год. Мы использовали конкурирующую модель риска для изучения факторов риска, влияющих на CSS, и построили прогностическую модель. В этом исследовании 39,1% умерших пациентов умерли от причин, не связанных с раком, что подчеркивает необходимость использования конкурирующей модели риска для анализа факторов риска ССС.
Предыдущее исследование показало, что пожилой возраст является фактором риска, влияющим на ОВ у пациентов с МПХК12. Однако в этом исследовании мы обнаружили, что возраст не является фактором риска развития ССС. Пожилые пациенты часто демонстрируют худшие исходные состояния здоровья и больше сопутствующих заболеваний, что может привести к более короткой ОВ по сравнению с более молодыми пациентами. Пожилые люди также чаще умирают от других причин, таких как сердечно-сосудистые заболевания и тяжелые инфекции, что делает их более восприимчивыми к этим факторам, чем более молодые пациенты. В этом исследовании мы сосредоточились на конкурирующей связи между смертностью от других причин и смертностью от самого рака. Используя конкурирующую модель риска и исключив влияние смертей, вызванных другими причинами, мы обнаружили, что в этих условиях пожилой возраст больше не является фактором риска развития ССС ПДКК. Это указывает на то, что пациенты с МПХК в разных возрастных группах могут сталкиваться с одинаковой опухолевой нагрузкой. В целом, молодые и пожилые пациенты с этим заболеванием имеют схожий CSS, что дает ценные рекомендации для разработки персонализированных стратегий лечения.
Это исследование также показало, что частота и прогноз МПХК демонстрируют гендерные тенденции, с более высокой долей и более низким уровнем ПСС среди пациентов мужского пола. Это согласуется с ситуацией, наблюдаемой при солитарном колоректальном раке. Предыдущие исследования показали, что одиночный колоректальный рак чаще встречается у мужчин, и пациенты мужского пола имеют худший прогноз, чем пациенты женского пола. Это может быть связано с влиянием эстрогенов на возникновение и прогрессирование колоректального рака25. Кроме того, другие исследования показали, что микробиота кишечника и метаболиты кишечника у пациентов мужского пола могут быть одной из причин гендерных различий, наблюдаемыху пациентов с колоректальным раком. Исследование, проведенное в Германии, показало, что диабет 2 типа оказывает большее влияние на колоректальный рак у женщин27 лет. Более того, витамин D оказывает защитное действие против колоректальной неоплазии у женщин, но у мужчинподобных результатов обнаружено не было.
Конкурирующий однофакторный анализ показал, что пациенты с МПХК с большими размерами опухоли имели более низкий уровень CSS. В предыдущих исследованиях размер опухоли часто рассматривался как показатель агрессивности опухоли 29,30,31. Тем не менее, результаты конкурирующих многофакторных анализов не подтверждали размер опухоли в качестве независимого фактора риска. Это говорит о том, что в полых органах, таких как колоректум, размер опухоли может иметь ограниченную способность отражать агрессивность опухоли. Это явление может быть обусловлено различными факторами, в том числе сложностью биологии опухоли и различными моделями роста и распространения опухоли в разных органах.
Плохая степень опухоли указывает на более сильную инвазивную и миграционную способность опухолевых клеток, что согласуется с выводами данного исследования: более низкая степень опухоли предполагает более слабую степень CSS у пациентов с МПКК. Стадия TNM является наиболее часто используемым клиническим методом для направления лечения пациента и прогнозирования прогноза32,33. Это исследование показало, что чем глубже инфильтрация опухоли, чем больше количество метастатических лимфатических узлов и наличие метастазов в органы, тем хуже выживаемость пациента при раке. Это полностью согласуется с клиническим консенсусом.
При колоректальном раке прогноз варьируется в зависимости от локализации опухоли. Многие исследования показали, что правая толстая кишка имеет худший прогноз по сравнению с левой толстой кишкой 34,35,36,37. Тем не менее, некоторые исследования показывают, что при резектабельном колоректальном раке боковая сторона расположения опухоли не влияет на долгосрочный прогноз. В этом исследовании ПДХК, расположенный в правой толстой кишке, имел худший CSS в краткосрочной перспективе, но лучший долгосрочный прогноз. Аналогичным образом, пациенты с МПКК, получавшие лучевую и химиотерапию, имели лучший краткосрочный ПСС, но худший долгосрочный ПСС. У SCRC был худший краткосрочный CSS по сравнению с MCRC, но лучший долгосрочный CSS. Причины такого двойного влияния на прогноз до сих пор неясны.
Данное исследование имеет некоторые ограничения. Из-за ограничений, присущих базе данных SEER, мы не смогли получить или проанализировать некоторые известные прогностические показатели, такие как уровни раково-эмбрионального антигена (РЭА) и микросателлитный статус. Кроме того, мы не могли исключить пациентов с воспалительным заболеванием кишечника, наследственным неполипозным колоректальным раком и семейным аденоматозным полипозом с более высоким риском развития МПХК39. Кроме того, иммунотерапия становится все более важным аспектом лечения колоректального рака, но мы не смогли получить данные по этому вопросу. Ретроспективный характер нашего анализа и опора на один набор данных могут привести к врожденным предубеждениям.
Исследование, основанное на базе данных SEER, показало, что мужской пол, плохая степень опухоли и прогрессирующая стадия TNM были связаны с более низким уровнем CSS у пациентов с MPCC после операции. Важно уделять пристальное внимание пациентам с этими факторами риска во время диагностики и лечения. Кроме того, в этом исследовании была разработана номограмма для прогнозирования CSS у пациентов с MPCC, которая может точно предсказать прогноз и внести вклад в принятие решения о клиническом лечении.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Никакой.
Материалы
| Name | Company | Catalog Number | Comments |
| forestplot package | Comprehensive R Archive Network (CRAN) | forest plot 3.1.3 | A forest plot that allows for multiple confidence intervals per row, custom fonts for each text element, custom confidence intervals, text mixed with expressions, and more. |
| ggprism package | Comprehensive R Archive Network (CRAN) | ggprism 1.0.5 | The ggprism package provides various themes, palettes, and other useful functions to customise ggplots and give them the ‘GraphPad Prism’ look. |
| ggscidca package | Comprehensive R Archive Network (CRAN) | ggscidca package | The 'ggscidca' package adds coloured bars of discriminant relevance to the traditional decision curve. Improved practicality and aesthetics. |
| ggsurvfit package | Comprehensive R Archive Network (CRAN) | ggsurvfit 1.1.0 | The ggsurvfit package eases the creation of time-to-event (aka survival) summary figures with ggplot2. The concise and modular code creates images that are ready for publication or sharing. |
| gtsummary package | Comprehensive R Archive Network (CRAN) | gtsummary 2.0.0 | The gtsummary package provides an elegant and flexible way to create publication-ready analytical and summary tables using the R programming language. The {gtsummary} package summarizes data sets, regression models, and more, using sensible defaults with highly customizable capabilities. |
| QHScrnomo package | Comprehensive R Archive Network (CRAN) | QHScrnomo 3.0.1 | The goal of QHScrnomo is to provide functionality to construct nomograms in the context of time-to-event (survival) analysis in the presence of competing risks. It also contains functions to build, validate, and summarize these models. |
| R Software | R Core Team | R 4.3.3 | Free software environment for statistical computing and graphics |
| riskRegression package | Comprehensive R Archive Network (CRAN) | riskRegression 1.3.7 | Risk Regression Models and Prediction Scores for Survival Analysis with Competing Risks |
| rms package | Comprehensive R Archive Network (CRAN) | rms 6.8-1 | rms does regression modeling, testing, estimation, validation, graphics, prediction, and typesetting by storing enhanced model design attributes in the fit. |
| RStudio | RStudio, Public Benefit Corporation(PBC) | Rstudio 2023.12.1+402 | Integrated Development Environment (IDE) used for running R scripts, data analysis, and model development. Provides a user-friendly interface for R programming with advanced features like script editing, debugging, and version control. |
| SEERstat | National Cancer Institute (NCI) | SEERstat 8.4.3 | Software for statistical analysis of SEER and other cancer-related databases |
| tidycmprsk package | Comprehensive R Archive Network (CRAN) | tidycmprsk 1.0.0 | The tidycmprsk package provides an intuitive interface for working with the competing risk endpoints |
Ссылки
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Derwinger, K., Gustavsson, B. A study of aspects on gender and prognosis in synchronous colorectal cancer. Clin Med Insights Oncol. 5, 259-264 (2011).
- Chin, C. C., Kuo, Y. H., Chiang, J. M. Synchronous colorectal carcinoma: predisposing factors and characteristics. Colorectal Dis. 21 (4), 432-440 (2019).
- Nikoloudis, N., et al. Synchronous colorectal cancer. Tech Coloproctol. 8 (Suppl 1), s177-s179 (2004).
- Huang, C. S., et al. Synchronous and metachronous colorectal cancers: Distinct disease entities or different disease courses. Hepatogastroenterology. 62 (140), 838-842 (2015).
- He, W., et al. Prognosis of synchronous colorectal carcinoma compared to solitary colorectal carcinoma: a matched pair analysis. Eur J Gastroenterol Hepatol. 31 (12), 1489-1495 (2019).
- Ranstam, J., Cook, J. A., Collins, G. S. Clinical prediction models. Br J Surg. 103 (13), 1886 (2016).
- Smith, T., et al. Comparison of prognostic models to predict the occurrence of colorectal cancer in asymptomatic individuals: a systematic literature review and external validation in the EPIC and UK Biobank prospective cohort studies. Gut. 68 (4), 672-683 (2019).
- Iasonos, A., Schrag, D., Raj, G. V., Panageas, K. S. How to build and interpret a nomogram for cancer prognosis. J Clin Oncol. 26 (8), 1364-1370 (2008).
- Conroy, T., et al. Five-year outcomes of FOLFIRINOX vs Gemcitabine as adjuvant therapy for pancreatic cancer: A randomized clinical trial. JAMA Oncol. 8 (11), 1571-1578 (2022).
- Zhong, M., et al. Impact of lung metastasis versus metastasis of bone, brain, or liver on overall survival and thyroid cancer-specific survival of thyroid cancer patients: A population-based study. Cancers. 14 (13), 3133 (2022).
- Xu, Y., Wang, X., Huang, Y., Ye, D., Chi, P. A LASSO-based survival prediction model for patients with synchronous colorectal carcinomas based on SEER. Transl Cancer Res. 11 (8), 2795-2809 (2022).
- Zhang, X., Zhao, L., Hu, Y., Deng, K., Ren, W. A novel risk prediction nomogram for early death in patients with resected synchronous multiple primary colorectal cancer based on the SEER database. Int J Colorectal Dis. 38 (1), 130 (2023).
- Zhang, X., et al. Developing prognostic nomograms to predict overall survival and cancer-specific survival in synchronous multiple primary colorectal cancer based on the SEER database. J Cancer Res Clin Oncol. 149 (15), 14057-14070 (2023).
- Austin, P. C., Lee, D. S., Fine, J. P. Introduction to the analysis of survival data in the presence of competing risks. Circulation. 133 (6), 601-609 (2016).
- Lau, B., Cole, S. R., Gange, S. J. Competing risk regression models for epidemiologic data. Am J Epidemiol. 170 (2), 244-256 (2009).
- Nolan, E. K., Chen, H. Y. A comparison of the Cox model to the Fine-Gray model for survival analyses of re-fracture rates. Arch Osteoporos. 15 (1), 86 (2020).
- Park, S. Y. Nomogram: An analogue tool to deliver digital knowledge. J Thorac Cardiovasc Surg. 155 (4), 1793 (2018).
- Balachandran, V. P., Gonen, M., Smith, J. J., DeMatteo, R. P. Nomograms in oncology: more than meets the eye. Lancet Oncol. 16 (4), e173-e180 (2015).
- Liang, W., et al. Development and validation of a nomogram for predicting survival in patients with resected non-small-cell lung cancer. J Clin Oncol. 33 (8), 861-869 (2015).
- Chen, D., et al. Predicting postoperative peritoneal metastasis in gastric cancer with serosal invasion using a collagen nomogram. Nat Commun. 12 (1), 179 (2021).
- Niu, X., et al. A prognostic nomogram for patients with newly diagnosed adult thalamic glioma in a surgical cohort. Neuro Oncol. 23 (2), 337-338 (2021).
- Luo, S., et al. Comparison of left- and right-sided colorectal cancer to explore prognostic signatures related to pyroptosis. Heliyon. 10 (7), e28091 (2024).
- Keum, N., Giovannucci, E. Global burden of colorectal cancer: emerging trends, risk factors and prevention strategies. Nat Rev Gastroenterol Hepatol. 16 (12), 713-732 (2019).
- Foster, P. A. Oestrogen and colorectal cancer: mechanisms and controversies. Int J Colorectal Dis. 28 (6), 737-749 (2013).
- Wang, L., et al. Male-biased gut microbiome and metabolites aggravate colorectal cancer development. Adv Sci. 10 (25), e2206238 (2023).
- Krämer, H. U., et al. Type 2 diabetes mellitus and gender-specific risk for colorectal neoplasia. Eur J Epidemiol. 27 (5), 341-347 (2012).
- Aigner, E., et al. Gender- and site-specific differences of colorectal neoplasia relate to vitamin D. Aliment Pharmacol Ther. 40 (11-12), 1341-1348 (2014).
- Dai, W., et al. Does tumor size have its prognostic role in colorectal cancer? Re-evaluating its value in colorectal adenocarcinoma with different macroscopic growth pattern. Int J Surg. 45, 105-112 (2017).
- Rössler, O., et al. Tumor size, tumor location, and antitumor inflammatory response are associated with lymph node size in colorectal cancer patients. Mod Pathol. 30 (6), 897-904 (2017).
- Zhang, Q., et al. Prognostic impact of tumor size on patients with metastatic colorectal cancer: a large SEER-based retrospective cohort study. Updates Surg. 75 (5), 1135-1147 (2023).
- Greene, F. L. TNM: our language of cancer. CA Cancer J Clin. 54 (3), 129-130 (2004).
- Ueno, H., et al. Optimal colorectal cancer staging criteria in TNM classification. J Clin Oncol. 30 (13), 1519-1526 (2012).
- Yahagi, M., Okabayashi, K., Hasegawa, H., Tsuruta, M., Kitagawa, Y. The worse prognosis of right-sided compared with left-sided colon cancers: a systematic review and meta-analysis. J Gastrointest Surg. 20 (3), 648-655 (2016).
- Holch, J. W., Ricard, I., Stintzing, S., Modest, D. P., Heinemann, V. The relevance of primary tumour location in patients with metastatic colorectal cancer: A meta-analysis of first-line clinical trials. Eur J Cancer. 70, 87-98 (2017).
- Petrelli, F., et al. Prognostic survival associated with left-sided vs right-sided colon cancer: A systematic review and meta-analysis. JAMA Oncol. 3 (2), 211-219 (2017).
- Zheng, C., Jiang, F., Lin, H., Li, S. Clinical characteristics and prognosis of different primary tumor location in colorectal cancer: a population-based cohort study. Clin Transl Oncol. 21 (11), 1524-1531 (2019).
- Karim, S., Brennan, K., Nanji, S., Berry, S. R., Booth, C. M. Association between prognosis and tumor laterality in early-stage colon cancer. JAMA Oncol. 3 (10), 1386-1392 (2017).
- Lindberg, L. J., et al. Risk of multiple colorectal cancer development depends on age and subgroup in individuals with hereditary predisposition. Fam Cancer. 18 (2), 183-191 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены