Method Article
Ameliyat Sonrası Çoklu Primer Kolorektal Kanser Hastalarında Kansere Özgü Sağkalımı Tahmin Etmek için Rekabet Riski Nomogramı
Bu Makalede
Özet
Çalışma, ameliyat sonrası çoklu primer kolorektal kanser (MPCC) hastalarında erkek cinsiyet, zayıf tümör derecesi ve ileri Tümör Nodu Metastazı evresinin daha kötü kansere özgü sağkalım (CSS) ile ilişkili olduğunu buldu. MPCC hastalarının CSS'sini tahmin etmek ve klinik tedavi karar verme sürecine katkıda bulunmak için bir nomogram geliştirdik.
Özet
Çoklu primer kolorektal kanser (MPCC) hastalarında kansere özgü sağkalım (CSS), diğer nedenlerden kaynaklanan ölümlerden rekabetçi bir şekilde etkilenir. Bu çalışmada MPCC hastalarında KSS ve ilişkili risk faktörlerinin yarışarak risk analizi ile incelenmesi amaçlanmıştır. Bu çalışmanın verileri SEER veri tabanından alınmıştır. Rekabetçi olayların etkisini zayıflatmak için rekabetçi risk modelinin tek değişkenli ve çok değişkenli analizini kullanarak, CSS'nin risk faktörlerini araştırır ve bir nomogram modeli geliştirir. Ardından, modelin performansı ROC eğrisi, kalibrasyon eğrisi ve DCA ile doğrulanır. Çalışma, 8931'i eğitim kohortunda ve 6255'i doğrulama kohortunda olmak üzere toplam 2676 hastayı kapsamaktadır. Tek değişkenli ve çok değişkenli analizler, MPCC hastalarında cinsiyet, Tümör Nodu Metastazı (TNM) evresi ve tümör derecesinin kansere özgü sağkalım için bağımsız risk faktörleri olduğunu gösterdi. Risk faktörlerine dayanarak, CSS'yi tahmin etmek için bir diyagram modeli geliştirdik. ROC eğrisi, kalibrasyon eğrisi ve DCA da iyi sonuçlar verir. Sonuç olarak, MPCC hastalarında CSS'yi tahmin etmek için değerli bir araç olarak hizmet eden ve klinisyenlere kişiselleştirilmiş tedavi planlaması için önemli bilgiler sağlayan bir nomogram geliştirilmiştir.
Giriş
Dünya çapında en yaygın sindirim sistemi tümörlerinden biri olan kolorektal kanser, son birkaç on yılda görülme sıklığında sürekli bir artış görmüştür. Sürekli yüksek insidans ve mortalite oranları önemli ölçüde dikkat çekmiştir. En son istatistiklere göre, kolorektal kanser dünya çapında yaygın malign tümörler arasında üçüncü sırada yer alıyor ve ölüm oranı küresel olarak ikinci sırada yer alıyor1. Multipl primer kolorektal kanser (MPCC), son yıllarda araştırmacıların artan ilgisini çeken özel bir kolorektal kanser alt tipidir. Aynı hastada, iki veya daha fazla bağımsız kolorektal kanser lezyonunun tanısı olarak, lezyonların kenarları arasında 5 cm'den fazla mesafe olması olarak tanımlanır. MPCC'de birden fazla tümör aynı anda veya 6 aydan daha kısa bir süre içinde teşhis edildiğinde senkron kolorektal kanser (SCRC) olarak tanımlanırken, tanılar arasındaki aralık 6 aydan fazla ise metakron kolorektal kanser (MCRC) olarak tanımlanır2,3,4,5.
Tüm kolorektal kanserler içindeki MPCC oranı nispeten düşüktür ve insidansı ile ilgili raporlar farklı bölgeler ve çalışmalar arasında farklılık göstermektedir. Son yıllarda yapılan çalışmalarda MPCC'nin kolorektal kanserlerin %2-%10'unu oluşturduğu bildirilmiştir 2,3,4,5. Soliter kolorektal kanser ile karşılaştırıldığında, MPCC'nin prognozu daha kötüdür 3,6. Günümüzde, MPCC prognozunun klinik değerlendirmesi, esas olarak, MPCC'nin gerçek evresi olarak çoklu lezyonların en ileri evresini kullanan Amerikan Kanser Ortak Komitesi'nin tümör lenf nodu metastazı (TNM) evreleme sistemine dayanmaktadır. Bununla birlikte, prognoz tahminlerini sadece TNM evrelemesine dayandırmak yetersiz kalmaktadır. Ameliyat sonrası MPCC'nin prognozunu tahmin etmek için hala etkili bir araç eksikliği vardır. Mevcut hassas tıp çağında, riski ölçmek için klinik tahmin modelleri, klinik karar vermede ve hasta prognoz değerlendirmesinde yaygın olarak kullanılmaktadır 7,8. Son yıllarda, tümör prognozunu öngörmede bağımsız prognostik risk faktörlerine dayanan nomogramlar yaygın olarak kabul görmektedir9. Nomogramlar, karmaşık istatistiksel modelleri görselleştirebilir ve bu da klinik ortamlarda uygulanmalarını kolaylaştırır. Tümör prognozunun değerlendirilmesinde, genel sağkalım (OS) ve kansere özgü sağkalım (CSS) yaygın olarak kullanılan sonuç göstergeleridir9. OS, bir hastada bir kanserin doğrulanmasından herhangi bir nedenden dolayı ölüme kadar geçen süreyi ifade eder. CSS, bir tümörün teşhisinden özellikle kanserin neden olduğu ölüme kadar geçen süreyi ifade eder ve kansere bağlı ölüm riskinin daha kesin bir yansımasını sunar. CSS, sonuç göstergesi olarak kullanıldığında, diğer faktörlerin neden olduğu ölümler, kansere özgü mortalite olasılığını etkileyebilir ve iki olay arasında rekabet eden bir risk ilişkisi ortaya çıkarabilir10,11. Bu nedenle, tümöre özgü sağkalım çalışmaları, rekabet eden olayların etkisini ortadan kaldırmak için rekabet eden risk modellerini kullanmalıdır. Önceki çalışmalar, MPCC'nin prognozunu tahmin etmek için modeller oluşturmuştur, ancak bunlar senkron kolorektal kanserle sınırlıdır ve rekabet eden olayların CSS 12,13,14 üzerindeki etkisini açıklamak için rakip risk modellerini kullanmamıştır.
Bu çalışmada, cerrahi sonrası MPCC için kansere özgü sağkalımı etkileyen rekabet eden bağımsız risk faktörlerini araştırdık. Rekabet eden bir risk modelinin kullanılmasının mantığı, hastaların kanser dışındaki nedenlerden ölme olasılığını açıklama yeteneğinden kaynaklanmaktadır ve bu, tarafsız sağkalım tahminleri elde etmek için kritik öneme sahiptir15,16. Cox modeli gibi geleneksel sağkalım analizi teknikleri, rekabet eden olayların varlığında hayatta kalma olasılıklarını abartabilir ve bu senaryolarda rekabet eden risk modellerinin kullanımını daha uygun hale getirebilir17.
Belirlenen bağımsız risk faktörlerine dayanarak, hayatta kalma olasılığını tahmin etmek için bir nomogram oluşturduk ve performansını doğruladık. Nomogramlar, karmaşık istatistiksel modellerin kullanıcı dostu bir grafik temsilini sağladıkları ve klinisyenlerin bireyselleştirilmiş risk skorlarını kolayca hesaplamasına olanak tanıdıkları için klinik ortamlarda popülerlik kazanmıştır18,19. Diğer öngörücü araçların aksine, nomogramlar birden fazla risk faktörü içerir ve daha doğru, kişiselleştirilmiş prognoz tahminleri sağlar. Bu yaklaşım, çeşitli kanserlerde giderek daha fazla doğrulanmıştır ve geleneksel evreleme sistemlerine göre üstün performans göstermiştir 20,21,22. Aracımız, klinisyenlere tanı ve tedavi sırasında kişiselleştirilmiş ve daha doğru prognoz tahminleri yapmalarında yardımcı olmayı ve böylece MPCC yönetiminde karar vermeyi geliştirmeyi amaçlamaktadır.
Protokol
Bu çalışma iki adımdan oluşmaktadır. İlk olarak, MPCC'nin klinik ve sağkalım verileri SEER veri tabanından elde edildi. Daha sonra, rakip bir risk modelini analiz etmek ve oluşturmak için R yazılımı (sürüm 4.3.3) kullanıldı. Çalışmanın iş akış şeması Şekil 1'de sunulmuştur. Bu çalışmaya katılım için etik kurul onayı ve onay gerekmemektedir. Bu çalışmada kullanılan veriler veri tabanlarından elde edilmiştir.
1. Veri toplama
- SEER'i indirin. SEER veritabanı web sitesinden (http://seer.cancer.gov/about/overview.html) Stat 8.4.3 yazılımı. SEER'e kaydolun ve giriş yapın. İlgili hasta verilerini elde etmek için İstatistik 8.4.3.
- SEER'e giriş yaptıktan sonra. İstatistik 8.4.3, Vaka Listeleme Oturum > Verilerine tıklayın ve İnsidans SEER Araştırma Verileri, 17 Kayıt, Kasım 2022 Alt (2000-2020) veritabanını seçin.
- Seçim > Düzenle'ye tıklayın ve {Irk, Cinsiyet, Yıl Dx. Tanı yılı} = '2004', '2005', '2006', '2007', '2008', '2009', '2010', '2011', '2012', '2013', '2014', '2015' VE {Site ve Morfoloji. Site recode ICD-O-3 / WHO 2008} = 'Kolon ve Rektum' VE {Site ve Morfoloji. Tanısal Onay} = 'Pozitif histoloji' VE {Çoklu Birincil Alanlar. Sıra numarası}! = 'Yalnızca bir birincil'.
- Tamam'a tıklayın ve seçimi kaydedin. Tabloya tıklayın ve Kullanılabilir değişkenler arayüzünde, Tek yaş ve 85+ ile yaş yeniden kodlama, Cinsiyet, Site yeniden kodlaması ICD-O-3/WHO 2008, CS tümör boyutu, Sınıf Yeniden Kodlama (2017'ye kadar), Türetilmiş AJCC T, 6. baskı (2004-2015), Türetilmiş AJCC N, 6. baskı (2004-2015), Türetilmiş AJCC M, 6. baskı (2004-2015), Radyasyon kodlaması, Kemoterapi yeniden kodlaması (evet, hayır/unk), SEER nedene özgü ölüm sınıflandırması, SEER diğer ölüm nedeni sınıflandırması, Sağkalım ayları, Hasta Kimliği, RX Summ-Surg Prim Sitesi (1998+) ve Sütuna tıklayın.
- Çıktı'ya tıklayın, verileri adlandırın ve verilerin çıktısını almak ve kaydetmek için Yürüt'e tıklayın.
- SEER veri tabanı, bir hastanın MPCC'ye sahip olup olmadığı hakkında doğrudan bilgi sağlamaz. Yukarıda açıklandığı gibi veri indirme işlemini tamamladıktan sonra, MPCC'li hastaları, yani iki veya daha fazla olay teşhisi konan hastaları filtrelemek için hasta kimliğini kullanın. MPCC hastalarını belirledikten sonra, hayatta kalma sürelerine göre tümör teşhisleri arasındaki aralığı hesaplayın. Sınır olarak 6 ay kullanarak, hastaları SMPCC ve MMPCC olarak sınıflandırın.
- İlk tanı anındaki yaşlarına göre, hastaların yaşlarını = 65 yıl ve> 65 yıl olarak sınıflandırın. Tümör derecesi için, derece I iyi farklılaşmaya, derece II orta derecede farklılaşmaya, derece III düşük farklılaşmaya ve derece IV farklılaşmaya karşılık gelir. Tümör lokalizasyonunu, birden fazla tümörün dağılımına göre sağ kolon, sol kolorektum ve tüm kolorektum olarak sınıflandırın.
- Proksimal ve distal kolorektum arasında embriyonik gelişim ve biyolojik özelliklerde belirgin farklılıklar vardır, tümör yerleşimini splenik fleksurayagöre bölün 23. Sağ kolon çekum, çıkan kolon, hepatik fleksura ve transvers kolon dahil olmak üzere splenik fleksuranın proksimalinde tanımlanırken, sol kolorektumda splenik fleksura, inen kolon, sigmoid kolon, rektosigmoid bileşke ve rektum bulunur. Bir hastanın tümörleri tamamen sağ kolonda yerleşmişse, tümör yerleşimini sağ kolon olarak tanımlayın; Tüm tümörler sol kolorektumda bulunuyorsa, konumu sol kolorektum olarak tanımlayın; Hem sağ kolonda hem de sol kolorektumda tümör varsa, yerleşimi tüm kolorektum olarak tanımlayın.
- Aynı hastadaki birden fazla tümör arasından en büyük tümör çapını seçerek tümör boyutunu belirleyin. Tümör çapına bağlı olarak, boyutu = 5 cm veya >5 cm olarak kategorize edin. Çalışmaya toplam 8.931 hasta dahil edildi. Bir eğitim kohortu ve bir doğrulama kohortu oluşturmak için tüm servis taleplerini 7:3 oranında rastgele bölün.
2. Model yapımı
- RStudio (2023.12.1+402) ve R yazılımını (4.3.3) indirin. R yazılımını çalıştırmak için RStudio'yu açın. Yeni Dosya'ya tıklayın ve yeni bir R programlama arabirimi oluşturmak için R Betiği'ni seçin. İlgili kodu kod düzenleyicisine girin ve kodu çalıştırmak için Çalıştır'a tıklayın.
NOT: R dili ve işlevleri çok çeşitli parametreler sunar. Bu parametrelerin eklenmesi veya değiştirilmesi, veri analizini ve görselleştirmeyi geliştirebilir. - Tek değişkenli analiz gerçekleştirmek ve CIF eğrisini çizmek için aşağıdaki kodu kullanın.
Kütüphane(Tidycmprsk)
Kitaplık(gtsummary)
Kütüphane(ggsurvfit)
Kütüphane(ggprism)
veri <-read.csv ("data.csv")
data$status<-factor(veri$status, levels=c(0,1,2),labels=c("0","CSS","OCS"))
CIF <- tidycmprsk::cuminc(Surv(zaman, durum) ~ Cinsiyet, veri = veri)
ggcuminc(CIF,sonuç= c("CSS", "OCS"),boyut=1.5)
burada data.csv, SEER veritabanından elde edilen verilerdir. - Yukarıdaki kodu çalıştırdıktan sonra Dışa Aktar'a tıklayın, ardından Görüntü Olarak Kaydet'e tıklayın ve son olarak İndirim'e tıklayın görüntüyü kaydetmek için. Sonraki görüntüleri kaydetme yöntemi bu adımdakiyle aynı olacaktır. Tüm faktörler için tek değişkenli analiz yapmak için yukarıdaki koddaki Cinsiyeti tek tek diğer faktörlerle değiştirin.
- BSR ve çok değişkenli analiz ve görselleştirme gerçekleştirmek için aşağıdaki kodu kullanın.
Kitaplık(sıçramalar)
library(riskRegression)
Kütüphane(PRODLIM)
Kütüphane (Orman Arsası)
leaps<-regsubsets(durum==0~Cinsiyet+Boyut+Sınıf+T+N+M,veri = veri)
plot(leaps,scale="adjr2")
çoklu <- FGR(Hist(zaman,durum)~Cinsiyet + T + N + M +Sınıf+ Boyut,neden=1,veri=veri)
Özet(Çoklu)
Çoklu <- read.csv("multi.csv", başlık = T)
forestplot(labeltext=as.matrix(Çoklu [,1:4]), mean= Çoklu $HR_ortalama, ower= Çoklu $HR_1, üst= Çoklu $HR_2)
burada multi.csv içindeki veriler önceki kodun sonuçlarından gelir. - Adım 2.3'ü izleyin. Görüntüyü kaydetmek için
- Nomogramı, ROC eğrisini, kalibrasyon eğrisini ve DCA eğrisini çizmek için aşağıdaki kodu kullanın.
kütüphane(QHScrnomo)
Kitaplık(RMS)
library(riskRegression)
Kütüphane(PRODLIM)
Veri <- read.csv ("data.csv")
d <- datadist (veri)
options(datadist = "d")
e <-cph(Surv(zaman,durum==1)~Cinsiyet + T + N + M +Sınıf,veri = veri,
x=T, y=T, surv=T,time.inc=60)
nomo <- crr.fit(e,failcode=1,cencode = 0)
nomogram.crr(fit =nomo, lp = F, xfrac = 0.5, fun.at =seq(from=0, to=1, by= 0.1) , failtime =c(12,36,60),funlabel = c("1 yıllık CSS Kümülatif İnsidansı", "3 yıllık CSS Kümülatif İnsidansı","5 yıllık CSS Kümülatif İnsidansı"))
set.tohum(123)
Veri$Pro <- tenf.crr(m3,zaman = 60)
groupci(x=veri$pro, ftime = veri$time, fstatus = veri$status, failcode = 1, cencode = 0, ci = TRUE)
f <- CSC(Hist(zaman,durum)~Cinsiyet + T + N + M +Sınıf,veri = veri)
x <- Score(list(model1=f), Hist(time,status)~1, data=data, cause=1, times=c(12,36,60), se.fit=1L, plots="roc", metrics="auc")
g <- as.data.frame(x$AUC$puan)
H <- g[g$times %in% C(12,36,60),]
col = c("darkcyan","domates","mor")
plotROC(x, xlab="1-Özgüllük", ylab="Duyarlılık",col=col[1], cex=1.5, legend="", auc.in.legend = F, times = 12)
plotROC(x,col=col[2],legend = '', cex=1.5,times =36,auc.in.legend = F,add=T)
plotROC(x,col=col[3], times =60, add=T, cex=1.5, legend = '',auc.in.legend = F)
bacak <- yapıştır0(c("1 yıl: ","3 yıl: ","5 yıl: "),substr(a$AUC,1,5)) - Adım 2.3'ü izleyin. Görüntüyü kaydetmek için
- DCA eğrisini çizmek için ggscidca paketini kullanın.
Kütüphane(ggscidca)
df_surv<-read.csv("data.csv",başlık = T)
cox_model <- coxph(Surv(zaman,durum==1)~Cinsiyet + T + N+ M +Derece, veri = df_surv)
cox_model1<-newcrr(cox_model)
scidca(cox_model1, newdata= df_surv,threshold.line = T,threshold.text = T)
burada data.csv, SEER veritabanından elde edilen verilerdir. - Adım 2.3'ü izleyin. Görüntüyü kaydetmek için
Sonuçlar
Hasta özellikleri
Çalışmaya toplam 8.931 hasta dahil edildi. Cinsiyet dağılımı açısından erkek hastaların oranı (%56) kadın hastalara (%44) göre daha yüksekti. Tümör lokalizasyonu dağılımı ile ilgili olarak, tümörlerin çoğunluğu toplam kolorektuma dağılırken, en az tümör sağ kolonda (%21) yerleşmişti. Tümör derecesi açısından en sık görülen derece, toplamın %70'ini oluşturan 6.251 hasta ile derece II idi; bunu 2.026 hasta (%23) ile derece III izledi. Derece I ve IV'te sırasıyla 355 ve 299 hasta vardı ve toplamın %4 ve %3.3'ünü oluşturuyordu. Tümör invazyonu açısından T3 ve T4 evreleri en sık görülenlerdi. Hastaların yarısından fazlasında lenf nodu metastazı görülmezken, hastaların %17'sinde uzak metastaz görülmüştür. Hastaların 1.446'sına (%16) radyoterapi, 3.843'üne (%43) kemoterapi uygulandı. SCRC daha yaygındı ve 5.327 hasta toplamın %60'ını oluşturuyordu; Metakron kolorektal kanserli 3.604 hasta vardı ve% 40'ını oluşturuyordu. Hastalar rastgele 7:3 oranında eğitim ve doğrulama setlerine ayrıldı. Tablo 1'de gösterildiği gibi, eğitim ve doğrulama kohortları arasında temel verilerde istatistiksel olarak anlamlı bir fark yoktu.
Tek değişkenli analiz
Rekabetçi olayların etkisi kontrol edildikten sonra, tek değişkenli analizin sonuçları, MPCC hastalarında CSS'yi etkileyen prognostik faktörlerin cinsiyet, tümör derecesi ve boyutu, TNM evresi, radyasyon, kemoterapi, senkron veya metakron durum ve tümör lokalizasyonu olduğunu gösterdi. MPCC hastalarında sadece yaş CSS için prognostik bir faktör değildir. Radyasyon, kemoterapi, lokalizasyon ve senkron veya metakron durumda CIF'in önemli bir kesişimi olduğunu ve radyasyonun MPCC hastaları üzerindeki kısa ve uzun vadeli prognostik etkilerinin kemoterapi, lokalizasyon ve senkron veya metakron durum gibi farklı olduğunu belirtiyoruz. Her bir alt grubun kümülatif risk eğrisi Şekil 2'de gösterilmektedir.
Çok değişkenli analiz
Tek değişkenli analiz ile elde edilen prognostik faktörler, rekabetçi risk modelinin en iyi alt küme regresyonu (BSR) ve çok değişkenli analizine dahil edilmiştir. Bunlar arasında radyasyon, kemoterapi, lokalizasyon ve senkron veya metakron durum, prognoz üzerindeki ikili etkileri nedeniyle hariç tutulmuştur. BSR ve çok değişkenli analizin sonuçları, MPCC hastalarında cinsiyet, TNM evresi ve tümör derecesinin CSS için bağımsız risk faktörleri olduğunu gösterdi. (Şekil 2)
Nomogram'ın oluşturulması ve doğrulanması
Çok değişkenli analizle elde edilen bağımsız risk faktörlerine dayanarak, CSS'yi tahmin etmek ve tahmin modelinin performansını doğrulamak için bir çizgi nomogramı oluşturuyoruz (Şekil 3). Ardından, modeli değerlendirmek için ROC eğrisini, kalibrasyon eğrisini ve DCA'yı kullanırız. ROC eğrisi, eğitim kohortunun 1 yıllık, 3 yıllık ve 5 yıllık AUC'lerinin 0.762, 0.742 ve 0.734 olduğunu ve doğrulama kohortunun 1 yıllık, 3 yıllık ve 5 yıllık AUC'lerinin 0.801, 0.740 ve 0.743 olduğunu gösterdi. Eğitim kohortunda ve doğrulama kohortunda, kalibrasyon eğrisi, öngörülen olasılık ile gerçek veriler arasında yüksek bir uyum gösterdi (Şekil 4). Modelin klinik uygulamadaki performansını doğrulamak için, modelin klinik değerini değerlendirmek için DCA'yı kullandık. Sonuçlar, modelin iyi bir net fayda gösterdiğini göstermektedir (Şekil 5).
Şekil 1: Etüdün iş akış şeması. Bu çalışma iki adımdan oluşmaktadır: ilk olarak SEER kullanılarak veriler elde edilmiştir. İstatistik ve ardından R kullanılarak veri analizi ve görselleştirme yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
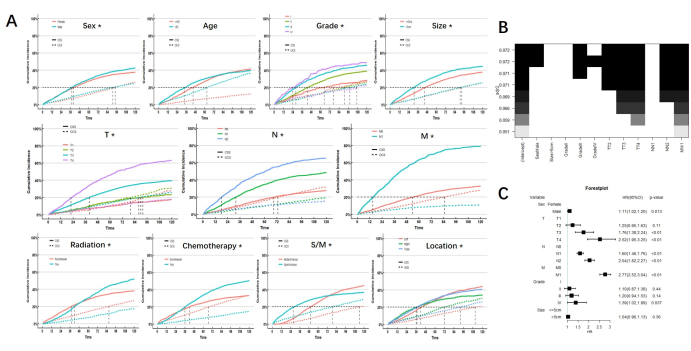
Şekil 2: Analiz sonuçları. (A) Alt grupların CIF'si. * P <0.05'i gösterir. (B) En iyi alt kümeler regresyonu. En iyi uyum iyiliği altında, cinsiyet, derece ve TNM aşaması dahil edilmek üzere kabul edildi (üstte siyah bloklar olarak gösterildi). (C) Çok değişkenli analiz ayrıca cinsiyet, derece ve TNM evresinin bağımsız risk faktörleri olduğunu göstermiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
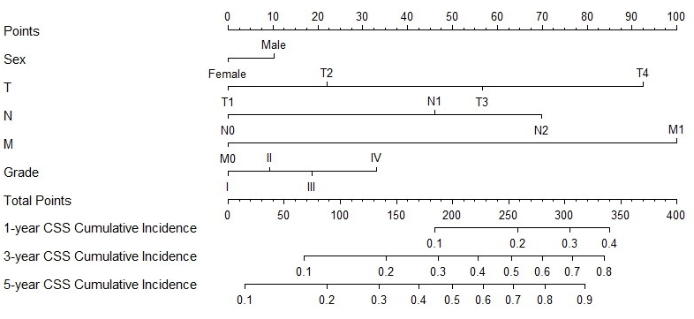
Şekil 3: MPCC hastalarında CSS için nomogram. Hastanın toplam puanı, her bir faktöre karşılık gelen puanlar toplanarak hesaplanabilir. Toplam puana dayanarak, 1, 3 ve 5 yıllarında kansere özgü ölüm olasılığı tahmin edilebilir Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
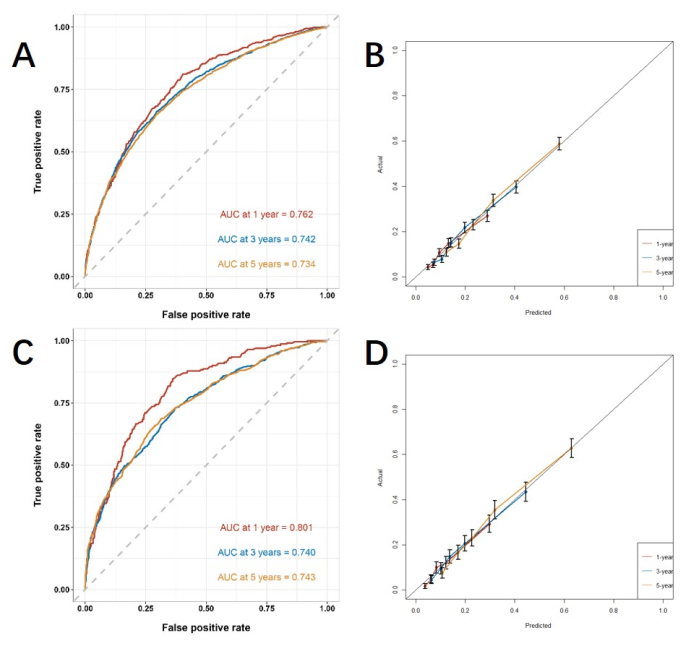
Şekil 4: ROC eğrisi ve kalibrasyon eğrisi. (A, B) Eğitim kohortundaki eğriler (n=6255) ve (C, D) validasyon kohortu (n=2676). AUC değeri 1'e ne kadar yakınsa, modelin sınıflandırma performansı o kadar iyi olur. Hata çubukları, gerçek olayın meydana gelme olasılığı için %95 güven aralığını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
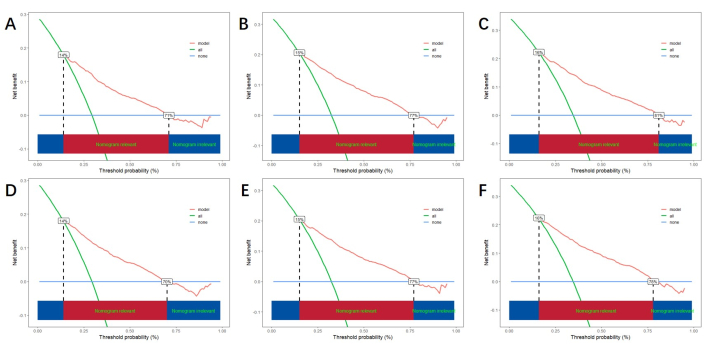
Şekil 5: 1 yıllık, 3 yıllık ve 5 yıllık DCA. (A, B, C) Eğitim kohortunda DCA ve (D, E, F) doğrulama kohortunda. Yeşil çizgi tüm pozitiflerin net faydasını, mavi çizgi hiçbir pozitifin net faydasını temsil etmez ve kırmızı çizgi modelin net faydasını gösterir. Aşağıdaki kırmızı alan, modelin gerçek fayda aralığını gösteren, modelin tüm pozitiflerinin ve hiçbirinin faydasını aşan faydasını temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Hastaların klinikopatolojik ve başlangıç özellikleri. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Yaygın bir sindirim sistemi tümörü olarak, soliter kolorektal kanserin prognozunu etkileyen faktörler önceki araştırmalarda incelenmiş ve doğrulanmıştır24. Bununla birlikte, MPCC hastaları için prognostik faktörler hakkında sınırlı araştırma yapılmıştır. Bu çalışma, 2004 ve 2015 yılları arasında SEER veri tabanından ameliyat edilen 8.931 MPCC hastasını içeriyordu. CSS'yi etkileyen risk faktörlerini araştırmak için rakip bir risk modeli kullandık ve tahmine dayalı bir model oluşturduk. Bu çalışmada vefat eden hastaların %39,1'inin kanser dışındaki nedenlerle hayatını kaybettiği belirtilerek, KSÖ için risk faktörlerinin analiz edilmesinde rakip bir risk modelinin kullanılması gerekliliği vurgulanmıştır.
Önceki çalışmalar, ileri yaşın MPCC hastalarının işletim sistemini etkileyen bir risk faktörü olduğunu bulmuştur12. Ancak bu çalışmada yaşın CSS için bir risk faktörü olmadığını bulduk. Yaşlı hastalar genellikle daha kötü temel sağlık koşulları ve daha fazla komorbidite sergiler, bu da genç hastalara kıyasla daha kısa bir işletim sistemine yol açabilir. Yaşlıların ayrıca kardiyovasküler olaylar ve ciddi enfeksiyonlar gibi diğer nedenlerden ölme olasılığı daha yüksektir ve bu da onları bu faktörlere genç hastalardan daha duyarlı hale getirir. Bu çalışmada, diğer nedenlere bağlı ölümler ile kanserin kendisine bağlı ölümler arasındaki rekabet ilişkisine odaklandık. Rakip bir risk modeli kullanarak ve diğer nedenlerden kaynaklanan ölümlerin müdahalesini dışlayarak, bu koşullar altında ileri yaşın artık MPCC'nin CSS'si için bir risk faktörü olmadığını bulduk. Bu, farklı yaş gruplarındaki MPCC hastalarının benzer tümör yükleriyle karşı karşıya kalabileceğini göstermektedir. Genel olarak, bu hastalığı olan genç ve yaşlı hastalar, kişiselleştirilmiş tedavi stratejileri geliştirmek için değerli rehberlik sağlayan benzer CSS'ye sahiptir.
Bu çalışma aynı zamanda MPCC insidansı ve prognozunun cinsiyetle ilişkili eğilimler sergilediğini, erkek hastaların daha yüksek bir oranı ve daha kötü CSS'si olduğunu bulmuştur. Bu, soliter kolorektal kanserde gözlenen durumla tutarlıdır. Önceki çalışmalar, soliter kolorektal kanserin erkeklerde daha sık görüldüğünü ve erkek hastaların kadın hastalara göre daha kötü prognoza sahip olduğunu göstermiştir. Bu, östrojenin kolorektal kanserin oluşumu ve ilerlemesi üzerindeki etkisine bağlı olabilir25. Ek olarak, diğer araştırmalar, erkek hastalarda bağırsak mikrobiyotası ve bağırsak metabolitlerinin, kolorektal kanser hastalarında gözlenen cinsiyet farklılıklarının nedenlerinden biri olabileceğini düşündürmektedir26. Almanya'da yapılan bir araştırma, tip 2 diyabetin27 kadında kolorektal kanser üzerinde daha büyük bir etkiye sahip olduğunu buldu. Dahası, D vitamini kadınlarda kolorektal neoplaziye karşı koruyucu bir etkiye sahiptir, ancak erkeklerde benzer bir bulguya rastlanmamıştır28.
Rekabet eden tek değişkenli analiz, daha büyük tümör boyutlarına sahip MPCC hastalarının daha zayıf CSS'ye sahip olduğunu buldu. Önceki çalışmalarda, tümör boyutu genellikle tümör agresifliğinin bir göstergesi olarak kabul edilmiştir 29,30,31. Bununla birlikte, rakip çok değişkenli analizlerden elde edilen sonuçlar, tümör boyutunu bağımsız bir risk faktörü olarak desteklemedi. Bu, kolorektum gibi içi boş organlarda, tümör boyutunun tümör agresifliğini yansıtma yeteneğinin sınırlı olabileceğini düşündürmektedir. Bu fenomen, tümör biyolojisinin karmaşıklığı ve tümör büyümesinin farklı paternleri ve farklı organlara yayılması dahil olmak üzere çeşitli faktörlerden kaynaklanabilir.
Kötü tümör derecesi, tümör hücrelerinin daha güçlü invaziv ve göç yeteneklerini gösterir ve bu da bu çalışmanın sonuçlarıyla uyumludur: daha kötü bir tümör derecesi, MPCC hastaları için daha zayıf bir CSS'yi önerir. TNM evresi, hasta tedavisini yönlendirmek ve prognozu öngörmek için en sık kullanılan klinik yöntemdir 32,33. Bu çalışma, tümör infiltrasyonu ne kadar derin olursa, metastatik lenf nodlarının sayısı o kadar fazla ve organ metastazı varlığı, hastanın kansere özgü sağkalımının o kadar kötü olduğunu bulmuştur. Bu tamamen klinik konsensüs ile tutarlıdır.
Kolorektal kanserde prognoz, tümörün konumuna bağlı olarak değişir. Birçok çalışmada sağ kolonun sol kolorektuma göre daha kötü prognoza sahip olduğu bulunmuştur 34,35,36,37. Bununla birlikte, bazı araştırmalar, rezektabl kolorektal kanserde, tümör lokalizasyonunun tarafının uzun vadeli prognozu etkilemediğini göstermektedir38. Bu çalışmada, sağ kolonda yerleşen MPCC'nin kısa dönemde CSS'si daha kötüydü, ancak uzun dönem prognozu daha iyiydi. Benzer şekilde, radyasyon ve kemoterapi alan MPCC hastaları kısa süreli CSS'ye daha iyi, ancak uzun süreli CSS'ye sahipti. SCRC, MCRC'ye kıyasla daha kötü kısa vadeli CSS'ye sahipti, ancak uzun vadeli CSS'si daha iyiydi. Prognoz üzerindeki bu ikili etkilerin nedenleri hala belirsizdir.
Bu çalışmanın bazı sınırlılıkları vardır. SEER veri tabanının doğal kısıtlamaları nedeniyle, karsinoembriyonik antijen (CEA) seviyeleri ve mikrosatellit durumu gibi bilinen bazı prognostik göstergeleri elde edemedik veya analiz edemedik. Ayrıca, MPCC39 riski daha yüksek olan inflamatuar barsak hastalığı, herediter nonpolipozis kolorektal kanser ve ailesel adenomatöz polipozis hastalarını dışlayamadık. Ek olarak, immünoterapi kolorektal kanser tedavisinin giderek daha önemli bir yönü haline geldi, ancak bu konuda veri elde edemedik. Analizimizin geriye dönük doğası ve tek bir veri setine güvenmesi, doğal önyargılara neden olabilir.
SEER veri tabanına dayanan çalışma, ameliyat sonrası MPCC hastalarında erkek cinsiyet, zayıf tümör derecesi ve ileri TNM evresinin daha zayıf CSS ile ilişkili olduğunu buldu. Tanı ve tedavi sırasında bu risk faktörlerine sahip hastalara çok dikkat etmek önemlidir. Ayrıca, bu çalışma, MPCC hastalarının CSS'sini tahmin etmek için prognozu doğru bir şekilde tahmin edebilen ve klinik tedavi karar verme sürecine katkıda bulunabilen bir nomogram geliştirmiştir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Hiç kimse.
Malzemeler
| Name | Company | Catalog Number | Comments |
| forestplot package | Comprehensive R Archive Network (CRAN) | forest plot 3.1.3 | A forest plot that allows for multiple confidence intervals per row, custom fonts for each text element, custom confidence intervals, text mixed with expressions, and more. |
| ggprism package | Comprehensive R Archive Network (CRAN) | ggprism 1.0.5 | The ggprism package provides various themes, palettes, and other useful functions to customise ggplots and give them the ‘GraphPad Prism’ look. |
| ggscidca package | Comprehensive R Archive Network (CRAN) | ggscidca package | The 'ggscidca' package adds coloured bars of discriminant relevance to the traditional decision curve. Improved practicality and aesthetics. |
| ggsurvfit package | Comprehensive R Archive Network (CRAN) | ggsurvfit 1.1.0 | The ggsurvfit package eases the creation of time-to-event (aka survival) summary figures with ggplot2. The concise and modular code creates images that are ready for publication or sharing. |
| gtsummary package | Comprehensive R Archive Network (CRAN) | gtsummary 2.0.0 | The gtsummary package provides an elegant and flexible way to create publication-ready analytical and summary tables using the R programming language. The {gtsummary} package summarizes data sets, regression models, and more, using sensible defaults with highly customizable capabilities. |
| QHScrnomo package | Comprehensive R Archive Network (CRAN) | QHScrnomo 3.0.1 | The goal of QHScrnomo is to provide functionality to construct nomograms in the context of time-to-event (survival) analysis in the presence of competing risks. It also contains functions to build, validate, and summarize these models. |
| R Software | R Core Team | R 4.3.3 | Free software environment for statistical computing and graphics |
| riskRegression package | Comprehensive R Archive Network (CRAN) | riskRegression 1.3.7 | Risk Regression Models and Prediction Scores for Survival Analysis with Competing Risks |
| rms package | Comprehensive R Archive Network (CRAN) | rms 6.8-1 | rms does regression modeling, testing, estimation, validation, graphics, prediction, and typesetting by storing enhanced model design attributes in the fit. |
| RStudio | RStudio, Public Benefit Corporation(PBC) | Rstudio 2023.12.1+402 | Integrated Development Environment (IDE) used for running R scripts, data analysis, and model development. Provides a user-friendly interface for R programming with advanced features like script editing, debugging, and version control. |
| SEERstat | National Cancer Institute (NCI) | SEERstat 8.4.3 | Software for statistical analysis of SEER and other cancer-related databases |
| tidycmprsk package | Comprehensive R Archive Network (CRAN) | tidycmprsk 1.0.0 | The tidycmprsk package provides an intuitive interface for working with the competing risk endpoints |
Referanslar
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Derwinger, K., Gustavsson, B. A study of aspects on gender and prognosis in synchronous colorectal cancer. Clin Med Insights Oncol. 5, 259-264 (2011).
- Chin, C. C., Kuo, Y. H., Chiang, J. M. Synchronous colorectal carcinoma: predisposing factors and characteristics. Colorectal Dis. 21 (4), 432-440 (2019).
- Nikoloudis, N., et al. Synchronous colorectal cancer. Tech Coloproctol. 8 (Suppl 1), s177-s179 (2004).
- Huang, C. S., et al. Synchronous and metachronous colorectal cancers: Distinct disease entities or different disease courses. Hepatogastroenterology. 62 (140), 838-842 (2015).
- He, W., et al. Prognosis of synchronous colorectal carcinoma compared to solitary colorectal carcinoma: a matched pair analysis. Eur J Gastroenterol Hepatol. 31 (12), 1489-1495 (2019).
- Ranstam, J., Cook, J. A., Collins, G. S. Clinical prediction models. Br J Surg. 103 (13), 1886 (2016).
- Smith, T., et al. Comparison of prognostic models to predict the occurrence of colorectal cancer in asymptomatic individuals: a systematic literature review and external validation in the EPIC and UK Biobank prospective cohort studies. Gut. 68 (4), 672-683 (2019).
- Iasonos, A., Schrag, D., Raj, G. V., Panageas, K. S. How to build and interpret a nomogram for cancer prognosis. J Clin Oncol. 26 (8), 1364-1370 (2008).
- Conroy, T., et al. Five-year outcomes of FOLFIRINOX vs Gemcitabine as adjuvant therapy for pancreatic cancer: A randomized clinical trial. JAMA Oncol. 8 (11), 1571-1578 (2022).
- Zhong, M., et al. Impact of lung metastasis versus metastasis of bone, brain, or liver on overall survival and thyroid cancer-specific survival of thyroid cancer patients: A population-based study. Cancers. 14 (13), 3133 (2022).
- Xu, Y., Wang, X., Huang, Y., Ye, D., Chi, P. A LASSO-based survival prediction model for patients with synchronous colorectal carcinomas based on SEER. Transl Cancer Res. 11 (8), 2795-2809 (2022).
- Zhang, X., Zhao, L., Hu, Y., Deng, K., Ren, W. A novel risk prediction nomogram for early death in patients with resected synchronous multiple primary colorectal cancer based on the SEER database. Int J Colorectal Dis. 38 (1), 130 (2023).
- Zhang, X., et al. Developing prognostic nomograms to predict overall survival and cancer-specific survival in synchronous multiple primary colorectal cancer based on the SEER database. J Cancer Res Clin Oncol. 149 (15), 14057-14070 (2023).
- Austin, P. C., Lee, D. S., Fine, J. P. Introduction to the analysis of survival data in the presence of competing risks. Circulation. 133 (6), 601-609 (2016).
- Lau, B., Cole, S. R., Gange, S. J. Competing risk regression models for epidemiologic data. Am J Epidemiol. 170 (2), 244-256 (2009).
- Nolan, E. K., Chen, H. Y. A comparison of the Cox model to the Fine-Gray model for survival analyses of re-fracture rates. Arch Osteoporos. 15 (1), 86 (2020).
- Park, S. Y. Nomogram: An analogue tool to deliver digital knowledge. J Thorac Cardiovasc Surg. 155 (4), 1793 (2018).
- Balachandran, V. P., Gonen, M., Smith, J. J., DeMatteo, R. P. Nomograms in oncology: more than meets the eye. Lancet Oncol. 16 (4), e173-e180 (2015).
- Liang, W., et al. Development and validation of a nomogram for predicting survival in patients with resected non-small-cell lung cancer. J Clin Oncol. 33 (8), 861-869 (2015).
- Chen, D., et al. Predicting postoperative peritoneal metastasis in gastric cancer with serosal invasion using a collagen nomogram. Nat Commun. 12 (1), 179 (2021).
- Niu, X., et al. A prognostic nomogram for patients with newly diagnosed adult thalamic glioma in a surgical cohort. Neuro Oncol. 23 (2), 337-338 (2021).
- Luo, S., et al. Comparison of left- and right-sided colorectal cancer to explore prognostic signatures related to pyroptosis. Heliyon. 10 (7), e28091 (2024).
- Keum, N., Giovannucci, E. Global burden of colorectal cancer: emerging trends, risk factors and prevention strategies. Nat Rev Gastroenterol Hepatol. 16 (12), 713-732 (2019).
- Foster, P. A. Oestrogen and colorectal cancer: mechanisms and controversies. Int J Colorectal Dis. 28 (6), 737-749 (2013).
- Wang, L., et al. Male-biased gut microbiome and metabolites aggravate colorectal cancer development. Adv Sci. 10 (25), e2206238 (2023).
- Krämer, H. U., et al. Type 2 diabetes mellitus and gender-specific risk for colorectal neoplasia. Eur J Epidemiol. 27 (5), 341-347 (2012).
- Aigner, E., et al. Gender- and site-specific differences of colorectal neoplasia relate to vitamin D. Aliment Pharmacol Ther. 40 (11-12), 1341-1348 (2014).
- Dai, W., et al. Does tumor size have its prognostic role in colorectal cancer? Re-evaluating its value in colorectal adenocarcinoma with different macroscopic growth pattern. Int J Surg. 45, 105-112 (2017).
- Rössler, O., et al. Tumor size, tumor location, and antitumor inflammatory response are associated with lymph node size in colorectal cancer patients. Mod Pathol. 30 (6), 897-904 (2017).
- Zhang, Q., et al. Prognostic impact of tumor size on patients with metastatic colorectal cancer: a large SEER-based retrospective cohort study. Updates Surg. 75 (5), 1135-1147 (2023).
- Greene, F. L. TNM: our language of cancer. CA Cancer J Clin. 54 (3), 129-130 (2004).
- Ueno, H., et al. Optimal colorectal cancer staging criteria in TNM classification. J Clin Oncol. 30 (13), 1519-1526 (2012).
- Yahagi, M., Okabayashi, K., Hasegawa, H., Tsuruta, M., Kitagawa, Y. The worse prognosis of right-sided compared with left-sided colon cancers: a systematic review and meta-analysis. J Gastrointest Surg. 20 (3), 648-655 (2016).
- Holch, J. W., Ricard, I., Stintzing, S., Modest, D. P., Heinemann, V. The relevance of primary tumour location in patients with metastatic colorectal cancer: A meta-analysis of first-line clinical trials. Eur J Cancer. 70, 87-98 (2017).
- Petrelli, F., et al. Prognostic survival associated with left-sided vs right-sided colon cancer: A systematic review and meta-analysis. JAMA Oncol. 3 (2), 211-219 (2017).
- Zheng, C., Jiang, F., Lin, H., Li, S. Clinical characteristics and prognosis of different primary tumor location in colorectal cancer: a population-based cohort study. Clin Transl Oncol. 21 (11), 1524-1531 (2019).
- Karim, S., Brennan, K., Nanji, S., Berry, S. R., Booth, C. M. Association between prognosis and tumor laterality in early-stage colon cancer. JAMA Oncol. 3 (10), 1386-1392 (2017).
- Lindberg, L. J., et al. Risk of multiple colorectal cancer development depends on age and subgroup in individuals with hereditary predisposition. Fam Cancer. 18 (2), 183-191 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır