Method Article
אפיון שלפוחיות חוץ-תאיות מנוזלים ביולוגיים
In This Article
Summary
כאן, אנו מדגימים את שיטת האפיון של שלפוחיות חוץ-תאיות (EVs) שנאספו מנוזלים ביולוגיים, כגון דמעות ורוק, של נבדקים אנושיים. הסורק המשמש בשיטה זו מסוגל לזהות את הפנוטיפ, הגודל וספירת החלקיקים הכוללת של EVs מ-1 מיקרוליטר של הדגימה.
Abstract
שלפוחיות חוץ-תאיות (EVs) הן מבנים המיוצרים מתאים ומשתתפים בתקשורת בין-תאית על ידי הובלת ביומולקולות מתא אחד למשנהו. הוכח כי רכבים חשמליים נוסעים למרחקים קצרים ורחוקים בגוף והם ספציפיים לרקמות. EVs נמצאים לא רק ברקמות, אלא ניתן למצוא אותם גם כמעט בכל נוזלי הגוף, כגון דמעות, רוק, נוזל עמוד השדרה, דם וכו'. למרות שניתן לאסוף EVs באופן לא פולשני מדמעות ורוק, ניתן לאסוף רק כמויות קטנות בכל פעם, מה שעלול לגרום לבעיות בהשגת מספיק EVs לניתוח חלבונים. הסורק הנדון במאמר זה הוא מנתח ננו-חלקיקים המספק פתרון לבעיה זו, ומאפשר לנו לאפיין ולחקור את הפנוטיפ, הגודל וספירת החלקיקים הכוללת של EVs מ-1 מיקרוליטר של נוזל ביולוגי בלבד. פרוטוקול זה ירחיב את הידע על רכבים חשמליים מכמויות קטנות של דגימות שקשה לחלץ ממטופלים. זה יכול לשפר את נוחות המטופל ואולי לזהות יעדים טיפוליים חדשים למגוון מחלות והפרעות.
Introduction
תאים מתקשרים עם תאים שכנים באמצעות מנגנוני איתות שונים, כולל שחרור שלפוחיות חוץ-תאיות (EVs), הממלאות תפקיד מפתח בתקשורת בין-תאית. EVs משתתפים בתקשורת בין-תאית על ידי העברת מטען גנטי, כגון DNA, RNA וחלבונים, מתא אחד למשנהו 1,2,3,4,5. נכון לעכשיו, ישנן שלוש קטגוריות של רכבים חשמליים: אקסוזומים, מיקרו-שלפוחיות וגופים אפופטוטיים, המאופיינים בגודלם. האקסוזומים הם הקטנים ביותר, בקוטר של 30-150 ננומטר 6,7,8, ונוצרים ממערכת הממברנה האנדוזומלית 9,10,11 (איור 1). מיקרו-שלפוחיות גדולות יותר מאקסוזומים בכך שהן נעות בין 100-1000 ננומטר12,13,14 וניצנות מממברנת הפלזמה 11,12,13 (איור 1). גופים אפופטוטיים הם הגדולים ביותר מבין ה-EVs ונעים בין 1000-5000 ננומטר12,14,15, והם גם נובטים מממברנת הפלזמה 12,16,17 (איור 1). מלבד הגודל, ניתן לסווג EVs על סמך מאפיינים ביופיזיים אחרים, הכוללים צפיפות, סמנים מולקולריים כגון CD63, CD81, CD9, וגם מנגנון ביוגנזה18. רכבים חשמליים יכולים לנסוע למרחקים קצרים בין תאים סמוכים ולמרחקים ארוכים בכל הגוף 19,20,21,22,23. ניתן למצוא EVs בנוזלים ביולוגיים כגון דם 24,25,26, נוזל עמוד השדרה המוחי 27,28,29, קרעים 30,31,32 ורוק 33,34,35, אם להזכיר כמה.
נכון להיום, אולטרה-צנטריפוגה היא אחת השיטות הידועות ביותר לבידוד רכבים חשמליים מדגימות 36,37,38. שיטה זו דורשת סבבים מרובים של צנטריפוגות ואולטרה-צנטריפוגה שניתן לבצע על ידי הגדלת המהירות לבידוד ה-EVs מתאים ופסולת תאים. ניתן להתחיל בשיטה זו במהירות נמוכה עם תאי גלולה שלאחריה מהירות בינונית כדי לחסל שלפוחיות גדולות יותר, ולבסוף, שלב אולטרה-צנטריפוגה לגלולה EVs18. בעוד שאולטרה-צנטריפוגה נחשבת לשיטה הטובה ביותר לבידוד, עדיין קיימות מגבלות מסוימות בכך שהיא משנה את המורפולוגיה של ה-EVs 39,40,41. טכניקה נוספת המשמשת לבידוד EVs היא ציטומטריית זרימה, המדגישה את היתרונות של הערכת נקודות זמן ונקודות קצה מרובות וניתוח EV יחיד בתפוקה גבוהה. עם זאת, המגבלות של זרימה ציטומטרית כוללות אך אינן מוגבלות לסתימת הנקבוביות ואותות חלשים. גישה נוספת המשמשת היא צנטריפוגה שיפוע, המשתמשת בחומרים בעלי צפיפות שונה לצנטריפוגה עם הרכבים החשמליים ומאפשרת הפרדה טובה יותר של הרכבים החשמליים בהשוואה לאולטרה-צנטריפוגה. למרות שטכניקה זו משפרת את ההפרדה, היא עתירת עבודה, גוזלת זמן ועלולה להוביל לאובדן משמעותי של הדגימה. בנוסף, ניתן להשתמש במשקעים וסינון גם כדי לבודד רכבים חשמליים. שתי הטכניקות הללו פשוטות ומהירות, אך שתיהן עלולות להוביל לזיהום דגימה. אמנם ישנן מספר טכניקות לבידוד רכבים חשמליים, אך לכל טכניקה יש את היתרונות והמגבלות שלה, המפורטים להלן (טבלה 1) 42,43,44,45,46,47,48,49,50,51,52,53,54, 55, 56,57,58,59,60,61,62,63,64,65,66,67.
לאחר בידוד הרכבים החשמליים, ניתן לבצע בדיקות מולקולריות כדי לאפיין את הרכבים החשמליים. כתמים מערביים הם בדיקה נפוצה לחיפוש ביטוי חלבון פני השטח והמטען 68,69,70 ותגובת שרשרת פולימראז (PCR) משמשת לביטוי miRNA 71,72,73 עבור EVs 74,75,76. מבחנים אלו מבוססים ויכולים להניב תוצאות מסקרנות. מגבלה של שיטות אלה היא שהן דורשות כמות גדולה של חלבונים או RNA מ-EVs כדי לקבל קריאה77, מה שמהווה בעיה עבור דגימות בעלות נפח קטן או ריכוז EV, מלכתחילה.
מנתח הננו-חלקיקים הנדון במאמר זה מאפשר למשתמש להתגבר על רבות מהמגבלות המפורטות בטבלה 1 ובטבלה 2 78,79,80,81,82,83,84,85,86,87,88,89,90 . שיטה זו אינה דורשת שימוש בטכניקות בידוד, שיעזרו להתגבר על התפוקה המופחתת של רכבים חשמליים. שיטה זו גם מאפשרת למשתמש לנתח את חלבוני פני השטח והמטען, ספירת EV הכוללת וגודל EV מנפח דגימה של עד 1 μL. זה נעשה על ידי שימוש בשבבי טטרספנין המסופקים על ידי החברה המשתמשת במיקרו-מערך נוגדנים עם נוגדנים טטרה-ספנין, CD63, CD81 ו-CD9, כדי לזהות EVs בתמיסה, כפי שמוצג באיור 2. נוגדנים פלואורסצנטיים מאשרים את נוכחותם של EVs וכן מונעים מחלקיקים מזהמים להטות את התוצאות.
המטרה הכוללת של טכניקה זו היא לספק שיטה שגוזלת פחות זמן לנתח רכבים חשמליים וכן לנתח רכבים חשמליים מנפח קטן של דגימה. שימוש במנתח ננו-חלקיקים זה מאפשר למשתמשים לנתח את הגודל, ספירת החלקיקים הכוללת וחלבוני פני השטח מ-1 מיקרוליטר של דגימה, שהוא אידיאלי עבור נוזלים ביולוגיים כגון דמעות ורוק.
Protocol
כל המחקרים שתוארו דבקו בהצהרת הלסינקי. הסכמה בכתב התקבלה מכל נבדק לפני שנכלל במחקר. אישור מועצת הביקורת המוסדית (IRB) מבית החולים האוניברסיטאי ארהוס (1-10-72-77-14) ומכון דין מקגי (1576837-2) התקבל על פי ההנחיות הפדרליות והמוסדיות. לפני העיבוד הוסרו כל דגימות הדמעות והרוק. כל המחקרים נבדקו ואושרו על ידי מועצת הביקורת המוסדית האזורית של צפון טקסס (#2020-030). הפרוטוקול הבא עומד בכל ההנחיות ואושר, כאמור לעיל.
1. יום 1: הכנת דגימה ודגירה
- אסוף דגימות נוזל ביולוגיות, כלומר דמעות ורוק מהנבדק/ים או הפשיר דגימות מהמקפיא.
- קרעים: אוספים קרעים באופן פסיבי מהמניסקוס הצדדי באמצעות צינור נימי זכוכית.
- הנח את צינור נימי הזכוכית על העפעף התחתון, היזהר לא לגעת בקרנית.
- יש לאסוף נפח של 10 מיקרוליטר דמעות תוך 10 דקות.
- יש להשתמש מיד בדמעות או לאחסן אותן בטמפרטורה של -20 מעלות צלזיוס.
- רוק: אסוף רוק מריר פסיבי בצינור מיקרוצנטריפוגה של 1.5 מ"ל
- אפשרו לתורם לאגור רוק בפיו.
- בקש מהתורם להזיל ריר לתוך הצינור עם משפך.
- יש להשתמש ברוק מיד או לאחסן בטמפרטורה של -20 מעלות צלזיוס.
- קרעים: אוספים קרעים באופן פסיבי מהמניסקוס הצדדי באמצעות צינור נימי זכוכית.
- הנח את שבבי הטטרספנין בצלחת שטיפת השבבים למשך 15 דקות לפני הוספת דגימות כדי לאפשר להם להגיע לטמפרטורת החדר. בעת הנחת השבבים בבאר, ודא שהמספרים נמצאים בצד התחתון כלפי מעלה ושהשבבים אינם נוגעים בדפנות הצד של הבארות.
- רשום את מספר הזיהוי ומספר השבב במחברת כדי לעקוב אחר השבבים.
- חבר את האפיק הטורי האוניברסלי (USB) המצורף לערכה, וחלץ ושמור את התיקייה עם מספר הערכה המשויך לאזור ייעודי לבחירתך.
- פיפטה 99 מיקרוליטר של תמיסה B בצינור של 1.5 מ"ל.
- הוסף 1 מיקרוליטר נוזל ביולוגי לצינור 1.5 מ"ל שהוכן בשלב הקודם.
- סובב את הצינורות.
- קח 70 מיקרוליטר מהתמיסה משלב 1.6 ופיפטה על שבב הטטרספנין.
- הנח את הסרט על צלחת שטיפת השבבים כדי למנוע את התאדות הדגימה.
- דגירה למשך 16 שעות בטמפרטורת החדר (RT) על ספסל נטול רעידות.
2. יום 2: שטיפת שבבים
- הפעל את מכונת הכביסה של השבבים.
- הסר את הסרט משלב 1.9 מהצלחת.
- הנח את הצלחת במכונת הכביסה, וודא שהיא ננעלת במקומה, וסגור את המכסה.
הערה: הצלחת לא תזוז בקלות אם ננעלה כהלכה במקומה. - לחץ על אפשרות CW-TETRA v0 במכונת הכביסה.
- בחר את שורת ההתחלה ואת מספר השורות לכביסה.
- לחץ על המשך במכונת הכביסה של השבבים.
- בזמן שטיפת השבב/ים, הכן את תמיסת החסימה המכילה את הנוגדנים בשפופרת באופן הבא:
- הכן 300 מיקרוליטר של תמיסת חסימה לכל שבב.
- הוסף 0.6 מיקרוליטר או כל נוגדן לכל שבב (מערבולת וסובב נוגדנים לפני הוספה לתמיסת החסימה)
- מערבולת תמיסת החסימה + קוקטייל נוגדנים.
הערה: יש לכסות את תמיסת החסימה + קוקטייל הנוגדנים מאור כדי להבטיח יציבות נוגדנים. זה חייב להיעשות ביום השימוש.
- כאשר מכונת הכביסה מצייצת, הוסף 250 מיקרוליטר מתמיסת החסימה + קוקטייל הנוגדנים על גבי השבב/ים.
- סגור את המכסה ולחץ על המשך.
הערה: מכונת הכביסה תבצע כעת דגירה של שעה אחת יחד עם מספר סבבים נוספים של כביסה ושטיפה. - כאשר מכונת הכביסה מצייצת, הסר את צלחת שטיפת השבבים והזז את השבב/ים במעלה הרמפה.
- הכנס את הצלחת בחזרה למכונת הכביסה, וודא שהיא ננעלת במקומה. סגור את המכסה ולחץ על המשך.
- כאשר מכונת הכביסה משלימה את התוכנית, הסר את הצלחת והנח את השבב על מגבת נייר. כסו את השבב/ים מהאור.
3. יום 2: סריקת השבבים
- הפעל את הסורק ופתח את תוכנת הסריקה.
הערה: הסורק יעבור בדיקות עצמיות כדי לציין אם יש שגיאות כלשהן או אם ניתן להמשיך בסריקה. - בחר שמור תיקיה ובחר את המיקום לשמירת הקבצים.
- בחר תיקיית ChipFile ובחר את התיקיה שנשמרה בשלב 1.4.
- בחר באפשרות הנפתחת כדי לבחור כל שבב ולאתר אותו במיקום שבב על הצ'אק. חזור על שלב זה עבור כל השבבים שצריך לסרוק.
- הפעל את הקרינה על ידי לחיצה על שלושת הריבועים מתחת למיקום השבב. הריבועים יהפכו לצהובים, כחולים ואדומים, בהתאמה.
- הסר את מכסה הצ'אק על ידי לחיצה על המכסה כלפי מטה ומשוך אותו.
- הנח את השבב/ים על הצ'אק, וודא שהם מאובטחים היטב.
- הנח את מכסה הצ'אק בחזרה על ידי הנחת היתדות בחורים, לחץ כלפי מטה והחלק את המכסה כדי לנעול אותו במקומו.
- הנח את הצ'אק על הבמה, וודא שהוא ננעל במקומו.
- בחר שבבי סריקה.
- בחר אישור.
- לאחר שהבמה עברה במלואה למכונה, סגור את הדלת.
הערה: לוקח בערך 12 דקות לסרוק שבב בודד. - לאחר שהתוכנית תסיים לסרוק את השבב/ים, פתח את הדלת כדי להוציא את ה-stage בדוק אם הסריקות הצליחו.
- אם הסריקות הצליחו, השליכו את השבב והניחו את סט השבבים הבא על הצ'אק, או החזירו את הצ'אק הריק לבמה. לאחר מכן, צא מהתוכנה וכבה את המכונה בסיום.
- אם הסריקות לא הצליחו, עיין בקוד השגיאה ותקן את השגיאה.
4. עיבוד נתונים
- פתח את תוכנת הניתוח.
- בחר Prescan Data ובחר את התיקיה המכילה את הסריקה מהיום השני שלב 3.2.
- בחר הבא.
- סמן את השבבים בעמודה שם לדוגמה בשם הדגימה על-ידי לחיצה על התא והקלדת המזהה לדוגמה.
- לאחר מכן, סמן את הטטרה-ספנינים בעמודה שם ערוץ . אדום = CD63, ירוק = CD81 וכחול = CD9.
- בחר הבא.
- בחר CV גבוה מהקבוצה בחר נקודה כדי לבדוק את התיבה הנפתחת ולכבות את קורות החיים הגבוהים עבור כל שבב על ידי השבתת נקודה אחת או שתיים.
- לאחר מכן, בחר ספירה גבוהה ונסה לכבות את אזהרות הספירה הגבוהה.
הערה: לחלק מהדגימות עשויה להיות ספירה גבוהה מדי, אך עדיין ניתן לנתח אותן. - בחר את כל הכתמים מהתפריט הנפתח, בחר Spot Montage ובדוק חזותית כל שבב לאיתור עיוותים או שריטות שעלולים להימצא.
- בחר הבא.
- בערוץ CD63, הגדר את המינימום ל-300 כדי להיפטר מתאים אדומים בשורה ממוצע % כלול; תאים צהובים הם בסדר, וממשיכים לערוץ CD81. אם הגדרת הערך המינימלי ל-300 אינה משנה את התא האדום לצהוב או לבן, המשך לשלב 4.14 לפתרון בעיות.
- בערוץ CD81, הגדר את המינימום ל-300 כדי להיפטר מתאים אדומים בשורה ממוצע % כלול; תאים צהובים הם בסדר, והמשיכו לערוץ CD9. אם הגדרת הערך המינימלי ל-300 אינה משנה את התא האדום לצהוב או לבן, המשך לשלב 4.14 לפתרון בעיות.
- בערוץ CD9, הגדר את המינימום ל-400 כדי להיפטר מתאים אדומים בשורה ממוצע % כלול; תאים צהובים הם בסדר, והמשך לשלב 4.15. אם הגדרת הערך המינימלי ל-400 אינה משנה את התא האדום לצהוב או לבן, המשך לשלב 4.14 לפתרון בעיות.
- פתרון בעיות
- הגדל את הערך המינימלי ב- 100 יחידות.
- אם שלב 4.14.1 לא עבד, בחר את השבב בקטע איסוף אסימונים לעבודה ובחר את השבב. בחר ספירת חלקיקים והשבת את הנקודות שיש להן ספירת חלקיקים גבוהה. בחר עוצמה/גודל, בחר כל הצ'יפים ובדוק אם פעולה זו פותרת את הבעיה.
- אם שלב 4.14.2 לא עבד, בחר את השבב בקטע איסוף אסימונים לעבודה ובחר את השבב. בחר חתכים של שבב יחיד והגדל את המינימום ב-100 יחידות. לאחר מכן בחר כל הצ'יפים כדי לראות אם התא האדום צהוב כעת. אם פעולה זו אינה עוזרת, חזור על שלב זה עד שהתא הממוצע % כלול יהפוך כעת לצהוב או לבן.
- בחר הבא.
- בטל את הבחירה בערוץ ההודעות המיידיות.
- הגדר את ערך מפת החום בפינה השמאלית התחתונה כדי לכלול את כל החלקיקים ובחר הוסף עלילה לדוח.
- התאם את המספר המרבי בתיבה הנפתחת והזן ערך באופן ידני.
- לאחר מכן, בחר את התפריט הנפתח באמצע העליון תחת Capture Probes ובחר CD63.
- בחר הוסף תרשים לדוח כדי להוסיף את ספירת החלקיקים הכוללת לדוח.
- בחר את התפריט הנפתח תחת מצב ניתוח, בחר לוקליזציה משותפת והוסף עלילה לדוח.
- לאחר מכן, בחר גודל, בחר שנה תצוגה לתרשים ובחר הוסף עלילה לדוח.
- לבסוף, בחר תמונות ובחר הוסף עלילה לדיווח.
- חזור על שלבים 4.18-4.22 עבור CD81 ו-CD9, והקפד לבטל את הבחירה בערוץ ההודעות המיידיות בכל פעם.
- לאחר הוספת כל הפריטים לדוח, בחר ייצוא דוח, ודא שהוא נשמר בקובץ הנכון ובחר תיקייה.
הערה: קבצים ותמונות של Excel נוצרו וכעת ניתן להשתמש בהם לניתוח נוסף.
תוצאות
בעת ניתוח הכתמים על השבבים, כוונו לריכוז אופטימלי של EVs על ידי התבוננות ברכבים חשמליים המסומנים פלואורסצנטית בערוצי CD63, CD81 ו-CD9, וערוץ MIgG30,91 אמור להישאר שחור, מכיוון שזהו ערוץ הבקרה כפי שניתן לראות באיור 3A. CD81 יופחת עבור נוזלים ביולוגיים. אם אין פלואורסצנטיות בערוצי CD63, CD81 ו-CD9, יש היעדר EVs (איור 3B). היזהרו לא להרוות יתר על המידה את השבב (איור 3C). זה יקשה על תוכנת הניתוח לחשב את הדיוק של הגודל, ספירת החלקיקים הכוללת והפנוטיפים של ה-EVs. מהנקודות של הריכוז האופטימלי, תוכנת הניתוח תוכל למדוד את הגודל (50-200 ננומטר), ספירת החלקיקים הכוללת וביטוי הטטרה-ספנין של ה-EVs (איור 4) ותיוצא לגיליונות אלקטרוניים בודדים להמשך ניתוח. ניתוח הטטרספנין יכלול את הקולוקליזציה של חלבוני פני השטח על ה-EVs. הקולוקליזציה תיוצג עם "/", לדוגמה, "CD63/CD81". זה לא אומר ש-CD63 ו-CD81 משולבים; זה אומר שגם CD63 וגם CD81 ממוקמים על פני השטח של ה-EV.
תוצאות אלה יספקו תובנה חשובה בין דגימות בריאות וחולות. נוכל לקבוע אם דגימות בריאות או דגימות חולות מייצרות יותר רכבים חשמליים, רכבים חשמליים גדולים או קטנים יותר, ואת הפנוטיפ של הרכבים החשמליים. כל אחד מהמאפיינים הללו או כולם יכולים לשחק תפקיד בביוגנזה של המחלה ו/או בהתקדמותה. עם תוצאות אלה, נוכל לראות אם יש היעדר או עלייה ברמות הטטרספנין, מה שיכול לספק תובנה לגבי תהליכים תאיים והיווצרות EVs.
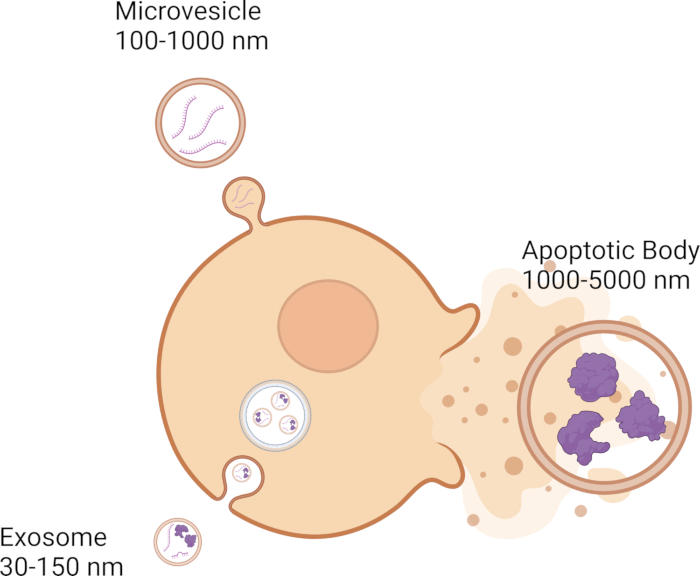
איור 1: הסוגים והגדלים של הרכבים החשמליים השונים. אנא לחצו כאן לצפייה בגרסה גדולה יותר של איור זה.
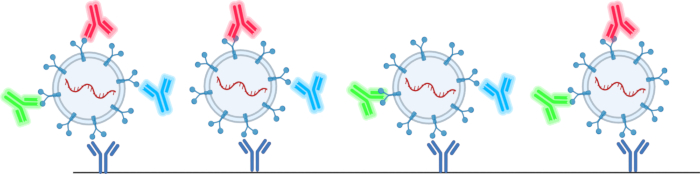
איור 2: סכמטי של האופן שבו שבבי הטטרה-ספנין לוכדים ומזהים רכבים חשמליים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
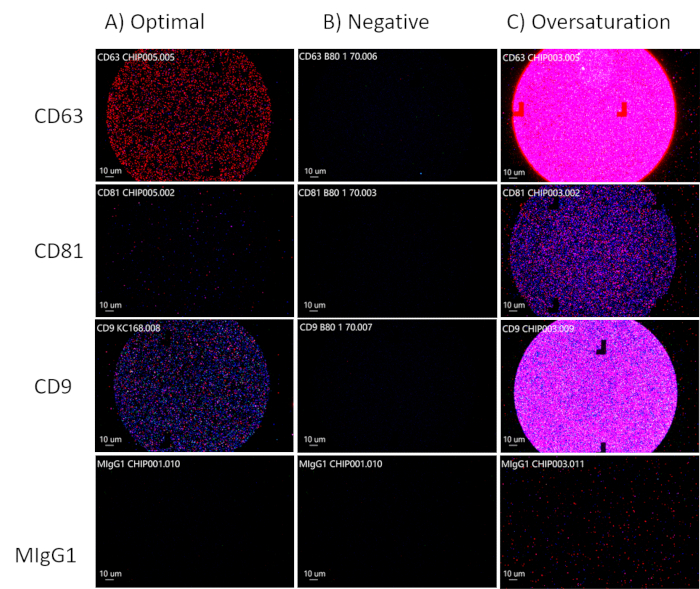
איור 3: אופטימיזציה של ריכוזי EV. (A) ריכוז אופטימלי של רכבים חשמליים. (B) תוצאה שלילית: אין רכבים חשמליים. (ג) רוויית יתר של רכבים חשמליים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
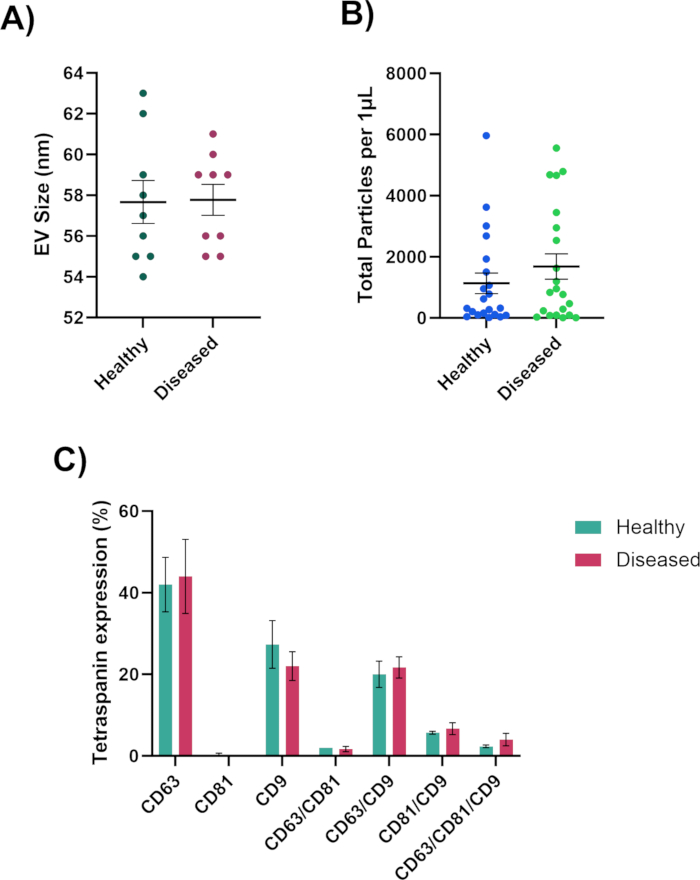
איור 4: נתונים שנוצרו על ידי מנתח הננו-חלקיקים. (A) גודל קוטר EV נמדד בננומטרים. (B) ספירת החלקיקים הכוללת של EVs. (C) פנוטיפ קו-לוקאלי של EV. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| טכניקה | יתרונות | מגבלות |
| אולטרה-צנטריפוגה | טוהר גבוה42,43 | שינויים במורפולוגיה של EV42,44 |
| הומוגניות42,45 | דורש נפח גדול42,44,46 | |
| פונקציונליות42,43 | יקר42,43 | |
| ציטומטריית זרימה | הערכת דגימות בנקודות זמן מרובות47 | אות חלש48,49 |
| נקודות קצה מרובות47,50 | נקבוביות סתומות51 | |
| ניתוח EV יחיד בתפוקה גבוהה52,53 | ||
| צנטריפוגת שיפוע צפיפות | הפקת דוגמאות טהורות ביותר54 | עבודה אינטנסיבית55,56 |
| מגוון דוגמאות55,57 | גוזל זמן55,58 | |
| אובדן יבול משמעותי54 | ||
| משקעים | פשוט59.60 | זיהום36,44,61 |
| מהיר61,62 | לא ספציפי63 | |
| תשואה גבוהה44,59,62 | ||
| pH ניטרלי36 | ||
| סינון | פשוט64 | מלכודת אקסוזומים65 |
| מהיר64 | פגיעה בשלפוחיות גדולות36 | |
| זול64 | עוגת פילטר66,67 | |
| סתימת אקסוזום65 |
טבלה 1: יתרונות ומגבלות של טכניקות בידוד EV. רשימה של הדרכים השונות לבודד רכבים חשמליים, כולל היתרונות והמגבלות שלהם.
| טכניקה | יתרונות | מגבלות |
| פיזור אור דינמי | מדידת חלקיקים בגודל 1 ננומטר עד 6 מיקרומטר78 | לא מתאים למדידת דגימות אקסוזום מורכבות בטווח מידות גדול79 |
| הגבול התחתון הוא 10 ננומטר מתאים למערכות חד-דיספריס79 | לא מסוגל להבחין בין חלבונים מזוהמים לאקסוזומים79 | |
| מיקרוסקופ אלקטרונים שידור (TEM) | שימו לב למורפולוגיה של אקסוזומים79,80 | הכנות מדגם מסובכות79 |
| התבוננו במבנה הפנימי81 | לא מסוגל להבחין באקסוזומים על סמך גודל וצורה בגלל אותות פלואורסצנטיים מוגזמים82 | |
| ניתוח מעקב אחר ננו-חלקיקים | מדידת ריכוז, גודל והתפלגות גודל של אקסוזומים בתחום של 10 ננומטר עד 2 מיקרומטר78 | לא יכול להבדיל את ה-EVs מצברי חלבון ומזהמים אחרים83 |
| הכנה ומדידה מהירה של מדגם78,84 | מכשיר NTA יקר85 | |
| ניתן לשחזר דגימות בצורה מקורית84 | רגיש לרעידות85 | |
| כתם מערבי (WBs) | יכול לנתח באופן איכותי וכמותי חלבוני סמן79,86 | מסובך וגוזל זמן79 |
| ניתוח אקסוזומים ממצע תרבית תאים79 | EV מבודדים עשויים להכיל ליפופרוטאינים ומזהמים אחרים86 | |
| ציטומטריית זרימה | רגישות גבוהה יותר והדמיה ברזולוציה גבוהה ל | גוזל זמן ומייגע עם מגבלת זיהוי של 400 ננומטר79,88 |
| להבחין בין אקסוזומים מוכתמים לבלימות87 | ||
| נדרש ריכוז דגימה נמוך79 | אותות אופטיים מעכבים את הדיוק והרזולוציה88 | |
| Exoview | מדוד טטרספנינים (CD9, CD63 ו-CD81) על אקסוזומים89 | לא מודד גדלי EV גדולים יותר75 |
| מודד חלבוני מטען EV90 |
טבלה 2: יתרונות ומגבלות של טכניקות אפיון EV.
Discussion
השלב הקריטי ביותר בפרוטוקול זה הוא לוודא שריכוז אופטימלי של רכבים חשמליים מושג. צריכים להיות מספיק רכבים חשמליים כדי לקבל קריאה, אבל לא יותר מדי רכבים חשמליים שירוויו את השבב יתר על המידה. הדרך הטובה ביותר לקבוע את ריכוז ה-EV האופטימלי היא לבצע ריצת אופטימיזציה עם 1 מיקרוליטר של דגימה ולראות אם יש צורך להתאים את הריכוז. צעד קריטי נוסף הוא לראות אם יש שפע של פסולת תאים בדגימה, שניתן לקבוע על ידי צפייה בנתחים גדולים על השבבים בתוכנת הניתוח. אם בדגימה יש פסולת תאים, צנטריפוגה או סינון פשוטים של הדגימה אמורים לפתור בעיה זו.
שלב נוסף ומכריע הוא להבטיח שהשבב/ים לא ייגעו בדפנות הבאר והימנעות ממגע עם האזור המרכזי של השבב/ים בעת הצבתם במעלה הרמפה. הסורק יקרא מהריבוע במרכז השבב, לכן חיוני להימנע מלגעת באזור זה עם המלקחיים כדי למנוע שיבוש של הרכבים החשמליים.
לשיטה זו יש כמה מגבלות כגון ריכוז לא מספיק של EVs לזיהוי על ידי המכשיר. ניתן לשפר את הריכוז על ידי ייבוש הדגימה או שימוש בצינור ריכוז. מגבלה נוספת היא שתוכנת הניתוח מודדת רק EVs בטווח של 50-200 ננומטר, לא כולל כמה מיקרו-שלפוחיות וכל הגופים האפופטוטיים ממדידות הגודל75.
ישנן דרכים רבות לבידוד (טבלה 1 42,43,44,45,46,47,48,49,50,51,52, 53,54,55,56,57,58)59,60, 61,62,63,64,65,66,67) ולנתח רכבים חשמליים (טבלה 2 78,79,80,81,82,83,84,85, 86,87,88,89,90), ותקן הזהב הנוכחי לבידוד EV הוא אולטרה-צנטריפוגה 36,37,38 כדי לגלול את התאים לבדיקות כגון Western Blots 68,69,70 ו-PCR 71,72,73,74,75,76. בעוד שפרוטוקול זה עובד היטב עבור דגימות גדולות 42,44,46, השגת נוזלים ביולוגיים יכולה להיות מאתגרת, ולעתים קרובות, ניתן לאסוף רק נפח קטן של דגימות בכל פעם, וזה לא אידיאלי עבור אולטרה-צנטריפוגה. לעומת זאת, שימוש במנתח ננו-חלקיקים זה מאפשר למשתמש לייצר נתונים יקרי ערך, כגון גודל, ספירת חלקיקים כוללת ופנוטיפ של ה-EVs, ב-1 מיקרוליטר בלבד של דגימה, מה שהופך אותו לאידיאלי עבור נוזלים ביולוגיים. נוכל להרחיב את הידע על רכבים חשמליים מכמויות קטנות של דגימות שקשה לחלץ, מה שיכול להגביר את נוחות המטופל ואולי למצוא מטרות טיפוליות פוטנציאליות למחלות והפרעות שונות.
Disclosures
למחברים אין אינטרסים פיננסיים מתחרים או ניגודי אינטרסים אחרים לחשוף.
Acknowledgements
ברצוננו להודות ל-NIH על המימון (EY031316 ו-EY034714). ברצוננו גם להודות ל-UNTHSC ול-NTERI על שטח המעבדה.
Materials
| Name | Company | Catalog Number | Comments |
| ChipWasher 100 | NanoView | EV-CW100 | Incubates, washes, rinses and dries the tetraspanin chips. This current model is no longer available. Price at time of purchase: $9,995.00 |
| ExoView Analyzer software | NanoView | N/A | Analyzes the chip informations and produces excel files for further analysis. No longer available. |
| ExoView R100 | NanoView | EV-R100 | Used to scan the tetraspanin chips at 3 wavelengths. This current model is no longer available. Price at time of purchase: $110,000.00 |
| ExoView Scanner software | NanoView | N/A | Scans the chips at 3 different wavelengths. No longer available. |
| Human Tetraspanin Kits | Unchained Labs | EV-TETRA-C | Includes 8 tetraspanin chips, Incubation Solution, Blocking Solution, CD63 antibody, CD81 antibody, CD9 antibody, Solution A, Solution B, USB, and plate cover. |
References
- Abels, E. R., Breakefield, X. O. Introduction to extracellular vesicles: Biogenesis, RNA cargo selection, content, release, and uptake. Cell Mol Neurobiol. 36 (3), 301-312 (2016).
- Radler, J., Gupta, D., Zickler, A., Andaloussi, S. E. Exploiting the biogenesis of extracellular vesicles for bioengineering and therapeutic cargo loading. Mol Ther. 31 (5), 1231-1250 (2023).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Adv Drug Deliv Rev. 178, 113961 (2021).
- Dixson, A. C., Dawson, T. R., Di Vizio, D., Weaver, A. M. Context-specific regulation of extracellular vesicle biogenesis and cargo selection. Nat Rev Mol Cell Biol. 24 (7), 454-476 (2023).
- Keshtkar, S., Azarpira, N., Ghahremani, M. H. Mesenchymal stem cell-derived extracellular vesicles: novel frontiers in regenerative medicine. Stem Cell Res Ther. 9 (1), 63 (2018).
- Zhang, H., et al. Exosome-induced regulation in inflammatory bowel disease. Front Immunol. 10, 1464 (2019).
- Barzin, M., et al. Application of plant-derived exosome-like nanoparticles in drug delivery. Pharm Dev Technol. 28 (5), 383-402 (2023).
- Zhou, C., et al. Stem cell-derived exosomes: emerging therapeutic opportunities for wound healing. Stem Cell Res Ther. 14 (1), 107 (2023).
- Kalluri, R., LeBleu, V. S. The biology, function, and biomedical applications of exosomes. Science. 367 (6478), aau6977 (2020).
- Mondal, J., et al. Hybrid exosomes, exosome-like nanovesicles and engineered exosomes for therapeutic applications. J Control Release. 353, 1127-1149 (2023).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nat Rev Mol Cell Biol. 19 (4), 213-228 (2018).
- Paul, N., Sultana, Z., Fisher, J. J., Maiti, K., Smith, R. Extracellular vesicles- crucial players in human pregnancy. Placenta. 140, 30-38 (2023).
- Zaldivia, M. T. K., McFadyen, J. D., Lim, B., Wang, X., Peter, K. Platelet-derived microvesicles in cardiovascular diseases. Front Cardiovasc Med. 4, 74 (2017).
- Tamasi, V., Nemeth, K., Csala, M. Role of extracellular vesicles in liver diseases. Life (Basel). 13 (5), 1117 (2023).
- Fu, Y., et al. Emerging understanding of apoptosis in mediating mesenchymal stem cell therapy. Cell Death Dis. 12 (6), 596 (2021).
- Santavanond, J. P., Rutter, S. F., Atkin-Smith, G. K., Poon, I. K. H. Apoptotic bodies: Mechanism of formation, isolation and functional relevance. Subcell Biochem. 97, 61-88 (2021).
- Yu, L., et al. Apoptotic bodies: bioactive treasure left behind by the dying cells with robust diagnostic and therapeutic application potentials. J Nanobiotechnology. 21 (1), 218 (2023).
- Momen-Heravi, F., Getting, S. J., Moschos, S. A. Extracellular vesicles and their nucleic acids for biomarker discovery. Pharmacol Ther. 192, 170-187 (2018).
- Liu, Y. J., Wang, C. A review of the regulatory mechanisms of extracellular vesicles-mediated intercellular communication. Cell Commun Signal. 21 (1), 77 (2023).
- Grange, C., Bussolati, B. Extracellular vesicles in kidney disease. Nat Rev Nephrol. 18 (8), 499-513 (2022).
- Cocucci, E., Meldolesi, J. Ectosomes and exosomes: shedding the confusion between extracellular vesicles. Trends Cell Biol. 25 (6), 364-372 (2015).
- Iannotta, D. A. A., Kijas, A. W., Rowan, A. E., Wolfram, J. Entry and exit of extracellular vesicles to and from the blood circulation. Nat Nanotechnol. 19 (1), 13-20 (2024).
- Saint-Pol, J., Gosselet, F., Duban-Deweer, S., Pottiez, G., Karamanos, Y. Targeting and crossing the blood-brain barrier with extracellular vesicles. Cells. 9 (4), 851 (2020).
- Alberro, A., Iparraguirre, L., Fernandes, A., Otaegui, D. Extracellular vesicles in blood: Sources, effects, and applications. Int J Mol Sci. 22 (15), 8163 (2021).
- Nieuwland, R., Siljander, P. R. A beginner's guide to study extracellular vesicles in human blood plasma and serum. J Extracell Vesicles. 13 (1), e12400 (2024).
- Thangaraju, K., Neerukonda, S. N., Katneni, U., Buehler, P. W. Extracellular vesicles from red blood cells and their evolving roles in health, coagulopathy and therapy. Int J Mol Sci. 22 (1), 153 (2020).
- Li, C., et al. Cerebrospinal fluid-derived extracellular vesicles after spinal cord injury promote vascular regeneration via PI3K/AKT signaling pathway. J Orthop Translat. 39, 124-134 (2023).
- Deng, Y., et al. Phosphoproteome analysis of cerebrospinal fluid extracellular vesicles in primary central nervous system lymphoma. Analyst. 148 (15), 3594-3602 (2023).
- Hirschberg, Y., et al. Proteomic comparison between non-purified cerebrospinal fluid and cerebrospinal fluid-derived extracellular vesicles from patients with Alzheimer's, Parkinson's and Lewy body dementia. J Extracell Vesicles. 12 (12), e12383 (2023).
- Hefley, B. S., et al. Revealing the presence of tear extracellular vesicles in Keratoconus. Exp Eye Res. 224, 109242 (2022).
- Cross, T., et al. RNA profiles of tear fluid extracellular vesicles in patients with dry eye-related symptoms. Int J Mol Sci. 24 (20), 15390 (2023).
- Ma, H., et al. Metabolic signatures of tear extracellular vesicles caused by herpes simplex keratitis. Ocul Surf. 31, 21-30 (2024).
- Han, P., Bartold, P. M., Ivanovski, S. The emerging role of small extracellular vesicles in saliva and gingival crevicular fluid as diagnostics for periodontitis. J Periodontal Res. 57 (1), 219-231 (2022).
- Han, P., Li, X., Wei, W., Ivanovski, S. Saliva diagnosis using small extracellular vesicles and salivaomics. Methods Mol Biol. 2588, 25-39 (2023).
- Reseco, L., et al. Characterization of extracellular vesicles from human saliva: Effects of age and isolation techniques. Cells. 13 (1), 95 (2024).
- Tiwari, S., Kumar, V., Randhawa, S., Verma, S. K. Preparation and characterization of extracellular vesicles. Am J Reprod Immunol. 85 (2), e13367 (2021).
- Tomiyama, E., Fujita, K., Nonomura, N. Urinary extracellular vesicles: Ultracentrifugation method. Methods Mol Biol. 2292, 173-181 (2021).
- Xu, K., Jin, Y., Li, Y., Huang, Y., Zhao, R. Recent progress of exosome isolation and peptide recognition-guided strategies for exosome research. Front Chem. 10, 844124 (2022).
- Brennan, K., et al. A comparison of methods for the isolation and separation of extracellular vesicles from protein and lipid particles in human serum. Sci Rep. 10 (1), 1039 (2020).
- Gao, J., et al. Recent developments in isolating methods for exosomes. Front Bioeng Biotechnol. 10, 1100892 (2022).
- Mol, E. A., Goumans, M. J., Doevendans, P. A., Sluijter, J. P. G., Vader, P. Higher functionality of extracellular vesicles isolated using size-exclusion chromatography compared to ultracentrifugation. Nanomedicine. 13 (6), 2061-2065 (2017).
- Ansari, F. J., et al. Comparison of the efficiency of ultrafiltration, precipitation, and ultracentrifugation methods for exosome isolation. Biochem Biophys Rep. 38, 101668 (2024).
- Patel, G. K., et al. Comparative analysis of exosome isolation methods using culture supernatant for optimum yield, purity and downstream applications. Sci Rep. 9 (1), 5335 (2019).
- Stam, J., Bartel, S., Bischoff, R., Wolters, J. C. Isolation of extracellular vesicles with combined enrichment methods. J Chromatogr B Analyt Technol Biomed Life Sci. 1169, 122604 (2021).
- Le Roy, A., et al. AUC and small-angle scattering for membrane proteins. Methods Enzymol. 562, 257-286 (2015).
- Chhoy, P., Brown, C. W., Amante, J. J., Mercurio, A. M. Protocol for the separation of extracellular vesicles by ultracentrifugation from in vitro cell culture models. STAR Protoc. 2 (1), 100303 (2021).
- McDorman, K. S., Chan, C., Rojko, J., Satterwhite, C. M., Morrison, J. P. . Chapter 7 - Special Techniques in Toxicologic Pathology. Haschek and Rousseaux's Handbook of Toxicologic Pathology (Third Edition). , (2013).
- Woud, W. W., et al. An imaging flow cytometry-based methodology for the analysis of single extracellular vesicles in unprocessed human plasma. Commun Biol. 5 (1), 633 (2022).
- Gul, B., Syed, F., Khan, S., Iqbal, A., Ahmad, I. Characterization of extracellular vesicles by flow cytometry: Challenges and promises. Micron. 161, 103341 (2022).
- Black, C. B., Duensing, T. D., Trinkle, L. S., Dunlay, R. T. Cell-based screening using high-throughput flow cytometry. Assay Drug Dev Technol. 9 (1), 13-20 (2011).
- Safford, H. R., Bischel, H. N. Flow cytometry applications in water treatment, distribution, and reuse: A review. Water Res. 151, 110-133 (2019).
- Kobayashi, H., et al. Precise analysis of single small extracellular vesicles using flow cytometry. Sci Rep. 14 (1), 7465 (2024).
- Welsh, J. A., et al. A compendium of single extracellular vesicle flow cytometry. J Extracell Vesicles. 12 (2), e12299 (2023).
- Carnino, J. M., Lee, H. Extracellular vesicles in respiratory disease. Adv Clin Chem. 108, 105-127 (2022).
- Sun, Y., Sethu, P. Low-stress microfluidic density-gradient centrifugation for blood cell sorting. Biomed Microdevices. 20 (3), 77 (2018).
- Strachan, B. C., Xia, H., Voros, E., Gifford, S. C., Shevkoplyas, S. S. Improved expansion of T cells in culture when isolated with an equipment-free, high-throughput, flow-through microfluidic module versus traditional density gradient centrifugation. Cytotherapy. 21 (2), 234-245 (2019).
- Malvezzi, H., Sharma, R., Agarwal, A., Abuzenadah, A. M., Abu-Elmagd, M. Sperm quality after density gradient centrifugation with three commercially available media: a controlled trial. Reprod Biol Endocrinol. 12, 121 (2014).
- Sun, Y., Sethu, P. Microfluidic adaptation of density-gradient centrifugation for isolation of particles and cells. Bioengineering (Basel). 4 (3), 67 (2017).
- Karttunen, J., et al. Precipitation-based extracellular vesicle isolation from rat plasma co-precipitate vesicle-free microRNAs. J Extracell Vesicles. 8 (1), 1555410 (2019).
- De Sousa, K. P., et al. Isolation and characterization of extracellular vesicles and future directions in diagnosis and therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 15 (1), e1835 (2023).
- Sidhom, K., Obi, P. O., Saleem, A. A review of exosomal isolation methods: Is size exclusion chromatography the best option. Int J Mol Sci. 21 (18), 6466 (2020).
- Coughlan, C., et al. Exosome isolation by ultracentrifugation and precipitation and techniques for downstream analyses. Curr Protoc Cell Biol. 88 (1), e110 (2020).
- Konoshenko, M. Y., et al. Isolation of extracellular vesicles from biological fluids via the aggregation-precipitation approach for downstream miRNAs detection. Diagnostics (Basel). 11 (3), 384 (2021).
- Drozdz, A., et al. Low-vacuum filtration as an alternative extracellular vesicle concentration method: A comparison with ultracentrifugation and differential centrifugation. Pharmaceutics. 12 (9), 872 (2020).
- Akbar, A., Malekian, F., Baghban, N., Kodam, S. P., Ullah, M. Methodologies to isolate and purify clinical grade extracellular vesicles for medical applications. Cells. 11 (2), 186 (2022).
- Chen, J., et al. Review on strategies and technologies for exosome isolation and purification. Front Bioeng Biotechnol. 9, 811971 (2021).
- Helling, A., et al. Investigation of microbial cell deformability by filter cake compressibility using ultrafiltration membranes. Colloids Surf B Biointerfaces. 185, 110626 (2020).
- Bagci, C., et al. Overview of extracellular vesicle characterization techniques and introduction to combined reflectance and fluorescence confocal microscopy to distinguish extracellular vesicle subpopulations. Neurophotonics. 9 (2), 021903 (2022).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- van Maanen, J. C., et al. A combined western and bead-based multiplex platform to characterize extracellular vesicles. Tissue Eng Part C Methods. 29 (11), 493-504 (2023).
- Xu, D., et al. MicroRNAs in extracellular vesicles: Sorting mechanisms, diagnostic value, isolation, and detection technology. Front Bioeng Biotechnol. 10, 948959 (2022).
- Lee, H., He, X., Le, T., Carnino, J. M., Jin, Y. Single-step RT-qPCR for detection of extracellular vesicle microRNAs in vivo: a time- and cost-effective method. Am J Physiol Lung Cell Mol Physiol. 318 (4), L742-L749 (2020).
- Kim, J. A., et al. Small RNA sequencing of circulating small extracellular vesicles microRNAs in patients with amyotrophic lateral sclerosis. Sci Rep. 13 (1), 5528 (2023).
- Fan, Y., et al. Differential proteomics argues against a general role for CD9, CD81 or CD63 in the sorting of proteins into extracellular vesicles. J Extracell Vesicles. 12 (8), e12352 (2023).
- Silva, A. M., et al. Quantification of protein cargo loading into engineered extracellular vesicles at single-vesicle and single-molecule resolution. J Extracell Vesicles. 10 (10), e12130 (2021).
- Salunkhe, S., Basak Dheeraj, M., Chitkara, D., Mittal, A. Surface functionalization of exosomes for target-specific delivery and in vivo imaging, tracking: Strategies and significance. J Control Release. 326, 599-614 (2020).
- Silva, A. K. A., et al. Development of extracellular vesicle-based medicinal products: A position paper of the group "Extracellular Vesicle translatiOn to clinicaL perspectiVEs - EVOLVE France". Adv Drug Deliv Rev. 179, 114001 (2021).
- Gurunathan, S., Kang, M. H., Jeyaraj, M., Qasim, M., Kim, J. H. Review of the isolation, characterization, biological function, and multifarious therapeutic approaches of exosomes. Cells. 8 (4), 307 (2019).
- Zhang, Y., et al. Exosome: A review of its classification, isolation techniques, storage, diagnostic and targeted therapy applications. Int J Nanomedicine. 15, 6917-6934 (2020).
- Colombo, M., Raposo, G., Thery, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu Rev Cell Dev Biol. 30, 255-289 (2014).
- Pisitkun, T., Shen, R. F., Knepper, M. A. Identification and proteomic profiling of exosomes in human urine. Proc Natl Acad Sci U S A. 101 (36), 13368-13373 (2004).
- Zaborowski, M. P., Balaj, L., Breakefield, X. O., Lai, C. P. Extracellular vesicles: Composition, biological relevance, and methods of study. Bioscience. 65 (8), 783-797 (2015).
- Kowkabany, G., Bao, Y. Nanoparticle tracking analysis: An effective tool to characterize extracellular vesicles. Molecules. 29 (19), 4672 (2024).
- Li, H. Metastatic characteristics of SY86B human gastric carcinoma in athymic nude mice. Zhonghua Zhong Liu Za Zhi. 10 (6), 421-423 (1988).
- Zhao, Z., Wijerathne, H., Godwin, A. K., Soper, S. A. Isolation and analysis methods of extracellular vesicles (EVs). Extracell Vesicles Circ Nucl Acids. 2, 80-103 (2021).
- Gandham, S., et al. Technologies and standardization in research on extracellular vesicles. Trends Biotechnol. 38 (10), 1066-1098 (2020).
- van der Vlist, E. J., Nolte-'t Hoen, E. N., Stoorvogel, W., Arkesteijn, G. J., Wauben, M. H. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nat Protoc. 7 (7), 1311-1326 (2012).
- Pospichalova, V., et al. Simplified protocol for flow cytometry analysis of fluorescently labeled exosomes and microvesicles using dedicated flow cytometer. J Extracell Vesicles. 4, 25530 (2015).
- Breitwieser, K., et al. Detailed characterization of small extracellular vesicles from different cell types based on tetraspanin composition by ExoView R100 platform. Int J Mol Sci. 23 (15), 8544 (2022).
- An, H. J., Cho, H. K., Song, D. H., Kee, C. Quantitative analysis of exosomes in the aqueous humor of Korean patients with pseudoexfoliation glaucoma. Sci Rep. 12 (1), 12875 (2022).
- Hefley, B. S., McKay, T. B., Hutcheon, A. E. K., Ciolino, J. B., Karamichos, D. Corneal epithelial-stromal constructs to study differences associated with diabetes mellitus. Exp Eye Res. 248, 110100 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved