Method Article
Характеристика внеклеточных везикул из биологических жидкостей
В этой статье
Резюме
В данной работе мы демонстрируем метод определения характеристик внеклеточных везикул (ВВ), собранных из биологических жидкостей, таких как слезы и слюна, человека. Сканер, используемый в этом методе, способен обнаруживать фенотип, размер и общее количество частиц ВВ из 1 мкл образца.
Аннотация
Внеклеточные везикулы (ВВ) — это структуры, которые образуются из клеток и участвуют в межклеточной коммуникации путем транспортировки биомолекул из одной клетки в другую. Было показано, что электромобили преодолевают короткие и дальние расстояния в организме и являются тканеспецифичными. ВВ содержатся не только в тканях, но и практически во всех жидкостях организма, таких как слезы, слюна, спинномозговая жидкость, кровь и т. д. Несмотря на то, что ВВ могут быть собраны неинвазивным способом из слез и слюны, за один раз можно собрать только небольшие объемы, что может вызвать проблемы с получением достаточного количества ВВ для анализа белков. Сканер, о котором идет речь в данной статье, представляет собой анализатор наночастиц, который обеспечивает решение этой проблемы, позволяя нам характеризовать и изучать фенотип, размер и общее количество частиц EV из всего лишь 1 мкл биологической жидкости. Этот протокол позволит расширить знания об ВВ из небольших объемов образцов, которые трудно извлечь у пациентов. Это может повысить комфорт пациента и потенциально определить новые терапевтические мишени для ряда заболеваний и расстройств.
Введение
Клетки взаимодействуют с соседними клетками с помощью различных сигнальных механизмов, включая высвобождение внеклеточных везикул (ВВ), которые играют ключевую роль в межклеточной коммуникации. ВВ участвуют в межклеточной коммуникации, передавая генетический груз, такой как ДНК, РНК и белки, от одной клетки к другой 1,2,3,4,5. В настоящее время существует три категории ВВ: экзосомы, микровезикулы и апоптотические тела, которые характеризуются своим размером. Экзосомы самые мелкие, диаметром 30-150 нм 6,7,8, и образуются из эндосомальной мембранной системы 9,10,11 (рисунок 1). Микровезикулы крупнее экзосом в том, что они варьируются от 100 до 1000 нм 12,13,14 и отпочковываются от плазматической мембраны 11,12,13 (рис. 1). Апоптотические тела являются самыми крупными из EV и варьируются от 1000 до 5000 нм 12,14,15, а также отпочковываются от плазматической мембраны 12,16,17 (рис. 1). Помимо размера, ВВ можно классифицировать на основе других биофизических характеристик, которые включают плотность, молекулярные маркеры, такие как CD63, CD81, CD9, а также механизм биогенеза18. Электромобили могут преодолевать короткие расстояния между соседними клетками и большие расстояния по всему телу 19,20,21,22,23. ВВ можно найти в биологических жидкостях, таких как кровь 24,25,26, спинномозговая жидкость 27,28,29, слезы 30,31,32 и слюна 33,34,35, и это лишь некоторые из них.
На сегодняшний день ультрацентрифугирование является одним из наиболее известных методов выделения ВВ из образцов 36,37,38. Этот метод требует нескольких раундов центрифугирования и ультрацентрифугирования, которые могут быть проведены путем увеличения скорости выделения EV из клеток и клеточного мусора. Этот метод может быть начат с низкой скорости с помощью грануляционных ячеек, за которыми последует средняя скорость для удаления более крупных везикул и, наконец, этап ультрацентрифугирования для гранулирования EV18. В то время как ультрацентрифугирование считается лучшим методом выделения, все еще существуют некоторые ограничения, заключающиеся в том, что оно изменяет морфологию EVs 39,40,41. Еще одним методом, используемым для выделения ВВ, является проточная цитометрия, которая подчеркивает преимущества оценки нескольких временных точек и конечных точек, а также высокопроизводительного анализа одного ВВ. Тем не менее, ограничения проточной цитометрии включают, помимо прочего, закупорку пор и слабые сигналы. Другим используемым подходом является градиентное центрифугирование, при котором используются материалы с разной плотностью для центрифугирования с электромобилями и что позволяет лучше отделить электромобили по сравнению с ультрацентрифугированием. Несмотря на то, что этот метод улучшает сепарацию, он является трудоемким, занимает много времени и может привести к значительным потерям образца. Кроме того, осадки и фильтрация также могут использоваться для изоляции электромобилей. Оба эти метода просты и быстры, но оба могут привести к загрязнению пробы. Несмотря на то, что существует несколько методов изоляции электромобилей, каждый из них имеет свои преимущества и ограничения, которые перечислены ниже (Таблица 1) 42,43,44,45,46,47,48,49,50,51,52,53,54. 55, 56,57,58,59,60,61,62,63,64,65,66,67.
После того, как ВВ были выделены, можно провести молекулярный анализ для определения их характеристик. Вестерн-блоттинг является распространенным анализом для поиска экспрессии поверхностных и грузовых белков 68,69,70, а полимеразная цепная реакция (ПЦР) используется для экспрессии микроРНК 71,72,73 для EV 74,75,76. Эти анализы установлены и могут дать интригующие результаты. Ограничением этих методов является то, что они требуют большого количества белков или РНК из EV для получения значения77, что является проблемой для образцов с небольшим объемом или концентрацией EV.
Анализатор наночастиц, рассмотренный в данной статье, позволяет пользователю преодолеть многие ограничения, указанные в Таблице 1 и Таблице 2 78,79,80,81,82,83,84,85,86,87,88,89,90 . Этот метод не требует использования методов изоляции, что поможет преодолеть снижение производительности электромобилей. Этот метод также позволяет пользователю анализировать поверхностные и грузовые белки, общее количество EV и размер EV из образца объемом всего 1 мкл. Это делается с помощью чипов тетраспанина, предоставленных компанией, которая использует микрочип антител с антителами тетраспанина, CD63, CD81 и CD9, для идентификации EV в растворе, как показано на рисунке 2. Флуоресцентные антитела подтверждают наличие EV, а также предотвращают искажение результатов загрязняющими частицами.
Общая цель этого метода — предоставить менее трудоемкий метод анализа электромобилей, а также анализ электромобилей из небольшого объема выборки. Использование этого анализатора наночастиц позволяет пользователям анализировать размер, общее количество частиц и поверхностные белки всего из 1 мкл образца, что идеально подходит для биологических жидкостей, таких как слезы и слюна.
протокол
Все описанные исследования соответствовали Хельсинкской декларации. Письменное согласие было получено от каждого субъекта до включения в исследование. Одобрение Институционального наблюдательного совета (IRB) от Университетской больницы Орхуса (1-10-72-77-14) и Института Дина Макги (1576837-2) было получено в соответствии с федеральными и институциональными рекомендациями. Перед обработкой все образцы слезы и слюны были обезличены. Все исследования были рассмотрены и одобрены Региональным институциональным наблюдательным советом Северного Техаса (#2020-030). Следующий протокол соответствует всем рекомендациям и был утвержден, как упоминалось выше.
1. День 1: Подготовка образца и инкубация
- Соберите образцы биологической жидкости, т. е. слезы и слюну у субъекта (субъектов) или разморозьте образец (образцы) из морозильной камеры.
- Разрывы: пассивно соберите разрывы из латерального мениска с помощью стеклянной капиллярной трубки.
- Поместите стеклянную капиллярную трубку на нижнее веко, стараясь не касаться роговицы.
- Соберите объем 10 мкл слез в течение 10 минут.
- Используйте слезы сразу или храните их при температуре -20 °C.
- Слюна: соберите слюну из пассивной слюны в микроцентрифужную пробирку объемом 1,5 мл
- Дайте донору скопиться слюны во рту.
- Попросите донора пустить слюни в трубку с помощью воронки.
- Используйте слюну сразу или храните при температуре -20 °C.
- Разрывы: пассивно соберите разрывы из латерального мениска с помощью стеклянной капиллярной трубки.
- Поместите чипсы тетраспанина в пластину для промывки стружки на 15 минут перед добавлением образцов, чтобы они нагрелись до комнатной температуры. При размещении стружки в лунке убедитесь, что цифры расположены нижней стороной вверх и что стружка (стружки) не касается боковых стенок скважины (лунок).
- Запишите идентификационный номер и номер чипа в блокнот, чтобы отслеживать чипы.
- Подключите универсальную последовательную шину (USB), которая идет в комплекте, извлеките и сохраните папку с соответствующим номером комплекта в указанном месте по вашему выбору.
- Пипетка 99 мкл раствора B в пробирке объемом 1,5 мл.
- Добавьте 1 мкл биологической жидкости в пробирку объемом 1,5 мл, приготовленную на предыдущем этапе.
- Вращаем трубки вниз.
- Возьмите 70 мкл раствора из шага 1.6 и нанесите пипетку на чип тетраспанина.
- Поместите пленку на пластину для промывки стружки, чтобы образец не испарился.
- Инкубировать в течение 16 часов при комнатной температуре (RT) на стенде без вибрации.
2. День 2: Промывка стружки
- Включите стиральную машину для чипов.
- Снимите пленку с шага 1.9 с пластины.
- Поместите пластину в шайбу для стружки, убедившись, что она зафиксирована на месте, и закройте крышку.
ПРИМЕЧАНИЕ: Пластина не будет легко перемещаться, если она правильно зафиксирована на месте. - Нажмите опцию CW-TETRA v0 на шайбе для стружки.
- Выберите начальный ряд и количество рядов для мытья.
- Нажмите Continue на стиральной машине для чипов.
- Пока чип(ы) промываются, приготовьте блокирующий раствор, содержащий антитела в пробирке, следующим образом:
- Приготовьте 300 мкл блокирующего раствора на каждую микросхему.
- Добавьте 0,6 мкл или каждое антитело на чип (вортекс и спин антител перед добавлением в блокирующий раствор)
- Вортекс блокирующий раствор + коктейль антител.
ПРИМЕЧАНИЕ: Накройте блокирующий раствор + коктейль антител от света, чтобы обеспечить стабильность антител. Это необходимо сделать в день использования.
- Когда промывочная машина издаст стрекотание, добавьте 250 мкл блокирующего раствора + коктейль антител поверх чипа (чипов).
- Закройте крышку и нажмите «Продолжить».
ПРИМЕЧАНИЕ: Теперь промывочная машина для стружки будет проводить 1–часовую инкубацию вместе с несколькими дополнительными циклами промывки и промывки. - Когда шайба для стружки зазвенит, снимите пластину для промывки стружки и переместите стружку (стружки) вверх по пандусу.
- Поместите пластину обратно в шайбу для стружки, убедившись, что она зафиксирована на месте. Закройте крышку и нажмите «Продолжить».
- Когда промывка для стружки завершит программу, снимите пластину и положите стружку (стружки) на бумажное полотенце. Закройте чип(ы) от света.
3. День 2: Сканирование чипа (чипов)
- Включите сканер и откройте программу сканирования.
ПРИМЕЧАНИЕ: Сканер пройдет самопроверку, чтобы определить, есть ли какие-либо ошибки или можно ли продолжить сканирование. - Выберите «Сохранить папку» и выберите место для сохранения файлов.
- Выберите ChipFile Folder и выберите папку, сохраненную на шаге 1.4.
- Выберите опцию раскрывающегося списка, чтобы выбрать каждую фишку, и найдите ее в поле «Положение стружки на патроне». Повторите этот шаг для всех чипов, которые необходимо отсканировать.
- Включите флуоресценцию, щелкнув по трем квадратам под Положением чипа. Квадраты станут желтыми, синими и красными соответственно.
- Снимите крышку патрона, нажав на крышку, и потяните ее.
- Поместите чип(ы) на патрон, убедившись, что они надежно закреплены.
- Установите крышку патрона обратно, вставив колышки в отверстия, нажмите и сдвиньте крышку, чтобы зафиксировать ее на месте.
- Поместите патрон на сцену, убедившись, что он зафиксирован на месте.
- Выберите Сканировать чипы.
- Нажмите OK.
- Как только сцена полностью переместится в машину, закройте дверцу.
ПРИМЕЧАНИЕ: Сканирование одного чипа занимает примерно 12 минут. - После того, как программа завершит сканирование чипа(ов), откройте дверцу, чтобы извлечь столик и проверить, было ли сканирование успешным.
- Если сканирование прошло успешно, выбросьте микросхемы и поместите следующий набор микросхем на патрон или верните пустой патрон на стол. Затем выйдите из программного обеспечения и выключите машину, когда закончите.
- Если сканирование не увенчалось успехом, посмотрите на код ошибки и исправьте ошибку.
4. Обработка данных
- Откройте программу для анализа.
- Выберите Данные предварительного сканирования и выберите папку, в которой выполняется сканирование из Дня 2, шаг 3.2.
- Нажмите кнопку Далее.
- Пометьте чипы в столбце «Имя образца » именем образца, щелкнув ячейку и введя идентификатор образца.
- Затем пометьте тетраспанинов в столбце «Имя канала ». Красный = CD63, зеленый = CD81, а синий = CD9.
- Нажмите кнопку Далее.
- Выберите High CV в группе Select Spot (Выбрать точку ), чтобы проверить раскрывающийся список и отключить высокие CV для каждой микросхемы, отключив одну или две точки.
- Затем выберите Большое количество и попробуйте отключить предупреждения с большим числом.
ПРИМЕЧАНИЕ: Некоторые образцы могут иметь слишком большое количество, но они все еще могут быть проанализированы. - Выберите «Все пятна » в раскрывающемся меню, выберите «Точечный монтаж» и визуально проверьте каждый скол на наличие деформаций или царапин, которые могут присутствовать.
- Нажмите кнопку Далее.
- В канале CD63 установите минимальное значение 300, чтобы избавиться от эритроцитов в строке Среднее % включено; желтые клетки в порядке, и переходят к каналу CD81. Если установка минимального значения 300 не приводит к изменению красной ячейки на желтую или белую, перейдите к шагу 4.14 для устранения неполадок.
- В канале CD81 установите минимальное значение 300, чтобы избавиться от эритроцитов в строке Средний % включено; желтые клетки находятся в хорошем состоянии и переходят в канал CD9. Если установка минимального значения 300 не приводит к изменению красной ячейки на желтую или белую, перейдите к шагу 4.14 для устранения неполадок.
- В канале CD9 установите минимальное значение 400, чтобы избавиться от эритроцитов в строке Средний % включено; Желтые клетки в порядке, и перейдите к шагу 4.15. Если установка минимального значения 400 не приводит к изменению красной ячейки на желтую или белую, перейдите к шагу 4.14 для устранения неполадок.
- Устранение неполадок
- Увеличьте минимальное значение на 100 единиц.
- Если шаг 4.14.1 не сработал, то выберите фишку в разделе Pick Chips для работы и выберите фишку. Выберите «Количество частиц » и отключите точки с большим количеством частиц. Выберите Интенсивность/Размер, выберите Все фишки и посмотрите, решит ли это проблему.
- Если шаг 4.14.2 не сработал, выберите чип в разделе Pick Chips to work и выберите чип. Выберите Single-Chip Cutoffs и увеличьте минимальное значение на 100 единиц. Затем выберите «Все фишки », чтобы увидеть, стала ли красная ячейка желтой. Если это не помогло, повторяйте этот шаг до тех пор, пока ячейка Среднее % включено не станет желтой или белой.
- Нажмите кнопку Далее.
- Снимите флажок с канала мгновенных сообщений.
- Установите значение тепловой карты в правом нижнем углу, чтобы включить все частицы, и выберите «Добавить график в отчет».
- Настройте максимальное число в выпадающем списке и вручную введите значение.
- Затем выберите раскрывающееся меню в верхней части в разделе «Зонды захвата » и выберите CD63.
- Выберите «Добавить график в отчет», чтобы добавить в отчет общее количество частиц.
- Выберите ниспадающее меню в разделе Режим анализа, выберите Колокализация и Добавить график в отчет.
- Затем выберите Размер, выберите Изменить вид на График и выберите Добавить график в отчет.
- Наконец, выберите «Изображения» и нажмите «Добавить график в отчет».
- Повторите шаги 4.18–4.22 для CD81 и CD9, каждый раз отменяя выбор канала IM.
- После того как все элементы будут добавлены в отчет, выберите «Экспорт отчета», убедитесь, что он сохраняется в нужном файле, и выберите «Папка».
ПРИМЕЧАНИЕ: Файлы и изображения Excel были сгенерированы и теперь могут быть использованы для дальнейшего анализа.
Результаты
При анализе пятен на чипах стремитесь к оптимальной концентрации EV, наблюдая за флуоресцентно помеченными EV в каналах CD63, CD81 и CD9, при этом канал MIgG30,91 должен оставаться черным, так как это канал управления, как показано на рисунке 3A. CD81 будет снижен для биологических жидкостей. Если флуоресценция отсутствует в каналах CD63, CD81 и CD9, то отсутствуют ВВ (рис. 3B). Будьте осторожны, чтобы не перенасытить чип (рисунок 3C). Это затруднит для аналитического программного обеспечения расчет точности размера, общего количества частиц и фенотипов электромобилей. Из точек оптимальной концентрации аналитическое программное обеспечение сможет измерить размер (50-200 нм), общее количество частиц и экспрессию тетраспанина EV (рис. 4) и будет экспортировано в отдельные таблицы для дальнейшего анализа. Анализ тетраспанина будет включать колокализацию поверхностных белков на EV. Колокализация будет представлена знаком "/", например, "CD63/CD81". Это не означает, что CD63 и CD81 объединены; это означает, что и CD63, и CD81 расположены на поверхности электромобиля.
Эти результаты позволят получить ценную информацию о здоровых и больных образцах. Мы сможем определить, производят ли здоровые или больные образцы больше EV, больше или меньше EV, а также фенотип EV. Любая или все эти характеристики могут играть роль в биогенезе и/или прогрессировании заболевания. С помощью этих результатов мы сможем увидеть, есть ли отсутствие или повышение уровня тетраспанина, что может дать представление о клеточных процессах и образовании ВВ.
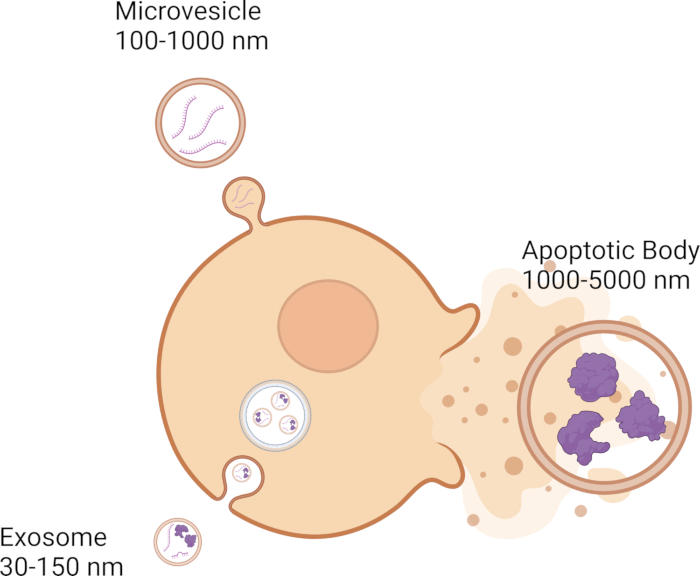
Рисунок 1: Типы и размеры различных электромобилей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
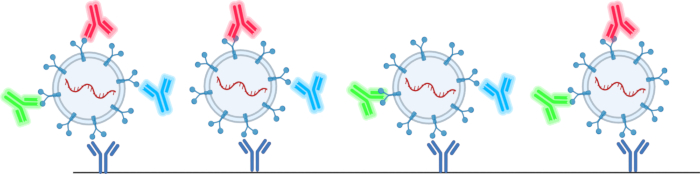
Рисунок 2: Схема того, как чипы тетраспанина захватывают и обнаруживают электромобили. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
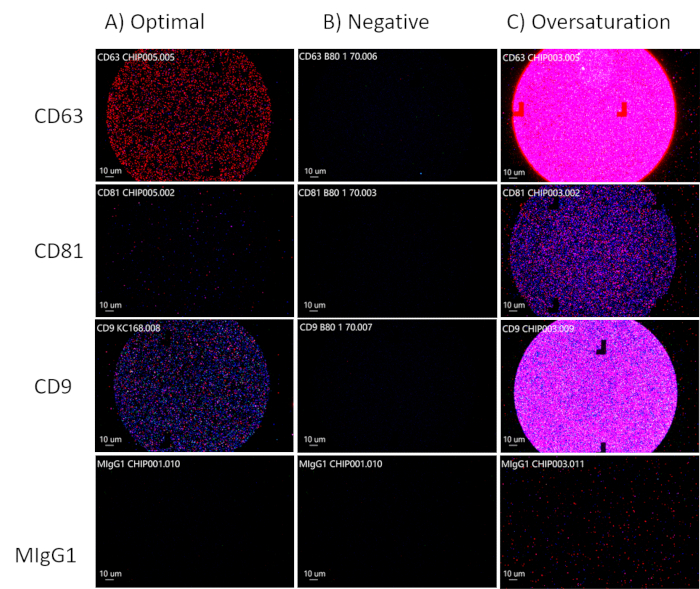
Рисунок 3: Оптимизация концентраций EV. (A) Оптимальная концентрация EV. (B) Отрицательный результат: нет электромобилей. (c) Перенасыщение электромобилями. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
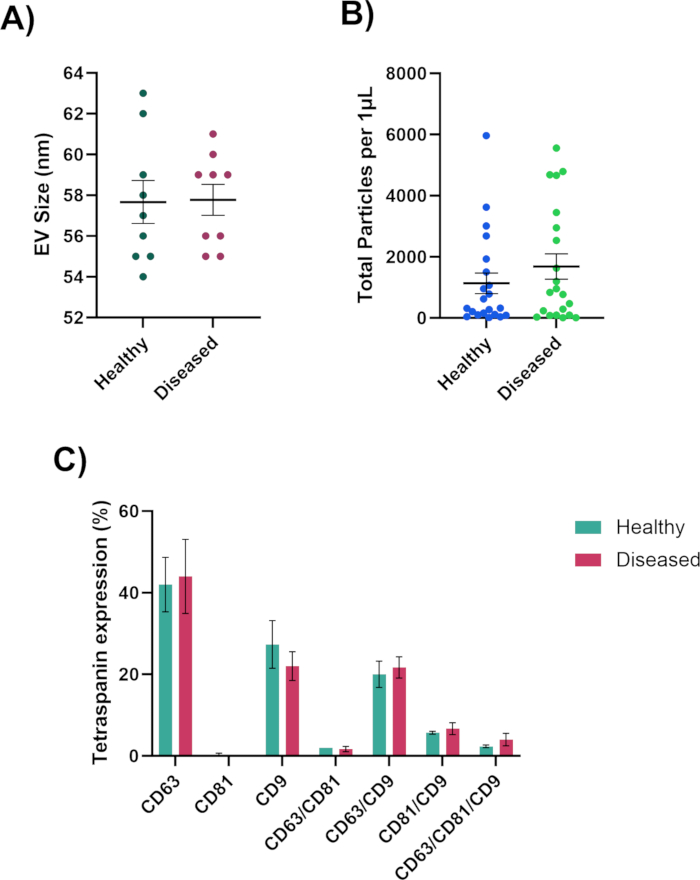
Рисунок 4: Данные, полученные с помощью анализатора наночастиц. (A) Размер диаметра EV измеряется в нанометрах. (B) Общее количество частиц EV. (C) Колокализованный фенотип EV. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Техника | Преимущества | Ограничения |
| Ультрацентрифуга | Высокая чистота42,43 | Изменения морфологии EV42,44 |
| Однородность42,45 | Требуется большой объем42,44,46 | |
| Функциональные возможности42,43 | Дорого42,43 | |
| Проточная цитометрия | Оценка образцов в нескольких временных точках47 | Слабый сигнал48,49 |
| Несколько конечных точек47,50 | Закупоренные поры51 | |
| Высокопроизводительный анализ одиночного электромобиля52,53 | ||
| Центрифугирование с градиентом плотности | Производство образцов высокой чистоты54 | Трудоемкий55,56 |
| Разнообразие образцов55,57 | Трудоемкий55,58 | |
| Значительные потери урожая54 | ||
| Осадки | Простой59,60 | Загрязнение36,44,61 |
| Быстрый61,62 | Неспецифические63 | |
| Высокая доходность44,59,62 | ||
| Нейтральный pH36 | ||
| Фильтрация | Симпл64 | Экзосомыловушек 65 |
| Быстрый64 | Повреждает крупные везикулы36 | |
| Недорого64 | Фильтрационный торт66,67 | |
| Закупорка экзосом65 |
Таблица 1: Преимущества и ограничения методов изоляции электромобилей. Список различных способов изоляции электромобилей, включая их преимущества и ограничения.
| Техника | Преимущества | Ограничения |
| Динамическое рассеяние света | Измерение частиц размером от 1 нм до 6 μМ78 | Не подходит для измерения сложных образцов экзосом с большим размерным диапазоном79 |
| Нижний предел – 10 нм, подходит для монодисперсных систем79 | Неспособность отличать загрязненные белки от экзосом79 | |
| Просвечивающая электронная микроскопия (ПЭМ) | Изучение морфологии экзосом79,80 | Подготовка сложных образцов79 |
| Наблюдение за внутренней структурой81 | Неспособность различать экзосомы по размеру и форме из-за преувеличенных сигналов флуоресценции82 | |
| Анализ отслеживания наночастиц | Измерение концентрации, размеров и распределения экзосом по размерам в диапазоне от 10 нм до 2 мкМ78 | Не может отличить EV от белковых агрегатов и других загрязнителей83 |
| Быстрая подготовка образцов и измерение78,84 | Дорогой прибор NTA85 | |
| Образцы могут быть восстановлены в нативной форме84 | Чувствительность к вибрациям85 | |
| Вестерн-блот (WBs) | может качественно и количественно анализировать маркерные белки79,86 | Сложность и трудоемкость79 |
| Анализ экзосом из сред клеточных культур79 | Изоляты EV могут содержать липопротеины и другие загрязнители86 | |
| Проточная цитометрия | Более высокая чувствительность и высокое разрешение для получения изображений | Трудоемкий и трудоемкий с пределом обнаружения 400 нм79,88 |
| Отличить окрашенные экзосомы от содержательных конструкций87 | ||
| Требуемая низкая концентрация образца79 | Оптические сигналы снижают точность и разрешающую способность88 | |
| Экзовид | Измерение тетраспанинов (CD9, CD63 и CD81) на экзосомах89 | Не измеряет большие размеры электромобилей75 |
| Измеряет EV грузовые белки90 |
Таблица 2: Преимущества и ограничения методов определения характеристик электромобилей.
Обсуждение
Наиболее важным шагом в этом протоколе является достижение оптимальной концентрации электромобилей. Для получения показаний должно присутствовать достаточное количество электромобилей, но не слишком много электромобилей, которые перенасытят чип. Лучший способ определить оптимальную концентрацию EV — провести оптимизацию с 1 мкл образца и посмотреть, нужно ли корректировать концентрацию. Еще один важный шаг — увидеть, есть ли в образце обилие клеточного мусора, что можно определить, просмотрев большие куски на чипах в программном обеспечении для анализа. Если в образце есть клеточный мусор, простое центрифугирование или фильтрация образца должны решить эту проблему.
Дополнительным, важным шагом является обеспечение того, чтобы стружка (стружки) не касалась стенок скважины, и избегание контакта с центральной областью стружки (стружки) при их размещении вверх по пандусу. Сканер будет считывать данные с квадрата в центре чипа, поэтому важно избегать прикосновения к этой области щипцами, чтобы не нарушить работу электромобилей.
Этот метод имеет некоторые ограничения, такие как недостаточная концентрация EV для обнаружения прибором. Концентрацию можно повысить либо путем сушки образца, либо с помощью концентрационной трубки. Еще одним ограничением является то, что аналитическое программное обеспечение измеряет EV только в диапазоне 50-200 нм, исключая некоторые микровезикулы и все апоптотические тела из измерений размера75.
Существует множество способов изоляции (Таблица 1 42,43,44,45,46,47,48,49,50,51,52, 53,54,55,56,57,58,59,60, 61,62,63,64,65,66,67) и проанализировать электромобили (Таблица 2 78,79,80,81,82,83,84,85, 86,87,88,89,90), а текущим золотым стандартом для выделения EV является ультрацентрифугирование 36,37,38 для гранулирования клеток для таких анализов, как вестерн-блоттинг 68,69,70 и ПЦР 71,72,73,74,75,76. Хотя этот протокол хорошо работает для больших образцов 42,44,46, получение биологических жидкостей может быть сложной задачей, и часто за один раз можно собрать только небольшой объем образцов, что не является идеальным для ультрацентрифугирования. В отличие от этого, использование этого анализатора наночастиц позволяет пользователю получать ценные данные, такие как размер, общее количество частиц и фенотип EV, всего в 1 μл образца, что делает его идеальным для биологических жидкостей. Мы сможем расширить знания об электромобилях на основе небольших объемов образцов, которые трудно извлечь, что может повысить комфорт пациента и, возможно, найти потенциальные терапевтические мишени для различных заболеваний и расстройств.
Раскрытие информации
Авторы не имеют конкурирующих финансовых интересов или других конфликтов интересов, которые можно было бы раскрыть.
Благодарности
Мы хотели бы поблагодарить NIH за финансирование (EY031316 и EY034714). Мы также хотели бы поблагодарить UNTHSC и NTERI за лабораторное пространство.
Материалы
| Name | Company | Catalog Number | Comments |
| ChipWasher 100 | NanoView | EV-CW100 | Incubates, washes, rinses and dries the tetraspanin chips. This current model is no longer available. Price at time of purchase: $9,995.00 |
| ExoView Analyzer software | NanoView | N/A | Analyzes the chip informations and produces excel files for further analysis. No longer available. |
| ExoView R100 | NanoView | EV-R100 | Used to scan the tetraspanin chips at 3 wavelengths. This current model is no longer available. Price at time of purchase: $110,000.00 |
| ExoView Scanner software | NanoView | N/A | Scans the chips at 3 different wavelengths. No longer available. |
| Human Tetraspanin Kits | Unchained Labs | EV-TETRA-C | Includes 8 tetraspanin chips, Incubation Solution, Blocking Solution, CD63 antibody, CD81 antibody, CD9 antibody, Solution A, Solution B, USB, and plate cover. |
Ссылки
- Abels, E. R., Breakefield, X. O. Introduction to extracellular vesicles: Biogenesis, RNA cargo selection, content, release, and uptake. Cell Mol Neurobiol. 36 (3), 301-312 (2016).
- Radler, J., Gupta, D., Zickler, A., Andaloussi, S. E. Exploiting the biogenesis of extracellular vesicles for bioengineering and therapeutic cargo loading. Mol Ther. 31 (5), 1231-1250 (2023).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Adv Drug Deliv Rev. 178, 113961 (2021).
- Dixson, A. C., Dawson, T. R., Di Vizio, D., Weaver, A. M. Context-specific regulation of extracellular vesicle biogenesis and cargo selection. Nat Rev Mol Cell Biol. 24 (7), 454-476 (2023).
- Keshtkar, S., Azarpira, N., Ghahremani, M. H. Mesenchymal stem cell-derived extracellular vesicles: novel frontiers in regenerative medicine. Stem Cell Res Ther. 9 (1), 63 (2018).
- Zhang, H., et al. Exosome-induced regulation in inflammatory bowel disease. Front Immunol. 10, 1464 (2019).
- Barzin, M., et al. Application of plant-derived exosome-like nanoparticles in drug delivery. Pharm Dev Technol. 28 (5), 383-402 (2023).
- Zhou, C., et al. Stem cell-derived exosomes: emerging therapeutic opportunities for wound healing. Stem Cell Res Ther. 14 (1), 107 (2023).
- Kalluri, R., LeBleu, V. S. The biology, function, and biomedical applications of exosomes. Science. 367 (6478), aau6977 (2020).
- Mondal, J., et al. Hybrid exosomes, exosome-like nanovesicles and engineered exosomes for therapeutic applications. J Control Release. 353, 1127-1149 (2023).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nat Rev Mol Cell Biol. 19 (4), 213-228 (2018).
- Paul, N., Sultana, Z., Fisher, J. J., Maiti, K., Smith, R. Extracellular vesicles- crucial players in human pregnancy. Placenta. 140, 30-38 (2023).
- Zaldivia, M. T. K., McFadyen, J. D., Lim, B., Wang, X., Peter, K. Platelet-derived microvesicles in cardiovascular diseases. Front Cardiovasc Med. 4, 74 (2017).
- Tamasi, V., Nemeth, K., Csala, M. Role of extracellular vesicles in liver diseases. Life (Basel). 13 (5), 1117 (2023).
- Fu, Y., et al. Emerging understanding of apoptosis in mediating mesenchymal stem cell therapy. Cell Death Dis. 12 (6), 596 (2021).
- Santavanond, J. P., Rutter, S. F., Atkin-Smith, G. K., Poon, I. K. H. Apoptotic bodies: Mechanism of formation, isolation and functional relevance. Subcell Biochem. 97, 61-88 (2021).
- Yu, L., et al. Apoptotic bodies: bioactive treasure left behind by the dying cells with robust diagnostic and therapeutic application potentials. J Nanobiotechnology. 21 (1), 218 (2023).
- Momen-Heravi, F., Getting, S. J., Moschos, S. A. Extracellular vesicles and their nucleic acids for biomarker discovery. Pharmacol Ther. 192, 170-187 (2018).
- Liu, Y. J., Wang, C. A review of the regulatory mechanisms of extracellular vesicles-mediated intercellular communication. Cell Commun Signal. 21 (1), 77 (2023).
- Grange, C., Bussolati, B. Extracellular vesicles in kidney disease. Nat Rev Nephrol. 18 (8), 499-513 (2022).
- Cocucci, E., Meldolesi, J. Ectosomes and exosomes: shedding the confusion between extracellular vesicles. Trends Cell Biol. 25 (6), 364-372 (2015).
- Iannotta, D. A. A., Kijas, A. W., Rowan, A. E., Wolfram, J. Entry and exit of extracellular vesicles to and from the blood circulation. Nat Nanotechnol. 19 (1), 13-20 (2024).
- Saint-Pol, J., Gosselet, F., Duban-Deweer, S., Pottiez, G., Karamanos, Y. Targeting and crossing the blood-brain barrier with extracellular vesicles. Cells. 9 (4), 851 (2020).
- Alberro, A., Iparraguirre, L., Fernandes, A., Otaegui, D. Extracellular vesicles in blood: Sources, effects, and applications. Int J Mol Sci. 22 (15), 8163 (2021).
- Nieuwland, R., Siljander, P. R. A beginner's guide to study extracellular vesicles in human blood plasma and serum. J Extracell Vesicles. 13 (1), e12400 (2024).
- Thangaraju, K., Neerukonda, S. N., Katneni, U., Buehler, P. W. Extracellular vesicles from red blood cells and their evolving roles in health, coagulopathy and therapy. Int J Mol Sci. 22 (1), 153 (2020).
- Li, C., et al. Cerebrospinal fluid-derived extracellular vesicles after spinal cord injury promote vascular regeneration via PI3K/AKT signaling pathway. J Orthop Translat. 39, 124-134 (2023).
- Deng, Y., et al. Phosphoproteome analysis of cerebrospinal fluid extracellular vesicles in primary central nervous system lymphoma. Analyst. 148 (15), 3594-3602 (2023).
- Hirschberg, Y., et al. Proteomic comparison between non-purified cerebrospinal fluid and cerebrospinal fluid-derived extracellular vesicles from patients with Alzheimer's, Parkinson's and Lewy body dementia. J Extracell Vesicles. 12 (12), e12383 (2023).
- Hefley, B. S., et al. Revealing the presence of tear extracellular vesicles in Keratoconus. Exp Eye Res. 224, 109242 (2022).
- Cross, T., et al. RNA profiles of tear fluid extracellular vesicles in patients with dry eye-related symptoms. Int J Mol Sci. 24 (20), 15390 (2023).
- Ma, H., et al. Metabolic signatures of tear extracellular vesicles caused by herpes simplex keratitis. Ocul Surf. 31, 21-30 (2024).
- Han, P., Bartold, P. M., Ivanovski, S. The emerging role of small extracellular vesicles in saliva and gingival crevicular fluid as diagnostics for periodontitis. J Periodontal Res. 57 (1), 219-231 (2022).
- Han, P., Li, X., Wei, W., Ivanovski, S. Saliva diagnosis using small extracellular vesicles and salivaomics. Methods Mol Biol. 2588, 25-39 (2023).
- Reseco, L., et al. Characterization of extracellular vesicles from human saliva: Effects of age and isolation techniques. Cells. 13 (1), 95 (2024).
- Tiwari, S., Kumar, V., Randhawa, S., Verma, S. K. Preparation and characterization of extracellular vesicles. Am J Reprod Immunol. 85 (2), e13367 (2021).
- Tomiyama, E., Fujita, K., Nonomura, N. Urinary extracellular vesicles: Ultracentrifugation method. Methods Mol Biol. 2292, 173-181 (2021).
- Xu, K., Jin, Y., Li, Y., Huang, Y., Zhao, R. Recent progress of exosome isolation and peptide recognition-guided strategies for exosome research. Front Chem. 10, 844124 (2022).
- Brennan, K., et al. A comparison of methods for the isolation and separation of extracellular vesicles from protein and lipid particles in human serum. Sci Rep. 10 (1), 1039 (2020).
- Gao, J., et al. Recent developments in isolating methods for exosomes. Front Bioeng Biotechnol. 10, 1100892 (2022).
- Mol, E. A., Goumans, M. J., Doevendans, P. A., Sluijter, J. P. G., Vader, P. Higher functionality of extracellular vesicles isolated using size-exclusion chromatography compared to ultracentrifugation. Nanomedicine. 13 (6), 2061-2065 (2017).
- Ansari, F. J., et al. Comparison of the efficiency of ultrafiltration, precipitation, and ultracentrifugation methods for exosome isolation. Biochem Biophys Rep. 38, 101668 (2024).
- Patel, G. K., et al. Comparative analysis of exosome isolation methods using culture supernatant for optimum yield, purity and downstream applications. Sci Rep. 9 (1), 5335 (2019).
- Stam, J., Bartel, S., Bischoff, R., Wolters, J. C. Isolation of extracellular vesicles with combined enrichment methods. J Chromatogr B Analyt Technol Biomed Life Sci. 1169, 122604 (2021).
- Le Roy, A., et al. AUC and small-angle scattering for membrane proteins. Methods Enzymol. 562, 257-286 (2015).
- Chhoy, P., Brown, C. W., Amante, J. J., Mercurio, A. M. Protocol for the separation of extracellular vesicles by ultracentrifugation from in vitro cell culture models. STAR Protoc. 2 (1), 100303 (2021).
- McDorman, K. S., Chan, C., Rojko, J., Satterwhite, C. M., Morrison, J. P. . Chapter 7 - Special Techniques in Toxicologic Pathology. Haschek and Rousseaux's Handbook of Toxicologic Pathology (Third Edition). , (2013).
- Woud, W. W., et al. An imaging flow cytometry-based methodology for the analysis of single extracellular vesicles in unprocessed human plasma. Commun Biol. 5 (1), 633 (2022).
- Gul, B., Syed, F., Khan, S., Iqbal, A., Ahmad, I. Characterization of extracellular vesicles by flow cytometry: Challenges and promises. Micron. 161, 103341 (2022).
- Black, C. B., Duensing, T. D., Trinkle, L. S., Dunlay, R. T. Cell-based screening using high-throughput flow cytometry. Assay Drug Dev Technol. 9 (1), 13-20 (2011).
- Safford, H. R., Bischel, H. N. Flow cytometry applications in water treatment, distribution, and reuse: A review. Water Res. 151, 110-133 (2019).
- Kobayashi, H., et al. Precise analysis of single small extracellular vesicles using flow cytometry. Sci Rep. 14 (1), 7465 (2024).
- Welsh, J. A., et al. A compendium of single extracellular vesicle flow cytometry. J Extracell Vesicles. 12 (2), e12299 (2023).
- Carnino, J. M., Lee, H. Extracellular vesicles in respiratory disease. Adv Clin Chem. 108, 105-127 (2022).
- Sun, Y., Sethu, P. Low-stress microfluidic density-gradient centrifugation for blood cell sorting. Biomed Microdevices. 20 (3), 77 (2018).
- Strachan, B. C., Xia, H., Voros, E., Gifford, S. C., Shevkoplyas, S. S. Improved expansion of T cells in culture when isolated with an equipment-free, high-throughput, flow-through microfluidic module versus traditional density gradient centrifugation. Cytotherapy. 21 (2), 234-245 (2019).
- Malvezzi, H., Sharma, R., Agarwal, A., Abuzenadah, A. M., Abu-Elmagd, M. Sperm quality after density gradient centrifugation with three commercially available media: a controlled trial. Reprod Biol Endocrinol. 12, 121 (2014).
- Sun, Y., Sethu, P. Microfluidic adaptation of density-gradient centrifugation for isolation of particles and cells. Bioengineering (Basel). 4 (3), 67 (2017).
- Karttunen, J., et al. Precipitation-based extracellular vesicle isolation from rat plasma co-precipitate vesicle-free microRNAs. J Extracell Vesicles. 8 (1), 1555410 (2019).
- De Sousa, K. P., et al. Isolation and characterization of extracellular vesicles and future directions in diagnosis and therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 15 (1), e1835 (2023).
- Sidhom, K., Obi, P. O., Saleem, A. A review of exosomal isolation methods: Is size exclusion chromatography the best option. Int J Mol Sci. 21 (18), 6466 (2020).
- Coughlan, C., et al. Exosome isolation by ultracentrifugation and precipitation and techniques for downstream analyses. Curr Protoc Cell Biol. 88 (1), e110 (2020).
- Konoshenko, M. Y., et al. Isolation of extracellular vesicles from biological fluids via the aggregation-precipitation approach for downstream miRNAs detection. Diagnostics (Basel). 11 (3), 384 (2021).
- Drozdz, A., et al. Low-vacuum filtration as an alternative extracellular vesicle concentration method: A comparison with ultracentrifugation and differential centrifugation. Pharmaceutics. 12 (9), 872 (2020).
- Akbar, A., Malekian, F., Baghban, N., Kodam, S. P., Ullah, M. Methodologies to isolate and purify clinical grade extracellular vesicles for medical applications. Cells. 11 (2), 186 (2022).
- Chen, J., et al. Review on strategies and technologies for exosome isolation and purification. Front Bioeng Biotechnol. 9, 811971 (2021).
- Helling, A., et al. Investigation of microbial cell deformability by filter cake compressibility using ultrafiltration membranes. Colloids Surf B Biointerfaces. 185, 110626 (2020).
- Bagci, C., et al. Overview of extracellular vesicle characterization techniques and introduction to combined reflectance and fluorescence confocal microscopy to distinguish extracellular vesicle subpopulations. Neurophotonics. 9 (2), 021903 (2022).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- van Maanen, J. C., et al. A combined western and bead-based multiplex platform to characterize extracellular vesicles. Tissue Eng Part C Methods. 29 (11), 493-504 (2023).
- Xu, D., et al. MicroRNAs in extracellular vesicles: Sorting mechanisms, diagnostic value, isolation, and detection technology. Front Bioeng Biotechnol. 10, 948959 (2022).
- Lee, H., He, X., Le, T., Carnino, J. M., Jin, Y. Single-step RT-qPCR for detection of extracellular vesicle microRNAs in vivo: a time- and cost-effective method. Am J Physiol Lung Cell Mol Physiol. 318 (4), L742-L749 (2020).
- Kim, J. A., et al. Small RNA sequencing of circulating small extracellular vesicles microRNAs in patients with amyotrophic lateral sclerosis. Sci Rep. 13 (1), 5528 (2023).
- Fan, Y., et al. Differential proteomics argues against a general role for CD9, CD81 or CD63 in the sorting of proteins into extracellular vesicles. J Extracell Vesicles. 12 (8), e12352 (2023).
- Silva, A. M., et al. Quantification of protein cargo loading into engineered extracellular vesicles at single-vesicle and single-molecule resolution. J Extracell Vesicles. 10 (10), e12130 (2021).
- Salunkhe, S., Basak Dheeraj, M., Chitkara, D., Mittal, A. Surface functionalization of exosomes for target-specific delivery and in vivo imaging, tracking: Strategies and significance. J Control Release. 326, 599-614 (2020).
- Silva, A. K. A., et al. Development of extracellular vesicle-based medicinal products: A position paper of the group "Extracellular Vesicle translatiOn to clinicaL perspectiVEs - EVOLVE France". Adv Drug Deliv Rev. 179, 114001 (2021).
- Gurunathan, S., Kang, M. H., Jeyaraj, M., Qasim, M., Kim, J. H. Review of the isolation, characterization, biological function, and multifarious therapeutic approaches of exosomes. Cells. 8 (4), 307 (2019).
- Zhang, Y., et al. Exosome: A review of its classification, isolation techniques, storage, diagnostic and targeted therapy applications. Int J Nanomedicine. 15, 6917-6934 (2020).
- Colombo, M., Raposo, G., Thery, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu Rev Cell Dev Biol. 30, 255-289 (2014).
- Pisitkun, T., Shen, R. F., Knepper, M. A. Identification and proteomic profiling of exosomes in human urine. Proc Natl Acad Sci U S A. 101 (36), 13368-13373 (2004).
- Zaborowski, M. P., Balaj, L., Breakefield, X. O., Lai, C. P. Extracellular vesicles: Composition, biological relevance, and methods of study. Bioscience. 65 (8), 783-797 (2015).
- Kowkabany, G., Bao, Y. Nanoparticle tracking analysis: An effective tool to characterize extracellular vesicles. Molecules. 29 (19), 4672 (2024).
- Li, H. Metastatic characteristics of SY86B human gastric carcinoma in athymic nude mice. Zhonghua Zhong Liu Za Zhi. 10 (6), 421-423 (1988).
- Zhao, Z., Wijerathne, H., Godwin, A. K., Soper, S. A. Isolation and analysis methods of extracellular vesicles (EVs). Extracell Vesicles Circ Nucl Acids. 2, 80-103 (2021).
- Gandham, S., et al. Technologies and standardization in research on extracellular vesicles. Trends Biotechnol. 38 (10), 1066-1098 (2020).
- van der Vlist, E. J., Nolte-'t Hoen, E. N., Stoorvogel, W., Arkesteijn, G. J., Wauben, M. H. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nat Protoc. 7 (7), 1311-1326 (2012).
- Pospichalova, V., et al. Simplified protocol for flow cytometry analysis of fluorescently labeled exosomes and microvesicles using dedicated flow cytometer. J Extracell Vesicles. 4, 25530 (2015).
- Breitwieser, K., et al. Detailed characterization of small extracellular vesicles from different cell types based on tetraspanin composition by ExoView R100 platform. Int J Mol Sci. 23 (15), 8544 (2022).
- An, H. J., Cho, H. K., Song, D. H., Kee, C. Quantitative analysis of exosomes in the aqueous humor of Korean patients with pseudoexfoliation glaucoma. Sci Rep. 12 (1), 12875 (2022).
- Hefley, B. S., McKay, T. B., Hutcheon, A. E. K., Ciolino, J. B., Karamichos, D. Corneal epithelial-stromal constructs to study differences associated with diabetes mellitus. Exp Eye Res. 248, 110100 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены