Method Article
חילוץ מודול הצעירים של ממברנות הבסיס הריאתיות של עכברים מקומיים ממפות כוח הנגזרות ממיקרוסקופ כוח אטומי
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מדמיין כיצד להכין חתכים קריוגרפיים של רקמת ריאה של עכברים, לבצע ניסויים במפת כוח במיקרוסקופ כוח אטומי ולנתח את הנתונים כדי לקבוע את המודול של יאנג של קרום הבסיס הריאתי המקומי של העכבר.
Abstract
מיקרוסקופ כוח אטומי (AFM) מאפשר לאפיין את התכונות המכניות של דגימה ברזולוציה מרחבית של כמה עשרות ננומטרים. מכיוון שתאי יונקים חשים ומגיבים למכניקה של המיקרו-סביבה המיידית שלהם, אפיון התכונות הביומכניות של רקמות ברזולוציה מרחבית גבוהה הוא חיוני להבנת תהליכים התפתחותיים, הומאוסטטיים ופתולוגיים שונים. קרום הבסיס (BM), תת-מבנה מטריצה חוץ-תאית (ECM) דק של כ-100 - 400 ננומטר, ממלא תפקיד משמעותי בהתקדמות הגידול ובהיווצרות גרורות. למרות שקביעת המודול של יאנג של תשתית ECM דקה כל כך היא מאתגרת, נתונים ביומכניים של ה-BM מספקים תובנות חדשות בסיסיות לגבי האופן שבו ה-BM משפיע על התנהגות התאים, ובנוסף, מציעים פוטנציאל אבחון יקר ערך. כאן, אנו מציגים פרוטוקול ויזואלי להערכת מכניקת BM ברקמת הריאה של העכבר, שהיא אחד האיברים העיקריים המועדים לגרורות. אנו מתארים זרימת עבודה יעילה לקביעת מודול יאנג של ה-BM, הממוקם בין שכבות תאי האנדותל והאפיתל ברקמת הריאה. ההוראות שלב אחר שלב כוללות הקפאת רקמת ריאה של עכברים, הקפאה ורישום מפת כוח AFM על קטעי רקמות. בנוסף, אנו מספקים הליך ניתוח נתונים חצי אוטומטי באמצעות CANTER Processing Toolbox, תוכנת ניתוח נתונים AFM ידידותית למשתמש שפותחה על ידי החברה. כלי זה מאפשר טעינה אוטומטית של מפות כוח מוקלטות, המרת כוח לעומת עקומות הארכת פיזו לעקומות כוח מול כניסה, חישוב המודולים של יאנג ויצירת מפות המודול של יאנג. לבסוף, הוא מראה כיצד לקבוע ולבודד את ערכי המודול של יאנג הנגזרים מה-BM הריאתי באמצעות שימוש בכלי סינון מרחבי.
Introduction
מפות כוח AFM התגלו כטכניקה בשימוש נרחב לקביעת התכונות הננו-מכניות של מגוון רחב של דגימות ביולוגיות עם רזולוציה מרחבית ננומטרית ורגישות לכוח פיקונוטון 1,2,3,4,5,6,7,8,9,10,11,12 . מחקר חלוצי על יישום מדידות AFM לדגימות ביולוגיות בתנאים פיזיולוגיים נערך על ידי P. Hansma ועמיתיו 13,14,15,16,17,18,19,20. לאחר מכן, נעשה שימוש במדידות כוח AFM כדי להעריך את התכונות המכניות של מולקולות בודדות21, תאים חיים ושלד התא שלהם 9,10,22,23,24,25,26, רקמות וקטעי רקמות 6,8,11,27,28, 29,30,31, כמו גם הידרוג'לים ביולוגיים 3,4,32. במחקר שלנו, השתמשנו ב-AFM כדי לבחון את התכונות המכניות של קשרים ביולוגיים וכימיים 18,33,34,35,36,37 ולמדוד את המאפיינים הננו-מכניים של תאים בודדים 38,39,40. יתר על כן, מדידות של סחוס לוחית גדילה8 הראו כי ארכיטקטורת הקולגן ומודול יאנג של המטריצה החוץ-תאית (ECM) מכוונים את חלוקת הכונדרוציטים וכתוצאה מכך, את כיוון הצמיחה של לוחית הגדילה של העכברים במהלך ההתפתחות העוברית. יתר על כן, חקרנו את השינויים הקשורים לניוון סחוס ודלקת מפרקים ניוונית בסחוס המפרקי 2,41,42,43,44,45,46,47.
בשנים האחרונות, חקירות AFM רבות בחנו את התכונות המכניות של רקמת ריאה בריאה ופתולוגית 48,49,50,51,52. עם זאת, חקירות אלה בחנו בעיקר את מכניקת הרקמות הכוללת, ולא התמקדו ברכיבי רקמה ספציפיים כגון ה-BM. ה-BM מהווה שכבה דקה (100 ננומטר - 400 ננומטר בבני אדם) של מבנה ECM מיוחד המצפה את רוב איברי היונקים ומבני הרקמות כגון נוירונים, שרירים, רקמות אדיפוציטים וכלי דם. גילינו כי התכונות המכניות של BM הריאתי של העכברים ממלאות תפקיד מרכזי במהלך היווצרות הגרורות באופן ש-BM רך יותר מתאם עם הסתברות הישרדות גבוהה יותר בחולי סרטן השד והכליות53. יתר על כן, חקירה זו גילתה כי חלבון המטריצה החוץ-תאית המופרש נטרין-4 מקטין את מודול יאנג של ה-BM באמצעות אינטראקציה סטוכיומטרית של 1:1 עם למינין γ1, מרכיב מרכזי הקיים כמעט בכל רשתות הלמינין בתוך BMs40.
כאן, אנו מציגים את ההדמיה של הפרוטוקול שפיתחנו כדי לקבוע את מודול יאנג (EBM) של BM ריאתי עכברי דק של 100 - 200 ננומטר. מודול יאנג של ה-BM הוא מדד לקשיחותו ומוגדר כיחס המתח (כוח ליחידת שטח) לעומת המתח הצירי (תזוזה) שנוצר במהלך עיוות אלסטי ליניארי54, במקרה זה, דחיסה קטנה של ה-BM על ידי קצה ה-AFM הנכנס. בניסוי AFM, ניתן לקבל את הכוח והתזוזה (עומק הזחה) מהסטייה של שלוחת ה-AFM וממיקום השלוחה, וניתן לחלץ את המודול של יאנג (יחס המתח-מתח-מתח) מעקומת הכוח לעומת הכניסה המתקבלת באמצעות מודל אלסטי מתאים, המסביר את הגיאומטריה של קצה הכניסה (במקרה זה דגם הרץ55 שונה). השלבים העיקריים מוצגים באיור 1. בתחילה, פרוטוקול זה מתאר את המתודולוגיה להכנה והטמעה של דגימות רקמת ריאה של עכברים בתרכובת OCT (ראה שלב 1), ובכך מקל על הליך ההקפאה הבא (שלב 2) המאפשר קביעת קשיחות ה-BM באמצעות מפות כוח AFM. טכניקת ההקפאה המוצגת כאן, המשתמשת בסרט חד צדדי ודו צדדי, מאפשרת חיתוך של רקמת הריאה ללא צורך בקיבוע וללא הפשרת החתך. נוהל AFM המפורט לאיסוף נתונים מתאימים להערכת קשיחות BM מתואר בחלק השלישי של הפרוטוקול. בחלק הבא של הפרוטוקול, אנו מסבירים כיצד ניתן לנתח אוטומטית את נפחי הכוח שנוצרו (שלב 4.1) באמצעות תוכנה מבוססת MATLAB שפותחה בבית, ארגז הכלים לעיבוד CANTER56. בשלב זה, מודול יאנג מופק מכל עקומת כוח-כניסה מתועדת על ידי התאמת מודל הרץ שונה, המתוקן עבור הגיאומטריה הפנימית, במקרה זה, פירמידה בעלת ארבע צלעות55. לבסוף, אנו מתארים בשלבים 4.2 ו-4.3 כיצד ליישם את כלי הסינון המרחבי ואת כלי הסינון R2 של ארגז הכלים שפותח כדי לחלץ את ערכי המודול של יאנג הספציפיים לקרום הבסיס (BM) מהמערך המקיף של ערכי המודול של יאנג המתקבלים במפת הכוח המכילה את כל תאי הרקמה של הדופן המכתשית.
Protocol
כל הנהלים לטיפול בדגימות בעלי חיים אושרו על ידי המועצה לניסויים בבעלי חיים של משרד הסביבה והמזון של דנמרק (מספר הרשאה 2017-15-0201-01265) על פי החוק הדני לרווחת בעלי חיים. כדי להדגים את הפרוטוקול הזה, השתמשנו בעכבר C57BL/6 זכר בגיל 13 שבועות.
זהירות: בפרוטוקול הבא, מספר שלבים דורשים טיפול בדגימות רקמה. ללבוש תמיד כפפות מתאימות וחלוק מעבדה בזמן הטיפול בדגימות ביולוגיות.
1. הכנת מדגם
- הנח ריאת עכבר שזה עתה נקטפה לתבנית בסיס חד פעמית בגודל 15 x 15 x 5 מ"מ. תוך שימוש במזרק של 10 מ"ל עם מחט של 0.9 מ"מ, הזריק בזהירות יחס של 1:1 (נפח לנפח) של טמפרטורת חיתוך אופטימלית (OCT) בינונית לתמיסת מלח חוצצת פוספט (PBS) לתוך הדגימה תוך החזרת המחט בו-זמנית. בצע את ההזרקה בטמפרטורת החדר תוך החזקת הדגימה היטב בעזרת פינצטה כירורגית קטנה. ההזרקה נחשבת שלמה כאשר הדגימה מתנפחת, ונצפית כמות ניכרת של נזילה.
- ממלאים OCT טהור בתבנית עד שהדגימה טובלת במלואה. כדי להבטיח הקפאה מוחלטת של הריאה כולה, אחסן את הדגימה בטמפרטורה של -80 מעלות צלזיוס למשך 4 שעות לפחות.
הערה: בשלב זה, ניתן לאחסן את הדגימה למשך שנתיים לפחות בטמפרטורה של -80 מעלות צלזיוס. בהתבסס על מפרט היצרן עבור ה-OCT, זמן האחסון של רקמה משובצת הוא מעל 10 שנים. בדרך כלל מומלץ לעטוף דגימות שצריך לאחסן לתקופות העולות על 4 חודשים בסרט שקוף כדי למנוע ספיגת לחות בדגימה.
2. הקפאה של דגימת ריאה משובצת
- לווסת את טמפרטורת תא הקריוטום ל-17 מעלות צלזיוס, מכיוון שזוהי טמפרטורת החיתוך האופטימלית לדגימות רקמת ריאה. הגדר את הטמפרטורה של יחידת שלב החיתוך ל-22 מעלות צלזיוס, אם תכונה זו זמינה. זה משמש כדי להבטיח שטמפרטורת החיתוך האופטימלית נשמרת על משטח הדגימה לאורך כל תהליך החיתוך.
- הכן 40 שקופיות מיקרוסקופ באמצעות סרט דבק דו צדדי המונח בזהירות באמצע מגלשת הזכוכית לפני גלגול צינור צנטריפוגה של 15 מ"ל על הסרט כדי להבטיח הידבקות יציבה ונטולת בועות. ודא שאורך סרט ההדבקה הדו-צדדי שווה בערך לרוחב בלוק ה-OCT המכיל את הדגימה. שקופיות מיקרוסקופ עם קצה חלבי מאפשרות תיוג בעיפרון המכיל מידע לדוגמא ומספר הסעיף.
- הכנס את שקופיות המיקרוסקופ המוכנות לקופסת שקופיות. לאחר מכן, הנח את הקופסה המחזיקה את המגלשות בתוך תא הקריוטום על מנת לצנן אותן.
הערה: קירור השקופיות מונע התרחשות של מחזור הקפאה-הפשרה בעת הרמת החלקים, מה שיפגע בתכונות המכניות של הדגימה. - הכן מספר סרטי דבק חד צדדיים, כל אחד בגודל זהה בערך לגוש הדגימה הקפוא.
- מלאו את שתי הטבעות הפנימיות של מחזיק הדגימה במדיום OCT. מקם את המדגם בתוך מדיום ה-OCT על מחזיק המדגם, וודא שהוא ישר ככל האפשר. לאחר מכן, הנח את מחזיק הדגימה למשך כ-10 דקות בתוך תא הקריוטום עד שמדיום ה-OCT התמצק לחלוטין והדגימה מאובטחת היטב למחזיק.
- התקן את המחזיק הנושא את הדגימה על יחידת שלב החיתוך של הקריוטום. התאם את כל המרכיבים החיוניים של הקריוטום, כגון נטיית שלב החיתוך ומיקום הלהב, בהתאם למדריך למשתמש של המכשיר כדי ליצור מישור חיתוך המיושר במקביל לפני השטח של בלוק ה-OCT.
- בצע חיתוך ראשוני של הדגימה על ידי התאמת עובי החיתוך ל-50 מיקרומטר והתחל לחתוך עד הגעה למיקום הרצוי בתוך הדגימה (בדרך כלל כ-500 מיקרומטר בתוך דגימת הריאה מפני השטח שלה) לאיסוף שקופיות רקמות. התאם את עובי החיתוך של הקריוטום ל-15 מיקרומטר, המתאים לעובי הרצוי של חלקי הרקמה.
זהירות: חיוני לנקוט משנה זהירות בעת שימוש במכשיר חיתוך, כגון קריוטום. כדי להבטיח בטיחות אישית, הקפידו על הנחיות הבטיחות של היצרן והרחיקו את האצבעות מהלהב. - חבר חתיכת סרט דבק חד צדדי לדגימה על ידי הפעלת לחץ חזק עם האגודל. לפני כן, ודא שהאגודל התקרר על ידי החזקתו כנגד דופן החדר של הקריוטום למשך מספר שניות.
הערה: יש למרוח את הסרט בחוזקה על הדגימה, שכן כל חוסר הידבקות עלול לגרום לניתוק הסרט מהרקמה במהלך החיתוך. - לייצר קטע רקמה של 15 מיקרומטר עם הקריוטום. השתמש במברשת כדי לכוון את הקטע וכדי למנוע מסרט ההדבקה להתנתק מהדגימה במהלך הליך החיתוך. חיוני למשטח חלק של קטע הרקמה שקצב החיתוך יישאר איטי ועקבי.
- החלק שנוצר בשלב הקודם שוכב כעת שטוח על בלוק הלהב כשהסרט פונה כלפי מעלה. השתמש באחת משקופיות המיקרוסקופ המצוננות עם הסרט הדו-צדדי מקופסת השקופיות, ולחץ אותה בחוזקה על החלק כדי להרים אותה. לאחר מכן, הנח את שקופית המיקרוסקופ, הנושאת כעת את הקטע, בחזרה לתוך תיבת השקופיות.
הערה: בעת הטיפול בשקופית המיקרוסקופ ובחתך, הקפד לשמור אותם בתוך תא הקריוטום בכל עת כדי למנוע את הפשרת החלק במהלך הליך החיתוך. - חזור על שלושת השלבים הקודמים עד לאיסוף מספר הסעיפים הנדרש, כלומר 40.
- בסיום, הניחו את המכסה על קופסת השקופיות והעבירו אותו על קרח יבש למקפיא של -20 מעלות צלזיוס. לבסוף, נקה את הקריוטום על ידי חיטוי כל הפריטים המשומשים והדלקת אור ה-UV בתא הקריוטום.
הערה: ניתן להשהות את הפרוטוקול בשלב זה. אחסן את הדגימות בטמפרטורה של -20 מעלות צלזיוס עד לביצוע מדידות ה-AFM. זמן האחסון המומלץ עבור החלקים ומדיום OCT לא יעלה על 6 שבועות. מעבר למסגרת זמן זו, החלקים ומדיום ה-OCT עשויים להפגין שינויים הדומים לכוויות במקפיא כתוצאה משטח הפנים המשמעותי שלהם ונטייתם לספיגת לחות.
3. מפות כוח AFM של קטע ריאות
הערה: עבור פרוטוקול זה, נעשה שימוש ב-JPK NanoWizard 4XP (AFM) ובבמה הממונעת מ-Bruker בשילוב עם DMi8 (מיקרוסקופ אופטי הפוך) מ-Leica כדי להקליט עקומות כוח-תזוזה של חלקי הריאות.
- הגדרת ה-AFM
- הפעל את כל המכשירים הנדרשים של מערך AFM (למשל, מחשב, בקר AFM, שולחן בידוד רעידות, מיקרוסקופ אופטי וכו').
- הפעל את תוכנת הבקרה AFM. בסקירה הכללית של בחירת ניסוי , בחר במצב הדמיה מתקדמת של QI . בנוסף, ציין את המיקום שבו יש לאחסן את נתוני הניסוי וקבצי הכיול.
הערה: אם אין ברשותך את הרחבת ההדמיה המתקדמת של QI , השתמש במצב מיפוי כוח של מצב מגע כאפשרות חלופית. - בחר שלוחה עם קבוע קפיץ מתאים לסוג הדגימה הספציפי שנצפה. עבור דגימות רקמת הריאה הרכות, מומלץ להשתמש בשלוחה MLCT F מבית Bruker עם קצה פירמידלי וקבוע קפיץ נומינלי של 0.6 N/m. אם שבב מכיל מספר שלוחים (כגון ה-MLCT), הסר את כל השלוחה הארוכה יותר מהשבב באמצעות זוג פינצטה מתחת למיקרוסקופ סטריאו כדי להבטיח שרק השלוחה המשמשת למדידה תבוא במגע עם הדגימה.
הערה: שלוחים אחרים במגע עם הדגימה מזה המשמש למדידה עלולים להוביל לתנועה לא רצויה של הדגימה במהלך הניסוי או אפילו לניתוק הדגימה מהסרט הבסיסי.
זהירות: הימנע ממגע עם השלוחה המשמשת למדידה עם הפינצטה בשלב הנוכחי או הבא. - בצע את התקנת השבב על מחזיק השלוחה. הכנס את המחזיק לראש ה-AFM. מקם את ראש ה-AFM על שלב הדגימה, הממוקם על המיקרוסקופ האופטי ההפוך. יישר את נתיב הידית האופטית לפי ההוראות במדריך למשתמש. היישור הנכון של נתיב המנוף האופטי מושג כאשר קרן הלייזר ממוקמת בתחילה בקצה הקדמי של שלוחת המדידה, ולאחר מכן, קרן הלייזר המוחזרת פוגעת במרכז הפוטו-דיודה המפולחת.
- כיול שלוחה בשיטת הרעש התרמי57
הערה: כיול השלוחה כולל קביעת רגישות הידית האופטית ההפוכה (InvOLS) וקבוע הקפיץ. הכיול האישי של כל שלוחה משומשת הוא הכרחי מכיוון שקבוע הקפיץ הנומינלי המסופק בדרך כלל עבור שלוחה הוא בדרך כלל קירוב גס בלבד. בניסויים שבהם התכונות המכניות של דגימה נקבעות מעקומות כוח מוקלטות, כמו זו המתוארת בפרוטוקול זה, חיוני לקבוע ישירות את ה-InvOLS באמצעות שיטה מבוססת מגע על מצע קשיח. שיטות חלופיות לקביעת ה-InvOLS, כגון גזירה שלו מהגיאומטריה של השלוחה יכולות לספק קירוב גס בלבד ואינן מתאימות לסוג היישום המתואר כאן. לחלופין, אם משתמשים בשלוחים כאשר הספק מספק את קבוע הקפיץ המדויק, ניתן לקבוע את ה-InvOLS על ידי הליך שתואר על ידי שילר ועמיתיו.58.- הנח שקופית מיקרוסקופ על הדגימהtagה של ה-AFM. שקופית המיקרוסקופ משמשת כמצע קשיח לקביעה מבוססת מגע של ה-InvOLS.
- לאחר הנחת ראש ה-AFM על הדגימהtagה, הורד את הראש באמצעות מנועי הצעד עד שהמרווח שנותר בין מחזיק השלוחה לשקופית המיקרוסקופ הוא כ-1 - 2 מ"מ בלבד. מרחו PBS על הצד של מחזיק השלוחה, ואפשרו לו לזרום מטה וליצור מניסקוס נוזלי ברווח בין המחזיק לשקופית המיקרוסקופ באמצעות מזרק של 1 מ"ל עם מחט ארוכה (0.9 מ"מ על 70 מ"מ).
הערה: ודא שאותו נוזל, כגון מאגר או מדיה, המשמש למדידות נפח הכוח של הדגימה משמש גם לתהליך הכיול. - כדי לבצע כיול מבוסס מגע בתוכנה, נווט לדף רכישת נתונים ובחר באפשרות תצוגה מתקדמת . גש למנהל הכיול באמצעות כפתור תפריט ההמבורגר הממוקם בפינה השמאלית העליונה. בתוך ממשק זה, בחר מבוסס מגע כשיטה ובחר את שלוחת MLCT F מהתפריט הנפתח כשם השלוחה. בנוסף, הגדר את נקודת ההגדרה ל-1 V ואת מספר הסריקות ל-10 בשדות הקלט המתאימים.
- בדף רכישת נתונים , בלוח הבקרה השמאלי, הזן נקודת הגדרה של 1 וולט עבור הליך הגישה האוטומטית. לחץ על לחצן החץ המצביע הכחול כלפי מטה הממוקם בפינה הימנית העליונה של ממשק המשתמש כדי להתחיל את הגישה האוטומטית. לאחר סיום הגישה והשלוחה נמצאת במגע עם שקופית המיקרוסקופ, לחץ על כפתור הכיול בחלון מנהל הכיול ..
הערה: ה-InvOLS וקבוע קפיץ השלוחה נקבעים שניהם באופן אוטומטי על ידי רישום 10 עקומות כוח כמו גם הצפיפות הספקטרלית של ההספק התרמי (PSD), המשמשת לקביעת קבוע הקפיץ בשיטת הרעש התרמי57. לאחר סיום הליך הכיול האוטומטי, בדוק ויזואלית שהעקומה המותאמת מתארת כראוי את המצב הרגיל (שיא ראשון) של ה-PSD המוקלט של השלוחה וכי לקבוע הקפיץ שנקבע יש את אותו סדר גודל כמו קבוע הקפיץ הנומינלי שניתן על ידי יצרן השלוחה. אם זה לא המקרה, יש לכוונן את טווח ההתאמה באופן ידני כדי להבטיח שההתאמה מתכנסת ומייצגת את השיא הראשון של ספקטרום ההספק התרמי. - לאחר סיום הכיול, סגור את חלון מנהל הכיול . לאחר סגירת מנהל הכיול, נוצר כיול file (*.tnd ascii file) בספרייה שנבחרה מראש (ראה שלב 3.1.2) המכיל את תוצאות הכיול שנקבעו, הנדרשות מאוחר יותר לניתוח הנתונים. תעד את ערכי הכיול לעיון עתידי במהלך תהליך ניתוח הנתונים, למשלample, במחברת המעבדה.
זהירות: משלב זה ואילך, הימנע משינוי מיקום הלייזר על השלוחה, כוונון המראה בראש ה-AFM או העברת מחזיק השלוחה. שינוי אלמנטים אלה ישפיע על ה-InvOLS ויהפוך את ערכי הכיול ללא חוקיים. כדי לפצות על סחיפה תרמית, התאם את המיקום של הפוטו-דיודה המפולחת של ראש ה-AFM.
- ניתוח דופן המכתשית בקטע ריאה
- אחזר את שקופית הדגימה כדי להעריך מהמקפיא. הניחו לדגימה להפשיר בטמפרטורת החדר למשך כדקה אחת עד שכל מדיום ה-OCT יתבהר. לאחר מכן, הוסף כמה טיפות של PBS לחלק רקמת הריאה כדי להחזיר לו לחות.
- הנח את שקופית המיקרוסקופ הנושאת את קטע רקמת הריאה על שלב הדגימה. התקן את ראש ה-AFM בחזרה על הדגימהtagהורד את הראש עד שהשלוחה ממוקמת כ-1 מ"מ מעל הדגימה. הוסף מעט PBS נוסף לצד מחזיק השלוחה באמצעות מזרק של 1 מ"ל בשילוב מחט של 0.9 מ"מ על 70 מ"מ עד שנוצר מניסקוס נוזלי בין קטע הרקמה למחזיק השלוחה.
- נווט אל מנהל ההגדרות על ידי לחיצה על הכפתור עם סמל מפתח הברגים בפינה השמאלית העליונה של ממשק המשתמש. במנהל ההגדרות, התאם את ההגדרות הכלליות הבאות. בתוך הקטע הגדרות גישה , הגדר את גובה היעד ל-4 מיקרומטר. לאחר מכן, בתוך הגדרות המצב הנוכחי סעיף, המשך אל הגדרות משוב מתקדמות והגדר את המכפיל ל-1. לבסוף, בתוך תת-הסעיף הגדרות כוח , שנמצא גם בקטע הגדרות מצב נוכחי , בחר באפשרות Retracted Piezo מהתפריט הנפתח מצב בסוף .
- השתמש במיקרוסקופ האופטי ההפוך כדי לזהות ולנווט לקיר מכתשית שלם. קיר שלם מאופיין בתמונת השדה הבהיר בקצוות כהים וחלקים. (ראה איור 2A-B).
הערה: ייבוא תמונת השדה הבהיר בתוכנת בקרת AFM, כאשר היא זמינה, יכול לסייע בניווט השלוחה לקיר מכתשית מסוים ולכידת מפת כוח או QI מעליו במדויק. בתוכנת JPK SPM, פונקציה זו מכונה שכבת-על ישירה. - הגדר את הפרמטרים עבור עקומות כניסת הכוח בלוח הבקרה השמאלי על סמך ה-AFM המשמש, השלוחה המופעלת והמדגם שנצפה. עבור NanoWizard 4XP ו-MLCT Cantilever F מבית Bruker, אנו ממליצים על הפרמטרים הבאים: Setpoint = 5 nN; אורך z = 8 מיקרומטר; מהירות z = 300 מיקרומטר לשנייה.
הערה: אורך ה-z המומלץ של 8 מיקרומטר הוא גדול למדי. זה מיוחס למאפיינים של רקמת הריאה. בהתחשב בכך שרקמת הריאה היא בדרך כלל רכה למדי, עומק הכניסה יכול להגיע עד 4 מיקרומטר בנקודות מסוימות, אפילו עם נקודת הגדרה צנועה יחסית של 5 nN. על מנת להבטיח שקו הבסיס, שבו הקצה אינו במגע עם המדגם, מהווה לפחות כמחצית מעקומת כניסת הכוח, מומלץ להגדיר את האורך הכולל של העקומה ל-8 מיקרומטר. זה יפשט משמעותית את ניתוח העקומה בהמשך. עבור ביו-AFMs אחרים, פרמטרים אלה צריכים להיות ישימים גם כן, אם כי המינוח לפרמטרים מסוימים, כגון נקודת ההגדרה, הקובעת את כוח הכניסה המרבי, עשוי להשתנות בין יצרנים שונים. אם מערכת ה-AFM אינה מסוגלת להשיג את המהירות האנכית הגבוהה הניתנת כאן, יש צורך להפחית את מהירות ה-z בהתאם להמלצת יצרן ה-AFM שלך.
זהירות: על מנת להבטיח השוואה של התוצאות, חיוני להשתמש במהירויות זהות של גישת z בכל הניסויים. - הגדר את המיקום והגודל של מפת כוח הסקירה הראשונית, וודא שהיא מקיפה את כל הקיר המכתשית, המשתרעת מצד אוויר אחד למשנהו. עבור דגימות רקמת ריאה של עכברים, בדרך כלל מספיק גודל בין 20 מיקרומטר x 20 מיקרומטר ל-30 מיקרומטר x 30 מיקרומטר. ללא קשר לגודל הספציפי של המפה, הגדר את מספר הפיקסלים (התואמים למספר עקומות הכוח שתועדו) ל-50 x 50. זה מוביל ליצירת 2,500 עקומות כניסת כוח עבור כל מפה, המספקת את הרזולוציה הדרושה לזיהוי ה-BM בערוץ השיפוע של מפת הכוח. (ראה איור 2C-D).
- לאחר הקלטת מפת הסקירה יש לבחון את ערוץ הגובה והשיפוע של מפת הכוח. אם ערוץ הגובה מציין שהדופן המכתשית שלמה (ראה איור 2D) ואם ניתן להבחין ב-BM בערוץ השיפוע כקו בהיר מוגדר בבירור (ראה איור 2C,E) הממוקם בין שתי שכבות של האפיתל והאנדותל, לכוד מפת כוח ממוקדת יותר בגודל של 3 מיקרומטר x 3 מיקרומטר או 4 מיקרומטר x 4 מיקרומטר על ה-BM. שמור על הפיקסלים ב-50 x 50 עקומות.
הערה: הליך זה מוביל לרזולוציית מפה גבוהה יותר ומאפשר רישום מספר גדול יותר של ערכי המודול של יאנג, במיוחד עבור ה-BM (ראה איור 2E-F). יתר על כן, זה מאפשר בידול מדויק יותר בין ה-BM לרקמות הסובבות, ומשפר את הדיוק של תהליך הסינון המרחבי שלאחר מכן. אם הערוצים של מפת הסקירה מראים קיר שקרס או קרוע, חפצים עקב השלוחה שנוגעת בדגימה לא רק עם הקצה, או ללא BM מזוהה בתעלת המדרון, נווטו לקיר אחר בקטע הרקמה עד שניתן לזהות קיר עם הערכה נטולת חפצים של ה-BM.
חזור על השלבים הקודמים (3.3.6 ו-3.3.7) בקטעים נוספים של אותה דגימת ריאה עד להערכת המספר הרצוי של דפנות המכתשית. לפחות ארבעה קירות מומלצים לכל דגימת ריאה כדי להשיג תוצאות חזקות59. - לאחר השלמת המדידה, נקה את כל הציוד והחומרים שבאו במגע עם הדגימה ו-PBS. אם אין עוד צורך בדגימה, השלך אותה למיכל פסולת זכוכית הניתן לחיטוי. שמור את כל הנתונים המוקלטים, וכבה את תוכנת הבקרה והמחשב. לבסוף, כבה את כל המכשירים החשמליים שהיו בשימוש.
הערה: בשלב זה, ניתן להשהות את הפרוטוקול. נתוני הניסוי נשמרים וניתן לנתח אותם בנקודת זמן מאוחרת יותר.
4. ניתוח נתונים
- ניתוח עקומות כוח-כניסה
הערה: מדריך מפורט של יישום ניתוח עקומת הכוח ניתן למצוא כאן: https://github.com/CANTERhm/CANTER_Processing_Tool/wiki/2a.-Force-Curve-Analysis.- הפעל את ארגז הכלים לעיבוד CANTER56 ב-MATLAB ופתח את אפליקציית ניתוח עקומת הכוח .
הערה: ניתן להוריד את ארגז הכלים ממאגר GitHub על ידי לחיצה על הקישור הזה: https://github.com/CANTERhm/CANTER_Processing_Tool. קובץ README.md, הכולל מדריך מקיף כיצד להתקין את התוכנה ולהפעיל אותה באמצעות MATLAB, זמין במאגר GitHub. מידע נוסף על כל יישום הכלול בארגז הכלים ניתן למצוא בוויקי המתאים בכתובת https://github.com/CANTERhm/CANTER_Processing_Tool/wiki. - טען את מפת הכוח ברזולוציה גבוהה (3 מיקרומטר x 3 מיקרומטר או 4 מיקרומטר x 4 מיקרומטר) על ידי לחיצה על כפתור בחר קובץ , ניווט למיקום שבו נשמרת מפת הכוח, לחיצה כפולה עליה ולאחר מכן לחיצה על כפתור טען נתונים בממשק המשתמש של האפליקציה.
- מופיע חלון מוקפץ המבקש את ערכי הכיול (InvOLS וקבוע קפיץ) שנקבעו (ראה שלב 3.2) עבור השלוחה המשמשת לרישום מפת הכוח שנבחרה בשלב הפרוטוקול הקודם. הזן את ערכי הכיול בשדות העריכה המתאימים. אם הם לא תועדו במהלך שלב 3.2.4, עיין בכיול שנוצר אוטומטית file, המכיל גם את ערכי הכיול. שמור על אפשרות ברירת המחדל כן לשאלה האם יש לחשב הפרדת טיפ לדגימה. לאחר מכן, לחץ על כפתור שלח כדי להמשיך.
- מופיע חלון מוקפץ שני, המאפשר לבחור את הגיאומטריה הפנימית ויחס פואסון עבור הדגימה המוכנסת. עבור שלוחי MLCT הנמצאים בשימוש, בחר פירמידה ארבע-צדדית כגיאומטריית קצה והזן 17.5° עבור חצי הזווית לקצה (שניהם ערכי ברירת המחדל). השתמש ביחס פואסון המוגדר כברירת מחדל של 0.5, המייצג חומר בלתי ניתן לדחיסה. כדי להמשיך בהליך הטעינה של מפת QI, לחץ על כפתור שלח .
הערה: במהלך הליך הטעינה, עקומות הסטיה-תזוזה המוקלטות (נתונים גולמיים של ה-AFM) מומרים לעקומות כניסת כוח על סמך ערכי הכיול שסופקו. להבנה מקיפה של שלבי הטרנספורמציה הבודדים והמשוואות הנלוות, עיין במידע המשלים של הרטמן ואחרים 59. - עם השלמת תהליך הטעינה, עקומת הכוח הראשונית של מפת הכוח תוצג על המסך. ודא שמצב תיקון קו הבסיס Offset + Tilt נבחר. מצב זה מזהה אוטומטית את קו הבסיס של עקומת אינדוקציית הכוח ומתקן את ההטיה וההיסט האנכי לאפס. בנוסף, בחר באמצעות מודל הרץ כאלגוריתם עבור מאתר נקודת המגע והשתמש בערך של 20% בשדה העריכה המיועד לאפשרות זו. אלגוריתם זה מתאים במיוחד לזיהוי נקודת המגע בעקומות כוח-הזחה שנרשמו על דגימות רקמות רכות. לבסוף, הגדר את עומק ההתאמה בשדה העריכה המתאים ל-1.5 מיקרומטר.
הערה: כדי להבטיח שהקשיחות של שקופית המיקרוסקופ לא תשפיע על המודול של יאנג המתקבל, מומלץ להגדיר את עומק ההתאמה המרבי לערך שאינו גדול מ-10% מעובי חתך הרקמה60. לפרטים נוספים על אלגוריתמי התיקון, עיין במידע המשלים של Hartmann et al.59.
זהירות: השתמש באותו עומק התאמה לאורך כל הניסויים כדי להבטיח שהתוצאות ניתנות להשוואה. - כדי להחיל את ההתאמה של מודל הרץ שהשתנה על כל עקומות כניסת הכוח של מפת ה-QI, לחץ על כפתור שמור והחל על הכל . נפתח חלון דו-שיח השואל אם יש להציג כל עקומת כוח במהלך הניתוח או לא. על ידי אי הצגת העקומות, מהירות העיבוד מואצת מעט.
- לאחר השלמת ניתוח עקומת הכוח האחרון, מופיע חלון השואל האם יש לשמור את תוצאות ההתאמה. כדי לשמור את התוצאות בשניהם. תבניות קובץ tsv (ערכים מופרדים באמצעות טאבים) ו-.xlsx (Excel), לחץ על כן והזן שם לקבצי התוצאות. בנוסף, נשמר קובץ טקסט עם סיומת הקובץ *.meta_data, המכיל את כל הפרטים לגבי ניתוח העקומות, כגון ערכי הכיול המנוצלים, מודל ההתאמה שנבחר, אלגוריתם זיהוי נקודת מגע שנבחר, טווח התאמה ומידע רלוונטי אחר.
- סגור את יישום ניתוח עקומת הכוח על ידי לחיצה על סמל הצלב בפינה השמאלית העליונה של החלון הראשי.
- הפעל את ארגז הכלים לעיבוד CANTER56 ב-MATLAB ופתח את אפליקציית ניתוח עקומת הכוח .
- סינון מרחבי של תוצאות מפת QI
הערה: שלב הסינון המרחבי מבטיח שרק ערכי המודול של יאנג של מפות ה-QI שמקורן ב-BM יילקחו בחשבון לכל ניתוח נוסף. מדריך מפורט לכלי סינון התוצאות ניתן למצוא כאן: https://github.com/CANTERhm/CANTER_Processing_Tool/wiki/Result-Filtering-Tool.- בחר את כלי סינון התוצאות מרשימת היישומים בחלון בחירת היישומים של ארגז הכלים לעיבוד CANTER והפעל את היישום על ידי לחיצה על כפתור התחל יישום .
- כדי לטעון את תוצאות ההתאמה, לחץ על פתח בשורת התפריטים העליונה של ממשק המשתמש של כלי סינון התוצאות . בחלון המוקפץ שלאחר מכן, אתר את כפתור ההגדרה הראשון הממוקם בתוך הכרטיסייה JPK Maps ובחר את קובץ ה-.tsv המכיל את התוצאות של ניתוח עקומת הכוח (עיין בשלב 4.1.6). לחץ על כפתור הגדר השני ואתר את קובץ מפת ה-QI המתאים לקובץ ה-.tsv שכבר נבחר. לאחר מכן, לחץ על שלח כדי לטעון את נתוני המפה ואת תוצאות ניתוח עקומת הכוח.
- בחר באפשרות Emodul מהתפריט הנפתח העליון של הערוץ המוצג כדי להציג את תוצאות המודול של יאנג שהתקבלו כתמונת מפה. יתר על כן, בחר באפשרות Emodul (אם עדיין לא נבחרה) מהתפריט הנפתח ערוץ נתונים הממוקם מתחת לעלילת ההיסטוגרמה כדי לדמיין את התפלגות ערכי המודול של יאנג הטעונים של מפת ה-QI.
- לחץ על כפתור חץ זרימת המניפולציה , שנמצא במרכז ממשק המשתמש, וודא שהוא מצביע לכיוון צד ימין. קבעו את הלחצן הדו-מצבי של מסנן התמונה למצב On בחלונית המסנן הממוקמת מעל צירי ההיסטוגרמה. בחר באפשרות Freehand מהתפריט הנפתח גיאומטריית סינון ולאחר מכן לחץ על כפתור הוסף .
- בתמונת הערוץ העליון, ציירו את מסיכת המסנן באמצעות סיבוב ה-BM תוך החזקת מקש העכבר השמאלי. ניתן לזהות את ה-BM במפת המודול של יאנג כמבנה בהיר (ערכי מודול יאנג גבוהים) בהשוואה לרקמה הרכה השכנה (ראה איור 3A). בסיום ציור המסכה, שחרר את מקש העכבר השמאלי ולחץ פעמיים על המסכה שתוחל על המפה. גרף ההיסטוגרמה מימין מציג כעת רק את ערכי המודול של יאנג עבור אזורי המפה המודגשים בירוק (צבע ברירת המחדל; ראו איור 3C-D).
- כדי ליצור קובץ תוצאות .tsv חדש המכיל רק את ערכי המודול של יאנג עם המסיכה, לחץ בשורת התפריטים העליונה של ממשק המשתמש בשמירה > שמירת היסטוגרמה > שמירת נתונים. לחלופין, לחץ לחיצה ימנית על אזור ריק בצירי התוויית ההיסטוגרמה ובחר שמור נתונים מהתפריט תלוי-ההקשר.
- לחץ על בחר הכל בחלון המוקפץ ושאל אילו תוצאות לכתוב לקובץ ה- .tsv. לאחר מכן, אשר את הבחירה על ידי לחיצה על OK לחצן. לאחר מכן, הזן שם עבור קובץ ה-.tsv בתיבת הדו-שיח של השמירה, בחר את מיקום השמירה הרצוי ולבסוף לחץ על אישור כדי לשמור את התוצאות המסוננות.
- סגור את כלי סינון התוצאות על ידי לחיצה על סמל הצלב בפינה השמאלית העליונה של היישום.
- R2 סינון תוצאות
הערה: שלב פרוטוקול זה מבטיח שרק תוצאות המודול של יאנג יילקחו בחשבון כאשר מודל הרץ השונה הראה הסכמה טובה לעקומת כוח-הכניסה אליה הוא הותאם. מדריך מפורט לכלי הסינון R² ניתן למצוא כאן: https://github.com/CANTERhm/CANTER_Processing_Tool/wiki/R%C2%B2-Filtering-Tool.- הפעל את כלי הסינון R² על ידי בחירתו ברשימת היישומים של חלון בחירת היישומים של ארגז הכלים לעיבוד CANTER ולחיצה על התחל יישום.
- נווט לשורת התפריטים העליונה של ממשק המשתמש ולחץ על פתח קובץ .tsv. בתיבת הדו-שיח הבאה של טעינת קובץ, אתר את קובץ ה-.tsv המכיל את תוצאות המודול של יאנג של ה-BM שנשמר במהלך השלב הקודם 4.2.5, ובחר אותו על ידי לחיצה כפולה.
- מופיעה תיבת דו-שיח המציגה רשימה של עמודות הנתונים הכלולות בקובץ ה- .tsv. בחר Emodul כעמודה המכילה את נתוני המודול של יאנג. לאחר מכן, בתיבת דו-שיח נפרדת של תיבת רשימה המבקשת את נתוני R², בחר rsquare_fit. לאחר השלמת הליך הטעינה, נתוני המודול של יאנג הטעונים מוצגים בצורה של היסטוגרמה בצד שמאל למעלה של המסך, בעוד שהתפלגות הנתונים R² מתוארת בגרף בצד ימין למעלה.
- הזן 0.96 בשדה העריכה הממוקם במרכז ממשק המשתמש הגרפי. לחץ על כפתור סינון נתונים כדי להחיל את מסנן R² באמצעות הערך שהוזן. פעולה זו תשמור רק את התוצאות בעלות ערך R² של 0.96 ומעלה. ההתפלגויות המסוננות של תוצאות המודול של יאנג וערכי ה-R² המתאימים מוצגות במחצית התחתונה של ממשק המשתמש.
- בחר שמור נתונים מסוננים משורת התפריטים העליונה כדי ליצור קובץ .tsv חדש הכולל רק את התוצאות העומדות בקריטריון מסנן R² המוגדר של > 0.96. כעת ניתן להציג את הנתונים השמורים כהיסטוגרמה, למשל, באמצעות כלי התוויית ההיסטוגרמה, אשר מדמיין את התפלגות המודול של יאנג עבור ה-BM הריאתי שנבדק (ראה איור 4A).
תוצאות
לאחר זיהוי ומדידה של דופן מכתשית שלמה, התוצאה העיקרית של פרוטוקול זה היא ערכי מודול יאנג המסוננים של ה-BM. חשוב לציין כי לא ניתן למצוא דופן מכתשית מתאימה למדידת AFM בכל קטע רקמה. בתצפיות הניסיוניות שלנו, כ-75% מהקריוסקציות שמקורן בדגימות ריאות של עכברים הראו דופן מכתשית הניתנת לכימות. כדי לקבוע במדויק את ההתפלגות המרחבית של מודול יאנג ב-BM ריאתי, אנו ממליצים להשתמש במפות כוח המשתרעות על פני 3 מיקרומטר x 3 מיקרומטר או 4 מיקרומטר x 4 מיקרומטר. גישה זו מבטיחה רזולוציה מספקת לבחינת BMs ריאתיים של עכברים, אשר בדרך כלל נמדדים בעובי של 100 ננומטר - 200 ננומטר. לכן, הגישה הניסיונית כוללת לכידת עקומות כוח של 50 x 50 עבור כל מפת כוח, ומניבה בסך הכל 2,500 עקומות כוח. בתוך מפת הכוח, עקומות הכוח מרווחות באופן שווה. זה מרמז שבנוסף למודול ה-BM של יאנג, מבני הרקמה המקיפים את ה-BM נבדקים אפילו במפות הכוח הקטנות. לכן, כדי לקבוע באופן מדויק וסלקטיבי את מודול יאנג אך ורק של ה-BM הריאתי, יישמנו תהליך סינון דו-שלבי בפרוטוקול זה.
שלב הסינון הראשוני של סינון מרחבי תלוי מפעיל בוחר תוצאות התאמת עקומת כוח שמקורן ב-BM הריאתי של העכבר, המהוות כ-10% עד 25% מסך ערכי התוצאה הכלולים במפת הכוח המנותחת. לאחר סינון מרחבי ראשוני זה, כ-250 - 625 תוצאות התאמה נשמרות לניתוח נוסף. שלב הסינון הבא מבטיח שרק התוצאות הקשורות ל-BM שמקורן בעקומות כוח שתוארו כראוי על ידי מודל הרץ השונה נכללות. לכן, מקדם הקביעה (R2) של התאמת מודל הרץ שהשתנה משמש כקריטריון המסנן. הניסיון האמפירי שלנו מצביע על כך ששמירה על תוצאות עם ערכי R2 גבוהים מ-0.96 מתאימה לתוצאות התאמה המתקבלות על ידי הקפדה על פרוטוקול זה. חשוב לציין שערך R2 מושפע באופן משמעותי מהאיכות (החלקות) והאורך של קו הבסיס של עקומת הכוח, קביעת נקודת המגע וההתכנסות של הדגם המותאם. לאחר היישום של שני הליכי הסינון, כ-100 עד 500 ערכי מודול יאנג נשארים בדרך כלל עבור ה-BM של דופן מכתשית יחידה.
ניתן לדמיין את ההתפלגות של ערכי המודול הנותרים של יאנג מה-BM באמצעות היסטוגרמה (איור 4A). חשוב לציין שערכי המודול של יאנג המתקבלים של ה-BM הריאתי עוקבים אחר התפלגות לוג-נורמלית, הנצפית בדרך כלל עבור משתנים מקריים שיכולים להשיג רק ערכים חיוביים61. זה מומחש על ידי תרשים ה-QQ באיור 4B. כתוצאה מכך, ניתן להתאים התפלגות נורמלית (גאוסית) להתפלגות ערכי מודול יאנג (E) שעברו טרנספורמציה בלוג. כאן, הלוגריתם הטבעי (ln) שימש לשינוי ערכי E . מיקום השיא של ההתפלגות (μ) וסטיית התקן (σ) חולצו מהתאמה זו ולאחר מכן הומרו מחדש כדי לקבל את מודול יאנג המייצג, המסומן כ-EBM, באמצעות המשוואה הבאה:
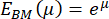
שים לב שלאחר הטרנספורמציה מחדש, מרווח סטיית התקן כבר אינו סימטרי סביב ערך השיא. ניתן לחשב את הקצוות השליליים (σ-) והחיוביים (σ+) של מרווח סטיית התקן באמצעות הביטויים הבאים:
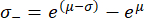
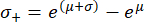
משוואות אלה הן תוצאה של העובדה שהפונקציה המעריכית היא הפונקציה ההפוכה של הלוגריתם הטבעי62.
לאחר שינוי מחדש של ערך השיא μ = 9.31 וסטיית התקן σ = 0.18 שנקבעה מההיסטוגרמה באיור 4A, ערך המודול המייצג של יאנג הוא EBM = 11.05 kPa עם מרווח סטיית תקן של [-1.82 kPa, +2.18 kPa]. לחלופין, ניתן להתאים התפלגות לוג-נורמלית להיסטוגרמה של ערכי מודול יאנג (E) שלא עברו טרנספורמציה כדי לקבוע את הפרמטרים האופייניים להתפלגות.
מומלץ לנתח לפחות ארבעה קירות לכל עכבר כדי לקבל תוצאה מייצגת חזקה כפי שהראינו בפירוט ב- Hartmann et al.59. כדי לקבוע את המודול המייצג של יאנג EBM עבור עכבר, ערכי הטרנספורמציה של כל ארבעת הקירות שורטטו בהיסטוגרמה משולבת אחת ו-μ ו-σ נקבעו על ידי התאמת התפלגות נורמלית. לאחר מכן, μ ו-σ עוברים טרנספורמציה כפי שתואר קודם לכן כדי לאחזר את EBM ואת מרווח סטיית התקן עבור העכבר הנבדק.
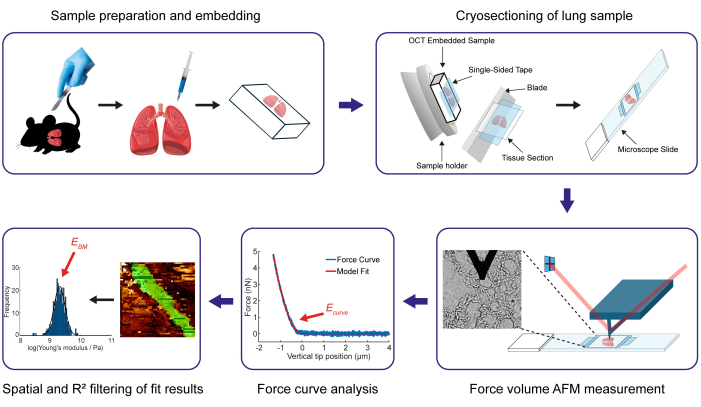
איור 1: סקירה כללית של שלבי הפרוטוקול העיקריים לקביעת מודול יאנג של קרום בסיס ריאתי של עכבר. השלב הראשוני כולל השגה והכנה של ריאות עכבר, ולאחר מכן הטמעתן. לפיכך, הריאה מוזרקת בשילוב של מדיום OCT ו-PBS, ולאחר מכן טובלת לחלוטין בתרכובת ה-OCT. לאחר מכן, מתקבלים קטעי רקמת ריאה בעובי 15 מיקרומטר באמצעות הקפאה עם קריוטום. בפרוטוקול זה, אנו מפרטים את תהליך השימוש בסרטי הדבקה חד צדדיים ודו צדדיים כדי לאבטח דגימות במקומן במהלך תהליך החיתוך. לאחר מכן, ערכי המודול של יאנג של ה-BM נקבעים באמצעות מדידות מפת כוח AFM על קטעי הרקמה. לאחר השלמת תהליך ניתוח עקומת הכוח, מוחל סינון מרחבי ו-R² כדי לבודד את תוצאות המודול של יאנג של המבנה המעניין, במיוחד ה-BM (מוצג בירוק במפת הכוח ומכומת בהתפלגות המודול של יאנג שעבר טרנספורמציה). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: ניסוי AFM של מפת כוח לדוגמה שנערך על קטע רקמת ריאה של עכבר. (A) תמונת סקירה של מיקרוסקופיה בשדה בהיר של קטע רקמת ריאה של עכבר, המאפשרת זיהוי של דפנות מכתשית שלמות מתאימות הממוקמות בין שתי נאדיות. בצד ימין של התמונה, נראה שלוחת ה-MLCT בצורת משולש F של ה-AFM. (B) תצוגה מוגדלת של קיר נבחר בתוך קטע הרקמה. (C) שיפוע ו-(D) ערוץ גובה של מפה כללית של 15 x 15 מיקרומטר המכילה עקומות כוח של 50 x 50 של הדופן המכתשית. בערוץ המדרון, ניתן לזהות את ה-BM כקו בהיר (חץ לבן), המצביע על מבנה של קשיחות מוגברת בתוך הקיר. התעלה הגבוהה מאשרת את שלמות הקיר ואין עדות לקרע. לאחר זיהוי ה-BM במפת הסקירה הכללית של 15 x 15 מיקרומטר, נרשמת מפה קטנה יותר של 4 x 4 מיקרומטר (E: ערוץ שיפוע, F: ערוץ גובה) עם עקומות כוח של 50 x 50. פסי קנה מידה: (A) 200 מיקרומטר ו-(B-D) 25 מיקרומטר. טווחי סולמות הצבעים של תמונות AFM המוצגות הם (C) 2.36 - 9.29 nN/μm, (D) 0 - 3.38 מיקרומטר, (E) 2.36 - 9.29 nN/μm (תמונה כוללת) ו-2.42 - 8.37 nN/μm (תמונה קטנה יותר), (F) 0 - 3.38 מיקרומטר (תמונה סקירה כללית) ו-0 - 1.99 מיקרומטר (תמונה קטנה יותר), מכהה לבהיר. סולמות צבע ליניאריים שימשו עבור כל תמונות AFM. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
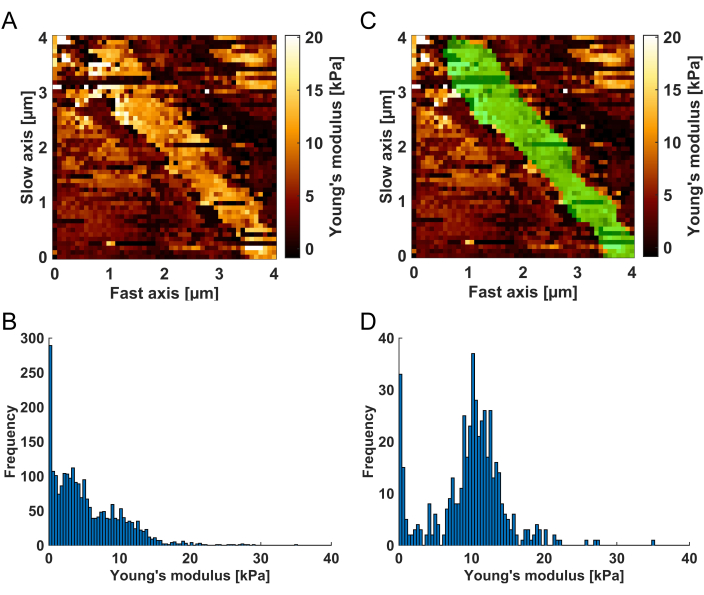
איור 3: הדמיה של הליך הסינון המרחבי. (A) מפת המודול של יאנג הנובעת מניתוח עקומת הכוח, כפי שהיא מוצגת בכלי סינון התוצאות כדי לאפשר סינון מרחבי של התוצאות. ניתן לזהות את ה-BM כפס בהיר (ערכי מודולוס גבוהים של יאנג) המוקף בתאי רקמה רכים יותר. (B) היסטוגרמה של ערכי המודול של יאנג שמתאימים למפה הלא מסוננת (A). לאחר היישום (C) של מסכת המסנן המרחבית (אזור ירוק), (D) ההיסטוגרמה כוללת אך ורק את ערכי המודול של יאנג מהאזור המודגש בירוק, שזוהה כ-BM. שימו לב שניתן לייחס את הערכים הרכים הנותרים הנצפים בצד שמאל של ההיסטוגרמה להתאמות מתכנסות גרועות, אשר יבוטלו בשלב הסינון הבא של R². אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
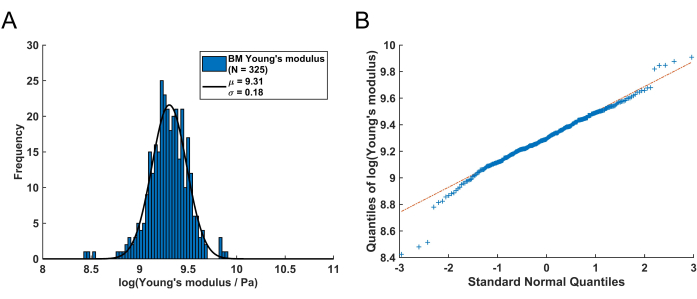
איור 4: התפלגות המודול של יאנג של BM ריאתי של עכבר שהתקבלה על ידי ביצוע פרוטוקול זה. (A) היסטוגרמה מנורמלת לוג של ערכי המודול של BM Young המתקבל (N = 325). על ידי התאמת התפלגות נורמלית (קו מוצק שחור), נקבע הערך הממוצע μ = 9.31 עם סטיית תקן של σ = 0.18. לאחר טרנספורמציה מחדש, זה מתאים למודול יאנג של ה-BM של EBM = 11.05 kPa עם מרווח סטיית תקן אסימטרי של [-1.82 kPa, +2.18 kPa]. (B) תרשים QQ של הקוונטילים של ערכי המודול של BM Young הלוגריתמי לעומת הקוונטילים של התפלגות נורמלית סטנדרטית. תרשים זה מדגים כי למעט כמה ערכים בזנב השמאלי והימני של ההתפלגות, ערכי המודול של יאנג המתקבלים הם בעיקר התפלגות לוג-נורמלית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
המאפיינים המכניים של BMs זכו לעניין רב בשל השפעתם על תפקודים תאיים שונים, כגון ניצני גידול, התמיינות תאים, תנועת תאים ונגישות הכרומטין 53,63,64,65,66,67,68. כתוצאה מכך, קיים פער שלא נענה ביכולת להעריך מכניקת BM בצורה עקבית ומדידה. פרוטוקול זה נועד לאפשר למשתמשי AFM לקבוע את מודול יאנג של BMs ריאתיים מדגימות ריאה של עכברים בריאים או פתולוגיים שהתקבלו מעכברים פראיים או מהונדסים גנטית. ממשק המשתמש הגרפי הידידותי למשתמש המבוסס על יישום MATLAB CANTER Processing Toolbox56 מקל על ניתוח במורד הזרם של נתוני AFM. פרוטוקול זה צפוי להיות שימושי עבור חוקרים אחרים המבצעים מחקרים שיכולים להוביל להתקדמות באבחון קליני, ניהול או אסטרטגיות טיפול חדשות להפרעות ריאה.
שלבים קריטיים בפרוטוקול כוללים הבטחה שבמהלך ההקפאה של דגימת הריאה, חלקי הרקמה לא יפשירו בכל עת כדי למנוע שינויים בתכונות המכניות עקב מחזורי הקפאה-הפשרה. לכן, חיוני להשתמש רק בשקופיות מיקרוסקופ מקוררות מראש כדי לאסוף את החלקים ולטפל בהם רק בתוך תא הקריוטום. השלב המכריע ביותר במהלך הקלטת מפות כוח על קיר מכתשית הוא שימוש בתמונת השיפוע שנוצרה, המספקת סקירה איכותית של התפלגות הנוקשות של האזור הנבדק, כדי לזהות מיקום מדידה מתאים של ה-BM. הסינון המרחבי של ערכי המודול של יאנג המתקבלים מהווה שלב קריטי בפרוטוקול ומהווה מאפיין מרכזי בארגז הכלים לעיבוד CANTER. שלב סינון זה מאפשר לחוקר לזהות את ה-BM, הממוקם בין שתי שכבות תאים רכות יותר, באמצעות טביעת הרגל הנוקשה הייחודית שלו ולחלץ את ערכי מודול יאנג המתאימים של ה-BM להמשך ניתוח.
תהליך עבודה מתקדם זה גילה כי עכברי נוקאאוט netrin-4 הפגינו מודול יאנג גבוה משמעותית (בערך פי שניים) בקרום הבסיס הריאתי שלהם בהשוואה לעכברי חול מסוגבר 53. לפיכך, הפרוטוקול הנוכחי מאפשר ניתוח השוואתי של מצבים או קבוצות מגוונות.
בנוסף ל-AFM, קיימות מתודולוגיות רבות לבחינת התכונות המכניות של ביו-חומרים, הכוללות פינצטה אופטית או מגנטית 69,70,71 ברמה המולקולרית, טכניקות מיקרו-הזחה 72,73 בקנה מידה בינוני ובדיקת דחיסה מוגבלת או לא מוגבלת 74,75 ברמה המקרוסקופית. באופן ספציפי, מיוגרפיה בלחץ, בדיקת מתיחה76,77 וריאולוגיה78 שימשו להערכת נוקשות ה-BM של דגימות כלי דם ומטריצות BM משוחזרות. עם זאת, טכניקות כמו מיוגרפיית לחץ ובדיקת מתיחה יכולות להעריך רק את המאפיינים המכניים של רקמות שלמות או מבני רקמות שלמות, כגון כלי דם שלמים, הכוללים שכבות תאים שונות ואלמנטים מבניים. כתוצאה מכך, כאשר משתמשים בשיטות אלו להערכת ביומכניקה של BM, התכונות המכניות של אנשים שאינם BM, כגון רכיבים סלולריים, מונחות תמיד על גבי תוצאות ה-BM, מה שמקשה על בידוד המאפיינים הספציפיים של ה-BM עצמו.
בפרוטוקול זה, תכונת העניין (BM) מופקת באמצעות סינון מרחבי של תוצאות מפת הכוח. מגבלה של גישה זו היא הדרישה שהתכונה המעניינת תהיה ניתנת להבחנה וזיהוי כתבנית מובחנת במפות המודול של יאנג שהתקבלו או בכל ערוץ מפה זמין אחר. לדוגמה, ניתן לזהות את ה-BM ברקמה המכתשית אך ורק בשל המבנה המקושר שלו, המציג מודול יאנג גבוה משמעותית בהשוואה לתאים שמסביב. כתוצאה מכך, ה-BM מתבטא כפס בהיר רציף במפות המודול של יאנג שהתקבלו. עם זאת, מבנים ביולוגיים אחרים מציגים תכונות מכניות שאינן נבדלות מספיק מאלו של הרקמה הסובבת כדי לאפשר סינון מרחבי בתוצאות המפה. למרות שניתן לשלב את הפרוטוקול עם שיטות אחרות לזיהוי מבנים במפות הכוח המוקלטות, כגון צביעה אימונופלואורסצנטית, גישה זו עשויה להניב תוצאות מאתגרות לפרשנות. סיבוך זה עלול להתרחש מכיוון שהליכי צביעה יכולים לשנות את התכונות המכניות של רקמות. כתוצאה מכך, כל עיבוד או צביעה של הרקמה לפני מדידות AFM צריך להתבצע רק כאשר אין שיטה חלופית זמינה לזיהוי התכונה המעניינת. יתר על כן, חשוב לבצע ניסויי בקרה מתאימים המשווים את התכונות הביומכניות של דגימות מוכתמות ולא מוכתמות.
הפרוטוקול מציג שיטה לזיהוי מבני מטרה המבוססת על ניגודיות המודול של יאנג. כתוצאה מכך, ניתן למרוח אותו על רקמות בעלות BM אנטומי הדומה לזה של הריאה, כולל בלוטת התריס, המעי הגס והערמונית. (ראה איור נתונים מורחב ב- Hartmann et al.59). בעוד שפותח בתחילה לניתוח מכניקת BM, פרוטוקול זה וארגז הכלים לעיבוד CANTER56 הם רב-תכליתיים מספיק כדי לבחון כל אזור מובחן ומחובר מכנית בתוך מפות כוח AFM (עיין בהוראות ב-www.github.com/CANTERhm/CANTER_Processing_Tool/wiki). ישימות רחבה זו הופכת את הכלי הזה לבעל ערך בכל תחום ה-AFM ותומכת בהתמקדות הגוברת במכניוביולוגיה בקהילה המדעית הרחבה יותר.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
B.H., ו-H.C.-S. להכיר במימון ממשרד המדע והאמנויות של מדינת בוואריה באמצעות מיקוד המחקר הבווארי Herstellung und biophysikalische Charakterisierung von dreidimensionalen Geweben (CANTER) והפורום האקדמי הבווארי (BayWISS) - קונסורציום מחקר בריאות דוקטורט. פיתוח תוכנת ניתוח הנתונים CANTER Processing Toolbox מומן על ידי קרן המחקר הגרמנית כחלק מתת-פרויקט 1 (CL 409/4-1/2) של קונסורציום המחקר חקר סחוס מפרקי וניוון עצם תת-כונדרלית והתחדשות בדלקת מפרקים ניוונית - ExCarBon (FOR2407-1/2). B.H. ו-H.C.-S. להכיר במימון מקרן המחקר הגרמנית באמצעות קמפיין המכשור הגדול GGA-HAW (INST 99/38-1). עבודה זו נתמכה גם על ידי האגודה הדנית לסרטן (R204-A12454 (R.R.)) וקרן המחקר הגרמנית (539446614 ל-R.R).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | B Braun | 9166017V | Injekt-F |
| 10 mL Syringe | B Braun | 4606108V | Injekt Luer Solo |
| 15 mL Falcon tube | Sarstedt | 62.554.002 | screw cap tube |
| Cantilever - MLCT | Bruker AFM Probes | 3444 | AFM cantilever with a pyramidal tip shape |
| Cryotome blades | Leica Biosystems | 14035843496 | Low-profile disposable blades DB80LX |
| Cryotome sample holder | Leica Biosystems | 14047740044 | Specimen disc 30 |
| Cyotome | Leica Biosystems | CM1950 | Leica Cryostat |
| Direct Overlay Extension | Bruker | Software extension for the JPK SPM Software which enables to import the optical image of the inverted microscope into the Data Viewer of the SPM software. | |
| Disposable base mold | Science Services | SA62534-15 | Tissue-Tek Cryomold 15x15x5 mm |
| Double-sided tape | tesa Film | 56661-00002 | Photo Film Tape |
| Fixed-Spring Cantilever Holder | Bruker | ||
| Inverted Microscope - Leica DMi8 | Leica Microsystems | ||
| JPK Motorized Stage | Bruker | ||
| JPK NanoWizard 4XP BioScience | Bruker | ||
| JPK SPM Software | Bruker | ||
| K5 CMOS Microscope Kamera | Leica Microsystems | ||
| MATLAB | Mathworks | Version R2024a or higher | |
| MATLAB - Curve Fitting Toolbox | Mathworks | ||
| MATLAB - Image Processing Toolbox | Mathworks | ||
| MATLAB - Signal Processing Toolbox | Mathworks | ||
| MATLAB - Statistics and Machine Learning Toolbox | Mathworks | ||
| Microscope slides | Carl Roth | H869.1 | Plain microscope slides for cantilever calibration |
| Microscope slides - frosted edge | Carl Roth | H870.1 | Microscope slides with frosted edge for cryosectioning |
| Needle ø0.9 mm × 25 mm | B Braun | 4657500 | OCT injection into the lung sample |
| Needle ø0.9 mm × 70 mm | B Braun | 4665791 | Long needle to apply PBS under the AFM |
| OCT compound | Sakura Finetek | 4583 | Tissue-Tek O.C.T. Compound |
| Phosphate Buffered Saline | Bio&Sell | BS.L1825 | PBS solution without Ca2+, Mg2+, 500 mL |
| QI Advanced Imaging Extension | Bruker | Software extension for the JPK SPM Software which provides for each recorded image pixel the whole underlying force curve. | |
| Scalpel | B Braun | 5518083 | Surgical Disposable Scalpel |
| Scissors | Kaut-Bullinger | M681700 | Precise Scissors 13 cm |
| Single-sided tape | tesa Film | 57330-00000 | crystal clear tape, 33 m x 19 mm |
| Slide box | GWL Storing Systems | K50W | Slidebox for 50 slides |
| Stereo Microscope - Stemi DR1663 | Zeiss | ||
| Tweezers - Vomm SS-SA-ESD | Eleshop | ELE002121 |
References
- Alsteens, D., et al. Atomic force microscopy-based characterization and design of biointerfaces. Nat Rev Mater. 2 (5), 17008 (2017).
- Aro, E., et al. Severe extracellular matrix abnormalities and chondrodysplasia in mice lacking collagen prolyl 4-hydroxylase isoenzyme II in combination with a reduced amount of isoenzyme I. J Biol Chem. 290 (27), 16964-16978 (2015).
- Domke, J., Radmacher, M. Measuring the elastic properties of thin polymer films with the atomic force microscope. Langmuir. 14 (12), 3320-3325 (1998).
- Huth, S., Sindt, S., Selhuber-Unkel, C. Automated analysis of soft hydrogel microindentation: Impact of various indentation parameters on the measurement of Young's modulus. PLoS One. 14 (8), e0220281 (2019).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nat Rev Phys. 1 (1), 41-57 (2019).
- Loparic, M., et al. Micro- and nanomechanical analysis of articular cartilage by indentation-type atomic force microscopy: validation with a gel-microfiber composite. Biophys J. 98 (11), 2731-2740 (2010).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nat Nanotechnol. 7 (11), 757-765 (2012).
- Prein, C., et al. Structural and mechanical properties of the proliferative zone of the developing murine growth plate cartilage assessed by atomic force microscopy. Matrix Biol. 50, 1-15 (2016).
- Radmacher, M., Fritz, M., Kacher, C. M., Cleveland, J. P., Hansma, P. K. Measuring the viscoelastic properties of human platelets with the atomic force microscope. Biophys J. 70 (1), 556-567 (1996).
- Radmacher, M., Tillamnn, R. W., Fritz, M., Gaub, H. E. From molecules to cells: imaging soft samples with the atomic force microscope. Science. 257 (5078), 1900-1905 (1992).
- Stolz, M., et al. Early detection of aging cartilage and osteoarthritis in mice and patient samples using atomic force microscopy. Nat Nanotechnol. 4, 186-192 (2009).
- Stolz, M., et al. Dynamic elastic modulus of porcine articular cartilage determined at two different levels of tissue organization by indentation-type atomic force microscopy. Biophys J. 86 (5), 3269-3283 (2004).
- Florin, E. L., Moy, V. T., Gaub, H. E. Adhesion forces between individual ligand-receptor pairs. Science. 264 (5157), 415-417 (1994).
- Hansma, P. K., et al. Tapping mode atomic force microscopy in liquids. Appl Phys Lett. 64 (13), 1738-1740 (1994).
- Moy, V. T., Florin, E. L., Gaub, H. E. Intermolecular forces and energies between ligands and receptors. Science. 266 (5183), 257-259 (1994).
- Radmacher, M., Fritz, M., Hansma, H. G., Hansma, P. K. Direct observation of enzyme activity with the atomic force microscope. Science. 265 (5178), 1577-1579 (1994).
- Radmacher, M., Fritz, M., Hansma, P. K. Imaging soft samples with the atomic force microscope: gelatin in water and propanol. Biophys J. 69 (1), 264-270 (1995).
- Rief, M., Clausen-Schaumann, H., Gaub, H. E. Sequence-dependent mechanics of single DNA molecules. Nat Struct Biol. 6 (4), 346-349 (1999).
- Rief, M., Gautel, M., Oesterhelt, F., Fernandez, J. M., Gaub, H. E. Reversible unfolding of individual titin immunoglobulin domains by AFM. Science. 276 (5315), 1109-1112 (1997).
- Drake, B., et al. Imaging crystals, polymers, and processes in water with the atomic force microscope. Science. 243 (4898), 1586-1589 (1989).
- Clausen-Schaumann, H., Rief, M., Tolksdorf, C., Gaub, H. E. Mechanical stability of single DNA molecules. Biophys J. 78 (4), 1997-2007 (2000).
- Rotsch, C., Radmacher, M. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study. Biophys J. 78 (1), 520-535 (2000).
- Lekka, M., et al. Elasticity of normal and cancerous human bladder cells studied by scanning force microscopy. Eur Biophys J. 28 (4), 312-316 (1999).
- Weisenhorn, A. L., Khorsandi, M., Kasas, S., Gotzos, V., Butt, H. J. Deformation and height anomaly of soft surfaces studied with an AFM. Nanotechnology. 4 (2), 106 (1993).
- Rotsch, C., Jacobson, K., Radmacher, M. Dimensional and mechanical dynamics of active and stable edges in motile fibroblasts investigated by using atomic force microscopy. Proc Natl Acad Sci USA. 96 (3), 921-926 (1999).
- Goldmann, W. H., Ezzell, R. M. Viscoelasticity in wild-type and vinculin-deficient (5.51) mouse F9 embryonic carcinoma cells examined by atomic force microscopy and rheology. Exp Cell Res. 226 (1), 234-237 (1996).
- Tschaikowsky, M., et al. Hybrid fluorescence-AFM explores articular surface degeneration in early osteoarthritis across length scales. Acta Biomater. 126, 315-325 (2021).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthr Cartilage. 29 (2), 269-279 (2021).
- Kinney, J. H., Balooch, M., Marshall, S. J., Marshall, G. W., Weihs, T. P. Atomic force microscope measurements of the hardness and elasticity of peritubular and intertubular human dentin. J Biomech Eng. 118 (1), 133-135 (1996).
- Lundkvist, A., et al. . Symposium on Thin Films - Stresses and Mechanical Properties VI,. 1996 MRS Spring Meeting. , 353-358 (1997).
- Tao, N. J., Lindsay, S. M., Lees, S. Measuring the microelastic properties of biological material. Biophys J. 63 (4), 1165-1169 (1992).
- Radmacher, M. Measuring the elastic properties of biological samples with the AFM. IEEE Eng Med Biol Mag. 16 (2), 47-57 (1997).
- Becke, T. D., et al. Pilus-1 backbone protein RrgB of Streptococcus pneumoniae binds collagen I in a force-dependent way. ACS Nano. 13 (6), 7155-7165 (2019).
- Becke, T. D., et al. Single molecule force spectroscopy reveals two-domain binding mode of Pilus-1 tip protein RrgA of Streptococcus pneumoniae to fibronectin. ACS Nano. 12 (1), 549-558 (2018).
- Pill, M. F., East, A. L. L., Marx, D., Beyer, M. K., Clausen-Schaumann, H. Mechanical activation drastically accelerates amide bond hydrolysis, matching enzyme activity. Angew Chem Int Ed Engl. 58 (29), 9787-9790 (2019).
- Schmidt, S. W., Filippov, P., Kersch, A., Beyer, M. K., Clausen-Schaumann, H. Single-molecule force-clamp experiments reveal kinetics of mechanically activated silyl ester hydrolysis. ACS Nano. 6 (2), 1314-1321 (2012).
- Docheva, D., et al. Researching into the cellular shape, volume and elasticity of mesenchymal stem cells, osteoblasts and osteosarcoma cells by atomic force microscopy. J Cell Mol Med. 12 (2), 537-552 (2008).
- Docheva, D., Padula, D., Schieker, M., Clausen-Schaumann, H. Effect of collagen I and fibronectin on the adhesion, elasticity and cytoskeletal organization of prostate cancer cells. Biochem Biophys Res Commun. 402 (2), 361-366 (2010).
- Kiderlen, S., et al. Age related changes in cell stiffness of tendon stem/progenitor cells and a rejuvenating effect of ROCK-inhibition. Biochem Biophys Res Commun. 509 (3), 839-844 (2019).
- Reuten, R., et al. Structural decoding of netrin-4 reveals a regulatory function towards mature basement membranes. Nat Commun. 7, 13515 (2016).
- Fleischhauer, L., et al. Nano-scale mechanical properties of the articular cartilage zones in a mouse model of post-traumatic osteoarthritis. Appl Sci. 12 (5), 2596 (2022).
- Alberton, P., et al. Aggrecan hypomorphism compromises articular cartilage biomechanical properties and is associated with increased incidence of spontaneous osteoarthritis. Int J Mol Sci. 20 (5), 1-16 (2019).
- Alberton, P., et al. Aggrecan is critical in maintaining the cartilage matrix biomechanics which in turn influences the correct development of the growth plate. Osteoarthr Cartilage. 27, S178-S178 (2019).
- Gronau, T., et al. Forced exercise-induced osteoarthritis is attenuated in mice lacking the small leucine-rich proteoglycan decorin. Ann Rheum Dis. 76 (2), 442-449 (2017).
- Hartmann, B., et al. Early detection of cartilage degeneration: A comparison of histology, fiber Bragg grating-based micro-indentation, and atomic force microscopy-based nano-indentation. Int J Mol Sci. 21 (19), 7384-7398 (2020).
- Rellmann, Y., et al. ER stress in ERp57 knockout knee joint chondrocytes induces osteoarthritic cartilage degradation and osteophyte formation. Int J Mol Sci. 23 (1), 182 (2021).
- Kamper, M., et al. Early changes in morphology, bone mineral density and matrix composition of vertebrae lead to disc degeneration in aged collagen IX -/- mice. Matrix Biol. 49, 132-143 (2016).
- Akhtar, R., Sherratt, M. J., Cruickshank, J. K., Derby, B. Characterizing the elastic properties of tissues. Mater Today. 14 (3), 96-105 (2011).
- Junior, C., et al. Baseline stiffness modulates the non-linear response to stretch of the extracellular matrix in pulmonary fibrosis. Int J Mol Sci. 22 (23), 12928 (2021).
- Junior, C., et al. Multi-step extracellular matrix remodelling and stiffening in the development of idiopathic pulmonary fibrosis. Int J Mol Sci. 24 (2), 1708 (2023).
- Sicard, D., Fredenburgh, L. E., Tschumperlin, D. J. Measured pulmonary arterial tissue stiffness is highly sensitive to AFM indenter dimensions. J Mech Behav Biomed Mater. 74, 118-127 (2017).
- Zemla, J., et al. AFM-based nanomechanical characterization of bronchoscopic samples in asthma patients. J Mol Recognit. 31 (12), e2752 (2018).
- Reuten, R., et al. Basement membrane stiffness determines metastases formation. Nat Mater. 20 (6), 892-903 (2021).
- Johnstone, A. H. CRC Handbook of Chemistry and Physics. J Chem Technol Biotechnol. 50 (2), 294-295 (1991).
- Rico, F., et al. Probing mechanical properties of living cells by atomic force microscopy with blunted pyramidal cantilever tips. Phys Rev E. 72 (2), 1-10 (2005).
- . . CANTER Processing Toolbox v.5.7.0. , (2022).
- Hutter, J. L. J. B. Calibration of atomic-force microscope tips. Rev Sci Instrum. 64 (7), 1868-1873 (1993).
- Schillers, H., et al. Standardized nanomechanical atomic force microscopy procedure (SNAP) for measuring soft and biological samples. Sci Rep. 7 (1), 5117 (2017).
- Hartmann, B., et al. Profiling native pulmonary basement membrane stiffness using atomic force microscopy. Nat Protoc. 19 (5), 1498-1528 (2024).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophys J. 82 (5), 2798-2810 (2002).
- Jolicoeur, P. . Introduction to Biometry. , (1999).
- Bronshtein, I. N., Semendyayev, K. A., Musiol, G., Mühlig, H. . Handbook of Mathematics. , (2015).
- Fiore, V. F., et al. Mechanics of a multilayer epithelium instruct tumour architecture and function. Nature. 585 (7825), 433-439 (2020).
- Koester, J., et al. Niche stiffening compromises hair follicle stem cell potential during ageing by reducing bivalent promoter accessibility. Nat Cell Biol. 23 (7), 771-781 (2021).
- Bedzhov, I., Zernicka-Goetz, M. Self-organizing properties of mouse pluripotent cells initiate morphogenesis upon implantation. Cell. 156 (5), 1032-1044 (2014).
- Kyprianou, C., et al. Basement membrane remodelling regulates mouse embryogenesis. Nature. 582 (7811), 253-258 (2020).
- Saraswathibhatla, A., Indana, D., Chaudhuri, O. Cell-extracellular matrix mechanotransduction in 3D. Nat Rev Mol Cell Biol. 24 (7), 495-516 (2023).
- Sherwood, D. R. Basement membrane remodeling guides cell migration and cell morphogenesis during development. Curr Opin Cell Biol. 72, 19-27 (2021).
- Ashkin, A., Dziedzic, J. M., Bjorkholm, J. E., Chu, S. Observation of a single-beam gradient force optical trap for dielectric particles. Opt Lett. 11 (5), 288 (1986).
- Marago, O. M., Jones, P. H., Gucciardi, P. G., Volpe, G., Ferrari, A. C. Optical trapping and manipulation of nanostructures. Nat Nanotechnol. 8 (11), 807-819 (2013).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5 (6), 491-505 (2008).
- Marchi, G., et al. Microindentation sensor system based on an optical fiber Bragg grating for the mechanical characterization of articular cartilage by stress-relaxation. Sens Actuators B. 252, 440-449 (2017).
- Wakitani, S., et al. Repair of large full-thickness articular cartilage defects with allograft articular chondrocytes embedded in a collagen gel. Tissue Eng. 4 (4), 429-444 (1998).
- Moutos, F. T., Freed, L. E., Guilak, F. A biomimetic three-dimensional woven composite scaffold for functional tissue engineering of cartilage. Nat Mater. 6 (2), 162-167 (2007).
- Schwarz, S., et al. Contactless vibrational analysis of transparent hydrogel structures using laser-Doppler vibrometry. Exp Mech. 60 (8), 1067-1078 (2020).
- Bhave, G., Colon, S., Ferrell, N. The sulfilimine cross-link of collagen IV contributes to kidney tubular basement membrane stiffness. Am J Physiol Renal Physiol. 313 (3), F596-F602 (2017).
- Fisher, R. F., Wakely, J. The elastic constants and ultrastructural organization of a basement membrane (lens capsule). Proc R Soc Lond B Biol Sci. 193 (1113), 335-358 (1976).
- Wisdom, K. M., et al. Covalent cross-linking of basement membrane-like matrices physically restricts invasive protrusions in breast cancer cells. Matrix Biol. 85-86, 94-111 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved