עקרון לה שאטלייה
Overview
מקור: המעבדה של ד"ר לין אוקונל — מכללת בוסטון
כאשר התנאים של מערכת בשיווי משקל משתנים, המערכת מגיבה באופן כזה כדי לשמור על שיווי המשקל. בשנת 1888, אנרי-לואיס לה שאטלייה תיאר תופעה זו בעיקרון הקובע, "כאשר שינוי בטמפרטורה, בלחץ או בריכוז מפריע למערכת בשיווי משקל כימי, השינוי יתובל על ידי שינוי בהרכב שיווי המשקל".
ניסוי זה מדגים את העיקרון של Le Châtelier בעבודה בתגובה הפיכה בין ברזל (III) יון ויון thiocyanate, אשר מייצר ברזל (III) יון thiocyante:
Fe3+(aq) + SCN- (aq)  FeSCN2+ (aq)
FeSCN2+ (aq)
הריכוז של אחד היונים משתנה או על ידי הוספת כמות של יון אחד לפתרון או על ידי הסרה סלקטיבית של יון מהפתרון באמצעות היווצרות מלח בלתי מסיס. תצפיות של שינויי צבע מצביעות אם שיווי המשקל עבר לטובת היווצרות של המוצרים או המגיבים. בנוסף, ניתן לראות את ההשפעה של שינוי טמפרטורה על הפתרון בשיווי משקל, מה שמוביל ליכולת להסיק אם התגובה היא אקסותרמית או אנדותרמית.
Principles
כדי להבין באופן מלא את עקרון לה שאטלייה, תגובה הפיכה מהסוג המובע על ידי המשוואה הכימית הבאה נחשבת:
aA + bB  cC + dD
cC + dD
תגובה זו מורכבת למעשה משני תהליכים מתחרים: התגובה קדימה, שבה נוצרים המוצרים C ו- D מהמגיבים, והתגובה ההפוכה, שבה נוצרים המגיבים A ו- B מהמוצרים. כאשר שיעורי שני התהליכים האלה שווים זה לזה, אין שינוי נטו בריכוז של המוצרים או המגיבים, והתגובה אמורה להיות בשיווי משקל. היחס בין ריכוזי שיווי המשקל של המוצרים לריכוז שיווי המשקל של המגיבים הוא קבוע, כפי שמוצג במשוואה הבאה:

כאשר Kc הוא קבוע שיווי המשקל. הסוגריים מסמלים את ריכוזי המינים השונים, והאותיות באותיות קטנות מייצגות את מספר המולים של כל חומר המעורב במשוואה המאוזנת. במקרה של התגובה בין ברזל(III) ויונים תיוצינאט שהוצגו בעבר, קבוע שיווי המשקל הוא:
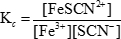
כאשר הריכוז של מגיב או מוצר בתמיסת שיווי משקל משתנה, הריכוזים של המינים האחרים חייבים להשתנות על מנת לשמור על היחס המתמיד של מוצרים למגיבים. שינויים אלה מכונים "משמרות" בשיווי המשקל. שיווי המשקל יכול לנוע שמאלה, כלומר הוא ממשיך בכיוון ההפוך והריכוזים של המגיבים גדלים, או זזים ימינה, כלומר הוא ממשיך בכיוון קדימה והריכוזים של המוצרים גדלים. בתגובה בין ברזל(III) ויונים תיוצינאט, שינוי שמאלה פירושו היווצרות של יותר ברזל(III) ויונים תיוצינאטים, בעוד מעבר ימינה פירושו היווצרות של יותר ברזל (III) יונים תיוצינאט.
קבוע שיווי המשקל תלוי בטמפרטורה; לכן, שינוי בטמפרטורה של פתרון שיווי משקל יכול גם לגרום לשינוי ימינה או שמאלה, תלוי אם התגובה היא אקסותרמית או אנדותרמית. עבור תגובה אקסותרמית, החום שנוצר על ידי התגובה יכול להיות מיוצג כמגורים בצד המוצר של המשוואה, שכן חום מיוצר יחד עם המוצרים:
aA + bB  cC + dD + חום
cC + dD + חום
אם החום מתווסף למערכת על ידי הגדלת הטמפרטורה, שיווי המשקל משתנה שמאלה, וריכוז המגיבים גדלים. לתגובה אנדותרמית, תוספת החום תגרום לשינוי ימינה.
aA + bB +  חום cC + dD
חום cC + dD
במקרה זה, ריכוזי המגיבים יגדלו עם עלייה בטמפרטורה.
Procedure
1. הכנת פתרונות שיווי משקל תיוצינאט ברזל(III)
- מניחים 1 טיפה של 1 M Fe(NO3)3 פתרון במבחנה לדלל עם 2 מ"ל של מים. מניחים 1 טיפה של 1 M KSCN במבחנה אחרת לדלל עם 2 מ"ל של מים. שתי מבחנות אלה משמשות כפקדים להשוואה לעומת המבחנות האחרות.
- מקם 1 טיפה של 1 M Fe(NO3)3 פתרון במבחנה.
- הוסף טיפה אחת של 1 M KSCN למבחנה.
- מוסיפים 16 מ"ל מים למבחנה ומערבבים היטב את התוכן.
- תקליט תצפיות.
- מחלקים את התערובת ל-2 מ"ל ב-8 מבחנות. אחת המבחנות נותרה ללא פגע ומשמשת כשליטת FeSCN2+ . מספר המבחנות האחרות 1-7.
2. הוספת ברזל(III) ויונים תיוצינאטים לפתרון שיווי המשקל
- כדי מבחן 1, להוסיף 1 טיפה של 1 M Fe(NO3)3 פתרון.
- לנער כדי לערבב ולהקליט כל תצפיות.
- כדי מבחן 2, להוסיף 1 טיפה של פתרון KSCN אחד.
- לנער כדי לערבב ולהקליט כל תצפיות.
3. הוספת חנקות כסף לפתרון שיווי המשקל
- כדי מבחן 3, להוסיף 3 טיפות של פתרון 0.1 M AgNO3.
- לנער כדי לערבב ולהקליט כל תצפיות.
- הוסף 3 טיפות של 1 M Fe (NO3)3 למבחנה.
- לנער כדי לערבב ולהקליט כל תצפיות.
- כדי מבחן 4, להוסיף 3 טיפות של פתרון 0.1 M AgNO3.
- לנער כדי לערבב ולהקליט כל תצפיות.
- הוסף 3 טיפות של 1 M KSCN למבחנה.
- לנער כדי לערבב ולהקליט כל תצפיות.
4. תוספת אשלגן פוספט לתמיסת שיווי המשקל
- כדי מבחנה 5, להוסיף 3 טיפות של 0.5 M K3PO4 פתרון.
- לנער כדי לערבב ולהקליט כל תצפיות.
- הוסף 3 טיפות של 1 M Fe (NO3)3 למבחנה.
- לנער כדי לערבב ולהקליט כל תצפיות.
- כדי מבחנה 6, להוסיף 3 טיפות של 0.5 M K3PO4 פתרון.
- לנער כדי לערבב ולהקליט כל תצפיות.
- הוסף 3 טיפות של 1 M KSCN למבחנה.
- לנער כדי לערבב ולהקליט כל תצפיות.
5. שינוי טמפרטורת פתרון שיווי המשקל
- מניחים מבחנה 7 באמבט מים 70-80 מעלות צלזיוס למשך 1-2 דקות.
- השווה את הפתרון החם לפתרון במבחנה הלא מחוממת (בקרת FeSCN2+), ותיעד תצפיות כלשהן.
- לאסוף את התוכן של מבחנות 3 ו 4 בצנצנת פסולת המעבדה שכותרתו "כסף". יוצקים את התוכן של כל המבחנות האחרות לביוב.
Results
תצפיות על הפתרונות הראשוניים ואת התערובת של שני הפתרונות ניתן לראות בטבלה 1.
תצפיות של תערובות שיווי משקל על תוספת של ריאגנטים שונים ניתן לראות בטבלה 2.
תצפית כאשר הטמפרטורה משתנה: במבחנה 7, הפתרון הופך כתום יותר בצבע (פחות אדום, יותר צהוב) כאשר מחומם.
במבחנות 1 ו -2, כאשר ברזל (III) חנקתי, המכיל מגיב, נוסף לפתרון שיווי המשקל, הצבע האדום של הפתרון התעצם. תצפית זו מצביעה על כך שיווי המשקל עבר ימינה כמו ריכוז של המוצר, ברזל (III) יון thiocyanate, גדל. באופן דומה, כאשר אשלגן thiocyanate, אשר מכיל את המגיב האחר, נוספה פתרון שיווי המשקל, הצבע האדום של הפתרון התעצם. תצפית זו גם מצביעה על כך שיווי המשקל עבר ימינה כמו ריכוז של המוצר גדל.
במבחנות 3 ו -4, כאשר כסף חנקתי (AgNO3) נוספהלפתרון שיווי המשקל, הצבע האדום של המוצר דהה והפתרון הפך חסר צבע. תצפית זו מצביעה על כך שיווי המשקל עבר שמאלה ככל שריכוז המגיבים גדל. בנוסף, נצפתה משקעים. הצבע האדום הופיע מחדש בתוספת יון תיוצינאט (SCN-). תצפית זו מצביעה על כך שיווי המשקל זז ימינה ככל שריכוז המוצר גדל. הצבע האדום לא הופיע שוב כאשר יון ברזל (III) נוספה.
מתצפיות אלה, ניתן להסיק כי תיוצינאט כסף (AgSCN) היה המשקעים שנוצרו כאשר חנקת כסף נוספה לפתרון שיווי המשקל. היווצרות של מוצק זה אחראי לעננות שנצפו בשתי המבחנות. כאשר יון thiocyanate הוסר מהפתרון על ידי משקעים, שיווי המשקל עבר שמאלה, כי הריכוז של אחד המגיבים הופחת. כאשר נוספו אז עוד יון תיוצינאט, שיווי המשקל נע חזרה ימינה כדי לבסס מחדש את יחס שיווי המשקל של ריכוזים על ידי יצירת מחדש של ברזל (III) תיוצינאט. תוספת של יותר ברזל (III) יון לא העבירה את שיווי המשקל בחזרה ימינה, כי יון thiocyanate הוסר מהפתרון כמו מזרז תיוצינאט כסף כבר לא היה זמין להגיב עם ברזל (III) כדי ליצור את ברזל (III) יון thiocyanate.
במבחנות 5 ו -6, כאשר אשלגן פוספט יון (K3PO4) נוספה לפתרון שיווי המשקל, הצבע האדום של המוצרים דהה והפתרון הפך צהוב. תצפית זו מצביעה על כך שיווי המשקל עבר שמאלה ככל שריכוז המגיבים גדל. הצבע האדום הופיע מחדש בתוספת ברזל (III) יון (Fe3+). תצפית זו מצביעה על כך שיווי המשקל זז ימינה ככל שריכוז המוצר גדל. בנוסף, נצפתה משקעים. הצבע האדום לא הופיע שוב כאשר יון תיוצינאט (SCN-) נוסף.
מתוך תצפיות אלה, ניתן להסיק כי ברזל (III) פוספט (FePO4)מלח נוצר כאשר אשלגן פוספט נוספה לתמיסת שיווי המשקל. כאשר יון הברזל (III) הוסר מהתמיסה על ידי היווצרות מלח זה, שיווי המשקל עבר שמאלה, כי הריכוז של אחד המגיבים צומצם. כאשר נוסף אז יותר ברזל(III) יון, שיווי המשקל נע חזרה ימינה כדי לבסס מחדש את יחס שיווי המשקל של ריכוזים על ידי יצירת ברזל מחדש (III) thiocyante. למרות שלא זוהתה עננות על ידי ראייה כאשר יון הפוספט נוספה בתחילה, עננות הופיעה כאשר יון הברזל (III) נוספה לאחר מכן, שהוא מלח ברזל מוצק (III). התוספת של יותר יון תיוצינאט לא הסיטה את שיווי המשקל בחזרה ימינה, מכיוון שיון הברזל (III) הוסר מהתמיסה כמלח פוספט מברזל(III) וכבר לא היה זמין להגיב עם יון תיוצינאט כדי ליצור את יון הטיוצינאט הברזל(III).
במבחנה 7, ככל שהטמפרטורה עלתה, הצבע האדום של המוצרים דהה, מה שמצביע על שיווי משקל שמאלה ככל שנוצרו יותר מגיבים. תצפית זו מובילה למסקנה כי התגובה היא אקסותרמית. עבור תגובה אקסותרמית, החום שנוצר על ידי התגובה שוכן בצד המוצר של המשוואה:
Fe3+ + SCN-  FeSCN2 + חום
FeSCN2 + חום
כאשר החום נוסף למערכת (על ידי הגדלת הטמפרטורה), שיווי המשקל עבר שמאלה.
| תמיסה | תצפית |
| Fe(NO3)3 | צהוב, ברור |
| KSCN | חסר צבע, ברור |
| Fe (SCN)2+ | כתום-אדום, ברור |
טבלה 1. תצפיות על הפתרונות הראשוניים ועל התערובת של שני הפתרונות.
| מבחנה # | ריאגנט ראשון | תצפית על פתרון שיווי משקל | ריאגנט שני | תצפית על פתרון שיווי משקל |
| 1 | Fe(NO3)3
|
אדום, ברור | — | — |
| 2 | KSCN
|
אדום, ברור | — | — |
| 3 | AgNO3 (חסר צבע, ברור) | חסר צבע (לבן), מעונן | Fe(NO3)3 | צהוב, עדיין מעונן |
| 4 | אגנו3 | חסר צבע (לבן), מעונן | KSCN | כתום-אדום, עדיין מעונן |
| 5 | K3PO4 (חסר צבע, ברור) | צהוב, ברור | Fe(NO3)3 | כתום-אדום, מעונן |
| 6 | K3PO4 | צהוב, ברור | KSCN | צהוב, עדיין ברור |
טבלה 2. תצפיות על תערובות שיווי המשקל על תוספת של ריאגנטים שונים.
Application and Summary
העיקרון של לה שאטלייה פועל בגופי אדם. חמצן מועבר מהריאות לשרירים ולרקמות אחרות על ידי חלבון הנקרא המוגלובין (Hb) שנמצא בדם. מולקולת החמצן נקשרת לחלבון זה בתגובה הפיכה שניתן לתאר על ידי משוואת שיווי משקל:
Hb + 4 O2  Hb(O2)4
Hb(O2)4
בריאות, הלחץ החלקי של גז חמצן גבוה (בסדר גודל של 100 טור). שיווי המשקל זז ימינה בסביבה זו, ומולקולות החמצן נקשרות למולקולות המוגלובין עד שהחלבון רווי בחמצן. כאשר המוגלובין רווי זה מגיע לתאי רקמת השריר, שם לחץ החמצן נמוך בהרבה, שיווי המשקל זז שמאלה, והחמצן משתחרר. אם השריר נמצא במנוחה, לחץ החמצן הוא כ -30 טור, וכ -40% מהחמצן משתחרר. כאשר השריר פעיל, לחץ החמצן נע בין 3 ל 18 torr, וכ -85% מהחמצן משתחרר כדי לספק את הביקוש המטבולי המוגבר.
דוגמה פיזיולוגית נוספת של מערכת שיווי משקל כרוכה בוויסות של pH דם. פחמן דו חמצני בדם מגיב באופן הפיך עם מים כדי לייצר חומצה פחמתית, אשר dissociates לייצר הידרוניום ויונים ביקרבונט:
CO2 (aq) + H2O(l)  H2CO3 (aq)
H2CO3 (aq)  H3O+ (aq) + HCO3-(aq)
H3O+ (aq) + HCO3-(aq)
במהלך פעילות גופנית מאומצת, כמות הפחמן הדו חמצני המיוצר על ידי התאים עולה כתוצאה מפעילות מטבולית גבוהה. הריכוז המוגבר של פחמן דו חמצני בדם גורם לשינוי ימינה בשיווי משקל זה כדי לייצר יותר חומצה פחמתית. כאשר זה קורה, רמת ה- pH של הדם יורדת ככל שריכוז ההידרוניום יונים עולה. אחת התגובות של הגוף לחוסר איזון זה ב- pH בדם היא להגביר את קצב הנשימה כך שיותר גז פחמן דו חמצני נושף מהריאות, ובכך להסיט את שיווי המשקל בחזרה שמאלה ולהעלות את ה- pH בחזרה לרמות נורמליות.
יש לקחת בחשבון את העיקרון של לה שאטלייה גם בתהליכים תעשייתיים רבים. אמוניה היא כימיקל חשוב המשמש דשנים, חומרי ניקוי, וכקן בניין בתגובות אורגניות סינתטיות. הייצור התעשייתי של אמוניה מושג באמצעות תהליך הבר, אשר מסתמך על התגובה ההיכונה בין מימן וחנקן:
3 H2 (ז)+ N2 (ז)  2 NH3 (ז)
2 NH3 (ז)
על מנת לייעל את הייצור של אמוניה, התגובה מופעלת בלחץ גבוה, בדרך כלל סביב 200 atm. יש 4 מולים של גז בצד שמאל של המשוואה ו-2 מולים של גז בצד ימין. העיקרון של לה שאטלייה מכתיב כי הגברת הלחץ על המערכת מעבירה את שיווי המשקל ימינה, מכיוון שהנפח של 2 מולים של גז קטן מהיקף של 4 מולים של גז. מכיוון שהנפח והלחץ הם פרופורציונליים ישירות, שינוי בהפחתת הנפח גם מפחית את הלחץ, והמערכת חוזרת לשיווי משקל. בנוסף, התהליך כרוך בהנזלת גז האמוניה במדחה, ולכן הוא מוסר מתא התגובה. ירידה זו אמוניה גם מעבירה את שיווי המשקל ימינה, למקסם את כמות האמוניה המיוצרת.
Skip to...
Videos from this collection:

Now Playing
עקרון לה שאטלייה
General Chemistry
265.8K Views

כלי זכוכית ושימושים נפוצים במעבדה
General Chemistry
658.3K Views

פתרונות וריכוזים
General Chemistry
275.1K Views

קביעת הצפיפות של מוצק ונוזל
General Chemistry
556.8K Views

קביעת הרכב אחוז המסה בפתרון מימי
General Chemistry
383.8K Views

קביעת הנוסחה האמפירית
General Chemistry
183.7K Views

קביעת כללי המסיסות של תרכובות יוניות
General Chemistry
141.6K Views

שימוש במד pH
General Chemistry
346.7K Views

מבוא לתמצית
General Chemistry
425.4K Views

חוק הגז האידיאלי
General Chemistry
79.0K Views

קביעת ספקטרופוטומטריה של קבוע שיווי משקל
General Chemistry
158.7K Views

דיכאון נקודת הקפאה כדי לקבוע תרכובת לא ידועה
General Chemistry
160.8K Views

קביעת חוקי התעריפים וסדר התגובה
General Chemistry
196.3K Views

שימוש בסריקה דיפרנציאלית קלורימטריה למדידת שינויים באנטלפיה
General Chemistry
44.7K Views

מתחמי כימיה של תיאום
General Chemistry
91.7K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved