È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Alta velocità Droplet basato Delivery System per pompaggio passiva in dispositivi microfluidici
In questo articolo
Riepilogo
Un nuovo sistema di microfluidica è stato sviluppato utilizzando il fenomeno del pompaggio passiva e di un controllo utente del sistema di consegna del fluido. Questo sistema di microfluidica ha il potenziale per essere utilizzato in una vasta gamma di applicazioni biologiche dato il suo basso costo, facilità d'uso, precisione volumetrica, alta velocità, ripetibilità e automazione.
Abstract
Un nuovo sistema di microfluidica è stato sviluppato che utilizza il fenomeno del pompaggio passivo con un sistema controllato utente fluido a base di consegna delle gocce. Passivo di pompaggio è il fenomeno per cui la tensione superficiale indotto pressione disco differenze movimento fluido nei canali chiusi. Il sistema automatico di erogazione del liquido è costituito da una serie di valvole di tensione controllata con micro-ugelli collegato ad un serbatoio fluido e un sistema di controllo. Queste valvole controllato in tensione offrono un modo preciso per fornire volumetricamente goccioline verso l'ingresso di un dispositivo a microfluidi in un modo ad alta frequenza. In base alle dimensioni illustrato nell'esempio studio, il sistema è in grado di fluire 4 millilitri al minuto (con un 2,2 millimetri di 260um sezione trasversale del canale). Sulla base di queste dimensioni sullo stesso canale, lo scambio fluido di un punto all'interno del canale può essere raggiunto in appena otto millesimi di secondo. Si osserva che non vi è interazione tra quantità di moto del sistema (impartita da una combinazione delle gocce creato dalle valvole e la velocità del fluido nel canale), e la tensione superficiale del liquido. Dove slancio fornisce velocità del flusso del fluido (o viceversa), equilibrio della tensione superficiale in ingresso fornisce un arresto improvviso di qualsiasi portata. Questo arresto improvviso permette all'utente di controllare le caratteristiche del flusso del canale e apre la porta per una varietà di applicazioni biologiche, che vanno da nessuna parte dalla consegna dei reagenti per farmaci a cellule studi. È anche osservato che quando gli ugelli sono finalizzate alla presa in angoli poco profonde, il momento delle gocce può causare ulteriori fenomeni fluido interessanti, come la miscelazione di goccioline più in entrata.
Protocollo
In questo rapporto si dimostra un metodo di consegna fluido che utilizza piccoli tensione superficiale delle gocce di pompare un volume desiderato attraverso un canale microfluidica al fine di ottenere una serie di fenomeni diversi fluidi. Per esempio, l'utente potrebbe desiderare di flusso di un fluido solo il più velocemente possibile, consegnare o fluidi diversi in rapida successione per creare specifici modelli fluidici. Per fare questo, l'utente deve prima avere un programma costruito intorno a un dispositivo a microfluidi. Il dispositivo microflluidic non ha bisogno di essere legato, ma dovrebbe essere costituito da un materiale idrofilo. Therfore, il metodo può essere utilizzato con qualsiasi dispositivo a microfluidi, con un andamento in gran parte dettata dai vincoli geometrici del canale microfluidica. Per aiutare a navigare i vincoli geometrici di questo metodo, un'introduzione all'analisi numerica rilevante è presentato per primo.
- Metodi analitici: Secondo la Legge di Laplace e la legge Washburn [1], si può riguardare la portata all'interno di un canale microfluidica alle sue dimensioni e le proprietà del liquido che scorre come si vede nella equazione (1),
 (1)
(1)
dove Δ P è la differenza di pressione tra l'ingresso e l'uscita, γ è la tensione superficiale liquido, R è il raggio goccia d'ingresso, Q è la portata e K è la resistenza fluida, come descritto dalla equazione (2),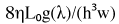 (2)
(2)
dove η è la viscosità del liquido, L 0 è la lunghezza del canale, h è l'altezza del canale, w è la larghezza del canale, λ = w / h, g (λ) = 1,5 se λ> 4,45 o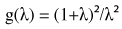
se λ <4.45. Sostituendo l'equazione (2) nella equazione (1), sempre nell'ipotesi che h (3)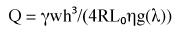
La stessa analisi può essere fatta per la velocità del fluido all'interno di un canale sapendo che Q = VA, dove V è la velocità media del fluido e A è l'area della sezione trasversale o hw. Inserendo queste nell'equazione (3) si arriva con l'equazione (4),
(4)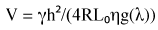
Un concetto importante meccanico che viene spesso applicato in biologia microfluidica è shear stress, che si riferisce alla portata e velocità dall'equazione (5),
(5)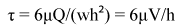
Conoscere la relazione tra portata, velocità e le loro implicazioni fisiche in funzione delle dimensioni dei canali e delle proprietà dei fluidi è cruciale nella progettazione di un dispositivo a microfluidi per un determinato scopo. Una volta che un dispositivo è stato creato, l'utente deve poi calibrare il sistema fluido di consegna da garantire le caratteristiche del flusso desiderato all'interno del dispositivo. - Passi in Impostazione e calibrazione del sistema di consegna:
- Creare un device microfluidica tramite soft-litografia tecnica usando polidimetilsilossano (PDMS, Sylgard 184, Dow Corning) [2]. Ci sono articoli numero JOVE che illustrano metodi per rendere PDMS dispositivi microfluidici [5]. Per questa dimostrazione, abbiamo scelto un canale semplice diritto, con le seguenti dimensioni: larghezza 2,2 mm, lunghezza 10 mm e altezza 260um. I diametri di entrata e di uscita sono rispettivamente di 1,8 millimetri e 5,1 millimetri (figura 1). Reversibilmente collegare dispositivo PDMS al vetrino premendolo su un vetrino (o altro substrato idoneo) e spremere eventuali bolle d'aria [5]. Un allegato reversibile permette al dispositivo di essere riutilizzato più volte. Il metodo può essere utilizzato anche con i dispositivi in modo permanente legato, ma non obbligatorio.
- Riempire dispositivo con liquido. La natura idrofobica del PDMS e la natura idrofila di aiuto vetro spostare una goccia che è posto all'ingresso o uscita, nel canale. Se la goccia di liquido non vuole entrare nel canale da solo o se bolle di entrare nel canale, l'utente può mettere una goccia di liquido in entrata o uscita, e utilizzare una pipetta dalla parte opposta a succhiare il liquido attraverso il canale. Un altro metodo per aiutare il passaggio liquido nel canale è separando il dispositivo PDMS dal vetrino e delicatamente la pulizia del dispositivo PDMS e il vetrino con etanolo. Questo restituisce al PDMS e il vetrino della loro natura idrofobica e idrofile, rispettivamente, che possono essere stati indeboliti con il tempo e l'uso.
- Dopo aver riempito dispositivo con liquido, posto una piccola goccia in entrata e una Bigger goccia in uscita. Assicurarsi che passiva di pompaggio sta accadendo guardando la piccola goccia nel crollo di ingresso e di osservare il flusso del fluido verso l'uscita. Anche in questo caso, assicurarsi che non vi siano bolle all'interno del canale.
- Utilizzando la Società di Lee [3] VHS micro kit di erogazione di partenza, mettere insieme una o più valvole (configurazione della valvola in figura 2) costituito dal VHS Lee M / 2 24 valvole Volt, un 0,062 ugelli MINSTAC con diametro di passaggio di 0,0100 ", il Lee 0,062 Minstac adattatore tubo morbido, la Spike Lee e Hold driver (per il controllo degli utenti, non mostrato) e l'Assemblea Conduttore (che collega la valvola a Spike e Hold driver, non mostrato).
- Un modo semplice per tenere la valvola è quello di utilizzare il Bioscience titolari di strumenti in miniatura (figura 2) [4]. Questi forniscono un modo per mirare con precisione e tenere la valvola in una certa posizione durante la sperimentazione incollando la valvola ad una estremità del titolare e con una base magnetica (non mostrato) sul lato opposto.
- Creare un sistema serbatoio da collocare a pochi metri sopra il dispositivo PDMS microfluidico (nel nostro caso abbiamo usato siringhe ¾ oz aperto l'ambiente, vedi figura 2). Il serbatoio offre una prevalenza di guidare gli ugelli, con la pressione che è proporzionale all'altezza del serbatoio. In alternativa le valvole dell'ugello può essere pressurizzato con qualsiasi numero di mezzi diversi (ad esempio, gas compresso). Inserire un ago di siringa siringa. Un ago della siringa tipico facilmente attaccare in tubi 1,14 mm di diametro interno. Il tubo di 1,14 mm sarà quindi facilmente collegare in 1,58 millimetri (1 / 16 ") tubi del diametro interno che poi si collega al" Adattatore tubo morbido "della valvola. Per evitare perdite di liquido in mm 1,14-1,58 connessione tubo mm, si può usare PDMS come sigillante. Ora che c'è una linea tra l'ago della siringa e la valvola di Lee Co., riempire i serbatoi siringa con un liquido. Una siringa e una valvola supplementare può essere usato per aiutare nel processo di epurazione (ma non etichettati mostrato in figura 2). Mettere un magnete al lato della valvola, questo è come queste valvole vengono eliminati (sono normalmente chiuse elettrovalvole), e iniziare a guardare liquido che scorre dal serbatoio attraverso la valvola e fuori l'ugello 0,0100''.
- Calibrare sistema scegliendo un tempo di apertura della valvola (tempo di apertura è il tempo che la valvola permette al liquido di passare su una base di impulsi per persona) e la frequenza (numero di impulsi al secondo). Attivare una valvola per un periodo scelto (un minuto o giù di lì, basta ricordare il tempo totale di esecuzione). Pesare il liquido che è stato consegnato dalla valvola. Conoscendo il tempo totale di esecuzione, frequenza e impulsi per tempo aperto, calcolare i grammi per millisecondo sparato fuori dalla valvola. Questo valore "grammi per millisecondo" vi permetterà di scegliere un tempo aperto per qualsiasi volume desiderato che l'utente può decidere di essere consegnati dalla valvola.
Esempio: Sistema attivato per un minuto (60 secondi). La frequenza di 15 Hz (15 impulsi al secondo). L'impulso per-tempo aperto è stato di 20 millisecondi (ms).
(20ms) (15Hz) (60) = 18000ms.
Ciò significa che, delle 60.000 ms in un minuto, la valvola era in realtà aperto a 18.000 ms.
Supponiamo che il volume di liquido consegnato pesava 5 grammi. Poi,
5 grammi / 18000 ms = 2.78e grammi -4 / ms.
Nel caso dell'acqua, con la sua densità è di un grammo per millilitro (ml),
2.78e grammi -4 / ms = 2.78e -4 ml / ms.
Dopo la calibrazione, il volume di una goccia dipende dal tempo aperto. Per esempio, con un tempo aperto di 20 ms, e tutti i parametri restanti lo stesso come nell'esempio precedente,
(2.78e -4 ml / ms) (20 ms) = 5.56e ml -3 = 5,56 microlitri.
Per trovare il tempo aperto y necessari per fare una goccia di x microlitro (mL) del volume,
(X mL) / [(2.78e -4 ml / ms) (1000 ml / ml)] = y ms
8) Puntare uno o più ugelli per l'ingresso del dispositivo PDMS (figura 3). Dopo aver calibrato il sistema, calcolare il volume in uscita di ogni valvola, in base a dimensioni dispositivo a microfluidi. Per passiva ad alta velocità di pompaggio (per ottenere massima portata), calcolare il volume di ingresso goccia necessario creare una goccia d'ingresso che possiede un angolo di 90deg contatto con la superficie di ingresso [2]. Per la creazione dei pacchetti, calcolare i tempi di frequenza e la valvola aperta e la valvola tempi necessari per attivare due valvole in sequenza. Come si vede in Figura 3, i due ugelli può essere puntato verso l'ingresso. Questo può estesa a ugelli multipli, tutti finalizzati alla presa del canale.
Rappresentante dei risultati:
Se adeguatamente calibrati, con tempi di valvola aperta correttamente calcolato e gli ugelli opportunamente finalizzati all'ingresso, l'utente dovrebbe essere in grado di vedere il flusso passivamente pompato (figura 4). Una raffica di sh liquidoould uscire dalla valvola e raggiungere l'ingresso. Come liquido raggiunge l'ingresso, c'è un crollo immediato del calo di ingresso nel canale, verso l'uscita. Liquido all'interno del canale si muove solo durante il crollo di una goccia d'ingresso. Movimento fluido completo all'interno del canale si ferma alla fine del crollo goccia, fornendo per l'arresto istantaneo del fluido e ben definiti i confini fluidi (nel caso che l'utente scorre più liquidi). La durata del crollo caduta dipende dal raggio di ingresso e il volume della goccia d'ingresso [1]. Nel nostro setup sperimentale e del design, crollo caduta di aspirazione si verifica nel giro di pochi millisecondi.

Figura 1. PDMS dispositivo a microfluidi con un ingresso, a sinistra, e uno sbocco, a destra. Si prega di cliccare qui per vedere una versione più grande della figura 1.

Figura 2. Serbatoio del sistema e la configurazione della valvola. Si prega di cliccare qui per vedere una versione più grande della figura 2.

Figura 3. Due valvole, entrambe volte a un ingresso singolo di un dispositivo a microfluidi. Si prega di cliccare qui per vedere una versione più grande della figura 3.

Figura 4. Time-step sequenza (33 millisecondi) del collasso goccia ingresso seguente espulsione del liquido da una valvola. Si prega di cliccare qui per vedere una versione più grande della figura 4.
Discussione
- Per passiva ad alta velocità di pompaggio, se la giusta combinazione di frequenza e il volume impulso per (a causa del tempo corretto aperta) viene scelto, l'utente dovrebbe vedere quello che sembra essere una goccia statico o conchiglia in ingresso e un flusso molto veloce all'interno del canale. Se si verifica un overflow, il tempo aperto e / o la frequenza sono troppo alti.
- Per rilevare lo slancio / superficie interazioni tensione, l'utente dovrebbe pompa un impulso alla volta e osservare l'ambiente intra-...
Riconoscimenti
Il finanziamento è stato fornito dall'Istituto Wisconsin di Discovery.
Riferimenti
- Berthier, E., Beebe, D. J. Flow rate analysis of a tension driven passive micropump. Lab Chip. 7, 1475-1478 (2007).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Anal. Chem. 70, 4974-4984 (1998).
- Harris, J., Lee, H., Vahidi, B., Tu, C., Cribbs, D., Cotman, C., NL, J. e. o. n. Non-plasma Bonding of PDMS for Inexpensive Fabrication of Microfluidic Devices. J Vis Exp. (9), (2007).
- Walker, G. M., Beebe, D. J. A passive pumping method for microfluidic devices. Lab Chip. 2 (3), 131-134 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon