È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Fotodecolorazione saggi (FRAP e FLIP) per misurare la dinamica delle proteine della cromatina in Living cellule staminali embrionali
In questo articolo
Riepilogo
Descriviamo metodi photobleaching tra cui Recovery fluorescenza Dopo photobleaching (FRAP) e Perdita Fluorescence In photobleaching (FLIP) per monitorare la dinamica delle proteine della cromatina in staminali embrionali (ES) cellule. Cromatina proteine dinamica, che è considerato uno dei mezzi per studiare la plasticità cromatina, è aumentata in cellule pluripotenti.
Abstract
Recupero della fluorescenza dopo photobleaching (FRAP) e Perdita Fluorescence In photobleaching (FLIP) consentono lo studio della dinamica delle proteine nelle cellule viventi con una buona risoluzione spaziale e temporale. Qui si descrivono come eseguire FRAP e FLIP analisi delle proteine della cromatina, tra H1 e HP1, nel topo staminali embrionali (ES) cellule. In un esperimento FRAP, le cellule sono transfettate, o transitoriamente o stabilmente, con una proteina di interesse fusa con la proteina fluorescente verde (GFP) o loro derivati (YFP, CFP, Ciliegio, ecc.) Nel transfettate, cellule fluorescenti, un intenso fascio laser focalizzato candeggine una regione relativamente piccola di interesse (ROI). La lunghezza d'onda laser è selezionato in funzione della proteina fluorescente utilizzato per la fusione. La luce laser sbiancanti irreversibilmente il segnale di fluorescenza delle molecole nella ROI e, subito dopo lo sbiancamento, la ripresa del segnale di fluorescenza nell'area sbiancato - mediata dalla sostituzione delle molecole sbiancato con le molecole di greggio - è controllata mediante l'imaging lasso di tempo. Le curve generate recupero fluorescenza fornire informazioni sulla mobilità della proteina. Se le molecole fluorescenti sono immobile, non il recupero fluorescenza sarà osservato. In un approccio complementare, perdita di fluorescenza in photobleaching (FLIP), il raggio laser decoloranti stesso punto ripetutamente e l'intensità del segnale è misurata in altre parti della cellula fluorescenti. Esperimenti FLIP quindi misurare il decadimento del segnale, piuttosto che di recupero fluorescenza e sono utili per determinare la mobilità delle proteine e proteine la spola tra compartimenti cellulari. Legame transitorio è una proprietà comune della cromatina proteine associate. Pur essendo la frazione principale di ogni proteina cromatina è legato alla cromatina in ogni momento allo stato stazionario, il legame è transitoria e maggior parte delle proteine della cromatina hanno un elevato turnover di cromatina, con un tempo di permanenza nell'ordine dei secondi. Queste proprietà sono cruciali per la generazione di elevata plasticità di espressione del genoma 1. Fotodecolorazione esperimenti sono quindi particolarmente utili per determinare la plasticità cromatina con GFP-fusione versioni della cromatina proteine strutturali, specialmente nelle cellule ES, dove lo scambio dinamico delle proteine della cromatina (tra cui le proteine eterocromatina 1 (HP1), un linker H1 e istoni core) è più alto che in cellule differenziate 2,3.
Protocollo
1. Placcatura le cellule ES
T = 0 ore
MEF placcatura
- Cappotto di imaging dal vivo ben 8-μ-Slides (ibidi, Monaco, Germania), con gelatina o in vetri a camera di copertura (Lab-Tek, Rochester, NY) o in fondo di vetro piatti cultura (MatTek, Ashland, MA). Lasciare agire per 5-30 minuti e aspirare via libera gelatina.
- Seed 22.000 MEF / pozzetto in 250 microlitri di volume totale di DMEM [supplementato con 10% siero fetale bovino (FBS)]. Consentono alle cellule di crescere in un tessuto culturale incubatore (37 ° C, 5% CO2).
T = 6 ore
ES cellula placcatura
- Aspirare DMEM.
- Seme ogni MEF rivestito bene con 15.000 cellule R1 / bene in 250 microlitri di volume totale del supporto di cellule ES [supplementato con 10% ESC-grade siero fetale bovino (FBS), 1 mM sodio piruvato, 0.1 mM amino acidi essenziali, 0,1 mM β- mercaptoetanolo, e 1000 U / ml fattore inibente la leucemia (LIF)], per ottenere il 30% al 50% confluenza del giorno successivo.
2. Trasfezione le cellule ES
T = 24 ore
Trasfezione transiente
- Sostituire il supporto ES cella con 250 microlitri / pozzetto di mezzi freschi cellule ES.
- In una da 1,5 ml in provetta sterile, aggiungere 100 microlitri di siero multimediale gratuito [Opti-MEM (Gibco)], quindi aggiungere 10 microlitri Transit-LT1 reagenti di trasfezione (Mirus) direttamente nel siero dei media liberi. Mescolare pipettando dolce e incubare a temperatura ambiente per 5-20 min.
- Aggiungere 1,5 mcg GFP DNA plasmidico fusione (H1E, H1o o HP1) diluito al transito-LT1 reagente. Mescolare pipettando dolce e incubare a temperatura ambiente per 15-30 min.
- Aggiungi 13,5 microlitri / e della miscela di trasfezione. Agitare bene l'8-μ-Slides per assicurare anche la dispersione. Dopo 24 ore di sostituire i vecchi mezzi di cellule staminali con 250 ml di mezzi freschi cellule ES.
3. Esecuzione FRAP e FLIP
T = 48-72 ore
- L'esperimento può essere eseguita su qualsiasi microscopio confocale a scansione laser (CLSM), ma dal momento che in una normale FRAP / FLIP esperimento, molte immagini consecutive sono acquisite, si consiglia di utilizzare un disco rotante-microscopio confocale, che consente velocità di acquisizione e assicura che nessun campione indesiderati sbiancamento si verifica dopo l'iniziale evento intenzionale sbiancamento. Qui, si consiglia di utilizzare la Rivoluzione filatura sistema confocale disco (www.Andor.com), con la CSU-X disco testa Yokogawa filatura. Questo sistema ha la capacità duplice photobleach utilizzando un modulo specializzato Frappa con un sistema di punti di scansione, e di passare rapidamente alla luce indietro per raccogliere le immagini utilizzando il disco rotante. Le 3 proteine fluorescenti più comunemente utilizzato per gli esperimenti sono photobleaching GFP, YFP e Cherry. Se GFP o YFP vengono utilizzati, un laser a 488 nm ~ è richiesto. Per Cherry, utilizzare un laser ~ 560 nm. In tutti i casi, si consiglia di utilizzare i laser allo stato solido. Avere uno stadio automatizzato è utile ma non necessaria. Dato che le cellule vive sono ripreso, è indispensabile utilizzare una camera climatica (usiamo una da LIS, Svizzera), l'ossigeno il controllo, l'umidità, CO 2 e temperatura. FRAP viene eseguita utilizzando l'intensità massima di imaging laser mentre si fa con la potenza del laser minima richiesta (in genere nel settore del 10%, quando il livello di fluorescenza è adeguato).
Osservare le cellule con luce fluorescente della lunghezza d'onda appropriata e selezionare una cella che esprime GFP 60X usando una lente di immersione in olio. Garantire la giusta distribuzione subcellulare. Occasionalmente, quando i livelli di espressione sono troppo alti, la localizzazione della proteina può 'fuoriuscita' di altri comparti come il nucleolo. Tali cellule non deve essere selezionato. - Ora impostare un protocollo di imaging: raccogliere 3-5 fotogrammi prima della photobleaching, poi photobleach a eucromatina o eterocromatina (visti come focolai condensato GFP) e raccogliere 90-120 fotogrammi dopo la photobleach, con intervalli di 250-1000 ms: H1E-GFP, 1000 ms, H1o e HP1-GFP, 250 ms (intervallo di tempo cambia a seconda della dinamica delle proteine, in cui le proteine altamente dinamico richiedono intervallo di tempo più breve). Normalmente usiamo intensità del laser 80-100% per photobleaching con un impulso laser di μseconds 20-40 (1-2 iterazioni), ma questi numeri possono variare a seconda delle proteine analizzate ed i livelli di espressione. Quando photobleaching è appropriato, si dovrebbe osservare un "buco nero" nella vostra fluorescenza GFP. Il buco nero è gradualmente ri-pieno di fluorescenza di recupero successivo. Anche se il disco rotante possono ottenere fino a circa 60 immagini al secondo (con una buona intensità di fluorescenza e quando lo zoom su una singola cella), si consiglia di non utilizzare il sistema a velocità così elevata a causa della bassa qualità delle immagini e il potenziale fototossicità aumentata.
- Per un esperimento FLIP, impostare un diverso protocollo di imaging: raccogliere 3-5 frame prima dello sbiancamento e inizia a ripetere lo sbiancamento nello stesso punto, mentre la raccolta delle immagini. Per H1E-GFP, candeggina ogni 5 secondi, per H1o-GFP, candeggina ogni 2 secondi, e per HP1-GFP candeggina ogni 1 sec. Candegginad raccogliere le immagini più volte durante l'intero esperimento.
- Per entrambe le tecniche, ripetere il processo su 20-30 cellule. A fini statistici, ripetere l'esperimento 3 volte o più, preferibilmente in giorni diversi. Nelle popolazioni omogenee e le impostazioni corrette, la deviazione standard è generalmente basso (<5%).
Per entrambi FRAP e FLIP, la dimensione e la forma della regione sbiancato influenza la dinamica di recupero e deve rimanere costante all'interno di un esperimento. Inoltre, quando due cellule si confrontano, i protocolli identici devono essere utilizzati e le cellule devono essere analizzate in sequenza, il giorno stesso laser di potenza e le altre condizioni possono variare e può influenzare l'esito dell'esperimento.
4. FRAP e FLIP Analisi dei dati
- In tutti i fotogrammi FRAP raccolti, misurare l'intensità di fluorescenza del ROI (ritorno sull'investimento b = area sbiancato), l'area di sfondo (ROI bg), e il non sbiancata settore nucleare (ROI nb) in funzione del tempo prima e dopo lo sbiancamento. Quando la regione sbiancato è trascurabile l'intero nucleo possono essere selezionati per scopi normalizzazione.
- Per ogni punto di tempo, normalizzare i dati secondo la formula: (ROI b - ROI bg) / (ROI nb - ROI bg) / (pbROI b - pbROI bg) / (pbROI nb - pbROI bg), pb denota pre-sbiancato. Per la pre-candeggina immagini si dovrebbe ottenere un valore di circa 1. La prima immagine dopo la candeggina indicherà la profondità Bleach. Sottrarre il valore 1 per il valore effettivo di profondità Bleach. Ripetere l'operazione per ogni cellula e media 20-30 cellule di ogni esperimento.
- In tutti i fotogrammi FLIP raccolti, misurare l'intensità di fluorescenza nell'area non sbiancata settore nucleare, e l'area di sfondo (ROI = nb non sbiancato zona, ROI bg sfondo =). Calcolo dei dati FLIP è simile a una curva FRAP, solo il ROI analizzati (ROI nb) dovrebbe essere diverso da quello della regione reale sbiancato, che non viene utilizzato per il calcolo: ROI (nb - ROI bg) / (pbROI nb - pbROI bg) . E 'anche possibile utilizzare una cellula vicina (ROI = n prossimo cellulare) per fini normalizzazione: il ROI (nb - ROI bg) / (ROI n - ROI bg) / (pbROI nb - pbROI bg) / (pbROI n - pbROI bg ).
A seguito di raccolta dei dati, è possibile adattare i dati sperimentali di simulazione al computer. Ciò consente di calcolare, con una buona vicinanza, la frazione mobile, la frazione immobile e la mezza massimo. Non discutere gli aspetti matematici e statistici di analisi FRAP qui e di rimandare il lettore ad altre pubblicazioni ottimo 4-9. La profondità bleach si riferisce alla distanza (in asse y) tra il pre-candeggina (100%) segnale e la prima immagine dopo candeggiante; la frazione mobile si intende la distanza (in asse y) tra la profondità candeggina e il segnale di ripresa, quando la cinetica raggiunge un plateau, e la frazione immobile si riferisce alla distanza (in asse y) tra il segnale di recupero e di pre-candeggina (100%) del segnale (vedi figure 1B e 2B). Al di là di questa analisi, ci sono buoni modelli matematici per adattarsi ai dati. Per un singolo esponente, l'equazione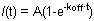
dove T è il tempo, A è la frazione mobile, 1-A è la frazione di immobile e k è la costante di dissociazione fuori, possono essere utilizzati per adattare i dati, e una stima diretta del tasso di fuori del legame (k off) può essere ottenuti, così come per il parametro A, che può essere usata per calcolare il tasso di associazione.
5. Rappresentante dei risultati:
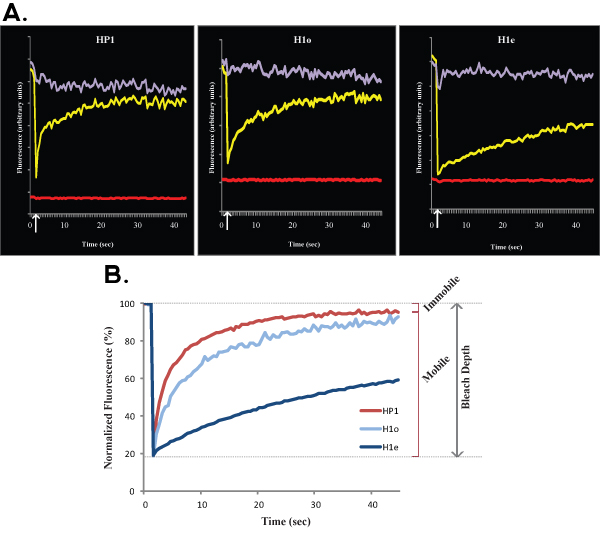
Figura 1. A e B mostrano le curve rappresentative FRAP di HP1 (a sinistra), H1o (al centro) e H1E (a destra) in cellule ES R1. Per semplicità e chiarezza Figura 1a mostra i dati grezzi di una singola cellula prima di ogni normalizzazione e di calcolo. La curva giallo corrisponde alla regione sbiancato, la curva viola corrisponde al non sbiancata settore nucleare (in cui la regione sbiancato è trascurabile l'intero nucleo può essere selezionato per scopi normalizzazione), e la linea rossa corrisponde alla fluorescenza di fondo, che è minimo in questo caso. Freccia verticale rappresenta il tempo di candeggina. Dati normalizzati e media è mostrata in Figura 1B. Si noti la ripresa più lenta di H1 (blu) rispetto al HP1 (rosso). Anche la variante H1E (blu scuro) è più lenta della variante H1o (luce blu). Frazioni mobile e immobile e la profondità Bleach sono indicati per HP1.
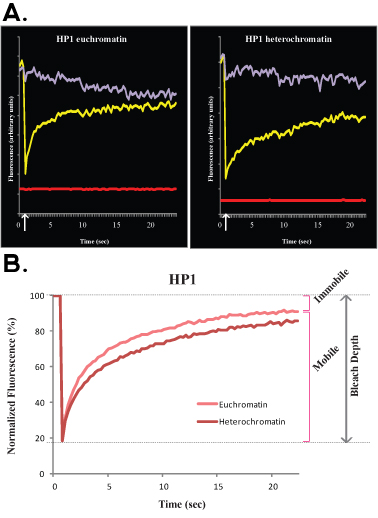
Figura 2. A e B mostrano le curve FRAP rappresentante confronto eucromatina (a sinistra) con eterocromatina (a destra) di HP1 in cellule ES R1. Allo stesso modo alla Figura 1, Figura 2A mostra i dati grezzi di una singola cella, curva giallo corrisponde alla regione sbiancato, la curva viola corrisponde al non sbiancata settore nucleare, e la linea rossa corrisponde alla fluorescenza di fondo. Freccia verticale rappresenta il tempo di candeggina. Dati normalizzati e media è mostrata in Figura 2B. Si noti la ripresa più lenta di eterocromatina (rosso scuro) rispetto a eucromatina (luce rossa). Frazioni mobile e immobile e la profondità Bleach sono indicati per eucromatina.
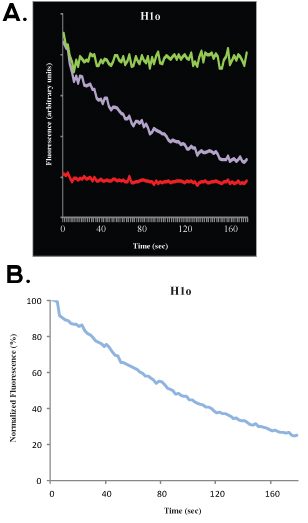
Figura 3.. Un tipico esperimento di FLIP H1o R1 cellule staminali embrionali è mostrato nella figura 3A (crudo, non normalizzata dei dati) e B (dati normalizzati e media). In questo esperimento la curva viola corrisponde al non sbiancata settore nucleare, la linea verde corrisponde ad un nucleo di cellula vicina e la linea rossa corrisponde alla fluorescenza di fondo.
Discussione
A differenza delle tecniche più disponibile, che coinvolgono cromatina purificato da popolazioni di cellule o cellule fisse, gli esperimenti FRAP seguire i cambiamenti nelle dinamiche delle proteine della cromatina in cellule viventi. Abbiamo trovato la dinamica delle proteine della cromatina per essere un buon indicatore per la plasticità cromatina. Tuttavia, perché richiede di fusione del gene di interesse con GFP, l'aggiunta del tag fluorescenti possono interferire con la funzione della proteina. C...
Divulgazioni
Riconoscimenti
Ringraziamo i membri del laboratorio Meshorer, specialmente Shai Melcer, Adi Alajem, Edupuganti Raghu Ram, Badi Sri Sailaja, Anna Mattout e Alva Biran, per commenti critici e per la risoluzione dei problemi photobleaching esperimenti su base giornaliera. EM è un Joseph H. e R. Braun Belle Senior Lecturer in Life Sciences ed è sostenuta dalla Israel Science Foundation (ISF 943/09), il ministero israeliano della Sanità (6007) l'Unione europea (IRG-206872 e 238176), Israele Cancer Research Foundation, l'interno Grants applicativi Medica della Hebrew University e la Psicobiologia Israel Institute.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
|---|---|---|---|
| DMEM | Sigma | D5671 | |
| Gelatina | Merck | 1,04078 | |
| Opti-MEM | Gibco | 31985 | |
| Transit-LT1 | Mirus | MIR2300 | |
| 8-ben μ-Slides | ibidi | 80826 |
Riferimenti
- Phair, R. D. Global nature of dynamic protein-chromatin interactions in vivo: three-dimensional genome scanning and dynamic interaction networks of chromatin proteins. Mol Cell Biol. 24, 6393-6402 (2004).
- Meshorer, E., Girard, L. . Imaging chromatin in embyonic stem cells in StemBook. , (2008).
- Meshorer, E. Hyperdynamic plasticity of chromatin proteins in pluripotent embryonic stem cells. Dev Cell. 10, 105-116 (2006).
- Bancaud, A., Huet, S., Rabut, G., Ellenberg, J. . Fluorescence perturbation techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, photoactivation, photo conversion, and FLIP. , (2009).
- Dundr, M., Misteli, T. Measuring dynamics of nuclear proteins by photobleaching. Curr Protoc Cell Biol. Chapter 13, Unit 13-Unit 13 (2003).
- Ellenberg, J. Nuclear membrane dynamics and reassembly in living cells: targeting of an inner nuclear membrane protein in interphase and mitosis. J Cell Biol. 138, 1193-1206 (1997).
- Lenser, T., Weisshart, K., Ulbricht, T., Klement, K., Hemmerich, P. Fluorescence fluctuation microscopy to reveal 3D architecture and function in the cell nucleus. Methods Cell Biol. 98, 2-33 (2010).
- Mueller, F., Mazza, D., Stasevich, T. J., McNally, J. G. FRAP and kinetic modeling in the analysis of nuclear protein dynamics: what do we really know. Curr Opin Cell Biol. 22, 403-411 (2010).
- Phair, R. D., Misteli, T. Kinetic modelling approaches to in vivo imaging. Nat Rev Mol Cell Biol. 2, 898-907 (2001).
- Poser, I. BAC TransgeneOmics: a high-throughput method for exploration of protein function in mammals. Nat Methods. 5, 409-415 (2008).
- Sigal, A. Generation of a fluorescently labeled endogenous protein library in living human cells. Nat Protoc. 2, 1515-1527 (2007).
- Cohen, A. A. Dynamic proteomics of individual cancer cells in response to a drug. Science. 322, 1511-1516 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon