Method Article
Targeting neuroni bulbo olfattivo utilizzo combinato In Vivo Elettroporazione e GAL4-Based Enhancer Trappola Linee Zebrafish
In questo articolo
Riepilogo
La risoluzione temporale e spaziale di manipolazioni genetiche determina lo spettro di fenomeni biologici che possono turbare. Qui usiamo temporalmente e spazialmente discreto In vivo Elettroporazione, combinate con linee transgeniche di zebrafish, per indurre l'espressione di un transgene GFP specificatamente nei neuroni del bulbo olfattivo sviluppo.
Abstract
Elettroporazione in vivo è un metodo potente per la consegna di plasmidi di espressione del DNA, reagenti RNAi, e morfolino oligonucleotidi anti-senso a specifiche regioni di embrioni sviluppo, compresi quelli di C. elegans, pulcino, Xenopus, pesce zebra e un mouse 1. In zebrafish, elettroporazione in vivo ha dimostrato di avere un'ottima risoluzione spaziale e temporale per la consegna di questi reagenti 2-7. La risoluzione temporale di questo metodo è importante perché permette di incorporazione di questi reagenti in determinate fasi dello sviluppo. Inoltre, poiché l'espressione da vettori elettroporate si verifica entro 6 ore 7, questo metodo è più attuale che si avvicina transgenici. Mentre la risoluzione spaziale può essere estremamente precisi quando mira una singola cella 2, 6, è spesso preferibile incorporare i reagenti in una popolazione di cellule specifiche all'interno di un tessuto o struttura. Quando ci si rivolge più celle, in elettroporazione in vivo è efficiente per la consegna ad una regione specifica di un embrione, ma in particolare nel sistema nervoso, è difficile bersaglio specifici tipi cellulari esclusivamente attraverso elettroporazione spazialmente discreto. In alternativa, enhancer trappola linee transgeniche offrono eccellenti cellule tipo-specifici espressione dei transgeni 8. Qui si descrive un approccio che combina transgenici GAL4 trappola a base di linee enhancer 8 con spazialmente discreto elettroporazione in vivo 7, 9 per indirizzare specificatamente lo sviluppo dei neuroni del bulbo olfattivo zebrafish. L'Et (zic4: Gal4TA4, UAS: mCherry) hzm5 (ex GA80_9) linea trappola enhancer precedentemente descritti 8, mostra mirata espressione transgenica di mCherry mediata da un pesce zebra ottimizzato GAL4 (KalTA4) attivatore trascrizionale in più regioni del cervello di sviluppo, compresi rombencefalo, cervelletto, proencefalo, e il bulbo olfattivo. Per obiettivo espressione GFP appositamente per il bulbo olfattivo, un plasmide con la sequenza codificante del GFP sotto il controllo di più GAL4 siti di legame (SUP) è stato elettroporate nella estremità anteriore del proencefalo in 24-28 ore dopo la fecondazione (HPF). Anche se questo metodo incorpora DNA plasmidico in più zone del prosencefalo, l'espressione della GFP è indotta nelle cellule che esprimono il transgenically KalTA4 fattore di trascrizione. Quindi, utilizzando la GA080_9 linea transgenica, questo approccio ha portato alla espressione di GFP esclusivamente nel bulbo olfattivo sviluppo. Cellule che esprimono GFP mirati attraverso questo approccio ha mostrato tipico proiezioni assonale, come precedentemente descritto per le cellule mitrali del bulbo olfattivo 10. Questo metodo potrebbe essere utilizzato anche per la somministrazione mirata di altri reagenti tra cui a breve tornante plasmidi di espressione interferenza dell'RNA, che forniscono un metodo per spazialmente e temporalmente discreta perdita di funzione di analisi.
Protocollo
1. Embrioni transgenici
- Qui si sta utilizzando una linea transgenica di zebrafish creata attraverso un trasposone-mediata metodo trappola potenziatore 8. L'inserto transgenico comprende due sequenze codificanti: KalTA4, un pesce zebra versione ottimizzata del GAL4 attivatore trascrizionale, e la proteina fluorescente rossa, mCherry. La trappola enhancer rendimenti metodo linee di zebrafish transgenici che esprimono questa cassetta transgenici sotto il controllo di una sequenza endogena enhancer. Così, a seconda della identità della specifica sequenza enhancer, espressione di entrambi KalTA4 e mCherry è localizzata a specifiche regioni del cervello di sviluppo. Per la Et (zic4: Gal4TA4, UAS: mCherry) hzm5 linea che stiamo usando qui, l'espressione è localizzata a vari siti nel romboencefalo, proencefalo, e, di particolare importanza, il bulbo olfattivo 8 (vedi anche Fig. 1). . Dato questo modello di espressione e la localizzazione della cassetta all'interno del genoma, i transgeni si prevede di essere sotto il controllo del promotore zic4 8 (vedi anche http://www.helmholtz-muenchen.de/en/idg/groups/ neuroimaging / lines_distel / main .).
- Et adulti (zic4: Gal4TA4, UAS: mCherry) hzm5 pesce eterozigote per l'inserto transgenici sono in genere accoppiati con WT (AB) di pesce, portando a circa il 50% prole transgenica. (Per una maggiore percentuale di prole transgenica, due eterozigoti possono essere accoppiati.)
- Al fine di bloccare la formazione di pigmento e facilitare l'imaging a fluorescenza, trattare gli embrioni transgenici con 100 mM N-phenylthiourea (PTU) inizio a 6-8 HPF.
2. Embrioni di montaggio
- A HPF 24-28, il trasferimento degli embrioni all'acqua uovo senza PTU. Identificare gli embrioni transgenici per l'espressione di mCherry utilizzando un microscopio a fluorescenza. Rimuovere la membrana corionica da embrioni transgenici con una pinza sottile. Trasferimento degli embrioni liberati dalla loro corion ad una piastra di Petri contenente tampone elettroporazione, più 0,02% tricaine [Buffer elettroporazione: 180 mM NaCl, 5 mM KCl, 1,8 mM CaCl 2, 5 HEPES mM, pH 7,2] 4. Lasciare 2 minuti per l'anestetico abbia effetto prima di procedere alla fase di montaggio.
- Preparare una soluzione allo 0,5% a basso punto di fusione agarosio in tampone elettroporazione più tricaine dal microonde la soluzione, e poi mettendo la soluzione in un 34-37 ° C incubatore. Una volta che la temperatura della soluzione di agarosio è equilibrato, posto una grossa goccia (~ 500 microlitri) della soluzione di agarosio al centro di un piatto di 60 millimetri di Petri. Aggiungere 6-8 embrioni anestetizzati a questa goccia di agarosio.
- Utilizzando una pinza sottile (o le estremità multa di punte taglio pipetta microloader), posizione che gli embrioni in modo che essi sono tutti rivolti nella stessa direzione e allineati in una fila verticale. Per solidificare l'agarosio, e intrappolare gli embrioni in posizione, porre la capsula su un grande piatto di Petri con 2-3 mm di ghiaccio.
- Una volta che l'agarosio si è solidificato, inondare il piatto con elettroporazione tampone più tricaine, assicurando che la soluzione copre completamente il calo solidificato agarosio.
3. Micro-iniezione di espressione del DNA plasmidico
- Preparare il plasmide di espressione GFP utilizzando un kit midi o maxi-prep isolamento plasmide (ad esempio, Qiagen). Sospendere il plasmide ad una concentrazione finale di 0,5 mg / mL in acqua sterile, più 0,03% rosso fenolo. Per l'esperimento bulbo olfattivo targeting qui descritti, stiamo usando una espressione plasmide con la sequenza codificante del EGFP sotto il controllo di più GAL4 siti di legame (14 tandem sequenze UAS e il promotore di pesce basale, E1b). Usando questo plasmide, solo le cellule che esprimono il transgenically KalTA4 fattore di trascrizione sarà in grado di esprimere la GFP, così, mediando espressione mirata di GFP.
Nota: qui stiamo usando rosso fenolo per la visualizzazione delle iniezioni di DNA, che dovrebbero essere applicabili per il targeting altre regioni del cervello in sviluppo, a condizione che la regione si può accedere dai ventricoli. Per il targeting di altri tipi di cellule che richiedono la visualizzazione fluorescente, Bodipy o Quantam coloranti Dot potrebbe potenzialmente essere usato per visualizzare le iniezioni sotto illuminazione fluorescente. - Pipette microiniezione possono essere fabbricati utilizzando un estrattore pipetta orizzontale o verticale. Regolazioni di calore e pull-resistenza varia a seconda del tipo di estrattore, il tipo di elemento riscaldante, e il tipo di tubi di vetro capillari.
Utilizzando un P-30 Sutter estrattore verticale, utilizzare un ambiente di calore di 980 e un divano-force di 960 per produrre lunghe, affusolate, pipette nitide da sottili pareti di vetro borosilicato capillare con filamenti [strumento Sutter # BF100-78-10]. Pipette Microinjetion tirato con queste impostazioni sono sigillate e devono essere rotto di nuovo prima dell'iniezione. - Utilizzare un puntale microloader per aggiungere 1-2 ml di soluzione di DNA plasmidico alla pipetta di iniezione.
- Montare eassicurare la pipetta caricata nel supporto pressione pipetta di iniezione del sistema.
- Rompere di nuovo la pipetta caricato con una pinza sottile fino a produrre impulsi di pressione rilascio sbuffo della soluzione di DNA rosso. In alternativa, suggerimenti possono essere rotto di nuovo da rapidamente penetrare in un sommerso, Kimwipe piegato laboratorio.
Nota: perché le pipette di iniezione sono inizialmente sigillata e deve essere manualmente rotto di nuovo, la dimensione della punta e il volume di iniezione sono variabili. Pipette di iniezione ideale dovrebbe richiedere 3-5 impulsi di iniezione per riempire completamente il ventricolo proencefalo sviluppo di 24 embrioni HPF (100 ms impulsi di iniezione a 40 psi). - Iniettare la soluzione plasmide DNA nei ventricoli del cervello sviluppare tale che il DNA è costretto adiacente, e intercalate in, la regione del cervello destinata a formare il bulbo olfattivo. Il bulbo olfattivo è derivato dalle cellule della parete più anteriore del ventricolo proencefalo. Così, inserendo la pipetta di iniezione nei ventricoli in modo tale che la pipetta punta verso l'estremità anteriore del cervello di sviluppo, le forze di pressione di iniezione del DNA e nella adiacente al bulbo olfattivo potenziali. Iniettare DNA fino colorante rosso è ben visibile alla fine anteriore del ventricolo proencefalo. Perché il DNA comincia a diffondere immediatamente, diluendo il DNA, è importante procedere alla fase elettroporazione il più presto possibile dopo l'iniezione (ad esempio, entro 10 sec).
4. Elettroporazione
- Elettroporazione viene effettuato con auto-costruito elettrodi in elettrodi di platino Grass ipodermico (Grass Tecnologia # E2). Gli elettrodi sono collegati a un portatile sonda e la distanza finale tra gli elettrodi di platino deve essere di 1 mm (per i dettagli sulla costruzione v. 9). Onda quadra impulsi elettroporazione sono prodotti collegando gli elettrodi ad una SD-9 stimolatore Grass (erba Technology, modello SD-9).
- Impostare la SD-9 stimolatore per produrre singole, 5 impulsi di elettroporazione ms a 70 volt. Posizionare gli elettrodi in modo che l'elettrodo positivo è posizionato adiacente alla estremità anteriore dell'embrione, mentre l'elettrodo negativo è posteriore alla testa dell'embrione. Avviare manualmente ~ 7-8 impulsi di elettroporazione con l'interruttore singolo modalità dello stimolatore-9 SD, separando ogni impulso da ~ 1 sec. Tensioni appropriato varierà a seconda dell'età degli embrioni e la sorgente di tensione utilizzati. Giovane embrioni richiedono tensioni più basse per evitare danni all'embrione, mentre vecchi embrioni richiedono alte tensioni di avviare elettroporazione 7.
- Lasciare gli embrioni di recuperare per almeno 10 minuti dopo l'elettroporazione prima liberandoli dalla agarosio.
- Utilizzando una pinza sottile, senza gli embrioni dal agarosio delicatamente tracciare il contorno degli embrioni evitando il contatto reale con gli stessi embrioni.
- Una volta liberato, tornare gli embrioni di acqua uovo (con PTU se necessario). Tenerli a 28 ° C fino a che non devono essere ripreso per l'espressione della GFP.
5. Embrioni di montaggio per l'imaging
- Trasferimento degli embrioni da acqua uovo più PTU all'acqua uovo, più 0,02% tricaine. Lasciare qualche minuto per l'anestetico abbia effetto prima di procedere alla fase di montaggio.
- Preparare una soluzione allo 0,5% a basso punto di fusione agarosio nell'uovo acqua più tricaine dal microonde la soluzione, e poi mettendo la soluzione in un 34-37 ° C incubatore. Una volta che la temperatura della soluzione di agarosio è equilibrato, posto una grossa goccia (~ 300 ul) della soluzione di agarosio al centro di un piatto di 35 millimetri di Petri. Aggiungi un embrione anestetizzati a questa goccia di agarosio.
- Utilizzando una pinza sottile (o le estremità multa di punte taglio pipetta microloader), posizione che gli embrioni in modo che siano in posizione verticale, rendendo possibile visualizzare una vista dorsale di sviluppo del cervello con un microscopio verticale (ambiti invertita richiederà una diversa geometria embrione, e un piatto diverso consentendo la visualizzazione dal basso, vedi 12). Solidificare l'agarosio mettendo il piatto su un grande piatto di Petri con 2-3 mm di ghiaccio. Ri-orientamento con una pinza sottile sarà probabilmente richiesto durante la solidificazione di assicurare che l'embrione non possa cadere su un lato.
- Una volta che l'agarosio si è solidificato, inondare il piatto con l'uovo l'acqua più tricaine garantire che la soluzione copre completamente il calo solidificato agarosio.
6. Rappresentante dei risultati:
Anche se l'espressione GFP può essere osservato a partire da 6 ore dopo l'elettroporazione, qui ci stanno mostrando le immagini da un embrione 4 giorni dopo l'elettroporazione in modo tale che la struttura dei neuriti delle cellule bersaglio è sufficientemente sviluppata. L'Et (zic4: Gal4TA4, UAS: mCherry) hzm5 transgenici linea trappola potenziatore visualizza espressione costitutiva di mCherry (e KalTA4) nel romboencefalo, cervelletto, proencefalo e nel bulbo olfattivo embrioni a 5 giorni dopo la fecondazione (Fig. 1A e 1C). Gli embrioni che hanno avuto un UAS-GFP plasmide di espressione incorporato mediante elettroporazione mirati (come descritto sopra), espressione di GFP dimostrano che è limitata alle cellule del bulbo olfattivo sviluppo (Fig. 1B, 1D e 1E). Transgenically solo le cellule che esprimono il fattore di trascrizione KalTA4 sono in grado di attivare l'espressione di questo SUP-GFP plasmide. L'incorporazione di questo plasmide in non transgenici embrioni non porta a qualsiasi espressione GFP rilevabile. Quindi, è l'azione combinata di elettroporazione mirata di UAS-GFP e localizzati espressione transgenica del driver KalTA4 che conduce alla espressione esclusiva di GFP nelle cellule del bulbo olfattivo sviluppo. Le cellule che esprimono GFP tipico spettacolo proiezioni assonali delle cellule bulbo olfattivo mitralico (Fig. 1B e 1D) 10. Al fine di visualizzare le proiezioni degli assoni, le immagini in figura 1B e 1D dovevano essere esposti ad alti livelli tali che la regione di corpi cellulari erano ben sovraesposta. Un livello inferiore di esposizione (Fig. 1E) mostra che i corpi delle cellule che esprimono GFP sono infatti localizzate nel bulbo olfattivo (cfr. Fig. 1C e 1E;. Linea grigia segna il confine del bulbo olfattivo).
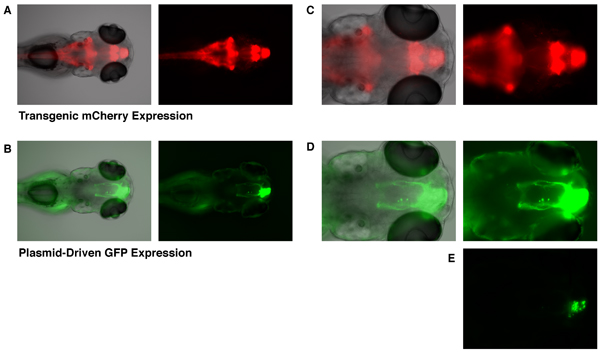
Figura 1. Mirate espressione GFP nel bulbo olfattivo di un embrione 5 dpf zebrafish. L'Et (zic4: Gal4TA4, UAS: mCherry) hzm5 transgenici linea trappola enhancer, display espressione costitutiva del mCherry nel cervelletto romboencefalo,, proencefalo, e bulbo olfattivo (A e C, mCherry fluorescenza mostrato in rosso). Questa espressione di mCherry è mediata da transgenico GAL4-espressione. Gli embrioni che sono stati elettroporate con un UAS-GFP vettore di espressione a 28 HPF, display espressione GFP mirati nel bulbo olfattivo a 5 giorni dopo la fecondazione (B, D ed E, GFP fluorescenza visualizzato in verde. Embrione Come in A e C). Un'immagine di esposizione più bassi in fondo (E) mostra che l'espressione di GFP è limitato a corpi cellulari del bulbo olfattivo. La linea grigia indica il confine del bulbo olfattivo. Campo chiaro (scala di grigi), fluorescenza verde (verde), e fluorescenza rossa (rosso) le immagini erano tutti prendere con un microscopio a fluorescenza Olympus BX60.
Discussione
Qui abbiamo descritto un metodo in elettroporazione in vivo in zebrafish che utilizza un potenziatore trappola GAL4 linea transgenica di indirizzare l'espressione del transgene elettroporate ad una popolazione di cellule nel bulbo olfattivo sviluppo. Questo approccio combina l'eccellente risoluzione temporale di elettroporazione in vivo 7 con la cellula-tipo specifica espressione mediata da potenziatore trappola linee transgeniche 8. Anche se qui abbiamo descritto gli attacchi del bulbo olfattivo, in elettroporazione in vivo possono essere utilizzati per indirizzare altre regioni del sistema nervoso 2-7, e le linee enhancer trap sono disponibili con l'espressione mirata di GAL4 in molti diversi tipi di cellule o tessuti specifici 8, 11. Naturalmente, questa tecnica di elettroporazione dovrebbe anche essere adatto per altri approcci combinatioral genetiche come il Lexa o Tet sistemi 13, 14, 15. Uno dei principali vantaggi di elettroporazione è che non c'è bisogno di fare ulteriori linee transgeniche, dato che un adeguato GAL4-line è disponibile. Ciò consente di risparmiare sei mesi.
Elettroporazione in vivo permette l'incorporazione di oligonucleotidi in neuroni e dei loro precursori in qualsiasi fase specifica di sviluppo dei sistemi nervosi è di interesse 7. La risoluzione temporale è particolarmente vantaggioso per la perdita di funzione di analisi, perché può aggirare problemi di targeting dei geni che hanno funzioni essenziali nelle fasi precedenti dello sviluppo. Il metodo che descriviamo qui può anche essere utilizzato per integrare la perdita di funzione tra oligonucleotidi reagenti RNAi o costrutti e morfolino oligonucleotidi anti-senso 4, 7. Plasmide-driven reagenti come plasmidi proteina dominante negativo di espressione o di breve tornante plasmidi RNAi può anche essere posta sotto controllo di un GAL4 UAS, consentendo per il tipo specifico di cellule precisa espressione che abbiamo mostrato qui per l'espressione di GFP.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato finanziato attraverso un NIH R15 AREA concedere a John Horne (NIMH; R15MH083221).
Materiali
Reagenti:
- Agarosio a basso punto di fusione (Sigma, A9414)
- Plasmide kit midi o maxi-prep (ad esempio Qiagen, # 12643]
- Rosso fenolo (Sigma, P3532)
Attrezzatura:
- Capillare di vetro con filamento; ID = 0.78 mm, OD = 1,0 mm (Sutter Instruments, # BF100-78-10)
- Erba SD-9 stimolatore (Grass Technology, modello SD-9)
- Erba elettrodi di platino ipodermico, ago dritto (Tecnologia Grass, # E2)
- Micro-loader puntali (Eppendorf, # X22703R)
- Pipettare estrattore (ad esempio Sutter, modello P-30)
- Pipettare estrattore (ad esempio Sutter, modello P-30)
Riferimenti
- Swartz, M., Eberhart, J., Mastick, G., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev Biol. 233, 13-21 (2001).
- Bhatt, D. H., Otto, S. J., Depoister, B., Fetcho, J. R. Cyclic AMP-induced repair of zebrafish spinal circuits. Science. 305, 254-258 (2004).
- Teh, C., Parinov, S., Korzh, V. New ways to admire zebrafish: progress in functional genomics research methodology. Biotechniques. 38, 897-906 (2005).
- Cerda, G. A., Thomas, J. E., Allende, M. L., Karlstrom, R. O., Palma, V. Electroporation of DNA, RNA, and morpholinos into zebrafish embryos. Methods. 39, 207-211 (2006).
- Hendricks, M., Jesuthasan, S. Electroporation-based methods for in vivo, whole mount and primary culture analysis of zebrafish brain development. Neural Development. 15, 2-6 (2007).
- Tawk, M., Bianco, I. H., Clarke, J. D. Focal electroporation in zebrafish embryos and larvae. Methods Mol Biol. 546, 145-151 (2009).
- Kera, S. A., Agerwala, S. M., Horne, J. H. The temporal resolution of in vivo electroporation in zebrafish: a method for time-resolved loss-of-function. Zebrafish. 7, 97-108 (2010).
- Distel, M., Wullimann, M. F., Köster, R. W. Optimized Gal4 genetics for permanent gene expression mapping in zebrafish. Proc Natl Acad Sci U S A. 106, 13365-13370 (2009).
- Hoegler, K. J., Horne, J. H. Targeting the zebrafish optic tectum using in vivo electroporation. Cold Spring Harb. Protoc. , (2010).
- Nobuhiko, M., Kozo, M., Tatsuya, T., Shin-ichi, H., Hitoshi, O., Yoshihiro, Y. From the olfactory bulb to higher brain centers: genetic visualization of secondary olfactory pathways in zebrafish. J. Neurosci. 29, 4756-4766 (2009).
- Davison, J. M., Akitake, C. M., Goll, M. G., Rhee, J. M., Gosse, N., Baier, H., Halpern, M. E., Leach, S. D., Parsons, M. J. Transactivation from Gal4-VP16 transgenic insertions for tissue-specific cell labeling and ablation in zebrafish. Developmental Biology. , 304-811 (2007).
- Distel, M., Kö, s. t. e. r., W, R. in vivo time-lapse imaging of zebrafish embryonic development. CSH Protocols. , (2007).
- Emelyanov, A., Parinov, S. Mifepristone-inducible LexPR system to drive and control gene expression transgenic zebrafish. Developmental Biology. 320, 113-121 (2008).
- Knopf, F., Schnabel, K., Haase, C., Pfeifer, K., Anastassiasdis, K., Weidinger, G. Dually inducible TetON systems for tissue-specific conditional gene expression in zebrafish. PNAS. , 107-10 (1993).
- Zhu, P., Narita, Y., Bundschuh, S. T., Fajardo, O., Schärer, Y. P., Chattopadhyaya, B., Bouldoires, E. A., Stepien, A. E., Deisseroth, K., Arber, S., Sprengel, R., Rijli, F. M., Friedrich, R. W. Optogenetic Dissection of Neuronal Circuits in Zebrafish using Viral Gene Transfer and the Tet System. Front Neural Circuits. 3, 21-21 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon