Method Article
Ottimizzato colorazione negativa: un protocollo ad alta velocità per l'esame di piccole e asimmetrica Protein Structure da microscopia elettronica
In questo articolo
Riepilogo
Più della metà delle proteine sono piccole proteine (massa molecolare <200 kDa) che stanno sfidando per entrambi microscopio elettronico di immagini e ricostruzioni tridimensionali. Ottimizzato colorazione negativa è un protocollo robusto e high-throughput per ottenere un elevato contrasto e immagini di piccole proteine o complessi asimmetrici in diverse condizioni fisiologiche relativamente alta risoluzione (~ 1 nm).
Abstract
Determinazione strutturale di proteine è piuttosto impegnativo per le proteine con masse molecolari tra 40 - 200 kDa. Considerando che più della metà delle proteine naturali hanno un peso molecolare tra 40 - 200 kDa 1,2, è necessario un metodo robusto e ad alta velocità con una capacità di risoluzione nanometrica. Colorazione negativa (NS) microscopia elettronica (EM) è un approccio facile, veloce e qualitativo che è stato spesso utilizzato nei laboratori di ricerca per esaminare la struttura della proteina e proteina-proteina interazioni. Purtroppo, i protocolli di NS convenzionali spesso generano artefatti strutturali su proteine, soprattutto con lipoproteine che di solito formano presentare artefatti rouleaux. Utilizzando immagini di lipoproteine da crio-microscopia elettronica (cryo-EM) come standard, i parametri chiave di NS condizioni di preparazione dei campioni sono stati recentemente selezionati e segnalati come protocollo di NS ottimizzato (OpNS), un protocollo convenzionale NS modificato 3. Artefatti come rouleaux può essere notevolmente limitata da OpNS, inoltre fornire alta contrasto con ragionevolmente ad alta risoluzione (vicino a 1 nm) immagini di proteine piccole e asimmetriche. Queste immagini ad alta risoluzione ed alto contrasto sono anche favorevole per una proteina individuo (un singolo oggetto, nessuna media) ricostruzione 3D, ad esempio un anticorpo 160 kDa, mediante il metodo di elettroni tomografia 4,5. Inoltre, OpNS possono essere uno strumento high-throughput di esaminare centinaia di campioni di piccole proteine. Ad esempio, il meccanismo precedentemente pubblicata di 53 kDa proteina di trasferimento degli esteri del colesterolo (CETP) coinvolto lo screening e l'imaging di centinaia di campioni 6. Considerando cryo-EM raramente con successo immagini proteine inferiore a 200 kDa deve ancora pubblicare qualsiasi studio che ha coinvolto oltre un centinaio di screening condizioni del campione, è giusto chiamare un metodo di high-throughput per lo studio di piccole proteine OpNS. Speriamo che il protocollo OpNS qui presentata può essere uno strumento utile per spingere i confini di EM e accelerare gli studi EM in piccola struttura di proteine, dinamiche e meccanismi.
Introduzione
Comprendere la funzione delle proteine richiede la conoscenza della struttura delle proteine. Determinazione strutturale è impegnativo per proteine la cui massa molecolare sono entro 40 - 200 kDa. Cristallografia a raggi X è limitata dalla proteina di cristallizzazione; risonanza magnetica nucleare (NMR) è limitato a masse molecolari inferiori a 40 KDa, mentre crio-microscopia elettronica (cryo-EM) ha difficoltà sia nella acquisizione delle immagini e tridimensionali (3D) ricostruzioni di piccole proteine, che le masse molecolari sono meno di 200 kDa. In particolare, più di 50% di proteine hanno un peso molecolare compreso tra 40 - 200 kDa 1,2, come i metodi attuali stanno sfidando nello studio delle proteine di queste dimensioni, è necessario un nuovo metodo.
Sebbene la maggior parte dei microscopi elettronici a trasmissione (TEM) sono in grado di risoluzione atomica, vale a dire, meglio di 3 Risoluzione Å, ottenendo anche una struttura vicino a risoluzione nanometrica di un campioni biologici è piuttosto ChallenGing 7. Danni da radiazione, basso contrasto, le deviazioni strutturali nonché manufatti come la disidratazione tutte ostacolano ad alta risoluzione delle immagini TEM 3,8.
Tra i vari approcci TEM, Cryo-EM è un metodo di bordo avanzato e taglio per realizzare strutture risoluzione atomica di grandi macromolecole altamente simmetrici in condizioni fisiologiche vicino 9-12. Il campione cryo-EM viene preparato il flash congelamento della soluzione del campione, incorporando le macromolecole in ghiaccio vitreo, che viene successivamente ripreso a temperature criogeniche, come azoto o elio temperature del liquido 13. Cryo-EM è vantaggioso in quanto i campioni non presentano artefatti e sono quasi nativo struttura 8-12. Cryo-EM ha i suoi svantaggi: i) dispositivi supplementari sono necessarie per essere installato o acquistato per aggiornare uno strumento TEM standard per una capacità di crio-EM. I dispositivi includono: anti-contaminante, crio-porta, il software in modalità a basso dosaggio e basse dosi di Sensitelecamera CCD tiva, anche se i prezzi di questi dispositivi sono molto più bassi rispetto al prezzo dello strumento TEM stesso; ii) il funzionamento crio-EM ha bisogno di tempo più lungo di funzionamento NS. Esaminando un campione crio-EM spesso richiede più tempo per preparare i campioni e usare lo strumento TEM di quella di NS perché cryo-EM rende necessario affrontare le difficoltà aggiuntive, tra cui: operazione di temperatura dell'azoto liquido, la carica del campione, deriva immagini, gradienti di temperatura, a basso dosaggio operazione modello, campione sensibilità radiazioni e limitazioni di dosaggio. Questi passaggi aggiuntivi rallenterà la velocità di acquisizione di dati utili rispetto all'acquisizione dei dati NS, anche se alcune immagini crio-EM può certamente essere ottenuti in 1 ora o meno da esperti Cryo-EM con lo strumento preparato con un gradiente di temperatura equilibrata; iii) gli utenti richiedono una formazione supplementare, come ad esempio la manipolazione di azoto liquido, il congelamento griglie crio-EM, funzionamento a basso dosaggio, misurazione della dose, la gestione della carica, alla deriva e la conoscenza nel campo dell'imaging processing; iv) la mancanza di immagini ripetibile per lo stesso crio-campione durante diverse sessioni TEM. Campioni Cryo-EM possono essere facilmente danneggiati da contaminazione ghiaccio durante esemplare di carico e scarico per / dallo strumento TEM. Questo danno è particolarmente un problema quando i campioni sono difficili da essere isolato / purificato 14; v) piccole proteine (<200 kDa massa molecolare) sono difficili da essere ripreso a causa del basso contrasto; vi) il basso contrasto ed elevata rumorosità di immagini crio-EM riduce il valore di cross-correlazione tra le immagini, quindi, diminuendo il grado di precisione nella determinazione di orientamenti proteine, conformazioni e classificazioni, soprattutto per proteine che sono strutturalmente flessibile e naturalmente variano in soluzione 4,5.
Colorazione negativa (NS) è un metodo relativamente "antico" e storica che ogni laboratorio, con qualsiasi tipo EM, può utilizzare per esaminare la struttura delle proteine. Brennero e Horne prima sviluppato il concetto of colorazione negativa mezzo secolo fa per l'esame di virus 15. NS si realizza attraverso il rivestimento del campione con sali di metalli pesanti cariche. Questo concetto originario di microscopia ottica e la pratica di incorporare i batteri in una soluzione colorante che fornisce buio intorno i campioni, permettendo un maggiore contrasto dell'immagine quando visualizzate l'immagine negativa 16. Poiché gli ioni di metalli pesanti hanno una maggiore capacità di disperdere gli elettroni rispetto ad atomi meno dense nelle proteine 17-20, e la macchia di rivestimento di metalli pesanti permette una limitazione dosaggio superiore con un maggior contrasto. Esemplare NS in grado di fornire immagini ad alto contrasto, 8 per facilitare la determinazione dell'orientamento delle particelle e la ricostruzione 3D di immagini da crio-EM.
NS tradizionali, purtroppo, possono produrre artefatti indotti dalle interazioni macchia di proteine, come ad esempio l'aggregazione generale, dissociazione molecolare, l'appiattimento e accatastamento 8,21,22. Per lipidico correlati proteins, come lipoproteine 16,23-30, un manufatto comune risultati in particelle che vengono raccolte e imballate insieme in un rouleaux (Figura 1), 31-36. Molti studi lipoproteine, come nondenaturing gradiente di poliacrilammide gel elettroforesi, crio-EM studia 13,29,37-40, spettrometria di massa 39,41, e piccoli dati di diffrazione a raggi X angolo di 42 tutte le particelle mostrano lipoproteine sono particelle isolate invece di natura impilati insieme formano un rouleaux 21,29,30,35,42-45. L'osservazione della formazione di rouleaux da NS convenzionali è probabilmente causata da interazioni dinamiche tra lipoproteine composto da apolipoproteine (APO) e fosfolipidi che sono strutturalmente flessibili in soluzione 13,29,30,46-49 e sensibilità al protocollo standard NS. Per identificare questo artefatto, apolipoproteina E4 (apoE4) palmitoil-oleoylphosphatidylcholine (POPC) lipoproteine ad alta densità (HDL) del campione sono stati utilizzati come un campione e cryo-Immagini EM per un artefatto libero standard di 29, lo screening dei campioni NS preparate sotto una serie di condizioni. Confrontando le dimensioni delle particelle e forme ottenute da NS e crio-EM, il tipo specifico di reagente di colorazione e concentrazione salina sono risultati essere due parametri fondamentali che causano i noti fenomeni rouleaux. Così, è stato segnalato un protocollo ottimizzato colorazione negativa (OpNS).
Con OpNS, fenomeno noto rouleaux di apoE4 HDL è stato eliminato da OpNS (Figura 2A). L'analisi statistica ha dimostrato OpNS rendimenti immagini molto simili (meno del 5% di deviazione) in dimensione e forma rispetto a quelli di crio-EM, ma il contrasto è stato eliminato. Le convalide di OpNS stati eseguiti esaminando l'eliminazione del manufatto rouleaux di quasi tutte le classi o sottoclassi di lipoproteine campioni 6,29,30,50,51, incluse apo-I 7.8 nm (Figura 2B), 8.4 nm (Figura 2C) , 9.6 nm discoidal ricostituito HDL (rHDL) (Figura 2D), 9.3 nm sferica rHDL (Figura 2E), HDL plasmatiche umane (Figura 2F), lipidi libero apoA-I (Figura 2G), HDL (Figura 2H), lipoproteine a bassa densità (LDL ) (Figura 2I), lipoproteine a densità intermedia (IDL) (Figura 2J), lipoproteine a bassissima densità (VLDL) (Figura 2K), e POPC liposomi (Figura 2L) 30. Convalide supplementari sono state eseguite da proteine di imaging piccole e asimmetriche, tra cui il 53 kDa proteina di trasferimento degli esteri del colesterolo (CETP) (Figura 3A - C) 6,29, e altamente flessibile 160 kDa anticorpi IgG (Figura 4A e B) 4,5,29 , 52, e due proteine strutturalmente ben noti, GroEL e proteasoma (Figura 2 M e N). Per richiedere alcuna validazione ulteriore da colleagues, siamo aperti a qualsiasi test cieco su questo metodo OpNS.
OpNS come un protocollo di alto-rendimento è stato utilizzato anche per studiare il meccanismo di proteine tramite l'esame di centinaia di campioni di piccole proteine, come CETP che è stato vincolanti per varie proteine in una serie di condizioni (tra cui CETP interagendo a 4 classi di lipoproteine, ricombinati HDL, plasma HDL, LDL e VLDL, con / senza 2 anticorpi, H300 e N13, sotto volte 9 di incubazione, di cui 3 min, 20 min, 1 ora, 2 ore, 4 ore, 8 ore, 24 ore, 48 ore e 72 ore, sotto i 4 rapporti molari, cioè 1: 0.5, 1: 1, 1: 2, 1: 4, e 3 diluizioni, cioè 0,1 mg / ml, 0,01 mg / ml e 0,001 mg / ml, oltre a campioni di controllo supplementari, tra cui solo CETP, solo LDL, VLDL e da solo, con le prove triple di esperimenti di cui sopra da parte di persone diverse) 6,29. OpNS immagini di CETP fornito immagini ad alto contrasto con ragionevolmente piccoli dettagli strutturali; che ci permette di ricostruire con successo una mappa di densità 3D del 53 kDa small proteina CETP (Figura 3D - F) per singola particella ricostruzione. Inoltre, le immagini ad alto contrasto OpNS ci forniscono un segnale sufficiente da una proteina individuo (Figura 4A - C), che ci ha permesso di raggiungere la risoluzione intermedia (~ 1.5 nm) di un singolo (un oggetto, non media) struttura IgG 3D attraverso il metodo (Figura 4E - J) individuale-particelle di elettroni tomografia (IPET) 5. La descrizione dettagliata della strategia IPET ricostruzione, la metodologia, i processi di step-by-step e l'analisi di variazione strutturale sono stati precedentemente segnalati 4. Un film sulle procedure di ricostruzione di anticorpi IPET, comprese le immagini crude e risultati intermedi, densità mappa 3D e attracco strutturale era disponibile anche al pubblico caricato su YouTube 5. Confronto delle ricostruzioni 3D da diverse particelle anticorpali individuali potrebbe rivelare le dinamiche di proteine e cmodifiche onformational durante le reazioni chimiche 4,5.
Considerando che oltre il 50% di proteine hanno massa molecolare compreso 40-200 kDa 1,2, il successo di imaging in queste piccole proteine evidenziato che il metodo OpNS è uno strumento utile per spingere il confine EM convenzionale verso le piccole e asimmetriche determinazioni strutturali e scoperte meccanismo . Pertanto, il protocollo dettagliato è fornito come sotto.
Protocollo
1 Preparazione del dolce negativo soluzione colorante al 1% (w / v)
- Mettere 1 mg di uranile formiato (UF) polvere in bottiglia di vetro contenente 100 ml di acqua deionizzata in una stanza buia o scatola.
- Mescolare la soluzione di O / N a RT in una stanza / scatola buia. Avvolgere la bottiglia di soluzione con un foglio di alluminio per evitare che la luce colpisca la soluzione.
- Filtrare la soluzione dolcemente attraverso 0,2 micron (dimensione dei pori) del filtro montato su una siringa da 5 ml. La soluzione filtrata è stato raccolto in diversi fogli di alluminio tubi Falcon coperti. La siringa filtro deve essere avvolto con un foglio di alluminio per evitare l'esposizione alla luce.
- Filtrare nuovamente la soluzione attraverso 0.02 micron (dimensione dei pori) del filtro montato sulla siringa da 1 ml. La soluzione filtrata è stata raccolta e aliquota in 2 ml fiale. Le siringhe e fiale vengono coperte con foglio di alluminio prima dell'uso.
- Congelare le fiale aliquote utilizzando pinze a manico lungo sommergendo le fiale in un azoto riempito contenitore di liquido immediatamenteDopo che la soluzione è stata filtrata.
- Trasferire i flaconi congelati in un freezer -80 ° C per la conservazione e l'utilizzo futuro.
2 Preparazione del negativo Workstation colorazione e incubazione Workstation
- Scongelare una fiala di soluzione all'1% UF in un bagnomaria regolato a temperatura ambiente. Assicurarsi che il foglio di alluminio rimane avvolto intorno al flacone per evitare l'esposizione alla luce.
- Filtrare la soluzione dopo che è completamente scongelato utilizzando un foglio di alluminio avvolto siringa da 1 ml con montato un filtro di 0,02 micron. Raccogliere la soluzione filtrata in un nuovo foglio di alluminio avvolto fiala, e lo mise sul ghiaccio all'interno di una calotta ricoperta di ghiaccio in attesa di utilizzo.
- Fai piastre soluzione da dito spingendo un foglio lungo Parafilm ~ 8 pollici sulla superficie di una piastra proteina cristallizzazione vuoto. Esso genera file di piastre circolari con un diametro di ~ 5 mm. Rendere 6 piatti in ogni luogo fila le piastre Parafilm su una superficie di ghiaccio schiacciato all'interno di un ghiaccio contengonocoperchio er, come workstation colorazione.
- Pipettare ~ 35 ml acqua deionizzata su ciascuna di sinistra tre piatti in ogni riga, e pipetta ~ 35 microlitri soluzione filtrata UF a destra tre piatti in ogni riga. Coprire la workstation colorazione con un coperchio per evitare l'esposizione alla luce prima colorazione delle proteine.
- Preparare una stazione di incubazione griglia EM riempiendo una scatola vuota a metà con ghiaccio, e aderito accanto a un gancio che può essere montato su una base di appoggio. Posizionare le pinzette campione del gancio, in cui le punte pinzette 'si trovano nelle vicinanze della superficie del ghiaccio. Metà coprire punte delle pinzette 'da l'altezza scatola labbro. Un contenitore di ghiaccio ideale per fare una stazione di incubazione utilizza un contenitore puntali vuoto.
3 OpNS Funzionamento
- Glow-scaricare il film sottile di carbonio rivestito 300 maglie EM griglie di rame per 10 sec.
- Prendete una griglia con una pinzetta e agganciare le pinzette nel gancio tenendo la griglia a 45 ° di inclinazione e 1 pollice sopra il ghiacciosuperficie interna della stazione di incubazione.
- Diluire il campione di proteina con Dulbecco Phosphate Buffered Saline (DBPs) ad una concentrazione proteica finale di ~ 0,01 a ~ 0.005 mg / ml. Cauzione ~ 4 microlitri del campione diluito immediatamente dopo la diluizione sul lato carbonio della griglia di EM. (DPBS possono essere cambiati ad un altro buffer se la proteina è sensibile a DPBS)
- Incubare il campione sulle griglie EM per ~ 1 min all'interno della stazione di incubazione.
- Rimuovere la soluzione in eccesso attraverso toccando rapidamente il bordo griglia con carta da filtro.
- Toccare la griglia rapidamente alla prima goccia (~ 35 ml) di superficie d'acqua pura in cima al foglio di Parafilm subito dopo la soluzione in eccesso è stato rimosso in griglia EM. E poi rimuovere l'acqua in eccesso subito con carta da filtro.
- Ripetere il punto 3.6 per altre due volte da lavare la griglia EM sui restanti due gocce d'acqua sulla Parafilm (Passo 3.6 e 3.7 possono essere saltati se il campione è molto sensibile all'acqua).
- Float la gri EMd immediatamente sulla superficie della prima goccia di UF soluzione dopo che l'acqua in eccesso sulla griglia EM è stato rimosso. E poi incubare per 10 sec. Assicurati di terminare le procedure di lavaggio acqua nel raggio di 3 secondi prima che galleggia la griglia sulla superficie della soluzione UF. Minore è il tempo di lavaggio, migliore è la qualità sarà.
- Pulire le pinzette penetrando le punte in una carta da filtro per ~ 2 - 3 volte.
- Rimuovere la soluzione in eccesso sulla griglia attraverso contattando il bordo della griglia con la carta da filtro, e poi galleggiano la griglia sulla seconda goccia di UF.
- Continuare al passo 3.10 sulla seconda goccia.
- Float la griglia sulla terza goccia di soluzione di UF e coprire la stazione di colorazione per ~ 1 min.
- Passaggio facoltativo: lavare la griglia rapidamente sulla cima di acqua, come descritto in 3.6. Questo ulteriore passo andrà a beneficio dei campioni contenenti più di particelle d'oro gratuiti cariche o macchia sfondo.
- Rimuovere l'eccesso di soluzione toccando la carta da filtro a the tutta la griglia posteriore (opposto al lato di carbonio). Asciugare la griglia sotto leggera corrente di azoto a temperatura ambiente a destra dopo aver osservato la soluzione di assorbimento per la carta da filtro.
- Posizionare la griglia su un foglio di carta da filtro in una capsula di Petri, e coprire il piatto in parte con un cappuccio per asciugare per almeno 30 minuti sotto RT. Per alcuni campioni, inserire la griglia a 40 ° C incubatore cuocere per un ora.
- Conservare la griglia in una scatola di rete EM per il futuro EM esame.
4. EM Esaminare
- Allineare il TEM correttamente prima EM esame delle piccole proteine sulla griglia.
- Controllare la risoluzione più alta visibile Thon-ring che è lo spettro di potenza di una pellicola di carbonio amorfo per determinare se il TEM è stata allineata correttamente. Dal momento che il TEM è condiviso da molti utenti diversi, il TEM è stato spesso non correttamente allineato.
- Controllare attentamente lo spettro di potenza sulla zona pellicola di carbonio del campione per regolare la conditio allineamenton della macchina. I più alti visibili Thon-ring sono migliori rispetto alla risoluzione mirata.
NOTA: Come esempio di un corretto allineamento di un TEM LaB6 filamento funzionano sotto 120 kV ad alta tensione, più di 20 Thon-ring possono essere visualizzati, in cui, la relativa risoluzione può essere migliore di 5,0 Å. Questo Thon-ring è stato ottenuto mediante trasferimento di Fourier di una pellicola di carbonio amorfo ripreso sotto una sfocatura di ~ 1,6 micron e una dose di 20,4 elettronica / A2 (figura 5).
NOTA: Osservazione della alta risoluzione Thon-ring è una condizione necessaria, ma non è una condizione sufficiente per il corretto allineamento. Per raggiungere effettivamente le immagini ad alta risoluzione, molti altri parametri sono importanti, come la qualità del campione, danni da radiazioni, carica e alla deriva, nonché il rateo di dose di illuminazione.
- Portare il defocus torna a quasi Scherzer punto di riferimento per l'imaging le piccole proteine in una zona ideale macchiata.
- Ricerca per zona "nuvoloso" per image. Un'area idealmente macchiata è generalmente situato vicino al bordo di una area della macchia più spessa, che si presenta come una zona "torbida" sulla griglia poiché lo spessore della macchia non è normalmente distribuita uniformemente sulla griglia carbonio rivestite (Figura 6). Tipicamente un basso ingrandimento (<100x) è stato quello di aiutare a trovare queste aree nuvolose prima di zoom per l'imaging.
Risultati
Le implementazioni di OpNS includono esami strutturali e morfologiche di varie specie di lipoproteine quali: nascente HDL ricombinante (rHDL), sferica HDL ricombinante, HDL, LDL, IDL e VLDL (figura 2) 30; così come piccole proteine quali 53 kDa CETP (tra le proteine più piccole impressi con successo attraverso EM) (Figura 3) 6 e gli anticorpi IgG 160kDa (una delle proteine più dinamiche ed eterogenee) (Figura 4) 4,5,29,52 , anche 28 kDa lipide apolipoproteina libero A-1 (Figura 2L), e GroEL e proteasomi (Figura 2 M e N).
Altri esempi di OpNS come metodo high-throughput stanno esaminando le interazioni proteina-proteina per scoprire i meccanismi di proteine, come ad esempio 53 kDa CETP. Come descritto in premessa, come CETP interagisce con diverse sottoclassi di lipoproteine erano INDAGINEted tramite l'esame più di 400 esemplari EM 6 Per quanto ne sappiamo, non era un caso di studio di crio-EM che coinvolge lo screening quasi un centinaio di condizioni diverse.
OpNS possono espandere i confini EM per studiare piccole e asimmetrica struttura delle proteine 3D e persino espandere per raggiungere la struttura 3D formare un unico e individuale di proteine (non media). Ad esempio, anticorpi IgG è di 160 kDa molecola con una struttura estremamente flessibile, in cui la ricostruzione 3D a risoluzione intermedia è difficile da raggiungere. il metodo OpNS stato usato per immagine un anticorpo IgG individuo da una serie di angoli di rotazione (Figura 4E e H). Le immagini ragionevolmente ad alta risoluzione e di proteine ad alto contrasto da OpNS consentiti per la ricostruzione di successo di una singola proteina da individuo tomografia elettrone particella (IPET) (Figura 4E - J) 4,5. Nella ricostruzione IPET 3D 4, la serie inclinazione 2D di anticorpi mirati sono stati progressivamente allineato al loro centro globale calcolato tramite la ricostruzione in seguito iterativa per ottenere una densità 3D a una risoluzione di ~ 14,1 Å (Figura 4F e G) 4. Con lo stesso approccio, un unico complesso anticorpo-peptide è stato ricostruito, e il peptide indotto il dominio cambiamento conformazionale interno di una singola particella anticorpo è stato scoperto (Figura 4I e J, risoluzione ~ 16,6 Å) 4,5. Confrontando le ricostruzioni 3D da diverse singole particelle, l'analisi strutturale può permettere di rivelare proteine fluttuazioni termodinamiche, e anche "snap-shot" le fasi intermedie di una reazione chimica 4,5,29,53,54.
In sintesi, le proteine con peso molecolare tra 40 kDa - 200 kDa sono impegnative per gli esami strutturali EM standard e ricostruzioni. Considerando che oltre il 50%di proteine hanno massa molecolare compreso 40-200 kDa 1,2, si segnalare un metodo OpNS come uno strumento robusto e high-throughput per spingere la EM confine convenzionale verso le piccole e asimmetriche determinazioni strutturali e anche studi meccanicistici.
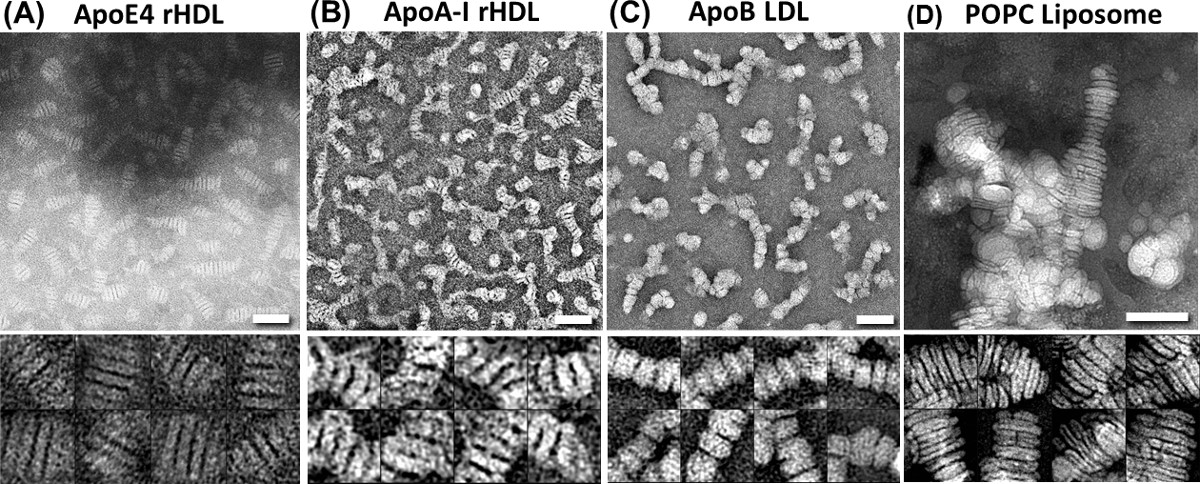
Figura 1 Rouleau artefatto delle lipoproteine da parte convenzionale colorazione negativa (NS) EM. Microscopio elettronico (sopra) e pannelli di particelle selezionate (sotto i pannelli) mostrano varie lipoproteine con rouleaux dopo NS con acido fosfotungstico (PTA) nell'ambito della procedura di miscela standard. (A) ricostituito HDL (rHDL) con ApoE4, (B) apoA-I-contenenti 9.6 nm discoidale rHDL, (C) apoB contenente LDL plasmatiche, (D)-non contenenti apolipoproteina POPC liposomi. Bar: 50 nm. Dimensioni finestra: A e C, 20 nm; B, 30 nm. Il Journal of Lipid Research pubblicato inizialmente questo lavoro 29,30. Cliccate qui per vedere una versione più grande di questa figura.
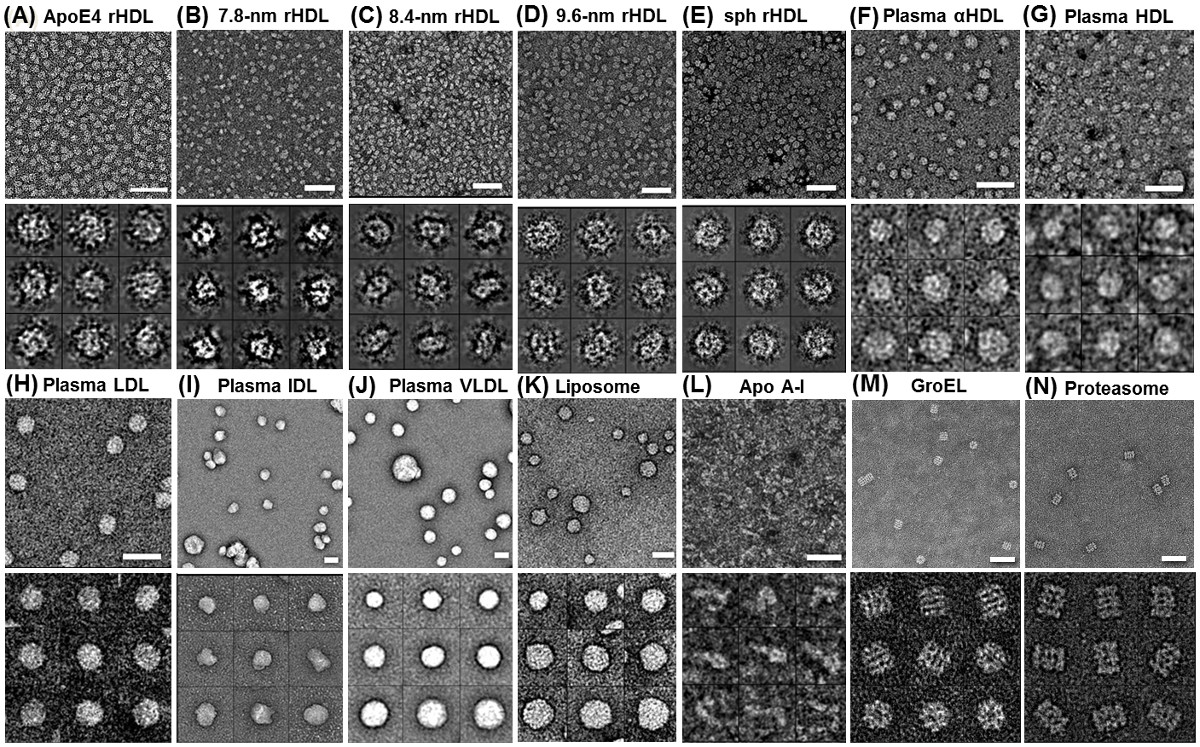
Figura 2 Struttura delle proteine dal ottimizzato colorazione negativa micrografie (OpNS) EM elettroni mostrano varie lipoproteine e liposomi senza rouleaux artefatto da OpNS (A) apoE4 contenenti rHDL,.. (B) 7,8 nm rHDL; (C) 8,4 nm rHDL; ( D) 9.6 nm rHDL; (E) 9,3 nm rHDL sferica; (F) del plasma umano α-HDL; (G) al plasma HDL; (H) LDL dal plasma umano; (I) IDL Plasma umano; (J) VLDL plasma umano; (K) POPC liposomi; (L) lipidi libero apoA-I. Verifica aggiuntivo è stato fatto utilizzando (M) GroEL e campioni (N) proteosoma. Micrografie (pannelli superiori) e le particelle selezionate (sotto i pannelli). Bar: 50 nm. Dimensioni finestra: A - D, 20 nm; E e F, 25 nm; G, 20 nm; H, 25 nm; I, 50 nm; J e K, 100 nm; L, 80 nm., Salvo lipidi libero apoA-I, GroEL e Proteasome, Questa ricerca è stata originariamente pubblicata sul Journal of Lipid Research 29,30. Cliccate qui per vedere una versione più grande di questa figura.
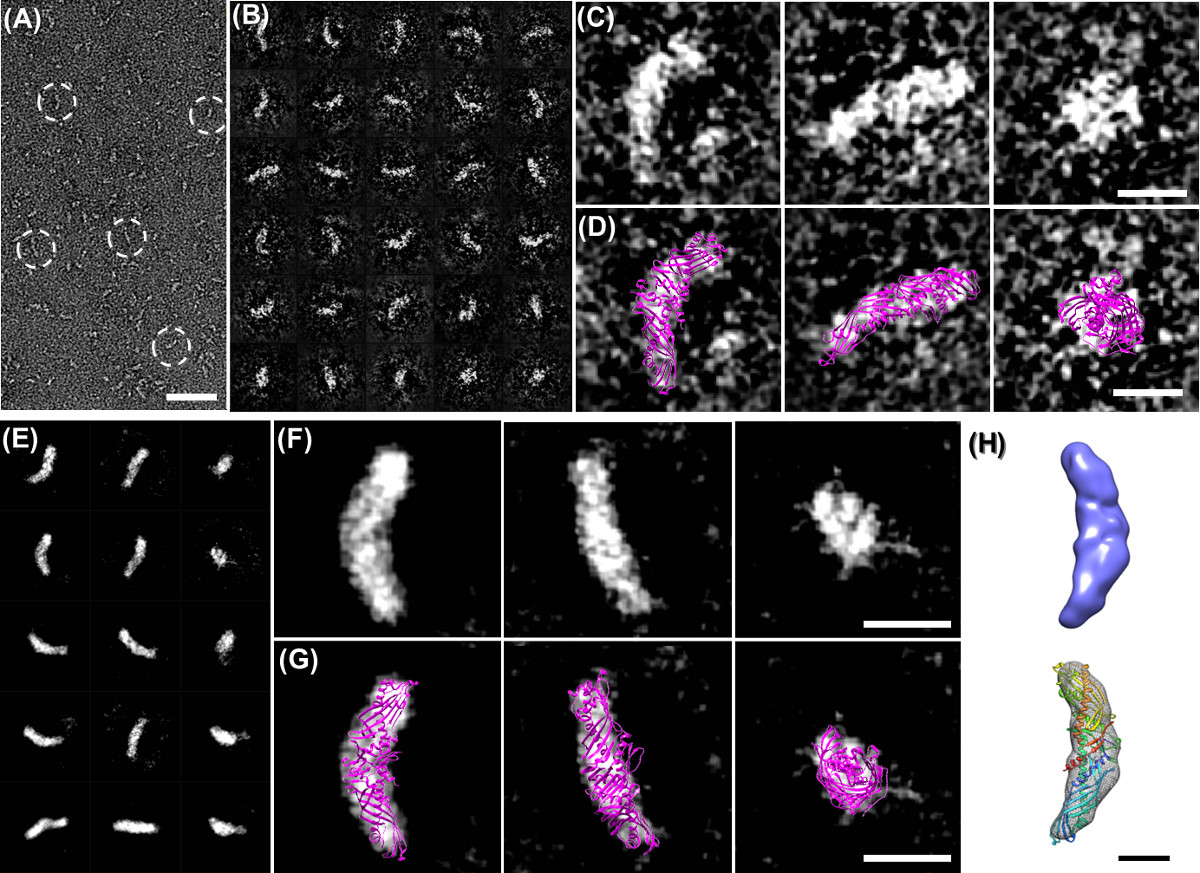
Figura 3 OpNS micrografie elettroniche di CETP. (A) Panoramica microfotografia con CETP (tratteggiata cerchi) particelle a forma di banana. (B) WindoweD Selezionare particelle prime. (C) Tre immagini di particelle CETP crudo singoli che mostra chiaramente un grande, punta globulare più pesante e più grande compreso l'altro più piccolo, più leggero e punta stretta (pannello di sinistra), vista dall'alto che mostra le regioni terminali simili con meno curvatura complessiva (al centro pannello), e alla fine vista lungo l'asse lungo della CETP (pannello di destra) (D) Sovrapposizione la struttura cristallina (PDB:. 2OBD) su queste immagini di particelle CETP prime, abbina bene sia in forma e le dimensioni del dominio strutturale che mostra l'orientamento può essere quasi direttamente definito anche senza l'assistenza di computer (corrispondenti pannelli a (C)). (E) Riferimento gratuiti medie di classe 2D (un processo ab initio per calcolare le somiglianze (calcolo cross-correlazione) di queste particelle orientate in modo casuale, le particelle che hanno un alta somiglianza tra loro sono stati raggruppati, allineati e poi una media per ridurre il rumore di fondo e migliorato la particella immagine concontrasto. Le medie di classe 2D gratuito di riferimento sono calcolati dal software refine2D.py nel pacchetto EMAN, in cui, senza alcun modello iniziale umano fatto è stato coinvolto in questa classe media. Le medie della classe di riferimento possono essere utilizzati come un metodo indipendente per convalidare la ricostruzione 3D dalla ricostruzione singolo-particella). (F) di riferimento selezionato gratuiti medie di classe 2D mostrano una estremità distale più grande rispetto agli altri. (G) struttura cristallina sovrapposto (PPB : 2OBD) rispetto alle medie libere di riferimento, le immagini sovrapposte mostrano un vicino abbinamenti perfetti tra cristallo-struttura e privi di riferimento della classe media sia in forma struttura e le dimensioni del dominio (bassa del pannello) (F) Densità 3D mappa di CETP a. risoluzione del 13 Å è stato ricostruito dal 8879 particelle impressi da OpNS e il metodo di ricostruzione singola particella (pannello superiore) e la increspato-corpo ancorata in questa ricostruzione singola particella dalla struttura cristallina (bassa del pannello). Il detinformazioni soffriva esattamente della ricostruzione singola particella, compresa la pre-elaborazione immagine, modello iniziale, le procedure di raffinatezza, la distribuzione e l'angolo di Fourier Shell Correlazione (FSC) sono stati pubblicati nella sezione metodo e informazioni a sostegno della carta originale (H) il confronto finale del singolo ricostruzione particella ( sopra il pannello) e ulteriore confronto in forma PDB (pannello inferiore) 6. Bar: A, 50 nm; B - D, 10 nm; F, 3 nm. Alcuni di questi dati sono stati precedentemente pubblicati in Nature Chemical Biology 6. Cliccate qui per vedere una versione più grande di questa figura.
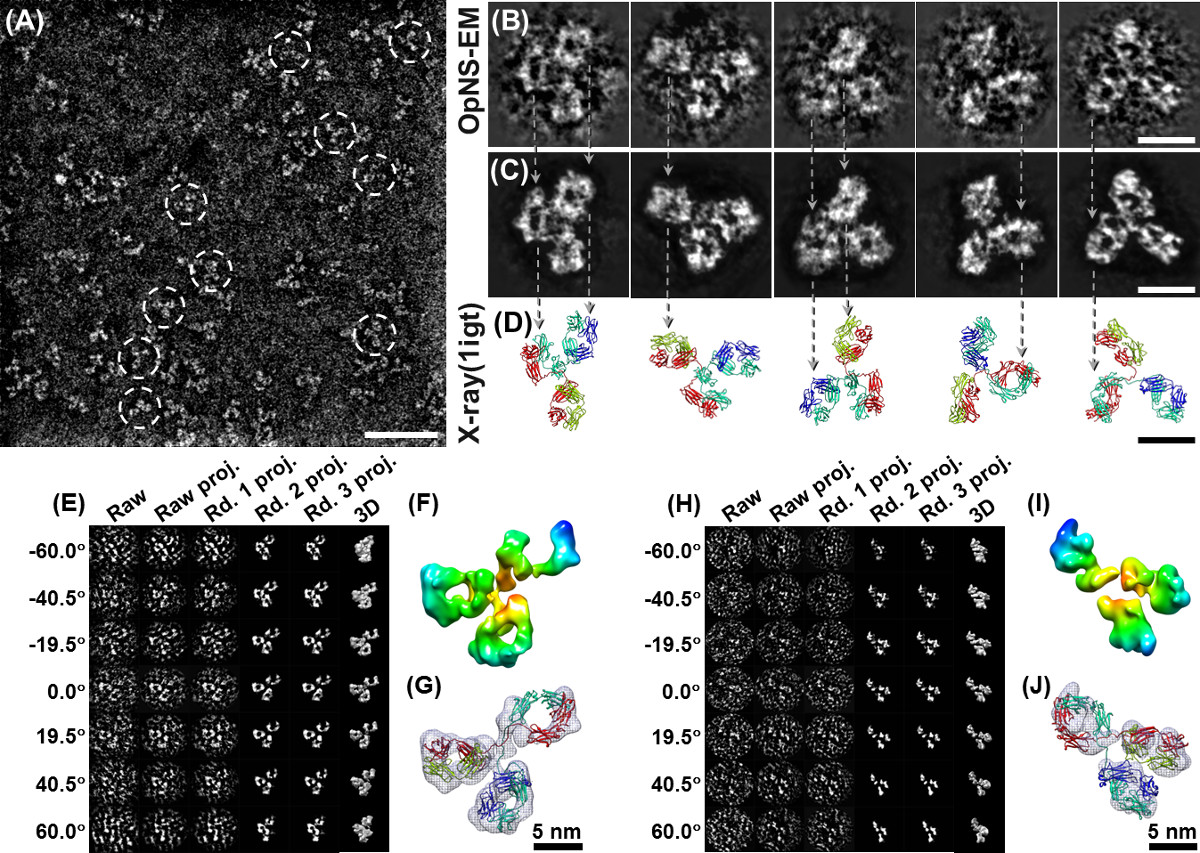
Figura 4 OpNS immagini e ricostruzioni di IgG umana particelle 1 anticorpi. (A) Sopravista delle immagini anticorpi IgG1 OpNS umani. Le particelle indicate in cerchi bianchi mostrano chiaramente le particelle con 3 sottodomini. (B) selezionato immagini ad alta risoluzione prime cinque singole particelle non coniugati di anticorpi e (C) le loro immagini al rumore ridotto corrispondenti riducendo manualmente rumore circostante bordo di particelle grezzo (senza toccare alcun densità all'interno delle particelle) per visualizzare facilmente. (D) La struttura cristallina (PDB 1IGT) di anticorpi IgG1 che è stato orientato ad una visione simile alle immagini EM. Confronto tra le immagini corrispondenti mostra molti punti in comune tra l'immagine EM e la struttura cristallina, comprese le posizioni e forme di dominio. (E) La procedura passo-a-passo di una ricostruzione ab initio 3D da una singola istanza di anticorpi IgG1 (nessuna media, un singolo oggetto) con il metodo individuale-particelle di elettroni tomografia (IPET). (F) La ricostruzione 3D finale di un SIparticella anticorpo ngle ad una risoluzione di 14,1 Å ha mostrato tre domini forma di ciambella formando a forma di "Y". (G) Docking le strutture cristalline domini in ciascuna delle corrispondenti densità dominio mappe, rispettivamente, e ripetendo manualmente i loop tra i domini. (H) La procedura passo-a-passo di ricostruzione 3D di un unico complesso IgG-peptide (nessuna media, un singolo oggetto) da IPET. (I) La ricostruzione 3D finale di un complesso peptide IgG è stata esposta ad una risoluzione di 16.6 Å ha mostrato tre asta domini forma formando a forma di "Y" (J) Rispettivamente, attracco la struttura cristallina di ogni domini anticorpali IgG (voce PDB: 1IGT). in ogni asta densità di forma mostrato una scarsa corrispondenza con strutture cristalline di dominio, suggerendo un cambiamento conformazionale del dominio interno dopo peptide coniugazione. La procedura dettagliata, l'analisi e la risoluzione delle statistiche sono stati descritti nel documento originale 5 Bar: A, 50 nm; B - D, 10 nm. Questo lavoro inizialmente pubblicato su PLoS ONE 4 e 5 relazioni scientifiche. Cliccate qui per vedere una versione più grande di questa figura.
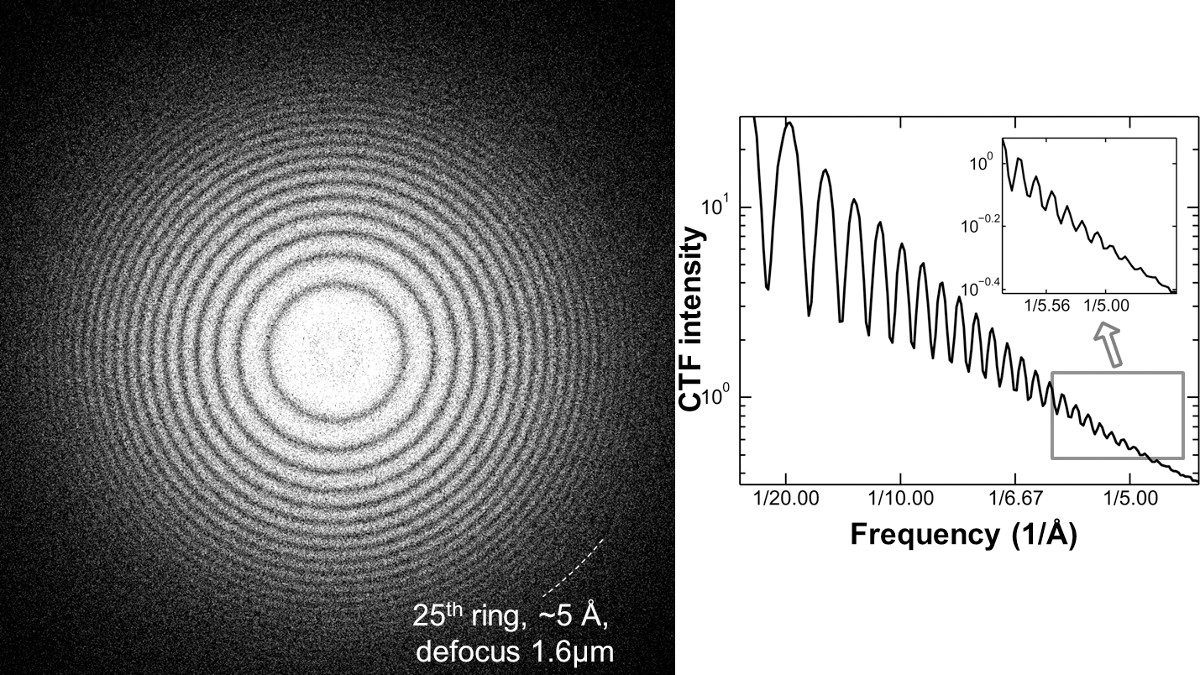
Figura 5 spettro di potenza del film di carbonio amorfo ripreso sotto 1,6 micron sfocatura da un Zeiss Libra 120 LaB6 TEM. Ad alta risoluzione delle immagini richiede prove sufficienti per dimostrare che EM ha la capacità di allineamento e ad alta risoluzione corretta. L'analisi dello spettro di potenza della zona di carbonio vicino sulla griglia è un metodo efficace per controllare la condizione fascio coerenza prima dell'acquisizione dei dati. Trasferimento di Fourier dell'immagine di un'area carbonio amorfo mostrano la funzione di trasferimento contrasto Relativo strumento (C TF), così chiamata Thon-ring. Un corretto allineamento e la coerenza può essere riflessa dal numero delle visibili Thon-ring e la più alta risoluzione di anelli Thon visibili in una condizione relativamente elevato defocus. Come esempio di una condizione di corretto allineamento nei pressi di un laboratorio di 6 filamento TEM attrezzata, più di ~ 20 Thon anelli (~ 5 A) possono essere generati da una pellicola di carbonio vengono esposte a 1.6 micron defocus utilizzando dosi 20,4 e - / A 2. Gli anelli Thon raggiunti da un TEM di fascia bassa hanno una simile a quella da TEM high-end, come una pistola campo di emissione (FEG) potenziato TEM operato sotto una condizione di allineamento corretto. Questo lavoro inizialmente pubblicato su Scientific Reports 5. Cliccare qui per visualizzare una versione più grande di questa figura.
6highres.jpg "width =" 500 "/>
Figura 6 micrografie Esempio di aree "ideali" per l'imaging OpNS. Tre campioni di proteine, (A) GroEL (B) Proteasome (C) Spherical HDL, sono stati utilizzati come esempi per dimostrare le OpNS ideali per l'imaging. Dal momento che le macchie non sono equamente distribuiti nel campione, il basso ingrandimento di campione di solito appare "nuvoloso" (pannello di sinistra). Le zone ideali per l'imaging sono normalmente situati nei confini di queste "nuvole". Un esempio di step-by-step zoom-in one "nuvoloso" regione macchia (pannello centrale a sinistra) mostrano le immagini ad alto ingrandimento che presentano ad alta risoluzione e immagini a contrasto elevato di particelle (pannello centrale a destra). Le immagini selezionate di particelle mostrano i dettagli della struttura delle proteine (pannello a destra). Bars:. 30nm Cliccate qui per vedere una grandeversione R di questa figura.
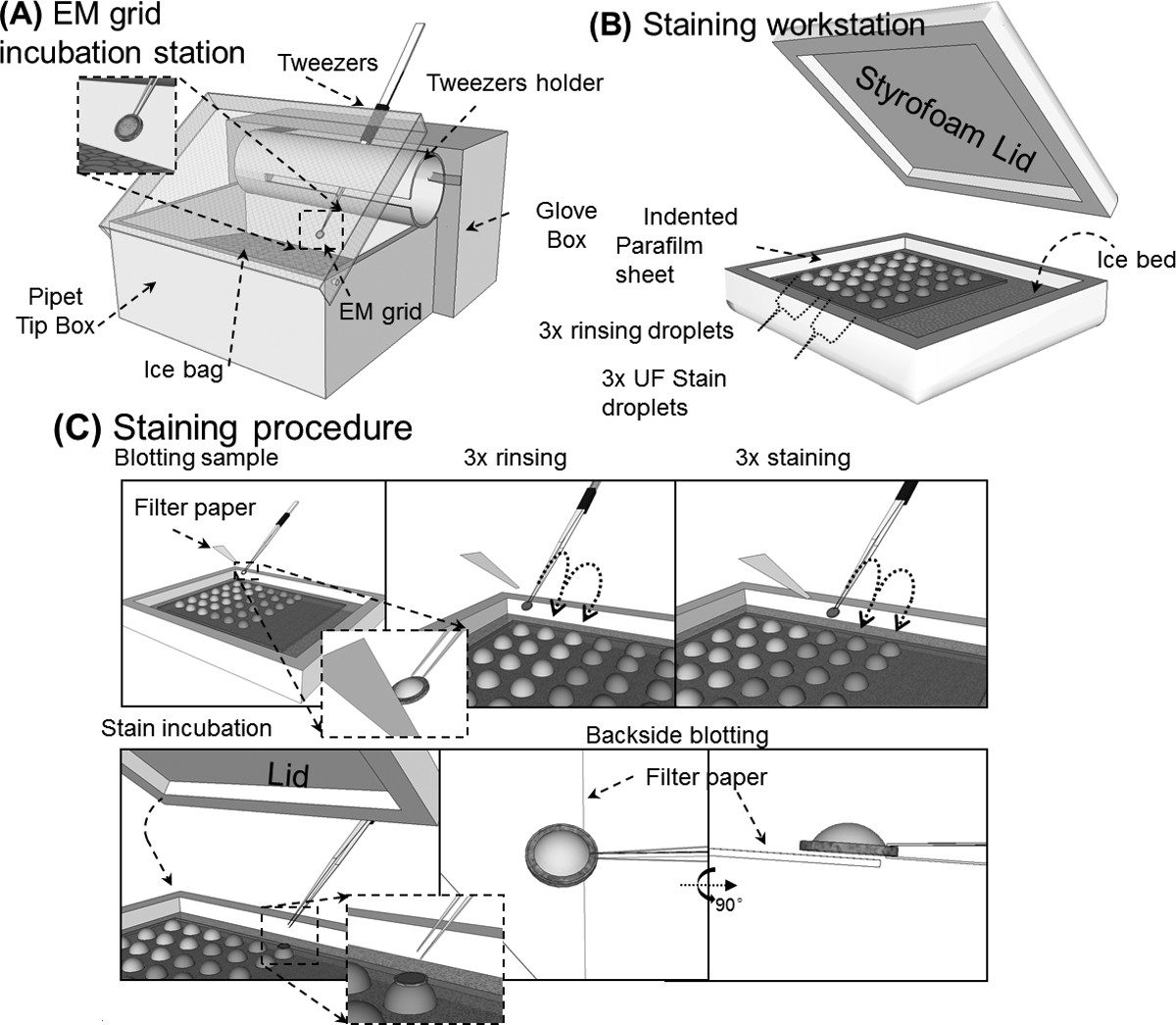
Figura 7 Un diagramma schematico delle procedure OpNS. (A) Stazione griglia EM incubazione, semplice stazione per incubare la soluzione del campione sulla griglia di luce-scarica. (B) workstation colorazione, progettato per mantenere le goccioline di acqua di lavaggio, e gocce macchia sopra un letto di ghiaccio, riducendo al minimo l'esposizione alla luce macchia. (C) Presentazione di procedura di colorazione, illustrando: direzione assorbente, risciacquo con acqua 3x, esposizione macchia 3x UF, incubazione colorazione con griglia invertita sul campione gocce macchia, e il campione retro finale assorbente per garantire un sottile strato di soluzione di macchia del campione prima dell'essiccazione da l'azoto dell'aria. Cliccate qui per vedere una versione più grande di thè figura.
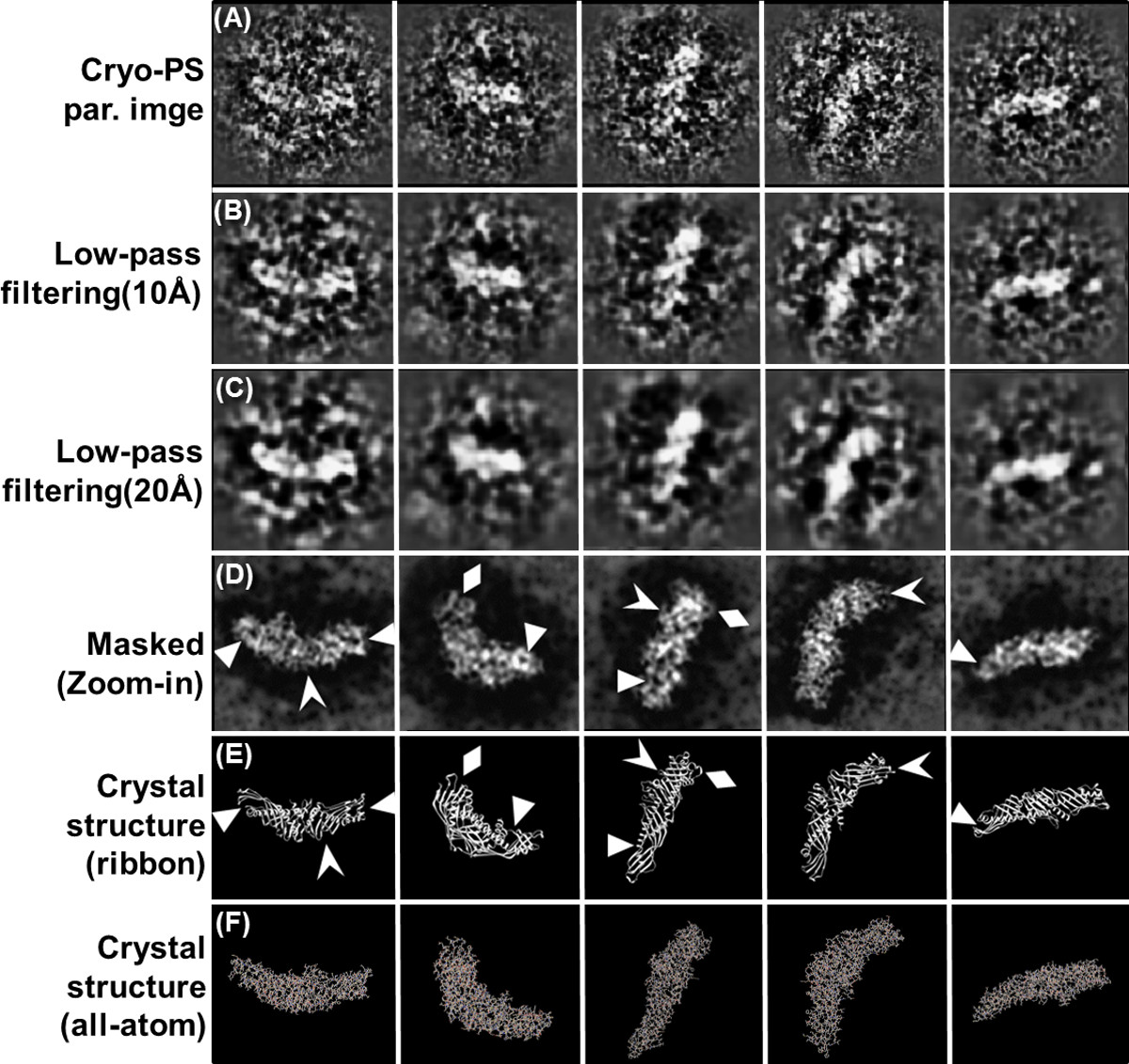
Figura 8 ad alta - immagini ad alta risoluzione di piccola proteina 53kDa CETP rivelato da un metodo OpNS modificato, crio-positivo-colorazione (crio-PS) Cinque selezionare ad alta risoluzione e di forma circolare morbidi mascherati crude immagini di particelle CETP (con contrasto inverso). e forma delle particelle mascherato particelle prime (rumore ridotto manualmente circostanti bordi immagini di particelle grezzi ', ma senza modificare alcuna densità all'interno delle particelle) per visualizzare facilmente. All-atomo e confronto struttura cristallina del nastro per mascherare le particelle prime allineati orientamenti simili di ogni particella di immagini EM. I dati ad alta risoluzione delle aree dell'immagine prime visualizzare certa somiglianza con la struttura cristallina, mentre non tutte le funzioni della struttura di cristallo possono essere risolte dai dati grezzi. Remarka Bly, queste immagini crude mostrano somiglianza in entrambi le estremità terminale aventi vicina piccoli fori circolari visto nelle immagini di rumore ridotto manualmente (triangoli); inoltre, i fili nelle regioni C-terminale all'interno di immagini di particelle completano struttura cristallina β-fogli (frecce) e, infine, loop sporgenti sulla regione CETP C-terminale sono simili alla struttura cristallina (diamanti). (A) Cinque selezionare ad alta risoluzione e di forma circolare, morbido mascherati crude immagini di particelle CETP (con contrasto inverso). (B) passa basso filtraggio a 10 bis. (C) Higher Low filtraggio passa a 20 bis. (D) Masked immagini manualmente rumore ridotto. (E) Cristallo confronto struttura per struttura del nastro. (F) Cristallo confronto struttura per ogni rappresentazione atomo. Bar: 5nm. Parte di questo lavoro è stato pubblicato su Nature Chemical Biology 6.lank "> Clicca qui per visualizzare una versione più grande di questa figura.

Figura 9 Electron micrografie di liposomi che mostrano formazione Rouleau dal protocollo di NS convenzionale (macchia PTA) in differenti salinità. (A) ad alta salinità (~ 0,5 MNaCl). (B) salinità regolare (~ 0,25 M NaCl). (C) a bassa salinità (~ 0.1 M NaCl). (D) acqua pura. Micrografie (sopra il pannello) e selezionare le particelle finestrate (qui di seguito indicate pannello). Bar: 100 nm. Dimensioni finestra: 80 nm. Il Journal of Lipid Research originariamente pubblicato questo lavoro 30. Cliccare qui per visualizzare una versione più grande di questa figura.
Discussione
Rispetto alle tecniche convenzionali NS, OpNS possono prevenire artefatti rouleaux (Figura 1 e 9), che forniscono ad alta risoluzione affidabile e ragionevole (~ 1 nm) dettagli strutturali di piccole proteine (Figura 2). Rispetto alla crio-EM, OpNS fornisce un metodo throughput elevato e può esaminare una grande varietà di proteine e le interazioni proteina-proteina 6. Tuttavia, OpNS ha ancora i suoi svantaggi. Rispetto ai convenzionali NS, OpNS comporta: i) i passaggi più complicati nella preparazione dei campioni; ii) utilizzando una sostanza radioattiva, UF; iii) mantenendo la macchia fresco dovuto alla potenza minore tra la macchia UF a causa della sua sensibilità alla luce; iv) per impedire la precipitazione della soluzione UF deve essere conservata in -80 ° C e richiede scongelamento prima dell'uso; v) e infine tutti UF deve essere trattato come rifiuto pericoloso. Rispetto alla crio-EM, OpNS fornisce immagini con risoluzione relativamente più bassi e nessuna garanzia per qualsiasi manufatto non ancora scopertoin futuro.
Dell'operatore di NS effetti procedurali sulla formazione delle lipoproteine rouleaux
Protocolli di NS per la preparazione di proteine per l'esame 16,29-36,55 possono essere classificati in tre gruppi principali di metodi di miscelazione 50: 55, goccia a goccia 16, e procedure di lavaggio 29. i) Il protocollo di miscelazione richiede la miscelazione preliminare del campione macchia e proteine in un rapporto specifico, e quindi applicare la soluzione mista su pellicola al carbonio rivestito su una griglia, infine rimuovendo la soluzione in eccesso con carta da filtro prima di asciugatura ad aria per EM esame 55. ii) Il protocollo goccia a goccia comporta l'applicazione (~ 4 microlitri) campione goccia direttamente ad una griglia EM rivestito in carbonio lasciar riposare per circa 1 minuto, successivamente rimuovendo soluzione campione in eccesso prima dell'applicazione di una goccia (~ 4 microlitri) di macchia soluzione sullo stesso lato della griglia. Dopo ~ 1 min di incubazione, rimuovere le excess macchia attraverso il contatto con la carta da filtro pulito, infine, la presentazione per l'essiccazione dell'aria 16,56-58. iii) Il protocollo di lavaggio (Figura 7) che richiede l'applicazione di esempio soluzione a una griglia EM rivestito in carbonio per 1 minuto, poi si lava con acqua deionizzata per tre volte a destra dopo aver rimosso la soluzione in eccesso ogni volta da carta da filtro 3,29,30. OpNS protocollo è stato modificato da questa procedura di lavaggio.
Tipi di macchia NS e gli effetti sulla formazione delle lipoproteine rouleaux
In NS, forte dispersione di elettroni a causa di macchie di metalli pesanti forniscono contrasto da proteine 17-20,59. Campioni NS possono inoltre subire maggiori dosi di radiazioni, e migliorare la funzionalità della proteina da un contrasto più netto negativo 8,9,60. Macchie di metalli pesanti possono essere classificati come: anionici, tra cui l'acido fosfotungstico (PTA) 16, metilammina tungstato 14 e tungstato di silicio 61; e cationiic, come ad esempio l'acetato di uranile (UA) 62, UF 3,29,30, e nitrato di uranile (NU) 63. Una delle macchie anionici NS che è più comunemente usato è PTA 33,64-67. PTA è un acido heteropoly, che viene in genere utilizzato intorno ad un pH 7,0-7,5. PTA può essere utilizzato anche per la colorazione positiva 3,16,68. Le cariche negative del PTA possono mediare interazioni elettrostatiche con i lipidi insaturi carica positiva gruppi di testa, come POPC, su entrambe le superfici lipoproteine e liposomi. PTA può causare la formazione di rouleaux attraverso questa interazione 29,30 anche sotto regolare 29,30 buffer di salinità (Figura 1). Macchie di uranile, come UA, UF e le Nazioni Unite sono scelte alternative per cationici metalli pesanti macchie e UA, in particolare, è spesso utilizzato per NS di una serie di campioni biologici 62,69,70. Esperimenti hanno trovato UF non provoca rouleaux di lipoproteine che contengono lipidi acidi grassi insaturi, come POPC. Tuttavia, UF può ancora indurre rouleformazione aux sulla lipoproteina che contengono lipidi acidi grassi saturi, come la fosfatidilcolina dimyristoyl (DMPC) e 1-hexadecanoyl-2-octadecanoyl-sn-glicero-3-fosfocolina (PSPC). Il meccanismo dettagliato di questa interazione è sconosciuto. UA / UF / ONU può lavorare tutti a valori di pH più bassi che vanno 3,5-4,6. Tali valori di pH inferiori non possono adatto per alcune macromolecole biologiche che sono sensibili al pH 14,71. È interessante notare che, UA / UF può risolvere la struttura delle proteine nel giro di pochi millisecondi attraverso un meccanismo sconosciuto 72. A differenza di PTA, UA / UF è più simile ad un sale di un acido.
UF riferito in grado di fornire risultati migliori rispetto UA 73, in cui, macchie UF e delle Nazioni Unite hanno granulometrie più piccole UA (UF: 0,3 nm, Onu: ~ 0.5 nm) 3,74. Un esempio interessante, secondarie struttura-come dettagli di una piccola proteina (53 kDa CETP) possono essere visualizzati direttamente dalle micrografie prime quando UF è stato utilizzato come reagente negativo-macchia, seguendo ilriportate in precedenza crio-positivo-colorazione (crio-PS) metodo (Figura 8) 6. In crio-PS, il campione era macchiato lampo congelato seguendo crio-EM procedura di preparazione del campione, invece di essiccamento in protocollo OpNS, che può causare il collasso strutturale secondario. Il crio-PS è un metodo per alto contrasto e immagini ad alta risoluzione di piccole proteine 75. Dal momento che le immagini crio-PS hanno invertito contrasto rispetto a quelli riportati dal protocollo di crio-NS 22, ma hanno contrasto costante a quelli da immagini crio-EM convenzionali, così è stato chiamato il metodo crio-PS. Le immagini crio-PS mostrano che il reagente di colorazione, formiato di uranile, penetra la superficie molecolare, sfidando la visione convenzionale che la colorazione può visualizzare solo la struttura della superficie esterna. Il meccanismo di come formiato di uranile penetra la superficie molecolare è sconosciuto. Una possibilità è che il catione uranile lega disponibili gruppi carbossilici proteina, e quindi lacircostante ghiaccio vitreo è di densità inferiore alla colorazione delle proteine e dei gruppi di uranile, agendo quindi come una macchia positivo. Il metodo di crio-PS è simile al metodo dei multipli di sostituzione isomorfa (MIR), che è stato un approccio comune per risolvere il problema della fase in cristallografia a raggi X 76-78. In MIR, campioni di cristallo sono impregnati con una soluzione atomo pesante, tra cui uranio, per ottenere una forma isomorfo alla sua forma originaria. L'aggiunta di un atomo pesante a volte non influenza la formazione di cristallo o unità di dimensioni delle cellule, ma fornisce ulteriori informazioni di cristallo determinazione della struttura 76-78. Con beneficiando del piccolo chicco di UF, crio-PS potrebbe fornire un'immagine ad alta risoluzione di contrasto elevato e di una singola proteina, che è importante per gli studi di struttura delle proteine, soprattutto se si considera che quasi tutte le proteine sono naturalmente dinamica ed eterogenea, in soluzione. Per la validazione di questo metodo crio-PS, apriamo per qualsiasi prova non vedenti dal campo EM.
Effetti di concentrazione di sale sulla formazione rouleaux in lipoproteine
Utilizzando PTA tradizionale colorazione negativa reagente, formazione rouleaux osservato è più probabile legata alle interazioni lipidi invece di interazione proteina. Imaging i campioni di POPC vescicole di liposoma preparati sotto notevole salinità (0,5 M NaCl), salinità moderata (0,25 M NaCl), relativamente debole salinità (0.1M NaCl), e l'acqua pura (Figura 9), i microscopio elettronico mostrano la formazione di rouleaux era correlata alla concentrazione di sale (Figura 9A - D). Utilizzando UF reagente colorazione come negativo, non rouleaux è stata osservata in POPC liposomi vescicole campione di 30 (Figura 2L), suggerendo la procedura di lavaggio per ridurre rapidamente la concentrazione di sale a destra prima della colorazione è una necessità, ma non passo autonomamente sufficiente per prevenire rouleaux in POPC correlate campioni.
immagini TEM piccola proteina richiede una condizione di messa a fuoco quasi Scherzer.
Immagini TEM di successo di piccole proteine a risoluzione più elevata richiede due condizioni critiche, un allineamento del fascio corretta e una condizione di acquisizione di messa a fuoco vicino-Scherzer. i) Un corretto allineamento del fascio può essere giudicata attraverso il numero di squilli visibili Thon (spettro di potenza) sul trasferimento di Fourier di una immagine acquisita pellicola di carbonio sotto una relativamente alta defocus. Migliore è la condizione di allineamento del fascio, i più anelli Thon può essere visualizzato e misurabile immagine .. ii) Acquisizione sotto un quasi-Scherzer fuoco è un'altra condizione critica. Una strategia standard tradizionale per l'imaging di campioni biologici utilizza tipicamente alta defocus (1 - 2 micron e anche di più), che può aumentare il contrasto dell'immagine campione biologico 79. Questa strategia è significativo differente dalla tipica strategia per l'imaging struttura risoluzione atomica di materiali duri, che spessoutilizza un vicino centro Scherzer (~ 50 nm defocus). Anche se, una sfocatura maggiore potrebbe rafforzare il contrasto campione biologico, segnali ad alta risoluzione sarà parzialmente eliminati. Come risultato, la complicità di segnale ad alta risoluzione sarebbe inferiore a una condizione di imaging sfocatura maggiore. La ragione è che, l'immagine TEM è la convoluzione della struttura campione e CTF strumento. La CTF è una curva oscillante contro la frequenza, in cui la curva di frequente oscillava attraversando ampiezza zero ad alta frequenza. Ogni volta CTF attraverso lo zero, sarà eliminato il segnale strutturale campione a questa frequenza specifica (zero volte ogni numero sarà pari a zero). Il segnale eliminato a questa frequenza può mai essere recuperato da qualsiasi algoritmo di correzione CTF (uno zero diviso per zero può essere qualsiasi numero casuale al posto del segnale strutturale originale). Sotto superiore di imaging sfocatura, CTF oscillerà molto più aggressivo, così CTF attraversa ampiezza nulla più frequentemente, di conseguenza,i segnali strutturali a un numero maggiore di frequenze specifiche saranno eliminati. I più segnali che vengono eliminati, la complicità meno l'immagine avrà. In particolare, la complicità di immagine non può essere recuperata o corretta da alcuna correzione CTF. Tuttavia, un numero di immagini acquisite incompleti sotto diversi defocuses può essere utilizzata per riempire i vuoti tra loro per ottenere un segnale strutturali completato della struttura campione tramite un metodo di media, in cui anche una risoluzione atomica può essere raggiunto 9-12.
Il metodo di media è un approccio efficace per realizzare la struttura di alcune proteine altamente simmetrica e proteine strutturalmente rigidi collegati. Tuttavia, rimane ancora difficile nello studio strutturale delle proteine piccole e asimmetriche, soprattutto per la dinamica strutturale e proteine flessibili, come gli anticorpi e le HDL. Mediazione si basa sul presupposto che le particelle proteiche sono identici nella struttura e conformazione ma different in orientamenti, ma molte proteine sono noti a subire oscillazioni termodinamica in soluzione. Applicando il metodo di calcolo della media senza prima conoscere le proteine di fluttuazione fluttuazioni termodinamiche, la struttura media può spesso causare domini 10,80 o variazioni locali nella risoluzione 81 in ricostruzioni crio-EM mancante.
Il successo nel raggiungere la ricostruzione 3D della piccola proteina, come ad esempio 53 kDa CETP, e la struttura 3D di una singola proteina, come ad esempio 160 kDa anticorpi IgG1, beneficia utilizzando la condizione di messa a fuoco delle immagini quasi Scherzer sotto una condizione di allineamento corretto. Anche se il contrasto dell'immagine sembra basso nel breve Scherzer immagini messa a fuoco, il contrasto può essere facilmente migliorata semplicemente applicando un filtro passa-basso per ridurre il rumore ad alta frequenza in background. Noi crediamo, prossimo-Scherzer fuoco immagini trasportano i segnali strutturali massimo, e può aumentare la precisione di allineamento delle particelle e migliorare efficienza in single-particelle di ricostruzione 3D e singola particella elettrone tomografia ricostruzione.
Divulgazioni
We have nothing to disclose.
Riconoscimenti
Ringraziamo il Dr. Mickey Yang per l'editing e commenti, e Drs. Lei Zhang Peng Bo e per l'assistenza. Questo lavoro è stato sostenuto dal Office of Science, Ufficio di Scienze energetici di base del Dipartimento dell'Energia degli Stati Uniti (contratto n. DE-AC02-05CH11231), il National Heart, Lung, e il Sangue Istituto dei National Institutes of Health (senza . R01HL115153), e l'Istituto Nazionale di scienze mediche generali del National Institutes of Health (senza. R01GM104427).
Materiali
| Name | Company | Catalog Number | Comments |
| Stain: Uranyl Formate | The SPI Supplies Division of Structure Probe, Inc. | 02545-AA | http://www.2spi.com/catalog/chem/Uranyl_Formate.shtml |
| Syringe: 1 ml NORM-JECT | VWR | 89174-491 | https://us.vwr.com/store/catalog/product.jsp?catalog_number=89174-491 |
| Syringe filter: 0.2 μm | VWR | 28145-487 | https://us.vwr.com/store/catalog/product.jsp?catalog_number=28145-487 |
| Syringe filter: 0.02 μm filter (Anotop 10) | Whatman | 6809-1002 | http://www.whatman.com/AnotopSyringeFilters.aspx |
| Dulbecco’s Phosphate Buffered Saline | SIGMA-Aldrich | D8537 | http://www.sigmaaldrich.com/catalog/product/sigma/d8537?lang=en®ion=US |
| Parafilm: 4 in. x 125 ft. | VWR | 470152-246 | https://us.vwr.com/store/catalog/product.jsp?catalog_number=WLS65710-A |
| Carbon film coated TEM grid: 300 mesh | Pacific Grid-Tech | Cu-300CN | http://www.grid-tech.com/catalog.htm#1-thincarbon |
| Carbon film coated TEM grid: 200 mesh | EMS (Electro Microscopy Sciences) | CF200-Cu | http://www.emsdiasum.com/microscopy/products/grids/support.aspx |
| Tweezer: Dumont Tweezer L5 | EMS (Electro Microscopy Sciences) | 72882-D | http://www.emsdiasum.com/microscopy/products/tweezers/dumont_clamping.aspx#02-L5 |
| Milli-Q Advantage A10 Ultrapure Water Purification System | EMD Millipore | Milli-Q Advantage A10 | http://www.millipore.com/catalogue/module.do?id=C10117 |
| Filter Paper: Grade 1 circles | Whatman | 1001-090 | http://www.whatman.com/QualitativeFilterPapersStandardGrades.aspx |
| Aluminum Foil | Any type | ||
| Filter Tips: Low-Retention Aerosol Filter Tips for 10µL Pipettors | VWR | 89174-520 | https://us.vwr.com/store/catalog/product.jsp?catalog_number=89174-520 |
| [header] | |||
| Glow Discharge Unit | Ted Pella | 91000 | http://www.tedpella.com/easiglow_html/Glow-Discharge-Cleaning-System.htm |
| Filter Tips: Low-Retention Aerosol Filter Tips for 40µL Pipettors | VWR | 89174-524 | https://us.vwr.com/store/catalog/product.jsp?catalog_number=89174-524 |
| Filter Tips: VWR Signature 200 µL Pipet Tips | VWR | 37001-528 | https://us.vwr.com/store/catalog/product.jsp?catalog_number=37001-528 |
| Pipet | Pipetman | F161201 and F167300 | http://www.pipetman.com/Pipettes/Single-Channel/PIPETMAN-Classic.aspx |
Riferimenti
- Lipman, D. J., Souvorov, A., Koonin, E. V., Panchenko, A. R., Tatusova, T. A. The relationship of protein conservation and sequence length. BMC Evol Biol. 2, (2002).
- Tran, J. C., et al. Mapping intact protein isoforms in discovery mode using top-down proteomics. Nature. 480, 254-258 (2011).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biol Proced Online. 6, 23-34 (2004).
- Zhang, L., Ren, G. IPET and FETR: experimental approach for studying molecular structure dynamics by cryo-electron tomography of a single-molecule structure. PLoS ONE. 7, e30249 (2012).
- Tong, H., et al. Peptide-conjugation induced conformational changes in human IgG1 observed by optimized negative-staining and individual-particle electron tomography. Sci Rep. 3, 1089 (2013).
- Zhang, L., et al. Structural basis of transfer between lipoproteins by cholesteryl ester transfer protein. Nat Chem Biol. 8, 342-349 (2012).
- Henderson, R. Realizing the potential of electron cryo-microscopy. Q Rev Biophys. 37, 3-13 (2004).
- Sander, B., Golas, M. M. Visualization of bionanostructures using transmission electron microscopical techniques. Microsc Res Tech. 74, 642-663 (2011).
- Liu, H., et al. Atomic structure of human adenovirus by cryo-EM reveals interactions among protein networks. Science. 329, 1038-1043 (2010).
- Liao, M., Cao, E., Julius, D., Cheng, Y. Structure of the TRPV1 ion channel determined by electron cryo-microscopy. Nature. 504, 107-112 (2013).
- Baker, M. L., et al. Validated near-atomic resolution structure of bacteriophage epsilon15 derived from cryo-EM and modeling. Proceedings of the National Academy of Sciences of the United States of America. 110, 12301-12306 (2013).
- Bai, X. C., Fernandez, I. S., McMullan, G., Scheres, S. H. Ribosome structures to near-atomic resolution from thirty thousand cryo-EM particles. eLife. 2, e00461 (2013).
- Ren, G., et al. Model of human low-density lipoprotein and bound receptor based on cryoEM. Proc Natl Acad Sci U S A. 107, 1059-1064 (2010).
- Bremer, A., Henn, C., Engel, A., Baumeister, W., Aebi, U. Has negative staining still a place in biomacromolecular electron microscopy. Ultramicroscopy. 46, 85-111 (1992).
- Brenner, S., Horne, R. W. A negative staining method for high resolution electron microscopy of viruses. Biochim Biophys Acta. 34, 103-110 (1959).
- Forte, T. M., Nordhausen, R. W. Electron microscopy of negatively stained lipoproteins. Methods in enzymology. 128, 442-457 (1986).
- Colliex, C., et al., Prince, E., et al. . International Tables For Crystallography. , 259-429 (2006).
- Ren, G., Zuo, J. M., Peng, L. -. M. Accurate Measurements of Crystal Structure Factors Using a FEG Electron Microscope Using Digital Micrographs. Micron. 28, 459-467 (1997).
- Peng, L. M., Ren, G., Dudarev, S. L., Whelan, M. J. Robust parameterization of elastic and absorptive electron atomic scattering factors. Acta Crystallographica Section A. 52, 257-276 (1996).
- Peng, L. M., Ren, G., Dudarev, S. L., Whelan, M. J. Debye-Waller factors and absorptive scattering factors of elemental crystals. Acta Crystallographica Section A. 52, 456-470 (1996).
- Melchior, V., Hollingshead, C. J., Cahoon, M. E. Stacking in Lipid Vesicle Tubulin Mixtures Is an Artifact of Negative Staining. Journal of Cell Biology. 86, 881-884 (1980).
- De Carlo, S., Harris, J. R. Negative staining and cryo-negative staining of macromolecules and viruses for TEM. Micron. 42, 117-131 (2011).
- Allan, V., Vale, R. Movement of Membrane Tubules Along Microtubules In - Evidence for Specialized Sites of Motor Attachment. Journal of Cell Science. 107, 1885-1897 (1994).
- Catte, A., et al. Novel changes in discoidal high density lipoprotein morphology: a molecular dynamics study. Biophys J. 90, 4345-4360 (2006).
- Forester, G. P., Tall, A. R., Bisgaier, C. L., Glickman, R. M. Rat intestine secretes spherical high density lipoproteins. J Biol Chem. 258, 5938-5943 (1983).
- Gantz, D. L., Walsh, M. T., Small, D. M. Morphology of sodium deoxycholate-solubilized apolipoprotein B-100 using negative stain and vitreous ice electron microscopy. Journal of Lipid Research. 41, 1464-1472 (2000).
- Pentikainen, M. O., Lehtonen, E. M., Kovanen, P. T. Aggregation and fusion of modified low density lipoprotein. J Lipid Res. 37, 2638-2649 (1996).
- Tall, A. R., Green, P. H., Glickman, R. M., Riley, J. W. Metabolic fate of chylomicron phospholipids and apoproteins in the rat. J Clin Invest. 64, 977-989 (1979).
- Zhang, L., et al. An optimized negative-staining protocol of electron microscopy for apoE4 POPC lipoprotein. J Lipid Res. 51, 1228-1236 (2010).
- Zhang, L., et al. Morphology and structure of lipoproteins revealed by an optimized negative-staining protocol of electron microscopy. J Lipid Res. 52, 175-184 (2011).
- Gong, E. L., et al. Discoidal complexes containing apolipoprotein E and their transformation by lecithin-cholesterol acyltransferase. Biochim Biophys Acta. 1006, 317-328 (1989).
- Schneeweis, L. A., Koppaka, V., Lund-Katz, S., Phillips, M. C., Axelsen, P. H. Structural analysis of lipoprotein E particles. Biochemistry. 44, 12525-12534 (2005).
- Raussens, V., et al. Orientation and mode of lipid-binding interaction of human apolipoprotein E C-terminal domain. Biochem J. 387, 747-754 (2005).
- Li, X., Kan, H. Y., Lavrentiadou, S., Krieger, M., Zannis, V. Reconstituted discoidal ApoE-phospholipid particles are ligands for the scavenger receptor BI. The amino-terminal 1-165 domain of ApoE suffices for receptor binding. J Biol Chem. 277, 21149-21157 (2002).
- Innerarity, T. L., Pitas, R. E., Mahley, R. W. Binding of arginine-rich (E) apoprotein after recombination with phospholipid vesicles to the low density lipoprotein receptors of fibroblasts. J Biol Chem. 254, 4186-4190 (1979).
- Lu, B., Morrow, J. A., Weisgraber, K. H. Conformational reorganization of the four-helix bundle of human apolipoprotein E in binding to phospholipid. J Biol Chem. 275, 20775-20781 (2000).
- van Antwerpen, R., La Belle, M., Navratilova, E., Krauss, R. M. Structural heterogeneity of apoB-containing serum lipoproteins visualized using cryo-electron microscopy. J Lipid Res. 40, 1827-1836 (1999).
- van Antwerpen, R., et al. Cryo-electron microscopy of low density lipoprotein and reconstituted discoidal high density lipoprotein: imaging of the apolipoprotein moiety. J Lipid Res. 38, 659-669 (1997).
- Silva, R. A., et al. Structure of apolipoprotein A-I in spherical high density lipoproteins of different sizes. Proc Natl Acad Sci U S A. 105, 12176-12181 (2008).
- van Antwerpen, R. Preferred orientations of LDL in vitreous ice indicate a discoid shape of the lipoprotein particle. Arch Biochem Biophys. 432, 122-127 (2004).
- Davidson, W. S., Silva, R. A. Apolipoprotein structural organization in high density lipoproteins: belts, bundles, hinges and hairpins. Curr Opin Lipidol. 16, 295-300 (2005).
- Peters-Libeu, C. A., Newhouse, Y., Hatters, D. M., Weisgraber, K. H. Model of biologically active apolipoprotein E bound to dipalmitoylphosphatidylcholine. J Biol Chem. 281, 1073-1079 (2006).
- Peng, D. C., Song, C., Reardon, C. A., Liao, S. S., Getz, G. S. Lipoproteins produced by ApoE-/- astrocytes infected with adenovirus expressing human ApoE. Journal of Neurochemistry. 86, 1391-1402 (2003).
- Peters-Libeu, C. A., Newhouse, Y., Hall, S. C., Witkowska, H. E., Weisgraber, K. H. Apolipoprotein E*dipalmitoylphosphatidylcholine particles are ellipsoidal in solution. J Lipid Res. 48, 1035-1044 (2007).
- Jones, M. K., et al. Assessment of the validity of the double superhelix model for reconstituted high density lipoproteins: a combined computational-experimental approach. J Biol Chem. 285, 41161-41171 (2010).
- Carnemolla, R., et al. The specific amino acid sequence between helices 7 and 8 influences the binding specificity of human apolipoprotein A-I for high density lipoprotein (HDL) subclasses: a potential for HDL preferential generation. J Biol Chem. 283, 15779-15788 (2008).
- Sivashanmugam, A., et al. Structural basis of human high-density lipoprotein formation and assembly at sub nanometer resolution. Methods Cell Biol. 90, 327-364 (2008).
- Cavigiolio, G., et al. The interplay between size, morphology, stability, and functionality of high-density lipoprotein subclasses. Biochemistry. 47, 4770-4779 (2008).
- Chen, B., et al. Apolipoprotein AI tertiary structures determine stability and phospholipid-binding activity of discoidal high-density lipoprotein particles of different sizes. Protein Sci. 18, 921-935 (2009).
- Zhang, L., Tong, H., Garewal, M., Ren, G. Optimized negative-staining electron microscopy for lipoprotein studies. Biochim Biophys Acta. 1830, 2150-2159 (2013).
- Tong, H. M., Zhang, L., Huang, L. Q., Ren, G. Optimized negative-staining protocol for electron microscopy study of lipoprotein structure. Progress in Biochemistry and Biophysics. 39, 972-978, doi:Doi 10.3724/Sp.J.1206.2012.00224. 39, 972-978 (2012).
- Zhang, L., Kaspar, A., Woodnutt, G., Ren, G. Monitoring the Structural Changes of Conjugated Antibodies by High-Resolution Electron Microscopy and Individual-Particle Electron Tomography. Biophysical Journal. 98, 440-441 (2010).
- Ren, G., Zhang, L. Asymmetric Small Protein Structure Determination by Individual Particle Electron Tomography. Biophysical journal. 102, 394a (2012).
- Zhang, L., Ren, G. Structural Determination of Heterogeneous Protein by Individual-Particle Electron Tomography - Combination of Electron Tomography and Local Refinement Reconstruction Method for High-Resolution Structural Determination of Each Individual Protein Particle. Biophysical journal. 98, 441a (2010).
- Forte, T., Norum, K. R., Glomset, J. A., Nichols, A. V. Plasma lipoproteins in familial lecithin: cholesterol acyltransferase deficiency: structure of low and high density lipoproteins as revealed by elctron microscopy. J Clin Invest. 50, 1141-1148 (1971).
- Fang, Y., Gursky, O., Atkinson, D. Lipid-binding studies of human apolipoprotein A-I and its terminally truncated mutants. Biochemistry. 42, 13260-13268 (2003).
- Gursky, O., Ranjana, D. L., Gantz, Complex of human apolipoprotein C-1 with phospholipid: thermodynamic or kinetic stability. Biochemistry. 41, 7373-7384 (2002).
- Jayaraman, S., Gantz, D. L., Gursky, O. Effects of protein oxidation on the structure and stability of model discoidal high-density lipoproteins. Biochemistry. 47, 3875-3882 (2008).
- Ren, G., Peng, L. M. The Analytic Doyle-Turner Representation of High Energy Electron Absorptive Structure Factors. Acta Physica Sinica. 45, 1344-1349 (1996).
- Ren, G., Reddy, V. S., Cheng, A., Melnyk, P., Mitra, A. K. Visualization of a water-selective pore by electron crystallography in vitreous ice. Proc Natl Acad Sci U S A. 98, 1398-1403 (2001).
- Camejo, G., Suarez, Z. M., Munoz, V. The apo-lipoproteins of human plasma high density lipoprotein: a study of their lipid binding capacity and interaction with lipid monolayers. Biochim Biophys Acta. 218, 155-166 (1970).
- Kondo, A., Muranaka, Y., Ohta, I., Kanno, T. Dynamic reaction in a homogeneous HDL-cholesterol assay visualized by electron microscopy. Clin Chem. 45, 1974-1980 (1999).
- Tufteland, M., Ren, G., Ryan, R. O. Nanodisks derived from amphotericin B lipid complex. J Pharm Sci. 97, 4425-4432 (2008).
- Clay, M. A., Pyle, D. H., Rye, K. A., Barter, P. J. Formation of spherical, reconstituted high density lipoproteins containing both apolipoproteins A-I and A-II is mediated by lecithin : cholesterol acyltransferase. Journal of Biological Chemistry. 275, 9019-9025 (2000).
- Desilva, H. V., Masoliva, J., Taylor, J. M., Mahley, R. W. Identification of Apolipoprotein B-100 Low-Density Lipoproteins, Apolipoprotein B-48 Remnants, and Apolipoprotein E-Rich High-Density-Lipoproteins in the Mouse. Journal of Lipid Research. 35, 1297-1310 (1994).
- Fagan, A. M., et al. Unique lipoproteins secreted by primary astrocytes from wild type, apoE (-/-), and human apoE transgenic mice. Journal of Biological Chemistry. 274, 30001-30007 (1999).
- Musliner, T. A., et al. Dissociation of high density lipoprotein precursors from apolipoprotein B-containing lipoproteins in the presence of unesterified fatty acids and a source of apolipoprotein A-I. J Lipid Res. 32, 917-933 (1991).
- Silverman, L., Glick, D. The reactivity and staining of tissue proteins with phosphotungstic acid. J Cell Biol. 40, 761-767 (1969).
- Hamilton, R. L., Williams, M. C., Fielding, C. J., Havel, R. J. Discoidal bilayer structure of nascent high density lipoproteins from perfused rat liver. J Clin Invest. 58, 667-680 (1976).
- Pollard, H., Scanu, A. M., Taylor, E. W. On the geometrical arrangement of the protein subunits of human serum low-density lipoprotein: evidence for a dodecahedral model. Proc Natl Acad Sci U S A. 64, 304-310 (1969).
- Frasca, J. M., Parks, V. R. A Routine Technique for Double-Staining Ultrathin Sections Using Uranyl and Lead Salts. J Cell Biol. 25, 157-161 (1965).
- Zhao, F. Q., Craig, R. Capturing time-resolved changes in molecular structure by negative staining. Journal of structural biology. 141, 43-52 (2003).
- Knight, D. P. Negative staining of rat tail tendon collagen fibrils with uranyl formate. Tissue Cell. 7, 651-654 (1975).
- Dash, S., et al. Temperature programmed decomposition of uranyl nitrate hexahydrate. Journal of Nuclear Materials. 264, 271-282 (1999).
- Zhang, L., et al. Structural basis of transfer between lipoproteins by cholesteryl ester transfer protein. Nature Chemical Biology. 8, 342-349 (2012).
- Kartha, G. Combination of multiple isomorphous replacement and anomalous dispersion data for protein structure determination. 3. Refinement of heavy atom positions by the least-squares method. Acta crystallographica. 19, 883-885 (1965).
- Kartha, G., Parthasarathy, R. Combination of Multiple Isomorphous Replacement and Anomalous Dispersion Data for Protein Structure Determination. I. Determination of Heavy-Atom Positions in Protein Derivatives. Acta crystallographica. 18, 745-749 (1965).
- Kartha, G., Parthasarathy, R. Combination of Multiple Isomorphous Replacement and Anomalous Dispersion Data for Protein Structure Determination. Ii. Correlation of the Heavy-Atom Positions in Different Isomorphous Protein Crystals. Acta crystallographica. 18, 749-753 (1965).
- Taylor, K. A., Glaeser, R. M. Electron microscopy of frozen hydrated biological specimens. Journal of ultrastructure research. 55, 448-456 (1976).
- Correia, I., et al. The structure of dual-variable-domain immunoglobulin molecules alone and bound to antigen. mAbs. 5, (2013).
- Cardone, G., Heymann, J. B., Steven, A. C. One number does not fit all: mapping local variations in resolution in cryo-EM reconstructions. Journal of structural biology. 184, 226-236 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon