Method Article
Raccolta e analisi dei
In questo articolo
Riepilogo
Conoscenza della composizione del floema nonché il meccanismo del suo carico e trasporto a lunga distanza è essenziale per la comprensione della segnalazione a lunga distanza in sviluppo delle piante e di stress / risposta patogeno e di assimilare trasporto. Questo manoscritto descrive la raccolta di essudati floema con il metodo EDTA-agevolata.
Abstract
Il floema impianto è essenziale per il trasporto a lunga distanza di (foto-) assimila nonché della trasmissione di segnali di stress biotici e abiotici. Esso contiene zuccheri, amminoacidi, proteine, lipidi, RNA e altri metaboliti. Mentre vi è un grande interesse per la comprensione della composizione e la funzione del floema, il ruolo di molte di queste molecole e, quindi, la loro importanza nella sviluppo delle piante e di stress risposta deve ancora essere determinato. Una barriera di analisi floema risiede nel fatto che i sigilli stesso floema upon ferendone. Come risultato, il numero di piante da cui floema può essere ottenuta è limitata. Un metodo che consente la raccolta di floema essudati da diverse specie di piante, senza attrezzature aggiunto è la collezione di EDTA-agevolata floema essudato qui descritto. Mentre è facile da usare, consentono di giungere alla ferimento di cellule e la cura deve essere presa per rimuovere contenuto delle cellule danneggiate. Inoltre, diversi controlli per dimostrare la purezza dell'essudatosono necessari. Perché è un essudato piuttosto che una raccolta diretta del floema (non possibile in molte specie) soltanto quantificazione relativa dei suoi contenuti può verificarsi. Il vantaggio di questo metodo rispetto ad altri è che può essere usato in molti erbacea o specie di piante legnose (Perilla, Arabidopsis, pioppo, ecc) e richiede un minimo di attrezzature e formazione. Si porta a ragionevolmente grandi quantità di essudati che possono essere utilizzati per la successiva analisi di proteine, zuccheri, lipidi, RNA, virus e metaboliti. È abbastanza semplice che può essere utilizzato sia in una ricerca così come in un laboratorio didattico.
Introduzione
Piante non possono muoversi per sfuggire condizioni avverse. Di conseguenza, hanno dovuto sviluppare meccanismi per rilevare stress ambientali, suscitare e trasmettere un segnale correlato in tutta la pianta, e di regolare di conseguenza lo sviluppo. Esistono due sistemi di trasporto per la distribuzione di acqua, i nutrienti e altri composti (segnalamento). Il primo è lo xilema; quali trasporta tipicamente acqua e sali minerali assorbiti dalle radici tutto l'impianto. Il secondo è il floema. La vista del floema è cambiata da un semplice sistema di trasporto assimilare ad un condotto per l'RNA, proteine, virus, lipidi e altre piccole molecole. Esso gioca un ruolo importante nel assimilare e trasporto di nutrienti, risposta allo stress biotico e abiotico, così come in crescita e sviluppo delle piante. Si è ora chiamato il "autostrade dell'informazione" della pianta 18.
Floema è composto da diversi tipi di cellule: floema parenchima, nonché compagna specializzato ceLLS ed elementi di Sieve. L'elemento setaccio è il sito di movimento a lunga distanza. Per consentire il flusso longitudinale ostruito, elementi forati mancano maggior organelli nonché nuclei e si pensa di contenere al massimo un macchinario traduzionale limitata 21, 33. Si ritiene che le cellule compagno sintetizzare le proteine e altri composti, che viaggiano nel flusso floema. Questi composti vengono poi trasportati nell'elemento setaccio attraverso plasmodesmata e può funzionare come segnali lunga distanza 4,16.
Diversi gruppi di composti possono essere trovati in floema essudati:
- Zuccheri sono spesso i prodotti di fotosintesi e vengono trasportati come "energetici che trasportano" molecole ad altre parti della pianta di stoccaggio o come blocchi di costruzione. Tuttavia, possono anche funzionare come antigelo o come composti di segnalazione.
- Le proteine possono anche essere trovati in floema essudati. Essi includono gli enzimi metabolici, ma anche hanno funzione di segnalazione. Uno example di una proteina che serve come segnale di sviluppo è la fioritura locus T proteina, che segnala l'induzione della fioritura nonché abscission foglia stagionali nelle piante. 6
- Gli acidi nucleici sono presenti in essudati floema in forma di mRNA, piccole e micro RNA e RNA virali. Essi sembrano essere in gran parte coinvolti nella segnalazione 27, 28, 39. Allo stesso tempo, rRNA e tRNA per quasi tutti gli amminoacidi sono stati osservati nel floema delle cucurbitacee 42. Essi appaiono da trasferire selettivamente nel sistema tubo setaccio. I tRNA mostrano modifiche necessarie per la capacità di trasferire gli amminoacidi all'apparato traduzionale. Eppure, invece di partecipare alle traduzioni, sembrano inibire questo processo. In alternativa, potrebbero servire come fonte di citochinine o segnalare lo stato metabolico della pianta 42.
- Acidi grassi, oxylipins e altri lipidi sono stati trovati anche nel floema essudati 3, 13, 14, 23. Jasmoacido nic, un oxylipin muove attraverso il floema come parte della risposta alle infezioni patogeno 22, 29, 31, 32. Mentre il ruolo della maggior parte dei lipidi floema è ancora chiaro, alcuni di loro probabilmente hanno la funzione 4 segnalazione.
La sfida nel lavorare con floema impianto risiede nella sua capacità di sigillare su di sé ferimento. Ci sono quattro metodi principali utilizzati per raccogliere floema essudati, eppure essi funzionano solo in alcune specie:
1) In cucurbitacee è possibile ottenere quantità ragionevole di floema essudato attraverso tagli del picciolo. Una volta che la goccia iniziale con contaminazione delle cellule danneggiate viene rimosso, è possibile avere ragionevolmente grandi quantità di pura floema 1, 15. Tuttavia, con l'aumento del tempo di raccolta, questo essudato addensa, rendendo sempre più inadatto per approcci di cromatografia liquida (non pubblicato). Pubblicazioni recenti suggeriscono, che a seconda della specie, tale floema è derivato da either il fascicolare (FP) o il extrafascicular floema (EP) e che, mentre lo fa contenere "mobile" floema linfa dagli elementi Sieve (FP), è anche incline alla contaminazione da altri tipi di cellule, tra cui lo xilema 40, 41 .
2) Un secondo approccio è quello di ottenere floema linfa attraverso tagli poco profondi o forature a gambo o picciolo. Questo metodo è stato utilizzato con successo in lupino 17, 25, 36 cucurbitacee, e Brassica napus 12. Qui la contaminazione da cellule danneggiate è minimo e il essudati molto puro. Tuttavia, le piante hanno bisogno per essere sani e ben irrigata dal momento che è molto difficile da perforare selettivamente solo gli elementi setaccio. Se vasi dello xilema sono intaccate tutti essudato viene disegnato nel flusso xilema. Ciò rende il metodo adatto per impianti con piccioli o gambi molto fragili o fortemente lignificato.
3) Afide stylectomy afidi permette di inserire il loro stiletto negli elementi setaccio l'n rimuovendo l'afide con un laser. Floema è trasudava attraverso il rimanente mandrino 2, 9, 10, 35, 38. In teoria, ogni pianta che può essere infettata da afidi può essere utilizzato per questo approccio. Tuttavia, la maggior serra o gestori di camera di crescita non supportano l'uso di un agente patogeno. Inoltre, afidi introducono diverse proteine nel floema con la loro saliva 19, 33. Questo porta ad una limitata trascrizionale riprogrammazione 30 e ha il potenziale per cambiare la composizione floema 26.
4) Il metodo descritto qui è l'essudazione EDTA-agevolata del floema. Questo metodo impiega EDTA per impedire tenuta del floema 20. EDTA chela Ca 2 + ioni che altrimenti partecipare ai processi che sigillano il floema. Mentre EDTA può portare a danni delle cellule 30, diversi gruppi hanno usato questo metodo e osservato alcun effetto negativo delle concentrazioni di EDTA da 10 mm a 20 mm sul ultrastruttura cellulare o su phloem di carico e di trasporto 5, 24. Per ridurre qualsiasi effetto dannoso come pure le interferenze di EDTA con cromatografia e elettroforesi su gel, piante vengono spostati in acqua dopo 1 ora e solo la parte successiva del essudato viene utilizzato 14. Così, invece di essudazione in EDTA, floema viene essudata in acqua (essudazione EDTA-agevolata). E 'un metodo straight-forward, a basso costo, e low-tech per la raccolta di floema essudati. Floema così ottenuto può essere utilizzato per analizzare le proteine, piccole molecole, lipidi, e RNA ed è stato usato con successo in molte piante. Mentre una quantità limitata di esperimenti è stata eseguita in monocotiledoni 11, il metodo sembra essere più adatto per dicotiledoni (perilla 17, 20, Arabidopsis 8, 13, 14, pioppo 7). Raccolta di essudati deve avvenire in un ambiente umido per evitare la perdita di essudati attraverso la traspirazione. Seconda della pianta, incubazione in EDTA per una o due ore èsufficiente a prevenire sigillatura degli elementi floema / setaccio. La raccolta può quindi verificarsi in acqua. Questo ha il vantaggio di evitare l'effetto negativo EDTA ha sulla struttura cellulare e stabilità. Inoltre elimina l'interferenza di EDTA con metodi quali HPLC o SDS-PAGE. È mostrato come si applica a Arabidopsis. Per impianti più grandi, l'incubazione in collezioni EDTA e essudato deve essere scalati e viene eseguita in bicchieri piuttosto che in 1,7 ml provette di reazione.
Protocollo
1. Preparazione delle piante
- Semi di Arabidopsis possono essere germinati direttamente sul suolo o su piastre di MS. Far crescere le piante per quattro-sei settimane in camere di crescita con un fotoperiodo di 12 ore (22 ° C il giorno, 15 ° C notte 14). Impianti di acqua una o due volte a settimana. Utilizzare il vassoio inferiore per annaffiare; Non piante di acqua dalla parte superiore, permettono ai cassetti di asciugare prima di ri-irrigazione. Assicurarsi che le piante sono ben idratato al momento della raccolta.
2. Preparazione di soluzioni e piatti
- K-EDTA soluzione 2: Fare un mM K 2-EDTA soluzione madre 100 soluzione, che può essere conservato in frigorifero. Il giorno della raccolta, diluire la soluzione 1-5 (una soluzione di EDTA parte, quattro parti di acqua) per ottenere una soluzione di 20 mM K 2-EDTA.
- Riempire un bicchiere o un piatto di Petri (diametro 7-15 cm) a metà strada con il 20 mm K soluzione 2-EDTA. Se la raccolta di campioni provenienti da diversi trattamenti (per esun controllo ed impianti di sale-stressate o diversi genotipi), preparano piatti separati per ogni trattamento.
- Riempire il numero desiderato di 1,7 ml provette con 1,4 ml di 20 mM K soluzione 2-EDTA. Riempire un pari numero di provette di reazione con 1,4 ml di acqua deionizzata o sterilizzati in autoclave Millipore.
- Mettere gli asciugamani di carta in panchina per impostare piante su; ottenere una nuova lama di rasoio e indossare i guanti.
3. Raccolta di Floema essudati (raffigurato nel diagramma di flusso in Figura 1)
- Rosetta lascia raccolto da quattro a sei settimane di età piante vengono tagliate con la lama di rasoio alla base del picciolo vicino al centro della rosetta.
- Porre immediatamente le foglie nei piatti contenenti 20 mM K 2-EDTA. Assicurarsi che l'estremità del taglio del picciolo è immerso nella soluzione (Figura 2).
- Una volta 15 foglie sono stati raccolti (ca. 3-4 piante), impilare delicatamente foglie sopra l'altro tale tcappello piccioli il taglio siano allineati tra loro. Tagliare nuovamente la base dei piccioli (ca. 1 mm) e trasferire immediatamente le foglie in una delle provette di reazione con la soluzione di 20 mM K 2-EDTA. Le foglie in forma più semplice se sono leggermente arrotolate. Evitare di schiacciare le foglie in quanto ciò potrebbe provocare lesioni delle cellule e, quindi, porta alla raccolta del contenuto delle cellule foglia.
- Se serve più materiale, coprire delicatamente i campioni con un tovagliolo di carta bagnato. Utilizzare un nuovo set di piatti, se per la raccolta di campioni da trattamenti o genotipi diversi.
- Una volta che tutti i campioni sono posizionati in provette di reazione, raccogliere i essudati o al buio o alla luce.
- Per la raccolta nel buio, linea il piano di un grande piatto fondo con tovaglioli di carta bagnati. Inserire la griglia con le provette di reazione foglia riempiti nel piatto e le copertine con i tovaglioli di carta bagnati o messi in un posteriore in plastica nera con feritoie per l'aerazione. Posizionare l'intera impostazione in un armadio o una stanza buia.
- Per la raccolta nella luce, foderare il fondo di un contenitore in plexiglass trasparente con tovaglioli di carta bagnati. Inserire la griglia con le provette di reazione foglia riempiti nel contenitore e chiuderlo.
- Dopo 1 ora, togliere le foglie delicatamente dal recipiente e le provette di reazione e lavare accuratamente con acqua distillata, deionizzata o Millipore per rimuovere tutti EDTA. Questo passaggio serve tre scopi: (1) rimuove l'EDTA al danno minimizzato alle cellule, (2) elimina l'interferenza di EDTA con SDS-PAGE e la cromatografia, e (3) rimuove eventuali residui che si sono accumulati da taglio / danneggiato cellule. Trasferire immediatamente nei tubi di reazione preparati contenenti acqua autoclavato e tornare ai contenitori per la raccolta umidificati per la raccolta di essudati. A questo punto, aggiungere RNasi inibitore se l'essudato deve essere utilizzato per l'estrazione di RNA. Optional: inibitore della proteinasi può essere aggiunto se si desidera l'analisi delle proteine.
- Dopo il tempo di raccolta previsto, tirare fuori e DISCArd le foglie e congelare gli essudati floema a liquido N 2 per un ulteriore uso. Se è necessario lo stoccaggio prolungato, liofilizzare i campioni e conservare a -80 ° C.
- Nel caso di Arabidopsis, metaboliti possono già essere rilevati dopo la raccolta di essudati per 1 ora. Tuttavia, la raccolta per 5-8 ore è consigliabile se è prevista l'analisi di componenti meno abbondanti. Per le piante più grandi come Perilla, sono consigliati tempi di incasso più lunghi (8 ore).
Essudato raccolto da 15 fogli è in genere sufficiente per una corsia su un gel SDS-PAGE (proteine), per l'estrazione di mRNA, GC-MS (zuccheri e metaboliti). Per l'analisi dei lipidi la messa in comune di 2-3 campioni (essudato 30-45 foglie) è raccomandato e porta a risultati più chiari.
4. Analisi successive (per video We Only Mostra 4,4)
- Per l'analisi delle proteine, campione risospendere in 15 microlitri di acqua e 30 microlitri tampone Lämmli, riscaldare a 95 ° C per 5 min, girare rapidamente ogni precipitates e caricare tutto il campione su un gel SDS-PAGE (45 tasche carico microlitri). I campioni devono essere colorati con Coomassie colloidale o altre macchie sensibili in quanto l'abbondanza di proteine è molto basso.
- Per lo zucchero e piccola analisi metabolita, aggiungere agenti derivatizzazione al campione essiccato come descritto in letteratura 14.
- mRNA può essere analizzata mediante RT-PCR, microarray o l'analisi di RNA-Seq.
- Per l'analisi dei lipidi immediatamente piscina 2-3 campioni e divisorie contro cloroformio: metanolo (1:1) nella cappa come segue: aggiungere una pari quantità di cloroformio: metanolo per ogni campione, vortex per qualche secondo, e centrifugare per 4 min a 400 x g. Raccogliere la (bio) di fase inferiore in un tubo di vetro con tappo in teflon e la partizione di ripetere con la fase superiore tre volte. Asciugare le fasi organiche riunite sotto un flusso di N 2, presentando, ad ulteriore analisi (cromatografia su strato sottile: TLC 14, 37; cromatografia-spettrometria di massa liquida: LC-MS 14).
Risultati
E 'diventato chiaro negli ultimi anni che la complessità del floema linfa può essere la risposta alla domanda di come le piante inviano diversi segnali di sviluppo e di stress per una risposta ottimale. Utilizzando EDTA-agevolata floema essudazione può fornire l'opportunità di analizzare essudati floema da piante che non sono adatti per altri approcci, ma possono essere di interesse economico o fisiologico.
Questo metodo consente la raccolta del floema essudati abbastanza per identificare le proteine floema-localizzate e rilevare cambiamenti nel loro livello in risposta a sviluppo o di stress (Figura 3). Come mostra la figura, le proteine sono in abbondanza molto basso, tuttavia, il loro livello è abbastanza alto per i successivi esperimenti di proteomica mediante LC-MS/MS o per l'analisi Western Blot. Conclusioni di cucurbitacee suggeriscono che il taglio dello stelo porta ad una rottura dell'equilibrio potenziale dell'acqua e un successivo afflusso di acqua epossibili contaminanti dalla apoplasto 41. Ancora raccolta per tempi che vanno da uno a otto ore non influenza il profilo floema proteina / composizione in Arabidopsis (. Solo la quantità assoluta varia Guelette et al), la quantità di proteina raccolta e il pattern di proteine trovate varia tra specie (Arabidopsis: A; Perilla, corsia I e NI) e trattamenti (Perilla coltivato a diverse lunghezze giorno, corsia I e NI). In qualità di segnali proteici risultato possono essere visualizzati, identificati e seguiti.
mRNA e micro RNA possono anche essere identificati in floema essudati da questo metodo. Tuttavia, il trattamento con inibitore di RNAsi è necessario per evitare la degradazione del mRNA durante il tempo prolungato essudazione. Poiché gli elementi setaccio non contengono cloroplasti funzionali, Rubisco piccolo o grande subunità (RBC o rbcL, rispettivamente) mRNA possono essere utilizzati come controlli negativi, mentre noto floema-MRNA localizzata enzima ubiquitina-conjugating può essere usato come controllo positivo (Figura 4).
Analogamente, zuccheri o piccoli metaboliti possono essere analizzati utilizzando GC-MS o LC-MS. Qui va detto che le essudati floema contengono un gran numero di enzimi funzionali, comprese quasi tutta via glicolitica 12. Quindi, utilizzando diversi punti di tempo può rivelare processi metabolici durante la raccolta essudato. Un esempio è mostrato in Figura 5: In tutti essudati, saccarosio è il metabolita più, questo è più evidente dopo una raccolta per 1 ora. Tuttavia, dopo cinque ore il saccarosio al rapporto fruttosio è leggermente ridotta. Se lo stesso essudato viene raccolto per un'ora e lasciato in panchina per le quattro ore successive, il saccarosio in fruttosio rapporto viene ridotto in misura molto più grande, suggerendo che gli enzimi attivi nel floema essudati portano ad un degrado di saccarosio a temtemperatura (per ulteriori interpretazioni di picco vedere 14). Ciò è coerente con i risultati che floema carico ed il trasporto di molecole da cellule compagne negli elementi setaccio possono continuare durante essudazione fino a quando il sistema perde la sua vitalità 34.
Lipidi nel essudati floema e, per estensione, la segnalazione di lipidi a lunga distanza sono una abbastanza recente campo di interesse in scienza delle piante. Grazie alla loro natura idrofobica dei lipidi sono presenti solo in basse concentrazioni e può essere collegato con altri molecole per solubilizzazione. Tuttavia, l'essudazione EDTA-facilitato consente la raccolta di materiale sufficiente per visualizzarne (TLC; Figura 6) e identificare (LC-MS; Figura 7) floema lipidi da diverse specie vegetali. Come mostra la figura, è possibile identificare e separare diverse specie lipidiche. LC-MS permette di identificare diverse specie di lipidi e per monitorare i cambiamenti nei profili lipidici di different genotipi o trattamenti. Questo permette lo studio del ruolo dei lipidi durante lo sviluppo della pianta e risposta allo stress.
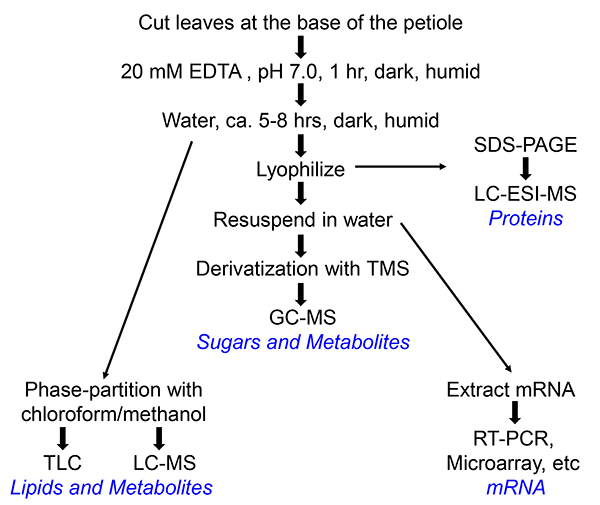
Figura 1. Diagramma di flusso della collezione di floema essudati di Arabidopsis o Perilla. Diversi percorsi portano a prodotti finali diversi, che sono indicati in blu. Per la preparazione di RNA, RNase Inhibitor (100 U / ml, Roche) viene aggiunto l'acqua in cui si raccoglie l'essudato floema.
Clicca qui per vedere l'immagine ingrandita .

Figura 2. Installazione di materiali per floema essudato raccogliereione. La configurazione visualizza tutti i materiali necessari per il protocollo passaggi 3,1-3,4.
Clicca qui per vedere l'immagine ingrandita .
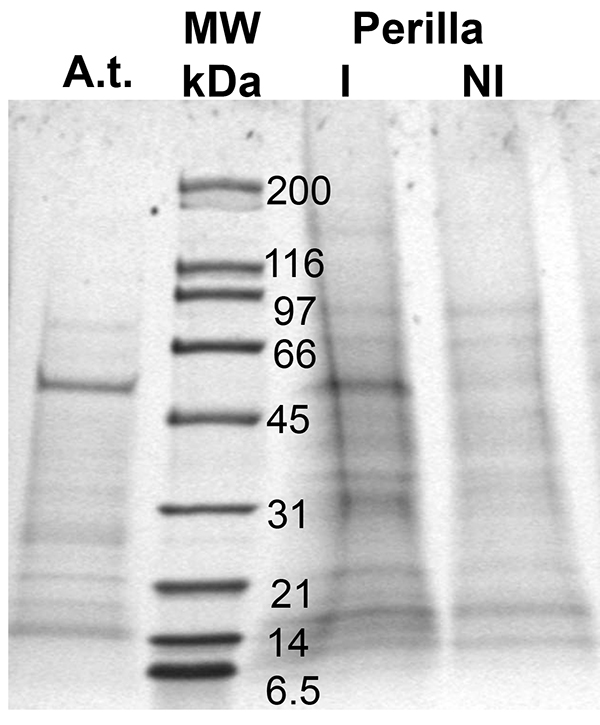
. Figura 3 proteine trovate in floema essudati di due specie diverse di piante, di Arabidopsis (A) e Perilla (I e NI; lunghezze differenti al giorno); MW: marcatore di peso molecolare (corsia 2). Proteine sono state separate usando un gradiente 10-20% SDS-PAGE.
Clicca qui per vedere l'immagine ingrandita .
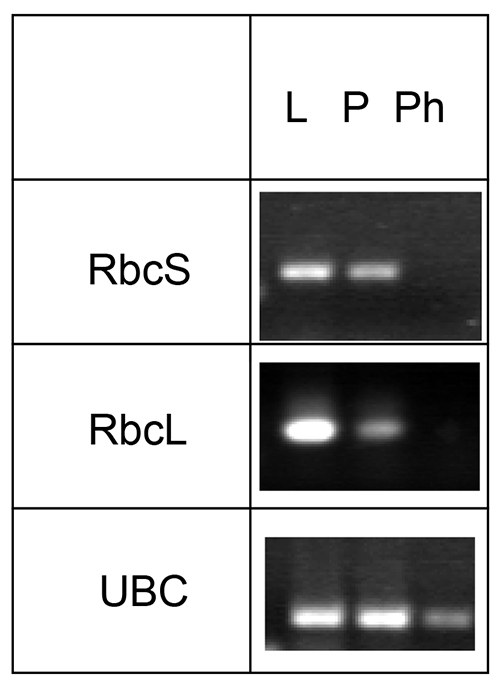
Figura 4. Analisidella presenza di mRNA per Rubisco piccola e grande subunità (RBC e rbcL, rispettivamente) e l'enzima ubiquitina-conjugating (UBC). mRNA è stato raccolto da foglie di Arabidopsis (L), piccioli (P), e floema essudati (Ph), invertire trascrizioni trascritte e specifici visualizzate mediante PCR. Il dato è stato modificato dalla Guelette et al. 14.
Clicca qui per vedere l'immagine ingrandita .
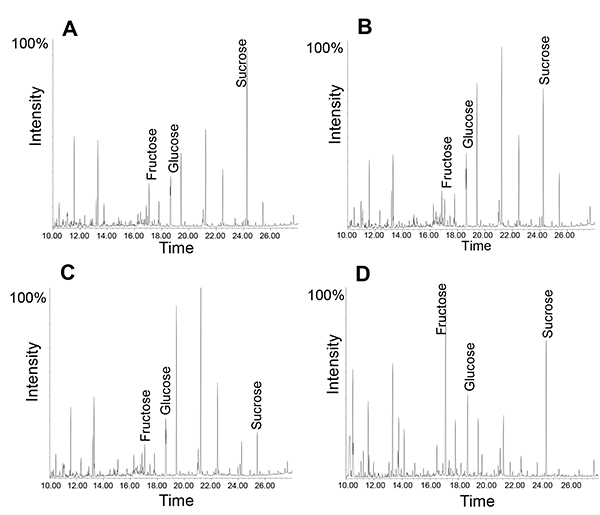
Figura 5. Profilo GC-MS di floema essudati raccolte per diverse quantità di volte. Notare come la quantità relativa di saccarosio cambia da 1 ora di raccolta (A) per 5 ore di tempo di raccolta (B). Essudato profilo dopo la raccolta per 1 ora seguito da "incubazione" in camera temperatura (RT) per quattro ore (C). Foglia profilo dei metaboliti (D).
Clicca qui per vedere l'immagine ingrandita .
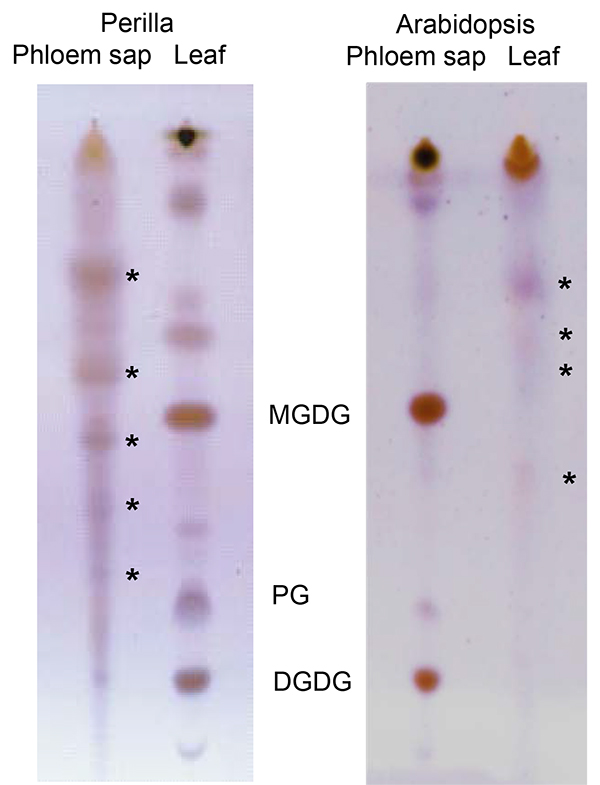
Figura 6. Strato sottile cromatogramma confrontando i lipidi da Perilla (a sinistra) e di Arabidopsis (a destra), foglie ed essudati floema. Gli asterischi indicano i lipidi specifici per floema essudati. DGDG: digalattosildiacilglicerolo; PG: fosfatidilglicerolo; MGDG: monogalactosyldiacyglycerol; La parte della figura visualizzazione lipidi Arabidopsis è stato modificato da Guelette et al 14..
Clicca qui per vedere l'immagine ingrandita .
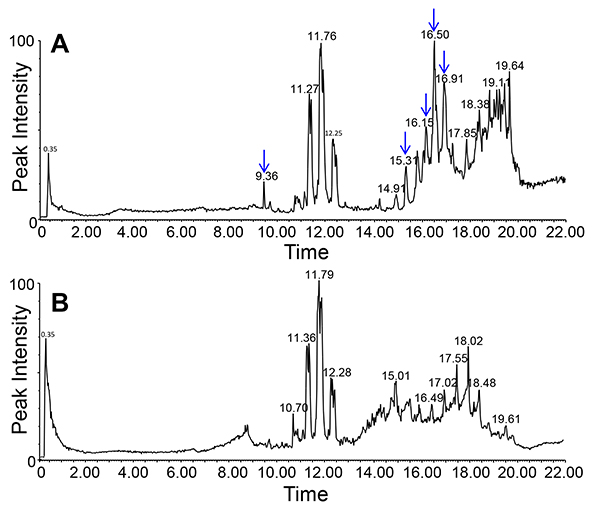
Figura 7. Profilo lipidico del floema essudati di Arabidopsis (fase di cloroformio) utilizzando LC-MS / modalità di ioni negativi. Grafici nella parte superiore (mutante, A) e fondo (wild-type, B) mostrano le differenze nei profili lipidici tra due diversi genotipi (indicati dalle frecce).
Clicca qui per vedere l'immagine ingrandita .
Discussione
La collezione di EDTA-agevolata di floema essudati è molto semplice, ha bisogno di attrezzatura minima, ed è applicabile alla maggior parte delle piante. In generale, questo metodo estende la capacità di analizzare essudati floema da più specie. Benchè l'essudato viene diluito, è facile raccogliere molti campioni differenti o da molte piante a scalare fino ad una grande quantità di materiale. Questo quindi permette l'individuazione di nuovi composti che si trovano in abbondanza molto basso e sarebbero altrimenti trascurati.
Questo metodo può essere utilizzato per più specie vegetali e lavora come descritto per quelli elencati in questo manoscritto. Se nuove specie vengono esplorati, i due aspetti che potrebbero aver bisogno di modifiche sono il numero di fogli utilizzati e il tempo di essudazione. Nella maggior parte dei casi, un cinque a otto ore essudazione dovrebbe essere adatto. Per confermare l'uso di questo metodo per una nuova specie vegetali, essudato devono essere raccolte e una o più delle successive analisi come descritto nella parte 4 del protocollo needs da eseguire. A seconda dell'intensità del segnale osservato, il volume di raccolta può essere necessario scalati. In generale, l'analisi dei lipidi e delle proteine si richiedono più materiale di analisi dello zucchero e del metabolita in quanto i primi sono meno abbondanti nel floema essudati.
Perché la raccolta essudato EDTA-facilitato coinvolge superfici tagliate e anche un effetto potenzialmente dannoso di EDTA, diversi punti devono essere considerati: (1) dopo un ora di incubazione con EDTA, piccioli devono essere lavati accuratamente. Questo rimuove qualsiasi composto ottenuto da cellule feriti nonché l'EDTA stessa, che potrebbe danneggiare le cellule o interferire con l'estrazione. (2) I controlli positivi e negativi devono essere inclusi per garantire che i dati ottenuti sono derivati da floema e non da cellule danneggiate (vedi i punti critici di seguito). (3) Floema linfa contiene numerosi enzimi, che potrebbe essere attivo durante la raccolta di essudato. Quindi, in alcuni casi può essere utile raccogliere for diverse quantità di tempo. (4) Dato che il metodo coinvolto essudazione in acqua, una quantificazione assoluta dei composti non è possibile.
Passaggi critici: la chiave per il successo nell'uso di questo metodo è l'uso di cautela durante la manipolazione del campione per non ferire eventuali cellule così come l'uso di controlli appropriati (vedi rif 14.). Un controllo adeguato è la raccolta di floema essudati senza precedente trattamento con EDTA. In questo caso il floema sigillerà stessa e nessun essudato può essere raccolto. Qualsiasi composto contaminanti provenienti dalle cellule feriti vengono rilevate qui. Un secondo controllo sarebbe l'analisi degli zuccheri nel essudato. In Arabidopsis, saccarosio dovrebbe essere il metabolita predominante all'interno del floema, con fruttosio al saccarosio rapporto di 1:04-01:08 (rif 8, 14).
Per l'estrazione di RNA è necessario l'uso di un inibitore RNAsi. Inoltre, un controllo positivo di precedenza descried mRNA floema-localizzato (UBC9: Ubiquitin enzima conjugating 9, At4g27960, 8, 14) e un controllo negativo di per esempio un mRNA cloroplasto (Rubisco LSU) sono consigliabili.
Poiché l'essudato contiene enzimi attivi, un corso di tempo si consiglia di assicurarsi cambiamenti nel profilo floema non sono semplicemente dovute a variazioni nel tempo di raccolta. In alcuni casi, può essere vantaggioso utilizzare inibitori della proteinasi. Tuttavia, i ricercatori hanno bisogno di tenere a mente, che l'essudato raccolto sarà concentrata e che eventuali composti aggiunti saranno in gran parte concentrati. Un secondo punto critico all'interno del protocollo è il recutting del picciolo con EDTA. Questo passo ha un duplice scopo: in primo luogo, esso rimuove tutti piatti forati sigillati, evitando la formazione di nuove spine permettendo così il libero flusso del floema. Secondo, rimuove la bolla di cavitazione nel xilema generato durante il taglio e quindi permette il trasporto xilema. Le dimensioni del secondo taglio dipendonos sulle piante utilizzate. In impianti con piccioli più grandi dovrebbe essere più millimetri (fino a 1 cm) sopra il primo taglio, in piante come Arabidopsis, 1-2 mm sono sufficienti.
L'uso di questo metodo può portare alla scoperta di nuovi composti in essudati floema che potrebbe avere la segnalazione, implicazioni sviluppo o biomedico. E ha spinto un più sguardo in profondità alle segnalazione di lipidi a lunga distanza, che era un campo poco studiato nella scienza pianta a causa della mancanza di accesso al floema.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Science Foundation concessione NSF-IOS # 1144391 per SHB.
Materiali
| Name | Company | Catalog Number | Comments |
| K2-EDTA | Sigma-Aldrich | ED2P-500G | |
| Shallow Glass or plastic Petri Dish (7-15cm) | PYREX or Corning | Any clean, shallow dish will work | |
| Chloroform | EMD | CX1054-1 | Only open containers in fume hood |
| Methanol | J.T.Baker | 9070-03 | |
| Screw cap tubes | VWR International | 53283-800 | |
| Screw cap tubes | Sun Sri | 13-425 | |
| Eppendorf tubes | Denville | C2170 |
Riferimenti
- Balachandran, S., Xiang, Y., Schobert, C., Thompson, G. A., Lucas, W. J. Phloem sap proteins from Cucurbita maxima and Ricinus communis have the capacity to traffic cell to cell through plasmodesmata. Proc. Natl. Acad. Sci. USA. 94, 14150-14158 (1997).
- Barnes, A., Bale, J., Constantinidou, C., Aston, P., Jones, A., Pritchard, J. Determining protein identity from sieve element sap in Ricinus communis L. by quadrupole time of flight (Q-TOF) mass spectrometry. J. Exp. Bot. 55, 1473-1481 (2004).
- Behmer, S. T., Grebenok, R. J., Douglas, A. E. Plant sterols and host plant suitability for a phloem feeding insect. Functional Ecology. , (2010).
- Benning, U. F., Tamot, B., Guelette, B. S., Hoffmann-Benning, S. New aspects of phloem-mediated long-distance lipid signaling in plants. Front.Plant.Sci. 3, 53> (2012).
- Chen, S., Petersen, B. L., Olsen, C. E., Schulz, A., Halkier, B. A. Long-distance phloem transport of glucosinolates in Arabidopsis. PlantPhysiol. 127, 194-201 (2001).
- Corbesier, L., et al. FT protein movement contributes to long distance signalling in floral induction of Arabidopsis. Science. 316, 1030-1033 (2007).
- Dafoe, N. J., Gowen, B. E., &Constabel, C. P. Thaumatin-like proteins are differentially expressed and localized in phloem tissues of hybrid poplar.BMC. Plant Biology. 10, (2010).
- Deeken, R., Ache, P., Kajahn, I., Klinkenberg, J., Bringmann, G., Hedrich, R. Identification of Arabidopsis thaliana phloem RNAs provides a search criterion for phloem-based transcripts hidden in complex datasets of microarray experiments. The Plant Journal. 55, 746-759 (2008).
- Doering-Saad, C., Newbury, H. J., Bale, J. S., Pritchard, J. Use of aphid stylectomy and RT-PCR for the detection of transporter mRNAs in sieve elements. J. Exp. Bot. 53, 631-637 (2002).
- Fisher, D. B., Wu, Y., Ku, M. S. B. Turnover of soluble-proteins in the wheat sieve tube. Plant Physiol. 100, 1433-1441 (1992).
- Gaupels, F., Buhtz, A., Knauer, T., Deshmukh, S., Waller, F., van Bel, A. J. E., Kogel, K. -. H., Kehr, J. Adaptation of aphid stylectomy for analyses of proteins and mRNAs in barley phloem sap. J Exp Bot. 59, 3297-3306 (2008).
- Giavalisco, P., Kapitza, K., Kolasa, A., Buhtz, A., Kehr, J. Towards the proteome of Brassica napus phloem sap. Proteomics. 6, 896-909 (2006).
- Guelette, B. S., Chamberlin, B., Benning, U. F., Hoffmann-Benning, S., Benning, C., Ohlroggeeds, J. Indications of lipids/lipid signaling in the phloem exudates of Arabidopsis thaliana and Perilla ocymoides. , 92-95 (2007).
- Guelette, B. S., Benning, U. F., Hoffmann-Benning, S. Identification of lipids and lipid-binding proteins in phloem exudates from Arabidopsis thaliana. J. Exp. Bot. 63, 3603-3616 (2012).
- Haebel, S., Kehr, J. Matrix-assisted laser desorption/ionization time of flight mass spectrometry peptide mass fingerprints and post source decay: a tool for the identification and analysis of phloem proteins from Cucurbita maxima Duch. separated by two-dimensional polyacrylamide gel electrophoresis. Planta. 214, 3328 (2001).
- Hayashi, H., Fukuda, A., Suzui, N., Fujimaki, S. Proteins in the sieve element-companion cell complexes: their detection, localization and possible functions. Aust. J. Plant Physiol. 27, 489-496 (2000).
- Hoffmann-Benning, S., Gage, D. A., McIntosh, L., Kende, H., Zeevaart, J. A. D. Comparison of peptides in the phloem sap of flowering and non-flowering Perilla and lupine plants using microbore HPLC followed by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. Planta. , 216-2140 (2002).
- Jorgensen, R. A., Atkinson, R. G., Forster, R. L., Lucas, W. J. An RNA-Based Information Superhighway in Plants. Science. 6, 1486-1487 (1998).
- Kehr, J. Phloem sap proteins: their identities and potential roles in the interaction between plants and phloem-feeding insects. J. Exp. Bot. 57, 767-774 (2006).
- King, R. W., Zeevaart, J. A. Enhancement of phloem exudation from cut petioles by chelating-agents. Plant Physiol. 53, 96-103 (1974).
- Lin, M. -. K., Lee, Y. -. J., Lough, T. J., Phinney, B., Lucas, W. J. Analysis of the pumpkin phloem proteome provides functional insights into angiosperm sieve tube function. Mol. Cell. Proteomics. 8, 343-356 (2009).
- Lough, T. J., Lucas, W. J. Integrative plant biology: role of phloem long-distance macromolecular trafficking. Annu.Rev. Plant Biol. 57, 203-232 (2006).
- Madey, E., Nowack, L. M., Thompson, J. E. Isolation and characterization of lipid in phloem sap of canola. Planta. 214, 625-634 (2002).
- Maeda, H., Song, W., Sage, T. L., DellaPenna, D. Tocopherols playa crucial role in low-temperature adaptation and phloem loading in Arabidopsis. The Plant Cell. 18, 2710-2732 (2006).
- Marentes, E., Grusak, M. A. Mass determination of low-molecular-weight proteins in phloem sap using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. J. Exp. Bot. 49, 903-911 (1998).
- Prado, E., Tjallingii, W. Behavioral evidence for local reduction of aphid-induced resistance. Journal ofInsect Science. 7, 48 (2007).
- Ruiz-Medrano, R., Xoconostle-Cázares, B., Lucas, W. J. Phloem long-distance transport of CmNACP mRNA: implications for supracellular regulation in plants. Development. 126, 4405-4419 (1999).
- Ryabov, E. V., Robinson, D. J., Taliansky, M. E. A plant virus-encoded protein facilitates long-distance movement of heterologous viral RNA. Proc. Natl. Acad. Sci. USA. 96, 1212-1217 (1999).
- Schilmiller, A. L., Howe, G. A. Systemic signaling in the wound response. Curr.Opin. Plant Biol. 8, 369-377 (2005).
- Thompson, G. A., Goggin, F. L. Transcriptomics and functional genomics of plant defence induction by phloem-feeding insects. J. Exp. Bot. 57, 755-766 (2006).
- Thorpe, M. R., Ferrieri, A. P., Herth, M. M., Ferrieri, R. A. (11)C-imaging: methyl jasmonate moves in both phloem and xylem, promotes transport of jasmonate, and of photoassimilate even after proton transport is decoupled. Planta. (11), 226-541 (2007).
- Truman, W., Bennett, M. H., Kubigsteltig, I., Turnbull, C., Grant, M. Arabidopsis systemic immunity uses conserved defense signaling pathways and is mediated by jasmonates. Proc. Natl. Acad. Sci. USA. 104, 1075-1080 (2007).
- van Bel, A. J. E., Knoblauch, M. Sieve element and companion cell: the story of the comatose patient and the hyperactive nurse. Aust. J. Plant Physiol. 27, 477-487 (2000).
- van Bel, A. J. E., Hess, P. H. Hexoses as phloem transport sugars: the end of a dogma. J. Exp. Bot. 59, 261-272 .
- Walz, C., Juenger, M., Schad, M., Kehr, J. Evidence for the presence and activity of a complete antioxidant defence system in mature sieve tubes. Plant J. 31, 189-197 (2002).
- Walz, C., Giavalisco, P., Schad, M., Juenger, M., Klose, J., Kehr, J. Proteomics of curcurbit phloem exudate reveals a network of defence proteins. Phytochemistry. 65, 1795-1804 (2004).
- Wang, Z., Benning, C. Arabidopsis thaliana Polar Glycerolipid Profiling by Thin Layer Chromatography (TLC) Coupled with Gas-Liquid Chromatography (GLC). J. Vis. Exp. (49), e2518 (2011).
- Will, T., van Bel, A. J. E. Physical and chemical interactions between aphids and plants. J. Exp. Bot. 57, 729-737 (2006).
- Yoo, B. C., Kragler, F., Varkonyi-Gasic, E., Haywood, V., Archer-Evans, S., Lee, Y. M., Lough, T. J., Lucas, W. J. A systemic small RNA signaling system in plants. Plant Cell. 16, 1979-2000 (2004).
- Zhang, B., Tolstikov, V., Turnbull, C., Hicks, L. M., Fiehn, O. Divergent metabolome and proteome suggest functional independence of dual phloem transport systems in cucurbits. PNAS USA. 107, 13532-13537 (2010).
- Zhang, C., Yu, X., Ayre, B. G., Turgeon, R. The Origin and Composition of Cucurbit "Phloem" Exudate. Plant Physiology. 158, 1873-1882 (2012).
- Zhang, S., Sun, L., Kragler, F. The Phloem-Delivered RNA Pool Contains Small Noncoding RNAs and Interferes with Translation. Plant Physiol. 150, 378-387 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon