Method Article
Сбор и анализ
В этой статье
Резюме
Знание состава флоэмы SAP, а также механизм ее транспортной нагрузки и междугородной имеет важное значение для понимания дальней сигнализации в развитии завода и стресс / патоген ответ и ассимилировать транспорта. Эта рукопись описывает набор экссудаты флоэмы использованием ЭДТА способствует методом.
Аннотация
Флоэмы растений имеет важное значение для дальней транспортировки (фото-) усваивает, а также сигналов передачи биотических или абиотических стрессов. Он содержит сахара, аминокислоты, белки, РНК, липидов и других метаболитов. В то время как существует большой интерес к пониманию состав и функции флоэмы, роль многих из этих молекул и, таким образом, их значение в развитии растений и стрессовые реакции до сих пор не определен. Одним из препятствий для анализа флоэмы заключается в том, что флоэмы уплотнения себя на ране. В результате, количество растений, из которых флоэмы сок может быть получена ограничено. Один из методов, который позволяет коллекцию экссудата флоэмы из нескольких видов растений без добавления оборудования ЭДТА при содействии флоэмой экссудата коллекции описаны здесь. Хотя это легко в использовании, это и ведет к ранению клетки и уход должны быть приняты, чтобы удалить содержимое поврежденных клеток. Кроме того, несколько элементов управления, чтобы доказать чистоту экссудатанеобходимы. Потому что это экссудата, а не прямого сбора флоэмы SAP (не для многих видов) лишь относительное количественное его содержание может произойти. Преимущество этого метода по сравнению с другими является то, что она может быть использована во многих травянистых или древесных растений (периллы, Arabidopsis, тополь и т.д.) и требует минимального оборудование и обучение. Это приводит к достаточно большого количества экссудатов, которые можно использовать для последующего анализа белков, сахара, липиды, РНК вирусов и метаболитов. Он достаточно прост, что его можно использовать как в исследованиях, а также в учебном лаборатории.
Введение
Растения не могут двигаться, чтобы избежать неблагоприятных условиях. Следовательно, они должны были разработать механизмы выявления экологических стрессов, выявить и передать сигнал связанной по всему растению, а также настроить развития соответственно. Два транспортных систем существуют для распределения воды, питательных веществ и других (сигнализация) соединений. Первый ксилемы; который обычно перевозит воду и минеральные вещества поглощается корнями по всему растению. Второй флоэмы. Ввиду флоэмы изменились по сравнению с простым ассимилировать транспортной системы с трубопроводом для РНК, белки, вирусы, липиды и другие малые молекулы. Она играет важную роль в ассимилировать и перенос питательных веществ, реакция на биотических и абиотических стрессов, а также в росте и развитии растений. Это теперь называется "информационной магистрали" растения 18.
Луб состоит из нескольких типов клеток: паренхимы флоэмы, а также специализированных спутника CELLS и сито элементов. Элемент сита является местом междугородной движения. Для обеспечения беспрепятственного продольного потока, сито элементы отсутствуют наиболее органелл, а также ядер и, как полагают, содержат в лучшем случае ограниченную поступательную машины 21, 33. Считается, что спутник клетки синтезируют белки и другие соединения, которые перемещаются в потоке флоэмы. Эти вещества затем транспортируется в сито элемент через плазмодесмы и может функционировать до тех пор, сигналы расстояние 4,16.
Некоторые группы соединений можно найти в экссудаты флоэмы:
- Сахар часто являются продукты фотосинтеза и транспортируются как "энергонесущей" молекулы к другой части растения для хранения или в качестве строительных блоков. Однако они могут также функционировать в качестве антифриза или в качестве сигнальных соединений.
- Белки также могут быть найдены в экссудата флоэмы. Они включают метаболические ферменты, но также сигнальную функцию. Один exampле белка, который служит в качестве развития сигнал Цветущие локусе Т белок, который сигнализирует индукции цветения, а также сезонные опадение листьев растений. 6
- Нуклеиновые кислоты присутствуют в флоэмы экссудаты в виде мРНК, малых и микро-РНК и вирусных РНК. Они, кажется, в значительной степени участвуют в 27 сигнализацией, 28, 39. В то же время, рРНК и тРНК для почти всех аминокислот были обнаружены в флоэмы сока тыквы 42. Они, кажется, быть выборочно переданы в систему труб сито. ТРНК показывают изменения, необходимые для возможности передачи аминокислот в трансляционной машины. Тем не менее, вместо того, участвующий в переводе, они видимому, ингибируют этот процесс. Альтернативно, они могут служить источником цитокининов или сигнал метаболического состояния установки 42.
- Жирные кислоты, оксилипинов и другие липиды были также обнаружены в флоэмы экссудаты 3, 13, 14, 23. JasmoNIC кислотой, оксилипинового движется через флоэмы как часть ответа на возбудителя инфекции 22, 29, 31, 32. Хотя роль самых липидов флоэмы до сих пор неясно, некоторые из них, вероятно, были сигнальную функцию 4.
Задача в работе с завода флоэмой заключается в его по герметизации себя на ранение. Существуют четыре основных методов, используемых для сбора экссудата флоэмы, но они работают только на некоторых видов:
1) В тыквенных можно получить достаточную количества экссудата флоэмы через разрезы черешок. Как только начальный перепад с загрязнением поврежденных клеток удаляется, можно получить достаточно большое количество чистого флоэмы сок 1, 15. Однако с увеличением времени сбора, это экссудата утолщается, что делает его непригодным для более жидких подходы хроматографии (не опубликовано). Последние публикации предложить, что в зависимости от вида, это флоэмой SAP является производным от eitheR пучковой (FP) или extrafascicular флоэмы (EP) и что, хотя он содержит «мобильной» флоэмой сок из элементов сита (FP), также склонны к загрязнению от других типов клеток, в том числе ксилемой 40, 41 .
2) Второй подход заключается в получении флоэмой SAP через порезы или мелкие проколы в стебель или черешок. Этот метод успешно применяется в 17 люпина, 25, 36 тыквенных и Brassica париз 12. Здесь загрязнение от поврежденных клеток является минимальным и выделения очень чистого. Тем не менее, растения должны быть здоровыми и хорошо поливают так как это очень сложно избирательно прокол только те элементы, сита. Если сосуды ксилемы являются рваные все экссудата всасывается в ксилемы поток. Это делает его малопригодным для растений с очень хрупкие или сильно одревесневшие стебли или черешки.
3) тли тлей stylectomy позволяет вставить их стилет в решето элементовн удалением тли с помощью лазера. Флоэмы сок излучал через остальные зонд 2, 9, 10, 35, 38. В принципе, любое растение, которое может быть заражен тли могут быть использованы для этого подхода. Однако большинство менеджеров теплице или камере роста не будет поддерживать использование патогена. Кроме того, тля ввести несколько белков в флоэмы с их слюне 19, 33. Это приводит к ограниченному транскрипционные перепрограммирования 30 и имеет потенциал, чтобы изменить состав флоэмы 26.
4) метод, описанный здесь является ЭДТА при содействии экссудации флоэмы SAP. Этот метод использует ЭДТА для предотвращения уплотнения флоэмы 20. Хелатов ЭДТА ионов Са 2 +, которые могли бы участвовать в процессах, которые запечатывают флоэмы. В то время как ЭДТА может привести к повреждению клеток 30, несколько групп использовали этот метод и не наблюдалось негативного влияния концентрации ЭДТА от 10 мм до 20 мм ультраструктуры клеток или на phloeм погрузки и транспортировки 5, 24. Для уменьшения вредного воздействия, а также помехи ЭДТА с хроматографию и гель-электрофорез, растения перемещаются в воде после 1 ч и только поздней части экссудата используется 14. Таким образом, вместо экссудата в ЭДТА, флоэме имеет exudated в воду (ЭДТА способствует экссудации). Это прямо вперед, низкой стоимостью и низкой технологий метод для сбора выделений флоэмы. Флоэмы сок полученный таким образом, может быть использована для анализа белков, малые молекулы, липиды и РНК, и была успешно использована во многих растениях. В то время как ограниченное количество экспериментов была выполнена в однодольных 11, метод оказывается более подходящим для двудольных (17 периллы, 20, Arabidopsis, 8, 13, 14, тополь 7). Коллекция экссудаты должно произойти во влажной среде, чтобы избежать потери экссудаты через испарение. В зависимости от растения, инкубации в ЭДТА от одного до двух часовдостаточным для предотвращения уплотнения флоэмы / сито элементов. Коллекция может произойти в воду. Это имеет то преимущество, предотвращая негативное воздействие ЭДТА имеет на клеточной структуры и стабильности. Это также исключает помехи ЭДТА с методов, таких как ВЭЖХ или SDS-PAGE. Показано, как он относится к Arabidopsis. Для более крупных растений, инкубации в ЭДТА и экссудата коллекции должна быть сокращена и выполняется в стаканы, а не в 1,7 мл пробирок.
протокол
1. Подготовка растений
- Arabidopsis семена можно проросшие непосредственно на почву или на MS пластин. Выращивать растения в течение четырех-шести недель роста в камерах с 12-часовой световой (22 ° С днем, +15 ° C ночью 14). Водные растения один-два раза в неделю. Используйте нижний лоток для полива; не поливайте растения сверху; позволить лотки высохнуть перед повторным поливом. Убедитесь, что растения хорошо увлажненной во время сбора урожая.
2. Приготовление растворов и посуды
- К 2-ЭДТА Решение: Сделайте 100 мМ K 2-ЭДТА маточного раствора, который можно хранить в холодильнике. В день сбора, разбавленный раствор 4:59 (одна часть раствора ЭДТУ, четыре части воды), чтобы получить 20 мМ K 2-ЭДТА.
- Наполните стакан или чашку Петри (диаметром 7-15 см) наполовину с 20 мМ K 2-ЭДТА. Если сбор образцов от различных методов лечения (напр.достаточный контроль и соль напряженных растений или различных генотипов), подготовить отдельные блюда для каждой процедуры.
- Заполните желаемое количество 1,7 мл пробирок с 1,4 мл 20 мМ K 2-ЭДТА. Заполните равного числа реакционных труб с 1,4 мл автоклаве или Millipore деионизированной воды.
- Положить бумажные полотенца на скамейке, чтобы установить растений на, получить одну новую лезвия бритвы и надеть перчатки.
3. Коллекция Флоэма Экссудат (Изображенные на блок-схемы на рисунке 1)
- Урожай Листья розетки с 5:56 недельных растений, сокращая их с лезвием у основания черешка близко к центре розетки.
- Сразу же месте листья в блюдах, содержащих 20 мМ K 2-ЭДТА. Убедитесь, что срез черенка листа погружена в раствор (рис. 2).
- После 15 листов были собраны (около 3:57 растений), аккуратно складывать лист на верхней части друг с другом так тшапка разреза черешки совмещены друг с другом. Recut основанию черешка (около 1 мм) и немедленно передать листья в одной из реакционных труб 20 мМ K 2-ЭДТА. Листья подходят проще, если они слегка закатаны. Не следует помещать в листьях, так как это может вызвать повреждение клеток и, таким образом, приводит к сбору лист содержание клетки.
- Если больше материала необходимо, мягко покрытия образцы с мокрым бумажным полотенцем. Используйте новый набор посуды, если для сбора образцов из различных обработок или генотипами.
- После того как все образцы расположены в реакционных труб, собирать экссудатов либо в темноте или на свету.
- Для сбора в темноте, линии этаже большой неглубокой посуде с влажными бумажными полотенцами. Поместите штатив с листом заполненные реакционных труб в блюдо крышкой и либо мокрые бумажные полотенца или положите в черной задней пластика с прорезями для аэрации. Поместите всей установки в шкаф или темной комнате.
- Для коллекции в свет, Линия нижней части контейнера ясно плексигласа с влажными полотенцами бумаги. Поместите штатив с листом заполненные реакционных труб в контейнере и закройте его.
- Через 1 ч осторожно удалить выходит из контейнера и реакционных труб и тщательно промывают дистиллированной деионизированной или Millipore водой для удаления ЭДТА. Этот этап служит трем целям: (1) он удаляет ЭДТА до минимуму повреждение клеток, (2) он исключает помехи ЭДТА с ДСН-ПААГ и хроматографию и (3) удаляет любые соединения, которые накопились от порезов / повреждения клетках. Немедленно передать в подготовленные пробирки реакционной смеси, содержащей автоклавного воды и вернуться к увлажненным сборники для сбора экссудата. На данный момент, добавления ингибитора РНКазы, если экссудат должна быть использована для выделения РНК. Дополнительно: ингибитор протеиназы могут быть добавлены, если анализ белка желательно.
- После предполагаемого времени сбора, вытащить и DISCAй листья и заморозить флоэмой экссудата в жидком N 2 для дальнейшего использования. При длительном хранении необходимо, лиофилизации образцы и хранят при -80 ° С.
- В случае Arabidopsis, метаболиты можно обнаружить уже после сбора выделений в течение 1 часа. Тем не менее, сбор за 5-8 часа целесообразно, если анализ менее обильными компонентов планируется. Для более крупных растений, как Перилла, большой коллекцией раз (8 ч) рекомендуется.
Экссудат собраны из 15 листов, как правило, достаточно для одной полосы на ДСН-ПААГ-геле (белки), для экстракции мРНК, ГХ-МС (сахаров и метаболитов). Для анализа липидных объединение 2-3 образцов (экссудата 30-45 листьев) рекомендуется и приводит к четкой результаты.
4. Последующий анализ (для видео мы показываем только 4.4)
- Для анализа белков, ресуспендируют образца в 15 мкл воды и 30 мкл буфера Lämmli, нагревают до 95 ° С в течение 5 мин, быстро спин вниз любой рrecipitates и загрузить весь образец на SDS-PAGE гель (45 мкл карманы нагрузки). Образцы должны быть окрашивали кумасси Коллоидный или другие чувствительные пятна с белком изобилие очень низка.
- Для сахара и небольшого анализа метаболитов, добавьте дериватизации агентов высушенного образца, как описано в литературе 14.
- мРНК может быть проанализированы с помощью ОТ-ПЦР, микрочипов, или РНК-Seq анализа.
- Для липидного анализа немедленно бассейна 2:58 образцов и раздел против хлороформ: метанол (1:1) в вытяжном шкафу следующим образом: добавляют равное количество Хлороформ: Метанол к каждому образцу, вихревые на несколько секунд, и центрифуги в течение 4 мин при 400 × г. Соберите нижнюю (органической) фазы в стеклянной трубке с тефлоновой крышкой и повторите раздел с верхней фазы еще три раза. Сушат объединенные органические фазы в потоке N 2 и представить дальнейший анализ (тонкослойной хроматографии: 14 TLC, 37, жидких хромато-масс-спектрометрии: LMS C-14).
Результаты
Стало ясно, в течение последних нескольких лет, что сложность флоэме SAP может быть ответом на вопрос о том, как растения отправить различной развития и стрессовых сигналов для оптимального ответа. Использование ЭДТА способствует флоэмы экссудат может обеспечить возможность проанализировать флоэмы вытяжки из растений, которые не подходят для других подходов, но может быть экономической или физиологический интерес.
Этот метод позволяет для урожая достаточно флоэмой экссудатам определить флоэмой локализованных белков и выявления изменений в их уровне в ответ на развитие или стресса (рис. 3). Как видно из рисунка, белки находятся в очень низкой численности, тем не менее, их уровень достаточно высок для последующих экспериментов протеомики использованием LC-MS/MS или Вестерн-блоттинга. Результаты в тыквенных предположить, что режущие стебля приводит к нарушению баланса потенциал воды и последующего притока воды ивозможных загрязнений от апопласт 41. Тем не менее, коллекция в течение от 7:59 часов не влияет на профиль флоэмой белка / композиции в Arabidopsis (. Только абсолютная сумма варьируется Guelette и др.), количество белка, собирали и структура белка зависит от вида (Arabidopsis: На; Перилла, Lane я и NI) и лечения (периллы, выращенных при различных длинах день, и Lane Я NI). В результате белковые сигналы могут быть визуализированы, определены, и соблюдены.
мРНК и микро-РНК также может быть идентифицировано в экссудата флоэмой этим методом. Однако обработка ингибитор РНКазы необходимо предотвратить деградацию мРНК в течение длительного времени экссудации. Поскольку сито элементы не содержат функциональных хлоропласты, Рубиско малой или большой субъединицы (эритроцитов или RbCl соответственно) мРНК может быть использован в качестве отрицательного контроля, в то время как известно флоэмыЛокализованных мРНК как убиквитин-сопрягающего фермент может быть использован в качестве положительного контроля (рис. 4).
Кроме того, сахар или небольшой метаболиты могут быть проанализированы с использованием либо ГХ-МС или ЖХ-МС. Здесь следует отметить, что флоэмы экссудаты содержат большое количество функциональных ферментов, в том числе практически весь гликолитического пути 12. Отсюда, используя разные моменты времени может выявить метаболические процессы в течение экссудата коллекции. Пример показан на рисунке 5: Во всех выделений, сахароза является наиболее распространенным метаболит, это наиболее очевидным после того, как сбор течение 1 часа. Однако после пяти часов сахарозы в соотношении фруктоза немного уменьшается. Если же экссудат собранных в течение одного часа и оставили на скамье в течение следующих четырех часов, сахароза во фруктозу соотношение уменьшается в гораздо большей степени, предполагая, что активные ферменты в флоэмы выделений приводит к деградации сахарозы при комнатной температуретемпературы (более интерпретаций пика см. 14). Это согласуется с выводами, что луб погрузке и транспортировке молекул из клетки компаньона в решето элементы могут продолжаться в течение экссудата, пока система не теряет свою жизненную силу 34.
Липидов в экссудата флоэмы и, как следствие, междугородной сигнализации липидные сравнительно недавно Область интересов завода в науке. Благодаря своей гидрофобной природы липиды присутствуют только в низких концентрациях и могут быть связаны с другими молекулами, для солюбилизации. Тем не менее, ЭДТА способствует экссудации позволяет для сбора достаточного количества материала для визуализации (ТСХ; рис. 6) и определения (ЖХ-МС; рис. 7) флоэмы липидов из нескольких видов растений. Как видно из рисунка, можно идентифицировать и отделить несколько видов липидов. ЖХ-МС позволяет идентифицировать различные виды липидов и следить за изменениями внутри липидный профиль DiffereNT генотипов или лечения. Это дает возможность для изучения роли липидов в процессе развития растений и стресс.
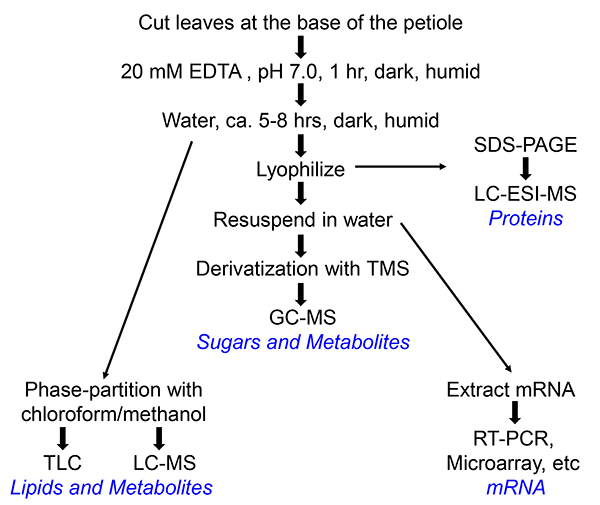
Рисунок 1. Блок-схема сбора выделений флоэмы Arabidopsis или периллы. Разные пути ведут к различным конечных продуктов, которые выделены синим цветом. Для приготовления РНК, ингибитор РНКазы (100 Ед / мл, Roche) добавляли к воде, в которую экссудата флоэмы собраны.
Кликните здесь, чтобы посмотреть увеличенное изображение .

Рисунок 2. Настройка материалов для сбора экссудата флоэмыиона. Настройки отображаются все материалы, необходимые для протоколов шаги 3.1-3.4.
Кликните здесь, чтобы посмотреть увеличенное изображение .
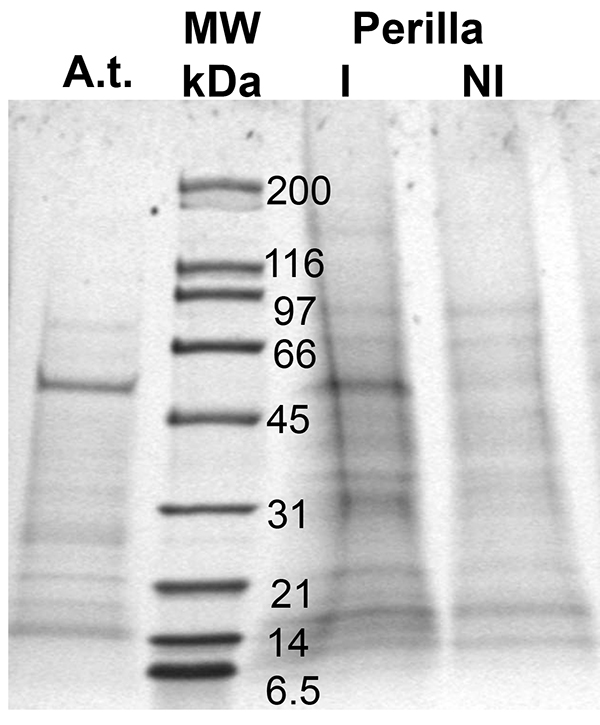
. Рисунок 3 белков, обнаруженных в флоэмы выделений из двух различных видов растений, Arabidopsis (At) и периллы (I и Н.И., различной длины день); МВт: маркер молекулярной массы (дорожка 2). Белки разделяли, используя градиент 10-20% ДСН-ПААГ.
Кликните здесь, чтобы посмотреть увеличенное изображение .
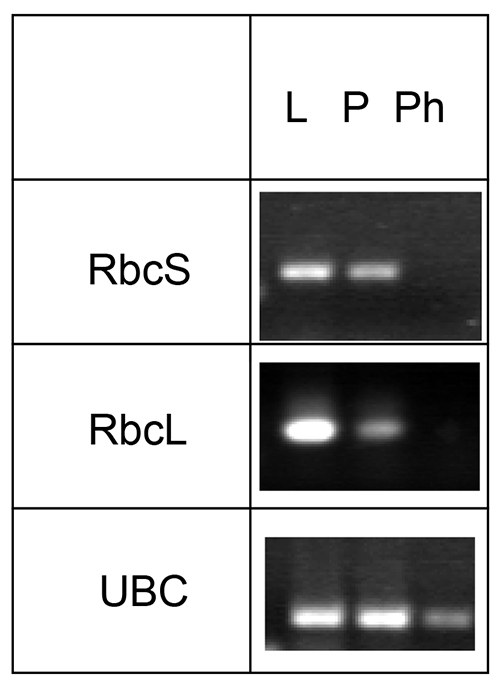
Рисунок 4. Анализприсутствие мРНК Рубиско малой и большой субъединиц (эритроцитов и RbCl, соответственно) и убиквитин-сопрягающего фермента (UBC). мРНК была получена из листьев Arabidopsis (L), черешков (Р), и флоэмы экссудата (Ph), обратной транскрипции и конкретные транскриптов визуализировали с использованием ПЦР. Эта цифра была редактировался Guelette соавт. 14.
Кликните здесь, чтобы посмотреть увеличенное изображение .
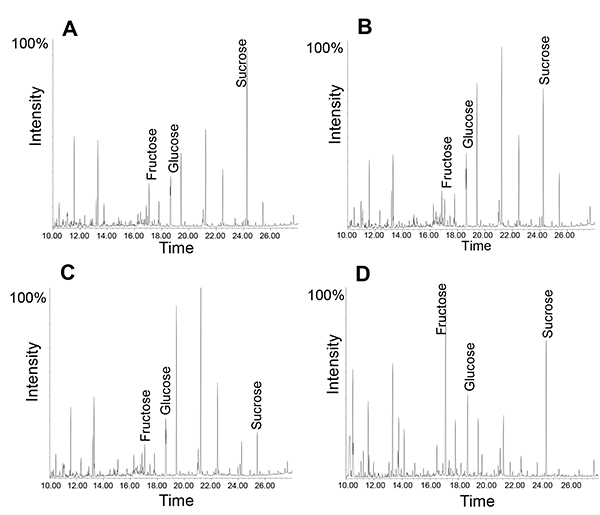
Рисунок 5. ГХ-МС профиля флоэмой экссудатами собрали для различных количество раз. Обратите внимание, что относительное количество сахарозы изменяется от 1 часа коллекции (А) до 5 часов времени сбора (B). Профиль экссудата после сбора в течение 1 часа, затем "инкубации" при комнатной температуре (КТ) в течение четырех часов (С). Лист метаболит профиль (D).
Кликните здесь, чтобы посмотреть увеличенное изображение .
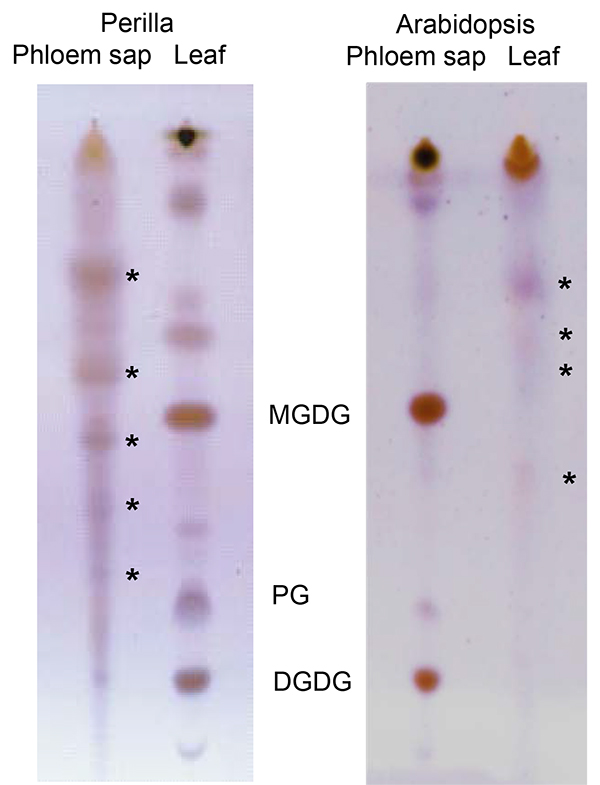
Рисунок 6. Тонкослойная хроматограмма сравнения липидов из периллы (слева) и Arabidopsis (справа) листья и флоэмы экссудата. Звездочки указывают конкретные липидов экссудатов флоэмы. DGDG: дигалактозилдиацилглицерин; PG: фосфатидилглицерин; МГДГ: monogalactosyldiacyglycerol; часть рисунка отображения Arabidopsis липидов была изменена с Guelette и др. 14..
Кликните здесь, чтобы посмотреть увеличенное изображение .
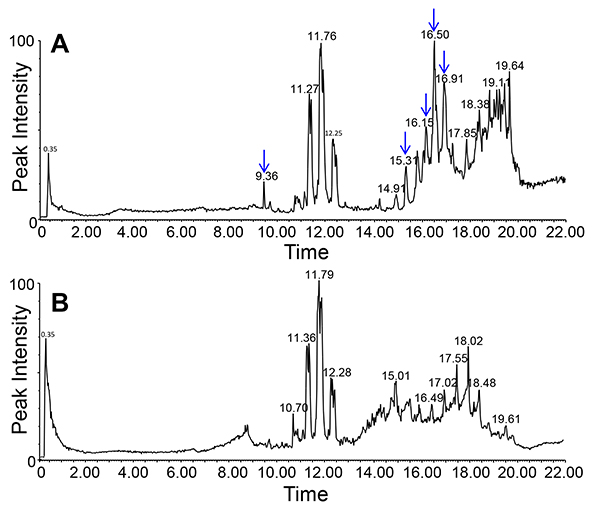
На рисунке 7. Липидный профиль экссудатов флоэмы Arabidopsis (хлороформ фаза) с помощью ЖХ-МС / отрицательный ион режиме. Графики в верхней части (мутант) и нижней (дикий тип, В) показаны различия в липидный профиль двух различных генотипов (указано стрелками).
Кликните здесь, чтобы посмотреть увеличенное изображение .
Обсуждение
ЭДТА при содействии коллекция флоэмой экссудата очень прост, требует минимального оборудования и подходит для большинства растений. В целом, этот метод расширяет возможности для анализа флоэмой экссудата из более видов. Хотя экссудата разбавляют, легко собрать много различных образцов или из многих растений масштабирования до большого количества материала. Затем это позволяет для обнаружения новых соединений, которые находятся в очень низкой численности и могли бы быть пропущены.
Этот метод может быть использован для нескольких видов растений и работает, как описано для перечисленных в этой рукописи. Если новые виды изучены, два аспекта, которые, возможно, потребуется модификация являются количество используемых листьев и время экссудации. В большинстве случаев 7:55 час экссудации должны быть пригодными. Чтобы подтвердить использование этого метода для новых видов растений, экссудат должна быть собрана и один или более из последующего анализа, как описано в протокольной части 4 нГКПЗ должна быть выполнена. В зависимости от интенсивности сигнала наблюдалось, сбор объема возможно, должны быть расширены. В общем, липидного и белкового анализа потребуется больше материала, чем сахар и анализ метаболитов с бывшим менее распространены в экссудата флоэмы.
Поскольку ЭДТА при содействии экссудата коллекция включает сократить поверхностей, а также потенциально повреждающее действие ЭДТА, несколько точек должны быть рассмотрены: (1) после одного часа инкубации с ЭДТА, черешки должны быть тщательно вымыты. Это устраняет любые соединения, полученные из раненых клеток, а также ЭДТА себе, что может привести к повреждению клеток или помешать экстракции. (2) Положительные и отрицательные контрольные должны быть включены для обеспечения полученные данные, полученные из флоэмы SAP, а не от поврежденных клеток (см. критические шаги ниже). (3) Флоэма SAP не исключает ряда ферментов, которые могли бы быть активными во время экссудата коллекции. Таким образом, в некоторых случаях может быть полезно для сбора лR разное количество времени. (4) Так как способ включал экссудации в воду, абсолютный количественный соединений невозможно.
Критические шаги: Ключ к успешному применению этого метода является использование осторожность при обращении с образцом, чтобы не травмировать любые клетки, а также использование соответствующего контроля (см. 14.). Один подходящий управления сбором экссудаты флоэмы без предварительной обработки с ЭДТА. В этом случае флоэмой будет печать себе и не экссудата не могут быть собраны. Любые загрязнения соединениями Исходя из раненых клетки будут обнаружены здесь. Второй элемент управления будет анализ сахара в экссудата. В Arabidopsis, сахароза должна быть преобладающей метаболита в флоэмы SAP, с фруктозу сахарозу соотношении от 1:4 до 1:08 (8 Ref, 14).
Для выделения РНК применение ингибитора РНКазы является необходимым. Кроме того, положительный контроль ранее описывающиеЭд флоэмой локализованных мРНК (UBC9: Убиквитин Сопрягающее фермента 9, At4g27960, 8, 14) и отрицательный контроль например хлоропластов мРНК (Rubisco ЛГУ) целесообразны.
Поскольку экссудат содержит активные ферменты, время конечно рекомендуется убедиться, что изменения в профиле флоэмы не просто из-за изменения времени сбора. В некоторых случаях может быть полезно использовать ингибиторы протеиназы. Тем не менее, исследователи должны иметь в виду, что собранные экссудата будут сосредоточены и добавил, что любые соединения будут в основном сосредоточены. Второй важный шаг в протокол перекройки черешка под ЭДТА. Этот шаг служит двойной цели: во-первых, он удаляет имеющиеся закрытые сетчатыми тарелками, предотвращая образование новых свечах что позволяет обеспечить свободный поток флоэме SAP. Во-вторых, он удаляет пузырька в ксилемы генерируется во время резки и таким образом позволяет ксилемы транспорта. Размер второго разреза зависитс на растениях, используемых. В установках с большим черешки она должна быть на несколько миллиметров (до 1 см) выше первого разреза, в растениях Arabidopsis как, 1-2 мм достаточно.
Использование этого метода может привести к открытию новых соединений в флоэмы экссудата, которые могли бы сигнализацию, развитием или биомедицинские последствия. , Послужила толчком к более глубокий взгляд на междугородние липидов сигнализации, который был малоизученной области в рамках науки о растениях в связи с отсутствием доступа к луб.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Эта работа выполнена при поддержке Национального научного фонда NSF-IOS грант № 1144391 в ШБ.
Материалы
| Name | Company | Catalog Number | Comments |
| K2-EDTA | Sigma-Aldrich | ED2P-500G | |
| Shallow Glass or plastic Petri Dish (7-15cm) | PYREX or Corning | Any clean, shallow dish will work | |
| Chloroform | EMD | CX1054-1 | Only open containers in fume hood |
| Methanol | J.T.Baker | 9070-03 | |
| Screw cap tubes | VWR International | 53283-800 | |
| Screw cap tubes | Sun Sri | 13-425 | |
| Eppendorf tubes | Denville | C2170 |
Ссылки
- Balachandran, S., Xiang, Y., Schobert, C., Thompson, G. A., Lucas, W. J. Phloem sap proteins from Cucurbita maxima and Ricinus communis have the capacity to traffic cell to cell through plasmodesmata. Proc. Natl. Acad. Sci. USA. 94, 14150-14158 (1997).
- Barnes, A., Bale, J., Constantinidou, C., Aston, P., Jones, A., Pritchard, J. Determining protein identity from sieve element sap in Ricinus communis L. by quadrupole time of flight (Q-TOF) mass spectrometry. J. Exp. Bot. 55, 1473-1481 (2004).
- Behmer, S. T., Grebenok, R. J., Douglas, A. E. Plant sterols and host plant suitability for a phloem feeding insect. Functional Ecology. , (2010).
- Benning, U. F., Tamot, B., Guelette, B. S., Hoffmann-Benning, S. New aspects of phloem-mediated long-distance lipid signaling in plants. Front.Plant.Sci. 3, 53> (2012).
- Chen, S., Petersen, B. L., Olsen, C. E., Schulz, A., Halkier, B. A. Long-distance phloem transport of glucosinolates in Arabidopsis. PlantPhysiol. 127, 194-201 (2001).
- Corbesier, L., et al. FT protein movement contributes to long distance signalling in floral induction of Arabidopsis. Science. 316, 1030-1033 (2007).
- Dafoe, N. J., Gowen, B. E., &Constabel, C. P. Thaumatin-like proteins are differentially expressed and localized in phloem tissues of hybrid poplar.BMC. Plant Biology. 10, (2010).
- Deeken, R., Ache, P., Kajahn, I., Klinkenberg, J., Bringmann, G., Hedrich, R. Identification of Arabidopsis thaliana phloem RNAs provides a search criterion for phloem-based transcripts hidden in complex datasets of microarray experiments. The Plant Journal. 55, 746-759 (2008).
- Doering-Saad, C., Newbury, H. J., Bale, J. S., Pritchard, J. Use of aphid stylectomy and RT-PCR for the detection of transporter mRNAs in sieve elements. J. Exp. Bot. 53, 631-637 (2002).
- Fisher, D. B., Wu, Y., Ku, M. S. B. Turnover of soluble-proteins in the wheat sieve tube. Plant Physiol. 100, 1433-1441 (1992).
- Gaupels, F., Buhtz, A., Knauer, T., Deshmukh, S., Waller, F., van Bel, A. J. E., Kogel, K. -. H., Kehr, J. Adaptation of aphid stylectomy for analyses of proteins and mRNAs in barley phloem sap. J Exp Bot. 59, 3297-3306 (2008).
- Giavalisco, P., Kapitza, K., Kolasa, A., Buhtz, A., Kehr, J. Towards the proteome of Brassica napus phloem sap. Proteomics. 6, 896-909 (2006).
- Guelette, B. S., Chamberlin, B., Benning, U. F., Hoffmann-Benning, S., Benning, C., Ohlroggeeds, J. Indications of lipids/lipid signaling in the phloem exudates of Arabidopsis thaliana and Perilla ocymoides. , 92-95 (2007).
- Guelette, B. S., Benning, U. F., Hoffmann-Benning, S. Identification of lipids and lipid-binding proteins in phloem exudates from Arabidopsis thaliana. J. Exp. Bot. 63, 3603-3616 (2012).
- Haebel, S., Kehr, J. Matrix-assisted laser desorption/ionization time of flight mass spectrometry peptide mass fingerprints and post source decay: a tool for the identification and analysis of phloem proteins from Cucurbita maxima Duch. separated by two-dimensional polyacrylamide gel electrophoresis. Planta. 214, 3328 (2001).
- Hayashi, H., Fukuda, A., Suzui, N., Fujimaki, S. Proteins in the sieve element-companion cell complexes: their detection, localization and possible functions. Aust. J. Plant Physiol. 27, 489-496 (2000).
- Hoffmann-Benning, S., Gage, D. A., McIntosh, L., Kende, H., Zeevaart, J. A. D. Comparison of peptides in the phloem sap of flowering and non-flowering Perilla and lupine plants using microbore HPLC followed by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. Planta. , 216-2140 (2002).
- Jorgensen, R. A., Atkinson, R. G., Forster, R. L., Lucas, W. J. An RNA-Based Information Superhighway in Plants. Science. 6, 1486-1487 (1998).
- Kehr, J. Phloem sap proteins: their identities and potential roles in the interaction between plants and phloem-feeding insects. J. Exp. Bot. 57, 767-774 (2006).
- King, R. W., Zeevaart, J. A. Enhancement of phloem exudation from cut petioles by chelating-agents. Plant Physiol. 53, 96-103 (1974).
- Lin, M. -. K., Lee, Y. -. J., Lough, T. J., Phinney, B., Lucas, W. J. Analysis of the pumpkin phloem proteome provides functional insights into angiosperm sieve tube function. Mol. Cell. Proteomics. 8, 343-356 (2009).
- Lough, T. J., Lucas, W. J. Integrative plant biology: role of phloem long-distance macromolecular trafficking. Annu.Rev. Plant Biol. 57, 203-232 (2006).
- Madey, E., Nowack, L. M., Thompson, J. E. Isolation and characterization of lipid in phloem sap of canola. Planta. 214, 625-634 (2002).
- Maeda, H., Song, W., Sage, T. L., DellaPenna, D. Tocopherols playa crucial role in low-temperature adaptation and phloem loading in Arabidopsis. The Plant Cell. 18, 2710-2732 (2006).
- Marentes, E., Grusak, M. A. Mass determination of low-molecular-weight proteins in phloem sap using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. J. Exp. Bot. 49, 903-911 (1998).
- Prado, E., Tjallingii, W. Behavioral evidence for local reduction of aphid-induced resistance. Journal ofInsect Science. 7, 48 (2007).
- Ruiz-Medrano, R., Xoconostle-Cázares, B., Lucas, W. J. Phloem long-distance transport of CmNACP mRNA: implications for supracellular regulation in plants. Development. 126, 4405-4419 (1999).
- Ryabov, E. V., Robinson, D. J., Taliansky, M. E. A plant virus-encoded protein facilitates long-distance movement of heterologous viral RNA. Proc. Natl. Acad. Sci. USA. 96, 1212-1217 (1999).
- Schilmiller, A. L., Howe, G. A. Systemic signaling in the wound response. Curr.Opin. Plant Biol. 8, 369-377 (2005).
- Thompson, G. A., Goggin, F. L. Transcriptomics and functional genomics of plant defence induction by phloem-feeding insects. J. Exp. Bot. 57, 755-766 (2006).
- Thorpe, M. R., Ferrieri, A. P., Herth, M. M., Ferrieri, R. A. (11)C-imaging: methyl jasmonate moves in both phloem and xylem, promotes transport of jasmonate, and of photoassimilate even after proton transport is decoupled. Planta. (11), 226-541 (2007).
- Truman, W., Bennett, M. H., Kubigsteltig, I., Turnbull, C., Grant, M. Arabidopsis systemic immunity uses conserved defense signaling pathways and is mediated by jasmonates. Proc. Natl. Acad. Sci. USA. 104, 1075-1080 (2007).
- van Bel, A. J. E., Knoblauch, M. Sieve element and companion cell: the story of the comatose patient and the hyperactive nurse. Aust. J. Plant Physiol. 27, 477-487 (2000).
- van Bel, A. J. E., Hess, P. H. Hexoses as phloem transport sugars: the end of a dogma. J. Exp. Bot. 59, 261-272 .
- Walz, C., Juenger, M., Schad, M., Kehr, J. Evidence for the presence and activity of a complete antioxidant defence system in mature sieve tubes. Plant J. 31, 189-197 (2002).
- Walz, C., Giavalisco, P., Schad, M., Juenger, M., Klose, J., Kehr, J. Proteomics of curcurbit phloem exudate reveals a network of defence proteins. Phytochemistry. 65, 1795-1804 (2004).
- Wang, Z., Benning, C. Arabidopsis thaliana Polar Glycerolipid Profiling by Thin Layer Chromatography (TLC) Coupled with Gas-Liquid Chromatography (GLC). J. Vis. Exp. (49), e2518 (2011).
- Will, T., van Bel, A. J. E. Physical and chemical interactions between aphids and plants. J. Exp. Bot. 57, 729-737 (2006).
- Yoo, B. C., Kragler, F., Varkonyi-Gasic, E., Haywood, V., Archer-Evans, S., Lee, Y. M., Lough, T. J., Lucas, W. J. A systemic small RNA signaling system in plants. Plant Cell. 16, 1979-2000 (2004).
- Zhang, B., Tolstikov, V., Turnbull, C., Hicks, L. M., Fiehn, O. Divergent metabolome and proteome suggest functional independence of dual phloem transport systems in cucurbits. PNAS USA. 107, 13532-13537 (2010).
- Zhang, C., Yu, X., Ayre, B. G., Turgeon, R. The Origin and Composition of Cucurbit "Phloem" Exudate. Plant Physiology. 158, 1873-1882 (2012).
- Zhang, S., Sun, L., Kragler, F. The Phloem-Delivered RNA Pool Contains Small Noncoding RNAs and Interferes with Translation. Plant Physiol. 150, 378-387 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены