Method Article
Screening rapido di HIV trascrittasi inversa e inibitori dell'integrasi
In questo articolo
Riepilogo
Qui si descrive la citotossicità cellulare e singoli saggi di infettività rotonde che consentono lo screening rapido e preciso dei composti di determinare la loro citotossicità cellulare (CC 50) e valori di IC 50 contro WT e resistente di HIV-1 farmaco.
Abstract
Sebbene un certo numero di farmaci anti HIV sono stati approvati, ci sono ancora problemi con la tossicità e la resistenza ai farmaci. Ciò dimostra la necessità di individuare nuovi composti in grado di inibire l'infezione da parte resistente droga comuni ceppi HIV-1 con tossicità minima. Qui si descrive un dosaggio efficace che può essere utilizzato per determinare rapidamente la citotossicità e l'efficacia di un composto contro i ceppi WT e mutanti cellulare.
La linea cellulare porta è seminato in una piastra a 96 pozzetti e, dopo una incubazione 24 ore, vengono aggiunti serialmente diluizioni dei composti da testare. Nessun ulteriore manipolazioni sono necessarie per i test di citotossicità cellulare; per anti HIV saggi una quantità predeterminata di una o WT o farmaco resistente HIV-1 vettore che esprime luciferasi viene aggiunta alle cellule. La citotossicità viene misurata utilizzando un saggio dipende luminescenza ATP e l'impatto dei composti sulla infettività viene misurata determinando la quantità di lucifeRASE in presenza o assenza di inibitori putativi.
Questo test di screening richiede quattro giorni per completare e composti multipli può essere proiettato in parallelo. I composti vengono proiettati in triplicato ei dati sono normalizzati ai livelli infettività / ATP in assenza di composti bersaglio. Questa tecnica fornisce una misurazione rapida e precisa della efficacia e la tossicità di potenziali composti anti-HIV.
Introduzione
La disponibilità di farmaci mirati diversi passaggi essenziali nella HIV-1 ciclo di vita virale ha portato alla terapia di combinazione farmaco (chiamato terapia altamente attiva antiretrovirale, o HAART), che ha notevolmente migliorato il trattamento delle infezioni da HIV-1, e la sopravvivenza a lungo termine dei pazienti. HAART, che utilizza tipicamente combinazioni di due nucleosidico della trascrittasi inversa (RT) e inibitori sia un inibitore della proteasi o un inibitore non nucleosidico RT, ha convertito una malattia mortale in una condizione di vita lunga 1-5. Tuttavia, nonostante i molti successi di HAART in soppressione sostenuta della replicazione virale, ma ha dei limiti. HAART non sradicare l'HIV, in modo che i pazienti non vengono curati e la terapia è lunga vita. Ci sono problemi con la tossicità della droga e con l'emergere di ceppi resistenti ai farmaci. La resistenza può nascere a tutti i farmaci anti-HIV approvati, tra cui i farmaci recentemente approvati che mirano HIV integrasi (IN). La resistenza ai farmaci probabilmente deriva Becauso di mutazioni spontanee che si verificano durante la replicazione virale (tasso di errore di 3 x 10 -5 ciclo mutazioni / base / replica) 6. Quando sorgono mutazioni nei geni che codificano per i bersagli di farmaci anti-retrovirali, un piccolo sottoinsieme di queste mutazioni porterà ad una riduzione di sensibilità del ceppo virale ai farmaci. Per evitare lo sviluppo di resistenza ai farmaci, le concentrazioni del farmaco devono essere mantenuti a livelli che sopprimono completamente replicazione dell'HIV. Scarsa aderenza al regime terapeutico aggrava il problema, e può portare al rapido sviluppo di resistenza 7-9. Anche se concentrazioni di farmaco possono variare in pazienti a causa di assorbimento differenti, il metabolismo, la distribuzione ei livelli di escrezione, elevate concentrazioni di droga possono portare a tossicità 10. Poiché la terapia continua per la vita del paziente, esistono gravi problemi di sicurezza circa la tossicità a lungo termine di anti antiretrovirali. Gli anti-retrovirali comunemente usati in HAART possono avere effetti negativi and ci sono stati episodi in cui gli effetti collaterali sono stati in pericolo di vita 11-15. I problemi riscontrati pazienti con lo sviluppo di resistenza e tossicità alla base della necessità di sviluppare nuovi farmaci che bloccano efficacemente la replicazione dei ceppi resistenti al farmaco comuni del virus con poca o nessuna tossicità a lungo termine.
Pertanto, vi è la necessità di un metodo che può schermo per i composti che bloccano fasi essenziali del ciclo vitale del virus rapidamente. Qui si descrive un dosaggio efficace che può essere utilizzato per valutare la citotossicità di composti e la loro capacità di bloccare rapidamente ed efficacemente la replicazione di entrambi WT e ceppi di HIV resistenti ai farmaci. Il test utilizzato è simile a un saggio che è stato sviluppato per lo screening farmacoresistenza in virus isolato da pazienti 16-18.
Anche se il dosaggio può essere utilizzato senza modifiche per schermo per i composti che possono bloccare la trascrizione inversa dell'HIV, noi descrIBE utilizzando il test per valutare IN inibitori. IN è un enzima virale essenziale che inserisce il DNA virale nel genoma cellulare 19. Anche se si stanno sviluppando una serie di promettenti inibitori, alcuni dei quali sono attualmente in fase di sperimentazione clinica, solo Isentress 20, 21 (noto anche come raltegravir o RAL) e, più recentemente, Elvitegravir (EVG) 22 e dolutegravir (DTG) 23 sono stati approvato dalla FDA. Questi composti sono attivi contro l'HIV B e sottotipi non B in coltura cellulare e nei pazienti 24, 25. Tuttavia, il trattamento con RAL seleziona per farmaco-resistente di HIV-1 IN mutanti, tra cui Y143R, N155H, e G140S/Q148H 24, 26-31. N155H e G140S/Q148H anche ridurre l'efficacia di EVG, che sottolinea la necessità di progettare e sviluppare seconda generazione IN Inibitori di trasferimento del filamento (INSTIs) che sono efficaci contro queste mutazioni di resistenza.
Protocollo
1. Preparazione di titoli di Master
- Fai maestri scorte dei composti da testare in DMSO. Preparare scorte a una concentrazione standard di 20 mM.
Nota: qualsiasi concentrazione superiore a 10 mm può essere utilizzato. Composti che possono essere utilizzati come controlli positivi per convalidare questo saggio includono RAL, EVG, e DTG. - Garantire i composti sono sciolti in DMSO vortex le soluzioni più volte per 15 secondi e incubando a temperatura ambiente per 1 ora. Conservare le 20 soluzioni madre mM al buio a -20 ° C fino al momento dell'uso.
2. Preparazione delle piastre con 96 pozzetti per Compound Screening
- Scegliere la linea di cellule da testare (es HOS o TZM-bl), e seminare 100 pl di tali cellule ad una densità di 4 x 10 4 cellule / ml (4.000 cellule / pozzetto) in mezzi (ad esempio modificato Eagle o DMEM Dulbecco supplementato con 5% (v / v) di siero fetale bovino, siero di vitello neonato 5%, e penicillina (50 unità / ml) più streptomycin).
3. Generazione di riserve di virus
Produrre VSV-g-pseudotyped HIV trasfettando cellule 293 (come mostrato in Figura 1, fase 1) 32-34.
- Il giorno prima della trasfezione, piastra 293 celle su 100 piatti mm di diametro con una densità di 1,5 x 10 6 cellule.
- Il giorno della trasfezione, trasfettare cellule 293 con 16 pg di tipo selvatico o mutante HIV (pNLNgoMIVR - ΔLUC) e 4 microgrammi di VSV (pHCMV-g) utilizzando il metodo del fosfato di calcio 35.
- Viene aggiunto circa 6 ore dopo il precipitato di fosfato di calcio, lavare 293 cellule due volte con tampone fosfato (PBS) e incubare con mezzi freschi per 48 ore. [DMEM supplementato con 5% (v / v) di siero fetale bovino, siero di vitello neonato 5%, e penicillina (50 unità / ml) più streptomicina (50 mg / ml)].
- Raccogliere il virus contenente surnatanti rimuovendo il supporto dal diametro di 100 mmpiatti, chiarire il surnatante mediante centrifugazione a bassa velocità a 3000 rpm per 10 minuti, filtrare il surnatante attraverso un filtro da 45 micron dimensione dei pori siringa, trattare surnatanti con DNasi Turbo per 30 minuti a RT e diluire surnatanti in mezzi per la preparazione in saggi di infezione . Conservare il surnatante virale congelati, in aliquote, a -80 ° C.
Nota: la quantità di p24 nel supernatante viene determinato utilizzando un kit p24 saggio immunoenzimatico HIV-1. La concentrazione p24 è utilizzato per controllare la quantità di virus nel campione. Circa 500 ng di virus viene aggiunta alle cellule HOS placcato da 60 piatti mm di diametro ad una densità di 1,5 x 10 5 cellule / piatto il giorno prima dell'infezione. Dopo 48 h di incubazione, le cellule vengono raccolte, raccolte per centrifugazione, lavate e risospese in 100 microlitri di PBS. Aggiungi una pari quantità di luminescenza giornalista dosaggio del gene del reagente e misurare l'attività luciferasi come descritto nelle sezioni 5.4.1 e5.4.2. Da questo, una diluizione appropriata del virus può essere fatto come discusso nel passo 4.6.
4. Composto screening in piastre con 96 pozzetti
Schermo ciascun composto in triplice copia e media i risultati.
Nota: l'effetto di ciascun composto sulla replicazione virale viene corretto normalizzando il livello di replicazione ottenuto in assenza di qualsiasi composto.
- Determinare l'intervallo di concentrazione empirica di essere proiettati.
Nota: in genere, schermi con 11 diluizioni seriali sono fatti aggiungendo il composto alla colonna piastra per colonna e schermi con 7 diluizioni seriali sono fatti aggiungendo il composto per riga. Una triplice copia set di pozzi deve essere riservato per il controllo non composto. Inoltre, una colonna o una riga deve rimanere vuota per agire come controllo negativo / sfondo. Infine, se è una citotossicità cellulare o prova di infettività detterà se viene aggiunto virus. - Prepararediluizioni seriali della soluzione stock di 20 mm. Le concentrazioni sono scelti in funzione della gamma determinato empiricamente di concentrazioni da testare (come mostrato nella Tabella 1). Preparare le diluizioni in media a 10 volte la concentrazione finale desiderata, cioè se la concentrazione finale sta per essere a 100 micron, fare un archivio di lavoro 1 mm.
Nota: composti con IC 50 s sopra 5-10 micron di solito non sono buoni candidati per lo sviluppo di farmaci. Nei test iniziali testiamo i composti solo contro il vettore WT. Promettenti composti che inibiscono efficacemente il vettore WT vengono poi testati contro un gruppo di mutanti resistenti ai farmaci. - Rimuovere le piastre a 96 pozzetti dall'incubatore e aggiungere le diluizioni seriali dei composti da testare ai pozzetti in triplicato (come mostrato in Figura 1, fase 2).
Nota: il volume aggiunto al pozzetto dovrebbe essere 1/10 del volume della concentrazione finale. Quindi, aggiungere 22 microlitri / pozzetto (volume finale pInoltre virus ost è di 220 ml) per i saggi di infettività. Per i saggi di citotossicità, aggiungere 11 microlitri / pozzetto (volume finale è di 110 ml / pozzetto). - Riportare le piastre a 96 pozzetti per l'incubatrice. Per uno schermo citotossicità cellulare, incubare le piastre a 96 pozzetti 48 ore a 37 ° C e senza ulteriori manipolazioni sono necessari nel protocollo 4: passare al protocollo 5 Per i saggi di infettività, proseguire seguendo le istruzioni riportate nel protocollo 4..
- Saggi di infettività solo. Rimuovere le piastre dal termostato dopo un minimo di 3 ore di incubazione a 37 ° C con i composti da analizzare.
Nota: questo permette il composto da assorbito dalle cellule prima dell'infezione con il vettore HIV. - Preparare una diluizione magazzino del virus 33, 34 (di solito circa 1,3) che produrrà un segnale luciferasi tra 0,2-1,5 unità luciferasi relative (RLU) in cellule non trattate. Un intero piatto richiederà circa 10 ml della diluizionevirus ted. Aggiungere 100 ml di virus a ciascuno dei pozzetti, utilizzando un 8 o 12 pipetta multicanale. Non aggiungere virus alle negativo / sfondo pozzetti di controllo. Riportare le piastre per la 37 ° C incubatore per 48 ore.
Nota: uno stock diluizione del virus 01:03 è tipica diluizione che produrrà un segnale luciferasi tra 0.2 -1.5 RLU basato su un saggio p24 mostrando che la concentrazione virale nel supernatante è approssimativamente 500 ng in 1,0 ml.
5. Preparazione e misurazione della citotossicità ed infettività in piastre con 96 pozzetti
- Aspirare il supporto dai pozzi (fenolo rosso nei media può interferire con il segnale luciferasi). Utilizzare una pipetta di vetro con una punta di pipetta 200 microlitri fissato all'estremità. Inizia la parte superiore del supporto e lavorare lentamente giù verso l'angolo in fondo al pozzo. Non spendere troppo tempo sul fondo del pozzo, o le cellule possono essere rimosse dal pozzo.
- Aggiungere 100 ml di PBS integrato con 0,5 mM MgCl 2 a ciascun pozzetto. Questo deve essere fatto immediatamente dopo la media è rimosso in modo che le cellule non si seccano.
- Solo per saggi di citotossicità, aggiungere 5 ml di tampone substrato dal saggio di rilevamento di luminescenza ATP per ogni flacone di dotazione del reagente liofilizzato. Un flaconcino è sufficiente per una piastra a 96 pozzetti.
- Aggiungere 50 ml di tampone di lisi cellulare dal saggio rilevamento luminescenza ATP a ciascun pozzetto. Agitare la piastra a 96 pozzetti a 700 rpm a temperatura ambiente per 5 minuti usando un thermomixer compatto.
- Aggiungere 50 ml di ricostituito luminescenza ATP di reagenti del dosaggio di rilevamento per tutti i pozzetti, eccetto per il controllo / sfondo negativi pozzi. Agitare a 700 rpm a temperatura ambiente per 5 minuti usando un thermomixer compatto. Incubare le piastre a temperatura ambiente per 20 min per permettere tempo per lo sviluppo del segnale.
- Leggere la piastra a 96 pozzetti utilizzando luminometro micropiastra.
Nota: aprire il programma microplacca luminometro SoftMax Pro. Assicurarsi che il luminometro sia impostato per misurare luminescence ad una sensibilità di 5 letture / pozzetto.
- Solo per saggi di infettività, aggiungere 10 ml di tampone substrato dal saggio gene luminescenza reporter per ogni flacone di dotazione del reagente liofilizzato. Un flaconcino è sufficiente per ciascuna piastra da 96 pozzetti.
- Aggiungere 100 pl di luminescenza ricostituito giornalista saggio gene reagente a ciascun pozzetto. Incubare a temperatura ambiente per 20 min per permettere tempo per lo sviluppo del segnale.
- Leggere la piastra a 96 pozzetti utilizzando un luminometro micropiastre interpretato nel paragrafo 5.3.3.
6. Determinazione del CC 50 e IC 50 valori per Composti
- Trasferire i dati luciferasi dal luminometro micropiastra in un foglio excel.
- Media sia i dati di luciferasi in triplice copia ed i dati del segnale di fondo / di controllo. Sottrarre il segnale di fondo media / controllo dal segnale medio triplicato per l'intera gamma di concentrazione.
- normalizzare il segnale di correzione del fondo media degli intervalli di concentrazione contro l'attività, se è citotossicità o infettività, in assenza di qualsiasi composto per determinare la percentuale di inibizione.
Nota: percentuale di inibizione è definito come l'attività di luciferasi in presenza del farmaco diviso per l'attività di luciferasi in assenza di farmaco moltiplicato per 100.
- Utilizzare software Kaleidagraph per ottenere CC 50 e IC 50 valori
- Trasferire sia l'intervallo di concentrazione empiricamente determinato e percentuale di inibizione dell'attività di luciferasi in Kaleidagraph.
- Tracciare i dati con l'intervallo di concentrazioni sull'asse x e la percentuale di inibizione di attività di luciferasi sull'asse y.
Risultati
Se il test (Figura 1, punti 1 e 2) è stata eseguita con successo, allora i valori luciferasi dovrebbero somigliare i dati presentati nella tabella 2 Eseguire la scansione di tutti i range di concentrazione.; un composto potenzialmente potente rivelerà aumentando l'attività luciferasi da sinistra a destra, e il controllo deve avere la più alta attività luciferasi. Se l'attività luciferasi non superi 0,1 Unità luciferasi relative (RLU) su tutta la gamma di concentrazione, questo di solito indica che il composto ha ucciso le cellule. Se i dati luciferasi è maggiore o uguale a 2,0 RLU in tutte le diluizioni seriali, poi i composti non erano in grado di inibire HIV-1 infezioni alle concentrazioni testate.
Tracciando la concentrazione dei composti contro la percentuale di inibizione di attività di luciferasi in Kaleidagraph (Tabella 3, parte A), dopo l'esecuzione di analisi di regressione lineare, produrrà risultati simili a t tubo mostrato in tabella 3, parte B.

Figura 1. Preparazione di HIV-1 Stocks virali e l'installazione di citotossicità cellulare e Single-round infettività saggi. Nella fase 1, cellule 293T sono trasfettate con pNL4.3ΔEnv.LUC e VSV-G ed incubato per 48 ore per produrre virus 34 . Il virus viene raccolto e conservato (congelato a -80 ° C in aliquote) finché non viene utilizzato nei saggi di infettività. Per il passaggio 2, cellule HOS vengono seminate in una piastra a 96 pozzetti e incubate per 24 ore. Le cellule sono poi pre-incubate con diluizioni seriali dei composti da testare per 3 ore e poi infettati con il virus (sia WT o resistenti ai farmaci). Dopo una incubazione 48 ore, l'attività della luciferasi è misurata.
le1.jpg "width =" 300 "/>
Tabella 1. Drug Screening Serial diluizione Prototype. Uno screening più rigoroso coinvolge 11 diluizioni seriali che in genere partono da 10 micron e finiscono a 0,0005 micron. Le diluizioni seriali sono preparati 10x; ci sono 100 microlitri di cellule e 100 ml di virus in ogni pozzetto). A questo volume e seguendo questi calcoli, le diluizioni seriali saranno sufficienti per 3 righe di un'intera piastra a 96 pozzetti. I saggi di citotossicità sono preparati allo stesso modo; tuttavia le diluizioni seriali 11 partono da 250 micron e terminano a 0.05 micron. Solo 11 ml delle diluizioni sono aggiunti ai pozzetti nella piastra che contengono 100 ml di cellule. Cliccate qui per vedere una versione più grande di questa cifra.
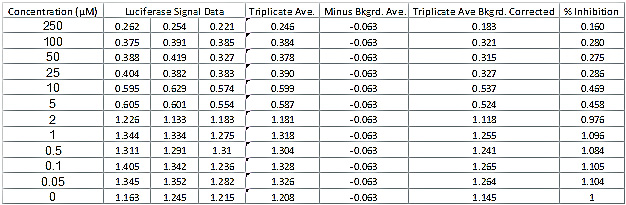
Tabella 2. Luciferasi Lettura segnale dati e Determinazione della percentuale di inibizione di attività luciferasi. La tabella dati mostra un tipico insieme di dati luciferasi per un composto successo. La tabella mostra inoltre i calcoli aggiuntivi necessari per determinare la percentuale di inibizione dell'attività di luciferasi e il CC 50 e IC 50 valori. Cliccare qui per vedere una versione più grande di questa figura.
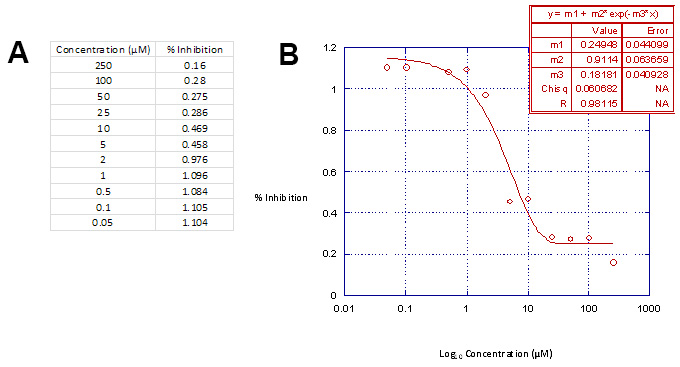
Tabella 3. Linear Regression Analysis Tabella dati. Parte A. Graficamente la gamma di concentrazione utilizzata contro la percentuale di inibizione di attività di luciferasi in Kaleidagraph produrrà le relative curve di inibizione. Parte B, Le curve di inibizione sono definiti dalla 3 parametricofunzione sigmoidale e in forma di dati mediante regressione lineare analisi 18. Questa tabella dati viene quindi utilizzato in combinazione con Microsoft Excel per calcolare le concentrazioni di farmaco necessarie per inibire l'integrazione virus e citotossicità cellulare del 50%, ad esempio, IC 50 e CC 50. Cliccare qui per vedere una versione più grande di questa figura.
Discussione
Descriviamo un saggio rapido, efficiente e riproducibile che può essere utilizzato per composti schermo di citotossicità e per la loro capacità di inibire la replicazione del WT e resistente HIV-1 farmaco. La capacità di identificare rapidamente i composti e testare la loro efficacia e la citotossicità è cruciale nello sviluppo di farmaci nuovi e migliorati contro HIV-1. Una volta composti di piombo sono identificati, analoghi del composto guida possono essere prodotti e testati utilizzando lo stesso dosaggio. Il saggio è relativamente semplice. Ci sono entrambi i controlli positivi e negativi che consentono all'utente di diagnosticare i problemi più comuni (composti tossici, problemi con il vettore stock). L'uso di un insieme triplicato di pozzetti senza composto aggiunto indica che si è verificato l'infezione virale. Il fatto che la citotossicità è misurata in un saggio indipendente misinterpreting evita una riduzione della luciferasi citotossicità causata da un effetto specifico sulla replicazione virale.
I passaggi criticinel protocollo si preparano le piastre in modo che le cellule sono distribuiti uniformemente nei pozzetti, che i pozzetti hanno le concentrazioni appropriate dei composti da testare, aggiungendo la stessa quantità di virus a ciascuno dei pozzetti, e misurando l'attività di luciferasi per determinare il CC 50 e IC 50 valori.
Il saggio è sicuro, quantitativa e riproducibile. Il saggio è sicuro perché il vettore è la replica difettoso. Il saggio è quantitativa e riproducibile perché si basa su un singolo vettore rotonda che esprime la luciferasi, che può essere saggiata esattamente e convenientemente. In un round saggio più replicazione del virus, la misurata IC 50 dipende dal numero di cicli di vita virali; questo è un problema particolare quando i saggi coinvolgono sia WT e virus resistenti ai farmaci che potrebbero avere le capacità di replica significativamente diversi.
Ci sono stati diversi saggi enzimatici riferito in precedenza che possonoessere utilizzato per lo screening per gli inibitori IN. I saggi che coinvolgono tecnologia PCR real time per misurare il DNA integrato richiedono proteine ricombinanti purificate (s), e sono, in generale, sia più laborioso e costoso, 36, 37. Sebbene sia possibile utilizzare saggi enzimatici per misurare l'impatto dei composti sugli altri enzimi virali (RT e proteasi), ciascun enzima richiede un proprio sistema di dosaggio. L'unico test vettore rotonda, come descritto, può essere utilizzato, senza modifiche, per lo screening inibitori della RT. Un test simile può essere usato per individuare inibitori di proteasi; Tuttavia, in un saggio di inibitore della proteasi, i composti devono essere aggiunti alle cellule usate per produrre i vettori. Un saggio correlate, utilizzando cellule e vettori differenti, può anche essere usato per individuare busta (env) e inibitori entrata fusione HIV. Infine, il test può essere utilizzato, in scala ingrandita, con dispensatori robotici automatizzati. Così, il saggio può essere utilizzato per lo screening di grandi librerie di composti contro WT e mutant HIV. Tuttavia, il fatto che il test in grado di rilevare un inibitore della replicazione dell'HIV che agisce in diverse fasi del virali punti del ciclo di vita di una limitazione nell'interpretazione dei dati. Di per sé il saggio non definisce la fase del ciclo di vita è bloccato da un composto. Se si pone questa domanda, può essere risolto utilizzando il tempo di saggi di addizione 38, e testando il composto contro le proteine virali ricombinanti purificate.
Purtroppo, nonostante il successo di farmaci anti HIV, vi sono ancora problemi sia con resistenza e tossicità. In assenza di un vaccino efficace contro l'HIV, è necessario non solo per sviluppare nuovi farmaci terapeutici che saranno efficaci contro i mutanti resistenti ai farmaci esistenti, ma anche per sviluppare farmaci profilattici che possono ridurre la diffusione del virus. Se l'uso profilattico di farmaci anti-HIV incudes il trattamento delle persone infette, questo approccio un onere speciale sullo sviluppo di farmaci che hanno little o nessuna tossicità a lungo termine.
Divulgazioni
Gli autori hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata sostenuta dal programma di ricerca intramurale del NSC.
Materiali
| Name | Company | Catalog Number | Comments |
| DMSO | Sigma | D2650 | |
| DMEM | Corning Cellgro | 10-017 | |
| ATPlite Luminescence ATP Detection Assay System | Perkin Elmer | 6016941 | |
| Steady Lite Plus High Sensitivity Luminescence Reporter Gene Assay System | Perkin Elmer | 6016751 | |
| Dulbecco's PBS | Gibco-Life Technologies-Invitrogen | 14190-136 | |
| SpectraMax Gemini EM | Molecular Devices | ||
| KaleidaGraph | Synergy Software | ||
| Nunc F96 Microwell White Polystyrene Plate | Thomas Scientific | 12-566-26 | |
| Eppendorf Thermomixer Compact | Sigma Aldrich | T1442-1EA | |
| Turbo DNase | Ambion-Life Technologies-Invitrogen | AM2238 | |
| Millex HA Filter Unit, 0.45 µM | Millipore | SLAHA033SS | |
| Alliance HIV-1 p24 Elisa Kit | Perkin Elmer | NEK050B001KT | |
| HOS cells | ATCC | CRL-1543 | |
| TZM-bl cells | NIH AIDS Reagent Program | 8129 | |
| pNL4.3ΔEnv.LUC | NIH-NCI HIV Drug Resistance Program- Hughes Lab | ||
| VSV-G | NIH-NCI HIV Drug Resistance Program- Hughes Lab | ||
| SoftMax Pro | Molecular Devices | 0200-310 |
Riferimenti
- Mouton, Y., et al. Impact of protease inhibitors on AIDS-defining events and hospitalizations in 10 French AIDS reference centres. Federation National des Centres de Lutte contre le SIDA. AIDS. , 101-105 (1997).
- Hammer, S. M., et al. A controlled trial of two nucleoside analogues plus indinavir in persons with human immunodeficiency virus infection and CD4 cell counts of 200 per cubic millimeter or less AIDS Clinical Trials Group 320 Study Team. New Eng. J. Med. 337, 725-733 (1997).
- Hogg, R. S., et al. Improved survival among HIV-infected patients after initiation of triple-drug antiretroviral regimens. Can. Med. Assoc. 160, 659-665 (1999).
- Egger, M., et al. Impact of new antiretroviral combination therapies in HIV infected patients in Switzerland: prospective multicentre study. Swiss HIV Cohort Study. BMJ. 315, 1194-1199 (1997).
- Gulick, R. M., et al. Treatment with indinavir, zidovudine, and lamivudine in adults with human immunodeficiency virus infection and prior antiretroviral therapy. New Eng. J. Med. 337, 734-739 (1997).
- Perelson, A. S., Neumann, A. U., Markowitz, M., Leonard, J. M., Ho, D. D. HIV-1 dynamics in vivo: virion clearance rate, infected cell life-span, and viral generation time. Science. 271, 1582-1586 (1996).
- Simoni, J. M., Amico, K. R., Pearson, C. R., Malow, R. Strategies for promoting adherence to antiretroviral therapy: a review of the literature. Curr. Infect. Dis. Rep. 10, 515-521 (2008).
- Simoni, J. M., Amico, K. R., Smith, L., Nelson, K. Antiretroviral adherence interventions: translating research findings to the real world clinic. Curr. HIV/AIDS Rep. 7, 44-51 (2010).
- Volberding, P. A., Deeks, S. G. Antiretroviral therapy and management of HIV infection. Lancet. 376, 49-62 (2010).
- Acosta, E. P., et al. Novel method to assess antiretroviral target trough concentrations using in vitro susceptibility data. Antimicr. 56, 5938-5945 (2012).
- Rockstroh, J. K., et al. Long-term treatment with raltegravir or efavirenz combined with tenofovir/emtricitabine for treatment-naive human immunodeficiency virus-1-infected patients: 156-week results from STARTMRK. Clin. Infect. Dis. 53, 807-816 (2011).
- Fernandez-Montero, J. V., Eugenia, E., Barreiro, P., Labarga, P., Soriano, V. Antiretroviral drug-related toxicities - clinical spectrum, prevention, and management. Exp. Opin. Drug Safety. , (2013).
- Lunzen, J., et al. Once daily dolutegravir (S/GSK1349572) in combination therapy in antiretroviral-naive adults with HIV: planned interim 48 week results from SPRING-1, a dose-ranging, randomised, phase 2b trial. Lancet Infect Dis. 12, 111-118 (2012).
- Sax, P. E., et al. Co-formulated elvitegravir, cobicistat, emtricitabine, and tenofovir versus co-formulated efavirenz, emtricitabine, and tenofovir for initial treatment of HIV-1 infection: a randomised, double-blind, phase 3 trial, analysis of results after 48 weeks. Lancet. 379, 2439-2448 (2012).
- Sax, P. E., et al. Abacavir/lamivudine versus tenofovir DF/emtricitabine as part of combination regimens for initial treatment of HIV: final results. Infect. Dis. 204, 1191-1201 (2011).
- Kellam, P., Larder, B. A. Recombinant virus assay: a rapid, phenotypic assay for assessment of drug susceptibility of human immunodeficiency virus type 1 isolates. Antimicr. Agents Chemother. 38, 23-30 (1994).
- Hertogs, K., et al. A rapid method for simultaneous detection of phenotypic resistance to inhibitors of protease and reverse transcriptase in recombinant human immunodeficiency virus type 1 isolates from patients treated with antiretroviral drugs. Antimicr. Agents Chemother. 42, 269-276 (1998).
- Petropoulos, C. J., et al. A novel phenotypic drug susceptibility assay for human immunodeficiency virus type 1. Antimicr. Agents Chemother. 44, 920-928 (2000).
- Engelman, A., Mizuuchi, K., Craigie, R. HIV-1 DNA integration: mechanism of viral DNA cleavage and DNA strand transfer. Cell. 67, 1211-1221 (1991).
- Hazuda, D. J., et al. Inhibitors of strand transfer that prevent integration and inhibit HIV-1 replication in cells. Science. 287, 646-650 (2000).
- Nguyen, B. Y., et al. Raltegravir: the first HIV-1 integrase strand transfer inhibitor in the HIV armamentarium. Ann. N.Y. Acad. Sci. 1222, 83-89 (2011).
- Wills, T., Vega, V. Elvitegravir: a once-daily inhibitor of HIV-1 integrase. Exp. Opin. Invest. Drugs. 21, 395-401 (2012).
- Kobayashi, M., et al. In Vitro antiretroviral properties of S/GSK1349572, a next-generation HIV integrase inhibitor. Antimicr. Agents Chemother. 55, 813-821 (2011).
- Cooper, D. A., et al. Subgroup and resistance analyses of raltegravir for resistant HIV-1 infection. Eng. J. Med. 359, 355-365 (2008).
- Briz, V., et al. Raltegravir and etravirine are active against HIV type 1 group O. AIDS Res.Human Retroviruses. 25, 225-227 (2009).
- Fransen, S., et al. Loss of raltegravir susceptibility by human immunodeficiency virus type 1 is conferred via multiple nonoverlapping genetic pathways. J. Virol. 83, 11440-11446 (2009).
- Goethals, O., et al. Primary mutations selected in vitro with raltegravir confer large fold changes in susceptibility to first-generation integrase inhibitors, but minor fold changes to inhibitors with second-generation resistance profiles. Virology. 402, 338-346 (2010).
- Goethals, O., et al. Resistance mutations in human immunodeficiency virus type 1 integrase selected with elvitegravir confer reduced susceptibility to a wide range of integrase inhibitors. J. Virol. 82, 10366-10374 (2008).
- Canducci, F., et al. Dynamic patterns of human immunodeficiency virus type 1 integrase gene evolution in patients failing raltegravir-based salvage therapies. AIDS. 23, 455-460 (2009).
- Ceccherini-Silberstein, F., et al. Characterization and structural analysis of HIV-1 integrase conservation. AIDS Rev. 11, 17-29 (2009).
- Charpentier, C., et al. Drug resistance profiles for the HIV integrase gene in patients failing raltegravir salvage therapy. HIV Med. 9, 765-770 (2008).
- Julias, J. G., et al. Effects of mutations in the G tract of the human immunodeficiency virus type 1 polypurine tract on virus replication and RNase H cleavage. J. Virol. 78, 13315-13324 (2004).
- Hare, S., et al. Structural and functional analyses of the second-generation integrase strand transfer inhibitor dolutegravir (S/GSK1349572). Mol. Pharmacol. 80, 565-572 (2011).
- Adachi, A., et al. Production of acquired immunodeficiency syndrome-associated retrovirus in human and nonhuman cells transfected with an infectious molecular clone. J. Virol. 59, 284-291 (1986).
- Kemp, S. D., et al. A novel polymorphism at codon 333 of human immunodeficiency virus type 1 reverse transcriptase can facilitate dual resistance to zidovudine and L-2',3'-dideoxy-3'-thiacytidine. J. Virol. 72, 5093-5098 (1998).
- Butler, S. L., Hansen, M. S., Bushman, F. D. A quantitative assay for HIV DNA integration in vivo. Nat. Med. 7, 631-634 (2001).
- Brussel, A., et al. Longitudinal monitoring of 2-long terminal repeat circles in peripheral blood mononuclear cells from patients with chronic HIV-1 infection. AIDS. 17, 645-652 (2003).
- Daelemans, D., Pauwels, R., De Clercq, E., Pannecouque, C. A time-of-drug addition approach to target identification of antiviral compounds. Nat. Protoc. 6, 925-933 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon