È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
La valutazione ecografica della dilatazione flusso-mediata del brachiale e arterie femorali superficiali nei ratti
In questo articolo
Riepilogo
valutazione non invasiva della funzione endoteliale in esseri umani può essere determinata mediante la tecnica dilatazione flusso-mediata. Anche se migliaia di studi hanno utilizzato questa tecnica, nessuno studio ha eseguito questa tecnica non invasiva nei ratti. Il seguente articolo descrive la misurazione non invasiva della dilatazione flusso-mediata nel brachiale e superficiali arterie femorali di ratti.
Abstract
Arterial vasodilation to increases in wall shear rate is indicative of vascular endothelial function. In humans, the non-invasive measurement of endothelial function can be achieved by employing the flow-mediated dilation technique, typically performed in the brachial or superficial femoral artery. Briefly, a blood pressure cuff placed distal to an ultrasound probe is inflated to a suprasystolic pressure, which results in limb ischemia. After 5 min of occlusion the cuff is deflated, resulting in reactive hyperemia and increases in wall shear rate that signal vasodilatory molecules to be released from the endothelium eliciting vasodilation. Despite the thousands of studies performing flow-mediated dilation in humans, surprisingly, no studies have performed this technique non-invasively in living rats. Considering the recent shift in focus to translational research, the establishment of guidelines for non-invasive measurement of flow-mediated dilation in rats and other rodents would be extremely valuable. In the following article, a protocol is presented for the non-invasive measurement of flow-mediated dilation in brachial and superficial femoral arteries of rats, as those sites are most commonly measured in humans.
Introduzione
L'endotelio vascolare è un monostrato cellulare che riveste la lume delle arterie ed è un importante regolatore della funzione vascolare. Ci sono numerose molecole rilasciate dal endotelio che provocano modulazione del diametro del vaso sanguigno. Tra queste molecole, ossido nitrico (NO), sembra essere la molecola vasodilatatrice primario rilasciato dall'endotelio vascolare in risposta alla stimolazione (ad esempio, insulina, acetilcolina, o cambiamenti nella sollecitazione di taglio) 1. Nel endotelio vascolare, NO è prodotto dall'enzima NO sintetasi endoteliale (eNOS) e viene successivamente rilasciato dalle cellule endoteliali 2. Diffonde NO al muscolo liscia vascolare dove provoca il rilassamento e l'aumento vaso di diametro 3.
La disfunzione endoteliale può essere valutato in modo non invasivo negli esseri umani usando la dilatazione flusso-mediata (FMD) tecnica di 4,5. FMD è stato proposto per rappresentare un saggio biologico funzionale per endotelio-derivatoNO biodisponibilità negli esseri umani, ed è tipicamente valutato al brachiale o femorale superficiale in risposta ad iperemia reattiva in seguito a ~ 5 min arto occlusione 6. Iperemia reattiva aumenta le forze di taglio laminare che sono trasduzione al cellule endoteliali 7, segnalando un rilascio di NO 8. Anche se negli ultimi anni, la percentuale di vasodilatazione avviato dal rilascio di NO è stata dibattuta 9,10, l'afta epizootica è indicativo della dilatazione endotelio-dipendente ed è stato costantemente dimostrato di predire gli eventi cardiovascolari 11-13.
Ad oggi, migliaia di studi hanno impiegato la tecnica FMD per la misurazione non invasiva della funzione endoteliale nell'uomo. Considerando il recente cambiamento di messa a fuoco per la ricerca traslazionale, le linee guida per la misurazione non invasiva di afta epizootica nei roditori sarebbe estremamente prezioso. Mantenere con un approccio traslazionale, questo protocollo è stato istituito per la misura di afta epizootica in brachiale e superficial arterie femorali di ratti, come quei siti sono più comunemente misurati negli esseri umani. Questo protocollo si traduce in un robusto e ripetibile risposta afta epizootica nei ratti, tuttavia, la misura di afta epizootica nei ratti è tecnicamente impegnativo e può essere difficile per gli altri investigatori di replicare senza video dimostrativo. Pertanto, l'articolo dimostrerà un metodo per la misurazione non invasiva della FMD nel brachiale e superficiali arterie femorali di ratti.
Protocollo
Tutte le procedure sugli animali conformi alla Guida per la cura e l'uso di animali da laboratorio 14 e sono stati approvati dalla University of Utah e Salt Lake City Veterans Affairs Medical Center cura degli animali e Usa.
1. Preparazione degli animali
- Posizionare animale nella camera di induzione dell'anestesia contenente 3% isoflurano in ossigeno al 100%. Lasciare l'animale in camera di induzione finché non risponde agli stimoli esterni.
- Rimuovere l'animale dalla camera di induzione e posizionarlo su un lettino riscaldato dotato di elettrodi dell'elettrocardiogramma (ECG). Mantenere l'anestesia al 3% isoflurano in ossigeno al 100%. Brachiale e femorale superficiale afta epizootica non può essere eseguita contemporaneamente. Pertanto, le istruzioni di preparazione per ogni misurazione sono elencati di seguito.
2. brachiale Preparazione
- Posizionare la supina animale e trattenere l'arto superiore sinistro e ciascun arto inferiore della unIMAL al lettino con del nastro adesivo chirurgico.
- Trattenere l'arto superiore destro dell'animale, in modo che la porzione inferiore dell'arto superiore è leggermente elevata (~ 0,2-0,5 cm) sopra la piattaforma.
- Applicare agente depilatorio (ad esempio, Nair) per arto superiore destro dell'animale per rimuovere i capelli.
- Posizionare un bracciale occlusione (10 mm di diametro del lume vascolare occlusore standard) a destra arto distale superiore al gomito. Non appoggiare il occlusore sulla piattaforma, come gonfiaggio / sgonfiaggio si muoverà l'arto e disturbare le immagini ad ultrasuoni.
- Impostare la macchina ad ultrasuoni per B-mode utilizzando la tastiera ultrasuoni.
- Applicare una piccola quantità di gel ultrasuoni per l'arto superiore dell'animale, prossimale al bracciale occlusione.
- allineare manualmente un trasduttore lineare di frequenza ultra-alta attaccato ad un supporto stereotassica con l'arto superiore. L'arteria brachiale dovrebbe essere visibile 2-3 mm di profondità.
- Per confermare che l'arteria brachiale, non la vena brachiale, è in corsoripreso, passare alla PW-mode utilizzando la tastiera ultrasuoni. L'arteria avrà flusso sanguigno pulsatile rispetto alla vena adiacente che avrà il flusso di sangue continuo.
3. superficiale femorale Arteria Preparazione
- Posizionare la supina animale e trattenere gli arti superiori e l'arto inferiore sinistro al lettino con nastro chirurgico.
- Trattenere inferiore destro dell'animale ad una posizione elevata (~ 0,5-1 cm) al di sopra della piattaforma utilizzando un pad (ad esempio, asciugamani di carta piegati).
- Applicare agente depilatorio (ad esempio, Nair) per il diritto degli animali arto inferiore per rimuovere i capelli. Dopo la rimozione dei capelli vena femorale deve essere chiaramente visibile nella coscia superiore.
- Posizionare un bracciale occlusione (10 mm di diametro del lume vascolare occlusore standard) prossimale alla caviglia destra. Non appoggiare il occlusore sulla piattaforma, come gonfiaggio / sgonfiaggio si sposterà l'arto inferiore e disturbare le immagini ad ultrasuoni.
- Impostare la macchina ad ultrasuoni perB-mode.
- Applicare una piccola quantità di gel ultrasuoni per l'arto inferiore dell'animale, prossimale al bracciale occlusione.
- allineare manualmente un trasduttore lineare di frequenza ultraelevata attaccato ad un supporto stereotassica con la vena femorale, che è visibile attraverso la pelle. L'arteria femorale superficiale dovrebbe essere visibile <1 mm di profondità.
- Per confermare che l'arteria femorale superficiale, non la vena femorale, viene esposta, passare alla PW-mode. L'arteria avrà flusso sanguigno pulsatile rispetto alla vena adiacente che avrà il flusso di sangue continuo.
4. Fase di base
- Ottimizzare l'immagine B-mode, simile a come sarebbe stato fatto negli esseri umani 15. Assicurarsi che una orizzontale, immagine longitudinale della nave con intima-media visualizzati in entrambe le pareti si osserva. Ottimizzare l'immagine leggermente regolando il posizionamento della sonda ecografica per garantire che il maggior numero di arterie possibile è visibile nella finestra di acquisizione.
- In alternativa, regolare le impostazioni ultrasuoni per ottenere una migliore immagine cambiando la luminosità / contrasto, zone focali, la frequenza, la gamma dinamica e la densità di linea. Ci sono altri modi per ottimizzare l'immagine ecografica, ma la descrizione dettagliata di questi sono oltre la portata di questo protocollo.
- Dopo l'ottimizzazione delle immagini delle arterie, accendere ECG-gating per visualizzare solo le immagini acquisite durante l'onda R per garantire che solo un fotogramma di diametro vengono raccolti sono in ogni porzione diastolica del ciclo cardiaco.
NOTA: ECG-gating è disponibile sulla macchina a ultrasuoni utilizzati in questo protocollo selezionando ECG-gating sotto l'opzione Impostazioni fisiologici, tuttavia, questa funzione potrebbe non essere disponibile su tutte le macchine a ultrasuoni. ECG-gating deve essere attivata dopo che l'immagine è ottimizzato, in quanto è difficile ottenere un'immagine a basso frame rate (cioè, una volta per onda R). Senza ECG-gating, la combinazione di una frequenza cardiaca elevata nei ratti e l'esigenza di un telaio altorate per catturare la porzione diastolica del ciclo cardiaco consente solo ~ 10-20 secondi di clip. Le dimensioni ingombranti e la quantità di dati in ogni clip aumenta il carico di analisi sostanzialmente. - Record 60 secondi di dati di base utilizzando B-mode.
NOTA: La macchina ad ultrasuoni è sempre registrando, però, non tutte le immagini sono memorizzate sulla macchina ad ultrasuoni, in quanto vi è un limite al numero di fotogrammi che è possibile registrare in un clip ad ultrasuoni. La lunghezza della clip (cioè, il numero di fotogrammi) può essere regolata nelle impostazioni. Si suggerisce di impostare per il numero massimo di fotogrammi al clip. Quando la registrazione è alla fine di una clip (cioè, il numero massimo di frame raggiunto), la registrazione continua, ma la clip rotola in avanti catturare i frame più recenti. In questo caso, frame precedenti che sono stati catturati all'esterno del limite massimo fotogramma vengono successivamente eliminati. Mentre queste complessità di registrazione differiscono tra le macchine, regolazione della lunghezza della registrazione può essere necessario. - Switch di PW-mode. Posizionare il cursore al centro del lume. cancelli campione saranno inseriti automaticamente in riferimento al cursore, ma possono essere regolati per la larghezza utilizzando la tastiera ultrasuoni. Mantenere un angolo insonazione di ≤60 °.
- Regolare l'angolo insonazione alterando l'angolo del fascio Doppler. Effettuare regolazioni fini l'angolo utilizzando la tastiera ultrasuoni. Se nessuno di questi forniscono un angolo adatto per la misurazione, regolare manualmente la sonda ecografica inclinando l'arteria ad un angolo più ottimale. Se viene eseguita alcuna regolazione dell'angolo di ultrasuoni, riprendere le immagini B-mode.
- Registrare 10 secondi di dati di velocità.
5. occlusione Phase
- Gonfiare il occlusore vascolare utilizzando un siringa da 10 ml piena di aria. Per mantenere costante la pressione dell'aria nel occluder vascolare, piegare il tubo su se stessa e posizionare un legante clip sul tubo piegato.
- Passa alla PW-mode per confermare l'occlusione della cuffia, come dimostrauna grande riduzione della velocità del sangue.
- Passare ai dati B-mode e registrare in 60 secondi di clip, fino 4:45 min di occlusione.
- Passa alla PW-mode. Tenere un registro di frequenza cardiaca e il tempo di ogni clip ultrasuoni per l'analisi.
6. Fase iperemiche
- Rilasciare il bracciale durante la registrazione in PW-mode rimuovendo la clip legante dal tubo piegato. Registrare 5 secondi prima e 5 secondi dopo il rilascio del bracciale.
- Passare ai dati B-mode e registrare in 60 secondi di clip fino a 3 minuti dopo l'occlusione. Tenere un registro di frequenza cardiaca e il tempo di ogni clip ultrasuoni per l'analisi.
- Dopo il completamento di afta epizootica rimuovere l'animale dal lettino e monitorare fino a quando non ha ripreso conoscenza sufficiente a mantenere decubito sternale.
7. Analisi
- Per l'analisi, l'esportazione ad ultrasuoni come file DICOM a un computer collegato dotato di software bordo di rilevamento, che permette di scoraggiare imparzialeminazione del diametro dell'arteria ad ogni frame. L'analisi è possibile sulla macchina ad ultrasuoni, tuttavia, non consigliabile, in quanto è estremamente dispendio di tempo e soggetti a bias ricercatore.
- Analizzare i dati delle arterie di diametro in 60 secondi segmenti durante il basale e l'occlusione di fase, e in 10 secondi segmenti durante la fase iperemica.
- Analizzare i dati di velocità del sangue utilizzando le funzionalità di analisi del flusso del software bordo di rilevamento automatico. Determinare la velocità del sangue media misurando 5 o più forme d'onda consecutivi di aspetto uniforme durante le fasi di base e di occlusione. Determinare velocità media di sangue durante iperemia reattiva per velocità di sangue subito dopo il rilascio della cuffia. La forma d'onda con la velocità del sangue più alta è considerata la velocità del sangue di picco.
Risultati
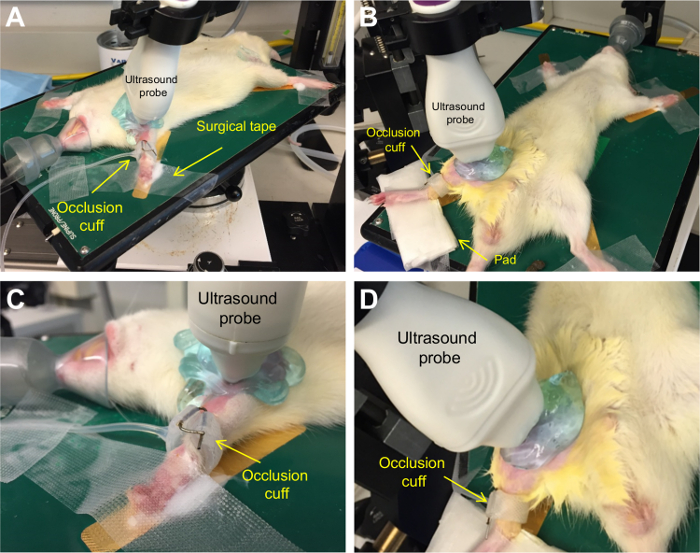
dilatazione flusso-mediata è stata eseguita sulla brachiale e femorale superficiale di 8 ratti Wistar. Posizionamento di un ratto è mostrato in Figura 1.
Immagini ecografiche rappresentative dell'arteria femorale superficiale sono mostrati nella Figura 2.
...
Discussione
Nel presente studio, una misurazione non invasiva della afta epizootica è stata dimostrata in brachiale e superficiali arterie femorali di ratti. Simili agli esseri umani 6, dopo un periodo di occlusione 5 min, c'è stato un rapido aumento della velocità del sangue (cioè, iperemia reattiva) aumentando così velocità di taglio sulla parete arteriosa che ha portato alla successiva vasodilatazione dell'arteria. Afta epizootica è stata osservata in entrambi i brachiale e le arterie femorali superfici...
Divulgazioni
None.
Riconoscimenti
All animal imaging was performed at the Small Animal Imaging Core Facility, University of Utah.
This study was funded in part by grants from the National Institutes of Health (R21 AG043952, R01 AG040297, K01 AG046326, K02 AG045339, and R01 DK100505).
Materiali
| Name | Company | Catalog Number | Comments |
| Vevo 2100 High Resolution Micro-Ultrasound Imaging System | VisualSonics, Toronto, ON, CAN | ||
| MicroScan Ultra-High Frequency Linear Array Transducer - MS-700 30-70 MHz | VisualSonics, Toronto, ON, CAN | ||
| Vevo Imaging Station | VisualSonics, Toronto, ON, CAN | ||
| Thermasonic gel warmer | Parker Laboratories, Fairfield, NJ, USA | 82-03 | Optional |
| Signacreme electrode cream | Parker Laboratories, Fairfield, NJ, USA | 17-05 | |
| Transpore surgical tape | 3M, Maplewood, MN, USA | 1527-1 | |
| Depilatory cream (e.g., Nair) | General supply | ||
| Cotton swabs | General supply | ||
| Ultrasound gel | General supply | ||
| Standard vascular occluder, 10 mm lumen diameter | Harvard Apparatus, Holliston, MA, USA | 62-0115 | |
| 10 ml syringe with Luer-Lok tip | General Supply | Used for occlusion cuff apparatus | |
| Paperclip | General Supply | Used for occlusion cuff apparatus | |
| Hypodermic needle – 18 gauge | General Supply | Used for occlusion cuff apparatus | |
| Medium binder clip | General Supply | Used for occlusion cuff apparatus |
Riferimenti
- Smits, P., et al. Endothelial release of nitric oxide contributes to the vasodilator effect of adenosine in humans. Circulation. 92, 2135-2141 (1995).
- Forstermann, U., et al. Nitric oxide synthase isozymes. Characterization, purification, molecular cloning, and functions. Hypertension. 23, 1121-1131 (1994).
- Gardiner, S. M., Compton, A. M., Bennett, T., Palmer, R. M., Moncada, S. Control of regional blood flow by endothelium-derived nitric oxide. Hypertension. 15, 486-492 (1990).
- Harris, R. A., Nishiyama, S. K., Wray, D. W., Richardson, R. S. Ultrasound assessment of flow-mediated dilation. Hypertension. 55, 1075-1085 (2010).
- Corretti, M. C., et al. Guidelines for the ultrasound assessment of endothelial-dependent flow-mediated vasodilation of the brachial artery: a report of the International Brachial Artery Reactivity Task Force. J Am Coll Cardiol. 39, 257-265 (2002).
- Celermajer, D. S., et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 340, 1111-1115 (1992).
- Niebauer, J., Cooke, J. P. Cardiovascular effects of exercise: role of endothelial shear stress. J Am Coll Cardiol. 28, 1652-1660 (1996).
- Sessa, W. C. eNOS at a glance. J Cell Sci. 117, 2427-2429 (2004).
- Wray, D. W., et al. Does brachial artery flow-mediated vasodilation provide a bioassay for NO?. Hypertension. 62, 345-351 (2013).
- Green, D. J., Dawson, E. A., Groenewoud, H. M., Jones, H., Thijssen, D. H. Is flow-mediated dilation nitric oxide mediated? A meta-analysis. Hypertension. 63, 376-382 (2014).
- Green, D. J., Jones, H., Thijssen, D., Cable, N. T., Atkinson, G. Flow-mediated dilation and cardiovascular event prediction: does nitric oxide matter?. Hypertension. 57, 363-369 (2011).
- Brevetti, G., Silvestro, A., Schiano, V., Chiariello, M. Endothelial dysfunction and cardiovascular risk prediction in peripheral arterial disease: additive value of flow-mediated dilation to ankle-brachial pressure index. Circulation. , 2093-2098 (2003).
- Gokce, N., et al. Predictive value of noninvasively determined endothelial dysfunction for long-term cardiovascular events in patients with peripheral vascular disease. J Am Coll Cardiol. 41, 1769-1775 (2003).
- National Research Council (U.S.). . Guide for the care and use of laboratory animals. , (2011).
- Alley, H., Owens, C. D., Gasper, W. J., Grenon, S. M. Ultrasound assessment of endothelial-dependent flow-mediated vasodilation of the brachial artery in clinical research. J Vis Exp. , e52070 (2014).
- Ghiadoni, L., et al. Assessment of flow-mediated dilation reproducibility: a nationwide multicenter study. J Hypertension. 30, 1399-1405 (2012).
- Thijssen, D. H., et al. Heterogeneity in conduit artery function in humans: impact of arterial size. Am J Physiol Heart Circ. 295, H1927-H1934 (2008).
- Green, D. J., et al. Why isn't flow-mediated dilation enhanced in athletes?. Med Sci Sports. 45, 75-82 (2013).
- Heiss, C., et al. In vivo measurement of flow-mediated vasodilation in living rats using high-resolution ultrasound. Am J Physiol Heart Circ. 294, H1086-H1093 (2008).
- Chen, Q., et al. Pharmacological inhibition of S-nitrosoglutathione reductase improves endothelial vasodilatory function in rats in vivo. J Appl Physiol. 114, 752-760 (2013).
- Pinnamaneni, K., et al. Brief exposure to secondhand smoke reversibly impairs endothelial vasodilatory function. Nicotine Tob Res. 16, 584-590 (2014).
- Liu, J., et al. Impairment of Endothelial Function by Little Cigar Secondhand Smoke. Tob Regul Sci. 2, 56-63 (2016).
- Schuler, D., et al. Measurement of endothelium-dependent vasodilation in mice--brief report. Arterioscler Thromb Vasc Biol. 34, 2651-2657 (2014).
- Erkens, R., et al. Left ventricular diastolic dysfunction in Nrf2 knock out mice is associated with cardiac hypertrophy, decreased expression of SERCA2a, and preserved endothelial function. Free Radic Biol Med. 89, 906-917 (2015).
- Harris, S. A., Billmeyer, E. R., Robinson, M. A. Evaluation of repeated measurements of radon-222 concentrations in well water sampled from bedrock aquifers of the Piedmont near Richmond, Virginia, USA: : effects of lithology and well characteristics. Environmental research. 101, 323-333 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon