Method Article
Basato su morfologia distinzione tra sano e patologico delle cellule utilizzando trasformazioni di Fourier e Self-Organizing Maps
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, forniamo un flusso di lavoro che permette l'identificazione delle cellule sane e patologiche, basato sulla loro forma 3-dimensionale. Descriviamo il processo di utilizzo di contorni di proiezione 2D basati sulle superfici 3D per formare una mappa di self-organizing che fornirà clustering oggettiva delle popolazioni cellulari studiati.
Abstract
L'aspetto e i movimenti delle cellule immuni sono guidati dal loro ambiente. Come reazione a un'invasione di patogeni, le cellule immunitarie sono reclutate nel sito di infiammazione e vengono attivate per impedire un ulteriore diffusione dell'invasione. Questo si riflette anche dai cambiamenti del comportamento e l'apparenza morfologica delle cellule immunitarie. Nel tessuto cancerogeno, cambiamenti morphokinetic simili sono stati osservati nel comportamento delle cellule microgliali: intra-tumorali microglia hanno meno complesse forme 3-dimensionale, avendo meno ramificata processi cellulari e spostare più rapidamente di quelli in buona salute tessuto. L'esame di tali proprietà morphokinetic richiede tecniche di microscopia 3D complessa, che possono essere estremamente impegnativi quando eseguito longitudinalmente. Pertanto, la registrazione di una forma 3D statica di una cella è molto più semplice, perché questo non richiede misure videomicroscopia e può essere eseguito su tessuto asportato pure. Tuttavia, è indispensabile possedere strumenti di analisi che consentono la rapida e precisa descrizione delle forme 3D e permette l'inquadramento diagnostico dei campioni di tessuto sano e patogeni basato esclusivamente su informazioni statiche, correlati alla forma. Qui, presentiamo un toolkit che analizza i componenti di Fourier discreti del contorno di una serie di proiezioni 2D del 3D cella superfici tramite self-organizing Maps. L'applicazione di metodi di intelligenza artificiale permette nostro framework per ulteriori informazioni sulle varie forme di cella come viene applicato a più campioni di tessuto, mentre il flusso di lavoro rimane semplice.
Introduzione
Determinazione puntuale, semplice e precisa dello stato patologico del tessuto biologico è del più alto interesse nella ricerca biomedica. Modelli murini forniscono i mezzi per studiare una gamma di condizioni patologiche, come le reazioni immuni o lo sviluppo del cancro, in combinazione con complessi 3D e tecniche di microscopia 4D (3 dimensioni spaziali e tempo). Gli studi di microscopia possono essere eseguita tramite intravital o tessuto asportato 2-fotone microscopia, microscopia a luce-foglio e - fino a una profondità limitata di tessuto di circa 100 µm-mediante microscopia confocale. Per avere informazioni relative all'ora sul comportamento delle cellule in condizioni fisiologiche o patologiche, è necessario monitorare il tessuto per un periodo prolungato di tempo, che richiede solitamente videomicroscopia imaging1,2 . Naturalmente, l'applicabilità di questa tecnica è limitata a modelli animali a causa della sua invasività. Tecniche non-invasive sono disponibili anche per applicazioni sull'uomo, tra cui una varietà di metodi di tomografia (MSOT, CT, ecc.), ma tutti questi metodi mancano il necessario spaziale - e spesso-risoluzione temporale per lo studio di comportamento a livello cellulare.
Informazioni statiche per quanto riguarda l'aspetto delle cellule possono essere più facilmente accessibili tramite 3D varie tecniche di imaging eseguiti su asportato campioni di tessuto. Qui, il comportamento cinetico delle cellule non è misurato, così è necessario adottare tecniche di analisi romanzo che sono in grado di determinare lo stato di patogeno delle cellule esaminate basato esclusivamente sulla loro morfologia3. Tale approccio è stato utilizzato per collegare le forme delle cellule e del tessuto texture al comportamento patologico4,5,6.
Nella nuova tecnica descritta qui, le cellule sono ricostruite come superfici 3D e le loro forme sono caratterizzate tramite proiezioni 3D a 2D e successivi basati su Fourier periferia-forma analisi7,8. Riducendo le dimensioni da 3 a 2, il problema è semplificato. È anche possibile caratterizzare le superfici delle cellule in 3D applicando analisi armoniche sferiche, come è stato fatto per immagini mediche9. Tuttavia, le armoniche sferiche non gestiscono forme nitide e robusti bene, che richiedono una griglia multi-scala devono essere istituiti sulla sfera unitaria. Inoltre, il numero di componenti necessari armoniche sferiche possa essere grandi (50-70), con i calcoli sottostanti molto esigente e i risultati difficili da interpretare10,11,12.
Con il nostro metodo recentemente proposto, l'attività è ridotta a una serie di descrizioni delle forme 2D, dove il numero delle proiezioni 2D è fino all'analista e può essere registrato secondo la complessità della forma 3D. Le proiezioni vengono generate automaticamente tramite uno script Python che viene eseguito all'interno di uno strumento di animazione 3D. Le proiezioni 2D sono descritti da componenti discreti Fourier transform (DFT) della loro periferia, calcolato da un plugin di13 Isole Figi che è fornito qui come parte del nostro pacchetto software. La DFT è applicata qui per scomporre la complessa struttura della cella in una serie di funzioni sin e cos. In questo modo, possiamo descrivere il contorno con un numero relativamente piccolo di componenti DFT, riducendo così la complessità del problema (per ulteriori dettagli vedere sezione equazioni). I componenti DFT sono messi in una mappa di self-organizing addestrato (SOM14), dove l'esistenza della forma cluster possono essere oggettivamente testato8. SOMs fornire uno strumento di apprendimento competitivo e non supervisionato dal campo dell'intelligenza artificiale. Sono costituiti da una matrice collegata di neuroni artificiali che comunicano tra loro tramite una funzione di distanza quartiere ponderata. Il sistema di un neurone risponde al primo elemento del set di dati input e il cui risposta è il più forte di neuroni sono "raggruppati" più vicino a vicenda. Come il sistema neurale riceve più ingresso, neuroni di dati che ripetutamente rispondono fortemente iniziano a formare cluster ben definito all'interno del sistema. Dopo un adeguato addestramento su un dataset di grandi dimensioni che contiene informazioni sulla forma 2D nella forma di un insieme di componenti DFT, componenti di ogni singola cella DFT possono essere messo nel SOM addestrato e rivelano se la cella probabile appartiene al sani o al gruppo di cellula patogeni. Ci aspettiamo che tale strumento per diventare una grande aggiunta ai metodi di diagnostica scientifica e clinica.
Protocollo
1. protocollo requisiti
- Ottenere dati ad alta risoluzione Quantificaizone tridimensionale (3D) microscopia deconvoluti in conformità con il criterio di Nyquist con un intervallo di campionamento almeno due volte il più alta frequenza spaziale dell'esemplare per ottenere un'immagine ad alta risoluzione.
- Utilizzare software di rendering 3D per la ricostruzione della superficie e l'esportazione.
- Utilizzare software di animazione 3D in grado di eseguire script Python (lo script Python può essere scaricato dal repository su github: https://github.com/zcseresn/ShapeAnalysis) per creare proiezioni 2D.
- Utilizzare Fiji13 di proiezioni 2D di analizzare ed estrarre i componenti DFT.
- Utilizzare l'attuale distribuzione di Fiji. Se esiste già una versione installata di Fiji, assicurarsi che la versione installata è la più recente. Questo può essere facilmente ottenuto eseguendo la Guida | Opzione di aggiornamento .
- Utilizzare la Active Contour plugin15, che può essere scaricato da http://imagejdocu.tudor.lu/doku.php?id=plugin:segmentation:active_contour:start e devono essere copiati nella cartella plugins.
- Scarica il plugin di ombra Fiji dal repository su github e copia nella cartella plugins.
- Utilizzare software di matematica computazionale in grado di calcolare self-organizing Maps.
2. ricostruire l'immagine in 3D.
Nota: Per scopi di test, viene fornito un set di dati di esempio nel repository su github (Vedi sopra).
- Avviare il software di ricostruzione 3D e aprire i dati dell'immagine 3D.
- Creare una superficie 3D di oggetti (tutti).
- Selezionare l'opzione di vista 3D e fare clic su superfici. Fare clic sul pulsante Avanti (cerchio blu con un triangolo bianco) per procedere con la procedura guidata di creazione della superficie.
- Selezionare il canale di immagine per la ricostruzione della superficie.
- Applicare una funzione di smussatura per evitare superfici porose.
- Scegliere un valore levigante che non nasconde i dettagli della superficie ma evita superfici porose.
- Selezionare un metodo di Sogliatura per trovare le superfici.
- Utilizzare una soglia di intensità assoluta quando gli oggetti sono ben separati dallo sfondo e hanno un livello di circa uniforme della luminosità.
- Applica una soglia di contrasto locale quando gli oggetti variano nella loro intensità, ma possono ancora essere separati dallo sfondo locale e dagli altri oggetti che li circondano. Impostare l'area di ricerca di soglia locale in base al valore del diametro previsto di oggetti ricostruiti.
- Filtrare le superfici ricostruite secondo parametri morfologici di interesse, ad esempio, volume, sfericità, rapporto superficie / volume, ecc.e finire la ricostruzione della superficie.
- Salvare ed esportare le superfici generate in un formato che è compatibile con il software di animazione 3D che verrà utilizzato nel passaggio successivo.
3. trasformazione 3D ricostruito superfici nelle proiezioni 2D
- Avviare Blender e vai alla scheda di output nella finestra di destra. Selezionare il formato TIFF dal menu a discesa e impostare la profondità di colore a 8 bit RGBA.
- Passare in modalità di Scripting e aprire il file di script fornito "GUI_AutoRotate.py" dal repository fornito con questo lavoro (https://github.com/zcseresn/ShapeAnalysis).
- Fare clic su Eseguire Script. Scegliere la cartella dei file wrl quando richiesto per l'input.
- Se necessario, creare più rotazioni quando si lavora con superfici più complesse: Vai alla GUI e impostare la casella rotazioni su un valore superiore a 6.
Nota: Una rotazione di 6 diverse angolazioni possa essere sufficiente per distinguere le popolazioni differenti delle cellule. Non è consigliabile creare meno di sei rotazioni per superficie, a causa della potenziale perdita di informazioni. - Eseguire lo script facendo clic sul pulsante ruota nella GUI. Salvare le proiezioni delle singole superfici nella stessa cartella in cui è stata utilizzata come la cartella di input (punto 2.3). Per impostazione predefinita, le immagini vengono salvate in un Tiff a 8 bit formato (Vedi punto 2.1), che è il formato richiesto dal plugin Fiji ombra.
4. trovare la periferia e calcolare i componenti di Fourier utilizzando Fiji.
- Aprire Fiji e selezionare ombra nel menu Plugins. Iniziare con i valori predefiniti e ottimizzare i parametri più tardi. Fare clic su OK quando si è pronti per eseguire il programma.
- Scegliere un valore di Soglia di gradiente per la soglia dell'immagine in ingresso.
- Scegliere il numero di iterazioni. Maggiore è il valore Numero di iterazioni , più precisa la ricostruzione della periferia. Per le forme più semplici, un numero più basso è solitamente sufficiente.
- Utilizzare il parametro Numero di dilatazioni per determinare quanto più grande la maschera iniziale viene confrontata con la cella reale. Di solito forme più complesse bisogno ulteriori passaggi di dilatazione per individuazione corretta periferia.
- Seleziona la casella Sfondo scuro se sagome proiettate sono più luminosi rispetto allo sfondo.
- Attivare la casella di controllo Visualizza i risultati intermedi solo quando si utilizza un dataset di piccolo test per determinare le prestazioni di ombra. Attivando questa opzione per i più grandi dataset abbassa l'efficienza computazionale e possibilmente potrebbe fermare un sistema con memoria video insufficiente.
- Seleziona la casella Salva risultato tabelle per utilizzare i risultati dell'ombra come input per il passaggio 5. Se la casella è selezionata, tutti i risultati vengono salvati in file csv individuali. Una sintesi dei dati di output viene sempre generata in un file chiamato "Result_collection_of_all_DFT_calculations.csv".
- Selezionare la cartella di dati di input che contiene i file TIFF sono stati creati nel passaggio 3.
- Fornire la cartella di dati di output.
- Fare clic su OK per avviare il plugin.
5. Self-Organizing Maps
Nota: SOM reti sono solo in grado di classificare i dati quando sono addestrati su un dataset di grandi dimensioni che contiene input da tutti i tipi di cella prevista e le condizioni. A scopo dimostrativo, un set di dati è disponibile e può essere trovato nel nostro archivio elettronico ("AllCells_summary_normalised.csv" da https://github.com/zcseresn/ShapeAnalysis
- Segui queste linee guida, se non esiste nessun SOM addestrato disponibile ancora per i dati di input; in caso contrario, procedere al punto 5.2.
- Avviare un software di matematico computazionale in grado di eseguire classificazioni di rete neurale.
- Selezionare un file di dati da utilizzare per la formazione della rete SOM. Questo set di dati deve contenere tutte le condizioni sperimentali allo scopo di formare il SOM sui tipi di cellule particolari e condizioni sperimentali.
Nota: È anche possibile utilizzare il AllCells_summary_normalised.csv fornito per testare il sistema. - Cominciare con l'allenamento e aspettare che la formazione è completata prima di procedere. Per impostazione predefinita, lo script è impostato per eseguire iterazioni 2000 ("epoche").
Nota: Il numero di iterazioni dipende il tasso di apprendimento del SOM. Secondo i dati di input si consiglia di testare sia superiore che inferiore numero di epoche e osservare la stabilità del modello del SOM. Quando si utilizza lo script fornito, il numero di iterazioni può essere cambiato sotto la linea 32. La dimensione di rete può essere cambiata in linea 34 (di default che è impostato a 12 di 12). - Dopo avere completato l'addestramento, esaminare la topologia della rete (Distanze neighbor, ingresso aerei, campione hits, ecc.). La rete ora è addestrata e possa essere salvata per un utilizzo futuro.
- Caricare in SOM, quando si utilizza una mappa già addestrata (questo può venire da 5.1 passaggio o da altre fonti) al fine di un set di dati del cluster.
- Importare il file CSV che deve essere testato con il precaricato som addestrato. Selezionare l'output csv del Plugin ombra dal passaggio 4 quando si utilizzano dati preparati dal plugin ombra.
Nota: È anche possibile utilizzare i file di dati di esempio "InteractingCells_summary_normalised.csv", "MobileCells_summary_normalised.csv" o "PhagocytosingCells_summary_normalised.csv" che vengono forniti tramite github. - Al termine della classificazione, valutare i risultati del SOM come descritto al punto 5.1.5.
- Esaminare il hitmap generato dal file csv. Ogni cella della mappa indica quante volte il dataset "colpisce" quel particolare cella del som addestrato. Quando un gruppo di celle sono raggruppati in una piccola area di questa mappa, ciò indica che il dataset è abbastanza omogeneo. Più cluster indicherà l'esistano di sottogruppi probabile nel dataset.
- Esaminare le distanze del peso di quartiere. Aree di questa mappa che sono ben separati corrispondano a gruppi di oggetti che si comportano in modo molto diverso dal punto di vista di SOM. Con componenti DFT come dati di input, questo significa che questi gruppi di cellule hanno forme molto dissimili delle corrispondenti superfici 3D.
- Esaminare i piani di peso per informazioni sul contributo di ogni elemento del vettore caratteristica. In caso di utilizzo, i componenti DFT 20 come descritto in precedenza, 19 mappe apparirà qui. Quando si utilizza il set di dati di esempio forniti, i primi 5 o 6 piani di peso sarà diversi, ma il resto di loro apparirà abbastanza simile. In questo caso si può concludere che sarebbe stato sufficiente utilizzare circa 7 componenti DFT.
- Importare il file CSV che deve essere testato con il precaricato som addestrato. Selezionare l'output csv del Plugin ombra dal passaggio 4 quando si utilizzano dati preparati dal plugin ombra.
Risultati
Abbiamo applicato una DFT per calcolare i componenti principali della forma corrispondente per le proiezioni di cella. I descrittori di Fourier sono stati ottenuti applicando l'algoritmo DFT per le coppie di coordinate xy della periferia attrezzata delle proiezioni delle cellule, ottenute come output della parte AbSnake del nostro flusso di lavoro. Queste coppie di xycoordinate possono essere gestite come una "g" a valori complessi vettoriale 2D: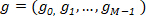
Dal vettore "g", utilizziamo DFT per calcolare lo spettro di Fourier valori complessi: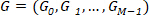
Basato su formule ben note lo spettro di Fourier discreto, e usando l'etichettatura del numero complesso di "g" come: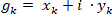
Otteniamo: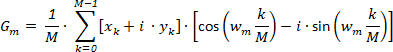 (1)
(1)
Possiamo calcolare la reale ("A") e le parti immaginarie ("B") 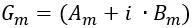 :
: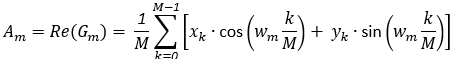 (2)
(2)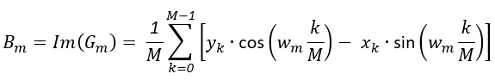 (3)
(3)
Qui, il primo DFT componente G0 corrisponde a m = 0, che dà: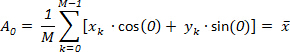 (4)
(4)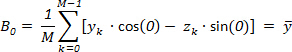 (5)
(5)
Di conseguenza, questo componente viene descritto il centro geometrico dell'oggetto originale.
Il secondo elemento dello spettro avanti DFT, G1, corrisponde a m = 1: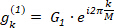
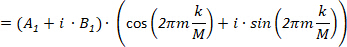 (6)
(6)
Da Eq.6 Concludiamo che questi punti formano un cerchio con un raggio di 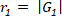 e angolo iniziale
e angolo iniziale 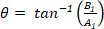 , dove il cerchio descrive un giro completo, mentre la forma è tracciata una volta. Il centro del cerchio si trova all'origine (0, 0), il raggio è | G1| ed è il punto di partenza:
, dove il cerchio descrive un giro completo, mentre la forma è tracciata una volta. Il centro del cerchio si trova all'origine (0, 0), il raggio è | G1| ed è il punto di partenza:
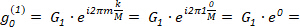
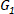 (7)
(7)
In generale, per un singolo coefficiente di Fourier 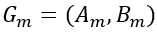 , le coordinate sono descritti come:
, le coordinate sono descritti come:
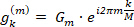
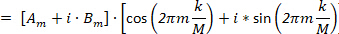 (8)
(8)
Analogamente a Eq.6, l'Eq.8 descrive un cerchio, ma con un raggio di Rm= | Gm|, un angolo di partenza 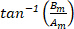 e un punto di partenza al
e un punto di partenza al 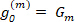 , dove il contorno è tracciato una volta mentre il cerchio viene eseguito attraverso la "m" completo orbite16,17.
, dove il contorno è tracciato una volta mentre il cerchio viene eseguito attraverso la "m" completo orbite16,17.
Parametri di forma come input SOM
Il flusso di lavoro, come descritto in Figura 1, è stato applicato a un Quantificaizone (utilizzando una funzione di diffusione punto misurato) dataset videomicroscopia multi-fotone microscopia di cellule microgliali di caratterizzare i cambiamenti morfologici nel sano o cancerose corticali tessuto18. Venti componenti DFT sono stati calcolati per ogni proiezione 2D delle superfici 3D ricostruite e i risultati sono stati utilizzati come input per la formazione di SOM. In condizioni fisiologiche, la microglia ha presentato una forma piuttosto complessa con il multiplo, molto ramificato processi (Figura 2a). Quando inserito in un ambiente canceroso (modello corticale del tumore), la microglia ha cambiato a una forma più semplice, più simile a mandrino (Figura 2b).
Il modello SOM addestrato è stato testato per valutare la sua capacità di distinguere tra cellule sane e tumorali. La popolazione delle cellule sane è stata proiettata su una singola area del SOM (Figura 2C). Il modello SOM ha risposto al dataset microglia cancerose con una regione attiva a forma di manubrio (figura 2d). Un insieme di dati input ciecamente misto che hanno consistito delle componenti forma DFT da sia il sano e il gruppo canceroso è stato proiettato dal SOM in due gruppi distinti, pur mantenendo la forma dei loro singoli contorni simili a quelli dei gruppi separati ( Figura 2e; Confronta con 2C e 2d). Si può concludere che il dataset misto è stata correttamente cluster dal modello SOM.
Abbiamo testato la performance del modello SOM confrontando le sue proiezioni con l'analisi manuale degli stessi dati da un medico esperto, che classificati il dataset in base al loro comportamento spazio-temporali. L'esperto individuato quattro gruppi distinti delle cellule (cellule quiescenti, phagocytosing cellule, cellule interagenti e cellule mobili18), che sono stati ricostruiti e usati per addestrare un 12 x 12 som La rete addestrata (Figura 3a) Mostra gruppi di neuroni artificiali di alti hit-valore, soprattutto in basso a sinistra e le zone centrali del SOM. La risposta della rete addestrata è stata testata anche con quattro sottoinsiemi selezionati in modo casuale (che non facevano parte del training dataset) delle immagini da quattro diversi gruppi identificati da esperti18. Questi sottoinsiemi di immagine ha provocato quattro risposte ben definite da SOM, come mostrato nella Figura 3b. Le cellule quiescenti esibiscono la forma più complessa e ha mostrato il più alto livello di separazione all'interno della rete neurale (Figura 3b pannello di "riposo"). Gli altri tre tipi di cella identificata ha condiviso uno spazio comune di SOM in basso a sinistra, ma in caso contrario sono stati separati dal modello SOM. Nell'angolo inferiore sinistro zona SOM così corrisponde ai valori DFT di basso-indice.
La robustezza dell'approccio SOM è stata testata utilizzando il SOM addestrato con tre sottoinsiemi casuale dello stesso - riposo - cell tipo (non fa parte del set di dati di formazione). La risposta della SOM a questo ingresso esibisce una risposta molto simile (Figura 3C, sottoinsiemi 1-3), che dimostra la robustezza del nostro approccio.
Cambiamenti di forma del tempo-dipendente delle cellule sono proprio caratterizzati dalla DFT
Al fine di esaminare l'effetto dei cambiamenti di tempo-dipendenti della forma delle cellule sui componenti DFT, uno a tre celle per sottogruppo (Vedi Figura 3b) sono stata monitorate per intervalli di tempo di 13 a 28. La figura 4 Mostra il primo DFT di dieci componenti di una cella mobile (Figura 4a) e una cella interagente (Figura 4b), che sono state tracciate in funzione del tempo. La cella mobile esibisce una forma definitivamente alterando (Vedi Video supplementari 4 a 8), che viene riflessa da una superficie più ruvida di DFT. Le raffiche di ampiezza DFT nel primo terzo del corso tempo per la cella interagente coincidono con i cambiamenti di forma cellulare veloce e vasto come illustrato nella complementare Video 5 in 8.
Il corso di tempo di tutti i componenti DFT 19 è stato anche caratterizzato per queste due cellule in tre momenti distinti durante il rilevamento di una cella mobile (Figura 5a) e di una cella interagente (Figura 5b). Gli assi perpendicolari rappresentano dichiara gli angoli di sei rotazione e indicano che tutte le proiezioni sono ugualmente importanti per la caratterizzazione della forma per entrambi i tipi cellulari.
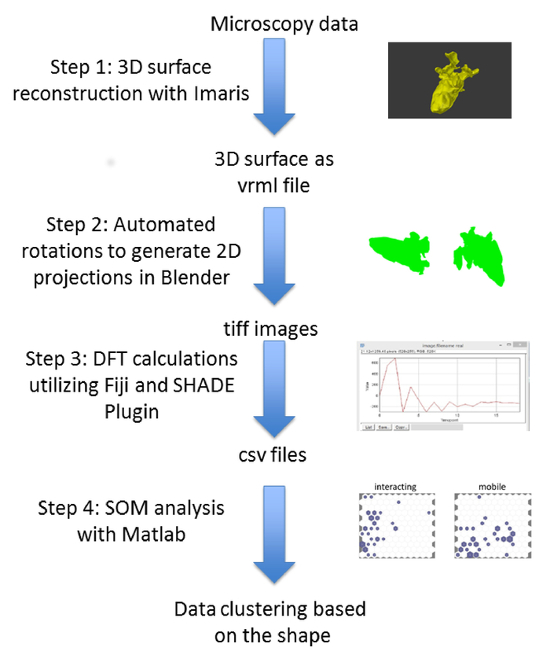
Figura 1. Passo dopo passo il flusso di lavoro del trattamento dei dati per identificare la cella di clustering basato sulla forma delle cellule. Superfici ricostruite in 3D sono state utilizzate come input per Blender per le proiezioni 3D a 2D automatizzate. La periferia di ogni proiezione è stata individuata e i componenti DFT sono stati calcolati. I componenti serviti come input di un SOM addestrato in Matlab, o di formare un nuovo som Clicca qui per visualizzare una versione più grande di questa figura.
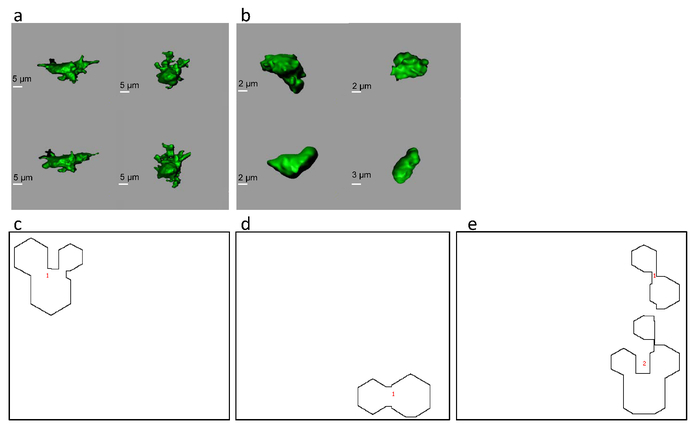
Figura 2. Tipico aspetto delle cellule di microglia corticali del topo in condizioni di controllo (a) e nel tessuto cancerogeno (b) screenshot per superfici di microglia ricostruito. Proiezioni di SOM sono state create da tre gruppi di microglia campioni dalla corteccia del mouse: controllare le cellule (non-tumorale) (c), le cellule del tumore (d) e una popolazione mista di cellule (e). Questa figura è stata modificata con autorizzazione8. Clicca qui per visualizzare una versione più grande di questa figura.
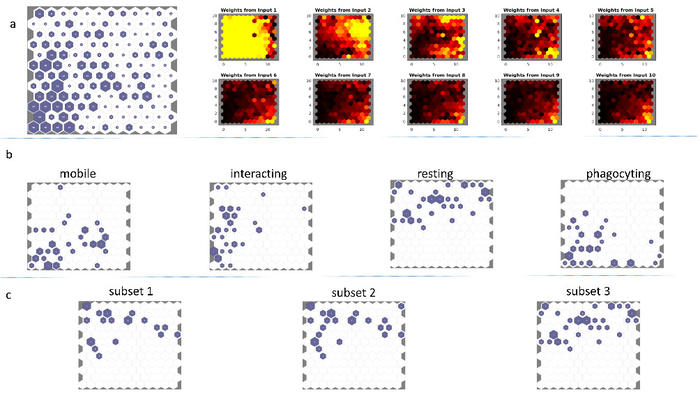
Figura 3. (a, a sinistra) Self-Organizing Map di un dataset di microglia del mouse composto da 768 vettori di feature input. Il dataset è stato utilizzato per addestrare una rete neurale artificiale 12x12, utilizzando la geometria esagonale quartiere, inizializzazione casuale e 2000 epoche. (una, a destra) Il modello SOM corrispondente ingresso aerei dei primi 10 componenti DFT (b) le risposte di SOM raffigurato (a), a un VRML file sottoinsieme casuale ogni dai tipi di quattro cella "mobili", "interazione", "riposo" e "fagocitiche" come descritto nella prima Figura 5 della Bayerl et al. 18. (c) la risposta della SOM stesso come in (a, a sinistra) a tre sottoinsiemi casuale dell'intero dataset (che quindi non facevano parte del training dataset) delle "cellule quiescenti"-digitare superfici 3D. La somiglianza tra le tre risposte è notevole. Questa figura è stata modificata con autorizzazione8. Clicca qui per visualizzare una versione più grande di questa figura.
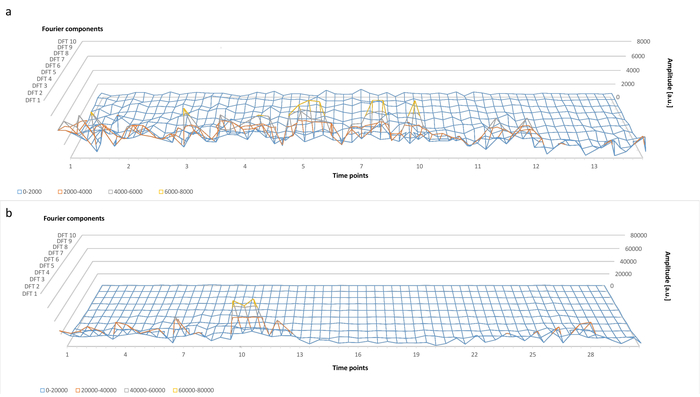
Figura 4. (a) dipendenza di tempo dei primi 10 componenti DFT durante un esperimento di imaging videomicroscopia di microglia del mouse. Questo pannello mostra i dati per una cella di tipo "Mobile Cells". L'asse x corrisponde a punti di tempo dell'esperimento a 60 s tempo di risoluzione, l'asse y indica l'ampiezza delle componenti DFT in unità arbitrarie (UA), mentre l'asse z corrisponde al componente DFT da 1 a 10. (b) come in (a), ma per una cella delle "Cellule interagendo" digitare. Questa figura è stata modificata con autorizzazione8. Clicca qui per visualizzare una versione più grande di questa figura.
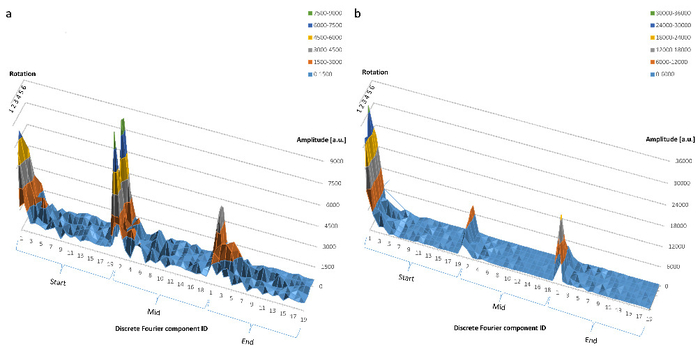
Figura 5. (a) il comportamento di tutti i componenti DFT 19 di una cella di tipo "Mobile cellule" all'inizio, a metà e alla fine dell'esperimento. I numeri sull'asse x corrispondono all'ID di componente DFT da 1 a 19. L'asse y indica l'ampiezza di componente DFT in unità arbitrarie (UA), mentre il z-asse segna sei angoli di rotazione casuale. (b) dello stesso come in (a), ma per una cella delle "Cellule interagendo" tipo. Questa figura è stata modificata con autorizzazione8. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'identificazione di condizioni potenzialmente patologiche utilizzando campioni di tessuto intatto, piccolo è di grande importanza. Tali tecniche assicurano una risposta tempestiva ai tipi aggressivi di cancro e malattie infettive. Le risposte morfologiche e cinetiche di varie cellule del sistema immunitario, per esempio, microglia e macrofagi sono caratteristici della risposta immunitaria del corpo. Anche se nella maggior parte dei casi non è pratico o anche possibile monitorare il comportamento cinetico di queste cellule, è abbastanza semplice per acquisire immagini 3-dimensionale per recuperare la loro forma. In genere, le cellule immuni assumono una forma complessa in tessuto sano e una forma molto più semplice sotto condizioni infiammata o cancerose18. Mentre le caratteristiche tempo-dipendente di tale cambiamento di forma vorrei aggiungere alla nostra comprensione dello sviluppo della risposta immunitaria, utilizzando solo la forma 3D di un gruppo rappresentativo delle cellule può anche essere sufficiente per determinare la natura sana o patologica del tessuto.
Che caratterizzano la superficie 3-dimensionale di una cella non è un compito semplice. L'applicazione di armoniche sferiche è un modo per rappresentare una superficie 3D con un numero relativamente elevato (50-70) di componenti11,12. Inoltre, determinare le armoniche sferiche è computazionalmente costoso; proiezione di forme molto complesse sulla sfera unitaria è impossibile o molto difficile a causa della necessità di applicare più griglie di finezza vari sulla sfera unità; Infine, l'interpretazione significativa degli spettri delle componenti armoniche sferiche è lungi dall'essere banale.
Nel nostro lavoro qui presentato, sostituiamo il difficile compito di analisi di superficie 3D diretta con l'approccio molto più semplice dell'utilizzo di proiezioni 2D della superficie originale per ottenere sufficienti informazioni morfologiche per identificare condizioni patologiche. Abbiamo dimostrato ogni passo di questo flusso di lavoro utilizzando la microscopia 3D dati dalle cellule mieloidi, mentre chiaramente sottolineando che tutti i passaggi erano semplici da completare e le mappe 2-dimensionale risultante erano facili da interpretare.
Naturalmente, una proiezione 3D a 2D porterà alla perdita di informazioni circa la struttura della superficie. Nel nostro esempio dataset di microglia in un modello di tumore corticali di topo, era sufficiente usare sei angoli quando si creano le proiezioni 2D. Tuttavia, forme più complesse, o i cambiamenti morfologici meno prominenti possono richiedere che un maggior numero di proiezioni è creato in modo da essere in grado di identificare in modo affidabile i sottogruppi di cellule con la SOM. Per questo motivo, il nostro approccio è progettato per essere in grado di generare e analizzare qualsiasi numero di proiezioni. Semplicemente scegliendo un numero maggiore di proiezioni per forme più complesse, è possibile scalare la perdita di informazioni al minimo tollerabile. Ad esempio, il tipo di cella interagenti in Figura 4a e 4b richiederebbe un numero maggiore di proiezioni al fine di rappresentare correttamente la superficie complessa.
Come qualsiasi metodo approssimativo, il flusso di lavoro con la presente proposta ha dovuto essere testato contro i risultati di un processo di classificazione manuale di microglia18. I risultati presentati in precedenza confermano l'affidabilità del flusso di lavoro automatizzato. Inoltre, il flusso di lavoro è più tempo efficiente rispetto alle analisi convenzionale. Il perito medico che classificati manualmente le cellule di microglia necessarie circa 4 settimane per la sua analisi del set di dati, considerando il nostro flusso di lavoro necessari solo circa 1 giorno. La robustezza del nostro approccio è stata dimostrata chiaramente anche dalla riproducibilità del SOM addestrato per un sottoinsieme di dati che appartenevano allo stesso tipo cellulare, ma non è stati utilizzati per addestrare il SOM, come mostrato nella Figura 3 c.
Anche se il nostro approccio non ha considerato informazioni cinetiche, abbiamo esaminato l'effetto di temporizzazione sull'analisi basate su DFT forma. L'esempio più tipico per comportamento tempo-dipendente è stata trovata fra la popolazione delle cellule mobili, dove il contributo da componenti di DFT indicizzate superiore era chiaramente osservabile, come in Figura 4a. Questo richiama l'attenzione sull'importanza di utilizzare un numero sufficientemente elevato di DFT componenti quando si tratta di tipi di cellule che sono in grado di comportarsi in un modo molto tempo-dipendente. A causa della natura automatizzata e l'elevata velocità di esecuzione dei nostri strumenti software, l'aumento del numero di componenti DFT e proiezioni aumenterà la precisione e l'affidabilità dei risultati, mentre essi non ostacolerà sensibilmente le prestazioni di elaborazione.
Divulgazioni
Gli autori dichiarano di non avere nessun concorrenti interessi finanziari.
Riconoscimenti
Gli autori ringraziano Benjamin Krause per la proficua discussione ed il suo supporto. Gli autori hanno ulteriormente ringraziano Robert Günther per la sua assistenza con la microscopia di cellule vive.
Il lavoro è stato supportato dal contributo finanziario DFG NI1167/3-1 (JIMI) di R.N. e Z.C., DFG finanziaria supporto CRC 1278 PolyTarget progetto Z01 per Z.C., C01 in TRR130 R.N. e SFB633, TRR130, Exc257 a A.E.H. e j.b.s. Il BfR fornito supporto intramurale SFP1322-642 per F.L.K e A.L.
Materiali
| Name | Company | Catalog Number | Comments |
| Imaris 9.1.2, software | Bitplane, Zürich, Switzerland | v.9.1.2 | 3D image reconstruction and surface generation; this was used by us! |
| Blender 2.75a, software | https://www.blender.org/ | v.2.75a | 3D and 4D open source animation software; 2.75a is the required version for this Python |
| Fiji /ImageJ, software | https://fiji.sc/ | ImageJ v.1.52b | Open source multi-D image analysis toolkit |
| MATLAB | MathWorks, www.mathworks.com | R2017b | General computational mathematical software |
| MATLAB Machine Learning kit | MathWorks, www.mathworks.com | R2017b | Can only be used together with MATLAB |
| Fiji plugins: SHADE | https://github.com/zcseresn/ShapeAnalysis | v.1.0 | |
| Fiji plugins: ActiveContour | http://imagejdocu.tudor.lu/doku.php? id=plugin:segmentation:active_contour:start | absnake2 | |
| Computer | Any | NA | See Imaris instructions for minimum computer requirements |
Riferimenti
- Masedunskas, A., et al. Intravital microscopy: a practical guide on imaging intracellular structures in live animals. Bioarchitecture. 2 (5), 143-157 (2012).
- Niesner, R. A., Hauser, A. E. Recent advances in dynamic intravital multi-photon microscopy. Cytometry A. 79 (10), 789-798 (2011).
- Ho, S. Y., et al. NeurphologyJ: an automatic neuronal morphology quantification method and its application in pharmacological discovery. BMC Bioinformatics. 12, 230(2011).
- Yin, Z., et al. A screen for morphological complexity identifies regulators of switch-like transitions between discrete cell shapes. Nature Cell Biology. 15 (7), 860(2013).
- Yu, H. Y., Lim, K. P., Xiong, S. J., Tan, L. P., Shim, W. Functional Morphometric Analysis in Cellular Behaviors: Shape and Size Matter. Advanced Healthcare Materials. 2 (9), (2013).
- Johnson, G. R., Buck, T. E., Sullivan, D. P., Rohde, G. K., Murphy, R. F. Joint modeling of cell and nuclear shape variation. Molecular Biology of the Cell. 26 (22), 4046-4056 (2015).
- Wang, S. -H., Cheng, H., Phillips, P., Zhang, Y. -D. Multiple Sclerosis Identification Based on Fractional Fourier Entropy and a Modified Jaya Algorithm. Entropy. 20 (4), 254(2018).
- Kriegel, F. L., et al. Cell shape characterization and classification with discrete Fourier transforms and self-organizing maps. Cytometry Part A. 93 (3), 323-333 (2017).
- Styner, M., et al. Framework for the Statistical Shape Analysis of Brain Structures using SPHARM-PDM. Insight Journal. (1071), 242-250 (2006).
- El-Baz, A., et al. 3D shape analysis for early diagnosis of malignant lung nodules. Medical Image Computing and Computer Assisted Intervention. 14 (Pt 3), 175-182 (2011).
- Williams, E. L., El-Baz, A., Nitzken, M., Switala, A. E., Casanova, M. F. Spherical harmonic analysis of cortical complexity in autism and dyslexia. Translational Neuroscience. 3 (1), 36-40 (2012).
- Kruggel, F. Robust parametrization of brain surface meshes. Medical Image Analysis. 12 (3), 291-299 (2008).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Kohonen, T. Essentials of the self-organizing map. Neural Networks. 37, 52-65 (2013).
- Andrey, P., Boudier, T. Adaptive Active Contours. ImageJ user and developer conference. , Luxembourg. (2006).
- Burger, W., Burge, M. J. Principles of Digital Image Processing. , Springer-Verlag. (2013).
- Lestrel, P. E. Fourier Descriptors and their Applications in Biology. , Cambridge University Press. (2008).
- Bayerl, S. H., et al. Time lapse in vivo microscopy reveals distinct dynamics of microglia-tumor environment interactions-a new role for the tumor perivascular space as highway for trafficking microglia. Glia. 64 (7), 1210-1226 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon