Method Article
Studio della dinamica trascrizionale muscolare su scale di singole molecole in Drosophila
In questo articolo
Riepilogo
La Drosophila è un modello consolidato per lo studio di molecole chiave che regolano la miogenesi. Tuttavia, i metodi attuali sono insufficienti per determinare la dinamica trascrizionale dell'mRNA e la distribuzione spaziale all'interno dei sincizi. Per ovviare a questa limitazione, abbiamo ottimizzato un metodo di ibridazione in situ a fluorescenza dell'RNA che consente il rilevamento e la quantificazione degli mRNA su scala di singola molecola.
Abstract
I muscoli scheletrici sono grandi sincizi costituiti da molte miofibre raggruppate che producono forze e consentono il movimento del corpo. La Drosophila è un modello classico per studiare la biologia muscolare. La combinazione della genetica della Drosophila e di approcci omici avanzati ha portato all'identificazione di molecole chiave conservate che regolano la morfogenesi e la rigenerazione muscolare. Tuttavia, la dinamica trascrizionale di queste molecole e la distribuzione spaziale del loro RNA messaggero all'interno dei sincizi non possono essere valutate con metodi convenzionali. Qui abbiamo ottimizzato un metodo esistente di ibridazione in situ a fluorescenza di RNA a singola molecola (smFISH) per consentire il rilevamento e la quantificazione di singole molecole di mRNA all'interno dei muscoli del volo adulto e delle loro cellule staminali muscolari. Come prova di concetto, abbiamo analizzato l'espressione e la distribuzione dell'mRNA di due fattori di trascrizione evolutivamente conservati, Mef2 e Zfh1/Zeb. Mostriamo che questo metodo è in grado di rilevare e quantificare in modo efficiente singole molecole di mRNA per entrambi i trascritti nelle cellule precursori muscolari, nei muscoli adulti e nelle cellule staminali muscolari.
Introduzione
I muscoli scheletrici dell'adulto sono costituiti da miofibre multinucleate differenziate le cui proprietà contrattili generano movimenti. La crescita, il mantenimento e la rigenerazione muscolare si basano su progenitori muscolari e cellule staminali muscolari (MuSC) che vengono specificati durante lo sviluppo embrionale1. Il programma miogenico è finemente controllato da una serie di fattori di trascrizione miogenici (TF) (ad esempio, Pax3/7, MYOD, Mef2 e ZEB)2,3,4. Decifrare i meccanismi molecolari che regolano la biologia muscolare è importante per chiarire le questioni fondamentali relative alla miologia e per un possibile uso terapeutico nel trattamento delle malattie muscolo-degenerative.
La Drosophila ha una lunga storia come modello genetico per studiare la miogenesi5. Recentemente è emerso come un nuovo modello per studiare la rigenerazione muscolare 6,7,8. La struttura muscolare e i programmi miogenici di base sono altamente conservati tra mosche e mammiferi. Ad esempio, i TF Mef2 e Zfh1/ZEB hanno una funzione conservata nella regolazione dello sviluppo e della rigenerazione muscolare 3,9,10,11. I muscoli adulti della Drosophila, come i muscoli del volo indiretto (IFM), sono formati da una popolazione specifica di MuSC, noti come progenitori muscolari adulti (AMP)12. Questi AMP sono specificati durante l'embriogenesi e si associano a strutture epiteliali come i dischi delle ali e delle gambe. Durante gli stadi embrionali e larvali, gli AMP rimangono indifferenziati fino alla metamorfosi, quando si impegnano nella differenziazione e nella fusione per formare gli IFM13,14. Il TF Spalt major (spalt, salm) è espresso durante lo sviluppo muscolare del volo ed è necessario per determinarne l'identità strutturale15. Mef2 è un altro importante TF miogenico che è essenziale per la formazione muscolare adulta16,17. È espresso negli AMP e mantenuto negli IFM adulti10,18. Mentre la maggior parte degli AMP si differenzia in muscoli funzionali, un sottogruppo sfugge alla differenziazione e forma i MuSCadulti 11. Analogamente ai vertebrati, il TF Zfh1/ZEB è necessario per prevenire la differenziazione prematura dei MuSC adulti e per mantenere la loro staminalità 9,10.
È stato dimostrato che le dinamiche di espressione genica regolano vari processi biologici muscolari19,20. L'avvento di tecniche di sequenziamento dell'RNA a singola cellula e a singolo nucleo ad alto rendimento ha permesso un'esplorazione completa di queste dinamiche trascrizionali21,22. Una notevole limitazione di questi approcci è la loro incapacità di fornire la distribuzione spaziale delle molecole di mRNA nelle fibre muscolari multinucleate. Queste caratteristiche possono essere studiate mediante ibridazione in situ a fluorescenza a singola molecola (smFISH) che rivela due tipi di corpi di mRNA: 1. Le singole molecole di mRNA si diffondono nel citoplasma e rappresentano l'RNA maturo e 2. Un massimo di due focolai nucleari luminosi corrispondono al trascritto nascente e rivelano gli alleli trascrizionalmente attivi23. Pertanto, smFISH è un metodo di scelta per la quantificazione di singole molecole di mRNA, studiando la loro distribuzione spaziale e fornendo istantanee della dinamica trascrizionale del gene.
Il metodo smFISH si basa su una serie di brevi sonde a oligonucleotide fluorescenti specificamente progettate per essere complementari al trascritto target. Dopo la ricottura, genera sorgenti puntiformi ad alta intensità che consentono la rilevazione di mRNA a livello di singola molecola utilizzando la microscopia confocale24. Questo metodo è sempre più applicato per un'ampia varietà di tipi di cellule, compresi i tessuti muscolari dei mammiferi19,20. Tuttavia, in Drosophila, come in altri modelli animali, la maggior parte delle conoscenze sull'espressione genica del muscolo adulto deriva da saggi molecolari di massa, che mancano di informazioni quantitative sulla posizione spaziale delle molecole di mRNA. Qui abbiamo ottimizzato un metodo per l'esecuzione di smFISH su cellule precursori muscolari e muscoli adulti di Drosophila 23,25. Questo protocollo include una pipeline di analisi completamente automatizzata per la segmentazione dei nuclei e il conteggio e la localizzazione dell'mRNA.
Protocollo
1. Dissezione e preparazione del disco alare e del muscolo adulto
NOTA: Pulire il banco di dissezione e tutti gli strumenti di dissezione con una soluzione di inibitore dell'RNAsi (Tabella dei materiali). I guanti da laboratorio devono essere indossati durante l'intera procedura sperimentale.
- Disco alare
- Collocare le larve in stadio L3 in soluzione salina tamponata con fosfato (PBS) fredda 1x (Figura 1A).
- Sciacquare le larve 3 volte con 1x PBS e tenerle in questa soluzione per 5 minuti.
- Usando due paia di pinze affilate, tenere la larva dalla parte anteriore e tirare e scartare il resto dei tessuti del corpo (circa 2/3).
- Tenere sia il primo 1/3 della larva con un paio di pinze che i ganci della bocca con l'altro paio. Ritrarre i ganci della bocca all'interno della larva fino a quando non è completamente capovolta.
NOTA: Sezionare circa 30 larve per esperimento, per garantire un'adeguata dimensione del campione per l'analisi. - Si osservi che i dischi alari sono strettamente associati ai due rami primari delle trachee, che corrono lungo ciascun lato della larva.
- Rimuovere tutti gli altri componenti larvali (dischi delle zampe e cervello) per ottenere una carcassa larvale rovesciata pulita con un paio di dischi alari attaccati alla trachea (Figura 1B).
- Mettere i campioni in una provetta da centrifuga da 1 mL e fissarli in paraformaldeide (PFA) al 4% diluita in 1x PBS per 45 minuti a temperatura ambiente sotto agitazione.
NOTA: L'agitazione del campione è ottenuta da un agitatore oscillante (Tabella dei materiali). - Lavare i campioni 3 x 5 minuti con etanolo al 70% (EtOH, diluito in acqua priva di RNAsi) e conservarli nella stessa soluzione di lavaggio a 4 °C per almeno 2 giorni e fino a 1 settimana.
- Muscoli del volo indiretto
- Anestetizzare le mosche adulte su un tappetino CO2 e rimuovere la testa, l'addome, le zampe e le ali.
- Posizionare i torace sezionati in PBS 1x freddo e continuare a farlo fino a quando tutti i campioni non sono stati sezionati (Figura 1D).
- Prefissare i torace al 4% di PFA (1% Triton) per 20 minuti a temperatura ambiente sotto agitazione.
- Risciacquare i campioni 3 x 5 minuti con 1x soluzione di lavaggio PBT (1% Triton in 1x PBS).
- Posizionare i torace su un nastro biadesivo (Tabella dei materiali) su un vetrino e dividerli in due con una lama affilata per microtomo per produrre due emitorace (Figura 1E,F).
- Fissare i campioni in PFA al 4% (Tritone all'1%) per 45 minuti a temperatura ambiente sotto agitazione.
- Lavare 2 x 20 min con 1x soluzione di lavaggio PBT (1% Triton, 1x PBS) a temperatura ambiente sotto agitazione.
- Posizionare gli emitoraci in PBS 1x freddo e utilizzare la pinza per isolare delicatamente gli IFM dall'emitorace (Figura 1G).
NOTA: Per ottenere ciò, è importante rimuovere la cuticola il più accuratamente possibile. - Per permeabilizzare i campioni, conservare gli IFM isolati in una soluzione di EtOH al 70% per almeno 2 giorni e fino a 1 settimana a 4 °C.
NOTA: Isolare gli IFM da circa 10 torace per esperimento per garantire un'adeguata dimensione del campione per l'analisi.
2. Ibridazione, immunocolorazione e montaggio
NOTA: Una procedura di ibridazione simile viene applicata sia per i dischi alari che per i campioni IFM. È fondamentale isolare i dischi alari dalle carcasse larvali e metterli in 200 μL di tampone A prima di iniziare l'ibridazione.
- Risospendere le sonde in 400 μL di tampone TE (10 mM Tris-HCl, 1 mM EDTA, pH 8,0) per ottenere una soluzione madre finale di 12,5 μM.
- Trasferire i campioni in una provetta da centrifuga da 0,5 mL contenente il tampone A (Tabella dei materiali).
NOTA: Diminuendo il volume del contenitore, diventa più facile visualizzare i campioni ed evitare di perderli durante il processo di lavaggio. - Lavare i campioni 2 x 20 min con il tampone A.
- Aspirare il tampone A, sostituirlo con 400 μL del tampone di ibridazione (Tabella dei materiali) e preibridare i campioni per 30 minuti a 37 °C in un miscelatore termico (Tabella dei materiali).
- Diluire le sonde a una concentrazione finale di 125 nM per i dischi alari e 200 nM per i muscoli adulti, nel tampone di ibridazione e aggiungere l'anticorpo primario.
NOTA: La diluizione dell'anticorpo varia a seconda dell'anticorpo specifico utilizzato (Tabella dei materiali). L'aggiunta di anticorpi è facoltativa. Gli utenti possono scegliere di rinunciare alla colorazione delle proteine e utilizzare invece un protocollo smFISH simile che non include l'aggiunta di anticorpi. - Aspirare il tampone di ibridazione e sostituirlo con 100 μL di tampone di ibridazione contenente la sonda e l'anticorpo.
- Incubare i campioni al buio a 37 °C per almeno 16 ore sotto agitazione a 300 giri/min in un miscelatore termico.
- Riscaldare un'aliquota di tampone A a 37 °C.
- Lavare i campioni per 3 x 10 minuti nel miscelatore termico a 37 °C sotto agitazione a 300 giri/min.
- Durante l'ultimo lavaggio, diluire l'anticorpo secondario (1/200) e il DAPI (1/10.000) nel tampone A e incubare i campioni in questa soluzione a 37 °C per almeno 1 ora.
- Lavare i campioni per 3 x 20 minuti con il tampone B (tabella dei materiali).
- Trasferire con cautela i campioni su un vetrino da microscopio, rimuovere il tampone B residuo e aggiungere 30 μL di terreno di montaggio, quindi coprire con un vetrino coprioggetto da 18 x 18 mm. Usa uno smalto per sigillare la preparazione.
- Conservare i campioni per un massimo di 1 settimana a 4 °C.
NOTA: Tuttavia, si consiglia di eseguire l'imaging il prima possibile per evitare la degradazione del segnale della sonda.
3. Imaging
- Acquisire immagini con una modalità di acquisizione xyz utilizzando un microscopio confocale dotato di obiettivi a immersione in olio 40x e 63x (Tabella dei materiali). Il segnale smFISH viene rilevato dal rilevatore HyD tramite una modalità di conteggio dei fotoni.
- Localizzare i campioni utilizzando il segnale DAPI e la lampada UV.
- Per ottenere l'immagine dei progenitori muscolari e degli IFM associati al disco alare (Figura 2 e Figura 3), applicare la seguente impostazione per le linee laser e i filtri di emissione: selezionare DAPI (eccitazione (es.) 405 nm, emissione (em.) 450 nm), Alexa Fluor 488 (es. 496 nm, em. 519 nm), e il Quasar 670 per le sonde smFISH (es. 647 nm, em. 670 nm).
- Per ottenere l'immagine dei MuSC adulti (Figura 2D), applicare la seguente impostazione per le linee laser e i filtri di emissione: selezionare DAPI (es. 405 nm, em. 450 nm), Alexa Fluor 488 (es. 496 nm, em. 519 nm), Alexa Fluor 555 (es. 555 nm, em. 565 nm), e Quasar 670 per le sonde smFISH (es. 647 nm, em. 670 nm).
NOTA: Per l'imaging, le lunghezze d'onda possono essere adattate in base ai coloranti associati agli anticorpi secondari e alle sonde. - Salvare le immagini confocali come file . TIFF.
4. Analisi post-imaging
- Per iniziare, avvia ImageJ e vai al menu Plugin . Da lì, seleziona Macro | Modifica per aprire il codice sorgente delle macro.
NOTA: In questo modo è possibile regolare i parametri in base alle esigenze e, se necessario, modificare la directory delle cartelle per ciascun canale all'interno del codice sorgente della macro. - Per seguire questo protocollo e quantificare le macchie di Mef2 smFISH nelle larve, utilizzare le seguenti impostazioni: Log_radius = 3,0 e Log_quality = 20,0. Nuclei Mef2-positivi con sfocatura = 2; nucleus_scale_parameter = 30; nucleus_threshold = -8.0; nucleus_size = 300.
- Nelle fibre muscolari, utilizzare i seguenti parametri: Log_radius = 2,5; Log_quality = 60,0; sfocatura = 2; nucleus_scale_parameter = 100; nucleus_threshold = 0,0; nucleus_size = 300.
- Per avviare la macro, è sufficiente eseguire il comando run e attendere che la macro carichi automaticamente tutte le immagini dalla cartella designata e le quantifichi in modo sequenziale.
NOTA: Si prega di notare che la durata di questo processo può variare da pochi secondi a diverse ore, a seconda del volume di dati analizzati. - Cercare i risultati visualizzati in due nuovi file .csv: file_FISH_results e file_nuclei_results. Il primo mostra il numero di macchie trascrizionali e le loro intensità medie e massime. Il secondo fornisce sia il numero totale di nuclei che il numero di macchie all'interno di ciascun nucleo.
Risultati
In questo protocollo, abbiamo utilizzato sonde prodotte commercialmente che hanno come bersaglio l'mRNA di Mef2 e zfh1. Abbiamo progettato le sonde con il progettista di sonde FISH del produttore (Table of Materials). L'insieme Mef2 ha come bersaglio gli esoni comuni a tutte le isoforme di RNA Mef2 (dall'esone 3 all'esone 10). L'insieme zfh1 ha come bersaglio il terzo esone comune alle isoforme10 di zfh1-RB e zfh1-RE. Entrambe le sonde sono coniugate al colorante fluorescente Quasar 670.
Abbiamo generato internamente una macro compatibile con il software ImageJ per analizzare automaticamente i dati grezzi .tif. La macro permette la segmentazione 3D dei nuclei da parte di Cellpose26 con il plugin Fiji BIOP e la quantificazione a punti trascrizionali da parte di un Laplaciano o Gaussiano come implementato nel plugin Trackmate27. Il pluginMorpholibJ 28 viene utilizzato per la post-elaborazione (file supplementare 1).
Come primo passo, abbiamo eseguito smFISH su dischi immaginali alari, dove Mef2 e zfh1 sono noti per essere espressi negli AMP. Questi dati mostrano che entrambi i trascritti sono uniformemente rilevati nella popolazione di AMP co-colorati con anticorpi Mef2 o Zfh1 (Figura 2A,B). I siti di trascrizione attivi (TS) possono essere rivelati e distinti dall'mRNA maturo mediante smFISH in quanto tendono ad essere più grandi e hanno segnali più intensi rispetto ai singoli trascritti citoplasmatici o ai trascritti nucleari maturi. Coerentemente, ingrandimenti più elevati degli AMP distinguono tra focolai di TS e mRNA maturo sparso nel citoplasma (Figura 2A',B'), convalidando la sensibilità di questo protocollo smFISH. Va comunque detto che abbiamo osservato una TS attiva per nucleo sia per zfh1 che per Mef2 (Figura 2A',B'). Questi dati convalidano ulteriormente l'accuratezza del design della sonda poiché i pattern trascrizionali Mef2 e zfh1 negli AMP colocalizzano con il rilevamento delle rispettive proteine (Figura 2).
In una seconda fase, abbiamo esaminato il sito di trascrizione e la distribuzione degli mRNA Mef2 e zfh1 negli IFM adulti differenziati e nelle cellule staminali associate (Figura 2C,D). Questi dati illustrano chiaramente le TS Mef2 nei nuclei muscolari sinciziali e la distribuzione dell'mRNA Mef2 in tutto il citoplasma (Figura 2C,C'). Zfh1 segna in modo specifico la popolazione di MuSC10,11. Utilizzando questo protocollo smFISH, abbiamo rilevato con successo la trascrizione di zfh1 nei MuSC contrassegnati dall'espressione di Zfh1-Gal4 > GFP. Un ingrandimento più elevato illustra la rilevazione sia di zfh1 TS che di singoli mRNA citoplasmatici (Figura 2D').
Infine, abbiamo utilizzato la nostra macro ImageJ costruita internamente per analizzare quantitativamente le dinamiche trascrizionali Mef2 e la distribuzione spaziale. La pipeline computazionale è in grado di rilevare e segmentare in modo efficiente i punti Mef2 e i nuclei muscolari (Figura 3A-C). Tuttavia, a causa di problemi di rapporto segnale/rumore, alcuni punti potrebbero non essere rilevati in alcuni casi (Figura 3A',B'). Abbiamo utilizzato questo metodo automatizzato per indagare se l'abbondanza di mRNA Mef2 varia tra le cellule precursori muscolari (AMP) e gli IFM adulti differenziati. La nostra analisi mostra che il numero di mRNA Mef2 per nucleo negli IFM adulti e negli AMP non è significativamente diverso (Figura 3D).
Per ottenere informazioni sulla distribuzione spaziale dei trascritti Mef2 nei muscoli IFM adulti, abbiamo quantificato la frazione di macchie di mRNA Mef2 citoplasmatiche rispetto a quelle nucleari (Figura 3E,F). Utilizzando il nostro programma, abbiamo contato sia il numero totale di macchie di mRNA Mef2 che il numero di macchie di mRNA Mef2 che si sovrappongono alla colorazione dei nuclei (Mef2). Sottraendo l'mRNA associato ai nuclei dal numero totale di mRNA si ottiene il numero di macchie di mRNA citoplasmatico. I nostri risultati rivelano che circa il 92% dell'mRNA Mef2 è presente nel citoplasma, mentre il restante 8% è associato ai nuclei muscolari, come mostrato nella Figura 3E,F.
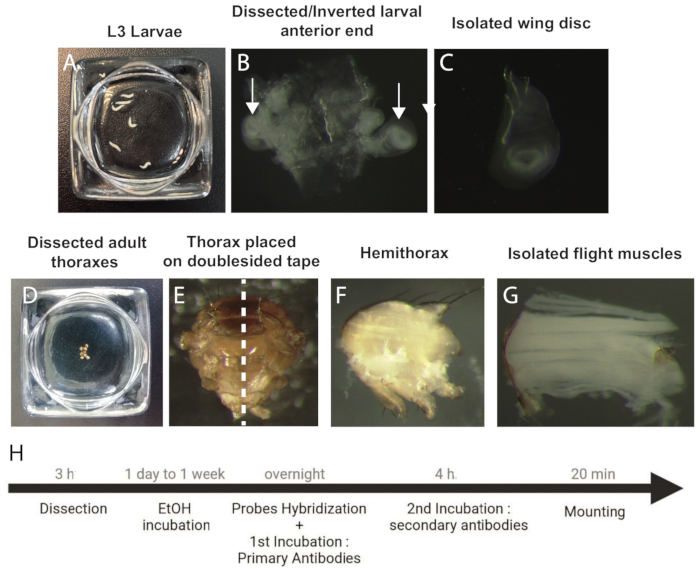
Figura 1: Procedura per sezionare e preparare dischi alari e campioni IFM per smFISH. (A) Larve in stadio L3. (B) Estremità anteriore della larva sezionata e invertita. Le frecce indicano i dischi alari. (C) Disco alare isolato. (D) Torace adulto sezionato. (E) Torace adulto orientato su un nastro biadesivo prima della bisezione (linea tratteggiata). (F) Emitorace adulto. g) IFM isolati. (H) Flusso di lavoro del protocollo smFISH. Abbreviazioni: IFM = muscoli del volo indiretto; smFISH = ibridazione in situ a fluorescenza di RNA a singola molecola; EtOH = etanolo. Fare clic qui per visualizzare una versione più grande di questa figura.
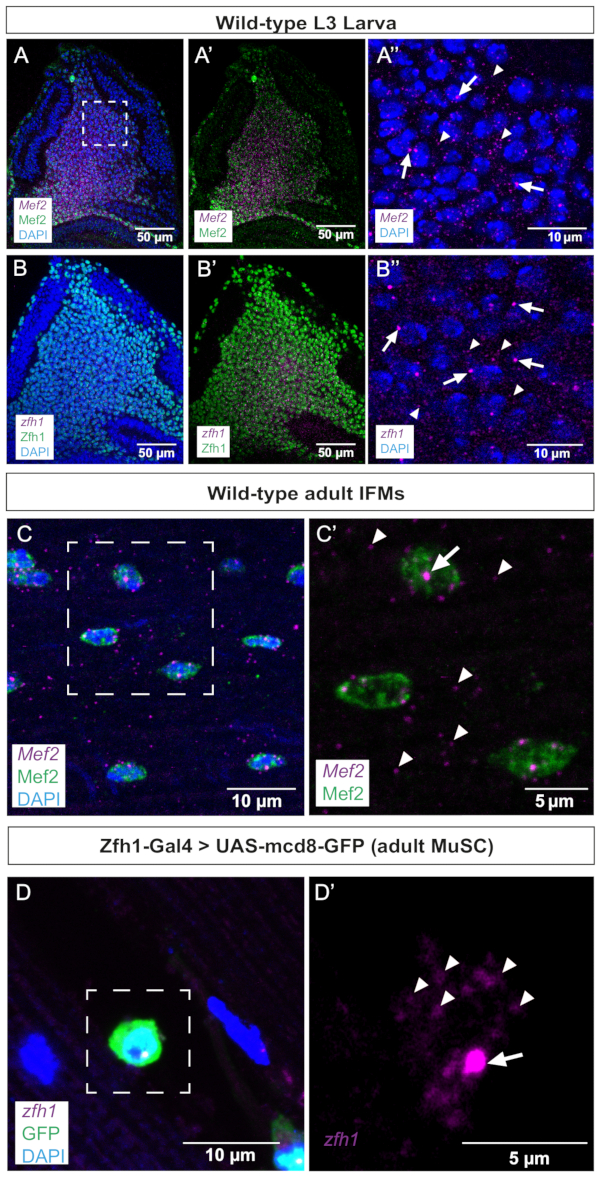
Figura 2: Immagini rappresentative di Mef2 e zfh1 smFISH nei dischi alari e negli IFM adulti. (A,B) Gli mRNA Mef2 e zfh1 (viola) sono rilevati uniformemente negli AMP e co-localizzano rispettivamente con le proteine (A,A') Mef2 e (B,B') Zfh1 (verde). (A'',B'') Maggiore ingrandimento degli AMP. (C) Gli mRNA Mef2 e la proteina Mef2 sono rilevati negli IFM adulti. (C') Maggiore ingrandimento della regione scatolata in C. (D) Zfh1-Gal4 >l'espressione di UAS-mCD8GFP (verde) etichetta i MuSC adulti. ZFH1 L'RNA viene rilevato nei MuSC adulti. (') Maggiore ingrandimento della regione riquadrata in D. I siti di inizio della trascrizione Zfh1 e i singoli mRNA sono indicati rispettivamente da frecce e punte di freccia. Colorazione DAPI (blu). Barre di scala = 50 μm (A,B,A',B'), 10 μm (A",B",C,D), 5 μm (C',D'). Abbreviazioni: IFM = muscoli del volo indiretto; smFISH = ibridazione in situ a fluorescenza di RNA a singola molecola; AMPs = progenitori muscolari adulti; MuSC = cellule staminali muscolari; DAPI = 4',6-diamidino-2-fenilindolo; GFP = proteina fluorescente verde. Fare clic qui per visualizzare una versione più grande di questa figura.
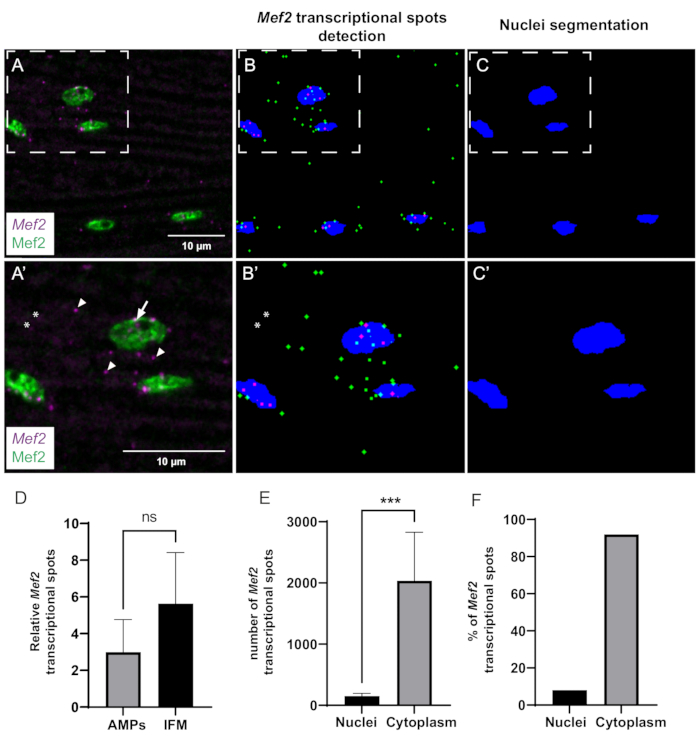
Figura 3: Quantificazione della trascrizione di Mef2 e dell'accumulo di mRNA citoplasmatico da parte di smFISH. (A) Distribuzione dei trascritti Mef2 (viola) e della proteina Mef2 (verde) in IFM adulti wildtype. (A') Maggiore ingrandimento della regione riquadrata in A. I siti di inizio della trascrizione e i singoli mRNA sono indicati rispettivamente da frecce e punte di freccia. (B,C) Ricerca automatica di spot Mef2 e segmentazione nucleare. Gli mRNA Mef2 citoplasmatici e nucleari sono indicati rispettivamente in verde e magenta. (B',C') Ingrandimenti più elevati delle regioni boxed in B e C. Gli asterischi indicano i punti che non vengono conteggiati dalla macro. (D) Esempio di quantificazione spot di Mef2 in AMP e IFM adulti, in relazione al numero totale di nuclei. (p = 0,0785, test t di Student, dischi alari (n = 4), IFM (n = 11)). (E) Esempio di quantificazione della distribuzione spot di Mef2 in IFM adulti. (*** p< 0,0007, test t di Student, n = 5). (F) Percentuale di macchie di mRNA Mef2 rilevate all'interno e all'esterno dei nuclei (n = 5). Barre di scala = 10 μm (A,A'). Abbreviazioni: IFM = muscoli del volo indiretto; smFISH = ibridazione in situ a fluorescenza di RNA a singola molecola; AMPs = progenitori muscolari adulti. Fare clic qui per visualizzare una versione più grande di questa figura.
File supplementare 1: macro utilizzata per la post-elaborazione. Fare clic qui per scaricare il file.
Discussione
L'applicazione del metodo smFISH ha guadagnato popolarità negli ultimi tempi, con il suo utilizzo che si estende a vari tipi di cellule e organismi modello. Tuttavia, nel caso della Drosophila, la maggior parte delle conoscenze sull'espressione genica del muscolo adulto deriva da saggi molecolari di massa, che non riescono a fornire informazioni quantitative sulla precisa posizione spaziale delle molecole di mRNA. Per colmare questa lacuna, abbiamo ottimizzato un metodo per l'esecuzione di smFISH su cellule precursori muscolari e muscoli adulti di Drosophila . Questo approccio è stato adattato da un protocollo23 precedentemente pubblicato e ottimizzato per i tessuti muscolari di Drosophila .
Il principale ostacolo nell'ottenere immagini smFISH di alta qualità è lo spessore dei muscoli adulti, che ostacola la penetrazione ottimale delle sonde. Pertanto, è fondamentale separare i muscoli adulti dagli altri tessuti dell'animale ed eseguire il processo di ibridazione con una leggera agitazione. Questo particolare passaggio garantisce un'efficace permeabilizzazione dei tessuti.
Un altro aspetto critico è che il rapporto segnale/rumore può causare il fallimento della pipeline computazionale nel rilevare determinati punti di mRNA. Abbiamo scoperto che l'aumento del rapporto segnale/rumore può essere ottenuto trovando la concentrazione ottimale delle sonde. La diluizione ottimale può variare a seconda della composizione di ciascun set di sonde, compresa la composizione del colorante coniugato e dell'oligonucleotide. Si consiglia di provare diverse diluizioni; una diluizione finale di 200 nM ha prodotto il miglior rapporto segnale-rumore per i tessuti adulti in questi esperimenti.
Con il metodo smFISH, è possibile quantificare il numero di RNA di nuova sintesi nei focolai TS. Quando un gene viene trascritto attivamente, più RNA nascenti vengono prodotti contemporaneamente nella TS. Di conseguenza, l'intensità del TS supererà quella dell'RNA citoplasmatico maturo e questa caratteristica, combinata con la sua localizzazione nucleare, può differenziare il TS dai singoli RNA citoplasmatici. Nel contesto della biologia muscolare, il rilevamento e la quantificazione della TS sono particolarmente importanti per determinare la sincronizzazione della trascrizione di un gene specifico tra i nuclei muscolari all'interno dello stesso sincizio. Tuttavia, questa pipeline computazionale non è progettata per differenziare tra segnali citoplasmatici di mRNA e TS. In alternativa, suggeriamo di combinare questo metodo smFISH con altri strumenti di analisi smFISH ben consolidati, come BayFISH o FISH-quant29,30. È stato dimostrato che questi strumenti facilitano la segmentazione automatizzata e i calcoli dell'intensità di fluorescenza degli aggregati di RNA con notevole precisione.
Infine, mentre smFISH rileva le molecole di mRNA con un'elevata risoluzione spaziale, si limita ad analizzare un piccolo numero di mRNA contemporaneamente. Metodi multiscala come merFISH (multiplexed error-robust fluorescence in situ hybridization) consentono l'analisi simultanea di un gran numero di mRNA31 diversi. Combinando sonde di oligonucleotidi e codici di correzione degli errori, questo metodo facilita il rilevamento di centinaia di specie di RNA in singole cellule.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Si ringrazia Alain Vincent per la lettura critica del manoscritto. Ringraziamo Ruth Lehmann per averci fornito l'anticorpo Zfh1. Ringraziamo Stephanie Dutertre e Xavier Pinson per la microscopia confocale presso la MRic Imaging Platform. EL è sostenuto da una borsa di dottorato del ministère de l'enseignement supérieur et de la recherche scientifique. NA è supportato dalla borsa di dottorato AFM-Telethon 23846. TP è finanziato da una sovvenzione DAF dell'iniziativa Chan Zuckerberg a T.P. (2019-198009). HB è supportato dal CNRS, dal programma Atip Avenir e dalla sovvenzione AFM-Telethon 23108 per il trampolino.
Materiali
| Name | Company | Catalog Number | Comments |
| Confocal microscope SP8 | Leica | SP8 DMI 6000 | |
| DAPI | ThermoFisher | 62248 | |
| Double-sided tape | Tesa | 57910-00000 | |
| Dumont #55 Forceps | Fine Science Tools | 11255-20 | |
| Formaldehyde 16% | Euromedex | EM-15710 | |
| Mef2 antibody | DHSB | NA | |
| PBS 10x | Euromedex | ET330 | |
| RNaseZAP | Sigma-Aldrich | R2020 | |
| Stellaris probes | LGC | NA | |
| Stellaris RNA FISH Hybridization Buffer | LGC | SMF-HB1-10 | |
| Stellaris RNA FISH Wash Buffer A | LGC | SMF-WA1-60 | |
| Stellaris RNA FISH Wash Buffer B | LGC | SMF-WB1-20 | |
| Swann-Morton Blades | Fisher scientific | 0210 | |
| ThermoMixer | Eppendorf | 5382000015 | |
| Triton X-100 | Euromedex | 2000 | |
| UAS-mCD8::GFP line | Bloomington | RRID:BDSC_5137 | |
| Ultrapure water | Sigma-Aldrich | 95284 | |
| Watch Glass, Square, 1 5/8 in | Carolina | 742300 | |
| Zfh1 antibody | Gifted by Ruth Leahman | ||
| Zfh1-Gal4 | Bloomington | BDSC: 49924, FLYB: FBtp0059625 |
Riferimenti
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692 (2021).
- Chal, J., Pourquie, O. Making muscle: skeletal myogenesis in vivo and in vitro. Development. 144 (12), 2104-2122 (2017).
- Taylor, M. V., Hughes, S. M. Mef2 and the skeletal muscle differentiation program. Seminars in Cell and Developmental Biology. 72, 33-44 (2017).
- Siles, L., et al. ZEB1 imposes a temporary stage-dependent inhibition of muscle gene expression and differentiation via CtBP-mediated transcriptional repression. Molecular and Cellular Biology. 33 (7), 1368-1382 (2013).
- Weitkunat, M., Schnorrer, F. A guide to study Drosophila muscle biology. Methods. 68 (1), 2-14 (2014).
- Boukhatmi, H. Drosophila, an integrative model to study the features of musclestem cells in development and regeneration. Cells. 10 (8), 2112 (2021).
- Bothe, I., Baylies, M. K. Drosophila myogenesis. Current Biology. 26 (17), R786-R791 (2016).
- Catalani, E., et al. RACK1 is evolutionary conserved in satellite stem cell activation and adult skeletal muscle regeneration. Cell Death Discovery. 8 (1), 459 (2022).
- Siles, L., Ninfali, C., Cortes, M., Darling, D. S., Postigo, A. ZEB1 protects skeletal muscle from damage and is required for its regeneration. Nature Communications. 10 (1), 1364 (2019).
- Boukhatmi, H., Bray, S. A population of adult satellite-like cells in Drosophila is maintained through a switch in RNA-isoforms. Elife. 7, e35954 (2018).
- Chaturvedi, D., Reichert, H., Gunage, R. D., VijayRaghavan, K. Identification and functional characterization of muscle satellite cells in Drosophila. Elife. 6, e30107 (2017).
- Gunage, R. D., Reichert, H., VijayRaghavan, K. Identification of a new stem cell population that generates Drosophila flight muscles. Elife. 3, e03126 (2014).
- Figeac, N., Daczewska, M., Marcelle, C., Jagla, K. Muscle stem cells and model systems for their investigation. Developmental Dynamics. 236 (12), 3332-3342 (2007).
- Aradhya, R., Zmojdzian, M., Da Ponte, J. P., Jagla, K. Muscle niche-driven insulin-Notch-Myc cascade reactivates dormant adult muscle precursors in Drosophila. Elife. 4, e08497 (2015).
- Schonbauer, C., et al. Spalt mediates an evolutionarily conserved switch to fibrillar muscle fate in insects. Nature. 479 (7373), 406-409 (2011).
- Bryantsev, A. L., Baker, P. W., Lovato, T. L., Jaramillo, M. S., Cripps, R. M. Differential requirements for Myocyte Enhancer Factor-2 during adult myogenesis in Drosophila. Developmental Biology. 361 (2), 191-207 (2012).
- Soler, C., Han, J., Taylor, M. V. The conserved transcription factor Mef2 has multiple roles in adult Drosophila musculature formation. Development. 139 (7), 1270-1275 (2012).
- Soler, C., Taylor, M. V. The Him gene inhibits the development of Drosophila flight muscles during metamorphosis. Mechanisms of Development. 126 (7), 595-603 (2009).
- Pinheiro, H., et al. mRNA distribution in skeletal muscle is associated with mRNA size. Journal of Cell Science. 134 (14), jcs256388 (2021).
- Denes, L. T., Kelley, C. P., Wang, E. T. Microtubule-based transport is essential to distribute RNA and nascent protein in skeletal muscle. Nature Communications. 12 (1), 6079 (2021).
- Li, H., et al. Fly Cell Atlas: A single-nucleus transcriptomic atlas of the adult fruit fly. Science. 375 (6584), eabk2432 (2022).
- Santos, M. D., et al. Extraction and sequencing of single nuclei from murine skeletal muscles. STAR Protocols. 2 (3), 100694 (2021).
- Raj, A., van den Bogaard, P., Rifkin, S. A., van Oudenaarden, A., Tyagi, S. Imaging individual mRNA molecules using multiple singly labeled probes. Nature Methods. 5 (10), 877-879 (2008).
- Femino, A. M., Fay, F. S., Fogarty, K., Singer, R. H. Visualization of single RNA transcripts in situ. Science. 280 (5363), 585-590 (1998).
- Raj, A., Tyagi, S. Detection of individual endogenous RNA transcripts in situ using multiple singly labeled probes. Methods in Enzymology. 472, 365-386 (2010).
- Stringer, C., Wang, T., Michaelos, M., Pachitariu, M. Cellpose: a generalist algorithm for cellular segmentation. Nature Methods. 18 (1), 100-106 (2021).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Legland, D., Arganda-Carreras, I., Andrey, P. MorphoLibJ: integrated library and plugins for mathematical morphology with ImageJ. Bioinformatics. 32 (22), 3532-3534 (2016).
- Mueller, F., et al. FISH-quant: automatic counting of transcripts in 3D FISH images. Nature Methods. 10 (4), 277-278 (2013).
- Gomez-Schiavon, M., Chen, L. F., West, A. E., Buchler, N. E. BayFish: Bayesian inference of transcription dynamics from population snapshots of single-molecule RNA FISH in single cells. Genome Biology. 18 (1), 164 (2017).
- Chen, K. H., Boettiger, A. N., Moffitt, J. R., Wang, S., Zhuang, X. RNA imaging. Spatially resolved, highly multiplexed RNA profiling in single cells. Science. 348 (6233), aaa6090 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon