Method Article
マイクロ流体フローセルを使用して流れの下で血小板粘着と凝集
要約
血小板接着カスケードには、せん断流の存在下で、従来の(静的)ウェルプレートアッセイでは考慮されていない要因を行われます。この記事の生理的せん断流れの条件をエミュレートするマイクロ流体ウェルプレートフォーマットを利用した血小板凝集アッセイに関するレポート。
要約
血小板凝集、内皮下細胞外マトリックスが露出された血管損傷への応答として発生します。血小板接着カスケードには、せん断流の存在下で、従来の(静的)ウェルプレートアッセイでは考慮されていない要因を行われます。この記事の生理的せん断流れの条件をエミュレートするマイクロ流体ウェルプレートフォーマットを利用した血小板凝集アッセイに関するレポート。細胞外タンパク質、コラーゲンI、またはvon Willebrand因子は、空気ポンプでアクティブな灌流を用いたマイクロ流体チャネル内に堆積される。マトリックスタンパク質を緩衝液で洗浄し、血小板の相互作用のためのマイクロ流体チャネルを準備するためにブロックされます。蛍光色素で標識された全血は、血小板活性化および凝集を達成するために様々な流量でチャネルを介して灌流される。血小板凝集の阻害はIC50用量応答データを生成するためのフローセル実験に先立って追加することができます。
プロトコル
パート1:BioFlux板のマイクロ流体チャネルの準備。
- フローセルの実験を実行する前に、人は目的のタンパク質のコーティングとマイクロ流体チャネルを準備する必要があります。このケースでは、コラーゲンは私が使用されます。各チャネルは、よく入口と出口を持っています。このプレートの場合、入口は井戸チャネルと同様の右にあるコンセントに給電左です。
- 0.02M酢酸に200μg/mlの濃度にコラーゲンI(5mg/ml株式)コーティングを希釈する。一つは、使用される各チャネルの20μlのが必要になります。マイクロピペットチップで穏やかtriterationで混ぜる。
- 使用するそれぞれのチャネルにコーティングの20μlを添加する。一つは、よくマイクロピペットを用いて関心のマイクロ流体チャネルを供給するコンセントの内側のパンチに、液体を分注する必要があります。気泡を導入しないように、ピペットから空気を押さないでください。ないコラーゲンのコントロール(接着および凝集のためのネガティブコントロール)のためのコラーゲンせずに1つのチャネルが含まれています。
- 一度、それらがすべて設定されている、4本のネジを締めて、最初の指でプレートにインターフェイスを接続、完全に締め、トルクドライバーを使用してください。それが最大の気密性に達するとトルクドライバがクリックされます。
- BioFluxソフトウェアで手動モードを使用して、コンセントも2dyn/cm -から2で興味のあるチャンネルに灌流を適用する。ここで一つは液体で満たされている反対側の内側のパンチを監視しなければなりません。これには数分かかります。一つは、これは顕微鏡で低消費電力の目標を使用して(4X)と同様またはプレートを保持し、下から入口の井戸を調べることでその入口を見つけることが発生見ることができます。一つは、最初ゆっくりと内側のパンチを満たす液体の小さなビーズが表示されるはずです。インレット内部のパンチがいっぱいになると、ソフトウェアでストップを押して、一度に灌流を停止します。
- 1時間室温でインキュベートする。
- インタフェースを削除し、よく口に1mlのPBSを(プラスのCa 2 + / Mg 2 +を )追加する。 2dyn/cm 2でよく口から血流を開始します。 10分間の灌流を続ける。血流を停止し、インタフェースを削除します。
- 入口と出口の井戸の両方から過剰なPBSを削除する - インナーパンチをいっぱいに液体を削除することはありません。ブロッキング溶液(PBS中の0.5%(v / v)のBSAを(プラスのCa 2 + / Mg 2 +を ))を使用してチャネルをブロックします。使用するだけでなく、各コンセントにブロッキング溶液1 mlを添加し、2dyn/cm 2でよくコンセントから灌流。 10分間の灌流を続ける。血流を停止し、インタフェースを削除します。このステップまでの準備のチャンネルは一日を通して使うことができます。
- 血液を追加する前に、内側のパンチ以外のチャネルの両側で液体を取り除く。
パート2。 GPIIb / IIIaの阻害抗体を持つ血液を準備する。
- コラーゲンは、チャネルでインキュベートされていますが、一つは全血を準備する必要があります。一つは、人間の血液を処理するときに、彼/彼女の機関によって決定バイオセーフティ規制に従ってください。
- クエン酸ナトリウムの抗凝固剤に引き込ま新鮮なヒト血液を(絶食した患者から)コレクションの3時間以内にご使用ください。
- 回答4μMカルセインを追加することにより、血液を準備します。 DMSO中のカルセインAMの4mmの株式を準備し、A / V 1 / 1000の希釈で血液に追加対穏やかに転倒混和します。
- 1.5mlのマイクロチューブ - カルセインの1mlを10に血液をラベル付け午前注します。希望の希釈(IgGの分子量は〜150kDaである)でそれぞれにGPIIb / IIIa阻害薬の抗体を追加。例の希釈系列は、1200nMから9nMすることであり、抗体のコントロールはと無関係な抗体のコントロールが含まれていません。 抑制のための優秀なポジティブコントロールが20ug/mlの濃度でレオプロ(アブシキシマブ、イーライリリー)となる。穏やかに転倒混和します。
- 1時間室温でインキュベートする。静かに転倒混和して10分おきに混ぜる。
パート3:BF1000ワークステーション上でフローセルの実験を実行する。
- 最初に、人はBioFluxの制御モジュールで自動化されたプロトコルを設定する必要があります。コラーゲンの場合私は、人はよく口から10分間10dyn/cm 2を実行するプロトコルを設定する必要があります。この時点で、一つでもBF1000ワークステーションを使用してデータ収集パラメータを設定する必要があります、チャネルの位置を含めて、FITC波長と時間経過の情報にキャプチャ。それは合計10分の期間にわたって、チャネルあたり10倍の目標を30秒ごとに使用してビューの3つのフィールドをキャプチャすることをお勧めします。
- 素早く作業を、別々の準備のチャンネルに各条件の準備血の500ulを置きます。コラーゲンとだけブロックされているものでコーティングされているチャンネルには抗体のコントロールの血を置かない。
- プレート上のインターフェイスを置きます。
- BF1000ワークステーションの顕微鏡でプレートを置きます。インターフェイス上でクランプ。
- プレートの負荷調整を行います。また、よく血液を含むものにステージを移動する。 FTを設定するICの画像キャプチャのパラメータ(露光時間、ゲイン等...)。
- BioFluxモンタージュのソフトウェアでは、同時に流れと取得を開始するために取得を開始します。
- BF1000ワークステーションからプレートを外し、制度的なガイドラインに従ってプレートを処分。
パート4:代表的な結果。
ここではマイクロ流体チャネルにおける血小板粘着と凝集のためのプロトコルが発表された。血小板凝集阻害剤による治療は、anti-GPIIb/IIIaもプロトコルに含まれていた。 BioFluxシステムのコラーゲンコーティングされたマイクロ流体チャネルを使用して、1つは、未処理の対照の血液サンプルとコーティングされていないチャネル上なく血栓形成に時間をかけて積極的な血栓形成を期待してください。 one最近行った実験では、制御条件下で凝集体の平均サイズは2000μm2であった。
図1。 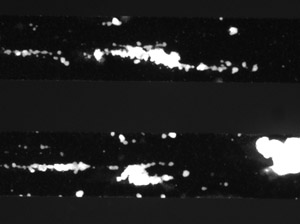
活性化GPIIb / IIIaとは、血小板-血小板相互作用および凝集安定化1の強力なメディエーターである。コラーゲンへの接着は、この応答2を引き出すためにGPIIb / IIIaとの複合体を活性化する。せん断暴露前に1時間anti-GPIIb/IIIaとのインキュベーション後、1つは血栓の大きさの減少だけでなく、血栓形成の頻度の減少を観察することが予想されます。用量依存性の応答は、通常10dyn/cm 2で観察することができます。
図2。 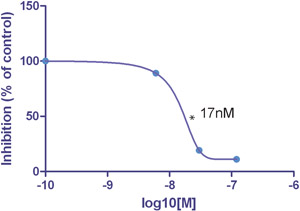
この特定の阻害剤のIC 50値は10 DYN / cm 2で17nMであった。抗体の制御なしに比べて最大阻害は、(このドナーのための)10 DYN / cm 2で11%であった。
ここでメソッドが特定の細胞外マトリックスタンパク質と血小板凝集の特異的阻害剤を用いて提示された一方で、プロトコルは他のコーティング、他の細胞型と細胞接着アッセイのための他の阻害剤への拡張が可能です。このような実験の成功するための秘訣は、すべての試薬のためのマイクロ流体チャネル、正しい希釈剤内のすべての試薬の適切な希釈、および適切な培養条件における気泡の回避です。
ディスカッション
ここでメソッドが特定の細胞外マトリックスタンパク質と血小板凝集の特異的阻害剤を用いて提示された一方で、プロトコルは他のコーティング、他の細胞型と細胞接着アッセイのための他の阻害剤への拡張が可能です。このような実験の成功するための秘訣は、すべての試薬のためのマイクロ流体チャネル、正しい希釈剤内のすべての試薬の適切な希釈、および適切な培養条件における気泡の回避です。
開示事項
資料
| Name | Company | Catalog Number | Comments | |
| collagen I, Bovine | Reagent | Invitrogen | A1064401 | other sources of collagen I can be used |
| PBS plus Ca/Mg | Reagent | Invitrogen | 14040-117 | |
| Bovine serum albumin (BSA) | Reagent | EMD Millipore | EM-2930 Bottom of Form | From VWR |
| calcein AM | Reagent | Invitrogen | C1430 | Calcein AM from BD can also be used |
| BioFlux 1000 System | Reagent | Fluxion Biosciences | Contact Company | |
| BioFlux Plate | Reagent | Fluxion Biosciences | 900013 | |
| antiGPIIb/IIIa | Reagent | Abcam | ab33407 | an alternative # is ab15021 |
| ReoPro | Reagent | Eli Lilly | by Rx only |
参考文献
- Jackson, S. P. The growing complexity of platelet aggregation. Blood. 109, 5087-5095 (2007).
- Nakamura, T., Kambayashi, J., Okuma, M., Tandon, N. N. Activation of the GP IIb-IIIa complex induced by platelet adhesion to collagen is mediated by both alpha2beta1 integrin and GP. VI. J Biol Chem. 274, 11897-11903 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved