このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
二重蛍光その場でハイブリダイゼーション
要約
このプロトコルは、非放射性の関係その場ハイブリダイゼーション手順。
要約
ここでは、二重蛍光の修正版を説明
プロトコル
このプロトコルは、以前は脳組織1-7に、1つまたは2つの転写産物の種を検出するために私達と他の人によって開発された標準的な放射性および非放射性in situハイブリダイゼーション法をベースに開発し、精製した。以下に記述されているプロトコルは、エンドユーザーによって選択された手続きの中断の数に応じて、2または3日間の合計の長さを持っています。以下に詳述するすべてのステップは、リボプローブのハイブリダイゼーション工程と後のハイブリダイゼーションの洗浄を除いて、室温で実施されるべきである。この方法に関係するすべてのステップのために必要な溶液とバッファーは、このプロトコルの終わりに見つけることができます。
1。組織の準備とセクショニング
- 首を切ると急速に被験者の脳を抽出し、適切なサイズのプラスチック金型に入れてください。
- ティッシュ- Tek製の包埋媒体と脳をカバーし、急速に急速凍結するためのdry-ice/alcoholバスでプラスチック金型を置きます。凍結組織を-80℃で使用時まで保存することができます。
- クライオスタットを用いて、荷電Superfrostプラススライドにスライドあたり2つまたは3つの脳切片を収集する。セクションの厚さは10-12μmのはずです。スライドは、-80℃で使用時まで保存することができます。
2。プローブの精製のためのセファデックスG50カラムの調製
"セファデックスカラムは商業的供給源から購入することができます、しかし、我々は、プローブの精製のために必要とされる列の生成については、以下の低コストの代替手段を提供しています。
- セファデックスG50過剰沈殿にRNaseフリー、DEPC処理水(例えば、DEPC処理水100mlに粉末2g)、室温で混合溶液の簡潔にし、店舗とのセファデックスG50粉体の水和物十分な量。
- セファデックスG50降水量は、次の(水の上位レイヤ)上清を取り除く。
- 5回 - 3上記プロセスを繰り返します。
- 最終洗浄後、使用するまで4℃でセファデックスG50 TEバッファー(1:1の比率)のソリューション、およびストア° Cを再サスペンド。
- 場所は、無菌1mlのシリンジにグラスウールをオートクレーブし、下部のコンパクトな層を作るためにプランジャーで圧縮し、次いで15 mlのFalconチューブに注射器を配置。
- よくTEにおけるセファデックスG50の溶液を混合。この溶液を注射器/列を埋める。
- 1000rpmで30秒間カラムを遠心する。
- 列がほぼ完全にセファデックスG50ビーズを充填されるまで、この手順を繰り返します。
- カラムにカラムの洗浄緩衝液200μlを適用し、1000rpmで2分のためにそれを遠心分離。フロースルー捨てる。
- 列に列のブロッキング緩衝液200μlを適用し、1000rpmで2分間、それを回転させる。カラムを平衡化するこのステップ4-5回繰り返します。 ° C使用時までパラフィルムで密封された場合、列は4℃保存することができます。
3。リボプローブのラベリングと精製
我々は詳細に、単一のリボプローブの生成と精製を以下に。 dFISHの場合は、各プローブの調製は、プローブのいずれかがビオチンタグの付いたUTPと他の一方、ジゴキシゲニン(DIG)-タグ付きUTPで標識されることを除いて、同じ方法論が含まれる。
- センス(対照)またはアンチセンスリボプローブのいずれかを生成するための関心の集中(> 150 ng /μLの)と精製した線状化したcDNA溶液を調製します。
- 1.5mlマイクロチューブに、cDNAを鋳型、5倍のプローブの標識バッファーを2μl、10X DIGの1μL(またはビオチン)標識ミックス、RNasin 0.5μlおよび適切なRNAポリメラーゼ1μlを精製の0.5〜1μgを追加する、およびRNaseフリー(DEPC処理)水で10μlの溶液の最終容積をもたらす。
- 37℃水浴中でソリューション℃で2時間、Cをインキュベートする。
- ソリューションに、そして列ブロッキングバッファー39μlを、tRNAの1μL(20μg/μLの株式)を追加します。
- プローブの精製のためのセファデックスG50カラムを準備します。この目的のために、列に50μlのブロッキングバッファーを追加し、1000rpmで10秒間、それを回転させる。
カラムを平衡化するこのステップを2-3回繰り返して(すなわち、列に適用される完全な50μlの遠心分離のサイクル後に回収される)。 - セファデックスG50カラム、位置、列の一番下に新しいマイクロ遠心チューブにプローブ溶液を適用する、とリボプローブ溶液を精製した50μlを得るために、1000rpmで3分間、それを回転させる。
- どちらかの標準的なホルムアルデヒド - アガロースRNAゲル、または分光光度計を用いて標識リボプローブの品質と収量を評価する。
4。後固定、アセチル化とハイブリダイゼーション
- -80℃の冷凍庫からセクションを削除し、平衡化は室温を可能にする。その後、5分間コールド、たての3%パラホルムアルデヒド溶液で切片をインキュベートします。
- 簡単に言うとPのセクションをすすぐhosphateは二回(PBS)緩衝生理食塩水。
- 標準的なアルコール系(70、95、および100%、2分ごと)を通してのセクションを脱水し、空気乾燥してみましょう。
- 10分間アセチル化溶液中でのセクションをインキュベートする。
- 2X SSPEのセクションを3回すすいでください。
- 標準的なアルコール系上記を通じて再びセクションを脱水し、それらを空気乾燥することができます。
- ハイブリダイゼーション溶液の適切な量を準備して、溶液(プローブ濃度:各プローブに対しては1 ng /μL)に、両方のリボプローブを追加します。ハイブリダイゼーション溶液の総体積がハイブリダイズするセクション(セクションごとのハイブリダイゼーション溶液の16μlの)の数に基づいて決定されます。
- 無気泡オーバーレイという組織を確実に組織し、カバースリップのスライドへのハイブリダイゼーション溶液の十分な量を適用します。
- 金属製のスライドホルダーにスライドを配置。 65で設定されたミネラルオイルバスに浸し、ホルダー℃で一晩。カバースリップが(すなわち、スライドホルダーの外側面は鉱物油の容器の底部に接触するはず)を上に向けられていることを確認します。
5。ポストハイブリダイゼーションの洗浄
- 翌日、慎重にミネラルオイルバスからスライドホルダーを削除し、簡単にスライドから余分な油を除去するためにクロロホルムでそれを洗う。
- 場所は、5〜10分間2X SSPE溶液中でスライドします。カバースリップは、溶液中の中のスライドからデタッチする必要があります。
- 新しい2X SSPEのソリューションにスライドを移し、室温で1時間のためにそれらを保つ。
- 2X SSPEプラス50%ホルムアミドを含む溶液にセクションを移す。この溶液の温度は、一晩ハイブリダイゼーション手順において使用される温度と一致する必要があります。 1.5時間この溶液中でスライドしてください。
- 0.1 × SSPEソリューションハイブリダイゼーション工程の同じ温度に予め温めておいたためにセクションを転送します。 30分間この溶液中でのセクションをインキュベートする。さらに30分ごとにこの手順を繰り返します。
6。リボプローブの検出と可視化
- 0.3%過酸化水素を10分間、添加されたTNTバッファーにスライドを移し。
- TNTバッファー、3回(10分ごと)でセクションを洗ってください。
- DAKOのペンを使用して、脳のセクションを含む領域の周囲に井戸を描く。重要なことに、注意はそのセクションが乾燥しないように行使する必要があります。
- 各スライドにTNBバッファー150μlのを適用し、湿度の高い室で、30分間この溶液中でのセクションをインキュベートする。
- 傾斜スライドで過剰TNBのソリューションを取り外します。
- 2時間多湿のチャンバー内でペルオキシダーゼ標識抗DIG抗体、および店舗のスライドを含むTNBの水溶液150μlを適用します。抗体濃度は、前dFISHを行うために関心の各転写産物に対して個別に決定されるべきである。
- 3回、10分ごとに、TNTバッファー内のセクションを洗ってください。
- 各スライドにアレクサ594 -共役チラミドワーキング溶液150μlを塗布し、1時間多湿のチャンバー内に保存してください。このソリューションは、製造者の指示に従って準備する必要があります。
- 3回、10分ごとに、TNTバッファー内のセクションを洗ってください。
- 30分 - 0.3%過酸化水素を10分間添加したTNTバッファー内のセクションをインキュベートする。
- 3回、10分ごとに、TNTバッファー内のセクションを洗ってください。
- スライドあたりのTNBバッファー150μlのを適用し、30分間湿潤なチャンバーに保管してください。
- 傾斜スライドで過剰TNBのソリューションを取り外します。
- 2時間多湿のチャンバー内でペルオキシダーゼ結合抗ビオチン抗体、および店舗のスライドを含むTNBの水溶液150μlを加え。
- 3回、10分ごとに、TNTバッファー内のセクションを洗ってください。
- アレクサの150μlの488標識スライドと1時間インキュベートするセクションへチラミド実用的なソリューションを適用します。このソリューションは、製造業者の推奨に従って準備する必要があります。
- 3回、10分ごとに、TNTバッファー内のセクションを洗ってください。
- セクションにヘキスト溶液(TNTバッファーで1:1000)150μlを加え、2分間多湿の室に保管してください。
- TNTバッファー内のセクションを洗って、3回、各5分間。
- 蛍光互換マウント培地(例えば、Vectashieldや褪色を褪色)付きカバースリップのセクション。
7。代表的な結果
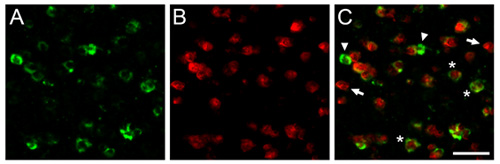
図1ここでは、キンカチョウの脳で得られた代表的なdFISHの結果を示す。示さcaudomedial nidopallium(NCM)、哺乳類の聴覚皮質の鳴き鳥のアナログから得られた顕微鏡写真である。脳切片は、パルブアルブミン(A)、抑制性ニューロンの亜集団のマーカーに対して向けられたビオチン化リボプローブとハイブリダイズし、リボDIG -標識したプローブは、活動依存的遺伝子zenk(B)、曲駆動型ニューロンのための信頼できるマーカーに対して向け。 C)のオーバーレイ()と(B)は、聴覚経験によって活性化される抑制性ニューロンの人口を示しています。矢印と矢印の2つのリボプローブのそれぞれに排他的に標識された細胞を表し、アスタリスクは、代表的なニューロンの興味の両方の成績証明書を共発現を示す。バー=25μmのスケール。
ディスカッション
我々は、脊椎動物の脳がneurochemicallyと機能的に編成されているか研究し、そしてどのように行動に関連した感覚刺激の影響成人の脳の8-10の神経細胞のゲノム機械かを判断するためにこのプロトコルを使用している。我々は正常マウス、ラット、鳴禽類の脳組織でこのメソッドを使用していましたが、このプロトコルは、脊椎動物種の配列と、おそらく、非神経組織から得られた脳切?...
開示事項
謝辞
NIH / NIDCDとRPへのシュミット財団の助成金によってサポートされている動作。
資料
ソリューション
- カラムの洗浄バッファー:50ミリリットルDEPC処理水に10mMトリス- HCl、0.15 MのNaCl、0.05mMのEDTA、50μg/μLのtRNAは、0.1%SDS。
- 列ブロッキングバッファー:50ミリリットルDEPC処理水に10mMトリス- HCl、50mMのNaCl、0.1mMのEDTA。
- TNTバッファー:1 Mトリス塩酸60mlを、5 M NaClを18 mlのDEPC処理水600mlのトリトンX - 100の1.8ミリリットル。
- TNBバッファー:100mMトリス- HCl、8.3μg/μLのBSA、0.15 MのNaClおよび3%トリトンDEPC処理水でX - 100。
- TEバッファー:10mMトリス- HCl、pH7.5のプラス1 mMのEDTA、pH7.5の。
- アセチル化のソリューション:トリエタノールアミンプラスDEPC処理水200mlの無水酢酸を0.5mlの2.7ミリリットル。
- ハイブリダイゼーション溶液:50%ホルムアミド、2X SSPE、2μg/μLのtRNAは、1μg/μLのBSAおよび1μgの/ DEPC処理水に添加ポリ。それは、セクションごとに16リットルが必要です。
参考文献
- Jin, L., Lloyd, R. V. In situ hybridization: methods and applications. J Clin Lab Anal. 11, 2-9 (1997).
- Stoler, M. H. In situ hybridization. Clin Lab Med. 10, 215-236 (1990).
- Komminoth, P., Werner, M. Target and signal amplification: approaches to increase the sensitivity of in situ hybridization. Histochem Cell Biol. 108, 325-3233 (1997).
- Kessler, C. The digoxigenin:anti-digoxigenin (DIG) technology--a survey on the concept and realization of a novel bioanalytical indicator system. Mol Cell Probes. 5, 161-205 (1991).
- Panoskaltsis-Mortari, A., Bucy, R. P. In situ hybridization with digoxigenin-labeled RNA probes: facts and artifacts. Biotechniques. 18, 300-307 (1995).
- Qian, X., Lloyd, R. V. Recent developments in signal amplification methods for in situ hybridization. Diagn Mol Pathol. 12, 1-13 (2003).
- Mello, C. V., Jarvis, E. D., Denisenko, N., Rivas, M. Isolation of song-regulated genes in the brain of songbirds. Methods Mol Biol. 85, 205-217 (1997).
- Pinaud, R. GABAergic neurons participate in the brain's response to birdsong auditory stimulation. Eur J Neurosci. 20, 1318-1330 (2004).
- Velho, T. A., Pinaud, R., Rodrigues, P. V., Mello, C. V. Co-induction of activity-dependent genes in songbirds. Eur J Neurosci. 22, 1667-1678 (2005).
- Tremere, L. A., Jeong, J. K., Pinaud, R. Estradiol shapes auditory processing in the adult brain by regulating inhibitory transmission and plasticity-associated gene expression. J Neurosci. 29, 5949-5963 (2009).
- Pinaud, R., Mello, C. V., Velho, T. A., Wynne, R. D., Tremere, L. A. Detection of two mRNA species at single-cell resolution by double-fluorescence in situ hybridization. Nat Protoc. 3, 1370-1379 (2008).
- Pinaud, R., Jeong, J. K. Duplex fluorescence in situ hybridization in the study of gene co-regulation in the vertebrate brain. Methods Mol Biol. 611, 115-129 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved