Method Article
膜電位、シナプス応答、神経回路、ニューロモデュレーションとザリガニを使用して筋肉の組織学:学生研究室の演習
要約
実験は、筋肉の構造、シナプス応答、イオン勾配や膜電位に対する透過性の影響を調べるには経験を積むために学生のための簡単なアプローチを示しています。また、感覚 - CNS -モーター筋回路は、神経回路上に化合物の影響をテストする手段を示すために提示されます。
要約
このレポートの目的は、生物学的膜を横切ってイオン勾配による影響の理解を深めることを支援することです。膜の外側に+ Kの(1)イオンの濃度、および特定のイオンに対する膜の(2)透過性:細胞の膜電位に影響を与えると我々はこれらの実験に取り組むその二つの側面があります。ザリガニ腹部伸筋は、それらの生化学的及び生理学的な表現型で、だけでなく、その構造にあるというトニック(遅い)と相性その他(高速)とのグループ内にあります。これらの筋肉を支配する運動ニューロンは機能的特徴に対応して異なっている。我々はこれらの筋肉だけでなく、シナプス伝達の特性を実証するために表面的、強壮腹部屈筋を使用。さらに、我々は回路の一部にはクチクラ感覚刺激の効果だけでなく、神経修飾物質の影響を実証するために感覚CNS -運動ニューロン筋の回路を紹介します。この演習で得られた技術を使うと、1つは他の実験の準備にだけでなく、医療や健康に関連する生理的なアプリケーションの残りの多くの質問に答えるために始めることができます。我々はすべての動物に関連する基本的な質問に対処するためのモデルの無脊椎動物製剤の有用性を実証している。
プロトコル
1。はじめ
これらの実験室での演習の目標は、興奮性膜、静止膜電位のイオン基礎、及び膜電位を測定する方法の特性を理解することです。さらに、筋肉の染色と組織は、筋肉の構造を教えるために使用できる、提示される。また、解剖の準備、2つの異なるタイプのは、様々な筋肉群におけるシナプス伝達の特性を実証するために使用されます。完全な感覚中枢神経系(CNS) - 運動ニューロン筋回路ザリガニの腹部には、感覚刺激と回路の側面に関するneromodulatorsと神経伝達物質の影響を調べるために準備を提示するために使用されます。
このレポートの最初の部分は、静止膜電位と膜電位に対する細胞外のK +の影響を測定するために使用されるアプローチを提示。我々はまた、筋肉の構造を紹介します。この演習の後半では、我々は神経筋接合部(NMJs)の異なるタイプのシナプス応答を測定する様々な手段を提示する。最初の演習では、ザリガニ腹部伸筋を使用し、2つ目は腹部浅屈筋を使用しています。さらに、我々は、保守が容易な神経回路(感覚入力と運動出力を持つザリガニの腹神経索)を提示し、その感覚CNSのさまざまな側面での教育のためだけでなく、研究用に使用することができます - 運動ニューロン筋回路。最初の演習の解説を完了した後、我々はNMJsと中枢神経系の回路の生理機能を示す。
生体膜を横切るイオンの勾配は、電位差が発生する可能性があります。安静時のセルの場合は、細胞膜を通過する電荷のこの違いは、細胞の静止膜電位と呼ばれています。我々はその影響を細胞の膜電位に対処する2つの主な要因があります。最初は膜の両側にイオン濃度である。二つ目は膜のイオン透過性です。生きている細胞で、細胞の内側と外側の様々な濃度の異なるイオンの数があることに留意することが重要です。我々が対処する主要なイオンは、ナトリウム(Na +)、カリウム(K +)と塩化物(Cl -)のです。筋肉の膜を通過する量とこれらのイオンの動きは、膜電位を決定する。この基礎から、我々はシナプス応答の膜の電気的興奮と抑制の間に観測された電位に対処し、薬理学的作用物質の効果を調べることができます。我々はまた、実験的なテストの概念(ロビンソンら 、2010)にこれらのプロセスを表現するために生物物理学的モデルを構築することができます。
ガラス毛細管微小電極を使用すると、膜電位の記録を可能にします。電極は先端が十分に小さいと膜電位の正確な測定を得ることができるの提供、損傷することなく細胞膜を介して挿入することができます。技術は、細胞内電極の挿入により損傷する可能性の低い大規模な細胞、に特に適用される。これは生理学の本質的な技術の一つです。
Na +とKのバランス+細胞膜を横切っては、生理的条件下でのNa - K ATPaseのポンプによって維持されます。通常の条件下でポンプの動き、平均で、三のNa +外のセルにセル二のK +の。サイドノートとして、ノーベル化学賞は、1950年代後半に戻って作られたこの発見のために1997年に授与されました。発見のファンダメンタルズは、カニ(Skou、1965、1998)から軸索を用いた研究から得られた。
それは細胞膜が脱分極のときにポンプに大きな能力(Skou、1989a、b)を持たないので、このポンプは、起電性と見なされます。セルが電気的脱分極によって活性化されたときに多くの細胞では、ポンプがスピードアップします。
細胞が静止状態にある間にカリウムもカリウム"リーク"チャネルを介して移動することができます。これらのカリウム漏洩チャネルのために、安静時の細胞膜は、他のイオンに比べてカリウムの透過性です。従って、細胞の静止膜電位はナトリウムに比べカリウムの平衡電位に近いです。静止膜電位は、それがカリウムの平衡電位に依存しているかどうかを調べることができます。
1)筋肉の変動
甲殻類の筋線維は構造上の特徴、膜の電気的性質と脊椎動物の筋線維に比べ収縮特性の大きなばらつきを示す。甲殻類における相動性筋線維は収縮型の収縮のために変更されます。それらは薄い短いサルコメアの長さ(2-4ミクロン)、、直線Z -線、太いフィラメントに薄いの比率が低い、とT -細管と筋小胞体の発達したシステムによって特徴付けられる胞体。相動性筋線維膜には、段階的または全か無かの活動電位を生成することがあります。緊張筋線維は、その一方で、緊張の長期維持のために変更されます。彼らはしばしば10〜15ミクロン、厚さ、波状のZ -ライン、T -細管と筋小胞体の太いフィラメントに薄い、とあまり開発されたシステムの割合が高いのサルコメア長さを有する。トニック筋線維膜はしばしば電気的な冷静なもの、またはそれらが傾斜電気的反応を("傾斜スパイク")を生成する可能性があります。中間の繊維の種類は幅広い。甲殻類筋肉に含まれています。
2)式
一般的にイオンと静止膜電位の平衡電位を決定するために使用される方程式はそれぞれ、ネルンストの式とゴールドマン - ホジキン - カッツ(GHK)の式です。 GHK方程式を越えて複数のイオンとその勾配の透過性を考慮することにより静止電位を決定するために使用されているのに対し、二つの方程式の重要な違いは、ネルンストの式は、そのイオンの平衡電位を求めるために1つの特定のイオンのみに使用されるようです。細胞膜(ネルンスト、1888、1889、ゴールドマン、1943、ホジキンとハクスリー、1952;ホジキンら、1952;。HodgkinとKatz氏は、1949年、ヒレ、1992を参照)。
ネルンストの式は、一般的に、一般的に示すように、起電力を発生させる膜を横切ってイオンを対象とみなされます。
V =(RT / ZF)はln([X] / OUT [X] で )
興味のX =イオン
膜を通過するXイオンのVは=平衡電圧
R =気体定数[8.314 J /(モル•K)]
T =絶対温度[ケルビン]
イオンのZは=価
F =ファラデー定数[9.649 × 10 4 C /モル]
K +イオンは20℃と定数に充填して10を一緒にログにLnの変換は、一つに到着の場合:
潜在的な= 58ログ([ 出力 K] / [ の K])、mV単位で表さ
私たちはその唯一のK +が拡散によって透過性であると仮定します。 [ の K]はKである+ [ 出力 K]セルとの内部の濃度はK +の細胞の外側の濃度である。
[ の K]運動の推定値として。 ______________
この計算で想定し、膜電位はK +の平衡電位にのみ依存します。
[ 出力 K]与えられた=使用される生理食塩水5.4 mmです。また、膜電位が- 70mV以下であると仮定します。
潜在的な= 58ログ(/ 5.4 [ の K])。
実験では、細胞の静止膜電位を測定し、それが[Kを出力 ]変更によって影響される方法が決まります。 [ アウト K]膜電位とを関連付ける仮想線の傾きは58です。 (5.4 mMのから100mMの範囲)[ アウト K]様々で、静止膜電位のデータを収集した後で我々は仮想線と一致するものがあるかどうかを判断するために観測値をプロットします。我々は5.4 mMで得られた平均静止膜電位[Kを出力 ]を使用します比較のための仮想と観測された行を開始するために。
膜は、安静時だけでなく、様々な脱分極した状態で複数のイオンを透過させることができることを考えると、一つのアカウントに、様々なイオンの透過性(式中のP)を取るGHK方程式を使用しています。膜が1つしかイオンに対して透過性である場合GHK方程式は、ネルンストの式に削減されます。
ここでのNa +、K +、およびClのための一般化GHK方程式である-イオンは: 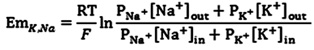
塩素以来-負の電荷を持って、濃度の項は内側と外側のため、この式で反転されます。これは、Z(イオンの電荷が)中断することができます。
3)この演習のねらい
この実験ではザリガニの筋細胞の膜電位を測定し、対処するために、上述の原則を適用します。
- 適切な計測機器と技術を持つ細胞の膜電位を測定する方法。
- イオンの筋細胞膜の透過性と、それがどのように膜電位に貢献する。
さらに、我々は、筋肉の構造の予備調査を行います。 - これらの電気生理学的実験を行うために使用されるザリガニの腹部の背側面の筋肉の解剖学的構造を強調するために汚れを使用してください。
- 別の筋線維タイプの組織型を調べます。
この研究室の演習では、我々はザリガニ腹部伸筋を使用します。この製剤は、生理学では、これらの原則を教えるために、過去に使用されていますD解剖学(アトウッドとパーナス、1968)。我々は現在の計測機器に対応するために、単一の3時間の学生実験の期間で目標を完了するためにこのソースと変更された他人からの手順の多くを使用している。これらの演習は、ケンタッキー州の大学(講師博士RLクーパー、2010)における生物学教室の動物生理学のコースで使用される他の実験の基礎となります。
4)なぜ、このモデル動物
この実験ではザリガニ腹部の伸筋を使用するためのいくつかの良い理由があります。
- ザリガニは、一般に入手可能であり、実験室の条件で維持するために、比較的安価で簡単です。
- 解剖では、ライブの準備のために解剖の技術を学ぶ学生のための比較的簡単です。
- 筋肉は電気生理学的手法を学ぶ学生のためにも役立つ最小限の生理食塩水で数時間安定です。外部[K +]短い期間のために変更されたときに筋肉の準備はかなり堅牢です。
- 様々なシナプス応答は、運動ニューロンを刺激することによって容易に得ることができる。
- 伸筋の解剖学的配置は、識別が容易であり、サイズが大きいため、安定した細胞内記録を得ることが比較的容易です。
- 筋肉と神経支配のパターンは、メチレンブルー染色で容易に観察することができます。さらに、特定の筋線維のタイプは、容易にサルコメア構造を観察するために組織学用に処理することができます。
- いいえ動物プロトコルは、米国内の多くの機関で研究室の実験での無脊椎動物、動物の準備のため、現時点では必要ありません。
2。の方法
1)材料
- はさみ(1)
- 鉗子(1)
- アース線用のシルバーワイヤー(1)
- 顕微鏡(1)
- 電極プローブ(1)
- 底のSylgardとペトリ皿(1)
- 生理食塩水(1)
- カリウムソリューション:5.4mM(生理食塩水)、10、20、40、80、100 mMの
- 漂白剤は、(少量のAg - Clを構築するために銀のワイヤーの先端のために使用します。)
- 削除し、ソリューションを追加するには、ガラスピペット(1)、
- シリンジ(1)
- アンプ/収集システム(1)
- ファラデーケージ(1)
- デスクトップ/ラップトップ(1)
- 解剖のピン(4)
- ザリガニ
2)方法
2.1)の準備/解剖:
- ボディーの長さのザリガニに、約6〜10 cmの(または管理可能なサイズ)を入手する必要があります。頭の後ろでザリガニや目の後ろから約センチメートルを保持する。ザリガニやその口の爪がザリガニを処理する個々に到達できないことを確認してください。 (ザリガニは頭を切断する前にそれを麻酔するために5分間砕いた氷に置かれるかもしれない。)
- すぐに頭を削除するには、大きなはさみを使用してください。ザリガニの目の後ろからきれいにし、迅速にカットを行います。ヘッドと付属物を処分する。

図1画像は、ザリガニの頭を削除するには、カットの配置を示します。 - ザリガニの足と爪は怪我を避けるために、この時点で削除することができます。男性と女性の両方の男性とswimmerets上でスタイラスも(図2)削除することができます。次に、胸部から腹部を分ける。 (図3)腹部と胸部を結合する関節膜に沿ってカットを行います。ザリガニの腹部の部分を保存し、胸部処分する。

図2。ハサミは、スタイレットを削減しています。これらは、ザリガニから削除することができます。
図3。画像は、腹部から胸部を削除するには、カットの配置を示します。
図4。腹部から胸部の除去。カットは、セグメントの結合で線に沿って循環方式でなされるべきである。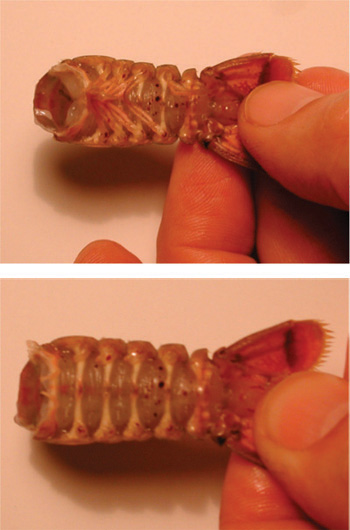
図5。上部の画像は、遊泳脚付属器と腹部を示しています。下の画像は、遊泳脚の付属のない腹部を示しています。 - 腹部で、カットは腹部の各側面の下側、外側縁に沿ってシェル内で行う必要があります。ケアは、ザリガニに深くカットしないように注意してください。シェルを切断のプロセスを支援するため、カットは腹側に向かって斜めに下に軽蔑的なポインティングハサミで行う必要があります。各セグメントの長さを実行する(図6)ザリガニの線の自然なシェルのパターンに従ってください。

図6。はさみが斜めに配置され、シェルの自然なアラインメントに従っています。深すぎるカットと準備を破壊しないでください。矢印はカットのために従わなければならない各セグメントに沿って自然なラインにポイントを率いている。 - シェルの腹側部分を削除します。腹部の筋肉を破壊しないように注意してください。腹側部分を削除するには、ピンセットを使用してください。シェルの腹の部分が削除されるときに、組織の白い塊が深い屈筋の上に見ることができます。この組織は、ピンセットで慎重に除去することができます。

図7。ピンセットで殻の腹側部分を削除する。削除するには、腹側部分を引き上げ、バック。腹側シェルの下に筋肉を破壊しないでください。
図8。破棄されるシェルの腹の部分に戻って引っ張る。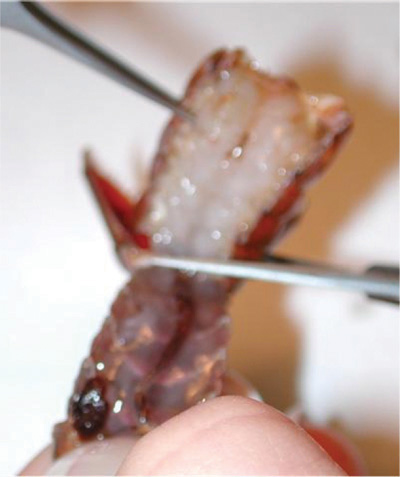
図9。ハサミと準備の腹側部分を切り取って捨てる。 - 消化管、深い屈筋の正中線に沿って実行している小さなチューブは、ザリガニから削除することができます。鉗子で管の上部をつまんで、腹部から引き出します。管の底部をカット - 尾の終わりに。糞便廃棄物は、準備に干渉しないようにするために生理食塩水で解剖をすすぐ。

図10。画像は、準備から消化管の除去を示しています。 - ペトリ皿に準備を確保するために解剖のピンを使用してください。準備の上部と下部の角が皿に釘付けされるべきである。食塩液をシャーレに注ぎ、細胞内記録が実行されるまで完全に準備をカバーする必要があります。
この解剖皿には、昆虫のピンがそれに付着することができるように底面のSylgard(ダウコーニング)コーティング(厚さ1CM)の必要があります。
解剖の準備は、標準的なザリガニ生理食塩水に浸し205 NaClで行われるヴァンHarreveldのソリューション(1936年)、から変更されています。5.3KCl、13.5のCaCl 2、2H 2 O、2.45のMgCl 2、6H 2 O、5 HEPESおよびpHに調整7.4(mMで)。
2.2)細胞内記録

図11記録装置の全体的なセットアップ。
- 準備とペトリ皿を顕微鏡下に置き、動きを防ぐために皿の底にワックスで保護する必要があります。

図12。顕微鏡下準備の配置。ペトリ皿と準備を確保するためにワックスを使用してください。 - 各一端に接続されている銀線の長さが短いと2本のワイヤを取得する必要があります。銀線は、Ag - Clの塗膜を得るために約20分間の漂白剤の少量の中に浸漬する必要があります。使用前に水で線を洗ってください。ガラス内ピペットを得て、慎重に3M KCl溶液で満たされた注射器に取り付けられた長い針を充填する必要があります。ピペットが下がって(床に面した開口部)とソリューションで埋めなくてはなりません。これは余分なKClが電極の背面を滴下されることを保証します。はKClが生理食塩水風呂に入るガラスのピペットに沿って実行されないことを確認してください。塩化カリウム溶液で充填終了時に直立ピペットをオンにします。銀線は、その後ピペット内に配置することができます。もう一方の端はアンプのヘッドステージに+(プラス)極に接続されています。ピペットは、電極プローブに固定される。ケアは、電極の先端を破損しないようになされるべきである。ファラデーケージに取り付けられた3番目の線はヘッドステージの緑の極に配置する必要があります。以下に示す(負)極 - 最後に残っている鉛の銀線はバスとに接続されたもう一方の端に配置する必要があります。ワイヤーは、ADコンバータPowerlabのグランド部にファラデーケージから配置する必要があります。ヘッドステージは買収/アンプの"入力プローブ"(Powerlab)に接続されています。
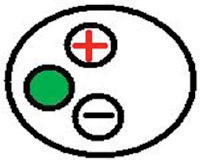
図13。ヘッドステージの構成。ヘッドステージの緑の入力に接続されたワイヤは、アンプまたはファラデーケージに接地されている。赤入力に接続されたワイヤは、電極の線に接続されています。黒の入力は、入浴液に接続するために使用されます。
図14。"テストトグル"電極resistance.The"粗い"ノブがまた検出されたテストするために一番下の行にあるDCオフセットの下になるが賢明カウンタクロックをオンにする必要があります。ゲインは、50倍の信号を増幅する50に設定されています。ヘッドステージからアース線は"GND"ピンジャックの開口部に配置されます。 - LabChartソフトウェアは、デスクトップまたはラップトップ上で開く必要があります。その後、"チャンネル設定"を"Setup"をクリックして、1つのチャネルだけを表示するチャートを調整するチャンネルの下の"チャンネルの設定、"変更のナンバーワンに。 "OK"をクリックします。チャートの上部、左側のコーナーでは、秒あたりのサイクル数は、2Kにする必要があります。 200mVの約500mVまでにボルト(y軸)を設定します。画面の右側の部分で"チャンネル1"をクリックしてください。 "入力アンプ"をクリックします。差動ボックスがチェックされていることを確認します。
アンプ出力は、チャンネル1にする必要があります。以下の設定は、アンプと組み合わせて使用する必要があります。- ハイパス- DC
- ノッチフィルタ- OFF
- パススルー20kHz低
- 容量コンプ.-反
- DCオフセットノブを反時計ファインとコース
- DCオフセット(+ OFF -) - OFF
- ゲインつまみ- 50
- 入力(DIFF MONO GND) - DIFF
- MODE(STIM - GATE - REC) - REC
- ΩTEST- OFF
- 電極抵抗の尺度として、電圧は2.0 nAの(すなわち、R = V / I、またはオームの法則)である、現在で割る必要があります。結果の値は、ガラス電極の抵抗です。抵抗は20〜60 MegaOhmsでなければなりません。低い(<20)と高抵抗(> 100)は認められません。抵抗が決定されると、細胞内記録を開始することができます。生理食塩水槽にガラス電極の先端を置きます。アース線は、生理食塩水浴にもなっていることを確認します。
録音を開始するには、画面の下部に起動を押してください。ゲインが5 V / divに設定されていることを確認してください。電極を挿入する前にゼロにLabChartでラインを移動するには、アンプのコースのノブを使用してください。トグルノブは、電極の抵抗をテストするために数回にしてからオフにする必要があります。次に、結果の値の振幅を測定する必要があります。安定したベースライン上に複数のマーカを配置し、電極の抵抗を得るために、ピークで2番目に置きます。 - 準備の縦筋(DEMまたはDEL1またはdel2は)(図16を参照)に電極を挿入する電極プローブと顕微鏡を使用してください。電極は、ほとんど筋肉に挿入する必要があります。筋肉を貫通しないでください。縦筋肉を見つけるために、筋肉に電極を挿入するために顕微鏡やプローブの設定を使用します。高輝度の照明は、電極が挿入されていると明らかに筋肉を見て調整する必要があります。この準備のために筋線維を突っついたりした場合に一般的に筋肉内のスペースや裂け目に実行することができます。これは、膜電位が出現、その後消えて、その後再び現れることができる理由です。

図15。筋肉への電極の挿入。 - 膜電位を測定するために、電極を挿入する前にゼロにLabChartでラインを移動するには、アンプの粗ノブを使用してください。筋線維を突く。次に、結果の値の振幅を測定する。安定したベースライン上でマーカーを配置し、値を記録。
マーカとアクティブなカーソルの違いは、画面の右側に表示されます。値は、電圧を与える。記録された電圧は、アンプで使用される増幅の量(すなわち、10倍または100倍増幅)で割った値が必要になることがあります。値はボルトのようにソフトウェアで報告されている場合は、電圧はボルトから数ミリボルト(1 V = 1,000 mVの)に変換する必要があります。 - 慎重に筋肉から電極を除去するために顕微鏡やマニピュレータを使用してください。別の筋線維を突くと、静止膜電位の点に注意してください。一つは、いくつかの録音を取り、興味の筋肉繊維に細胞間の電極を指示するだけでなく、施策に満足することでしょう。
電極は、おそらくすべての異なる変化した[K +]アウトソリューションの変更中に一筋線維に滞在しません。電極を撤回することをお勧めですし、筋肉の損傷を防ぐために、再び浸透し、ソリューションを変更してください。それは、別々の筋線維からソリューションごとに3測定値を取得し、任意のスプリアス測定を避けるために平均を使用するのが最適です。 - ペトリ皿から生理食塩水を削除し、破棄するように注射器を使用してください。ペトリ皿は、完全に準備をカバーする、塩化カリウム生理食塩水の次に高い濃度で埋めなくてはなりません。同じプロセスは、それぞれのカリウム溶液を繰り返すことが必要と電圧/電位の変化を注意して記録すべきである。我々が使用する一連の[K +] 外ザリガニ生理食塩水があります:5.4、20、40、60、80、100 mMの。
2.3)解剖学
今生理が完了したことを、我々は、関連を調べることができます筋線維と神経支配のパターンの解剖学。染色皿に準備を移し、メチレンブルー(ザリガニ生理食塩水100mLで混合メチレン青の1グラム)を追加します。生理食塩水で5分の準備を入浴してから削除し、染色することなく、新鮮なザリガニの生理食塩水を追加してみましょう。これらの筋肉の解剖学は、(;巡礼者とWiersma、1963ハクスリー、1880)年間に詳細に記載されている。ごく最近になって筋肉のいくつかは生理的、生化学的、解剖学的に記載されている(。。グリフィスら、2000;。Cooperらが 、1998年孫ら、2000。)。
筋肉の一般的な解剖学的なレイアウトは、図16(この目的のために図の右側)に描かれている。セグメント内で主に筋肉をinnervatesメイン神経を探します。 SEM、del2は、DEL1とセグメントにおけるDEM筋肉への神経支配のパターンをスケッチします。腹部は、しっかりと料理の準備を固定することによって完全に伸ばしする必要があります。次の生理食塩水を削除し、固定液を加える。修正液はブアン溶液(シグマ - アルドリッチ社飽和ピクリン酸、ホルムアルデヒドや酢酸を用いて調製した)です。
注意。皮膚や目にこのソリューションを取得しないでください。ヒュームフードの下で働くことによってソリューションの蒸気を避けてください。あなたの目には目の洗浄ステーションで即座にあなたの目を洗い流す焼くに開始する場合。
ブアン溶液は約10分の準備に残るし、ピペットと生理食塩水用交換ソリューションを使用してみましょう。 DEL1またはdel2は筋肉の外の薄い部分を切り取り、ガラススライド上に置きます。スライドにラベルを付けます。 SEMの筋肉のための手順を繰り返します。両方の組織標本におけるサルコメアバンドパターンを表示します。あなたのバンドパターンを確認するために化合物の顕微鏡を使用し、それに応じて目標を調整することができます。可能性が顕微鏡のアイピースを介してデジタル写真を撮影する場合(注:一部の携帯電話のカメラは、この手順のために働く)。
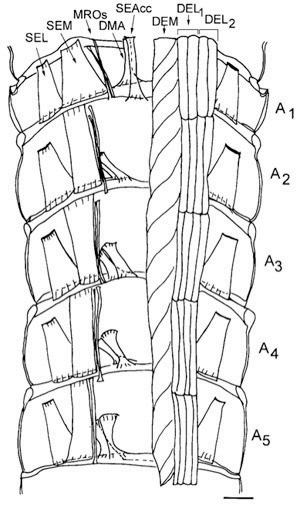
図16各セグメントの伸筋組織を示すザリガニの腹部の背の部分の腹側から見た模式図。背側細胞膜の腹部の筋肉(DMA)と浅伸副筋のヘッドは(SEAcc)各セグメントごとに異なる方向と腹部の5までのセグメント1で発生します。セグメント1の例外を除いて、これらの筋肉が石灰化背板への前端で、関節の膜の後端に、その結合部位を持っている。セグメント1に、相同筋は、胸部と腹部の間にある関節膜への前方付着部位を持っている。イラストはメチレンブルー染色した調製品の写真のモンタージュに基づいていた。図の左側にすべての深い伸筋は背側表面的な伸筋を表示するために削除されています。規模= 2.35 mmを。 (孫ら、2000から引用)。
3。結果
次の質問およびデータ処理は、この検査法の主な原則と目標を示しています。
- 各[K +] 外使用における静止膜電位で得られた措置をプロットします。観測されたと仮定の行は、その傾きに一致した場合に参照してください。プロットする値は、x軸との片対数プロットを使用して様々な[K +] ログアウトし、膜電位(以下に示すように、図17)のy軸として。 (必要に応じて自由なグラフ用紙をダウンロードhttp://incompetech.com/graphpaper/logarithmic/を )

図17。グラフ用紙
[K +]から比較するための仮説と観測された行を開始するために5.4 mMで得られた平均静止膜電位を使用してください。
ラインはこれがかもしれない理由について議論が一致しない場合。 - あなたがNa +イオンの外部レベルを変更している場合は、K +濃度を変更するための観測としては、変化の同じ種類を期待?
- 神経に比べてどの程度のメチレンブルーは、筋肉を汚すのですか?なぜ違いがあるかもしれません?ライブヒト細胞の組織やコントラストの識別のために今日使用されるメチレンブルーですか。ジークムントフロイトとザリガニで使用されている汚れとそこには何関係ですか?
- DELとSEMの筋肉の間にサルコメアのパターンの違いに注意してください。もしそうなら、理由は何でしょう?すべての筋肉が同じ休息サルコメアの距離を持っていますか?あなたが(既知のサルコメア筋肉の解剖学的構造との関係で)可能な限り図の多くは顕微鏡とラベルで観察筋肉バンディングパターンを描画します。
4。シナプスReを測定sponses
1)はじめに
静止膜電位を示すために使用される腹部の伸筋の準備にも様々な筋肉からNMJsでシナプス応答の誘導を示すために理想的です。いくつかの単一繊維はそのような足を歩いてザリガニの伸筋(アトウッド、2008年のように両方の相動性および持続性興奮性運動ニューロンによって支配することができるものの、甲殻類の一部の筋肉が選択的に、相動性または強直運動ニューロンのどちらかによって神経支配されています。Joveの参照してください生産のID#2319 -呉とクーパー、2010)および他のほとんどの四肢の筋肉(Wiersma、1961a)。選択的に相動性および持続性の運動ニューロンを刺激することによって、EPSPの中の生理的な違いを測定することができる。相動性運動ニューロンは筋線維の単収縮急速に生産し、10から40 mVのオーダーのEPSPの呼び起こす。相動応答は、刺激の5〜10 Hzの電車で急速に低下させることができる。トニック運動ニューロンは、刺激のより高い周波数(10〜50 Hz)の存在下で促進することができる小さいEPSPのを生じさせる。構造的に、NMJsにおけるシナプス前一過性および強直端末が異なっている(アトウッドとクーパー、1996; Bradacs ら、1997;。。Cooperら 、1998)。
(。。メルシエとアトウッド、1989 Cooper ら 、1998)意外にも相性生理反応の表現型は、7日間毎日数時間のための電気エアコン相動性ニューロンによって強壮剤のような状態に変換を受けることができる。また、変換されたNMJsの神経調節に感受性が受容体の発現の調節(グリフィスら 、2000)を調査するための素数です。
この比較的堅牢な準備(ザリガニ腹部の筋肉)、強壮剤と相動性応答の両方で簡単にファシリテーションおよび/または様々な刺激パラダイムによるシナプス応答のうつ病のために記録し、検査されます。これらの製剤で、学生は神経束を刺激することにより、一過性および持続性シナプス応答の一般論を認識できるようになります。
提示の追加NMJの準備はCNSから本質的な運動能力と感覚刺激誘発される自発運動量をモニタするのに使用されます。これは、ザリガニの腹部の腹側の屈筋群です。この調製物はまた感覚- CNS -モーター筋回路と神経修飾物質の影響(ストラウンら 、2000)を監視するために使用されます。
(1)それらの制御腹肢(swimmerets)運動、(2)3つの伸筋及び(3)3屈筋:腹部セグメント(最後を除く)のそれぞれの筋肉の3つの官能基がある。屈筋と伸筋は体節間のヒンジの回転を引き起こすことによって腹部屈曲または伸展のどちらかをもたらす筋肉の拮抗グループです。トニック筋肉が背側(伸)と、各腹節の腹側(屈筋)の側面にまたがる繊維の薄いシートを構成しながら相動筋組織は、ほとんどの腹部の体積を占めます。
ザリガニでは、ザリガニのトニック腹部屈筋は、5つの運動ニューロンでと末梢抑制性ニューロンで半分ずつのセグメントに神経支配されています。興奮性運動ニューロンは、神経伝達物質としてグルタミン酸を使用してください。グルタミン酸は、主にナトリウムイオンの透過性の増加を引き起こすことによって筋線維を脱分極。抑制性ニューロンは通常、塩化物イオンの透過性の増加を引き起こすことによって筋線維をhyperpolarizesγ-アミノ酪酸(GABA)を、離します。一部の甲殻類の筋肉(主に手足の)で、末梢抑制性ニューロンは運動ニューロンの端末と同様に筋線維とのシナプス連絡を行い、運動ニューロン(シナプス前抑制)(Dudelとカフラー、1961年までリリースされた送信機の量を減らす)。この現象は、ザリガニのトニック屈筋に存在しません。
ザリガニの腹神経索は、動物の長さを実行している左右対称の構造である。ボディのセグメントごとに神経節があります。腹部(6セグメント)で、各神経節では、数百のニューロンを含んで、二つの結合子のそれぞれは、数千の軸索から構成されています。神経の細胞体は、各神経節の腹側表面に厚い層、いくつかの細胞体を形成する。すぐに細胞体層上に神経突起の微細な網目構造、神経網です。すべてのシナプスの相互作用は、ここで発生、細胞体はシナプスを欠いている。
それぞれの腹部神経節は、(最後を除く)各側に3つの根を持っています。第二ルートは、一過性および強直性伸筋筋肉や感覚軸索を神経支配軸索が含まれています;最初のルートは、腹肢筋肉や感覚軸索を神経支配ニューロンの軸索が含まれており、神経節の尾側の神経脊髄数mmを残し三乗根は、軸索innervが含まれています相動性および強直性屈筋の筋組織を阿。三乗根の2つの分岐があります。深枝(IIIA)は、相の屈筋をinnervates。各ハーフセグメントの第三ルート(IIIb)の浅枝はトニック屈筋を支配するsix軸索が、含まれています。
トニックの屈筋を支配する神経細胞は一過性遠心性ニューロンとは異なり、自発的にアクティブとなるため、腹部が動物から除去された後で良い準備に、彼らは多くの時間のために発射していきます。これらの腹部の準備で行われた発見の歴史的性質の見直しのためアトウッド(2008)を参照してください。 4つの運動ニューロンの、任意の半分のセグメントにトニック屈筋を支配する末梢抑制性ニューロンの細胞体は、そのセグメントの神経節に位置しています。残りの運動ニューロンの細胞体は、次の尾神経節に位置しています。これらのニューロンは、確実にextracelluarly記録されたスパイクの振幅に基づいて互いに区別されることがあります。半分のセグメントからトニック屈筋がこの筋肉を支配する神経細胞を含む二つの神経節と一緒に削除される場合は、5ニューロンは、通常、自発活動のある程度を示す。これらのニューロンは昇順で、相対的な細胞外スパイクの振幅に基づいて番号が付けられます。 F4 F1から運動ニューロンとF5、最大の自発的活性ニューロンは、末梢屈筋の阻害されています。 F6、最大の運動ニューロンは、ほとんど自発的にアクティブではない興奮性運動ニューロンです。
トニック運動ニューロンの活動の自発的な性質は化合物の外因性アプリケーションによって、または運動神経の活動のために監視されている同じセグメント内のキューティクルに感覚刺激を提供することによって調整することができる。
2)解剖
腹部伸筋の準備の細胞外カリウムとの関係で静止膜電位を調べるために上記と同じ手順を取得する。違いは、甲羅の側面に沿って実行される分節神経束の世話をすることです。この神経は刺激電極として機能する吸引電極に引っ張られます。相動性応答を監視するための1 Hzで刺激する。トニックの応答をモニタしながら10〜20の刺激のためのパルス10Hzの短いバーストを刺激する。
ザリガニのトニックの屈筋に実験を世話するための実験手順は異なってあり、1つのニーズは、腹側神経索をそのままにする。いくつかの腹部のセグメントで構成される準備が行われます。これは次のように取得されます。
- ボディーの長さのザリガニに、約6〜10 cmの(または管理可能なサイズ)を入手する必要があります。頭の後ろや目の後ろから約2〜3センチメートルからそれを持って、ザリガニを取得します。ザリガニを取り扱う際にはザリガニや口の爪は、実験者に到達できないことを確認してください。それらを削除した後、頭部と付属物を処分する。
- すぐに頭を削除するには、はさみを使用してください。ザリガニの目の後ろからきれいにし、迅速にカットを行います。

図18。画像は、ザリガニの頭を削除するには、カットの配置を示します。
ザリガニの足と爪は怪我を避けるために、この時点で削除することができます。男性と女性の両方の男性とswimmerets上でスタイラスも(図19と20)削除することができます。次に、胸部から腹部を分ける。 (図20)腹部と胸部を結合する関節膜に沿ってカットを行います。 - ザリガニの腹部の部分を保存し、胸部処分する。

図19。画像は、ザリガニから削除することができますスタイレットの配置を示します。
図20は 、画像には腹部から胸部を削除するには、カットの配置を示します。
図21。腹部から胸部の除去。カットは、セグメントの結合の線に沿って循環方式でなされるべきである。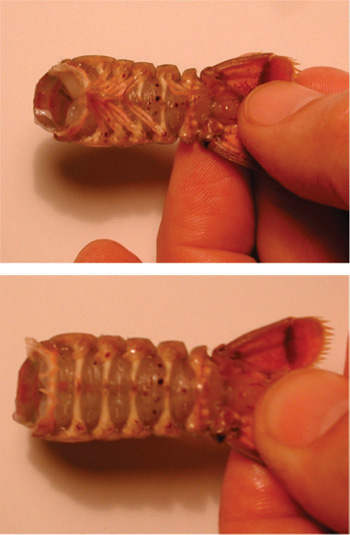
図22。上部の画像は、付属で腹部を示しています。下の画像は、腹部の付属肢の削除を示します。 - 大きなペトリ皿に食塩水で分離された尾の準備を置きます。皿に準備の尾と上部を突き止める。準備が安全であることを確認してください。肋骨の間の準備の腹側の正方形の部分を削除するには、メスを使用してください。
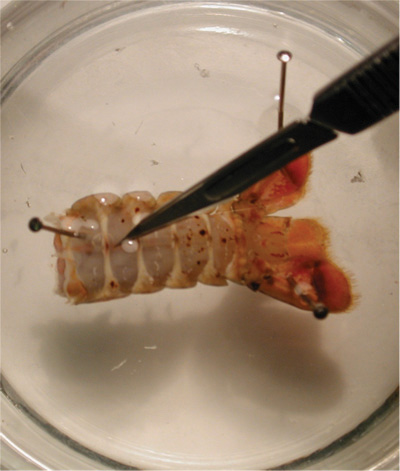
図23。カットは、準備の腹薬を除去するためになされるべき場所を示します。 - 小さなカットが(また、ハサミで行うことができます)なされるべきである。フラップを切断し、上向きに持ち上げる必要があります。フラップは、深い屈筋を公開する、はさみで除去することができる。顕微鏡は、準備の腹部分を除去する際に精度を確保するために、このプロセス中に使用する必要があります。
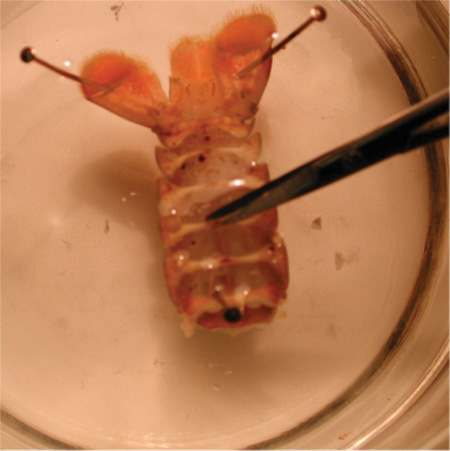
図24。筋肉を公開するためにはさみでカットの準備。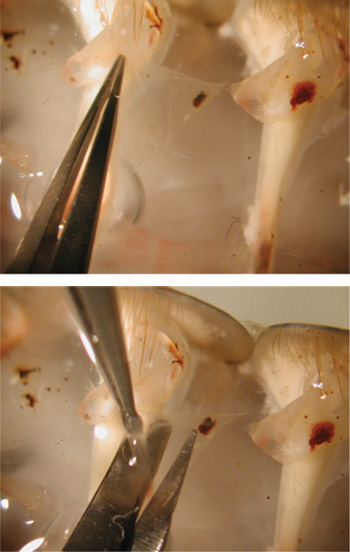
図25。トップ画像は、鉗子でフラップの把握を示しています。下の画像は、顕微鏡を使用して準備からフラップの除去を示しています。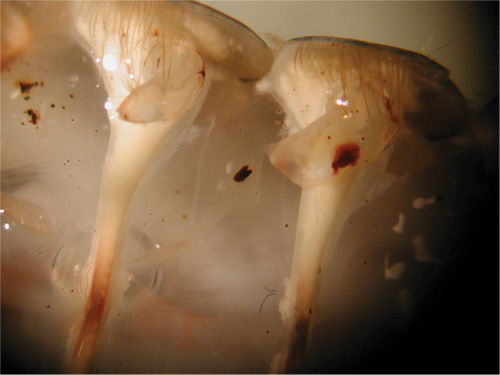
図26。浅屈筋の露出。
3)細胞内記録:

図27。録画機器の全体的なセットアップ。
- 準備とペトリ皿を顕微鏡下に置き、動きを防ぐために皿の底にワックスで保護する必要があります。

図28は。顕微鏡下準備の配置を示します。ペトリ皿と準備を確保するためにワックスを使用してください。 - 一端に接続されている銀線の長さが短いと2本のワイヤを取得する必要があります。銀線は、Ag - Clの塗膜を得るために約20分間の漂白剤の少量の中に浸漬する必要があります。使用前に水で線を洗ってください。ガラス細胞内のピペットは、塩化カリウム(3 M)溶液を得て、慎重に記入してください。ピペットが下がって(床に面した開口部)とソリューションで埋めなくてはなりません。後者は超過KClが電極の背面を滴下されることを保証します。はKClが生理食塩水風呂に入る予定ガラスピペットに沿って実行されないことを確認してください。塩化カリウム溶液で充填終了時に直立ピペットをオンにします。銀線は、その後ピペット内に配置することができます。もう一方の端は、ヘッドステージに+(プラス)極に接続されています。ピペットは、電極プローブに固定される。ケアは、電極のピペットを壊さないようになされるべきである。ファラデーケージに取り付けられた3番目の線はヘッドステージの緑の極に配置する必要があります。以下に示す(負)極 - 最後に残っている鉛の銀線はバスとに接続されたもう一方の端に配置する必要があります。ワイヤーは、ADコンバータPowerlabのグランド部にファラデーケージから配置する必要があります。ヘッドステージは買収/アンプの"入力プローブ"(Powerlab)に接続されています。
図29。ヘッドステージの構成。ヘッドステージの緑の部分に接続されたワイヤは、アンプまたはファラデーケージに接地されている。赤い部分に接続されたワイヤは、電極の線に接続されています。黒い部分が、入浴液に接続するために使用されます。
図30。"トグルTest"は、電極の抵抗をテストするために一番下の行になります。 "粗い"ノブは、賢明なカウンタクロックをオンにする必要があるDCオフセットの下にあります。ゲインは、50倍の信号を増幅する50に設定されています。ヘッドステージからアース線は"GND"ピンジャックの開口部に配置されます。 - LabChartソフトウェアは、デスクトップまたはラップトップ上で開く必要があります。その後、"チャンネル設定"をクリックして"セットアップ"で1つのチャネルだけを表示するチャートを調整するチャンネルの下の"チャンネルの設定、"変更のナンバーワンに。 "OK"をクリックします。チャートの上部、左側のコーナーでは、秒あたりのサイクル数は、2Kにする必要があります。 200mVの約500mVまでにボルト(y軸)を設定します。画面の右側の部分で"チャンネル1"をクリックしてください。 "入力アンプ"をクリックします。差動ボックスがチェックされていることを確認します。
アンプ出力は、チャンネル1にする必要があります。以下の設定は、アンプと組み合わせて使用する必要があります。- ハイパス- DC
- ノッチフィルタ- OFF
- パススルー20kHz低
- 容量コンプ.-反
- DCオフセットノブを反時計ファインとコース
- DCオフセット(+ OFF -) - OFF
- ゲインつまみ- 50
- 入力(DIFF MONO GND) - DIFF
- MODE(STIM - GATE - REC) - REC
- ΩTEST- OFF
- 電極抵抗を測定するために、電圧は2.0 nAのである現在、で割る必要があります。結果の値は、ガラス電極の抵抗です。抵抗は20〜60 MegaOhmsでなければなりません。抵抗が決定されると、細胞内記録を開始することができます。生理食塩水浴中にガラス電極の先端を配置。アース線は、生理食塩水浴にもなっていることを確認します。
録音を開始するには、画面の下部にある"スタート"を押してください。ゲインが5 V / divに設定されていることを確認してください。電極を挿入する前にゼロにLabChartでラインを移動するには、アンプのコースのノブを使用してください。トグルノブは、電極の抵抗をテストするために数回にしてからオフにする必要があります。次に、結果の値の振幅を測定する必要があります。安定したベースラインをoneメーカーを配置し、電極の抵抗を得るために、ピークで2番目に置きます。 - 筋肉に電極を挿入する電極プローブと顕微鏡を使用してください。筋肉を貫通しないでください。筋線維の薄層を検索し、繊維に電極を挿入するために顕微鏡やプローブの設定を使用します。筋肉を貫通する際に高輝度の照明は、光源として使用することができます。
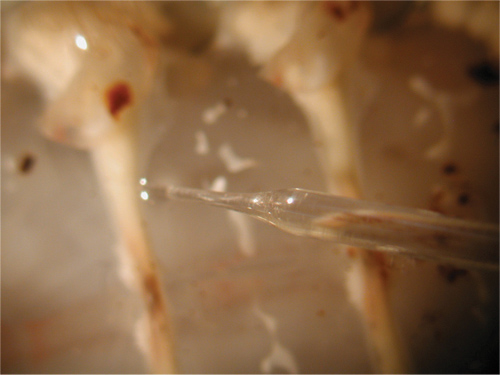
図31。筋肉への電極の挿入。 - ケアは、表面的な筋肉に神経根を損傷しないように注意する必要があります。
それは実験操作を行いながら準備クール(10-15℃)とよく酸素生理食塩水入浴を維持することをお勧めします。冷却ユニットが利用できない新鮮で生理食塩水を交換する場合は、定期的に生理食塩水を冷却。酸素ガス、または少なくとも空気は、生理食塩水を通してバブリングされるべきである。 - EPSPSの自発的活動を記録します。 EPSPSの異なるサイズに注意してくださいとIPSPsのが存在する場合。
- 非常に慎重に小さなペイントブッシュを取ると、手で一つ自発活動を監視していることを同一セグメント内でキューティクルの端に沿って刺激する。応答の周波数の変化を注意し、異なるサイズのEPSPのがキューティクルを刺激する前にはなかったように表示されます場合。
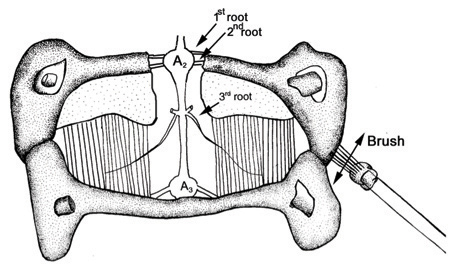
図32。ブラシや神経根を刺激すると準備。 (ストラウンら 、2000から改変) - 刺激は、慎重にそのようなCO 2でバブリングセロトニン(1 microM)または生理食塩水などの神経修飾物質を含むものと生理食塩水槽を交換した後に繰り返すことができます。与えられた刺激のための活動のプロファイルへの影響に注意してください。その初期状態に新鮮な生理食塩水を返すために活動を生理食塩水バックを交換する場合にも注意してください。
- 次に、人はさまざまな方法で感覚- CNS -モーターニューロン回路内の神経活動をモニターすることができます。我々は運動ニューロンの活動を監視するために吸引電極の代わりに細胞内電極(図33)を使用することができます。ガラス吸引電極の先端に、プラスチック製のチューブは、先端に神経を引っ張るために正しいサイズの開口部を持つ配置されます。神経は電極の圧力によって損傷されるため、小さすぎるか、神経が落ちると同じように開口部は、大きすぎてはいけません。プラスチック製のチューブは、炎を介してプルアップし、必要な大きさに戻ってトリミングされます。

図33。吸引電極記録の整理をセットアップします。
吸引電極を生理食塩水槽に簡単にアクセスできる位置にマニピュレータを配置します。まで生理食塩水吸引は、吸引電極内部の銀線に接触しているまで。電極の先端に近い吸引電極のカット面で他の線をアレンジなので、両方のワイヤには、生理食塩水浴との接触になります。
電気監視用として、電源のラボ26TにAC / DC差動アンプ(増幅器)を接続します。 PowerLab 26Tで入力1からアンプの出力に適切な電源コードを接続することによってこれを行います。- アンプのインストゥルメントのコントロールは、次の設定に設定する必要があります。
- ハイパス- DC
- ノッチフィルタ- OFF
- パススルー20kHz低
- 容量コンプ.-反
- DCオフセットノブを反時計ファインとコース
- DCオフセット(+ OFF -) - OFF
- ゲインつまみ- 50
- 入力(DIFF MONO GND) - DIFF
- MODE(STIM - GATE - REC) - REC
- ΩTEST- OFF
吸引電極からのヘッドステージに電線を接続します。線が緑に(地面)黒(ネガティブ下部、中央に、左上の(正の)赤に接続してください。これは、図34に示されています。アース線はちょうど生理食塩水浴に置くことができます。
図34。ヘッドステージの設定 - アンプのインストゥルメントのコントロールは、次の設定に設定する必要があります。
- 今PowerLabの26TからラップトップにUSBコードを接続します。アンプとPowerLab26T両方が接続され、コンピュータ上LabChart7を開く前に電源が入っているか確認します。
- LabChart7を開きます。
- LabChartウェルカムセンターボックスが開いているポップアップ表示されます。それを閉じます。
- セットアップをクリックしてください
- チャンネルの設定をクリックしてください。 [OK]を押す(ボックスの左下)を1にチャネル数を変更します。
- チャートの左上に約2kに秒あたりのサイクル数を設定します。約500または200mVにボルト(y軸)を設定します。
- チャートの右側にチャンネル1をクリックしてください。入力アンプをクリックしてください。シングルエンド、AC結合、および反転(必要に応じて信号を反転します)、およびアンチエイリアス、チェックされます:。設定がいることを確認してください
- 記録のプレススタートを開始する。
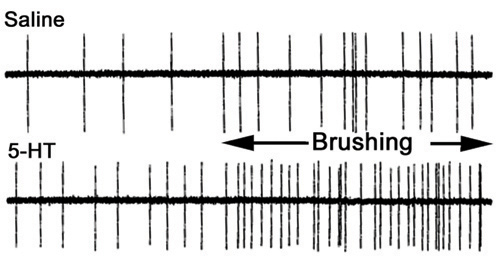
図35。前と生理食塩水(上部)および100nMの5 - HT(底部)のクチクラ刺激時の第3のルートの活動。キューティクル刺激時の時間がバーで示されます。準備は5 - HT(ストラウンら 、2000から改変)を浴びている刺激前と後に拡張された動作を確認してください。
我々は、神経のついでに記録することによって第1または第2の根から録音することができます、または私達はVNCとVNCに信号を送信するという周囲に起因する記録純粋な感覚入力からルートを横に切断することもできます。したがって、知覚活動のための周辺につながるtransectedルートから記録していました。
第2のルートは、筋肉の受容体の器官(MRO)と伸筋運動ニューロンへefferentsの小さい軸索(フィールドとケネディ、1965)から非常に大きな一次求心性軸索が含まれています。第1及び第2の根に多くの感覚軸索があります。
mechanosensoryニューロンは、横方向の巨大軸索(LG)(;ザッカー1972クラスネ1969)と電気シナプスによって、直接接続を持っている。また、mechanosensoryニューロンを化学シナプスを介して介在ニューロンを励起することが知られています。
検査する方法を感覚入力感覚- CNS -運動ニューロン回路を介して、運動ニューロンの活動に影響を与えることができる、我々は筋肉のシナプス応答を記録することができます。我々が使用する回路のさまざまな側面を調べることができます。例えば、我々はスパイク周波数の記録を分析するためにVNC into無傷の感覚入力の有無に関係なく単独で感覚神経根またはモーターのルートから録音したり、1つは、異なる条件でピリオドの時間をかけてカウントすることができます。対策は、刺激と一定時間(図35)のためのブラシの刺激の間を磨く前に行うことができます。一つは、条件を5回繰り返すと比較を行うための措置として、周波数の平均変更率を得ることができます。
一つは、このようなセロトニン(ストラウンら 、2000)やアセチルコリン(ACH)、ニコチンやグルタミン酸などの外因性化合物を適用することもできます。様々な行動のアクションは、無脊椎動物ではニコチンのために記載されている。これは、ニコチン性受容体(角山と五條堀、1998)の存在を示唆している。グルタミン酸は、NMJとAchの最も無脊椎動物における主要な興奮性神経伝達物質は中枢神経系内の主要な興奮性神経伝達物質(。。ワトキンス、 ら 、1990 Monoghanら、1989)である。
一つは、ヘプタノール試すことができますまたは博士ソニアM. Bierbowerが(ケンタッキー大学)彼女の論文の研究で示されているとして、それが回路内の中隔(またはギャップ)ジャンクションザリガニを切り離すことになりますので、CO 2は、生理食塩水を吹き込んだ。環境での高CO 2(Bierbowerとクーパー、2010)にさらされると、このアクションは、変更された全体の動物の行動を占める可能性があります。あなたがブラシでキューティクルを刺激し、感覚入力を駆動し、運動ニューロンの応答を記録する場合、ヘプタノールまたはCO 2曝露前および実行中に活性の違いがあるかどうか注意してください。これは、または感覚CNS -運動ニューロン回路の役割を持っているギャップ結合を示唆しない場合があります。
ディスカッション
膜電位
1902年には早くも、バーンスタインは、イカの軸索の静止電位の問題を扱っていた。それは、バーンスタイン(1902)とネルンスト(1888)のこれらの初期のアイデアとの観測が、後膜の生理学の研究に影響を与えたかを考えるために興味深いです。 (MalmivuoとPlonsey、1995年までのレビューを参照してください。WWW上でも利用できるhttp://www.bem.fi/book/ )。イオンチャネルの機能と組織、器官およびシステムの機能に関する細胞生理を理解する上で非常に重要な生体膜の性質について行われているブレークスルーは、この日に、残されています。
外部の[K +]静止膜電位に関する実験的および理論的に派生効果の比較は、膜電位に対するイオンの影響を示している。これと同じ準備を使用して追加実験では、基本的な生理学的な質問に対処するために実行されずに残っている。いくつかは、アトウッドとパーナスによって1968年に戻って強調され、まだ完全に取り組むことにしました。この演習で得られた技術を使うと、1つは他の実験の準備にだけでなく、医療や健康に関連する生理的なアプリケーションの残りの多くの質問に答えるに進むことができます。我々はすべての動物に関連する基本的な質問に対処するためのモデルの無脊椎動物の準備の有用性を実証している。
この上記の練習中のイオンの電気化学的勾配で得た知識で、あなたは今ザリガニの神経筋の準備でシナプス伝達を調べることによって、膜の興奮性に進むことができます。
シナプス応答の測定
この研究室の最初の部分、および関連する映画のために提供詳細は、膜電位を記録し、筋肉の構造を調査するための重要なステップを提供している。この研究室の第二部では、相動性および強直運動単位のNMJsで解剖し、記録シナプス伝達のデモでは、生理学の基本的な概念へのエクスポージャーを提供。無傷の動物の部分に関連した挙動を説明するために使用できることができる神経回路への暴露は、だけでなく、彼らの実験室での運動の中でも井の中の神経回路に関する今後の研究のための様々なオープンエンドの質問を調査する学生のための可能性がある確立された無脊椎動物の準備(Kennedy ら、1969;。アントンセンとエドワーズ、2003)
これらの製剤はまた、シナプス促進、抑うつとの長期可塑性を(本研究室の研究で検討されていない)を調査するために使用することができます。だけでなく、その自然環境、にもザリガニのいくつかの種の中で、神経可塑性は、実験的な刺激条件(。Cooperら 、1998メルシエとアトウッド、1989)に依存します。どの程度にシナプス伝達効率と筋肉のダイナミクスを変更する機能は、動物を調査するまま提供しています。ザリガニの季節変動と脱皮周期に関連して、その動作を変更しないため、それらの神経筋システムにおいて比較的長期の活動の違いがあります。それは、爪に近い筋の相動運動神経の端末は冬の間に古典的な一過性の形態を示すが、夏季には端子の長さに沿ってより多くの静脈瘤(; Lnenickaと趙、1991 Lnenicka 1993)膨潤となることが示されている。
腹神経索内でザリガニ横の巨大な(LG)の介在で実施されたいくつかの初期の研究では、ギャップジャンクション(;渡辺とGrundfest、1961年ジョンソン、1924)の存在を証明した。これはよくCO 2は、ギャップ結合を(ラーノら、1990)脱共役によって、電気通信に影響を及ぼすことが知られています。 Bierbowerとクーパー、、最近ではギャップジャンクションの存在を示すように、このレポートで説明されている感覚- CNS -モーター筋肉回路、2露出をCOにも敏感である、(Bierbower、2010内で神経索と通信することが示された2010)
1960同じまたは隣接するセグメント内の静的な筋肉の受容体の器官(MRO)を焼成トニックは、自発運動の駆動を占めることができればエッカート(1961)検査時なので第3 回運動根の自発的な活動が話題となっている。 (ストラウンら 、2000;ケネディと武田、1965a、B。エッカート、1961)これらの初期の研究では、アクティビティが可能性高い拠点から腹側神経索(VNC)内で駆動されたことが明らかとなった。 CO 2の存在は、自発的活動を停止して以来、人はギャップ結合またはグルタミン酸作動性興奮性ドライブがあるかもしれないどこかドライブの運動ニューロンに想定することができます。 NMJsを塞いだり、展示は、CO 2の存在下でグルタミン酸に感度を減少し、そして彼らは、ブロック可能性がありますされていますCNS内だけでなくヒツジシラミバエ(Bierbower、2010; Bierbowerとクーパー、2010;またBadre らを参照、2005)。
様々な神経修飾物質の作用も容易にNMJsの様々なタイプ(;グリフィスら、2000;。サウサードら、2000;。。ストラウンら 、2000年クーパーとクーパー、2009)で検討されている。さらに、様々な影響は中枢神経系の回路で神経修飾物質によって及ぼされている。それは5 - HTとoctopaminergicニューロンは神経回路の出力を変えることで"ゲイン設定主体"(Ma らとして機能する可能性が示唆されている、1992;。シュナイダーら、1996;。ホーナーら、1997;。エドワーズは、 ら 、2002)。我々は完全に個々の標的細胞に対する神経修飾物質の影響を理解する前に多くの作業が行われるままです。異なる神経修飾物質が互いに協調して動作する可能性があることを考えると、それらの混合作用の解析は今後の研究(Djokaj ら 、2001)のための領域です。さらに、いくつかの研究は、特に脊椎動物では、特定の行動を規制することができます全体の経路上の神経修飾物質の影響に対処する。この感覚- CNS -モータユニットの準備で1つは運動ニューロン(ケネディら 、1969)の活動に関する感覚入力と神経修飾物質の両方の影響を調べることができます。
(。。リビングストンら 、1980;スネッドンら 、2000)が5 - HTは、ザリガニ、ロブスター、カニの行動の状態を調節する役割を果たしていることが仮定されているので、いくつかの試みは、その濃度を決定するためになされているVNC、血リンパ、そしてロブスターの孤立神経節における(リビングストンら、1980;。ハリス、ウォリックとクラヴィッツ1984; Fadool ら、1988。)。しかし、行動のアクションを占めることができる特定の用量反応関係を排除し、記録された測定値にかなりのばらつきがあった。
上昇位置に保持されて爪を持つと、その腹部の下に隠れてテールとザリガニが支配する姿勢(リビングストンら 、1980)を示すと考えられてきた。ザリガニの腹部屈曲の状態が支配的な階層的な状態を(Listerman ら 、2000)を維持しながら、支配的なザリガニが、ペアの中で、社会的相互作用中に示すかという姿勢であることが表示されません。彼らは相手からの撤退として従順なザリガニは、さらに自分自身で自分の腹部を挟むだろう。このようなテール挟み込むも防衛態勢(Listerman ら 、2000)として見られている。これらの動作は容易に(; Bruskiとダナム、1987; Li ら、2000;。。Listermanら 、2000 Bovbjerg、1953、1956)フィールドと実験室の設定で観察されている。興味深いことに、ロブスター(リビングストンら 、1980)に記載の行動姿勢は5 - HTとオーストラリアのザリガニにおけるオクトパミン注射、Cheraxデストラクタ (マクレー、1996)用に反転されています。おそらく、全く別の応答は、オーストラリアのザリガニの浅指屈筋の準備で見られます。優位性は、一般的にザリガニの間で関連する大きさであるためさらに、1つは急速に変更の社会的条件(ストラウンら 、2000)のための非常に塑性応答システムを期待する。無脊椎動物における神経修飾物質に対する反応性の可塑性は、調査のオープンエリアです。
ウィッテンバッハ、ジョンソン、そしてホイ(1999)は、デジタルメディアや他のザリガニの準備に加えて、本レポートに記載され、同じ筋肉を含む様々なザリガニのexperimentationsための実験マニュアルを作成しました。これは、学生の演習のための優れたリソースです。
開示事項
謝辞
ケンタッキー州の大学、生物学科、学部及び芸術科学大学のOfficeでサポート。
資料
- ザリガニ( ザリガニ )。アチャファラヤ生物サプライ(株)、レースランド、LA。、米国。
- 標準的なザリガニ生理食塩水:ヴァンHarreveldのソリューション(1936)から変更された。 (mMで)205のNaCl、5.3 KClを、13.5のCaCl 2 2H 2 O、2.45のMgCl 2 · 6H 2 O、5 HEPES、pHを7.4に調整。セロトニン、グルタミン酸とドーパミンは、ザリガニの生理食塩水で作られています。ブアン固定液を直接使用したとメチレンブルーは、ザリガニの生理食塩水で作られています。すべての化学物質は、シグマケミカル社(セントルイス、MO)から入手されています。
- 解剖ツール:ファイン#5ピンセット、細かいはさみ、ナイフの刃ホルダー、#26002から20虫ピン(すべてのファイン科学のツール(米国)、(株)、373 - Gビンテージパークドライブ、フォスターシティー、CA 94404から1139から取得) 。
- Sylgard底ガラス皿
- ビーカー(薬液を保持する)
- 電気信号は、コンピュータにPowerLab 26Tインタフェース(ADInstruments、コロラドスプリングズ、コロラド州、米国)への行に記録されます。我々は、チャートまたはScopeというADInstrumentsから標準のソフトウェアを使用してください。
- 細胞内だけでなく、細胞外記録のためのモデル3000 AC / DCアンプを使用することができます。
- 細胞内記録用のズーム機能で顕微鏡を解剖。可視化端末上で焦点距離の記録のために直立の目標(4 ×と20倍)を持つ化合物の顕微鏡が使用されます。一つは、水銀光源を必要とします。
- 細胞内記録のために我々はガラスキャピラリチューブ(FHC、ブランズウィック、ME、04011、アメリカ合衆国カタログ#30-31-0)を使用します。細胞内電極は、20〜30オームの抵抗を持つ必要があります。細胞内電極は、3 MのKClを充填した。
- 吸引電極は細胞外シグナルを記録するために使用されます。
- ファラデーケージ。
- 高輝度の照明装置(光源)。
- マニピュレーター
参考文献
- Antonsen, B. L., Edwards, D. H. Differential dye coupling reveals lateral giant escape circuit in crayfish. J. Comp. Neurol. 466, 1-13 (2003).
- Arellano, R. O., Rivera, A., Ramón, F. Protein phosphorylation and hydrogen ions modulate calcium-induced closure of gap junction channels. Biophys. J. 57, 363-367 (1990).
- Atwood, H. L. γ -aminobutyric acid and crab muscle fibres. Experientia (Basel). 20, 161-163 (1964).
- Atwood, H. L. Variation in physiological properties of crustacean motor synapses. Nature. 215, 57-58 (1967).
- Atwood, H. L. Peripheral inhibition in crustacean muscle. Experimentia. 24, 753-763 (1968).
- Atwood, H. L. An attempt to account for the diversity of crustacean muscles. Am. Zool. 13, 357-378 (1973).
- Atwood, H. L. Organization and synaptic physiology of crustacean neuromuscular systems. Prog. Neurobiol. 7, 291-391 (1976).
- Atwood, H. L., Sandeman, D. C., Atwood, H. L. Synapses and neurotransmitters. The Biology of Crustacea. 3, 105-150 (1982).
- Atwood, H. L. Parallel 'phasic' and 'tonic' motor systems in the crayfish abdomen. J. Exp. Biol. 211, 2193-2195 (2008).
- Atwood, H. L., Cooper, R. L. Functional and structural parallels in crustaceans and Drosophila neuromuscular systems. Am. Zool. 35 (6), 556-565 (1995).
- Atwood, H. L., Cooper, R. L. Assessing ultrastructure of crustacean and insect neuromuscular junctions. J. Neurosci. Meth. 69, 51-58 (1996).
- Atwood, H. L., Cooper, R. L. Synaptic diversity and differentiation: Crustacean neuromuscular junctions. Invertebrate Neurosci. 1, 291-307 (1996).
- Atwood, H. L., Parnas, I., Kerkut, G. A. . Recording from the crayfish abdominal extensor muscle preparation with microelectrodes. In: Experiments in physiology and biochemistry. , 307-330 (1968).
- Badre, N. H., Martin, M. E., Cooper, R. L. The physiological and behavioral effects of carbon dioxide on Drosophila larvae. Comparative Biochemistry and Physiology A. 140, 363-376 (2005).
- Bernstein, J. Untersuchungen zur Thermodynamik der bioelektrischen Ströme. Pflüger Arch. ges. Physiol. 9, 521-562 (1902).
- Bernstein, J. . Elektrobiologie. , 215 (1912).
- Bierbower, S. M. . Environmental effects on behavior and physiology in crayfish. , (2010).
- Bierbower, S. M., Cooper, R. L. The effects of acute carbon dioxide on behavior and physiology in Procambarus clarkii. J. Exp. Zool. , (2010).
- Boistel, J., Fatt, P. Membrane permeability change during inhibitory transmitter action in crustacean muscle. J. Physiol. (Lond.). 144, 176-191 (1958).
- Bovbjerg, R. V. Dominance order in the crayfish Orconectes 6irilis (Hagen). Physiol. Zool. 26, 173-178 (1953).
- Bovbjerg, R. V. Some factors affecting aggressive behavior in crayfish. Physiol. Zool. 29, 127-136 (1956).
- Bradacs, H., Cooper, R. L., Msghina, M., Atwood, H. L. Differential physiology and morphology of phasic and tonic motor axons in a crayfish limb extensor muscle. J. Exp. Biol. 200, 677-691 (1997).
- Bruski, C. A., Dunham, D. W. The importance of vision in agonistic communication of the crayfish Orconectes rusticus, I. an analysis of bout dynamics. Behaviour. 63, 83-107 (1987).
- Burke, W., Ginsborg, B. L. The electrical properties of the slow muscle fibre membrane. J. Physiol. 132, 586-598 (1956).
- Cooper, A. S., Cooper, R. L. Historical View and Physiology Demonstration at the NMJ of the Crayfish Opener Muscle. J. Vis. Exp. (33), e1595 (2009).
- Cooper, R. L., Warren, W. M., Ashby, H. E. Activity of phasic motor neurons partially transforms the neuronal and muscle phenotype to a tonic-like state. Muscle & Nerve. 21, 921-931 (1998).
- Djokaj, S., Cooper, R. L., Rathmayer, W. Effects of octopamine, serotonin, and cocktails of the two modulators on synaptic transmission at crustacean neuromuscular junctions. J. Comp. Physiol. A. 187 (2), 145-154 (2001).
- Dudel, J., Kuffler, S. W. Mechanism of facilitation at the crayfish neuromuscular junction. J. Physiol. (Lond.). 155, 540-542 (1961).
- Eckert, R. O. Reflex relationships of the abdominal stretch receptors of the crayfish. J. Cell. Comp. Physiol. 57, 149-162 (1961).
- Edwards, D. H., Yeh, S. R., Musolf, B. E., Antonsen, B. L., Krasne, F. B. Metamodulation of the crayfish escape circuit. Brain Behav Evol. 60 (6), 360-369 (2002).
- Fadool, D. A., Cobb, S. J., Kass-Simon, G., Brown, P. R. Liquid chromatographic procedures for the analysis of compounds in the serotonergic and octopamine pathways of lobster hemolymph. J. Chromatogr. 452, 491-501 (1988).
- Fatt, P., Katz, B. The electrical properties of crustacean muscle fibers. J. Physiol. 120, 171-204 (1953).
- Fields, H. L., Kennedy, D. Functional role of muscle receptor organs in crayfish. Nature. 206 (990), 1235-1237 (1965).
- Fisher, L., Florey, E. Modulation of synaptic transmission and excitation-contraction coupling in the opener muscle of the crayfish, Astacus leptodactylus, by 5-hydroxytryptamine and octopamine. J. Exp. Biol.. 102, 187-198 (1983).
- Freud, S. Über den Bau der Nervenfasern und Nervenzellen beim Flußkrebs. Anzeiger Akad. 18, 275 (1881).
- Freud, S. Über den Bau der Nervenfasern und Nervenzellen beim Flußkrebs. Sitzungsber. Akad. 85, 9-46 (1881).
- Goldman, D. E. Potential, impedance, and rectification in membranes. J. Gen. Physiol. 27, 37-60 (1943).
- Griffis, B., Bonner, P., Cooper, R. L. Sensitivity of transformed (phasic to tonic) motor neurons to the neuromodulator 5-HT. Comparative Biochemistry and Physiology A. 127, 495-504 (2000).
- Grundfest, H., Reuben, J. P., Florey, E. Neuromuscular synaptic activity in lobster. Nervous Inhibition. , 92-104 (1961).
- Harris-Warrick, R. M., Kravitz, E. A. Cellular mechanisms for modulation of posture by octopamine and serotonin in the lobster. J. Neurosci. 4, 1976-1993 (1984).
- Hagiwara, S., Chichibu, S., Naka, K. I. The effects of various ions on resting and spike potentials of barnacle muscle fibers. J. Gen. Physiol. 48, 163-179 (1964).
- Hille, B. . Ionic Channels of Excitable Membranes. , (1992).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. J. Physiol. (Lond.). 117, 500-544 (1952).
- Hodgkin, A. L., Huxley, A. F., Katz, B. Measurement of current-voltage relations in the membrane of the giant axon of Loligo. J. Physiol. (Lond.). 116, 424-448 (1952).
- Hodgkin, A. L., Katz, B. The effect of sodium ions on the electrical activity of the giant axon of the squid. J. Physiol. (Lond.). 108, 37-77 (1949).
- Hodgkin, A. L., Rushton, W. A. H. The electrical constants of a crustacean nerve fibre. Proc. Roy. Soc. 133, 444-479 (1946).
- Hörner, M., Weiger, W. A., Edwards, D. H., Kravitz, E. A. Excitation of identified serotonergic neurons by escape command neurons in lobsters. J. Exp. Biol. 200, 2017-2033 (1997).
- Huxley, T. H. . The crayfish. , (1880).
- Johnson, G. E. Giant nerve fibers in crustaceans with special reference to Cambaus and Palaemonetes. J. Comp. Neurol. 36, 323-373 (1924).
- Johnston, M. F., Simon, S. A., Ramon, F. Interaction of anaesthetics with electrical synapses. Nature (Lond.). 286, 498-500 (1980).
- Katz, B., Miledi, R. The role of calcium in neuromuscular facilitation. J. Physiol. (Lond.). 195, 481-492 (1968).
- Kennedy, D., Takeda, K. Reflex control of abdominal flexor muscles in the crayfish: the twitch system. J. Exp. Biol. 43, 211-227 (1965).
- Kennedy, D., Takeda, K. Reflex control of the abdominal flexor in the crayfish: the tonic system. J. Exp. Biol. 43, 229-246 (1965).
- Kennedy, D., Selverston, A. I., Remler, M. P. Analysis of restricted neural networks. Science. 164, 1488-1496 (1969).
- Krasne, F. B. Excitation and habituation of the crayfish escape reflex: the depolarizing response in lateral giant fibres of the isolated abdomen. J. Exp. Biol. 50, 29-46 (1969).
- Li, H., Listerman, L. R., Doshi, D., Cooper, R. L. Heart rate measures in blind cave crayfish during environmental disturbances and social interactions. Comp. Biochem. Physiol A. 127, 55-70 (2000).
- Listerman, L., Deskins, J., Bradacs, H., Cooper, R. L. Measures of heart rate during social interactions in crayfish and effects of 5-HT. Comp. Biochem. Physiol A. 125, 251-264 (2000).
- Livingstone, M. S., Harris-Warrick, R. M., Kravitz, E. A. Serotonin and octopamine produce opposite postures in lobsters. Science. 208, 76-79 (1980).
- Lnenicka, G. A. Seasonal differences in motor terminals. Comp. Biochem. Physiol A. 104, 423-429 (1993).
- Lnenicka, G. A., Zhao, Y. Seasonal differences in the physiology and morphology of crayfish motor terminals. J. Neurobiol. 22, 561-569 (1993).
- Ma, P. M., Beltz, B. S., Kravitz, E. A. Serotonin containing neurons in lobsters: their role as 'gainsetters' in postural control mechanisms. J. Neurophysiol. 68, 36-54 (1992).
- Malmivuo, J., Plonsey, R. . Bioelectromagnetism-Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- McRae, T. On the postural effects induced in female Cherax destructor (Clark) by serotonin and octopamine. Freshwater Crayfish. 11, 293-298 (1996).
- Mercier, A. J., Atwood, H. L. Long-term adaptation of a phasic extensor motoneurone in crayfish. J. Exp. Biol. 145, 9-22 (1989).
- Monaghan, D. T., Bridges, R. J., Cotman, C. W. The excitatory amino acid receptors: their classes, pharmacology, and distinct properties in the function of the central nervous system. Annu. Rev. Pharmacol. Toxicol. 29, 365-402 (1989).
- Moody, W. Gradual increase in the electrical excitability of crayfish slow muscle fibers produced by anoxia or uncouplers of oxidative phosphorylation. J. Comp. Physiol. 125, 327-334 (1978).
- Nernst, W. H. Zur Kinetik der Lösung befindlichen Körper: Theorie der Diffusion. Z. Phys. Chem. 3, 613-637 .
- Nernst, W. H. Die elektromotorische Wirksamkeit der Ionen. Z. Phys. Chem. 4, 129-181 .
- Pilgrim, R. L. C., Wiersma, C. A. G. Observations on the skeleton and somatic musculature of the abdomen and thorax of Procambarus clarkii (Girard), with notes on the thorax of Panulirus interruptus (Randall) and Astacus. J. Morphol. 113, 453-587 (1963).
- Robinson, M. M., Martin, J. M., Atwood, H. L., Cooper, R. L. Modeling Biological Membranes with Circuit Boards and Measuring Electrical Signals in Axons: Student Laboratory Exercises. J. Vis. Exp. (47), e2325 (2011).
- Schneider, H., Budhiraja, P., Walter, I., Beltz, B. S., Peckol, E., Kravitz, E. A. Developmental expression of the octopamine phenotype in lobsters. J. Comp. Neurol. 371, 3-14 (1996).
- Skou, J. C. The influence of some cations on an adenosine triphosphatase from peripheral nerves. Biochim. Biophys. Acta. 1000, 439-446 (1989).
- Skou, J. C. The identification of the sodium-pump as the membrane-bound Na+/K+-ATPase: a commentary on 'The Influence of Some Cations on an Adenosine Triphosphatase from Peripheral Nerves. Biochim. Biophys. Acta. 1000, 435-438 (1989).
- Skou, J. C. Enzymatic basis for active transport of Na+ and K+ across cell membrane. Physiol. Rev. 45, 596-617 (1965).
- Skou, J. C. Nobel Lecture. The identification of the sodium pump.. Biosci Rep. 18, 155-169 (1998).
- Sneddon, L. U., Taylor, A. C., Huntingford, F. A., Watson, D. G. Agonistic behavior and biogenic amines in shore crabs Carcinus maenas. J. Exp. Biol. 203, 537-545 (2000).
- Sohn, J., Mykles, D. L., Cooper, R. L. The anatomical, physiological and biochemical characterization of muscles associated with the articulating membrane in the dorsal surface of the crayfish abdomen. J. Exp. Zool. 287, 353-377 (2000).
- Southard, R. C., Haggard, J., Crider, M. E., Whiteheart, S. W., Cooper, R. L. Influence of serotonin on the kinetics of vesicular release. Brain Res. 871, 16-28 (2000).
- Stefani, E., Steinbach, A. B. Resting potential and electrical properties of frog slow muscle fibers. Effect of different external solutions. J. Physiol. 203, 383-401 (1969).
- Strawn, J. R., Neckameyer, W. S., Cooper, R. L. The effects of 5-HT on sensory neurons, CNS command, and neuromuscular junctions of the crayfish abdominal superficial flexor. Comp. Biochem. Physiol B. 127, 533-550 (2000).
- Takeuchi, A., Takeuchi, N. Anion permeability of the inhibitory post-synaptic membrane of the crayfish neuromuscular junction. J. Physiol. (London). 191, 575-590 (1967).
- Tsunoyama, T., Gojobori, S. Evolution of Nicotinic Acetylcholine receptor Subunits. Mol. Biol. Evol. 15 (5), 518-527 (1998).
- Van Harreveld, A., Mendelson, M. Glutamate-induced contractions in crustacean muscle. J. Cell Comp. Physiol. 54, 85-94 (1959).
- Van Harreveld, A. A physiological solution for freshwater crustaceans. Proc. Soc Exp. Biol. Med. 34, 428-432 (1936).
- Van Harreveld, A., Wiersma, C. A. G. The Triple Innervation of the Crayfish Muscle. Proc. Natl. Acad. Sci. USA. 22 (11), 667 (1936).
- Vélez, S. J., Wayman, R. J. Synaptic connectivity in a crayfish neuromuscular system. I. Gradient of innervations and synaptic strength. J. Neurophysiol. 41, 75-84 (1978).
- Watanabe, A., Grundfest, H. Impulse propagation at the septal and commissural junctions of crayfish lateral giant axons. J. Gen. Physiol. 45, 267-308 (1961).
- Watkins, J. C. L-Glutamate as a central neurotransmitter: Looking back. Biochemical Society Transactions. 28, 297-310 (2000).
- Wiersma, C. A. G., Waterman, T. H. The neuromuscular system. The Physiology of Crustacea. II, (1961).
- Wiersma, C. A. G. Reflexes and the central nervous system. The physiology of Crustacea. II, 241-279 (1961).
- Wine, J. J., Mittenthal, J. E., Kennedy, D. The structure of tonic flexor motoneurons in crayfish abdominal ganglia. J. Comp. Physiol. 93, 315-335 (1974).
- Wu, W. H., Cooper, R. L. Physiological Recordings of High and Low Output NMJs on the Crayfish Leg Extensor Muscle. J. Vis. Exp. (45), e2319 (2010).
- Wyttenbach, R. A., Johnson, B. R., Hoy, R. R. . Crawdad. A CD-ROM Lab manual for neurophysiology. , (1999).
- Zucker, R. S. Crayfish escape behavior and central synapses. 3. Electrical junctions and dendrite spikes in fast flexor motoneurons. J. Neurophysiol. 35, 638-651 (1972).
- Zucker, R. S. Crayfish escape behavior and central synapses. II. Physiological mechanisms underlying behavioral habituation. J. Neurophysiol. 35 (5), 621-637 (1972).
- Zucker, R. S. Crayfish escape behavior and central synapses. I. Neural circuit exciting lateral giant fiber. J. Neurophysiol. 35 (5), 599-620 (1972).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved