Method Article
Potentiels de membrane, les réponses synaptiques, circuits neuronaux, neuromodulation et histologie muscle en utilisant l'écrevisse: des exercices de laboratoire étudiant
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les expériences démontrent une approche facile pour les étudiants d'acquérir une expérience dans l'examen de la structure musculaire, les réponses synaptiques, les effets des gradients d'ions et de la perméabilité sur les potentiels de membrane. En outre, un sensori-SNC-moteur du muscle circuit est présenté pour montrer un moyen de tester les effets de composés sur un circuit neuronal.
Résumé
Le but de ce rapport est d'aider à développer une compréhension des effets causés par des gradients d'ions à travers une membrane biologique. Deux aspects qui influencent le potentiel de membrane d'une cellule et que nous adressons dans ces expériences sont: la concentration d'ions (1) de K + à l'extérieur de la membrane, et (2) de la perméabilité de la membrane aux ions spécifiques. Les muscles extenseurs écrevisses abdominaux sont dans des groupes avec quelques toniques être (lent) et d'autres phasique (rapide) dans leurs phénotypes biochimiques et physiologiques, ainsi que dans leur structure, les neurones moteurs qui innervent ces muscles sont également différent des caractéristiques fonctionnelles. Nous utilisons ces muscles ainsi que du superficiel, muscle fléchisseur tonique abdominale afin de démontrer les propriétés de la transmission synaptique. En outre, nous introduisons une sensori-SNC-neurone moteur du muscle circuit pour démontrer l'effet de la stimulation sensorielle cuticulaires ainsi que l'influence des neuromodulateurs sur certains aspects du circuit. Avec les techniques obtenus dans cet exercice, on peut commencer à répondre à plusieurs questions qui restent dans les autres préparations expérimentales ainsi que dans les applications physiologiques liés à la médecine et la santé. Nous avons démontré l'utilité des préparations d'invertébrés modèle pour répondre aux questions fondamentales pertinentes à tous les animaux.
Protocole
1. Présentation
Les objectifs de ces exercices en laboratoire est de comprendre les propriétés des membranes excitables, la base ioniques du potentiel de membrane au repos, et les méthodes pour mesurer le potentiel de membrane. En outre, la coloration et l'histologie du muscle est présenté, ce qui peut être utilisé pour enseigner la structure musculaire. En outre, deux types différents de préparations disséquées sont utilisées pour démontrer les propriétés de la transmission synaptique dans des groupes musculaires différents. Un sensorielle complète-système nerveux central (SNC)-neurone moteur du muscle circuit dans l'abdomen des écrevisses est également utilisé pour présenter une préparation à examiner la stimulation sensorielle et l'influence de neromodulators et des neurotransmetteurs sur les aspects d'un circuit.
La première partie du rapport présente les approches utilisées pour mesurer le potentiel de repos membranaire et l'influence de K + extracellulaire sur le potentiel de membrane. Nous allons aussi introduire la structure musculaire. Dans la deuxième partie de cet exercice, nous présentons divers moyens de mesurer les réponses synaptiques de différents types de jonctions neuromusculaires (NMJs). Le premier exercice utilise les muscles extenseurs des écrevisses abdominales et la seconde utilise les muscles abdominaux fléchisseur superficiel. En outre, nous présentons un circuit neuronal (la corde nerveuse ventrale de l'écrevisse avec des entrées sensorielles et les sorties du moteur) qui est facile à entretenir, et qui peut être utilisé pour l'enseignement ainsi que pour la recherche dans divers aspects d'une SNC-sensorielle -neurone moteur du muscle-circuit. Après avoir terminé l'explication des exercices initiaux, nous présentons la physiologie de la NMJs et circuit du SNC.
Le gradient d'ions à travers une membrane biologique peut aboutir à une différence de potentiel. Pour une cellule au repos, cette différence de charge électrique à travers la membrane cellulaire est connu comme le potentiel de membrane de la cellule au repos. Il ya deux facteurs principaux que nous aborderons cette influence du potentiel de membrane d'une cellule. La première est la concentration en ions de chaque côté de la membrane. La seconde est la perméabilité ionique de la membrane. Il est important de garder à l'esprit que dans une cellule vivante il ya un certain nombre d'ions différents avec des concentrations variables à l'intérieur et l'extérieur de la cellule. Les ions principaux que nous aborderons sont le sodium (Na +), potassium (K +) et chlorure (Cl-). Les quantités et les mouvements de ces ions à travers une membrane musculaire qui détermine le potentiel de membrane. A partir de cette fondation, nous pouvons répondre à des potentiels électriques observés lors de l'excitation électrique et l'inhibition d'une membrane à partir des réponses synaptiques et d'examiner les effets des agents pharmacologiques. Nous pouvons également construire des modèles biophysiques pour représenter ces processus à des concepts d'essais expérimentaux (Robinson et al., 2010).
L'utilisation de microélectrodes capillaires en verre permet l'enregistrement des potentiels de membrane. L'électrode peut être insérée à travers la membrane cellulaire sans dommage, offrant la pointe est assez petit et une mesure précise du potentiel transmembranaire peut être obtenue. La technique est particulièrement applicable à grandes cellules, qui sont moins susceptibles d'être endommagés par l'insertion de l'électrode intracellulaire. C'est l'une des techniques essentielles en physiologie.
L'équilibre de Na + et K + à travers la membrane est maintenue par la pompe Na-K ATPase dans des conditions physiologiques. Dans des conditions normales les mouvements de la pompe, en moyenne, trois Na + hors de la cellule et deux K + dans la cellule. Comme note latérale, un prix Nobel de chimie a été décerné en 1997 pour cette découverte faite revenir à la fin des années 1950. Les fondamentaux de la découverte ont été obtenus à partir de la recherche en utilisant les axones d'un crabe (Skou, 1965, 1998).
Cette pompe est également considéré comme électrogénique comme il a une grande capacité de pomper lorsque la membrane est dépolarisée (Skou, 1989a, b). Dans de nombreuses cellules, la pompe accélère quand une cellule est activé électriquement par la dépolarisation.
Le potassium peut également se déplacer dans de potassium "fuite" des canaux tandis qu'une cellule est dans un état de repos. Grâce à ces canaux de fuite de potassium, de la membrane cellulaire au repos est plus perméable au potassium que d'autres ions. Ainsi, le potentiel de la cellule de repos membranaire est plus proche du potentiel d'équilibre pour le potassium que pour le sodium. Le potentiel de repos membranaire peut alors être examinée pour voir si elle dépend du potentiel d'équilibre du potassium.
La variabilité musculaire 1)
Fibres musculaires Crustacés montrent une plus grande variabilité des caractéristiques structurelles, les propriétés électriques et la membrane des propriétés contractiles que ne le font les fibres musculaires de vertébrés. Fibres musculaires phasiques dans les crustacés sont modifiés pour contraction de type contractions. Elles sont caractérisées par de courtes longueurs sarcomère (2-4 microns), mince, droite Z-lignes, un faible ratio de myofilaments minces d'épaisseur, et des systèmes bien développés de T-tubules et sarcoplasmiqueréticulum. Phasic membranes à fibres musculaires peuvent générer des potentiels d'action gradué ou tout-ou-rien. Fibres musculaires toniques, d'autre part, sont modifiés pour la maintenance prolongée de la tension. Ils ont souvent des longueurs sarcomère de 10 à 15 microns, épais, ondulés Z-lignes, un ratio élevé de myofilaments minces d'épaisseur, et des systèmes moins bien développé des tubules T et le réticulum sarcoplasmique. Tonic membranes des fibres musculaires sont souvent électriquement inexcitable, ou ils peuvent produire des réponses électriques graduée («pointes graduée"). Une large gamme de types de fibres intermédiaires se trouve dans les muscles des crustacés.
2) Les équations
Les équations qui sont couramment utilisés pour déterminer le potentiel d'équilibre d'un potentiel de membrane d'ions et de repos sont l'équation de Nernst et de Goldman-Hodgkin-Katz (GHK) équation respectivement. Une distinction importante entre les deux équations est que l'équation de Nernst est utilisée pour un seul ion spécifique pour déterminer le potentiel d'équilibre pour que l'ion, tandis que l'équation GHK est utilisé pour déterminer le potentiel de repos en considérant la perméabilité des ions multiples et leurs gradients travers une membrane cellulaire (Nernst, 1888, 1889; Goldman, 1943; Hodgkin et Huxley, 1952; Hodgkin et al, 1952;. Hodgkin et Katz, 1949; voir Hille, 1992).
L'équation de Nernst est généralement considéré pour des ions à travers une membrane générant une force électromotrice que souvent montré que:
V = (RT / ZF) ln ([X] / sortie [X])
Ion X = intérêt
V = tension d'équilibre pour l'ion X à travers la membrane
R = constante des gaz [8,314 J / (mol • K)]
T = température absolue [Kelvin]
Z = valence de l'ion
F = Faraday constant [9,649 x 10 4 C / mol]
Pour l'ion K + à 20 ° C et la transformation de Ln au journal 10 avec le remplissage dans les constantes, on arrive à:
Potentiel = 58 log ([K] / [K out]); exprimée en mV
Supposons que K + seulement perméants par diffusion. [K] est la concentration de K + à l'intérieur de la cellule et [K out] est la concentration de K + à l'extérieur de la cellule.
Comme une estimation exercice [K]. ______________
Supposons pour ce calcul, le potentiel de membrane ne dépend que du potentiel d'équilibre de K +.
Compte tenu de la [K out] = pour la saline utilisée est de 5,4 mM. Aussi, supposons le potentiel de membrane est-70mV.
Potentiel = 58 log ([K] / 5,4).
Dans l'expérience nous allons mesurer le potentiel d'une cellule de repos membranaire et de déterminer comment il est influencé par la modification de [K out]. La pente de la ligne hypothétique concernant le potentiel de membrane et [K out] est de 58. Après avoir recueilli des données sur le potentiel membranaire de repos à différents [K out] (plage de 5,4 mM à 100 mM), nous allons tracer les valeurs observées pour déterminer s'il ya un match avec la ligne hypothétique. Nous allons utiliser le potentiel de membrane au repos moyenne obtenue à 5,4 mM de [K out] pour initier les lignes hypothétiques et observé pour la comparaison.
Considérant que la membrane peut être perméable à plus d'un ion au repos, ainsi que dans divers états dépolarisée, on utilise l'équation GHK pour tenir compte de la perméabilité (P dans l'équation) pour divers ions. L'équation GHK sera réduit à l'équation de Nernst si une membrane est perméable à un seul ion.
Voici une équation GHK généralisée pour Na +, K + et Cl - des ions: 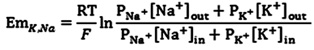
Depuis Cl - a une charge négative, le terme de concentration est inversé dans cette équation pour l'intérieur et l'extérieur. Cela permet à la Z (charge de l'ion) pour être laissé.
3) Les objectifs de cet exercice
Dans cette expérience nous permettra de mesurer le potentiel de membrane d'une cellule musculaire écrevisses et d'appliquer les principes discutés ci-dessus à l'adresse:
- Comment mesurer un potentiel de membrane cellulaire avec une instrumentation appropriée et la technique.
- Perméabilité aux ions de la membrane des cellules musculaires et comment il contribue à le potentiel de membrane.
En outre, nous allons faire une étude préliminaire de la structure musculaire: - Utilisez les taches de mettre en évidence l'anatomie des muscles de la face dorsale de l'abdomen des écrevisses, qui est utilisé pour mener ces expériences électrophysiologiques.
- Examiner l'histologie des différents types de fibres musculaires.
Dans cet exercice de laboratoire, nous allons utiliser les muscles extenseurs des écrevisses abdominale. Cette préparation a été utilisée dans le passé à enseigner ces principes dans la physiologie uned anatomie (Atwood et Parnas, 1968). Nous avons utilisé de nombreuses procédures de cette source et d'autres modifiés pour tenir compte des instruments actuels et à remplir les objectifs dans une seule période d'étudiants 3 heures de laboratoire. Ces exercices sont une base pour d'autres expériences utilisés dans le cours Physiologie animale dans le département de biologie de l'Université du Kentucky (Instructeur Dr. RL Cooper, 2010).
4) Pourquoi ce modèle animal
Il ya plusieurs bonnes raisons d'utiliser les muscles extenseurs abdominaux écrevisses dans cette expérience:
- Les écrevisses sont couramment disponibles et sont relativement bon marché et facile à maintenir dans des conditions de laboratoire.
- La dissection est relativement facile pour les élèves l'apprentissage des techniques de dissection pour les préparations en direct.
- Le muscle est stable pendant plusieurs heures dans une solution saline normale minimale qui sert bien pour les élèves l'apprentissage de techniques électrophysiologiques. La préparation musculaire est assez robuste quand externes [K +] est modifié pour de courtes périodes.
- Diverses réponses synaptiques peuvent être facilement obtenus en stimulant les neurones moteurs.
- La disposition anatomique des muscles extenseurs est facile à discerner, et en raison de leur grande taille, il est relativement facile d'obtenir des enregistrements intracellulaires stables.
- Les muscles et le schéma d'innervation peut être observée facilement avec coloration au bleu de méthylène. En outre, en particulier les types de fibres musculaires peuvent être facilement traitées pour l'histologie pour observer la structure du sarcomère.
- Aucun protocole d'animaux sont nécessaires à ce moment pour les préparatifs des animaux invertébrés dans l'expérimentation en laboratoire dans de nombreuses institutions dans les Etats-Unis.
2. Méthodes
1) Matériaux
- Ciseaux (1)
- Pince (1)
- Fil d'Argent pour le fil de terre (1)
- Microscope (1)
- Sonde d'électrode (1)
- Boîte de Pétri avec Sylgard sur le fond (1)
- Solution saline (1)
- Solutions de potassium: 5.4mm (sérum physiologique), 10, 20, 40, 80, 100 mm
- Bleach (petite quantité, l'utilisation de la pointe du fil d'argent pour construire Ag-Cl)
- Verre pipette (1), à enlever et ajouter des solutions
- Seringue (1)
- Amplificateur / Système d'acquisition (1)
- Cage de Faraday (1)
- Bureau / portable (1)
- Dissection broches (4)
- Écrevisse
2) Méthodes
2.1) Préparation / dissection:
- Une écrevisse d'environ 6-10 cm de longueur du corps doit être obtenu (ou une taille gérable). Tenir les écrevisses à l'arrière de la tête, soit environ un centimètre à l'arrière de l'œil. Assurez-vous que les griffes de l'écrevisse ou de sa bouche ne peut pas atteindre la personne chargée de l'écrevisse. (Les écrevisses peuvent être placés dans la glace pilée pendant 5 minutes pour qu'il anesthésier avant de couper la tête.)
- Utilisez le gros ciseaux d'enlever rapidement la tête. Faire une coupe nette et rapide à partir de derrière les yeux de l'écrevisse. Jeter de la tête et des appendices.

Figure 1. Image montre le placement de la coupe pour enlever la tête de l'écrevisse. - Les pattes et les pinces de l'écrevisse peut être retiré à ce point pour éviter les blessures. Stylets sur les hommes et les pléopodes sur les deux mâles et des femelles peut également être retiré (figure 2). Ensuite, séparée de l'abdomen du thorax. Faites une coupe le long de la membrane qui relie l'articulant abdomen et du thorax (figure 3). Enregistrer la partie abdomen de l'écrevisse et de disposer du thorax.

Figure 2. Les ciseaux coupent les stylets. Ceux-ci peuvent être retirés de l'écrevisse.
Figure 3. Image montre le placement de la coupe pour enlever le thorax de l'abdomen.
Figure 4. Suppression du thorax de l'abdomen. La coupe doit être faite de manière circulaire le long de la ligne dans l'assemblage des segments.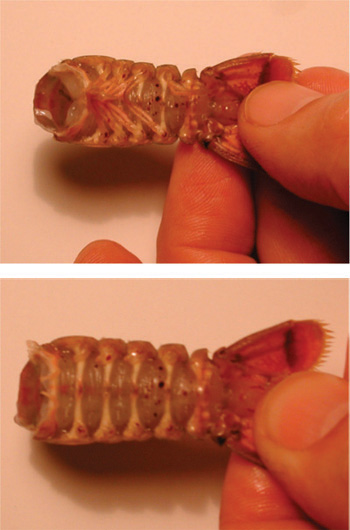
Figure 5. L'image du haut montre l'abdomen avec appendices nageoire. L'image du bas montre l'abdomen sans appendices nageoire. - Avec l'abdomen, une coupe doit être faite dans la coquille sur le bas, bord latéral de chaque côté de l'abdomen. Il faut prendre soin de ne pas couper trop profondément dans l'écrevisse. Pour aider dans le processus de couper la coquille, la coupe doit être faite avec les ciseaux pointant vers le bas méprisante face ventrale et à un angle. Suivez le motif shell naturel des lignes de l'écrevisse qui courent le long de chaque segment (figure 6).

Figure 6. Ciseaux sont placés à un angle et suivre l'alignement naturel de la coquille. Ne pas couper trop profondément et détruire la préparation. La flèche têtes point à la ligne naturelle le long de chaque segment qui devrait être suivie pour les coupes. - Retirez la partie ventrale de la coquille. Prenez soin de ne pas détruire les muscles abdominaux. Utilisez une pince pour enlever la partie ventrale. Lorsque la partie ventrale de la coquille est enlevée, une masse blanche de tissu peut être vu au-dessus des muscles fléchisseurs profonds. Ce tissu peut être enlevé soigneusement avec une pince.

Figure 7. Retrait de la partie ventrale de la coquille avec une pince. Tirer vers le haut et le dos sur la partie ventrale à enlever. Ne détruisez pas les muscles sous la coque ventrale.
Figure 8. Tirant sur la partie ventrale de la coquille qui doit être jeté.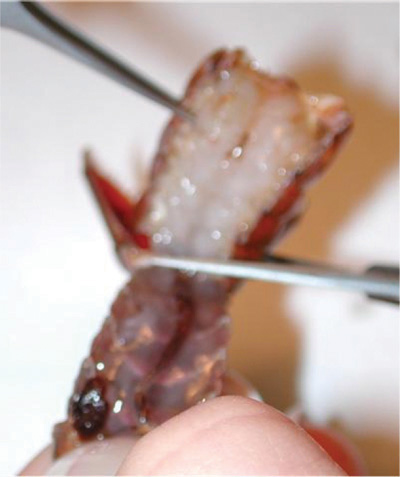
Figure 9. Couper la partie ventrale de la préparation avec des ciseaux et le jeter. - Le tube digestif, un petit tube qui longe la ligne médiane des muscles fléchisseurs profonds, peuvent être retirés de l'écrevisse. Pincez le haut du tube avec la pince et se détache de l'abdomen. Découpez le fond de l'appareil - à la fin de la queue. Rincer la dissection avec une solution saline pour assurer les déchets fécaux ne pas interférer avec la préparation.

Figure 10. Image montre le retrait du tube digestif de la préparation. - Utilisez les broches de dissection pour assurer la préparation à la boîte de Pétri. Les coins en haut et en bas de la préparation doit être coincé à l'antenne. Une solution saline doit être versé dans la boîte de Pétri et couvrir la préparation complètement jusqu'à ce que des enregistrements intracellulaires sont effectués.
Ce plat doit avoir une dissection Sylgard (Dow Corning) revêtement sur le fond (1cm d'épaisseur) afin que les broches d'insectes peut être coincé dedans.
Des préparations disséquées sont baignés dans une solution saline écrevisses standard, modifiées de la solution Van Harreveld (1936), ce qui est fait avec 205 NaCl; 5.3KCl; 13,5 CaCl 2; 2H 2 O; 2,45 MgCl 2; 6H 2 O; HEPES 5 et ajusté à pH 7.4 (en mm).
2.2) L'enregistrement intracellulaire

Figure 11. Configuration globale de l'équipement d'enregistrement.
- La boîte de Pétri avec la préparation doit être placé sous le microscope et sécurisée avec de la cire au fond du plat pour empêcher tout mouvement.

Figure 12. Le placement de la préparation sous le microscope. Utiliser de la cire pour obtenir la boîte de Pétri et de préparation. - Deux fils chacune avec une courte longueur de fil d'argent attaché à une extrémité doit être obtenu. Le fil d'argent doit être trempé dans une petite quantité d'eau de javel pendant environ 20 minutes pour obtenir un revêtement Ag-Cl. Laver le fil de l'eau avant utilisation. Une pipette en verre intracellulaire doit être obtenue et soigneusement remblayé avec une longue aiguille montée sur une seringue remplie d'une solution 3M KCl. La pipette doit être tourné vers le bas (avec l'ouverture vers le sol) et rempli d'une solution. Cela permettra d'assurer que tout excédent sera KCl au goutte à goutte à l'arrière de l'électrode. Soyez sûr pas KCl longe la pipette en verre qui va entrer dans le bain salin. Tournez la pipette verticale lorsque vous avez terminé le remplissage avec une solution de chlorure de potassium. Le fil d'argent peut ensuite être placé dans la pipette. L'autre extrémité est connectée au + (positif) poteau sur la scène la tête de l'amplificateur. La pipette est ensuite fixé sur la sonde d'électrode. Des précautions doivent être faits pour ne pas briser la pointe de l'électrode. Un troisième fil attaché à la cage de Faraday doit être placé dans le pôle vert de la scène la tête. Enfin le fil d'Ag de la tête restants devraient être placés dans le bain et l'autre extrémité attachée à la - (négatif) pole-dessous. Un fil doit également être placé dans la cage de Faraday pour la portion terrestre de l'Powerlab convertisseur AD. L'étape la tête est relié à la «saisie-sonde» sur l'acquisition / amplificateur (Powerlab).
Figure 13. Configuration de scène en chef. Le fil relié à l'entrée verte de l'étape de la tête est mise à l'amplificateur ou de la cage de Faraday. Le fil relié à l'entrée rouge est connecté au fil de l'électrode. L'entrée de noir est utilisé pour se connecter à la solution de bain.
Figure 14. "Test toggle" est dans la rangée du bas pour tester resistance.The électrode "grossier" bouton est également constatésous décalage DC qui devrait être tourné antihoraire. Le gain est fixé à 50, ce qui amplifie les signaux par un facteur de cinquante ans. Le fil de terre de l'étape de la tête est placée dans le "GND" ouverture jack. - Le logiciel LabChart doit être ouvert sur le bureau ou portable. Ajustez le graphique pour afficher un seul canal en cliquant sur "Configuration", puis "Paramètres canal." Sous "Paramètres Channel," Changer le nombre de canaux à un. Cliquez sur «OK». Au haut du tableau, dans le coin gauche, de cycles par seconde devrait être 2K. Réglez volts (axe Y) à environ 200 mV à 500 mV. Cliquez sur "Channel 1" sur la partie droite de l'écran. Cliquez sur "amplificateur d'entrée." Assurez-vous que la case est cochée différentiel.
La sortie de l'amplificateur doit être dans le canal. Les paramètres suivants doivent être utilisés avec l'amplificateur:- High Pass-DC
- Notch Filter-OFF
- Low Pass-20kHz
- Capacité Comp .- antihoraire
- DC Offset fines et grossières bouton-antihoraire
- DC Offset (+ OFF) - OFF
- GAIN-50
- Entrée (DIFF MONO GND) - DIFF
- MODE (STIM-GATE-REC) - REC
- ΩTEST-OFF
- Comme une mesure de la résistance de l'électrode, la tension doit être divisée par le courant, ce qui est de 2,0 nA (ie., R = V / I, ou la loi d'Ohm). La valeur résultante est la résistance de l'électrode de verre. La résistance doit être de 20 à 60 mégaohms. Basse (<20) et une résistance élevée (> 100) ne sont pas acceptables. Une fois que la résistance a été déterminée, des enregistrements intracellulaires peut commencer. Placez l'extrémité de l'électrode de verre dans le bain salin. Assurez-vous un fil de terre est aussi dans le bain salin.
Pour commencer l'enregistrement, appuyez sur Start en bas de l'écran. Assurez-vous que le gain est fixé à 5 V / div. Utilisez le bouton de cap sur l'amplificateur pour déplacer la ligne sur le LabChart à zéro avant d'insérer l'électrode. Le bouton à bascule doit être activé et puis en route plusieurs fois afin de tester la résistance de l'électrode. Ensuite, l'amplitude des valeurs résultant doit être mesurée. Placer un marqueur sur la ligne de base stable et ensuite placer le second à la pointe pour obtenir la résistance de l'électrode. - Utilisez la sonde d'électrode et d'un microscope pour insérer l'électrode dans les muscles longitudinaux (DEM ou Del1 ou DEL2) de la préparation (voir figure 16). L'électrode doit à peine être inséré dans le muscle. Ne pas pénétrer à travers le muscle. Utilisez microscope et les paramètres de la sonde afin de trouver les muscles longitudinaux et d'insérer les électrodes dans le muscle. L'illuminateur d'intensité élevée devrait être ajusté à voir clairement le muscle que l'électrode est insérée. Lorsque piquer fibres musculaires dans cette préparation, on peut souvent fonctionner dans des espaces et des fentes dans le muscle. C'est la raison pour laquelle le potentiel de membrane peuvent apparaître, puis disparaître, puis réapparaître.

Figure 15. Insertion d'électrode dans le muscle. - Pour mesurer le potentiel de membrane, utilisez le bouton grossière sur l'amplificateur pour déplacer la ligne sur le LabChart à zéro avant d'insérer l'électrode. Poke une fibre musculaire. Ensuite, mesurer l'amplitude des valeurs résultantes. Placer un marqueur sur la ligne de base stable et enregistrer la valeur.
La différence dans le marqueur et le curseur actif est affiché sur le côté droit de l'écran. La valeur est donne la tension. La tension enregistrée peut-être besoin d'être divisée par la quantité d'amplification utilisé sur l'amplificateur (c'est à dire l'amplification 10x ou 100x). La tension doit être converti à partir volts à millivolts (1 V = 1000 mV) si les valeurs sont rapportées sur le logiciel en tant que volts. - Soigneusement utiliser le microscope et manipulateurs d'enlever l'électrode du muscle. Poke une autre fibre musculaire et noter le potentiel de repos membranaire. Il convient de prendre plusieurs enregistrements et d'être à l'aise avec les mesures ainsi que la direction de l'électrode intercellulaire dans la fibre musculaire d'intérêt.
L'électrode ne sera probablement pas rester dans une fibre musculaire au cours de l'évolution de l'ensemble des différents altérée [K +] des solutions hors. Il est préférable de retirer l'électrode, puis changez la solution, puis pénètre à nouveau pour éviter d'endommager le muscle. Il est préférable d'obtenir trois lectures par solution à partir de fibres musculaires séparés et utiliser un moyen pour éviter toute fausse lecture. - Utilisez une seringue pour enlever et jeter la solution saline de la boîte de Pétri. La boîte de Pétri doivent être remplis avec la concentration supérieure suivante de solution de chlorure de potassium salines, couvrant la préparation complètement. Le même processus doit être répété avec chaque solution de potassium et les changements de tension / potentiel devrait être noté et enregistré. La série de [K +] des solutions salines écrevisses que nous utilisons sont: 5,4, 20, 40, 60, 80, 100 mM.
2.3) Anatomie
Maintenant que la physiologie est terminée, nous pouvons examiner les associésl'anatomie des fibres musculaires et le modèle d'innervation. Transférer la préparation dans le plat coloration et ajouter le bleu de méthylène (1 gramme de bleu de méthylène mélangé avec 100 ml d'écrevisses salin). Laissez la solution saline baignent la préparation pendant 5 minutes puis retirer et ajouter les écrevisses salines frais sans tache. L'anatomie de ces muscles a été décrite en détail au fil des ans (Huxley, 1880; Pilgrim et Wiersma, 1963). C'est seulement récemment que certains des muscles été décrites anatomiquement, physiologiquement et biochimiquement (Cooper et al, 1998;. Griffis et al, 2000;. Sohn et al, 2000)..
La disposition anatomique générale des muscles est représenté dans la figure 16 (à droite de la figure à cet effet). Recherchez le nerf principal qui innerve principalement les muscles dans un segment. Esquisse de la structure d'innervation de la SEM, DEL2, Del1 et DEM muscles dans un segment. L'abdomen doit être tendu complètement en épinglant la préparation dans le plat fermement. Retirer ensuite le sérum physiologique et ajouter la solution de fixateur. La solution est une solution corriger Bouin (Préparé avec de l'acide picrique saturée, l'acide acétique et de formol; Sigma-Aldrich).
ATTENTION. Ne pas mettre cette solution sur la peau ou dans vos yeux. Eviter les vapeurs de la solution en travaillant sous la hotte. Si vos yeux commencent à brûler lavez-vous les yeux immédiatement à la station de lavage des yeux.
Laissez la solution de Bouin rester sur la préparation pendant environ 10 minutes et ensuite utiliser une pipette et d'échange de la solution pour salins. Coupez un morceau mince de Del1 ou DEL2 hors du muscle et le placer sur une lame de verre. Étiquette de la diapositive. Répétez la procédure pour le muscle SEM. Voir le schéma du sarcomère banding dans les deux préparations de tissus. Vous pouvez utiliser le microscope composé et ajuster les objectifs en conséquence de voir les profils de bandes. Si possible, prenez une photo numérique à travers l'oculaire du microscope (note: certaines caméras de téléphones cellulaires fonctionnent bien pour cette procédure).
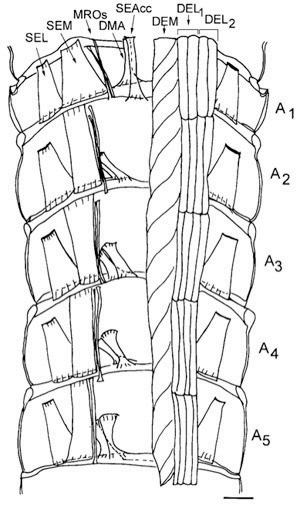
Figure 16. Schéma d'une vue ventrale de la partie dorsale de l'abdomen écrevisses montrant la musculature des extenseurs de chaque segment. Le muscle membrane dorsale abdomen (DMA) et le superficiel tête de l'extenseur muscle accessoire (SEACC) surviennent dans des segments de 1 à 5 de l'abdomen avec une orientation différente pour chaque segment. À l'exception du segment 1, ces muscles ont leurs sites d'attachement à leur extrémité antérieure à l'tergite calcifiés et à l'extrémité postérieure de la membrane articulaire. Dans le segment 1, les muscles homologues ont leurs sites de fixation antérieure à la membrane articulaire située entre le thorax et l'abdomen. L'illustration a été basée sur des montages photographiques bleu de méthylène préparations colorées. Sur le côté gauche de la figure de tous les muscles extenseurs profonds ont été enlevés pour montrer les muscles dorsaux extenseurs superficiels. Échelle = 2,35 mm. (Tiré de Sohn et al. 2000).
3. Résultats
Les questions suivantes et de traitement des données illustrent les principes et les objectifs principaux pour cette procédure de laboratoire.
- Tracer les mesures obtenues pour les potentiels de membrane de repos à chaque [K +] à utiliser. Voir si les lignes observées et hypothétiques sont compensées dans leur pente. Pour tracer les valeurs d'usage une parcelle semi-logarithmique avec l'axe des x de diverses [K +] comme un journal et l'axe des y des potentiels de membrane (comme illustré ci-dessous; figure 17). (Télécharger le papier graphique gratuit si nécessaire http://incompetech.com/graphpaper/logarithmic/ )

Figure 17. Graphique papier
Utiliser le potentiel de membrane au repos moyenne obtenue à 5,4 mM de [K +] hors d'initier les lignes hypothétiques et observé pour la comparaison.
Si les lignes ne correspondent pas à expliquer pourquoi cela pourrait être. - Si vous avez altéré le niveau externe d'ions Na +, vous attendez-vous le même type d'altérations observées que pour changer la concentration de K +?
- Comment s'est-bleu de méthylène tache des muscles par rapport aux nerfs? Pourquoi y aurait-il des différences? Est-bleu de méthylène utilisé aujourd'hui pour l'identification de tissus ou de contraste dans des cellules vivantes de l'homme? Quelle relation y at-il avec Sigmund Freud et les taches utilisés dans les écrevisses?
- Notez toutes les différences dans les habitudes sarcomère entre les DEL et les muscles SEM. Si oui, quelle pourrait être la raison? Ne tous les muscles sont les mêmes distances sarcomère repos? Dessinez le motif de bandes musculaires que vous avez observé avec le microscope et l'étiquette autant de la figure que possible (par rapport à l'anatomie des muscles connue sarcomère).
4. Mesure Re Synapticponses
1) INTRODUCTION
La préparation musculaire abdominale extenseurs utilisés pour démontrer le potentiel de repos membranaire est également idéal pour démontrer l'induction des réponses synaptiques à la NMJs des muscles différents. Certains muscles innervés crustacés sont sélectivement soit par un phasique ou un tonique des neurones moteurs, bien que certaines fibres simples peuvent être innervées par les neurones phasique et tonique du moteur excitateur, comme pour les muscles extenseurs de l'écrevisse à pied les jambes (Atwood, 2008; voir JOVE Identifiant de production # 2319-Wu et Cooper, 2010) et la plupart des muscles des membres d'autres (Wiersma, 1961a). En stimulant sélectivement les neurones moteurs phasique et tonique, les différences physiologiques dans le RPEB peut être mesurée. Neurones moteurs Phasic produire rapidement tics des fibres musculaires et évoquent EPSP de l'ordre de 10-40 mV. La réponse phasique peut déprimer rapidement avec 5-10-Hz trains de stimulation. Les neurones moteurs toniques donnent lieu à de plus petits EPSPS qui peut être facilitée en présence d'une fréquence plus élevée (10-50 Hz) de la stimulation. Structurellement, les terminaisons présynaptiques phasique et tonique à la NMJs sont différents (Atwood et Cooper, 1996; Bradacs et al, 1997;.. Cooper et al, 1998).
Étonnamment, le phénotype des réponses physiologiques phasique peut subir une transformation à un état tonico-comme la climatisation par les neurones électriquement phasique pendant quelques heures par jour pendant 7 jours (Cooper et al, 1998;. Mercier et Atwood, 1989). Aussi la sensibilité à la neuromodulation de l'NMJs transformé est premier pour étudier la régulation de l'expression des récepteurs (Griffis et al., 2000).
Dans cette préparation relativement robustes (muscles abdominaux écrevisses), à la fois tonique et phasique des réponses sont facilement enregistrés et examinés pour la facilitation et / ou la dépression des réponses synaptiques avec les paradigmes de stimulation variée. Avec ces préparatifs, les étudiants seront capables de reconnaître des généralités sur les réponses synaptiques phasique et tonique en stimulant un faisceau nerveux.
Une préparation supplémentaire JNM présenté est utilisé pour la surveillance de l'activité motrice et sensorielle intrinsèques de l'activité motrice de stimulation induite par le CNS. C'est le muscle fléchisseur superficiel sur la face ventrale de l'abdomen des écrevisses. Cette préparation sera également utilisé pour surveiller la sensori-SNC-moteur du muscle circuit et les effets des neuromodulateurs (Strawn et al., 2000).
Dans chacun des segments abdominaux (sauf le dernier) il ya trois groupes fonctionnels des muscles: (1) ceux pleopod contrôle (pléopodes) mouvement, (2) trois muscles extenseurs et (3) trois muscles fléchisseurs. Les muscles fléchisseurs et extenseurs sont des groupes de muscles antagonistes qui conduisent à la flexion ou l'extension abdominale en provoquant la rotation autour des charnières intersegmentaire. La musculature phasique occupe la majeure partie du volume de l'abdomen, tandis que les muscles toniques comprennent des feuilles minces de fibres qui s'étendent sur la dorsale (extenseurs) et ventrale (fléchisseurs) aspect de chaque segment abdominal.
Dans les écrevisses, les muscles fléchisseurs abdominale tonique d'écrevisses sont innervés dans chaque segment de moitié par cinq motoneurones et par un neurone inhibiteur de périphériques. Les motoneurones excitateurs utilisent le glutamate comme neurotransmetteur. Le glutamate dépolarise les fibres musculaires en provoquant une augmentation de la perméabilité principalement des ions sodium. Les neurones inhibiteurs communiqué acide gamma-amino butyrique (GABA), qui hyperpolarise généralement les fibres musculaires en provoquant une augmentation de la perméabilité aux ions chlorure. Dans certains muscles des crustacés (principalement dans les membres), les neurones périphériques inhibitrices de nouer des contacts synaptiques avec les terminaux du neurone moteur ainsi que les fibres musculaires, et de réduire la quantité de transmetteur libéré par les neurones moteurs (inhibition présynaptique) (Dudel et Kuffler, 1961 ). Ce phénomène n'est pas présent dans les muscles fléchisseurs tonique des écrevisses.
La chaîne nerveuse ventrale de l'écrevisse est une structure bilatérale et symétrique sur toute la longueur de l'animal. Il ya un ganglion par segment du corps. Dans l'abdomen (6 segments), chaque ganglion contient plusieurs centaines de neurones, et chacun des deux connecteurs se compose de quelques milliers d'axones. Le corps des cellules nerveuses forment un corps de plusieurs couche de cellules d'épaisseur sur la surface ventrale de chaque ganglion. Immédiatement au-dessus de la couche de corps cellulaire est un maillage fine des processus neuronaux, le neuropile. Toutes les interactions synaptiques se produisent ici, les corps cellulaires sont dépourvues de synapses.
Chaque ganglion abdominal (sauf le dernier) a trois racines de chaque côté. La première racine contient les axones des neurones innervant les muscles et les axones sensoriels pleopod; la seconde racine contient les axones innervant phasique et tonique muscles extenseurs et des axones sensoriels, et la troisième racine, ce qui laisse la moelle épinière de plusieurs millimètres caudale au ganglion, contient les axones innervating muscles fléchisseurs phasique et tonique. Il ya deux branches de la troisième racine. La branche profonde (IIIa) innerve les muscles fléchisseurs ne phasique. La branche superficielle de la troisième racine (IIIb) dans chaque demi-segment contient six axones qui innervent les muscles fléchisseurs des toniques.
Les neurones innervant le muscle fléchisseur tonique sont spontanément actifs, contrairement aux neurones efférents phasique, et dans une bonne préparation, ils continueront à feu pendant plusieurs heures après l'abdomen a été retiré de l'animal. Pour un examen de la nature historique des découvertes faites dans ces préparations abdominale voir Atwood (2008). Les corps cellulaires des quatre des neurones moteurs et des neurones périphériques innervant inhibition du muscle fléchisseur tonique dans n'importe quel segment de la moitié sont situés dans le ganglion de ce segment. Le corps cellulaire du neurone moteur le reste est situé dans le ganglion côté caudal. Ces neurones peuvent être distingués de manière fiable les uns des autres sur la base de extracelluarly enregistrées amplitudes pic. Si le muscle fléchisseur tonique d'un demi-segment est enlevé avec le deux ganglions contenant les neurones innervant ce muscle, cinq neurones montrent habituellement un certain degré d'activité spontanée. Ces neurones sont numérotés sur la base du pic d'amplitude relativement extracellulaire, dans l'ordre croissant. F1 à F4 et F5 sont motoneurones, le plus grand neurone spontanément actifs, est l'inhibiteur fléchisseurs périphériques. f6, le plus grand du motoneurone, est un neurone moteur excitateurs qui est rarement spontanément actifs.
Le caractère spontané de tonique des neurones moteurs d'activité peut être modulée par l'application exogène de composés ou en fournissant un stimulus sensoriel à la cuticule dans le même segment qui est surveillé par l'activité du nerf moteur.
2) Dissection
Pour obtenir la préparation des extenseurs abdominaux la même procédure que décrite ci-dessus pour examiner les potentiels de membrane au repos par rapport au potassium extracellulaire. La différence est de prendre soin du faisceau nerveux segmentaire qui longe le côté de la carapace. Ce nerf va être tiré dans une électrode d'aspiration qui servira de l'électrode de stimulation. Stimuler à 1 Hz pour le suivi des réponses phasiques. Stimuler avec de courtes rafales d'impulsions 10Hz pour 10 à 20 stimuli tout en surveillant les réponses tonique.
Les procédures expérimentales pour s'occuper des expériences sur les muscles fléchisseurs des écrevisses toniques sont différents et on a besoin de quitter la corde nerveuse ventrale intacte. Une préparation composée de plusieurs segments de l'abdomen est faite. Ceci est obtenu comme suit:
- Une écrevisse d'environ 6-10 cm de longueur du corps doit être obtenu (ou une taille gérable). Obtenir l'écrevisse en le tenant par l'arrière de la tête, soit environ 2 ou 3 centimètres à l'arrière de l'œil. Assurez-vous que les griffes de l'écrevisse ou de la bouche ne peuvent pas atteindre l'expérimentateur lors de la manipulation de l'écrevisse. Jeter de la tête et les appendices après les avoir retirés.
- Utilisez les ciseaux pour enlever rapidement la tête. Faire une coupe nette et rapide à partir de derrière les yeux de l'écrevisse.

Figure 18. Image montre le placement de la coupe pour enlever la tête de l'écrevisse.
Les pattes et les pinces de l'écrevisse peut être retiré à ce point pour éviter les blessures. Stylets sur les hommes et les pléopodes sur les deux mâles et des femelles peut également être retiré (figure 19 et 20). Ensuite, séparée de l'abdomen du thorax. Faites une coupe le long de la membrane qui relie l'articulant abdomen et du thorax (figure 20). - Enregistrer la partie abdomen de l'écrevisse et de disposer du thorax.

Figure 19. Image montre le placement des stylets qui peuvent être retirés de l'écrevisse.
Figure 20. Image montre le placement de la coupe pour enlever le thorax de l'abdomen.
Figure 21. Retrait du thorax de l'abdomen. La coupe doit être faite de manière circulaire le long de la ligne de jonction des segments.
Figure 22. L'image du haut montre l'abdomen avec appendices. L'image du bas montre l'enlèvement des appendices abdominaux. - Placer la préparation queue isolés dans une solution saline dans un grand plat de Pétri. Pin bas la partie supérieure de la queue et la préparation à l'antenne. Assurez-vous que la préparation est sécurisé. Utiliser un scalpel pour enlever une partie carrée de la face ventrale de la préparation entre les côtes.
Figure 23.Montre où la coupe doit être faite pour enlever la potion ventrale de la préparation. - Une petite coupe doit être faite (peut aussi être fait avec des ciseaux). Un lambeau doit être coupé et levées vers le haut. Le volet peut alors être enlevé avec des ciseaux, exposant les muscles fléchisseurs profond. Le microscope doit être utilisé pendant ce processus pour garantir la précision à enlever la partie ventrale de la préparation.
Figure 24. Coupe avec des ciseaux la préparation d'exposer les muscles.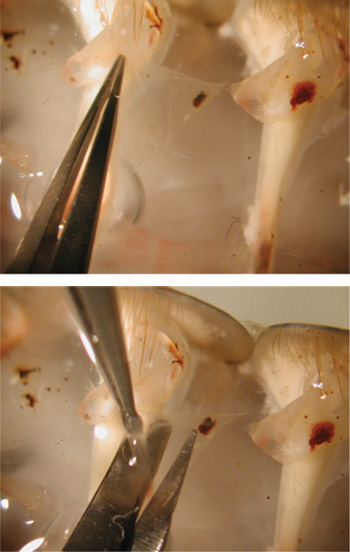
Figure 25. Image du haut montre la saisie du volet avec une pince. L'image du bas montre le retrait du volet de la préparation à l'aide du microscope.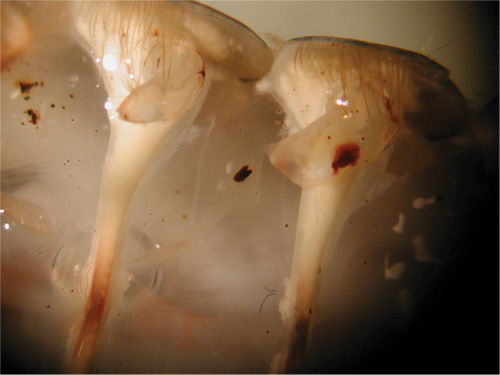
Figure 26. Exposition des muscles fléchisseurs superficiel.
3) L'enregistrement intracellulaire:

Figure 27. Configuration globale de l'équipement d'enregistrement.
- La boîte de Pétri avec la préparation doit être placé sous le microscope et sécurisée avec de la cire au fond du plat pour empêcher tout mouvement.

Figure 28. Indique l'emplacement de la préparation sous le microscope. Utiliser de la cire pour obtenir la boîte de Pétri et de préparation. - Deux fils de courte longueur de fil d'argent attaché à une extrémité doit être obtenu. Le fil d'argent doit être trempé dans une petite quantité d'eau de javel pendant environ 20 minutes pour obtenir un revêtement Ag-Cl. Laver le fil de l'eau avant utilisation. Une pipette en verre intracellulaire devraient être obtenus et soigneusement rempli avec une KCl (3 M) solution. La pipette doit être tourné vers le bas (avec l'ouverture vers le sol) et rempli d'une solution. Ce dernier fera en sorte que tout excédent sera KCl au goutte à goutte à l'arrière de l'électrode. Soyez sûr pas KCl longe la pipette en verre qui va entrer dans le bain salin. Tournez la pipette verticale lorsque vous avez terminé le remplissage avec une solution de chlorure de potassium. Le fil d'argent peut ensuite être placé dans la pipette. L'autre extrémité est connectée au + (positif) poteau sur la scène la tête. La pipette est ensuite fixé sur la sonde d'électrode. Des précautions doivent être faits pour ne pas casser la pipette électrode. Un troisième fil attaché à la cage de Faraday doit être placé dans le pôle vert de la scène la tête. Enfin le fil d'Ag de la tête restants devraient être placés dans le bain et l'autre extrémité attachée à la - (négatif) pole-dessous. Un fil doit également être placé dans la cage de Faraday pour la portion terrestre de l'Powerlab convertisseur AD. L'étape la tête est relié à "l'entrée-sonde» sur l'acquisition / amplificateur (Powerlab).
Figure 29. Configuration de scène en chef. Le fil relié à la partie verte de l'étape de la tête est mise à l'amplificateur ou de la cage de Faraday. Le fil relié à la partie rouge est connecté au fil de l'électrode. La partie noire est utilisée pour se connecter à la solution de bain.
Figure 30. "Test toggle" est dans la rangée du bas pour tester la résistance de l'électrode. Le «grossier» potentiomètre est également trouvé sous décalage DC qui devrait être tourné antihoraire. Le gain est fixé à 50, ce qui amplifie les signaux par un facteur de cinquante ans. Le fil de terre de l'étape de la tête est placée dans le "GND" ouverture jack. - Le logiciel LabChart doit être ouvert sur le bureau ou portable. Ajustez le graphique pour afficher un seul canal en cliquant sur "Configuration", puis "Paramètres canal." Sous "Paramètres Channel," Changer le nombre de canaux à un. Cliquez sur «OK». Au haut du tableau, dans le coin gauche, de cycles par seconde devrait être 2K. Réglez volts (axe Y) à environ 200 mV à 500 mV. Cliquez sur "Channel 1" sur la partie droite de l'écran. Cliquez sur "amplificateur d'entrée." Assurez-vous que la case est cochée différentiel.
La sortie de l'amplificateur doit être dans le canal. Les paramètres suivants doivent être utilisés avec l'amplificateur:- High Pass-DC
- Notch Filter-OFF
- Low Pass-20kHz
- Capacité Comp .- antihoraire
- DC Offset fines et grossières bouton-antihoraire
- DC Offset (+ OFF) - OFF
- GAIN-50
- Entrée (DIFF MONO GND) - DIFF
- MODE (STIM-GATE-REC) - REC
- ΩTEST-OFF
- Pour mesurer la résistance de l'électrode, la tension doit être divisée par le courant, ce qui est de 2,0 nA. La valeur résultante est la résistance de l'électrode de verre. La résistance doit être de 20 à 60 mégaohms. Une fois que la résistance a été déterminée, des enregistrements intracellulaires peut commencer. Placez l'extrémité de l'électrode de verre dans le bain salin. Assurez-vous un fil de terre est aussi dans le bain salin.
Pour commencer l'enregistrement, appuyez sur "start" au bas de l'écran. Assurez-vous que le gain est fixé à 5 V / div. Utilisez le bouton de cap sur l'amplificateur pour déplacer la ligne sur le LabChart à zéro avant d'insérer l'électrode. Le bouton à bascule doit être activé et puis en route plusieurs fois afin de tester la résistance de l'électrode. Ensuite, l'amplitude des valeurs résultant doit être mesurée. Placez un fabricant de la ligne de base stable et ensuite placer le second à la pointe pour obtenir la résistance de l'électrode. - Utilisez la sonde d'électrode et d'un microscope pour insérer l'électrode dans le muscle. Ne pas pénétrer à travers le muscle. Utilisez les paramètres de la sonde de microscope et afin de trouver la mince couche de fibres musculaires et d'insérer les électrodes dans les fibres. L'illuminateur d'intensité élevée peut être utilisé comme une source de lumière lors de la pénétration dans le muscle.
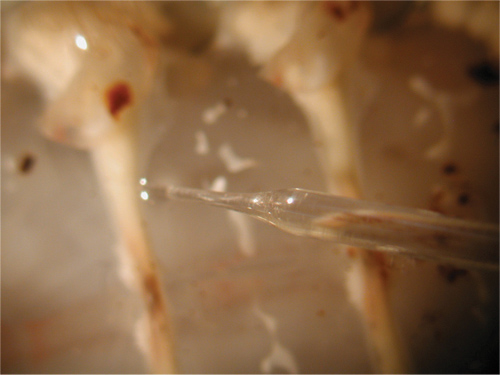
Figure 31. Insertion d'électrode dans le muscle. - Des précautions doivent être prises pour éviter d'endommager les racines des nerfs aux muscles superficiels.
Il est conseillé de garder le bain salin les préparations fraîches (10-15 degrés Celsius) et bien oxygénée tout en effectuant les procédures expérimentales. Si les unités de refroidissement ne sont pas disponibles remplacer les salines avec des produits frais, refroidis salines régulièrement. L'oxygène gazeux, ou du moins l'air, doivent être à barboter dans la solution saline. - Enregistrement de l'activité spontanée de l'EPSP. Notez la différence de taille des EPSP et si IPSP sont présents.
- Très soigneusement prendre un petit buisson de peinture et de la main le long du bord de stimuler la cuticule dans le même segment que l'on est suivi de l'activité spontanée. Noter un changement dans la fréquence des réponses et si RPEB taille différente apparaissent qui n'étaient pas là avant la stimulation de la cuticule.
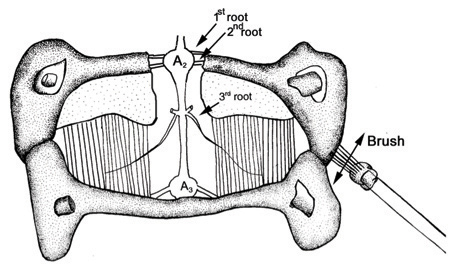
Figure 32. Préparation à la stimulation des racines nerveuses et une brosse. (Modifié par Strawn et al., 2000) - La stimulation peut être répétée après avoir soigneusement échangeant le bain salin avec l'un contenant un neuromodulateur tels que la sérotonine (1 microM) ou une solution saline à barboter avec du CO 2. Notez l'effet sur le profil d'activité pour un stimulus donné. A noter également, si l'échange de l'arrière du sérum physiologique pour frais retourne salines de l'activité à son état initial.
- Ensuite, on peut suivre l'activité neuronale au sein du circuit sensori-moteur SNC neurone de diverses manières. Nous pouvons utiliser une électrode d'aspiration au lieu d'une électrode intracellulaire (figure 33) pour surveiller l'activité des neurones moteurs. A la pointe de l'électrode d'aspiration en verre, des tubes en plastique est placé qui a une ouverture de la bonne taille pour tirer le nerf dans la pointe. L'ouverture ne doit pas être trop grand, comme le nerf allaient tomber, ou trop petit, parce que le nerf serait endommagé par la pression de l'électrode. Le tube de plastique est tiré sur une flamme et coupée à la taille nécessaire.

Figure 33. Mettre en place avec des arrangements d'enregistrement d'aspiration des électrodes.
Placez le micromanipulateur dans une position où l'électrode d'aspiration a un accès facile au bain salin. D'aspiration jusqu'à salée jusqu'à ce qu'elle soit en contact avec le fil d'argent à l'intérieur de l'électrode d'aspiration. Disposer l'autre fil sur le côté coupé des électrodes d'aspiration proche de la pointe de l'électrode, afin que les deux fils seront en contact avec le bain salin.
Comme pour la surveillance électrique raccorder l'amplificateur différentiel AC / DC (amplificateur) au 26T Power Lab. Pour ce faire, brancher le cordon d'entrée 1 bon sur le 26T PowerLab à la sortie de l'amplificateur.- Les contrôles instrument de l'amplificateur doit être réglé sur les paramètres suivants:
- High Pass-DC
- Notch Filter-OFF
- Low Pass-20kHz
- Capacité Comp .- antihoraire
- DC Offset fines et grossières bouton-antihoraire
- DC Offset (+ OFF) - OFF
- GAIN-50
- Entrée (DIFF MONO GND) - DIFF
- MODE (STIM-GATE-REC) - REC
- ΩTEST-OFF
Connectez les fils électriques de l'électrode d'aspiration à l'étape de la tête. Les fils doivent être connectés avec le rouge (positif) en haut à gauche, vert (terre) au milieu, noir (négatif à la base. Ceci est indiqué dans la figure 34. Le fil de terre peut être simplement mis dans le bain salin.
Configuration de scène la figure 34. Head - Les contrôles instrument de l'amplificateur doit être réglé sur les paramètres suivants:
- Maintenant, connectez le câble USB de la 26T PowerLab à l'ordinateur portable. Vérifiez que l'amplificateur et PowerLab26T sont branchés et sous tension avant d'ouvrir LabChart7 sur l'ordinateur.
- Ouvrez LabChart7.
- La zone Centre LabChart Bienvenue apparaîtra ouvert. Fermez-le.
- Cliquez sur Setup
- Cliquez sur Paramètres canal. Changer le nombre de canaux à 1 (en bas à gauche de la boîte) Appuyer sur OK.
- En haut à gauche de la carte de l'ensemble de cycles par seconde à environ 2k. Réglez le volts (axe Y) à environ 500 ou 200 mV.
- Cliquez sur le canal 1 sur la droite du graphique. Cliquez sur l'amplificateur d'entrée. Assurez-vous que les paramètres: single-ended, couplage AC, et inverser (inverse le signal si nécessaire), et d'anti-alias, sont vérifiées.
- Pour commencer l'enregistrement appuyer sur start.
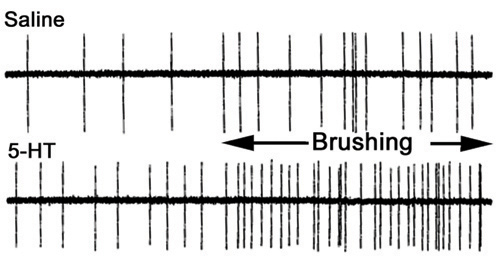
Figure 35. Activité de la racine 3 e avant et pendant la stimulation cuticulaires dans une solution saline (en haut) et dans 100 nM de 5-HT (en bas). Le temps pendant la stimulation cuticule est indiqué par la barre. Notez le renforcement de l'activité avant et après stimulation lorsque la préparation est baigné dans la 5-HT (modifié par Strawn et al., 2000).
Nous pouvons enregistrer à partir du 1 er ou 2 ème racines en faisant un enregistrement en passant du nerf, ou nous pouvons transect la racine loin de la VNC et enregistrement d'entrée pur sensorielles provenant de la périphérie qui serait d'envoyer des signaux dans le VNC. Ainsi, vous enregistrer à partir de la racine sectionnée menant à la périphérie de l'activité sensorielle.
La racine contient 2 ème très gros axones afférents primaires des organes récepteurs musculaires (MRO) et les petits axones efférents des extenseurs aux neurones moteurs (Fields et Kennedy, 1965). Il ya beaucoup d'axones sensoriels dans les 1 er et 2 ème racines.
Les neurones mécano ont des connexions directes, par des synapses électriques avec les axones géants latéral (LG) (Krasne 1969; Zucker, 1972). Aussi, les neurones mécano sont connus pour exciter les interneurones via les synapses chimiques.
Pour examiner comment les entrées sensorielles peuvent influencer l'activité du neurone moteur, grâce à un circuit sensori-SNC-neurone moteur, nous pouvons enregistrer les réponses synaptiques dans un muscle. Divers aspects du circuit, nous allons utiliser ne peut être examinée. Par exemple, on peut enregistrer à partir de la racine nerveuse sensorielle seul ou la racine motrice avec ou sans entrée sensorielle intacte dans le VNC pour analyser les enregistrements de fréquence pic, on peut compter sur une période de temps dans des conditions différentes. Les mesures peuvent être faites avant de se brosser la stimulation et pendant la stimulation brosse pour un laps de temps donné (figure 35). On peut répéter les conditions 5 fois et d'obtenir le changement pour cent en moyenne en fréquence comme une mesure d'effectuer des comparaisons.
On peut également appliquer des composés exogènes tels que la sérotonine (Strawn et al., 2000) ou l'acétylcholine (ACh), de nicotine ou du glutamate. Diverses actions de comportement ont été décrits pour la nicotine chez les invertébrés. Cela suggère la présence de récepteurs nicotiniques (Tsunoyama et Gojobori, 1998). Le glutamate est un neurotransmetteur excitateur majeur dans la plupart des invertébrés à la JNM et ACH est le principal neurotransmetteur excitateur dans le SNC (Monoghan et al, 1989;. Watkins et al, 1990).
On peut essayer heptanol ou CO 2 buller salée, car il va découpler les écrevisses cloisonnées (ou gap) jonctions au sein du circuit comme le Dr Sonya M. Bierbower (University of Kentucky) a montré dans sa thèse de recherche. Cette action peut expliquer le comportement des animaux modifiés entière lorsqu'ils sont exposés à de CO 2 élevée dans l'environnement (Bierbower et Cooper, 2010). Lorsque vous stimulez la cuticule avec un pinceau et d'entrée du variateur sensoriel et enregistrer une réponse dans les neurones moteurs, note si il ya une différence dans l'activité avant et pendant heptanol ou CO 2 d'exposition. Cela peut ou ne peut suggérer des jonctions d'avoir un rôle dans le circuit sensori-SNC-neurone moteur.
Discussion
Potentiel de membrane
Dès 1902, Bernstein a été le traitement des questions d'un potentiel de repos dans l'axone d'un calmar. Il est curieux d'examiner comment ces premières idées et des observations de Berstein (1902) et de Nernst (1888) plus tard, influencé la recherche en physiologie de membrane. (Voir revue par Malmivuo et Plonsey, 1995; également disponible sur le www http://www.bem.fi/book/ ). Il ya encore, à ce jour, les percées faites au sujet de la fonction des canaux ioniques et les propriétés des membranes biologiques qui sont très importants dans la compréhension de la physiologie cellulaire qui se rapporte à la fonction des tissus, organes et systèmes.
La comparaison des effets expérimentaux et théoriques issus de l'extérieur [K +] sur le potentiel de repos membranaire indique l'influence des ions sur le potentiel de membrane. Des expériences complémentaires utilisant cette même préparation restent à effectuer pour répondre aux questions fondamentales physiologiques. Certains ont été mis en évidence en 1968 par Atwood et Parnas et n'ont pas encore été entièrement traités. Avec les techniques obtenus dans cet exercice, on peut procéder pour répondre à de nombreuses questions qui restent dans les autres préparations expérimentales ainsi que dans les applications physiologiques liés à la médecine et la santé. Nous avons démontré l'utilité d'une préparation d'invertébrés modèle pour répondre aux questions fondamentales pertinentes à tous les animaux.
Grâce aux connaissances acquises sur les gradients électrochimiques des ions dans cet exercice ci-dessus, vous pouvez maintenant passer à l'excitabilité des membranes en examinant la transmission synaptique neuromusculaire dans les préparations à l'écrevisse.
Mesure des réponses synaptiques
Les détails fournis par la première partie de ce laboratoire, et le film associé, ont fourni les principales étapes pour l'enregistrement de potentiels de membrane et d'enquêter sur la structure musculaire. Dans la deuxième partie de ce laboratoire, la démonstration de la dissection et la transmission synaptique d'enregistrement à la NMJs d'unités motrices phasiques et toniques fourni une exposition à des concepts fondamentaux de la physiologie. L'exposition à un circuit de neurones, qui peut en partie peut être utilisée pour expliquer les comportements associés, chez l'animal intact a un potentiel non seulement pour les étudiants d'étudier diverses questions ouvertes dans leur exercice de laboratoire, mais aussi pour de futures recherches sur les circuits neuronaux dans un puits la préparation d'invertébrés établis (Kennedy et al, 1969;. Antonsen et Edwards, 2003)
Ces préparations peuvent aussi être utilisées pour étudier la facilitation synaptique, la dépression et plasticité à long terme (pas étudiés dans cette étude en laboratoire). Même au sein de certaines espèces d'écrevisses, de la plasticité neuronale dépend des conditions de stimulation expérimentale (Mercier et Atwood, 1989;. Cooper et al, 1998) ainsi que leur environnement naturel. Dans quelle mesure la capacité d'altérer l'efficacité synaptique et la dynamique musculaire sert de l'animal reste à étudier. Depuis écrevisses ne modifient leur comportement en relation avec les variations saisonnières et du cycle de mue, il ya relativement différences d'activité à long terme dans leurs systèmes neuromusculaires. Il a été démontré que les bornes phasique nerf moteur des muscles griffes présentent le plus proche morphologie classique phasique pendant l'hiver, mais gonflent et deviennent plus varices le long de la borne pendant les mois d'été (Lnenicka 1993; Lnenicka et Zhao, 1991).
Certaines des premières études menées en écrevisses géantes latérales (LG) interneurones au sein de la corde nerveuse ventrale démontré la présence de jonctions lacunaires (Johnson, 1924; Watanabe et Grundfest, 1961). Il est bien connu que le CO 2 a un effet sur la communication électrique par découplage jonctions gap (Arellano et al, 1990). Il a été récemment montré que la moelle épinière et de la communication au sein du circuit sensori-moteur-SNC-musculaires, telles que décrites dans ce rapport, est également sensible au CO 2 d'exposition, indiquant la présence de jonctions lacunaires (Bierbower, 2010; Bierbower et Cooper, 2010)
L'activité spontanée de la racine 3 e moteur a été un sujet depuis les années 1960 lorsque Eckert (1961) a examiné si la tonique tirs statiques organe récepteur musculaire (MRO) dans le même segment ou voisins pourraient représenter pour le lecteur motrice spontanée. Dans ces études antérieures, il est devenu évident que l'activité a été tirée dans la corde nerveuse ventrale (VNC), éventuellement des centres supérieurs (Eckert, 1961; Kennedy et Takeda, 1965a, b;. Strawn et al, 2000). Puisque la présence de CO 2 arrêté l'activité spontanée, on peut supposer quelque part dans le lecteur pour les neurones moteurs pourrait y avoir des jonctions ou glutamatergiques excitateurs disque. Le NMJs sont bloqués ou présentent une sensibilité diminuée à la glutamate en présence de CO 2, et ils peuvent être du Blocked ainsi dans le SNC (Bierbower, 2010; Bierbower et Cooper, 2010; voir aussi Badre et al, 2005)..
L'action des neuromodulateurs différents est aussi facile a étudié à différents types de NMJs (Cooper et Cooper, 2009; Griffis et al, 2000;. Southard et al, 2000;.. Strawn et al, 2000). En outre, les diverses influences sont exercées par les neuromodulateurs du système nerveux central sur les circuits. Il a été suggéré que la 5-HT et les neurones octopaminergic peut fonctionner comme «gain-setters» dans la modification de la sortie des circuits neuronaux (Ma et al, 1992;. Schneider et al, 1996;. Horner et al, 1997;. Edwards et al., 2002). Beaucoup de travail reste à faire avant que nous ne pouvons comprendre pleinement les effets des neuromodulateurs sur les cellules cibles individuelles. Étant donné que les neuromodulateurs différents peuvent travailler de concert avec l'autre, l'analyse de leur action mixte est une zone pour des recherches futures (Djokaj et al., 2001). En outre, peu d'études, en particulier chez les vertébrés, lutter contre les effets des neuromodulateurs ensemble sur les voies qui peuvent réguler un comportement spécifique. Dans cette préparation unité sensori-motrice SNC-on peut examiner l'influence des deux entrées sensorielles et neuromodulateurs sur l'activité des neurones moteurs (Kennedy et al., 1969).
Comme il a été postulé que la 5-HT joue un rôle dans la régulation de l'état comportemental du écrevisses, langoustes et des crabes (Livingstone et al, 1980;.. Sneddon et al, 2000), plusieurs tentatives ont été faites pour déterminer sa concentration dans VNC, l'hémolymphe, et dans les ganglions isolés de homards (Livingstone et al, 1980;. Harris-Warrick et Kravitz 1984;. Fadool et al, 1988). Cependant, il a été variations considérables dans les mesures enregistrées, ce qui exclut spécifiques relation dose-réponse qui pourrait rendre compte des mesures comportementales.
Une écrevisse avec les griffes lieu dans une position surélevée et avec la queue repliées sous son abdomen a été pensé pour exposer une posture dominent (Livingstone et al., 1980). L'état de flexion abdominale chez les écrevisses ne semble pas être la posture que l'écrevisse dominante, dans une paire, présentent au cours des interactions sociales ou tout en conservant un statut dominant hiérarchique (Listerman et al., 2000). Soumise écrevisses vont même tuck leurs abdomens en eux-mêmes comme ils se retirent d'un adversaire. Border la queue est également considéré comme une posture de défense (Listerman et al., 2000). Ces comportements ont été facilement observés sur le terrain et en laboratoire (Bovbjerg, 1953, 1956; Brousski et Dunham, 1987; Li et al, 2000;.. Listerman et al, 2000). Fait intéressant, les postures comportementales noté dans les homards (Livingstone et al., 1980) sont inversés pour la 5-HT et les injections octopamine dans les écrevisses australiennes, destructeur Cherax (McRae, 1996). Peut-être, des réponses tout à fait différente serait observé dans la préparation fléchisseur superficiel de l'écrevisse australienne. En outre, depuis la domination est généralement de taille liés entre écrevisses, on s'attendrait à un système de réponse très rapide en plastique pour modifier les conditions sociales (Strawn et al., 2000). La plasticité de la réactivité aux neuromodulateurs dans les invertébrés est un espace ouvert d'enquête.
Wyttenbach, Johnson, et Hoy (1999) ont produit des supports numériques et d'un manuel de laboratoire pour les expérimentations impliquant les différents écrevisses musculaires mêmes présentées dans ce rapport, en plus de préparations autres écrevisses. Ceci est une excellente ressource pour les exercices des élèves.
Déclarations de divulgation
Remerciements
Soutenue par l'Université du Kentucky, Département de biologie, Bureau des études de premier cycle et le Collège des Arts et des Sciences.
matériels
- Ecrevisses (Procambarus clarkii). Atchafalaya biologique Supply Co., Raceland, LA., USA.
- Standard écrevisses salin: modification de la solution Van Harreveld (1936). (En mm) 205 NaCl, 5,3 KCl; 13,5 CaCl 2, 2H 2 O; 2,45 MgCl 2 6H 2 O; HEPES 5 et ajusté à pH 7,4. La sérotonine, glutamate et la dopamine sont faites dans une solution saline écrevisses. Solution de fixateur de Bouin a été utilisé directement et bleu de méthylène est faite dans une solution saline écrevisses. Tous les produits chimiques sont obtenus chez Sigma Chemical Company (St. Louis, MO).
- Des outils de dissection: Beaux # 5 pinces, ciseaux fins, porte-lame de couteau, des broches # 26002-20 insectes (tous obtenus à partir des outils Fine Science (USA), Inc, 373-G Vintage Park Drive, Foster City, CA 94404-1139) .
- Plat en verre à fond Sylgard
- Béchers (pour retenir des solutions chimiques)
- Les signaux électriques sont enregistrées sur la ligne à une interface PowerLab 26T à un ordinateur (ADInstruments, Colorado Springs, CO, USA). Nous utilisons un logiciel standard de ADInstruments nommé Chart ou la portée.
- Modèle 3000 AC / DC amplificateur pour des enregistrements intracellulaires ainsi que extracellulaire peut être utilisé.
- Loupe binoculaire avec fonction zoom pour les enregistrements intracellulaires. Pour l'enregistrement de contact sur les bornes visualisés au microscope composé avec les objectifs debout (4 x et 20x) est utilisé. On a besoin d'une source lumineuse Hg.
- Pour les enregistrements intracellulaires nous utilisons tube capillaire en verre (catalogue # 30-31-0 du FHC, Brunswick, ME, 04011, USA). L'électrode intracellulaire doivent avoir une résistance de 20 à 30 Mohm. Électrodes intracellulaires ont été remplis avec 3 M de KCl.
- Une électrode d'aspiration est utilisé pour enregistrer des signaux extracellulaires.
- Cage de Faraday.
- Illuminateur à haute intensité (source lumineuse).
- Micromanipulateur
Références
- Antonsen, B. L., Edwards, D. H. Differential dye coupling reveals lateral giant escape circuit in crayfish. J. Comp. Neurol. 466, 1-13 (2003).
- Arellano, R. O., Rivera, A., Ramón, F. Protein phosphorylation and hydrogen ions modulate calcium-induced closure of gap junction channels. Biophys. J. 57, 363-367 (1990).
- Atwood, H. L. γ -aminobutyric acid and crab muscle fibres. Experientia (Basel). 20, 161-163 (1964).
- Atwood, H. L. Variation in physiological properties of crustacean motor synapses. Nature. 215, 57-58 (1967).
- Atwood, H. L. Peripheral inhibition in crustacean muscle. Experimentia. 24, 753-763 (1968).
- Atwood, H. L. An attempt to account for the diversity of crustacean muscles. Am. Zool. 13, 357-378 (1973).
- Atwood, H. L. Organization and synaptic physiology of crustacean neuromuscular systems. Prog. Neurobiol. 7, 291-391 (1976).
- Atwood, H. L., Sandeman, D. C., Atwood, H. L. Synapses and neurotransmitters. The Biology of Crustacea. 3, 105-150 (1982).
- Atwood, H. L. Parallel 'phasic' and 'tonic' motor systems in the crayfish abdomen. J. Exp. Biol. 211, 2193-2195 (2008).
- Atwood, H. L., Cooper, R. L. Functional and structural parallels in crustaceans and Drosophila neuromuscular systems. Am. Zool. 35 (6), 556-565 (1995).
- Atwood, H. L., Cooper, R. L. Assessing ultrastructure of crustacean and insect neuromuscular junctions. J. Neurosci. Meth. 69, 51-58 (1996).
- Atwood, H. L., Cooper, R. L. Synaptic diversity and differentiation: Crustacean neuromuscular junctions. Invertebrate Neurosci. 1, 291-307 (1996).
- Atwood, H. L., Parnas, I., Kerkut, G. A. . Recording from the crayfish abdominal extensor muscle preparation with microelectrodes. In: Experiments in physiology and biochemistry. , 307-330 (1968).
- Badre, N. H., Martin, M. E., Cooper, R. L. The physiological and behavioral effects of carbon dioxide on Drosophila larvae. Comparative Biochemistry and Physiology A. 140, 363-376 (2005).
- Bernstein, J. Untersuchungen zur Thermodynamik der bioelektrischen Ströme. Pflüger Arch. ges. Physiol. 9, 521-562 (1902).
- Bernstein, J. . Elektrobiologie. , 215 (1912).
- Bierbower, S. M. . Environmental effects on behavior and physiology in crayfish. , (2010).
- Bierbower, S. M., Cooper, R. L. The effects of acute carbon dioxide on behavior and physiology in Procambarus clarkii. J. Exp. Zool. , (2010).
- Boistel, J., Fatt, P. Membrane permeability change during inhibitory transmitter action in crustacean muscle. J. Physiol. (Lond.). 144, 176-191 (1958).
- Bovbjerg, R. V. Dominance order in the crayfish Orconectes 6irilis (Hagen). Physiol. Zool. 26, 173-178 (1953).
- Bovbjerg, R. V. Some factors affecting aggressive behavior in crayfish. Physiol. Zool. 29, 127-136 (1956).
- Bradacs, H., Cooper, R. L., Msghina, M., Atwood, H. L. Differential physiology and morphology of phasic and tonic motor axons in a crayfish limb extensor muscle. J. Exp. Biol. 200, 677-691 (1997).
- Bruski, C. A., Dunham, D. W. The importance of vision in agonistic communication of the crayfish Orconectes rusticus, I. an analysis of bout dynamics. Behaviour. 63, 83-107 (1987).
- Burke, W., Ginsborg, B. L. The electrical properties of the slow muscle fibre membrane. J. Physiol. 132, 586-598 (1956).
- Cooper, A. S., Cooper, R. L. Historical View and Physiology Demonstration at the NMJ of the Crayfish Opener Muscle. J. Vis. Exp. (33), e1595 (2009).
- Cooper, R. L., Warren, W. M., Ashby, H. E. Activity of phasic motor neurons partially transforms the neuronal and muscle phenotype to a tonic-like state. Muscle & Nerve. 21, 921-931 (1998).
- Djokaj, S., Cooper, R. L., Rathmayer, W. Effects of octopamine, serotonin, and cocktails of the two modulators on synaptic transmission at crustacean neuromuscular junctions. J. Comp. Physiol. A. 187 (2), 145-154 (2001).
- Dudel, J., Kuffler, S. W. Mechanism of facilitation at the crayfish neuromuscular junction. J. Physiol. (Lond.). 155, 540-542 (1961).
- Eckert, R. O. Reflex relationships of the abdominal stretch receptors of the crayfish. J. Cell. Comp. Physiol. 57, 149-162 (1961).
- Edwards, D. H., Yeh, S. R., Musolf, B. E., Antonsen, B. L., Krasne, F. B. Metamodulation of the crayfish escape circuit. Brain Behav Evol. 60 (6), 360-369 (2002).
- Fadool, D. A., Cobb, S. J., Kass-Simon, G., Brown, P. R. Liquid chromatographic procedures for the analysis of compounds in the serotonergic and octopamine pathways of lobster hemolymph. J. Chromatogr. 452, 491-501 (1988).
- Fatt, P., Katz, B. The electrical properties of crustacean muscle fibers. J. Physiol. 120, 171-204 (1953).
- Fields, H. L., Kennedy, D. Functional role of muscle receptor organs in crayfish. Nature. 206 (990), 1235-1237 (1965).
- Fisher, L., Florey, E. Modulation of synaptic transmission and excitation-contraction coupling in the opener muscle of the crayfish, Astacus leptodactylus, by 5-hydroxytryptamine and octopamine. J. Exp. Biol.. 102, 187-198 (1983).
- Freud, S. Über den Bau der Nervenfasern und Nervenzellen beim Flußkrebs. Anzeiger Akad. 18, 275 (1881).
- Freud, S. Über den Bau der Nervenfasern und Nervenzellen beim Flußkrebs. Sitzungsber. Akad. 85, 9-46 (1881).
- Goldman, D. E. Potential, impedance, and rectification in membranes. J. Gen. Physiol. 27, 37-60 (1943).
- Griffis, B., Bonner, P., Cooper, R. L. Sensitivity of transformed (phasic to tonic) motor neurons to the neuromodulator 5-HT. Comparative Biochemistry and Physiology A. 127, 495-504 (2000).
- Grundfest, H., Reuben, J. P., Florey, E. Neuromuscular synaptic activity in lobster. Nervous Inhibition. , 92-104 (1961).
- Harris-Warrick, R. M., Kravitz, E. A. Cellular mechanisms for modulation of posture by octopamine and serotonin in the lobster. J. Neurosci. 4, 1976-1993 (1984).
- Hagiwara, S., Chichibu, S., Naka, K. I. The effects of various ions on resting and spike potentials of barnacle muscle fibers. J. Gen. Physiol. 48, 163-179 (1964).
- Hille, B. . Ionic Channels of Excitable Membranes. , (1992).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. J. Physiol. (Lond.). 117, 500-544 (1952).
- Hodgkin, A. L., Huxley, A. F., Katz, B. Measurement of current-voltage relations in the membrane of the giant axon of Loligo. J. Physiol. (Lond.). 116, 424-448 (1952).
- Hodgkin, A. L., Katz, B. The effect of sodium ions on the electrical activity of the giant axon of the squid. J. Physiol. (Lond.). 108, 37-77 (1949).
- Hodgkin, A. L., Rushton, W. A. H. The electrical constants of a crustacean nerve fibre. Proc. Roy. Soc. 133, 444-479 (1946).
- Hörner, M., Weiger, W. A., Edwards, D. H., Kravitz, E. A. Excitation of identified serotonergic neurons by escape command neurons in lobsters. J. Exp. Biol. 200, 2017-2033 (1997).
- Huxley, T. H. . The crayfish. , (1880).
- Johnson, G. E. Giant nerve fibers in crustaceans with special reference to Cambaus and Palaemonetes. J. Comp. Neurol. 36, 323-373 (1924).
- Johnston, M. F., Simon, S. A., Ramon, F. Interaction of anaesthetics with electrical synapses. Nature (Lond.). 286, 498-500 (1980).
- Katz, B., Miledi, R. The role of calcium in neuromuscular facilitation. J. Physiol. (Lond.). 195, 481-492 (1968).
- Kennedy, D., Takeda, K. Reflex control of abdominal flexor muscles in the crayfish: the twitch system. J. Exp. Biol. 43, 211-227 (1965).
- Kennedy, D., Takeda, K. Reflex control of the abdominal flexor in the crayfish: the tonic system. J. Exp. Biol. 43, 229-246 (1965).
- Kennedy, D., Selverston, A. I., Remler, M. P. Analysis of restricted neural networks. Science. 164, 1488-1496 (1969).
- Krasne, F. B. Excitation and habituation of the crayfish escape reflex: the depolarizing response in lateral giant fibres of the isolated abdomen. J. Exp. Biol. 50, 29-46 (1969).
- Li, H., Listerman, L. R., Doshi, D., Cooper, R. L. Heart rate measures in blind cave crayfish during environmental disturbances and social interactions. Comp. Biochem. Physiol A. 127, 55-70 (2000).
- Listerman, L., Deskins, J., Bradacs, H., Cooper, R. L. Measures of heart rate during social interactions in crayfish and effects of 5-HT. Comp. Biochem. Physiol A. 125, 251-264 (2000).
- Livingstone, M. S., Harris-Warrick, R. M., Kravitz, E. A. Serotonin and octopamine produce opposite postures in lobsters. Science. 208, 76-79 (1980).
- Lnenicka, G. A. Seasonal differences in motor terminals. Comp. Biochem. Physiol A. 104, 423-429 (1993).
- Lnenicka, G. A., Zhao, Y. Seasonal differences in the physiology and morphology of crayfish motor terminals. J. Neurobiol. 22, 561-569 (1993).
- Ma, P. M., Beltz, B. S., Kravitz, E. A. Serotonin containing neurons in lobsters: their role as 'gainsetters' in postural control mechanisms. J. Neurophysiol. 68, 36-54 (1992).
- Malmivuo, J., Plonsey, R. . Bioelectromagnetism-Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- McRae, T. On the postural effects induced in female Cherax destructor (Clark) by serotonin and octopamine. Freshwater Crayfish. 11, 293-298 (1996).
- Mercier, A. J., Atwood, H. L. Long-term adaptation of a phasic extensor motoneurone in crayfish. J. Exp. Biol. 145, 9-22 (1989).
- Monaghan, D. T., Bridges, R. J., Cotman, C. W. The excitatory amino acid receptors: their classes, pharmacology, and distinct properties in the function of the central nervous system. Annu. Rev. Pharmacol. Toxicol. 29, 365-402 (1989).
- Moody, W. Gradual increase in the electrical excitability of crayfish slow muscle fibers produced by anoxia or uncouplers of oxidative phosphorylation. J. Comp. Physiol. 125, 327-334 (1978).
- Nernst, W. H. Zur Kinetik der Lösung befindlichen Körper: Theorie der Diffusion. Z. Phys. Chem. 3, 613-637 .
- Nernst, W. H. Die elektromotorische Wirksamkeit der Ionen. Z. Phys. Chem. 4, 129-181 .
- Pilgrim, R. L. C., Wiersma, C. A. G. Observations on the skeleton and somatic musculature of the abdomen and thorax of Procambarus clarkii (Girard), with notes on the thorax of Panulirus interruptus (Randall) and Astacus. J. Morphol. 113, 453-587 (1963).
- Robinson, M. M., Martin, J. M., Atwood, H. L., Cooper, R. L. Modeling Biological Membranes with Circuit Boards and Measuring Electrical Signals in Axons: Student Laboratory Exercises. J. Vis. Exp. (47), e2325 (2011).
- Schneider, H., Budhiraja, P., Walter, I., Beltz, B. S., Peckol, E., Kravitz, E. A. Developmental expression of the octopamine phenotype in lobsters. J. Comp. Neurol. 371, 3-14 (1996).
- Skou, J. C. The influence of some cations on an adenosine triphosphatase from peripheral nerves. Biochim. Biophys. Acta. 1000, 439-446 (1989).
- Skou, J. C. The identification of the sodium-pump as the membrane-bound Na+/K+-ATPase: a commentary on 'The Influence of Some Cations on an Adenosine Triphosphatase from Peripheral Nerves. Biochim. Biophys. Acta. 1000, 435-438 (1989).
- Skou, J. C. Enzymatic basis for active transport of Na+ and K+ across cell membrane. Physiol. Rev. 45, 596-617 (1965).
- Skou, J. C. Nobel Lecture. The identification of the sodium pump.. Biosci Rep. 18, 155-169 (1998).
- Sneddon, L. U., Taylor, A. C., Huntingford, F. A., Watson, D. G. Agonistic behavior and biogenic amines in shore crabs Carcinus maenas. J. Exp. Biol. 203, 537-545 (2000).
- Sohn, J., Mykles, D. L., Cooper, R. L. The anatomical, physiological and biochemical characterization of muscles associated with the articulating membrane in the dorsal surface of the crayfish abdomen. J. Exp. Zool. 287, 353-377 (2000).
- Southard, R. C., Haggard, J., Crider, M. E., Whiteheart, S. W., Cooper, R. L. Influence of serotonin on the kinetics of vesicular release. Brain Res. 871, 16-28 (2000).
- Stefani, E., Steinbach, A. B. Resting potential and electrical properties of frog slow muscle fibers. Effect of different external solutions. J. Physiol. 203, 383-401 (1969).
- Strawn, J. R., Neckameyer, W. S., Cooper, R. L. The effects of 5-HT on sensory neurons, CNS command, and neuromuscular junctions of the crayfish abdominal superficial flexor. Comp. Biochem. Physiol B. 127, 533-550 (2000).
- Takeuchi, A., Takeuchi, N. Anion permeability of the inhibitory post-synaptic membrane of the crayfish neuromuscular junction. J. Physiol. (London). 191, 575-590 (1967).
- Tsunoyama, T., Gojobori, S. Evolution of Nicotinic Acetylcholine receptor Subunits. Mol. Biol. Evol. 15 (5), 518-527 (1998).
- Van Harreveld, A., Mendelson, M. Glutamate-induced contractions in crustacean muscle. J. Cell Comp. Physiol. 54, 85-94 (1959).
- Van Harreveld, A. A physiological solution for freshwater crustaceans. Proc. Soc Exp. Biol. Med. 34, 428-432 (1936).
- Van Harreveld, A., Wiersma, C. A. G. The Triple Innervation of the Crayfish Muscle. Proc. Natl. Acad. Sci. USA. 22 (11), 667 (1936).
- Vélez, S. J., Wayman, R. J. Synaptic connectivity in a crayfish neuromuscular system. I. Gradient of innervations and synaptic strength. J. Neurophysiol. 41, 75-84 (1978).
- Watanabe, A., Grundfest, H. Impulse propagation at the septal and commissural junctions of crayfish lateral giant axons. J. Gen. Physiol. 45, 267-308 (1961).
- Watkins, J. C. L-Glutamate as a central neurotransmitter: Looking back. Biochemical Society Transactions. 28, 297-310 (2000).
- Wiersma, C. A. G., Waterman, T. H. The neuromuscular system. The Physiology of Crustacea. II, (1961).
- Wiersma, C. A. G. Reflexes and the central nervous system. The physiology of Crustacea. II, 241-279 (1961).
- Wine, J. J., Mittenthal, J. E., Kennedy, D. The structure of tonic flexor motoneurons in crayfish abdominal ganglia. J. Comp. Physiol. 93, 315-335 (1974).
- Wu, W. H., Cooper, R. L. Physiological Recordings of High and Low Output NMJs on the Crayfish Leg Extensor Muscle. J. Vis. Exp. (45), e2319 (2010).
- Wyttenbach, R. A., Johnson, B. R., Hoy, R. R. . Crawdad. A CD-ROM Lab manual for neurophysiology. , (1999).
- Zucker, R. S. Crayfish escape behavior and central synapses. 3. Electrical junctions and dendrite spikes in fast flexor motoneurons. J. Neurophysiol. 35, 638-651 (1972).
- Zucker, R. S. Crayfish escape behavior and central synapses. II. Physiological mechanisms underlying behavioral habituation. J. Neurophysiol. 35 (5), 621-637 (1972).
- Zucker, R. S. Crayfish escape behavior and central synapses. I. Neural circuit exciting lateral giant fiber. J. Neurophysiol. 35 (5), 599-620 (1972).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon