Method Article
Мембранные потенциалы, Synaptic Ответы, нейронной цепи, Нейромодуляция и мышцы гистологии Использование раков: Упражнения Студенческая лаборатория
В этой статье
Резюме
Эксперименты показывают, свободный доступ для студентов, чтобы приобрести опыт в изучении мышечной структуры, синаптических ответов, эффекты ионных градиентов и проницаемости на мембранных потенциалов. Кроме того, сенсорно-CNS-мотор-мышечной схема представлена, чтобы показать средствами для проверки эффектов соединений на нейронные цепи.
Аннотация
Цель настоящего доклада заключается в содействии развитию понимания эффектов, вызванных ионных градиентов через биологические мембраны. Два аспекта, которые влияют на мембранный потенциал клеток и которым мы обращаемся в этих экспериментах, являются: (1) концентрация ионов К + на внешней мембране, и (2) проницаемость мембраны для конкретных ионов. Раков мышцы живота разгибателей в группы причем некоторые из них тоник (медленно) и другие фазовые (быстро) в их биохимических и физиологических фенотипов, а также в их структуру; моторных нейронов, иннервирующих эти мышцы, соответственно, отличаются по функциональным характеристикам. Мы используем эти мышцы, а также поверхностных, тоник брюшные мышцы сгибателей, чтобы продемонстрировать свойства в синаптической передачи. Кроме того, мы вводим сенсорно-CNS-двигательный нейрон-мышечной схемы, чтобы продемонстрировать влияние кутикулярной сенсорной стимуляции, а также влияние нейромодуляторов по некоторым аспектам цепи. С методами, полученные в этой работе, можно начать отвечать на множество вопросов, остающихся в других экспериментальных препаратов, а также в физиологических приложений, связанных с медициной и здоровьем. Мы доказали полезность препаратов модель беспозвоночных для решения фундаментальных вопросов, имеющих отношение к всех животных.
протокол
1. Введение
Цели этих лабораторных занятий, чтобы понять свойства возбудимых мембран, ионный основе мембранный потенциал покоя, и методы для измерения мембранного потенциала. Кроме того, окрашивание и гистологии мышечной представлена, которые могут быть использованы для обучения мышечной структуры. Кроме того, два различных типа расчлененный препараты используются для демонстрации свойств синаптической передачи в различных группах мышц. Полный сенсорно-центральной нервной системы (ЦНС)-двигательный нейрон-мышечной замыкания в раков живота также используется для представления подготовки для изучения сенсорной стимуляции и влияние neromodulators и нейротрансмиттеров по аспектам цепи.
Первая часть этой докладе представлены подходы, используемые для измерения потенциала покоя мембраны и влиянием внеклеточных + K от мембранного потенциала. Мы также внедрим мышечной структуры. Во второй части этой работы мы представляем различные средства измерения синаптических ответов от различных видов нервно-мышечного соединения (NMJs). Первое упражнение использует раков брюшной мышцы разгибателей и второй использует брюшной поверхностных мышц сгибателей. Кроме того, мы представляем нейронные цепи (брюшной нервной цепочки из раков с сенсорными входами и выходами двигателя), который прост в обслуживании, и которые могут быть использованы для обучения, а также для исследований в различных аспектах сенсорно-ЦНС -двигательный нейрон-мышечной цепи. После завершения объяснения начального упражнения, мы представляем физиологию NMJs и ЦНС цепи.
Ионный градиент по всей биологической мембраны может привести к разности потенциалов. Для клетки в покое, это различие в электрический заряд через мембрану клетки, как известно, как мембранный потенциал покоя клетки. Есть два основных фактора, мы будем решать, что влияние мембранного потенциала клетки. Во-первых, концентрация ионов по обе стороны мембраны. Второй ионной проницаемости мембраны. Важно иметь в виду, что в живой клетке Есть ряд различных ионов с различной концентрацией внутри и вне клетки. Ключевые ионов мы будем решать являются натрий (Na +), калия (K +) и хлора (Cl-). Количество и движение этих ионов через мембраны мышц определяет мембранного потенциала. Из этого основания, мы можем обратиться электрических потенциалов наблюдается во время электрического возбуждения и торможения мембрану из синаптических ответов и изучение влияния фармакологических агентов. Мы также можем построить биофизических моделей для представления этих процессов экспериментальные концепции теста (Robinson и соавт., 2010).
Использование стеклянных капиллярных микроэлектродов разрешения записи мембранных потенциалов. Электрода может быть вставлена через клеточную мембрану без повреждений, обеспечивая наконечник достаточно мал и точной мерой трансмембранного потенциала могут быть получены. Метод особенно применимо к большой клетки, которые имеют меньше шансов быть повреждены вставки внутриклеточного электрода. Это один из важнейших методов в физиологии.
Баланс Na + и K + через мембрану поддерживается Na-K АТФ-азы насоса в физиологических условиях. При нормальных условиях насоса движется, в среднем, три Na + из клетки и два K + в клетку. В качестве побочного сведению, Нобелевская премия по химии была присуждена в 1997 году за это открытие сделал еще в конце 1950-х. Основы открытия были получены из исследований с помощью аксонов из краба (Skou, 1965, 1998).
Этот насос также считается электрогенных как он обладает большей способностью к насоса, когда мембрана деполяризованной (Skou, 1989а, б). Во многих клетках, ускоряет насоса, когда клетка электрически активируется деполяризации.
Калий также можете переместить через калия "утечка" каналов в то время как ячейка находится в состоянии покоя. Из-за этих калиевых каналов утечки, клеточные мембраны в состоянии покоя составляет более проницаема для калия, чем для других ионов. Таким образом, потенциал покоя мембраны ячейки ближе к равновесным потенциалом для калия, чем натрия. Мембранный потенциал покоя могут быть рассмотрены с целью увидеть, если она зависит от калия потенциал равновесия.
1) Мышцы изменчивости
Волокна ракообразных мышц проявлять большую изменчивость структурных особенностей, электрические свойства мембран и сократительные свойства, чем у позвоночных мышечных волокон. Фазовые мышечных волокон у ракообразных модифицируются для дергаться типа сокращений. Для них характерны короткие длины саркомера (2-4 мкм), тонкие, прямые Z-линий, низкое соотношение тонкой на толстую myofilaments, и хорошо развитой системой T-трубочек и саркоплазматическогоретикулума. Фазовые мембраны мышечных волокон может генерировать градуированная или все или ничего потенциалов действия. Тоник волокна мышц, с другой стороны, были изменены в течение длительного поддержания напряженности. Они часто имеют длины саркомера от 10 до 15 мкм, толстые, волнистые Z-линий, высокий коэффициент тонких к толстым myofilaments, и менее развитые системы Т-трубочек и саркоплазматического ретикулума. Тоник мембраны мышечных волокон, часто электрически inexcitable, или они могут производить градуированных электрических ответов ("градуированных шипы"). Широкий спектр промежуточных типов волокон находится в ракообразных мышц.
2) уравнения
Уравнения, которые обычно используются, чтобы определить равновесный потенциал ионов и мембранного потенциала покоя в уравнение Нернста и Гольдмана-Ходжкина-Катца (ГХК) уравнение соответственно. Важное различие между двумя уравнениями, что уравнение Нернста используется только для одного конкретного иона, чтобы определить равновесный потенциал для этого иона, а уравнение ГХК используется, чтобы определить потенциал покоя, рассматривая проницаемость нескольких ионов и их градиенты поперек клеточной мембраны (Нернст, 1888, 1889; Goldman, 1943; Ходжкин и Хаксли, 1952; Ходжкина и др., 1952;. Ходжкин и Кац, 1949; см. Хилле, 1992).
Уравнение Нернста как правило, считается для ионов через мембрану генерации электродвижущей силы, как правило отображен как:
V = (RT / ZF) п ([X] из / [X] в)
X = ион интерес
V = равновесия напряжения для X ион через мембрану
R = газовая постоянная [8,314 Дж / (моль • К)]
Т = абсолютная температура [Кельвин]
Z = валентность иона
F = Фарадея постоянная [9,649 х 10 4 C / моль]
Для ионов К + при 20 ° С и трансформации Ln войти 10 вместе с заполнения констант, приходим к:
Потенциальные = 58 журнала ([K в] / [K выход]), выраженный в мВ
Допустим, что только + К проникающий путем диффузии. [К в] является K + концентрация на внутренней части клетки и [K выход] является K + концентрация на внешней стороне клетки.
В качестве упражнения оценке [K в]. ______________
Предположим, для этого расчета, мембранный потенциал зависит только от K + равновесного потенциала.
Учитывая [K выход] = для солевых используется 5,4 мм. Предположим также, мембранный потенциал-70mV.
Потенциальные = 58 журнала ([K в] / 5,4).
В ходе эксперимента мы будем измерять потенциал покоя мембраны клетки и определить, как на него влияют изменения [K выход]. Наклон гипотетической линии, касающихся мембранного потенциала и [K выход] составляет 58. После сбора данных на мембранный потенциал покоя в разное [K выход] (в диапазоне от 5,4 мм до 100 мм), мы будем участка наблюдаемых значений, чтобы определить, есть ли матч с гипотетической линии. Мы будем использовать средний мембранный потенциал покоя, полученных при 5,4 мМ [K выход] для начала гипотетической и наблюдаемые линии для сравнения.
Учитывая, что мембрана может быть проницаема для более чем одного иона в состоянии покоя, а также на различных деполяризованного состояний, одно использует ГХК уравнение с учетом проницаемости (P в уравнении) для различных ионов. Уравнение ГХК будет свести к уравнению Нернста, если мембрана пропускает только один ион.
Вот обобщенные уравнения ГХК для Na +, K + и Cl - ионов: 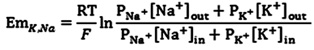
С Cl - имеет отрицательный заряд, концентрация термин инвертируется в этом уравнении для внутри и снаружи. Это позволяет Z (заряд ионов), которые будут прерваны.
3) Цель этого упражнения
В этом эксперименте мы будем измерять мембранный потенциал мышечных клеток рака и применять принципы, обсуждаемые выше по адресу:
- Как измерить потенциал клеточной мембраны с соответствующими приборами и техникой.
- Ионная проницаемость мембраны мышечных клеток и как она способствует мембранного потенциала.
Кроме того, мы сделаем предварительного изучения мышечной структуры: - Используйте для выделения пятен анатомию мышц в спинной части раков брюшной полости, которое используется для проведения этих электрофизиологических экспериментов.
- Изучите гистологию различных типов мышечных волокон.
В этой лаборатории упражнения, мы будем использовать раков брюшной мышцы разгибателей. Этот препарат был использован в прошлом, чтобы научить этих принципов в области физиологииг анатомии (Этвуд и Парнас, 1968). Мы использовали многие процедуры из этого источника и изменение других для размещения текущей приборов и завершить цели в одной 3-часовой период лаборатории студент. Эти упражнения являются основой для других экспериментов, используемые в ходе физиологии животных на кафедре биологии университета штата Кентукки (инструктор доктора Р. Л. Купер, 2010).
4) Почему эта модель животного
Есть несколько убедительных доводов в пользу раков брюшной мышцы разгибателей в этом эксперименте:
- Раки, как правило, доступны и относительно дешевы и просты в обслуживании в лабораторных условиях.
- Рассечение относительно легко для студентов, обучение методам вскрытия для живых препаратов.
- Мышцы стабилен в течение нескольких часов в минимальном физиологическом растворе, который служит также для студентов, изучающих электрофизиологических методов. Мышечного препарата является достаточно надежным, когда внешние [K +] изменяется в течение коротких периодов времени.
- Различные синаптические ответы могут быть легко получены путем стимуляции моторных нейронов.
- Анатомического расположения разгибателей легко различить, и из-за их больших размеров он сравнительно легко получить стабильный внутриклеточный записей.
- Мышцы и иннервации картину можно наблюдать легко метиленовым синим окрашиванием. Кроме того, определенные типы мышечных волокон могут быть легко обработан для гистологии наблюдать саркомера структуры.
- Ни одно животное протоколы необходимы в это время для подготовки беспозвоночных животных в лабораторных экспериментов во многих учреждениях в пределах США.
2. Методы
1) Материалы
- Ножницы (1)
- Пинцет (1)
- Серебряный Провод для заземления (1)
- Микроскоп (1)
- Электроды зонда (1)
- Чашки Петри с Sylgard на дне (1)
- Солевой раствор (1)
- Калий решения: 5,4 мм (физиологический раствор), 10, 20, 40, 80, 100 мм
- Bleach (небольшое количество, использование для кончик серебряной проволоки построить Ag-Cl)
- Стеклянную пипетку (1), удалить и добавить решений
- Шприц (1)
- Усилитель / Система сбора (1)
- Клетка Фарадея (1)
- Desktop / Laptop (1)
- Препарирование контактов (4)
- Рак
2) методы
2.1) Подготовка / Препарирование:
- Раков примерно 6-10 см, длина тела должна быть получена (или управляемого размера). Держите рак в задней части головы или около сантиметра от задней части глаза. Убедитесь, что когти раков или его уст не могут прийти к индивидуальной обработки раков. (Раки могут быть помещены в колотый лед в течение 5 минут, чтобы обезболить его до отрезать голову.)
- Используйте большие ножницы, чтобы быстро удалить голову. Сделать чистым и быстрым, вырезанные из за глаза раков. Утилизировать голову и придатков.

Рисунок 1. На рисунке показано размещение разреза для удаления главы раков. - Ноги и когти раков можно снять в этом месте, чтобы избежать травм. Стилеты на мужчин и swimmerets на мужчин и женщин также может быть удален (рис. 2). Далее, отдельные живота от грудной клетки. Сделать разрез вдоль формулирование мембрану, которая присоединяется к брюшной полости и грудной клетки (рис. 3). Сохранить живота часть раков и распоряжаться грудной клетки.

Рисунок 2. Ножниц резки стилеты. Они могут быть удалены из раков.
Рисунок 3. На рисунке показано размещение вырезать, чтобы удалить грудную клетку от брюшной полости.
Рисунок 4. Удаление грудной клетки от брюшной полости. Сокращения должны быть сделаны по кругу вдоль линии в соединении сегментов.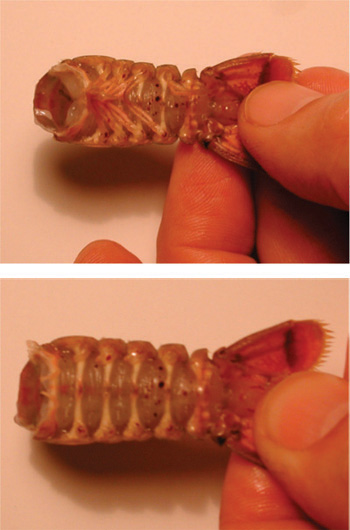
Рисунок 5. Верхнее изображение показывает живот swimmeret придатков. Нижнее изображение показывает брюшко без swimmeret придатков. - С живота, вырезать должны быть сделаны в оболочке вдоль нижней, боковой границе каждой стороне живота. Следует проявлять осторожность, чтобы не порезать слишком глубоко в раков. Чтобы помочь в процессе резки оболочки, сокращение должно быть сделано с ножницами указывая пренебрежительное вниз к брюшной стороне и под углом. Следуйте естественной модели оболочки линий раков, которые работают длина каждого сегмента (рис. 6).

Рисунок 6. Ножницы размещены под углом, и следовать естественному выравнивание оболочки. Не режьте слишком глубоко и уничтожить подготовки. Наконечники стрел указывают на естественную линию вдоль каждого сегмента, которым нужно следовать для сокращения. - Удалить брюшной части оболочки. Будьте осторожны, чтобы не разрушить мышцы живота. Используйте пинцет, чтобы удалить брюшной части. Когда брюшной части оболочки удаляется, белой массы ткани можно увидеть на вершине глубоких мышц сгибателей. Эта ткань может быть удалена осторожно щипцами.

Рисунок 7. Удаление брюшной части оболочки щипцами. Потяните вверх и назад на брюшной части удалить. Не разрушайте мышцы под вентральной оболочки.
Рисунок 8. Отходили на брюшной части снаряда, который должен быть отброшен.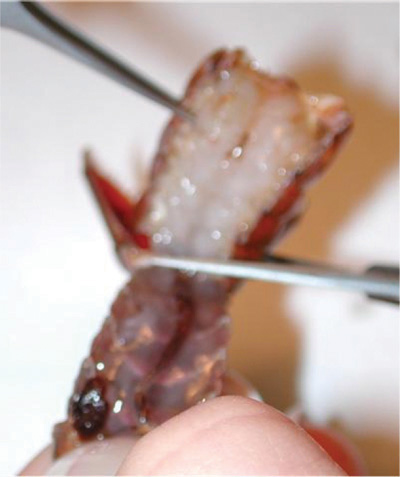
Рисунок 9. Cut брюшной части подготовки с помощью ножниц и выбросьте. - Желудочно-кишечный тракт, трубочку вдоль средней линии глубоких мышц сгибателей, могут быть удалены из раков. Pinch верхней части тракта с пинцетом и оторваться от живота. Отрежьте нижнюю часть пути - в конце хвоста. Промыть рассечение физиологическим раствором для обеспечения фекальных отходов не мешает подготовке.

Рисунок 10. Рисунке показано удаление из желудочно-кишечного тракта препарат. - Используйте рассечение контакты для обеспечения подготовки к чашке Петри. Верхние и нижние углы Препарат следует придавленный к блюду. Солевой раствор следует вылить в чашку Петри и охватывают подготовку полностью, пока внутриклеточных записей выполняется.
Это рассечение блюдо должно иметь Sylgard (Dow Corning) покрытие на нижней (1 см толщиной), так что насекомое выводы могут быть застрял в нем.
Расчлененный препараты купались в стандартном солевом раков, модифицированный из раствора Ван Harreveld (1936), который сделан с 205 NaCl; 5.3KCl; 13,5 CaCl 2, 2H 2 O; 2,45 MgCl 2; 6H 2 O, 5 HEPES и доводят до рН 7,4 (в мм).
2.2) внутриклеточной регистрации

Рисунок 11. В целом настройки записывающего оборудования.
- Чашка Петри с подготовкой должен быть помещен под микроскопом и закрепляется воска на дно тарелки, чтобы предотвратить движение.

Рисунок 12. Размещению препарат под микроскопом. Использование воска для обеспечения чашке Петри и подготовки. - Два провода каждой короткой серебряной проволокой к одному концу должна быть получена. Серебряной проволоки должна быть погружают в небольшое количество хлорной извести в течение приблизительно 20 минут для получения Ag-Cl покрытия. Вымойте провод с водой перед использованием. Стекла внутриклеточных пипетки должны быть получены и тщательно засыпана с длинной иглой, чтобы шприц с раствором KCl 3M. Пипетки должны быть повернуты вниз (с отверстием этаж) и заполнены раствором. Это будет гарантировать, что любой избыток KCl будет капать из задней части электрода. Будьте уверены, не KCl проходит вдоль стеклянной пипетки, который вступит солевые ванны. Включите пипетку вертикально по окончании заполнения раствором хлористого калия. Серебряной проволоки может быть помещена в пипетку. Другой конец соединен с + (положительный) полюс на сцене головы усилителя. Пипетки затем фиксируется на электрод зонда. Забота должна быть сделана, чтобы не сломать электрода. Третий провод прилагается к клетке Фарадея должны быть помещены в зеленый полюс голову стадии. Наконец провод Ag оставшихся привести должны быть помещены в ванну, а другой конец прикреплен к - (отрицательный) полюс показано ниже. Провод должен быть размещен из клетки Фарадея на землю часть АЦП Powerlab. Голова этап связан с "вход-зонд" на приобретение / усилитель (Powerlab).
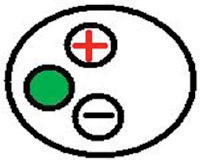
Рисунок 13. Конфигурации глава стадии. Провод подключен к зеленым входе головой этап основывается на усилитель или клетки Фарадея. Провод подключен к красным вход подключен к электродной проволоки. Черный вход используется для подключения к купания решение.
Рисунок 14. "Тест переключения" находится в нижней строке, чтобы тест электрода resistance.The "грубых" ручку также найденпод DC смещение, которое должно быть повернуто против часовой стрелки. Gain установлен на 50, который усиливает сигналы с коэффициентом пятьдесят. Заземляющий провод от головы этапе находится в "GND" открытие контактный разъем. - LabChart программное обеспечение должно быть открыт на настольном компьютере или ноутбуке. Настройте диаграмму, чтобы отобразить только один канал, нажав кнопку "Настройка", затем "Настройки канала". В разделе "Настройки канала", изменение количества каналов к одному. Нажмите "OK". В верхней части диаграммы, левом углу, циклов в секунду должна быть 2K. Установить вольт (у-оси) около 200 мВ до 500 мВ. Нажмите на "Канал 1" на правой части углу экрана. Нажмите кнопку "Вход усилителя". Убедитесь в том, Дифференциальные флажок.
Выходе усилителя должно быть в канале. Следующие параметры следует использовать с усилителем:- ВЧ-DC
- Notch Filter-OFF
- НЧ-20кГц
- Емкость Comp .- против часовой стрелки
- Постоянное смещение изобразительного и курс ручку против часовой стрелки-
- Постоянное смещение (+ OFF-) - OFF
- Усиление ручки-50
- Вход (DIFF MONO GND) - DIFF
- MODE (STIM-GATE-REC) - REC
- ΩTEST-OFF
- В качестве меры сопротивления электродов, напряжение должно быть разделено на ток, который составляет 2,0 нА (т.е. R = V / I, или закон Ома). Полученное значение сопротивления стеклянного электрода. Сопротивление должно быть от 20 до 60 MegaOhms. Нижний (<20) и высокой стойкостью (> 100) не принимаются. Как только сопротивление было определено, внутриклеточных записей может начаться. Место кончика стеклянного электрода в солевой ванне. Убедитесь, что провод заземления также находится в солевой ванне.
Чтобы начать запись, нажмите начать в нижней части экрана. Убедитесь, что усиление установлено до 5 В / дел. Используйте конечно ручку на усилителе, чтобы переместить линию на LabChart к нулю, прежде чем вставлять электрод. Ручка переключения должен быть включен и затем прочь несколько раз, чтобы проверить сопротивления электродов. Затем амплитуда результирующих значений должны быть измерены. Разместите один маркер на устойчивый базовой линии, а затем поместить второй на пике получить сопротивления электродов. - Использование зонда электрода и микроскоп, чтобы вставить электрод в продольные мышцы (DEM или Del1 или DEL2) препарата (см. рисунок 16). Электрод должен быть вставлен только в мышцу. Не проникает через мышцу. Использование микроскопа и зонд настройки для того, чтобы найти продольные мышцы и вставить электроды в мышцы. Высокая интенсивность подсветки должна быть скорректирована четко видеть мышцы электрод вставляется. Когда тыкать мышечных волокон в этом препарате можно часто столкнуться с пространствами и трещины в мышцах. Это причина, почему мембранного потенциала могут появиться, а затем исчезают, то появляются.

Рисунок 15. Введение электрода в мышцу. - Для измерения мембранного потенциала, использование грубых ручку на усилителе, чтобы переместить линию на LabChart до нуля перед установкой электрода. Пока мышечных волокон. Далее, измерения амплитуды результирующих значений. Место маркер на устойчивой базовой линии и записывать значения.
Разница в маркер и активный курсор отображается в правой части экрана. Значение дает напряжение. Записал напряжение, возможно, необходимо разделить на количество усиления используется на усилитель (т.е. 100x 10x или усиление). Напряжение должно быть преобразован из вольт милливольт (1 V = 1000 мВ), если значения, как сообщается на программное обеспечение, как вольт. - Осторожно использовать микроскоп и манипуляторы для удаления электрода от мышц. Пока другого мышечных волокон и обратите внимание на мембранный потенциал покоя. Надо занять несколько записей и быть удобным с мерами, а также направлять межклеточных электрода в мышечных волокон, представляющих интерес.
Электрода, вероятно, не будет оставаться на одном мышечных волокон во время изменения всех различных изменен [K +] решения из. Лучше всего, чтобы снять электрода, а затем измените решение, то проникнуть снова, чтобы не повредить мышцы. Лучше всего, чтобы получить 3 показаний в раствор из отдельных мышечных волокон и использовать средний, чтобы избежать ложных показаний. - Используйте шприц, чтобы удалить и уничтожить солевой раствор из чашки Петри. Чашке Петри должно быть заполнено следующий более высокая концентрация калия хлорид раствор солевой, охватывающих подготовку полностью. Тот же процесс должен быть повторен с каждым калия решения и изменения напряжения / потенциальных Следует отметить и зарегистрированы. Серия [K +] из раков солевые растворы, используемые нами: 5,4, 20, 40, 60, 80, 100 мм.
2.3) Анатомия
Теперь, когда физиология завершена, мы можем рассмотреть связанныеАнатомия мышечных волокон и иннервация узор. Передача подготовки к окрашиванию блюдо и добавить метиленовый синий (1 грамм метиленового голубого смешивают с 100 мл раков физиологический раствор). Пусть солевой купаться подготовки в течение 5 минут, а затем удалить и добавить свежих раков без солевых пятен. Анатомии этих мышц был подробно описан в течение года (Huxley, 1880; Пилигрим и Вирсма, 1963). Только в последнее время некоторые мышцы были описаны анатомически, физиологически и биохимически (Cooper и др., 1998;. Гриффис и др., 2000;. Sohn и др., 2000.).
Генеральный план анатомических мышц изображен на рисунке 16 (справа цифра для этой цели). Ищите главный нерв, который иннервирует главным образом мышцы в сегменте. Эскиз иннервации шаблон для SEM, DEL2, Del1 и DEM мышцы в сегменте. Живота должна быть растянуты полностью, закрепив препарата в блюдо твердо. Следующая удалить солевые и добавить фиксирующий раствор. Исправить решение решение Буэна (Подготовлено насыщенным пикриновой кислоты, формальдегида и уксусной кислоты; Sigma-Aldrich Co.)
ВНИМАНИЕ. Не поймите это решение на кожу или в глаза. Избегайте паров решение, работающих под вытяжкой. Если ваши глаза начинают гореть мыть глаза сразу на станции мыть глаза.
Давайте решение Буэна остаются на подготовку в течение приблизительно 10 минут, а затем использовать пипетку и обмен решение для физиологического раствора. Отрежьте тонкий кусок Del1 или DEL2 мышц, и место на стекле. Этикетка слайда. Повторите процедуру для мышц SEM. Посмотреть саркомера полосы картина в обоих тканевых препаратов. Вы можете использовать соединение микроскопа и корректировать цели соответственно, чтобы увидеть полосы узоров. По возможности принимать цифровое фото через окуляр микроскопа (примечание: некоторые камеры мобильного телефона хорошо работать для этой процедуры).
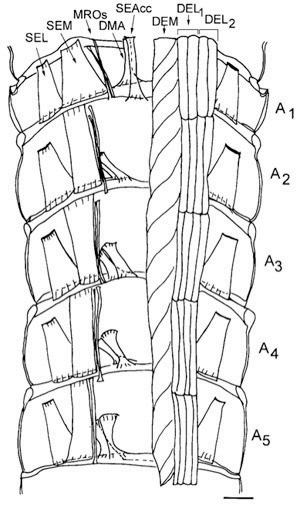
Рисунок 16. Схематическое изображение из брюшной стороны спинной части раков живота показывает разгибателей мускулатуры каждого сегмента. Спинные мышцы живота мембраны (DMA) и поверхностных мышц разгибателей головы аксессуар (SEAcc) происходят в сегменты с 1 по 5 из брюшной полости с различной ориентации для каждого сегмента. За исключением сегмента 1, эти мышцы имеют свои сайты вложений на их переднем конце, чтобы кальцинированная брюшка и на заднем конце в суставной мембраны. В сегменте 1, гомологичных мышцы имеют свои сайты передней привязанность к суставным мембрана расположена между грудной клетки и живота. Иллюстрация была основана на фотографических монтажей метиленового синего окрашенных препаратах. На левой части рисунка все глубоких мышц разгибателей были удалены, чтобы показать, спинной поверхностных мышц разгибателей. Масштаб = 2,35 мм. (Взято из Sohn и соавт. 2000).
3. Результаты
Следующие вопросы и обработки данных иллюстрируют основные принципы и цели этой лаборатории процедуры.
- Участок меры, полученные для отдыха потенциалов мембраны в каждой [K +] из использованы. Смотрите, если наблюдается и гипотетические линии сопоставляются в их наклон. Для построения значения используют полулогарифмической участок оси абсцисс различной [K +] в качестве журнала и у-оси мембранных потенциалов (как показано ниже, рисунок 17). (Скачать миллиметровой бумаги, если это необходимо http://incompetech.com/graphpaper/logarithmic/ )

Рисунок 17. Бумага для построения графиков
Используйте средний мембранный потенциал покоя, полученных при 5,4 мМ [K +] для начала из гипотетических и наблюдаемые линии для сравнения.
Если линии не совпадают обсудить, почему это могло бы быть. - Если вы изменили внешний уровень ионов Na +, вы бы ожидать того же типа, как изменения наблюдались изменения концентрации K +?
- Насколько хорошо метиленовым синим пятном мышцы по сравнению с нервами? Почему может ли быть различия? Является метиленового синего, используемых сегодня для идентификации ткани или контрастности в живых клетках человека? Какие отношения существуют с Зигмундом Фрейдом и пятен, используемых в рак?
- Обратите внимание на любые различия в саркомера моделей между DEL и SEM мышц. Если да, то какие могут быть причины? Все ли мышцы имеют те же расстояния саркомера отдыха? Нарисуйте мышц полосы узора наблюдается с микроскопом и этикетки, поскольку значительная часть фигуры, как это возможно (в связи с известными саркомера анатомию мышц).
4. Измерение Synaptic Responses
1) Введение
Брюшные мышцы разгибателей подготовки используется для демонстрации потенциала покоя мембраны также идеально подходит для демонстрации индукции синаптической ответы на NMJs из различных мышц. Некоторые мышцы у ракообразных выборочно иннервируются либо фазовый или тоником двигательных нейронов, хотя некоторые из одного волокна могут быть иннервируется как фазической и тонической возбуждающих двигательных нейронов, например, для разгибателей мышц раков ходильных ног (Этвуд, 2008, см. Юпитера Производство ID # 2319-У и Купер, 2010) и в большинстве других мышц конечностей (Вирсма, 1961а). По выборочно стимулирует фазической и тонической моторных нейронов, физиологические различия в ВПСП могут быть измерены. Фазовые моторные нейроны производят быстрые подергивания мышечных волокон и вызывают ВПСП порядка 10-40 мВ. Фазовый ответ могут угнетать быстро с 5-10-Гц поездов стимуляции. Тоник моторных нейронов приводит к меньшим ВПСП, что может быть облегчено при наличии высокой частоты (10-50 Гц) стимуляции. Структурно пресинаптических фазической и тонической терминалы в NMJs различны (Этвуд и Купер, 1996; Bradacs и др., 1997;.. Купер и др., 1998).
Удивительно фенотип фазовый физиологические реакции могут пройти преобразование тоник-подобного состояния электрически кондиционирования фазовый нейронов в течение нескольких часов в день в течение 7 дней (Купер и др., 1998;. Мерсье и Этвуд, 1989). Кроме того, чувствительность к нейромодуляции преобразованной NMJs прост для исследования регуляции экспрессии рецепторов (Гриффис и соавт., 2000).
В этом сравнительно надежной подготовки (раки мышцы живота), как тонизирующее и фазовый ответы легко записаны и проверены на содействие и / или депрессии синаптических ответов с различными парадигмами стимуляции. С помощью этих препаратов, студенты смогут признать общими из фазической и тонической синаптических ответов, стимулируя нерв расслоения.
Дополнительной подготовки NMJ представлены используется для мониторинга внутренней активности моторных и сенсорных стимулов индуцированной двигательной активности из центральной нервной системы. Это поверхностные мышцы сгибателей на брюшной стороне раки живота. Этот препарат также будет использоваться для наблюдения за сенсорно-CNS-мотор-мышечной цепи и последствия нейромодуляторов (Strawn и соавт., 2000).
В каждом из брюшной сегмент (кроме последней) Есть три функциональные группы мышц: (1), контролирующих плеопода (swimmerets) движение, (2) три разгибателей и (3) три мышцы сгибателей. Сгибателей и разгибателей являются антагонистические группы мышц, которые вызывают либо брюшной сгибания или расширения, вызывая вращение вокруг межсегментного петель. Фазовый мускулатура занимает большую часть объема живота, в то время как тонизирующий мышцы составляют тонкие листы волокон, которые охватывают спинной (разгибатели) и вентральной (сгибатели) аспект каждого сегмента брюшка.
В раков, тонизирующий мышцы живота сгибателей раков иннервируются в каждой половине сегмента на пять мотонейронов и периферической тормозных нейронов. Возбуждающие мотонейронов использовать глутамат в качестве нейротрансмиттера. Глутамат деполяризует мышечные волокна, вызывая увеличение проницаемости в первую очередь ионов натрия. Тормозящие нейроны релиз гамма-аминомасляной кислоты (ГАМК), которая обычно hyperpolarizes мышечные волокна, вызывая увеличение проницаемости для ионов хлора. В некоторых ракообразных мышц (в основном в конечностях), периферические тормозящие нейроны сделать синаптические контакты с моторным нейроном терминалов, а также с мышечными волокнами, а также уменьшить количество передатчиков выпущен двигательного нейрона (пресинаптического торможения) (Dudel и Kuffler, 1961 ). Это явление не присутствует в тонизирующий мышцы сгибателей раков.
Брюшной нервной раков является двусторонне симметричные структуры по всей длине животного. Существует одна ганглий в теле сегмента. В брюшной полости (6 сегментов), каждая из ганглий содержит несколько сотен нейронов, и каждый из двух связок состоит из нескольких тысяч аксонов. Тел нервных клеток образуют слой в несколько органов клетка толстый на вентральной стороне каждого ганглия. Непосредственно над слоем клеток организма является прекрасным сети из нейронов процессов, нейропиле. Все синаптических взаимодействий происходит здесь, клеточных тел лишены синапсов.
Каждый брюшной ганглий (кроме последней) имеет три корня на каждой стороне. Первый корень содержит аксоны нейронов, иннервирующих плеопода мускулатуры и сенсорных аксонов, второй корень содержит аксонов, иннервирующих фазической и тонической мускулатуры разгибателей и сенсорных аксонов, а третий корень, который оставляет нерв шнур нескольких миллиметров до хвостового ганглия, содержит аксоны innervating фазической и тонической мускулатуры сгибателей. Есть две ветви третий корень. Глубокая ветвь (IIIa) иннервирует только фазовый мышц сгибателей. Поверхностные ветви третий корень (IIIb) в каждую половину сегмента содержит шесть аксоны, которые иннервируют мышцы сгибателей тоником.
Нейронов, иннервирующих тоник сгибателей спонтанно активными, в отличие от фазовой эфферентных нейронов, а в хорошую подготовку, они будут продолжать стрелять в течение многих часов после брюшной полости был удален из животных. Для обзора исторический характер открытия, сделанные в этих брюшной подготовку видеть Этвуд (2008). Клеточных тел четырех моторных нейронов и периферических тормозных нейронов, иннервирующих мышцы сгибателей тоником все наполовину в сегменте находятся в ганглии этого сегмента. Тела клетки из оставшихся двигательных нейронов находится в следующем хвостового ганглия. Эти нейроны можно было бы достоверно отличить друг от друга на основе записанных extracelluarly шип амплитуд. Если тоник мышц сгибателей из одной половины сегмента, удаляется вместе с двумя ганглиев содержащих нейронов, иннервирующих эти мышцы, пять нейроны обычно показывают какой-то степени спонтанной активности. Эти нейроны пронумерованы на основе относительной амплитуды внеклеточной шип, в порядке возрастания. F1 до F4 являются мотонейроны и f5, крупнейший спонтанно активных нейронов, является ингибитором периферической сгибателей. f6, крупнейший двигательных нейронов, является возбуждающим нейрона двигатель, который редко спонтанно активны.
Спонтанный характер тонической активности двигательных нейронов можно модулировать экзогенными применения соединений или путем предоставления сенсорные стимулы для кутикулы в пределах одного сегмента, который находится под контролем за деятельностью двигательного нерва.
2) Препарирование
Для получения брюшной подготовки разгибателей же процедуру, как описано выше, для изучения потенциала покоя мембраны по отношению к внеклеточным калием. Разница в том, чтобы заботиться о сегментарный нервный пучок, который проходит вдоль стороне панциря. Этот нерв будет втянут в всасывания электрод, который будет служить стимулирующим электродом. Стимулировать с частотой 1 Гц для мониторинга фазовый ответов. Стимулировать короткими очередями импульсов 10 Гц от 10 до 20 стимулов в процессе мониторинга тоник ответов.
Экспериментальных процедур по уходу эксперименты на раков мышц сгибателей тоник разные, и нужно оставить брюшной нервной нетронутыми. Препарат, состоящий из нескольких сегментов брюшка сделана. Это достигается следующим образом:
- Раков примерно 6-10 см, длина тела должна быть получена (или управляемого размера). Получить раков, удерживая ее от задней части головы или примерно 2 или 3 см от задней части глаза. Убедитесь, что когти раков или рот не могут прийти к экспериментатору при работе раков. Утилизировать голову и придатков после их удаления.
- Используйте ножницы, чтобы быстро удалить голову. Сделать чистым и быстрым, вырезанные из за глаза раков.

Рисунок 18. На рисунке показано размещение разреза для удаления главы раков.
Ноги и когти раков можно снять в этом месте, чтобы избежать травм. Стилеты на мужчин и swimmerets на мужчин и женщин также может быть удален (рис. 19 и 20). Далее, отдельные живота от грудной клетки. Сделать разрез вдоль формулирование мембрану, которая присоединяется к брюшной полости и грудной клетки (рис. 20). - Сохранить живота часть раков и распоряжаться грудной клетки.

Рисунок 19. На рисунке показано размещение стилеты, которые могут быть удалены из раков.
Рисунок 20. На рисунке показано размещение вырезать, чтобы удалить грудную клетку от брюшной полости.
Рисунок 21. Удаление грудной клетки от брюшной полости. Сокращения должны быть сделаны по кругу вдоль линии соединения сегментов.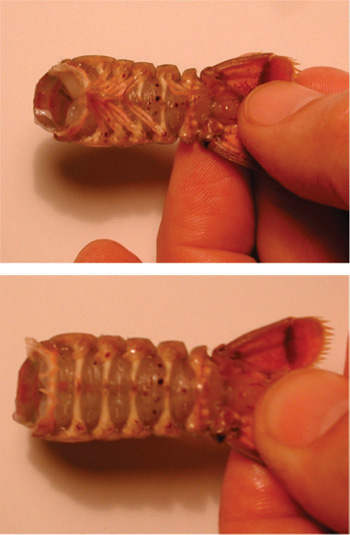
Рисунок 22. Верхнее изображение показывает живота с придатками. Нижнее изображение показывает удаление брюшной придатков. - Место изолированных подготовки хвост в солевой раствор в большой чашке Петри. Pin вниз хвост и верхнюю часть подготовки к блюду. Убедитесь, что препарат является безопасным. Используйте скальпель для удаления квадратных часть брюшной стороне подготовки между ребрами.
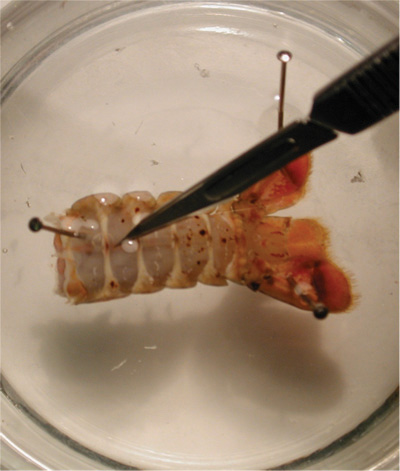
Рисунок 23.Показывает, где сокращение должно быть сделано, чтобы удалить вентральной зелье подготовки. - Небольшой разрез должно быть сделано (можно сделать и с помощью ножниц). Лоскут должен быть сокращены и поднял вверх. Клапан может быть удалена с помощью ножниц, выставляя глубоких мышц сгибателей. Микроскоп должен использоваться во время этого процесса, чтобы обеспечить точность в удалении брюшной части подготовки.
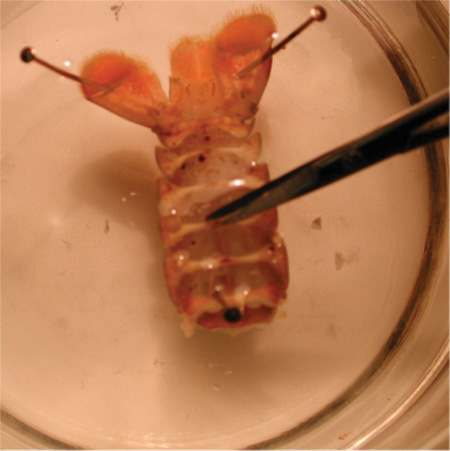
Рисунок 24. Резка препарат с ножницами, чтобы подвергать мышцы.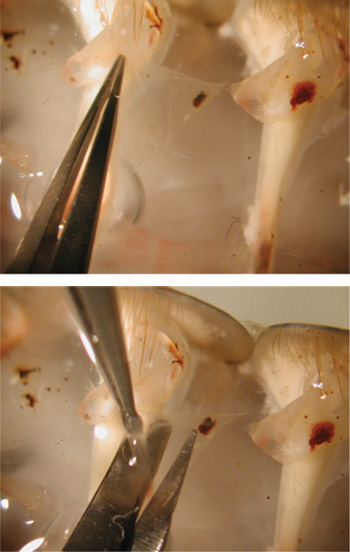
Рисунок 25. Верхнее изображение показывает, схватив лоскута щипцами. Нижнее изображение показывает удаление лоскут от подготовки использованием микроскопа.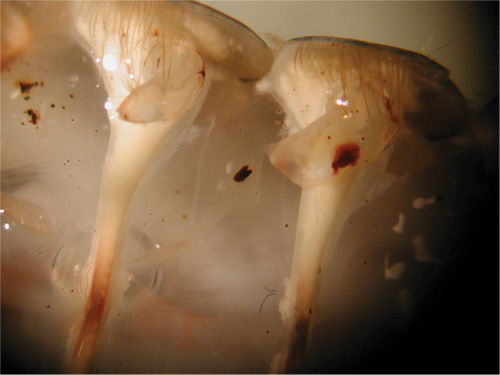
Рисунок 26. Воздействие на поверхностные мышцы сгибателей.
3) внутриклеточной регистрации:

Рисунок 27. В целом настройки записывающего оборудования.
- Чашка Петри с подготовкой должен быть помещен под микроскопом и закрепляется воска на дно тарелки, чтобы предотвратить движение.

Рисунок 28. Показывает размещение препарат под микроскопом. Использование воска для обеспечения чашке Петри и подготовки. - Два провода с короткой серебряной проволокой к одному концу должна быть получена. Серебряной проволоки должна быть погружают в небольшое количество хлорной извести в течение приблизительно 20 минут для получения Ag-Cl покрытия. Вымойте провод с водой перед использованием. Стекла внутриклеточных пипетки должны быть получены и тщательно заполненный KCl (3 м) решение. Пипетки должны быть повернуты вниз (с отверстием этаж) и заполнены раствором. Последний будет обеспечивать, чтобы любое избыточное KCl будет капать из задней части электрода. Будьте уверены, не KCl проходит вдоль стеклянной пипетки, который вступит в солевой ванне. Включите пипетку вертикально по окончании заполнения раствором хлористого калия. Серебряной проволоки может быть помещена в пипетку. Другой конец соединен с + (положительный) полюс на голове сцены. Пипетки затем фиксируется на электрод зонда. Забота должна быть сделана, чтобы не сломать электрода пипетки. Третий провод прилагается к клетке Фарадея должны быть помещены в зеленый полюс голову стадии. Наконец провод Ag оставшихся привести должны быть помещены в ванну, а другой конец прикреплен к - (отрицательный) полюс показано ниже. Провод должен быть размещен из клетки Фарадея на землю часть АЦП Powerlab. Голова этап связан с "вход-зонд" на приобретение / усилитель (Powerlab).
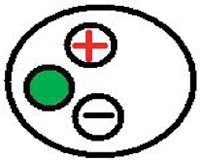
Рисунок 29. Конфигурации глава стадии. Провод подключен к зеленой части головы этап основывается на усилитель или клетки Фарадея. Провод подключен к красной части подключен к электродной проволоки. Черная часть используется для подключения к купания решение.
Рисунок 30. "Тест переключения" находится в нижнем ряду для тестирования сопротивления электродов. "Грубый" ручки также находится под DC смещение, которое должно быть повернуто против часовой стрелки. Gain установлен на 50, который усиливает сигналы с коэффициентом пятьдесят. Заземляющий провод от головы этапе находится в "GND" открытие контактный разъем. - LabChart программное обеспечение должно быть открыт на настольном компьютере или ноутбуке. Настройте диаграмму, чтобы отобразить только один канал, нажав на кнопку "Настройка", затем "Настройки канала". В разделе "Настройки канала", изменение количества каналов к одному. Нажмите "OK". В верхней части диаграммы, левом углу, циклов в секунду должна быть 2K. Установить вольт (у-оси) около 200 мВ до 500 мВ. Нажмите на "Канал 1" на правой части углу экрана. Нажмите кнопку "Вход усилителя". Убедитесь в том, Дифференциальные флажок.
Выходе усилителя должно быть в канале. Следующие параметры следует использовать с усилителем:- ВЧ-DC
- Notch Filter-OFF
- НЧ-20кГц
- Емкость Comp .- против часовой стрелки
- Постоянное смещение изобразительного и курс ручку против часовой стрелки-
- Постоянное смещение (+ OFF-) - OFF
- Усиление ручки-50
- Вход (DIFF MONO GND) - DIFF
- MODE (STIM-GATE-REC) - REC
- ΩTEST-OFF
- Для измерения сопротивления электродов, напряжение должно быть разделено на ток, который составляет 2,0 нА. Полученное значение сопротивления стеклянного электрода. Сопротивление должно быть от 20 до 60 MegaOhms. Как только сопротивление было определено, внутриклеточных записей может начаться. Место кончика стеклянного электрода в солевой ванне. Убедитесь, что провод заземления также находится в солевой ванне.
Чтобы начать запись, нажмите кнопку "Пуск" в нижней части экрана. Убедитесь, что усиление установлено до 5 В / дел. Используйте конечно ручку на усилителе, чтобы переместить линию на LabChart к нулю, прежде чем вставлять электрод. Ручка переключения должен быть включен и затем прочь несколько раз, чтобы проверить сопротивления электродов. Затем амплитуда результирующих значений должны быть измерены. Разместите один производитель устойчивый базовой линии, а затем поместить второй на пике получить сопротивления электродов. - Использование зонда электрода и микроскоп, чтобы вставить электрод в мышцах. Не проникает через мышцу. Использование микроскопа и зонд настройки для того, чтобы найти тонкий слой мышечной ткани и вставить электроды в волокнах. Высокая интенсивность подсветки может быть использован в качестве источника света во время проникновения в мышцы.
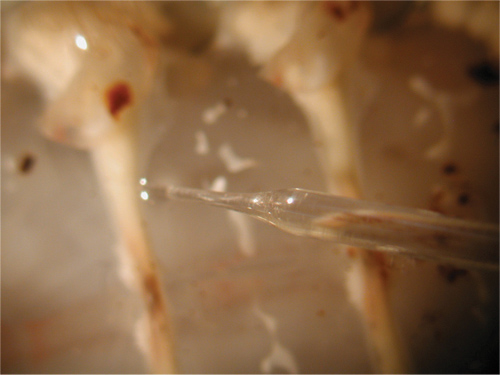
Рисунок 31. Введение электрода в мышцу. - Необходимо соблюдать осторожность, чтобы не повредить нервные корешки, чтобы поверхностные мышцы.
Желательно, чтобы сохранить солевой купания подготовки прохладной (10-15 градусов по Цельсию) и хорошо кислородом при проведении экспериментальных процедур. Если охлаждения не доступны заменить солевой со свежих, охлажденных засоленных регулярно. Кислород, или по крайней мере воздуха, должна, пропускается через солевой раствор. - Запись спонтанной активности ВПСП. Обратите внимание на разные размеры ВПСП и если IPSPs присутствуют.
- Очень осторожно взять небольшой куст краски и вручную стимулировать вдоль края кутикулы в том же сегменте, что одна является мониторинг спонтанной активности. Обратите внимание, изменение частоты ответов и если отличается ВПСП размер показаться, что там не было до стимулирующего кутикулы.
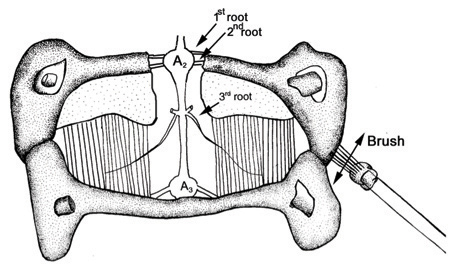
Рисунок 32. Подготовка со стимулирующим кисть и нервных корешков. (С изменениями от Strawn и соавт., 2000) - Стимуляция может быть повторен после тщательного обмена солевые ванны с одним содержащие нейромодулятора, таких как серотонин (1 мкМ) или физиологический раствор пропускается с CO 2. Обратите внимание на влияние на профиль деятельности для данного стимула. Также обратите внимание, если обмен засоленные обратно на свежий солевой возвращает деятельности в исходное состояние.
- Далее, можно проводить мониторинг нейронной активности в сенсорно-ЦНС-Мотор цепь нейронов в различных направлениях. Мы можем использовать всасывающий электрод вместо внутриклеточного электрода (рис. 33) для мониторинга активности двигательных нейронов. На кончике электрода всасывания стекло, пластиковые трубы помещается который имеет отверстие нужного размера тянуть нерва в наконечник. Отверстие не должно быть слишком большим, так как нерв будет выпадать, или слишком мало, потому что нервы были бы повреждены давления электрода. Пластиковые трубы натягивается пламени и поправили обратно необходимого размера.

Рисунок 33. Настройка с расположением всасывающего записи электрода.
Позиция микроманипулятора в положении, когда всасывающий электрод имеет легкий доступ к солевые ванны. Всасывающая до солевой пока он находится в контакте с серебряной проволокой внутри всасывающего электрода. Упорядочить другой провод на разрезе стороне всасывания электрода близко к кончику электрода, так как провода будут находиться в контакте с солевые ванны.
Что касается электрических мониторинг подключения AC / DC дифференциальный усилитель (усилитель) к 26Т Мощность Lab. Сделайте это путем подключения надлежащего питания от входа 1 на PowerLab 26Т с выходом на усилитель.- Управления усилителем инструмент должен быть установлен на следующие параметры:
- ВЧ-DC
- Notch Filter-OFF
- НЧ-20кГц
- Емкость Comp .- против часовой стрелки
- Постоянное смещение изобразительного и курс ручку против часовой стрелки-
- Постоянное смещение (+ OFF-) - OFF
- Усиление ручки-50
- Вход (DIFF MONO GND) - DIFF
- MODE (STIM-GATE-REC) - REC
- ΩTEST-OFF
Подключение электрических проводов от всасывающего электрода к голове сцены. Провода должны быть связаны с красного (положительного) в левом верхнем углу, зеленый (земля) в середине, черный (отрицательный внизу. Это показано на рисунке 34. Провод заземления можно просто положить в солевой ванне.
Рисунок 34. Глава этапе конфигурации - Управления усилителем инструмент должен быть установлен на следующие параметры:
- Теперь подключите USB шнур от 26Т PowerLab для ноутбука. Убедитесь, что оба усилителя и PowerLab26T подключены и включены перед открытием LabChart7 на компьютере.
- Открытое LabChart7.
- Добро пожаловать LabChart окне появится Центр открыт. Закройте ее.
- Нажмите на установки
- Нажмите на настройки канала. Изменение числа каналов до 1 (нижней левой части окна) нажмите OK.
- В верхней левой части графика набора циклов в секунду до примерно 2к. Установить вольт (у-оси) до примерно 500 или 200 мВ.
- Нажмите на канал 1 на правом графике. Нажмите на вход усилителя. Убедитесь, что настройки: несимметричный, по переменному току, и инвертировать (инвертирует сигнал, если это необходимо), и сглаживание, проверяются.
- Для начала начать запись прессы.
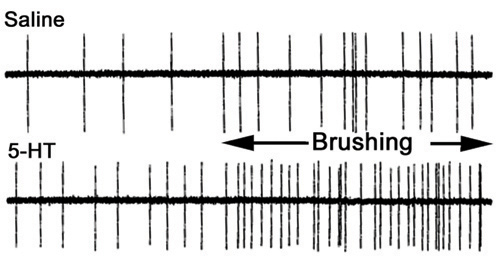
Рисунок 35. Деятельность 3-й корень до и во время стимуляции кутикулярной в солевом растворе (вверху) и в 100 нм 5-HT (внизу). Времени, в течение кутикулы стимуляции указывается бар. Обратите внимание на повышенную активность до и после стимуляции при подготовке купается в 5-HT (с изменениями от Strawn и соавт., 2000).
Мы можем записывать с 1-го или 2-й корни, делая записи мимоходом нерва, или мы можем разреза корень от VNC и записывать чистый сенсорной информации, связанных с периферией, которая будет посылать сигналы в VNC. Таким образом, вы бы запись из перерезанного корень, ведущих к периферии для сенсорных деятельности.
2-й корень содержит очень больших первичных афферентных аксонов от мышц рецепторов органов (MRO) и меньше эфферентные аксоны к разгибателей моторных нейронов (поля, и Кеннеди, 1965). Есть много сенсорных аксонов в 1-й и 2-й корни.
Mechanosensory нейроны имеют прямые связи, электрические синапсы с боковой аксоны гигантских (LG) (Красне 1969; Zucker, 1972). Кроме того, mechanosensory нейронов, как известно, возбуждают интернейронов посредством химических синапсов.
Чтобы изучить, как сенсорный вход может влиять на активность двигательных нейронов, через сенсорно-CNS-двигательный нейрон цепи, мы можем записать синаптических ответов в мышцах. Различные аспекты схемы мы будем использовать может быть рассмотрен. Например, мы можем записывать с сенсорных нервных корешков в одиночку или двигателя корень с или без нетронутыми сенсорный ввод в VNC Для анализа шип записи частоты, можно рассчитывать на определенный период времени в различных условиях. Меры могут быть сделаны до кисти стимуляции и при стимуляции кисти для определенного периода времени (рис. 35). Можно повторить условия в 5 раз и получить среднее изменение в процентах по частоте в качестве меры, чтобы сделать сравнение.
Можно также применять экзогенные соединения, такие как серотонин (Strawn и соавт., 2000) или ацетилхолин (Ach), никотина или глутамата. Различные поведенческие действия были описаны в никотине у беспозвоночных. Это предполагает наличие никотиновых рецепторов (Tsunoyama и Gojobori, 1998). Глутамат является основным возбуждающим нейромедиатором в большинстве беспозвоночных на NMJ и Ах является основным возбуждающих нейротрансмиттеров в ЦНС (Monoghan и др., 1989;. Уоткинс и др., 1990).
Можно попытаться гептанола или CO 2 пузырилась солевым, поскольку она будет разъединять раков перегородками (или разрыв) переходов в цепи, как доктор Соня М. Bierbower (Университет Кентукки) показал в своей диссертации исследований. Это действие может быть причиной изменены все поведение животных при воздействии высоких CO 2 в окружающей среде (Bierbower и Купер, 2010). Когда вы стимулируете кутикулу с помощью щетки и сенсорного ввода диска и записывать ответ в моторные нейроны, обратите внимание, есть ли разница в активности до и во время гептанола или CO 2 экспозиции. Это может или не может предложить щелевые контакты, чтобы играть роль в сенсорно-CNS-двигательный нейрон цепи.
Обсуждение
Мембранного потенциала
Еще в 1902 году, Бернштейн имел дело с вопросами потенциал покоя в аксона кальмара. Любопытно рассмотреть, как эти ранние идеи и наблюдения Берштейн (1902) и Нернст (1888) позже повлияли исследования в мембранном физиологии. (См. обзор Malmivuo и Plonsey, 1995; также доступны на WWW http://www.bem.fi/book/ ). Есть еще, по сей день, прорывы делаются о ионных каналов функции и свойства биологических мембран, которые очень важны для понимания клеточной физиологии, которая относится к функции тканей, органов и систем.
Сравнение экспериментальных и теоретически производный воздействия внешних [K +] на мембранный потенциал покоя указывает на влияние ионов на мембранный потенциал. Дополнительные эксперименты с помощью этого же препарата остаются должны быть выполнены для решения фундаментальных физиологических вопросов. Некоторые из них были выделены еще в 1968 году Этвуд и Парнас, и до сих пор не полностью решены. С методами, полученные в этом упражнении, можно исходить ответить на многие вопросы, остающиеся в других экспериментальных препаратов, а также в физиологических приложений, связанных с медициной и здоровьем. Мы доказали полезность подготовки модели беспозвоночных для решения фундаментальных вопросов, имеющих отношение к всех животных.
С знания, полученные на электрохимического градиента ионов в этом выше упражнения, вы можете заранее, чтобы возбудимость мембран, исследуя синаптической передачи в нервно-мышечных препаратов в раков.
Измерение Synaptic Ответы
Информацию, указанную в первой части этой лаборатории, и связанные кино, предоставили ключевые шаги для записи мембранных потенциалов и расследования мышечной структуры. Во второй части этой лаборатории, демонстрация рассечение и записи синаптической передачи в NMJs стадийного и тонизирующих двигательных единиц при условии воздействия фундаментальных концепций в физиологии. Воздействия нейронные цепи, которые могут частично могут быть использованы для объяснения связаны с поведением, в интактных животных есть потенциал не только для студентов, чтобы исследовать различные открытые вопросы в рамках своей лаборатории занятие, но и для будущих исследований на нейронных цепей в хорошо создана беспозвоночных подготовки (Кеннеди и др., 1969;. Antonsen и Эдвардс, 2003)
Эти препараты могут также быть использованы для исследования синаптических облегчение, депрессия и долгосрочных пластичности (не исследовались в этой лаборатории исследования). Даже в рамках некоторых видов рака, пластичность нейронов зависит от условий эксперимента стимуляции (Мерсье и Этвуд, 1989;. Cooper и др., 1998), а также их естественной среде. В какой степени способность изменять синаптической эффективности и мышечной динамики служит останки животных предстоит изучить. Поскольку раки изменяют свое поведение в зависимости от сезонных изменений и цикл линьки, Есть относительно долгосрочной деятельности различия в их нервно-мышечной систем. Было показано, что фазовый двигательного нерва терминалы коготь ближе мышцы выставки классический фазовый морфологии в течение зимы, но набухают и становятся более варикозное по длине терминала в течение летних месяцев (Lnenicka 1993 года; Lnenicka и Чжао, 1991).
Некоторые ранние исследования, проведенные в боковой гигантских раков (LG) интернейронов в брюшной нервной показали наличие щелевые контакты (Johnson, 1924; Ватанабе и Грундфест, 1961). Хорошо известно, что CO 2 влияет на электрической связи на разобщение щелевые контакты (Ареллано и др., 1990). Недавно было показано, что нервная и коммуникации в рамках сенсорно-CNS-мотор-мышечной цепи, как это описано в настоящем докладе, также чувствителен к CO 2 экспозиции, указывающие на наличие разрыва соединения (Bierbower, 2010; Bierbower и Купер, 2010)
Спонтанной активности 3-й корень мотор был темой, поскольку 1960-х годов, когда Эккерт (1961) рассматривается, если тоник стрельбы статический орган рецепторов мышц (MRO) в пределах одного или соседних сегментов может объяснить спонтанное двигателя. В этих ранних исследований стало очевидным, что деятельность был обусловлен в брюшной нервной цепочки (VNC), возможно, из высших центров (Эккерт, 1961; Кеннеди и Такэда, 1965а, б;. Strawn и др., 2000). Так как наличие CO 2 остановился спонтанной активности, можно предположить, где-то в привод для моторных нейронов могут быть щелевые контакты или глутаматергической возбуждающие диска. NMJs блокируются или выставлять снижением чувствительности к глутамата в присутствии СО 2, и они могут быть блоккед, а в ЦНС (Bierbower, 2010; Bierbower и Купер, 2010; см. также Бэйдр и др., 2005.).
Действия различных нейромодуляторов также легко учился в различных типах NMJs (Cooper и Cooper, 2009; Гриффис и др., 2000;. Саутард и др., 2000;.. Strawn и др., 2000). Кроме того, различные воздействий оказываемое нейромодуляторов на схему ЦНС. Было высказано предположение, что 5-НТ и octopaminergic нейронов может функционировать как «выигрыш-сеттеры" на изменение выходной нейронных цепей (Ма и др., 1992;. Шнейдер и др., 1996;. Хернер и др., 1997;. Эдвардс и соавт., 2002). Многое еще предстоит сделать, прежде чем мы сможем полностью понять последствия нейромодуляторов на отдельные клетки-мишени. Учитывая, что различные нейромодуляторов может работать в согласии друг с другом, анализ их смешанное действие района для будущих исследований (Djokaj и соавт., 2001). Кроме того, несколько исследований, в частности, позвоночных, преодоления последствий нейромодуляторов на целые пути, которые могут регулировать определенное поведение. В этом сенсорно-CNS-блок двигателя подготовки можно исследовать влияние и сенсорный ввод и нейромодуляторов от активности моторных нейронов (Kennedy и соавт., 1969).
Поскольку было предположение, что 5-HT играет роль в регуляции поведенческих состояния раков, омаров и крабов (Livingstone и др., 1980;.. Снеддон и др., 2000), несколько попыток было сделано, чтобы определить его концентрацию в VNC, гемолимфы, а в отдельных ганглиев омары (Livingstone и др., 1980;. Харрис-Уоррик и Kravitz 1984;. Fadool и др., 1988). Тем не менее, наблюдается значительная разница в записанных измерений, исключающие конкретные доза-реакция которые могли бы объяснить поведенческие действия.
Раки с когтями состоялась в поднятом положении и с хвостом подложив под ее живот, как считалось, выставки доминируют позы (Livingstone и соавт., 1980). Состояние брюшной сгибания в раков, кажется, не будет поза, что доминирующей раки, в паре, демонстрируют во время социальных взаимодействий, или при сохранении доминирующей иерархического статуса (Листерман и соавт., 2000). Смиренный раков даже складки животы под себя, как они отступают от противника. Такие заправляя хвост также рассматривается как оборонная политика (Листерман и соавт., 2000). Такие действия были легко наблюдается в области, и в лабораторных условиях (Bovbjerg, 1953, 1956; Бруски и Данхэм, 1987; Li и др., 2000;.. Листерман и др., 2000). Интересно, что поведенческие позы отмечается в омары (Livingstone и соавт., 1980) поменялись местами для 5-НТ и октопамин инъекций в австралийских речных раков, Cherax деструктор (McRae, 1996). Возможно, совершенно разные ответы можно было бы наблюдать в поверхностных сгибателей подготовку в австралийском раков. Кроме того, с доминированием, как правило, размер связанных между раков, то можно ожидать очень пластичный системы реагирования на быстро изменить социальные условия (Strawn и соавт., 2000). Пластичности в способности реагировать на нейромодуляторов у беспозвоночных является открытой площадке исследования.
Wyttenbach, Джонсон, и Хой (1999) дали цифрового мультимедиа и лаборатории руководства для различных экспериментов раков с участием тех же мышечных представленные в данном отчете в дополнение к другим подготовки раков. Это отличный ресурс для студентов упражнений.
Раскрытие информации
Благодарности
Поддержке Университета Кентукки, биологический факультет, Управление бакалавриата и колледж искусств и наук.
Материалы
- Раки (Procambarus clarkii). Атчафалайя Биологические питания Ко, Raceland, Лос-Анджелесе., США.
- Стандартный раков солевых: Модифицированная из раствора Ван Harreveld (1936). (В мм) 205 NaCl, 5,3 KCl; 13,5 CaCl 2 2H 2 O; 2,45 MgCl 2 6H 2 O, 5 HEPES и доводят до рН 7,4. Серотонин, глютамат и дофамин производятся в раков физиологического раствора. Фиксирующий раствор Буэна была использована непосредственно и метиленового синего выполнен в раков физиологического раствора. Все химические вещества получаются из Sigma Chemical Company (Сент-Луис, Миссури).
- Dissection инструменты: Fine # 5 пинцет, ножницы штраф, держатель ножа, # 26002-20 насекомых штифты (все полученные от изобразительных инструментов науки (США), Inc, 373-G Vintage Park Drive, Foster City, CA 94404-1139) .
- Sylgard дном стеклянную посуду
- Стаканы (провести химические растворы)
- Электрические сигналы, записанные на линии интерфейса PowerLab 26Т к компьютеру (ADInstruments, Колорадо Спрингс, Колорадо, США). Мы используем стандартное программное обеспечение от имени ADInstruments Диаграмма или область.
- Модель 3000 AC / DC усилитель для внутриклеточной, так и внеклеточной записи могут быть использованы.
- Пройдя через микроскоп с функцией масштабирования для внутриклеточных записей. Для записи на координационный визуализированы терминалы составной микроскоп с вертикальным целям (4 х и 20-кратный) не используется. Нужно Hg источника света.
- Для внутриклеточного записи мы используем стекло капиллярных трубок (каталог # 30-31-0 от FHC, Брауншвейг, ME, 04011, США). Внутриклеточный электрод должен иметь сопротивление от 20 до 30 мОм. Внутриклеточное электроды были заполнены 3 М KCl.
- Всасывающего электрода используется для записи внеклеточных сигналов.
- Клетки Фарадея.
- Высокая интенсивность осветитель (источник света).
- Микроманипулятор
Ссылки
- Antonsen, B. L., Edwards, D. H. Differential dye coupling reveals lateral giant escape circuit in crayfish. J. Comp. Neurol. 466, 1-13 (2003).
- Arellano, R. O., Rivera, A., Ramón, F. Protein phosphorylation and hydrogen ions modulate calcium-induced closure of gap junction channels. Biophys. J. 57, 363-367 (1990).
- Atwood, H. L. γ -aminobutyric acid and crab muscle fibres. Experientia (Basel). 20, 161-163 (1964).
- Atwood, H. L. Variation in physiological properties of crustacean motor synapses. Nature. 215, 57-58 (1967).
- Atwood, H. L. Peripheral inhibition in crustacean muscle. Experimentia. 24, 753-763 (1968).
- Atwood, H. L. An attempt to account for the diversity of crustacean muscles. Am. Zool. 13, 357-378 (1973).
- Atwood, H. L. Organization and synaptic physiology of crustacean neuromuscular systems. Prog. Neurobiol. 7, 291-391 (1976).
- Atwood, H. L., Sandeman, D. C., Atwood, H. L. Synapses and neurotransmitters. The Biology of Crustacea. 3, 105-150 (1982).
- Atwood, H. L. Parallel 'phasic' and 'tonic' motor systems in the crayfish abdomen. J. Exp. Biol. 211, 2193-2195 (2008).
- Atwood, H. L., Cooper, R. L. Functional and structural parallels in crustaceans and Drosophila neuromuscular systems. Am. Zool. 35 (6), 556-565 (1995).
- Atwood, H. L., Cooper, R. L. Assessing ultrastructure of crustacean and insect neuromuscular junctions. J. Neurosci. Meth. 69, 51-58 (1996).
- Atwood, H. L., Cooper, R. L. Synaptic diversity and differentiation: Crustacean neuromuscular junctions. Invertebrate Neurosci. 1, 291-307 (1996).
- Atwood, H. L., Parnas, I., Kerkut, G. A. . Recording from the crayfish abdominal extensor muscle preparation with microelectrodes. In: Experiments in physiology and biochemistry. , 307-330 (1968).
- Badre, N. H., Martin, M. E., Cooper, R. L. The physiological and behavioral effects of carbon dioxide on Drosophila larvae. Comparative Biochemistry and Physiology A. 140, 363-376 (2005).
- Bernstein, J. Untersuchungen zur Thermodynamik der bioelektrischen Ströme. Pflüger Arch. ges. Physiol. 9, 521-562 (1902).
- Bernstein, J. . Elektrobiologie. , 215 (1912).
- Bierbower, S. M. . Environmental effects on behavior and physiology in crayfish. , (2010).
- Bierbower, S. M., Cooper, R. L. The effects of acute carbon dioxide on behavior and physiology in Procambarus clarkii. J. Exp. Zool. , (2010).
- Boistel, J., Fatt, P. Membrane permeability change during inhibitory transmitter action in crustacean muscle. J. Physiol. (Lond.). 144, 176-191 (1958).
- Bovbjerg, R. V. Dominance order in the crayfish Orconectes 6irilis (Hagen). Physiol. Zool. 26, 173-178 (1953).
- Bovbjerg, R. V. Some factors affecting aggressive behavior in crayfish. Physiol. Zool. 29, 127-136 (1956).
- Bradacs, H., Cooper, R. L., Msghina, M., Atwood, H. L. Differential physiology and morphology of phasic and tonic motor axons in a crayfish limb extensor muscle. J. Exp. Biol. 200, 677-691 (1997).
- Bruski, C. A., Dunham, D. W. The importance of vision in agonistic communication of the crayfish Orconectes rusticus, I. an analysis of bout dynamics. Behaviour. 63, 83-107 (1987).
- Burke, W., Ginsborg, B. L. The electrical properties of the slow muscle fibre membrane. J. Physiol. 132, 586-598 (1956).
- Cooper, A. S., Cooper, R. L. Historical View and Physiology Demonstration at the NMJ of the Crayfish Opener Muscle. J. Vis. Exp. (33), e1595 (2009).
- Cooper, R. L., Warren, W. M., Ashby, H. E. Activity of phasic motor neurons partially transforms the neuronal and muscle phenotype to a tonic-like state. Muscle & Nerve. 21, 921-931 (1998).
- Djokaj, S., Cooper, R. L., Rathmayer, W. Effects of octopamine, serotonin, and cocktails of the two modulators on synaptic transmission at crustacean neuromuscular junctions. J. Comp. Physiol. A. 187 (2), 145-154 (2001).
- Dudel, J., Kuffler, S. W. Mechanism of facilitation at the crayfish neuromuscular junction. J. Physiol. (Lond.). 155, 540-542 (1961).
- Eckert, R. O. Reflex relationships of the abdominal stretch receptors of the crayfish. J. Cell. Comp. Physiol. 57, 149-162 (1961).
- Edwards, D. H., Yeh, S. R., Musolf, B. E., Antonsen, B. L., Krasne, F. B. Metamodulation of the crayfish escape circuit. Brain Behav Evol. 60 (6), 360-369 (2002).
- Fadool, D. A., Cobb, S. J., Kass-Simon, G., Brown, P. R. Liquid chromatographic procedures for the analysis of compounds in the serotonergic and octopamine pathways of lobster hemolymph. J. Chromatogr. 452, 491-501 (1988).
- Fatt, P., Katz, B. The electrical properties of crustacean muscle fibers. J. Physiol. 120, 171-204 (1953).
- Fields, H. L., Kennedy, D. Functional role of muscle receptor organs in crayfish. Nature. 206 (990), 1235-1237 (1965).
- Fisher, L., Florey, E. Modulation of synaptic transmission and excitation-contraction coupling in the opener muscle of the crayfish, Astacus leptodactylus, by 5-hydroxytryptamine and octopamine. J. Exp. Biol.. 102, 187-198 (1983).
- Freud, S. Über den Bau der Nervenfasern und Nervenzellen beim Flußkrebs. Anzeiger Akad. 18, 275 (1881).
- Freud, S. Über den Bau der Nervenfasern und Nervenzellen beim Flußkrebs. Sitzungsber. Akad. 85, 9-46 (1881).
- Goldman, D. E. Potential, impedance, and rectification in membranes. J. Gen. Physiol. 27, 37-60 (1943).
- Griffis, B., Bonner, P., Cooper, R. L. Sensitivity of transformed (phasic to tonic) motor neurons to the neuromodulator 5-HT. Comparative Biochemistry and Physiology A. 127, 495-504 (2000).
- Grundfest, H., Reuben, J. P., Florey, E. Neuromuscular synaptic activity in lobster. Nervous Inhibition. , 92-104 (1961).
- Harris-Warrick, R. M., Kravitz, E. A. Cellular mechanisms for modulation of posture by octopamine and serotonin in the lobster. J. Neurosci. 4, 1976-1993 (1984).
- Hagiwara, S., Chichibu, S., Naka, K. I. The effects of various ions on resting and spike potentials of barnacle muscle fibers. J. Gen. Physiol. 48, 163-179 (1964).
- Hille, B. . Ionic Channels of Excitable Membranes. , (1992).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. J. Physiol. (Lond.). 117, 500-544 (1952).
- Hodgkin, A. L., Huxley, A. F., Katz, B. Measurement of current-voltage relations in the membrane of the giant axon of Loligo. J. Physiol. (Lond.). 116, 424-448 (1952).
- Hodgkin, A. L., Katz, B. The effect of sodium ions on the electrical activity of the giant axon of the squid. J. Physiol. (Lond.). 108, 37-77 (1949).
- Hodgkin, A. L., Rushton, W. A. H. The electrical constants of a crustacean nerve fibre. Proc. Roy. Soc. 133, 444-479 (1946).
- Hörner, M., Weiger, W. A., Edwards, D. H., Kravitz, E. A. Excitation of identified serotonergic neurons by escape command neurons in lobsters. J. Exp. Biol. 200, 2017-2033 (1997).
- Huxley, T. H. . The crayfish. , (1880).
- Johnson, G. E. Giant nerve fibers in crustaceans with special reference to Cambaus and Palaemonetes. J. Comp. Neurol. 36, 323-373 (1924).
- Johnston, M. F., Simon, S. A., Ramon, F. Interaction of anaesthetics with electrical synapses. Nature (Lond.). 286, 498-500 (1980).
- Katz, B., Miledi, R. The role of calcium in neuromuscular facilitation. J. Physiol. (Lond.). 195, 481-492 (1968).
- Kennedy, D., Takeda, K. Reflex control of abdominal flexor muscles in the crayfish: the twitch system. J. Exp. Biol. 43, 211-227 (1965).
- Kennedy, D., Takeda, K. Reflex control of the abdominal flexor in the crayfish: the tonic system. J. Exp. Biol. 43, 229-246 (1965).
- Kennedy, D., Selverston, A. I., Remler, M. P. Analysis of restricted neural networks. Science. 164, 1488-1496 (1969).
- Krasne, F. B. Excitation and habituation of the crayfish escape reflex: the depolarizing response in lateral giant fibres of the isolated abdomen. J. Exp. Biol. 50, 29-46 (1969).
- Li, H., Listerman, L. R., Doshi, D., Cooper, R. L. Heart rate measures in blind cave crayfish during environmental disturbances and social interactions. Comp. Biochem. Physiol A. 127, 55-70 (2000).
- Listerman, L., Deskins, J., Bradacs, H., Cooper, R. L. Measures of heart rate during social interactions in crayfish and effects of 5-HT. Comp. Biochem. Physiol A. 125, 251-264 (2000).
- Livingstone, M. S., Harris-Warrick, R. M., Kravitz, E. A. Serotonin and octopamine produce opposite postures in lobsters. Science. 208, 76-79 (1980).
- Lnenicka, G. A. Seasonal differences in motor terminals. Comp. Biochem. Physiol A. 104, 423-429 (1993).
- Lnenicka, G. A., Zhao, Y. Seasonal differences in the physiology and morphology of crayfish motor terminals. J. Neurobiol. 22, 561-569 (1993).
- Ma, P. M., Beltz, B. S., Kravitz, E. A. Serotonin containing neurons in lobsters: their role as 'gainsetters' in postural control mechanisms. J. Neurophysiol. 68, 36-54 (1992).
- Malmivuo, J., Plonsey, R. . Bioelectromagnetism-Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- McRae, T. On the postural effects induced in female Cherax destructor (Clark) by serotonin and octopamine. Freshwater Crayfish. 11, 293-298 (1996).
- Mercier, A. J., Atwood, H. L. Long-term adaptation of a phasic extensor motoneurone in crayfish. J. Exp. Biol. 145, 9-22 (1989).
- Monaghan, D. T., Bridges, R. J., Cotman, C. W. The excitatory amino acid receptors: their classes, pharmacology, and distinct properties in the function of the central nervous system. Annu. Rev. Pharmacol. Toxicol. 29, 365-402 (1989).
- Moody, W. Gradual increase in the electrical excitability of crayfish slow muscle fibers produced by anoxia or uncouplers of oxidative phosphorylation. J. Comp. Physiol. 125, 327-334 (1978).
- Nernst, W. H. Zur Kinetik der Lösung befindlichen Körper: Theorie der Diffusion. Z. Phys. Chem. 3, 613-637 .
- Nernst, W. H. Die elektromotorische Wirksamkeit der Ionen. Z. Phys. Chem. 4, 129-181 .
- Pilgrim, R. L. C., Wiersma, C. A. G. Observations on the skeleton and somatic musculature of the abdomen and thorax of Procambarus clarkii (Girard), with notes on the thorax of Panulirus interruptus (Randall) and Astacus. J. Morphol. 113, 453-587 (1963).
- Robinson, M. M., Martin, J. M., Atwood, H. L., Cooper, R. L. Modeling Biological Membranes with Circuit Boards and Measuring Electrical Signals in Axons: Student Laboratory Exercises. J. Vis. Exp. (47), e2325 (2011).
- Schneider, H., Budhiraja, P., Walter, I., Beltz, B. S., Peckol, E., Kravitz, E. A. Developmental expression of the octopamine phenotype in lobsters. J. Comp. Neurol. 371, 3-14 (1996).
- Skou, J. C. The influence of some cations on an adenosine triphosphatase from peripheral nerves. Biochim. Biophys. Acta. 1000, 439-446 (1989).
- Skou, J. C. The identification of the sodium-pump as the membrane-bound Na+/K+-ATPase: a commentary on 'The Influence of Some Cations on an Adenosine Triphosphatase from Peripheral Nerves. Biochim. Biophys. Acta. 1000, 435-438 (1989).
- Skou, J. C. Enzymatic basis for active transport of Na+ and K+ across cell membrane. Physiol. Rev. 45, 596-617 (1965).
- Skou, J. C. Nobel Lecture. The identification of the sodium pump.. Biosci Rep. 18, 155-169 (1998).
- Sneddon, L. U., Taylor, A. C., Huntingford, F. A., Watson, D. G. Agonistic behavior and biogenic amines in shore crabs Carcinus maenas. J. Exp. Biol. 203, 537-545 (2000).
- Sohn, J., Mykles, D. L., Cooper, R. L. The anatomical, physiological and biochemical characterization of muscles associated with the articulating membrane in the dorsal surface of the crayfish abdomen. J. Exp. Zool. 287, 353-377 (2000).
- Southard, R. C., Haggard, J., Crider, M. E., Whiteheart, S. W., Cooper, R. L. Influence of serotonin on the kinetics of vesicular release. Brain Res. 871, 16-28 (2000).
- Stefani, E., Steinbach, A. B. Resting potential and electrical properties of frog slow muscle fibers. Effect of different external solutions. J. Physiol. 203, 383-401 (1969).
- Strawn, J. R., Neckameyer, W. S., Cooper, R. L. The effects of 5-HT on sensory neurons, CNS command, and neuromuscular junctions of the crayfish abdominal superficial flexor. Comp. Biochem. Physiol B. 127, 533-550 (2000).
- Takeuchi, A., Takeuchi, N. Anion permeability of the inhibitory post-synaptic membrane of the crayfish neuromuscular junction. J. Physiol. (London). 191, 575-590 (1967).
- Tsunoyama, T., Gojobori, S. Evolution of Nicotinic Acetylcholine receptor Subunits. Mol. Biol. Evol. 15 (5), 518-527 (1998).
- Van Harreveld, A., Mendelson, M. Glutamate-induced contractions in crustacean muscle. J. Cell Comp. Physiol. 54, 85-94 (1959).
- Van Harreveld, A. A physiological solution for freshwater crustaceans. Proc. Soc Exp. Biol. Med. 34, 428-432 (1936).
- Van Harreveld, A., Wiersma, C. A. G. The Triple Innervation of the Crayfish Muscle. Proc. Natl. Acad. Sci. USA. 22 (11), 667 (1936).
- Vélez, S. J., Wayman, R. J. Synaptic connectivity in a crayfish neuromuscular system. I. Gradient of innervations and synaptic strength. J. Neurophysiol. 41, 75-84 (1978).
- Watanabe, A., Grundfest, H. Impulse propagation at the septal and commissural junctions of crayfish lateral giant axons. J. Gen. Physiol. 45, 267-308 (1961).
- Watkins, J. C. L-Glutamate as a central neurotransmitter: Looking back. Biochemical Society Transactions. 28, 297-310 (2000).
- Wiersma, C. A. G., Waterman, T. H. The neuromuscular system. The Physiology of Crustacea. II, (1961).
- Wiersma, C. A. G. Reflexes and the central nervous system. The physiology of Crustacea. II, 241-279 (1961).
- Wine, J. J., Mittenthal, J. E., Kennedy, D. The structure of tonic flexor motoneurons in crayfish abdominal ganglia. J. Comp. Physiol. 93, 315-335 (1974).
- Wu, W. H., Cooper, R. L. Physiological Recordings of High and Low Output NMJs on the Crayfish Leg Extensor Muscle. J. Vis. Exp. (45), e2319 (2010).
- Wyttenbach, R. A., Johnson, B. R., Hoy, R. R. . Crawdad. A CD-ROM Lab manual for neurophysiology. , (1999).
- Zucker, R. S. Crayfish escape behavior and central synapses. 3. Electrical junctions and dendrite spikes in fast flexor motoneurons. J. Neurophysiol. 35, 638-651 (1972).
- Zucker, R. S. Crayfish escape behavior and central synapses. II. Physiological mechanisms underlying behavioral habituation. J. Neurophysiol. 35 (5), 621-637 (1972).
- Zucker, R. S. Crayfish escape behavior and central synapses. I. Neural circuit exciting lateral giant fiber. J. Neurophysiol. 35 (5), 599-620 (1972).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены