Method Article
心筋梗塞のマウスモデルにおける冠動脈結紮および心筋内注入
要約
多数の遺伝子操作及び/または遺伝子、タンパク質、細胞、および/または生体物質の心筋内注射は、急性虚血/再灌流傷害およびマウスにおける慢性的リモデリングの研究に時間の次元に重ね合わされている。このビデオでは、虚血/再灌流、恒久的な冠動脈結紮、および心筋内注入の研究のための顕微手順を示しています。
要約
Mouse models are a valuable tool for studying acute injury and chronic remodeling of the myocardium in vivo. With the advent of genetic modifications to the whole organism or the myocardium and an array of biological and/or synthetic materials, there is great potential for any combination of these to assuage the extent of acute ischemic injury and impede the onset of heart failure pursuant to myocardial remodeling.
Here we present the methods and materials used to reliably perform this microsurgery and the modifications involved for temporary (with reperfusion) or permanent coronary artery occlusion studies as well as intramyocardial injections. The effects on the heart that can be seen during the procedure and at the termination of the experiment in addition to histological evaluation will verify efficacy.
Briefly, surgical preparation involves anesthetizing the mice, removing the fur on the chest, and then disinfecting the surgical area. Intratracheal intubation is achieved by transesophageal illumination using a fiber optic light. The tubing is then connected to a ventilator. An incision made on the chest exposes the pectoral muscles which will be cut to view the ribs. For ischemia/reperfusion studies, a 1 cm piece of PE tubing placed over the heart is used to tie the ligature to so that occlusion/reperfusion can be customized. For intramyocardial injections, a Hamilton syringe with sterile 30gauge beveled needle is used. When the myocardial manipulations are complete, the rib cage, the pectoral muscles, and the skin are closed sequentially. Line block analgesia is effected by 0.25% marcaine in sterile saline which is applied to muscle layer prior to closure of the skin. The mice are given a subcutaneous injection of saline and placed in a warming chamber until they are sternally recumbent. They are then returned to the vivarium and housed under standard conditions until the time of tissue collection. At the time of sacrifice, the mice are anesthetized, the heart is arrested in diastole with KCl or BDM, rinsed with saline, and immersed in fixative. Subsequently, routine procedures for processing, embedding, sectioning, and histological staining are performed.
Nonsurgical intubation of a mouse and the microsurgical manipulations described make this a technically challenging model to learn and achieve reproducibility. These procedures, combined with the difficulty in performing consistent manipulations of the ligature for timed occlusion(s) and reperfusion or intramyocardial injections, can also affect the survival rate so optimization and consistency are critical.
プロトコル
- 滅菌手術器具(表1)及び3"綿ひっくり返されたアプリケーターは、滅菌underpad上に配置されています。ビーズ滅菌器(Germinator 500)オンになっている。
- マウスは(年齢:> 6週間、重量:> 18グラム)は、トリブロムエタノールの20μlの/ gのBW(; - 約40分持続250mg/kg)の腹腔内注射で麻酔する。
- マウスはつま先-ピンチに応答しないときは、乾燥や胸部の左側からそれらを保護するために目に適用される滅菌潤滑油が(涙がリニューアル)皮膚から毛を削除するには、脱毛剤(例えばNairさん)でコーティングされています。
- 脱毛は、実行中の暖かい水とbetadine /アルコールスワブで洗い流される外科領域の消毒に使用されます。
- マウスは、プレキシガラスのテーブルに固定されている暖かいdeltaphase等温パッドの上に配置されます。各肢は、テープを使用して固定化されていると太い糸ではその場で上顎を保持するために上部の歯の下に水平に配置されます。
- テーブルは、垂直に配置されており、光ファイバ、光は経食道照明のために頸部に直接輝いています。これは、このようにPEチューブの挿入を容易に可視化するために気管を可能にする、喉の開口部が明るいオリフィスとして表示されるように正確に配置する必要があります。
- 速度125回/分;最大吸気圧10月12日CMH 2 O; *注チューブは、一定の陽圧換気(TOPO人工呼吸器を管理するための人工呼吸器(95%O 2 / 5%CO 2に接続)に接続されています:設定値)は、ひずみとジェンダー1-3異なります。換気が同期胸の動きが確認されると、接続が手術中に抜管を防ぐためにテープでパッドに固定されています。
- 胸から持ち上げ、皮膚を引っ張って歯鉗子を使用すると、第3位メスハンドルに接続された第10滅菌外科用メスの刃は、胸骨に皮膚と平行に1.5センチメートル切開を行うために使用されます。
- 湾曲したヴァンナのmicroscissorsは胸筋をカットし、肋間筋に小さな穴を作るために使用されます。
- ストレート、鈍microscissorsは3リブカットスルーするために使用されます。
- 9ミリメートル小児眼科の反射鏡は、胸郭を撤回するために使用されます。
- 湾曲鉗子を使用して、心臓からの心膜を引っ張り、ゆっくりとそれが開いて破れに歯鉗子を使用してください。
- Castroviejo針ホルダーは6mmテーパーポイント3月8日針の糸を使用して、冠動脈を(心の長軸に沿って)左前下に8から0ポリエチレン縫合糸は、それに垂直。
- 時限再灌流のために削除できる一時的な合字の場合は、PE90の滅菌0.5〜1センチメートルピースが冠状動脈と平行に中心に配置されます。第一冠状動脈の下にループされた縫合糸が、、その後、チューブに接続されています。それが解放される時に、合字を緩めている。希望と閉塞/再閉塞の時は4を変更できるようにこれを繰り返すことができます。プロトコルの長さと使用される麻酔の種類に応じて、補充が必要になることがあります。
- 永続的な閉塞の場合は、冠状動脈の下混入合字は、単に接続されています。白化やジスキネジアは明らかであり、縫合糸の長い方の端を 5〜10カットされます。
- 心筋内注入(S)の場合は、30ゲージ滅菌斜め針付き滅菌ハミルトンシリンジは、合字の右側の損傷の領域の上に心の底に導入される。針は、傷害の領域に進出し、わずかにベベルが約国境地帯で見られることが引き出される。シリンジ内の溶液(2 -3μl)の一部は心臓に注入し、針を所定位置に保持される。注射器は、別の1〜3ミリメートル撤回され、ソリューションの残りの部分は注入されます。ソリューションによって形成される水疱が消散するまでシリンジを所定位置に保持される。針はその後削除されます。いずれかの出血がある場合は出血5-7停止するまで、綿棒を静かに針の挿入部位に押し付けている。
- 心筋の操作が完了すると、リブのリトラクターが削除され、胸腔は6から0 surgiproの縫合糸を使用して2〜3マットレス縫合で閉じられます。
- 2〜3マットレス縫合糸は、筋肉に適用され、その後2〜3マットレス縫合をするために行われる、滅菌生理食塩水0.25%marcaine 1:10(0.1ml/25gマウス)の1-3滴を胸の筋肉を閉じるために作られています皮膚を閉じます。
- マウスは、人工呼吸器から削除されます。一度リズム、急速な、浅い呼吸が確認され、マウスを抜管することができます。
- 0.5ミリリットル暖かい滅菌生理食塩水は、背側皮下空間に注入され、それがモビリティ(1時間の最小値を)取り戻すまでのマウスは、ケージ内の温暖化のパッドの上に配置されます。
- 生存実験のために、マウスをケージに戻し入れられ、屠殺時までビバリウムに戻った。最初の2日間、食べ物は湿らせた摂食を促進するためにケージの床の上に配置(ので、彼らは痛みを引き起こす可能性があるまで到達する必要がない)とブプレノルフィンは6 - 12時間毎に投与する必要があります。術後のケアも十分な可動性、身づくろい、そして食習慣を確認するために最初の週の毎日の監視が含まれます。
- 手術器具はエタノールで拭いて次の手術の前にビーズ滅菌器に挿入されます。
- 屠殺時、マウスはペントバルビタールナトリウム(; 55〜65 mg / kgを65mg/ml)で麻酔する。麻酔の適切な面が達成されると、胸腔が開かれます。
- 心臓はまだ、寒い塩化カリウムを含む23ゲージの注射針と注射器を打っている(のKCl、30mMの)または2,3 - ブタンジオンmonoxime(BDM; 10mMのは)しながら穿刺するために心室の後基底領域を使用してソリューションのです心臓が拡張期で逮捕されるまで徐々にチャンバー内に注入。
- 心臓が削除されると、PBSを含む注射器は逆行残っているすべての血液を除去するために心を洗浄灌流するために使用されます。急性試験の場合は、再灌流の期間の終了時に、LADは閉塞の原点で再連結される。 1パーセントエバンスブルーを含む溶液は、大動脈に注入されます。心臓が抽出されると、それは、1%2,3,5 -トリフェニルテトラ塩化物中でインキュベート、同じ厚さの3つのセクションに横方向に切断し、形態学的解析11の結像される。慢性毒性試験のために、心臓は、その後ルーチンの手順にしたがって処理して組み込み、固定液に浸漬する。スライドはその後組織学的に染色され、9,10,12(サイオン、NIHイメージJ、またはイメージプロプラスを使用)形態学的解析のために撮像することができます。
代表的な結果:
正しく完了したら、マウス(雄:年齢8〜10週間、22〜28グラム、女性:年齢10〜12週、20〜26グラム)の生存率は以下のとおりです。以上、急性虚血/再灌流と虚血プレコンディショニングの実験では90%以上恒久的な動脈の結紮の研究で85%、および心筋内注射のための約80%。初期の損傷がより容易に目に見える代謝の変化ではなく、構造的なことですので、虚血/再灌流における梗塞サイズの決定と虚血プレコンディショニングの実験がLADで提供されていない心臓を灌流される大動脈に1パーセントエバンスブルー色素を注入することによって実行されます(図1A)。心臓が削除され、横方向に半分に切断されると、組織は梗塞サイズ(図1B)を測定するために2,3,5 - トリフェニルクロリドの1%溶液中でインキュベートされる。領域が同じ倍率で撮像さマイクロメータを使用して較正することができますサイオンやNIHイメージソフトウェアを使用して測定されます。これらの数値は、リスク/左心室と梗塞のリスクが11でサイズ/エリアで面積を計算するために使用されます。違いは体重と心臓の大きさとそのケアの変化をもたらすことができる株は、比較のために心臓重量、体重、または脛骨の長さにこれらの対策を正規化するために注意が必要です。
このような壊死などの総構造変化、減肉、および心室拡張の恒久的な動脈の結紮の結果。左心室への相対的な梗塞サイズおよび壊死に対する治療および/または時間の効果の比較、チャンバ領域、永久閉塞モデル(図2A)の隔壁と左心室自由壁の厚さもサイオンやNIHのイメージングを使用して測定することができます。ソフトウェア。 picrosirius赤色/緑色で速く(図2B)とコラーゲンの染色は、壁の補強8-10の機能的な指標に相関insterstitial線維症を測定するために使用することができます。図3の画像は、恒久的な動脈の結紮は、次の心臓の国境地帯に注入6ulソリューション(エバンスブルー)の分布を表します。それはtransmurallyも基地に向かってだけでなく、けがの方向に進行していることに注意してください。

図1。 A.エヴァンのブルーは前に切除の大動脈に注入する。このイメージは、心臓(ステンドグラス)や閉塞部位(非染色)の潅流領域を示す。B.エヴァンのブルーとTTCは、急性虚血/再灌流傷害に続く染色。これはunoccluded地域だけでなく、代謝的に実行可能な組織のTTC染色(赤)を染色した青色色素の分布を示す代表的な画像(20倍)です。壊死領域が染色されないので、これらは(概説)薄いままです。
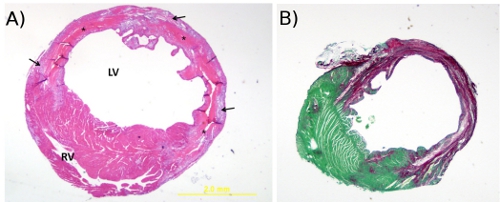
図2。 A.ヘマトキシリンおよびエオシン染色。これは、4日後に心筋梗塞で梗塞領域を介して横方向に切断マウスの心臓(20倍)のH&E染色の代表画像(20倍)である。 *は、組織の壊死を示し、矢印のポイント肉芽組織に、RV =右心室とLV =左心室。B. Picrosirius赤色と緑色で速く染色。これはpicrosirius赤/ポストMI 4週間でのマウスの心臓の断面の高速グリーン染色の代表画像(20倍)。細胞質の汚れの緑とコラーゲン線維が赤です。
6ul心筋内注射後図3。エバンスブルー色素染色の分布。これは、すぐに冠動脈結紮(12倍)以下の国境地帯で6ul心筋内注射した後、心臓全体にエバンスブルー色素のグローバルおよび経壁分布を示す代表的な画像です。
ディスカッション
冠状動脈性心臓病の疫学的および財政的に重要な公衆衛生上の問題であり続けている。かなり基本的な研究はまだ怪我して改造を続行するメカニズムとそれらがどのように臨床使用するために開発される場合に潜在的な治療法はこれらのプロセスを調節することを理解するのに必要です。げっ歯類は、最も一般的に使用され、遺伝子改変マウスの広い範囲が利用可能なこの種のより魅力的なモデルになりますされています。
マウスや他の種の違いがありますが、マウスモデルに多くの利点があります。簡単な解剖スコープまたは虫眼鏡を使用しても点灯条件は、血管を容易に見ることができるようになります(血管系の詳細な肉眼解剖学のために、サルト- Tellez らを参照してください。、2004 13)。 25グラムのマウスの全血液量が2ミリリットル14よりも小さいので、手術後の死亡のリスクを減らすために、それは大型船を切断することを避けるために非常に重要です。過度の出血が発生した場合には、圧力やピンポイントの焼灼の穏やかなアプリケーションは、出血を止めるために使用することができます。
この手順は、さまざまな方法で変更することができます。例えば、マウスは、イソフルラン、ケタミン/キシラジン、またはペントバルビタールナトリウムと適切な選択はプロトコル15から18までの期間によって決定されるを使用して麻酔することができます。つま先-ピンチの反射は麻酔の深さの最も一般的に使用されるインデックスです。さらに、長期生存の確率を向上させるために、いくつかの研究者が致死性不整脈19,20の発生率を減らすためにリドカイン等の抗不整脈薬を使用するしかし、それは、これは最近、急性の抗アポトーシス特性を有することが示されていることを考慮する必要があります。モデル21。また、手術後の痛みを軽減する、そのようなブプレノルフィンなどの鎮痛薬は、手術3,16,17,22,23後の最初の48時間に投与することができる。 (特に長いプロトコルのため)手術中の体温を維持するために、加熱パッド付きシリーズの直腸プローブは、多くの場合、等温パッドの代わりに使用されます。永久的な閉塞のため、梗塞の大きさは、合字の位置を調整することによって変更されることがあります;閉塞(s)と再灌流(s)の持続時間は変更することができます:虚血/再灌流および/または虚血前またはpostconditioning用と心筋内注射(例えば、細胞、蛋白質)のために,1 - 3注射の場所が存在することができ、注入あたりの体積は15μlの24まですることができます。細胞が注入されている場合は針の内径は、シェアーリングを避けるために十分な大きさであるので、(通常は26〜30)5,25,26を使用するニードルのゲージは、細胞の大きさに基づいて選択する必要があります。手術によって引き起こされる炎症性プロセスによる困惑を避けるために、いくつかの研究者は手術27から29の後の任意の時点で閉胸のマウスの心臓を閉塞し、reperfuseにex vivoで操作されるスネアを使って報告している。さらに最近では、ガオら 30は、一時的および永久的な閉塞が換気を必要とせずに実行できると、いくつかの研究室が閉まる胸心筋内注射25,31を実行するために超音波を使用し始めていることが示されている。
マウスでは冠動脈を結紮することの実現可能性を実証する最初の研究、1954年32にジョンズとオルソンによって公開されて以来、多くの人はこのモデルを採用し、心筋障害とリモデリング3,33-45のさまざまな側面を研究するためにそれを変更しました。サイズ、生殖能力、購入とメンテナンスのため、比較的少ない費用の点でマウスの性質は、この種の生理学的および病態生理学的研究の幅広い魅力的なツールになります。 in vivoでの進歩46から49 のイメージング技術の微細化だけでなく、大規模ゲノミクスとプロテオミクスを実行し、分析することを意味し、薬剤のスクリーニング、細胞ベースおよび/ またはタンパク質の治療だけでなく、生体50から64の効果、組み合わせユビキタスまたは組織特異的トランスジェニックやノックアウト/変異マウスがもたらす遺伝子操作のますます広い範囲で、心筋梗塞のマウスモデルは、間違いなく急性心筋傷害と長期的なリモデリングを評価する上で貴重なツールであり続けるでしょう。したがって、確実にかつ再現性これらの実験を行うためにできることで疑う余地のない価値があります。
開示事項
謝辞
私は彼らの警戒と支援のために私の研究と比較医学科を支援する資金を提供するための研究と大学院の専攻を感謝したい。私も彼らの助けのための支援と指導のための生理学教室だけでなく、私の研究室の学生や技術者を認識したいと思います。最後に、私はマウスのマイクロサージェリーを学習した時にトレーニングの機会のために私のポスドクのメンター、博士チャールズE.ムリーロードを、感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Long Vanna Scissors | George Tiemann & Co. | 160-159 | |
| Micro Dissecting Scissors | George Tiemann & Co. | 160-161 | |
| Forceps – straight, 1x2 teeth | George Tiemann & Co. | 105-205 | |
| Scalpel handle #3 | George Tiemann & Co. | 105-64 | #10 sterile blade |
| Forceps – half curved serrated | George Tiemann & Co. | 160-19 | |
| Tissue Scissors | George Tiemann & Co. | 105-410 | |
| Castroviejo Needle Holder | Miltex Inc. | 18-1828 | |
| Cook Eye Speculum | Miltex Inc. | 18-63 | |
| Surgipro II 8-0 | Suture Express | VP-900-X | |
| Prolene 6-0 | Suture Express | 8776 | |
| Germinator 500 Bead Sterilizer | Cellpoint Scientific | 65369-1 | |
| Deltaphase isothermal pad | Braintree Scientific, Inc. | 39DP | |
| Hamilton syringe - 25μl | Hamilton Co | 80430 | |
| 30 gauge beveled needle | Hamilton Co | 7803-07 | |
| Ventilator | Kent Scientific | TOPO |
参考文献
- Reinhard, C. Inbred strain variation in lung function. Mamm Genome. 13, 429-437 (2002).
- Schulz, H. Respiratory mechanics in mice: strain and sex specific differences. Acta Physiol Scand. 174, 367-375 (2002).
- Tarnavski, O. Mouse cardiac surgery: comprehensive techniques for the generation of mouse models of human diseases and their application for genomic studies. Physiol Genomics. 16, 349-360 (2004).
- Klocke, R., Tian, W., Kuhlmann, M. T., Nikol, S. Surgical animal models of heart failure related to coronary heart disease. Cardiovasc Res. 74, 29-38 (2007).
- Murry, C. E. Haematopoietic stem cells do not transdifferentiate into cardiac myocytes in myocardial infarcts. Nature. 428, 664-668 (2004).
- Nussbaum, J. Transplantation of undifferentiated murine embryonic stem cells in the heart: teratoma formation and immune response. Faseb J. 21, 1345-1357 (2007).
- Reinecke, H., Minami, E., Virag, J. I., Murry, C. E. Gene transfer of connexin43 into skeletal muscle. Hum Gene Ther. 15, 627-636 (2004).
- Virag, J. A. Attenuation of Myocardial Injury in Mice with Functional Deletion of the Circadian Rhythm Gene mPer2. Am J Physiol Heart Circ Physiol. , (2008).
- Virag, J. A. Fibroblast growth factor-2 regulates myocardial infarct repair: effects on cell proliferation, scar contraction, and ventricular function. Am J Pathol. 171, 1431-1440 (2007).
- Virag, J. I., Murry, C. E. Myofibroblast and endothelial cell proliferation during murine myocardial infarct repair. Am J Pathol. 163, 2433-2440 (2003).
- Cozzi, E. Ultrafine particulate matter exposure augments ischemia-reperfusion injury in mice. Am J Physiol Heart Circ Physiol. 291, 894-903 (2006).
- Virag, J. A. Attenuation of myocardial injury in mice with functional deletion of the circadian rhythm gene mPer2. Am J Physiol Heart Circ Physiol. 298, 1088-1095 (2010).
- Salto-Tellez, M. Myocardial infarction in the C57BL/6J mouse: a quantifiable and highly reproducible experimental model. Cardiovasc Pathol. 13, 91-97 (2004).
- Diehl, K. H. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21, 15-23 (2001).
- Lichtenberger, M., Ko, J. Anesthesia and analgesia for small mammals and birds. Vet Clin North Am Exot Anim Pract. 10, 293-315 (2007).
- Davis, J. A. Mouse and rat anesthesia and analgesia. Curr Protoc Neurosci. Appendix 4, Appendix 4B-Appendix 4B (2008).
- Flecknell, P. A. Anaesthesia of animals for biomedical research. Br J Anaesth. 71, 885-894 (1993).
- Kolk, M. V. LAD-ligation: a murine model of myocardial infarction. J Vis Exp. , (2009).
- Kinoshita, H. T-type Ca2+ channel blockade prevents sudden death in mice with heart failure. Circulation. 120, 743-752 (2009).
- Mulder, P. Increased survival after long-term treatment with mibefradil, a selective T-channel calcium antagonist, in heart failure. J Am Coll Cardiol. 29, 416-421 (1997).
- Kaczmarek, D. J. Lidocaine protects from myocardial damage due to ischemia and reperfusion in mice by its antiapoptotic effects. Anesthesiology. 110, 1041-1049 (2009).
- Blaha, M. D., Leon, L. R. Effects of indomethacin and buprenorphine analgesia on the postoperative recovery of mice. J Am Assoc Lab Anim Sci. 47, 8-19 (2008).
- Flecknell, P. A. Analgesia of small mammals. Vet Clin North Am Exot Anim Pract. 4, 47-56 (2001).
- Dries, J. L., Kent, S. D., Virag, J. A. Intramyocardial administration of chimeric ephrinA1-Fc promotes tissue salvage following myocardial infarction in mice. J Physiol. 589, 1725-1740 (2011).
- Springer, M. L. Closed-chest cell injections into mouse myocardium guided by high-resolution echocardiography. Am J Physiol Heart Circ Physiol. 289, 1307-1314 (2005).
- Wang, C. C. Direct intramyocardial injection of mesenchymal stem cell sheet fragments improves cardiac functions after infarction. Cardiovasc Res. 77, 515-524 (2008).
- Nossuli, T. O. A chronic mouse model of myocardial ischemia-reperfusion: essential in cytokine studies. Am J Physiol Heart Circ Physiol. 278, 1049-1055 (2000).
- Kim, S. C. Toll-like receptor 4 deficiency: smaller infarcts, but no gain in function. BMC Physiol. 7, 1472-6793 (2007).
- Fazel, S. S. Activation of c-kit is necessary for mobilization of reparative bone marrow progenitor cells in response to cardiac injury. Faseb J. 22, 930-940 (2008).
- Gao, E. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circ Res. 107, 1445-1453 (2010).
- Fujii, H. Ultrasound-targeted gene delivery induces angiogenesis after a myocardial infarction in mice. JACC Cardiovasc Imaging. 2, 869-879 (2009).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Ann Surg. 140, 675-682 (1954).
- Frangogiannis, N. G. The immune system and cardiac repair. Pharmacol Res. 58, 88-111 (2008).
- Dobaczewski, M., Frangogiannis, N. G. Chemokines and cardiac fibrosis. Front Biosci (Schol Ed). 1, 391-405 (2009).
- Willis, M. S., Townley-Tilson, W. H., Kang, E. Y., Homeister, J. W., Patterson, C. Sent to destroy: the ubiquitin proteasome system regulates cell signaling and protein quality control in cardiovascular development and disease. Circ Res. 106, 463-478 (2010).
- Nithipatikom, K., Gross, G. J. Review article: epoxyeicosatrienoic acids: novel mediators of cardioprotection. J Cardiovasc Pharmacol Ther. 15, 112-119 (2010).
- Palaniyandi, S. S., Sun, L., Ferreira, J. C., Mochly-Rosen, D. Protein kinase C in heart failure: a therapeutic target. Cardiovasc Res. 82, 229-239 (2009).
- Michael, L. H. Myocardial ischemia and reperfusion: a murine model. Am J Physiol. 269, 2147-2154 (1995).
- Patten, R. D. Ventricular remodeling in a mouse model of myocardial infarction. Am J Physiol. 274, 1812-1820 (1998).
- Paigen, K. A miracle enough: the power of mice. Nat Med. 1, 215-220 (1995).
- Kogan, M. E., Belov, L. N., Leont'eva, T. A., Zolotareva, A. G. Modeling of myocardial pathology in mice with the surgical methods. Kardiologiia. 17, 125-128 (1977).
- Tarnavski, O. Mouse surgical models in cardiovascular research. Methods Mol Biol. 573, 115-137 (2009).
- Wong, R., Aponte, A. M., Steenbergen, C., Murphy, E. Cardioprotection leads to novel changes in the mitochondrial proteome. Am J Physiol Heart Circ Physiol. 298, 75-91 (2010).
- Dobaczewski, M., Gonzalez-Quesada, C., Frangogiannis, N. G. The extracellular matrix as a modulator of the inflammatory and reparative response following myocardial infarction. J Mol Cell Cardiol. 48, 504-511 (2010).
- Zhao, Z. Q. Inhibition of myocardial injury by ischemic postconditioning during reperfusion: comparison with ischemic preconditioning. Am J Physiol Heart Circ Physiol. 285, 579-588 (2003).
- Thibault, H. Acute myocardial infarction in mice: assessment of transmurality by strain rate imaging. Am J Physiol Heart Circ Physiol. 293, 496-502 (2007).
- Scherrer-Crosbie, M. Three-dimensional echocardiographic assessment of left ventricular wall motion abnormalities in mouse myocardial infarction. J Am Soc Echocardiogr. 12, 834-840 (1999).
- Stypmann, J. Echocardiographic assessment of global left ventricular function in mice. Lab Anim. 43, 127-137 (2009).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. Murine echocardiography and ultrasound imaging. J Vis Exp. , (2010).
- Zimmermann, W. H. Heart muscle engineering: an update on cardiac muscle replacement therapy. Cardiovasc Res. 71, 419-429 (2006).
- Mangi, A. A. Mesenchymal stem cells modified with Akt prevent remodeling and restore performance of infarcted hearts. Nat Med. 9, 1195-1201 (2003).
- Chavakis, E., Koyanagi, M., Dimmeler, S. Enhancing the outcome of cell therapy for cardiac repair: progress from bench to bedside and back. Circulation. 121, 325-335 (2010).
- Mirotsou, M., Jayawardena, T. M., Schmeckpeper, J., Gnecchi, M., Dzau, V. J. Paracrine mechanisms of stem cell reparative and regenerative actions in the heart. J Mol Cell Cardiol. , (2010).
- Fromstein, J. D. Seeding bioreactor-produced embryonic stem cell-derived cardiomyocytes on different porous, degradable, polyurethane scaffolds reveals the effect of scaffold architecture on cell morphology. Tissue Eng Part A. 14, 369-378 (1089).
- Lee, R. J. Stem cells for myocardial repair and regeneration: where are we today. Methods Mol Biol. 660, 1-6 (2010).
- Segers, V. F., Lee, R. T. Protein Therapeutics for Cardiac Regeneration after Myocardial Infarction. J Cardiovasc Transl Res. , (2010).
- Webber, M. J. Capturing the stem cell paracrine effect using heparin-presenting nanofibres to treat cardiovascular diseases. J Tissue Eng Regen Med. 10, (2010).
- Kofidis, T. Novel injectable bioartificial tissue facilitates targeted, less invasive, large-scale tissue restoration on the beating heart after myocardial injury. Circulation. 112, I173-1177 (2005).
- Vunjak-Novakovic, G. Challenges in cardiac tissue engineering. Tissue Eng Part B Rev. 16, 169-187 (2010).
- Guyette, J. P., Cohen, I. S., Gaudette, G. R. Strategies for regeneration of heart muscle. Crit Rev Eukaryot Gene Expr. 20, 35-50 (2010).
- Menasche, P. Cardiac cell therapy: Lessons from clinical trials. J Mol Cell Cardiol. , (2010).
- Ott, H. C., McCue, J., Taylor, D. A. Cell-based cardiovascular repair--the hurdles and the opportunities. Basic Res Cardiol. 100, 504-517 (2005).
- Terrovitis, J. V., Smith, R. R., Marban, E. Assessment and optimization of cell engraftment after transplantation into the heart. Circ Res. 106, 479-494 (2010).
- Nelson, T. J. Repair of acute myocardial infarction by human stemness factors induced pluripotent stem cells. Circulation. 120, 408-416 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved