Method Article
경색의 Murine 모델에서 관상 동맥 내고과 Intramyocardial 사출
요약
수많은 유전자 조작 및 / 또는 유전자, 단백질, 세포 및 / 또는 biomaterials의 intramyocardial 주사는 급성 국소 빈혈 / reperfusion 부상과 생쥐의 만성 리모델링의 연구에 시간의 차원에 따라 겹쳐있다. 이 동영상은 국소 빈혈 / reperfusion에 대한 microsurgical 절차, 영구적인 관상 동맥 내고, 그리고 intramyocardial 사출 공부를 보여줍니다.
초록
Mouse models are a valuable tool for studying acute injury and chronic remodeling of the myocardium in vivo. With the advent of genetic modifications to the whole organism or the myocardium and an array of biological and/or synthetic materials, there is great potential for any combination of these to assuage the extent of acute ischemic injury and impede the onset of heart failure pursuant to myocardial remodeling.
Here we present the methods and materials used to reliably perform this microsurgery and the modifications involved for temporary (with reperfusion) or permanent coronary artery occlusion studies as well as intramyocardial injections. The effects on the heart that can be seen during the procedure and at the termination of the experiment in addition to histological evaluation will verify efficacy.
Briefly, surgical preparation involves anesthetizing the mice, removing the fur on the chest, and then disinfecting the surgical area. Intratracheal intubation is achieved by transesophageal illumination using a fiber optic light. The tubing is then connected to a ventilator. An incision made on the chest exposes the pectoral muscles which will be cut to view the ribs. For ischemia/reperfusion studies, a 1 cm piece of PE tubing placed over the heart is used to tie the ligature to so that occlusion/reperfusion can be customized. For intramyocardial injections, a Hamilton syringe with sterile 30gauge beveled needle is used. When the myocardial manipulations are complete, the rib cage, the pectoral muscles, and the skin are closed sequentially. Line block analgesia is effected by 0.25% marcaine in sterile saline which is applied to muscle layer prior to closure of the skin. The mice are given a subcutaneous injection of saline and placed in a warming chamber until they are sternally recumbent. They are then returned to the vivarium and housed under standard conditions until the time of tissue collection. At the time of sacrifice, the mice are anesthetized, the heart is arrested in diastole with KCl or BDM, rinsed with saline, and immersed in fixative. Subsequently, routine procedures for processing, embedding, sectioning, and histological staining are performed.
Nonsurgical intubation of a mouse and the microsurgical manipulations described make this a technically challenging model to learn and achieve reproducibility. These procedures, combined with the difficulty in performing consistent manipulations of the ligature for timed occlusion(s) and reperfusion or intramyocardial injections, can also affect the survival rate so optimization and consistency are critical.
프로토콜
- 무균 수술기구 (표 1) 3 "무명 밀고 applicators은 살균 underpad에 표시됩니다. 구슬 살균기 (Germinator 500)가 설정되어 있습니다.
- 마우스 (나이 :> 6주, WT :> 18g)는 tribromoethanol의 20μl / g BW (; 기간 - 약 40 분 250mg/kg)의 IP 주사로 anesthetized 있습니다.
- 쥐가 발끝 - 찔러봐, 살균 윤활제 (눈물이 갱신)에 응답하는 경우 탈수와 가슴의 왼쪽에서 그들을 보호하기 위해 눈에 적용은 피부에서 모피를 제거하는 depilatory (예 : 나이르)으로 코팅됩니다.
- depilatory는 따뜻한 실행 물과 betadine / 알코올 보라고가 수술 영역을 소독하는 데 사용됩니다 함께 씻겨입니다.
- 마우스는 플렉시 글라스 테이블에 고정 따뜻한 deltaphase 등온 패드에 배치됩니다. 각 갈기갈기는 테이프를 사용하여 고정하고 두꺼운 스레드 장소에서 위턱을 보유 가기 치아 아래에 수평으로 배치됩니다.
- 테이블이 수직으로 위치하며 fiberoptic 빛이 transesophageal 조명에 대한 목 지역에 직접 빛났다입니다. 이것은 따라서기도는 PE 관의 삽입을 용이하게하기 위해 시각 될 수 있도록, 인후의 구멍이 잘 조명 구멍으로 볼 수 있습니다 그러한 정확한 위치를 필요로합니다.
- 속도 125 숨을 / 분,, 피크 inspiratory 압력 10-12 CMH 2 O; * 참고 튜브 그런 다음 일정한 양압 환기 (토포 호흡기 관리 환풍기 (95 % O 2 / 5% CO 2에 연결)에 연결 : 설정) 부담 및 성별 1-3과 다를 수 있습니다. 환기가 동기 가슴의 움직임에 의해 확인되면, 연결이 수술하는 동안 extubation 않도록 테이프로 패드에 고정됩니다.
- # 3 메스를 처리하기 위해 첨부 # 10 멸균 메스 블레이드, 가슴의 피부를 잡아 이빨 집게를 사용하여 멀리하는 것은 흉골에 피부가 병렬로 1.5cm 절개를하는 데 사용됩니다.
- 곡선 바나의 microscissors는 pectoralis 근육을 잘라 늑간 근육의 작은 구멍을 만들기 위해 사용됩니다.
- 스트레이트, 뭉툭한의 microscissors 3 늑골을 통해 절단하는 데 사용됩니다.
- 9mm 소아 안과 검경은 갈빗대를 철회하는 데 사용됩니다.
- 곡선 집게를 사용하면, 거리의 중심에서 심낭을 당겨 부드럽게 열어 눈물에 톱니 집게를 사용합니다.
- Castroviejo 니들 홀더, 6mm 테이퍼 포인트 8분의 3 바늘 스레드를 사용하여 관상 동맥을 (마음의 긴 축을 따라) 내림차순 왼쪽 앞쪽에 아래 8-0 폴리에틸렌 봉합은 수직.
- 초과의 reperfusion 위해 제거할 수 있습니다 임시 묶인 들어, PE90의 멸균 0.5 - 1cm 조각은 관상 동맥에 병렬로 마음에 배치됩니다. 처음으로 관상 동맥에 따라 반복되었습니다 봉합은 다음 튜브에 묶여있다. 그것이 공개하는 동시에, 묶인이 느슨하게됩니다. 원하는 및 폐색 / reocclusion의 시간이 4 수정할 수 있듯이 이것은 반복 수 있습니다. 프로토콜 및 사용 마취의 종류의 길이에 따라 보완이 필요할 수 있습니다.
- 영구 폐색은 관상 동맥에 따라 레이스 묶인 단순히 묶여 있습니다. 창백하고 운동 이상증은 분명하며 봉합의 긴 끝을 50-10 절단됩니다.
- 에 대한 intramyocardial 사출 (S), 30 게이지 바늘로 살균 beveled 살균 해밀턴 주사기는 묶인의 오른쪽에 부상의 영역 위에있는 마음의 기지에 소개됩니다. 바늘은 다음 상해의 영역으로 고급 약간 그래서 베벨은 약 국경 지대에서 볼 수 철회합니다. 주사기 (2 - 3μl)의 솔루션 중 일부는 심장에 주입하고 바늘이 장소에서 개최됩니다. 주사기는 또 1~3mm 철회하고 솔루션의 나머지 주입니다. 솔루션 형성 물집이 없어져요 때까지 주사기는 장소에서 개최됩니다. 주사 바늘을 뺍니다. 어떠한 출혈이있다면 출혈이 멈출 때까지 5-7, 솜 밀고 작은 주걱은 부드럽게 바늘을 삽입 사이트에 누르면됩니다.
- 심근 조작이 완료되면, 갈비뼈 견인기이 제거되고 흉강은 6-0 surgipro의 봉합사를 사용하여 2-3 매트리스 봉합과 함께 닫힙니다.
- 둘, 셋 매트리스 봉합은 다음 멸균 식염수로 0.25 % marcaine의 1시 10분 (0.1ml/25g 마우스)의 1-3 방울, pectoralis 근육을 닫습니다 만들어진 것은 근육에 적용 후 2-3 매트리스 봉합을 위해 만들어진다 피부를 닫습니다.
- 마우스는 환풍기에서 제거됩니다. 얕은, 급속한, 일단 리듬 호흡이 확인, 마우스 extubated 수 있습니다.
- 0.5ml 따뜻한 멸균 생리는 등의 피하 공간에 주입하고 이동성 (1 시간 최소)을 차릴 때까지 마우스는 새장에 온난 패드에 배치됩니다.
- 생존 실험 들어, 생쥐들은 연습장에 다시 배치되고 희생의 시간까지 동식물 사육장으로 돌아왔습니다. 처음 2 일 동안, 음식이 moistened(그들이 고통을 일으킬 수있는 최대에 도달하지 않아도됩니다) 공급을 촉진하기 위해 케이지 바닥에 배치하고 buprenorphine는 모든 6 - 12hr을 관리해야합니다. 포스트 수술 치료는 적절한 이동성, 정리하고, 식습관을 확인하는 첫 번째 주일 동안 매일 모니터링을 포함합니다.
- 수술 악기는 에탄올로 닦아하고 다음 수술 전에 비드 살균기에 삽입됩니다.
- 희생의 시간에, 마우스는 pentobarbital 나트륨 (; 55-65 MG / kg 65mg/ml)와 anesthetized 있습니다. 마취의 적절한 비행기가 달성되면, 흉강가 열립니다.
- 심장이 계속 뛰는이지만, 23 게이지 차가운 칼륨 염화물을 포함하는 바늘 (KCl, 30mM) 또는 2,3 - butanedione와 주사기가 monoxime는 (BDM, 10mM)입니다 찔린 뇌실의 후부 기초 영역과 솔루션에 사용됩니다 심장이 심장 확장에 체포 때까지 천천히 챔버에 주입.
- 심장이 제거되면, PBS를 포함하는 주사기는 retrogradely 남아있는 혈액을 제거하는 마음을 씻어 perfuse하는 데 사용됩니다. 급성 연구, reperfusion 기간의 끝에, 그 소년은 폐색의 원래 시점에 다시 출혈도 잡았입니다. 1퍼센트 에반의 파란색을 포함하는 솔루션은 대동맥에 주입합니다. 심장이 추출되면, 그것은 2,3,5 - triphenyltetrazolium 염화물 1 % 안에 incubated, 동등한 두께의 3 섹션으로 transversely 절단하고, morphometric 분석 11 군데입니다. 만성 연구, 마음 그 후 일상적인 절차에 따라 처리 및 임베디드, 정착액에 포장되어 있습니다. 슬라이드는 다음 histologically 스테인드 및 9,10,12 (귀공자, NIH 이미지 J, 또는 이미지 프로 플러스를 사용하여) morphometric 분석을 위해 몇 군데 있습니다.
대표 결과 :
생쥐에서 올바르게, 생존 가격 (남성 : 연령 80~10주, 22-28g, 여성 : 연령 10-12주, 20-26g)는 다음과 같습니다의 90 % 이상 급성 국소 빈혈 / reperfusion 및 허혈성 preconditioning 실험을 통해 영구 동맥 내고 연구 85 %, 그리고 intramyocardial 주사에 대한 약 80 %. 초기 부상이 더 쉽게 보이는 신진 대사 변화보다는 국소 빈혈 / reperfusion의 구조, 경색의 크기 결정과 허혈성 preconditioning 실험 내사가 제공하지 않는 마음을 perfuse됩니다 대동맥에 1% 에반의 파란색 염료를 일으키는 수행하여 (때문에 그림 1A). 심장이 반으로 제거하고 transversely 절단되면, 조직은 경색의 크기 (그림 1B)를 측정하는 2,3,5 - triphenyltetrazolium 염화물의 1 % 용액에 incubated입니다. 영역 귀공자 또는 동일한 배율에서 몇 군데 마이크로 미터를 사용하여 보정 수있는 NIH 이미징 소프트웨어를 사용하여 측정하고 있습니다. 이 번호는 위험 / 좌심실과 경색 위험 11시 크기 / 영역에 영역을 계산하는 데 사용됩니다. 스트레인 차이 신경이 심장 무게, 체중, 또는 비교 목적을 위해 경골 길이 이러한 조치를 정상화로 이동해야 체중과 심장의 크기에 따라서 차이가 발생할 수 있습니다.
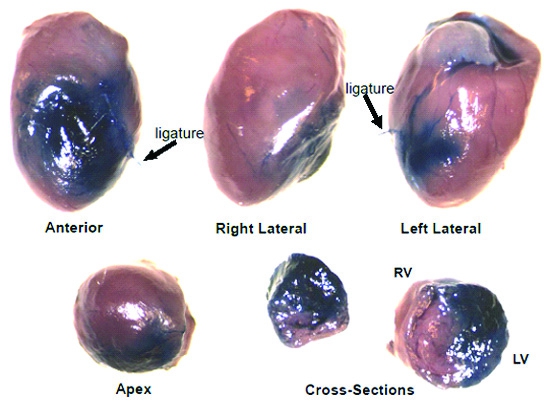
같은 괴사 등 총 구조적 변화에 영구 동맥 내고 결과, 벽면은 밝은, 그리고 챔버 지연. 경색 크기와 영구 폐색 모델 (그림 2A)에서 좌심실, 실내 공간, septal 벽과 왼쪽 심실 무료 벽 두께에 비해 괴사에 대한 치료 및 / 또는 시간의 효과 비교도 귀공자 또는 NIH 이미지를 사용하여 측정할 수 소프트웨어. picrosirius 빨간색 / 빠른 그린 (그림 2B)와 콜라겐의 얼룩은 벽면 stiffening의 8-10의 기능 지표에 연결합니다 insterstitial 섬유증을 측정하는 데 사용할 수 있습니다. 그림 3의 이미지는 영구 동맥 내고 다음과 마음의 국경 지대에 주입 6ul 솔루션 (에반의 파란색)의 분포를 나타냅니다. 그뿐만 아니라 기본 방향으로 또한 transmurally 부상의 방향으로 진행되는지 확인합니다.

그림 1. A. 에반의 블루. 전에 절단하는 대동맥에 주입이 이미지는 마음 (스테인드)와 occluded 지역 (흠없는)의 perfused 영역을 보여줍니다. B. 에반 '급성 국소 빈혈 / reperfusion 상해 다음의 블루와 TTC의 얼룩이. 이것은 unoccluded 지역뿐만 아니라 metabolically 가능한 조직의 TTC의 얼룩 (적색)을 스테인드 청색 색소의 분포를 보여주는 대표적인 이미지 (20x)입니다. 괴사성 지역 얼룩없고 그래서 그들은 (설명) 창백 남아 있습니다.
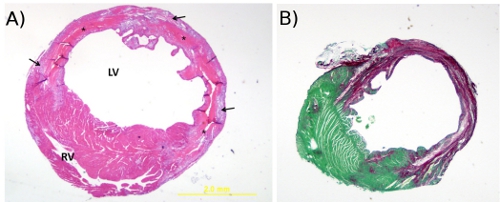
그림 2. A. Hematoxylin 및 eosin는 얼룩.이 포스트 MI (20x) 사일의 경색이 지역을 통해 transversely자를 마우스 심장의 H & E 염색법의 대표 이미지 (20x)입니다. *이 조직 괴사를 나타냅니다, 화살표는 과립 조직 만들기를 가리킨 다음 RV = 우심실과 LV = 좌심실. B. Picrosirius 빨간색 빠른 녹색 얼룩.이가picrosirius 레드 / 사후 MI 사주에서 마우스 마음의 단면의 빠른 녹색 얼룩의 대표적인 이미지 (20x). 세포질의 얼룩의 녹색과 콜라겐 섬유가 빨간색입니다.
6ul intramyocardial 분사 다음 그림 3. 에반의 청색 색소 착색 분포. 이것은 즉시 관상 동맥 내고 (12 배) 다음과 같은 국경 지대에서 6ul intramyocardial 사출 다음 심장에 걸쳐 에반의 청색 색소의 글로벌 및 transmural 분포를 보여주는 대표 이미지입니다.
토론
관상 심장 질환은 epidemiologically과 fiscally 중요한 공중 보건 문제가되고 있습니다. 상당한 기초 연구는 아직 부상과 개조를 진행하는 메커니즘과 방법들이 임상 사용하기 위해 개발해야하는 경우 잠재적인 치료제가 이러한 프로세스를 조절 수 있습니다 이해가 필요합니다. 설치류는 가장 일반적으로 사용 가능한 유전자 변형 생쥐의 다양한 수종이 더 매력적인 모델을 만들 수 있습니다.
마우스와 다른 종 사이의 차이가 있지만, murine 모델에 많은 장점이 있습니다. 간단한 해부 범위 또는 돋보기의 사용을 잘 조명 조건 vasculature가 쉽게 (vasculature에 대한 자세한 총 해부학에 대한, 살토 - 텔레 즈 외 참조하십시오., 2004 13) 볼 수 있습니다. 25g 마우스의 총 혈액 볼륨 미만 2ml 14 년부터 이후 수술 사망률의 위험을 줄이기 위해서는 대형 선박을 severing 피하기 위해 매우 중요합니다. 과도한 출혈이 발생하는 경우, 압력이나 정확하게의 소작의 부드러운 응용 프로그램은 출혈을 멈추게하는 데 사용할 수 있습니다.
이 절차는 또한 다양한 방법으로 수정할 수 있습니다. 예를 들어, 마우스는 isoflurane, 마취제 / xylazine, 또는 나트륨 pentobarbital하고 적절한 선택이 프로토콜 15-18 기간에 의해 결정됩니다를 사용하여 anesthetized 수 있습니다. 발가락 - 핀치 반사는 마취의 깊이에서 가장 일반적으로 사용되는 인덱스입니다. 또한, 장기적인 생존 가능성을 향상시키기 위해, 몇 가지 조사가 치명적인 arrhythmias 19,20 그러나이 최근 급성에서 antiapoptotic 속성을 가지고 표시되었는지 고려해야한다의 발생을 줄이기 위해 같은 lidocaine과 같은 antiarrhythmic 약물을 사용 모델 21. 또한, 포스트 수술 고통을 줄이기 위해 같은 buprenorphine과 같은 진통제는 수술 3,16,17,22,23 후 첫 48 시간 시행하실 수 있습니다. 수술 중 체온을 (특히 이상 프로토콜)을 유지하기 위해 가열 패드와 시리즈의 직장 프로브은 종종 등온 패드 대신 사용됩니다. 영구 폐색 들어, 경색의 크기는 묶인의 위치를 조정하여 수정할 수 있습니다,, 폐색 (S)과 reperfusion (S) 기간은 변경될 수 있습니다 국소 빈혈 / reperfusion 및 / 또는 허혈성 사전 또는 postconditioning에 대한 그리고 intramyocardial 주사 (예 : 세포, 단백질)를, 1-3 주입 위치가있을 수 있으며, 사출 당 볼륨을 15 μl 24까지 수 있습니다. 세포가 주입되는 경우, 바늘의 게이지는 바늘의 내부 직경이 쉬어링 피할 정도로 큰되도록 5,25,26는 세포의 크기에 따라 선택한다 (일반적으로 26-30) 사용됩니다. 수술에 의해 발생한 염증 과정으로 인해 confounds을 피하기 위해, 일부 조사는 수술 후 27-29 어느 시점 닫힌 가슴 마우스의 마음을 막다하고 reperfuse 전 (前) 생체내을 조작하는 올무를 사용하여보고있다. 최근 가오 외. 30 임시 및 영구 폐색이 통풍을위한 필요없이 수행할 수 있으며 몇 연구소가 폐쇄 가슴 intramyocardial 주사 25,31을 수행하기 위해 초음파를 사용하여 시작하는 것으로 나타났습니다.
생쥐에서 관상 동맥을 ligating의 가능성을 보여주는 첫 연구가 1954 32 존스와 올슨에 의해 출판 되었음 때문에, 많은 사람들이이 모델을 채택하고 심근 상해 및 리모델링 3,33-45의 다양한 측면을 연구하기 위해 그것을 수정했습니다. 크기, 생식 능력과 구매 및 유지 보수에 대한 비교적 적은 비용의 관점에서 생쥐의 성격이 종에게 physiologic과 pathophysiologic 연구 광범위한 매력적인 도구를합니다. 생체내의 진보 46-49의 이미징을위한 기술의 소형화뿐만 아니라이 수행하고 대규모 게놈과 proteomics, 약물 검사, 세포 기반 및 / 또는 단백질 요법의 효능뿐만 아니라 결합 biomaterials 50-64을 분석하는 수단으로 유비 쿼터스 또는 조직 특정 유전자 변형이나 돌연변이 / 녹아웃 마우스에서 유전자 조작 여유의 점점 다양한, 심근 경색의 murine 모델은 의심의 여지없이 급성 심장 부상 장기적인 리모델링을 평가에 귀중한 도구가 될 것입니다. 따라서, 안정 reproducibly 이러한 실험을 수행할 수있는에 나무랄 데없는 가치가있다.
공개
감사의 말
난 그들의 경계와 도움을 비교 의학 연구 및 부서를 지원하기 위해 기금을 제공하는 연구 및 졸업 연구학과를 인정하고 싶습니다. 나는 또한 그들의 도움을 그들의 지원과지도에 대한 생리학의학과뿐만 아니라, 내 연구실에서 학생과 기술자를 인식하고 싶습니다. 마지막으로, 내가 마우스 미세을 알게되는 시간 동안 교육 기회에 대한 내 포스트 박사 멘토, 닥터 찰스 E. 머리를 감사하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Long Vanna Scissors | George Tiemann & Co. | 160-159 | |
| Micro Dissecting Scissors | George Tiemann & Co. | 160-161 | |
| Forceps – straight, 1x2 teeth | George Tiemann & Co. | 105-205 | |
| Scalpel handle #3 | George Tiemann & Co. | 105-64 | #10 sterile blade |
| Forceps – half curved serrated | George Tiemann & Co. | 160-19 | |
| Tissue Scissors | George Tiemann & Co. | 105-410 | |
| Castroviejo Needle Holder | Miltex Inc. | 18-1828 | |
| Cook Eye Speculum | Miltex Inc. | 18-63 | |
| Surgipro II 8-0 | Suture Express | VP-900-X | |
| Prolene 6-0 | Suture Express | 8776 | |
| Germinator 500 Bead Sterilizer | Cellpoint Scientific | 65369-1 | |
| Deltaphase isothermal pad | Braintree Scientific, Inc. | 39DP | |
| Hamilton syringe - 25μl | Hamilton Co | 80430 | |
| 30 gauge beveled needle | Hamilton Co | 7803-07 | |
| Ventilator | Kent Scientific | TOPO |
참고문헌
- Reinhard, C. Inbred strain variation in lung function. Mamm Genome. 13, 429-437 (2002).
- Schulz, H. Respiratory mechanics in mice: strain and sex specific differences. Acta Physiol Scand. 174, 367-375 (2002).
- Tarnavski, O. Mouse cardiac surgery: comprehensive techniques for the generation of mouse models of human diseases and their application for genomic studies. Physiol Genomics. 16, 349-360 (2004).
- Klocke, R., Tian, W., Kuhlmann, M. T., Nikol, S. Surgical animal models of heart failure related to coronary heart disease. Cardiovasc Res. 74, 29-38 (2007).
- Murry, C. E. Haematopoietic stem cells do not transdifferentiate into cardiac myocytes in myocardial infarcts. Nature. 428, 664-668 (2004).
- Nussbaum, J. Transplantation of undifferentiated murine embryonic stem cells in the heart: teratoma formation and immune response. Faseb J. 21, 1345-1357 (2007).
- Reinecke, H., Minami, E., Virag, J. I., Murry, C. E. Gene transfer of connexin43 into skeletal muscle. Hum Gene Ther. 15, 627-636 (2004).
- Virag, J. A. Attenuation of Myocardial Injury in Mice with Functional Deletion of the Circadian Rhythm Gene mPer2. Am J Physiol Heart Circ Physiol. , (2008).
- Virag, J. A. Fibroblast growth factor-2 regulates myocardial infarct repair: effects on cell proliferation, scar contraction, and ventricular function. Am J Pathol. 171, 1431-1440 (2007).
- Virag, J. I., Murry, C. E. Myofibroblast and endothelial cell proliferation during murine myocardial infarct repair. Am J Pathol. 163, 2433-2440 (2003).
- Cozzi, E. Ultrafine particulate matter exposure augments ischemia-reperfusion injury in mice. Am J Physiol Heart Circ Physiol. 291, 894-903 (2006).
- Virag, J. A. Attenuation of myocardial injury in mice with functional deletion of the circadian rhythm gene mPer2. Am J Physiol Heart Circ Physiol. 298, 1088-1095 (2010).
- Salto-Tellez, M. Myocardial infarction in the C57BL/6J mouse: a quantifiable and highly reproducible experimental model. Cardiovasc Pathol. 13, 91-97 (2004).
- Diehl, K. H. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21, 15-23 (2001).
- Lichtenberger, M., Ko, J. Anesthesia and analgesia for small mammals and birds. Vet Clin North Am Exot Anim Pract. 10, 293-315 (2007).
- Davis, J. A. Mouse and rat anesthesia and analgesia. Curr Protoc Neurosci. Appendix 4, Appendix 4B-Appendix 4B (2008).
- Flecknell, P. A. Anaesthesia of animals for biomedical research. Br J Anaesth. 71, 885-894 (1993).
- Kolk, M. V. LAD-ligation: a murine model of myocardial infarction. J Vis Exp. , (2009).
- Kinoshita, H. T-type Ca2+ channel blockade prevents sudden death in mice with heart failure. Circulation. 120, 743-752 (2009).
- Mulder, P. Increased survival after long-term treatment with mibefradil, a selective T-channel calcium antagonist, in heart failure. J Am Coll Cardiol. 29, 416-421 (1997).
- Kaczmarek, D. J. Lidocaine protects from myocardial damage due to ischemia and reperfusion in mice by its antiapoptotic effects. Anesthesiology. 110, 1041-1049 (2009).
- Blaha, M. D., Leon, L. R. Effects of indomethacin and buprenorphine analgesia on the postoperative recovery of mice. J Am Assoc Lab Anim Sci. 47, 8-19 (2008).
- Flecknell, P. A. Analgesia of small mammals. Vet Clin North Am Exot Anim Pract. 4, 47-56 (2001).
- Dries, J. L., Kent, S. D., Virag, J. A. Intramyocardial administration of chimeric ephrinA1-Fc promotes tissue salvage following myocardial infarction in mice. J Physiol. 589, 1725-1740 (2011).
- Springer, M. L. Closed-chest cell injections into mouse myocardium guided by high-resolution echocardiography. Am J Physiol Heart Circ Physiol. 289, 1307-1314 (2005).
- Wang, C. C. Direct intramyocardial injection of mesenchymal stem cell sheet fragments improves cardiac functions after infarction. Cardiovasc Res. 77, 515-524 (2008).
- Nossuli, T. O. A chronic mouse model of myocardial ischemia-reperfusion: essential in cytokine studies. Am J Physiol Heart Circ Physiol. 278, 1049-1055 (2000).
- Kim, S. C. Toll-like receptor 4 deficiency: smaller infarcts, but no gain in function. BMC Physiol. 7, 1472-6793 (2007).
- Fazel, S. S. Activation of c-kit is necessary for mobilization of reparative bone marrow progenitor cells in response to cardiac injury. Faseb J. 22, 930-940 (2008).
- Gao, E. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circ Res. 107, 1445-1453 (2010).
- Fujii, H. Ultrasound-targeted gene delivery induces angiogenesis after a myocardial infarction in mice. JACC Cardiovasc Imaging. 2, 869-879 (2009).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Ann Surg. 140, 675-682 (1954).
- Frangogiannis, N. G. The immune system and cardiac repair. Pharmacol Res. 58, 88-111 (2008).
- Dobaczewski, M., Frangogiannis, N. G. Chemokines and cardiac fibrosis. Front Biosci (Schol Ed). 1, 391-405 (2009).
- Willis, M. S., Townley-Tilson, W. H., Kang, E. Y., Homeister, J. W., Patterson, C. Sent to destroy: the ubiquitin proteasome system regulates cell signaling and protein quality control in cardiovascular development and disease. Circ Res. 106, 463-478 (2010).
- Nithipatikom, K., Gross, G. J. Review article: epoxyeicosatrienoic acids: novel mediators of cardioprotection. J Cardiovasc Pharmacol Ther. 15, 112-119 (2010).
- Palaniyandi, S. S., Sun, L., Ferreira, J. C., Mochly-Rosen, D. Protein kinase C in heart failure: a therapeutic target. Cardiovasc Res. 82, 229-239 (2009).
- Michael, L. H. Myocardial ischemia and reperfusion: a murine model. Am J Physiol. 269, 2147-2154 (1995).
- Patten, R. D. Ventricular remodeling in a mouse model of myocardial infarction. Am J Physiol. 274, 1812-1820 (1998).
- Paigen, K. A miracle enough: the power of mice. Nat Med. 1, 215-220 (1995).
- Kogan, M. E., Belov, L. N., Leont'eva, T. A., Zolotareva, A. G. Modeling of myocardial pathology in mice with the surgical methods. Kardiologiia. 17, 125-128 (1977).
- Tarnavski, O. Mouse surgical models in cardiovascular research. Methods Mol Biol. 573, 115-137 (2009).
- Wong, R., Aponte, A. M., Steenbergen, C., Murphy, E. Cardioprotection leads to novel changes in the mitochondrial proteome. Am J Physiol Heart Circ Physiol. 298, 75-91 (2010).
- Dobaczewski, M., Gonzalez-Quesada, C., Frangogiannis, N. G. The extracellular matrix as a modulator of the inflammatory and reparative response following myocardial infarction. J Mol Cell Cardiol. 48, 504-511 (2010).
- Zhao, Z. Q. Inhibition of myocardial injury by ischemic postconditioning during reperfusion: comparison with ischemic preconditioning. Am J Physiol Heart Circ Physiol. 285, 579-588 (2003).
- Thibault, H. Acute myocardial infarction in mice: assessment of transmurality by strain rate imaging. Am J Physiol Heart Circ Physiol. 293, 496-502 (2007).
- Scherrer-Crosbie, M. Three-dimensional echocardiographic assessment of left ventricular wall motion abnormalities in mouse myocardial infarction. J Am Soc Echocardiogr. 12, 834-840 (1999).
- Stypmann, J. Echocardiographic assessment of global left ventricular function in mice. Lab Anim. 43, 127-137 (2009).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. Murine echocardiography and ultrasound imaging. J Vis Exp. , (2010).
- Zimmermann, W. H. Heart muscle engineering: an update on cardiac muscle replacement therapy. Cardiovasc Res. 71, 419-429 (2006).
- Mangi, A. A. Mesenchymal stem cells modified with Akt prevent remodeling and restore performance of infarcted hearts. Nat Med. 9, 1195-1201 (2003).
- Chavakis, E., Koyanagi, M., Dimmeler, S. Enhancing the outcome of cell therapy for cardiac repair: progress from bench to bedside and back. Circulation. 121, 325-335 (2010).
- Mirotsou, M., Jayawardena, T. M., Schmeckpeper, J., Gnecchi, M., Dzau, V. J. Paracrine mechanisms of stem cell reparative and regenerative actions in the heart. J Mol Cell Cardiol. , (2010).
- Fromstein, J. D. Seeding bioreactor-produced embryonic stem cell-derived cardiomyocytes on different porous, degradable, polyurethane scaffolds reveals the effect of scaffold architecture on cell morphology. Tissue Eng Part A. 14, 369-378 (1089).
- Lee, R. J. Stem cells for myocardial repair and regeneration: where are we today. Methods Mol Biol. 660, 1-6 (2010).
- Segers, V. F., Lee, R. T. Protein Therapeutics for Cardiac Regeneration after Myocardial Infarction. J Cardiovasc Transl Res. , (2010).
- Webber, M. J. Capturing the stem cell paracrine effect using heparin-presenting nanofibres to treat cardiovascular diseases. J Tissue Eng Regen Med. 10, (2010).
- Kofidis, T. Novel injectable bioartificial tissue facilitates targeted, less invasive, large-scale tissue restoration on the beating heart after myocardial injury. Circulation. 112, I173-1177 (2005).
- Vunjak-Novakovic, G. Challenges in cardiac tissue engineering. Tissue Eng Part B Rev. 16, 169-187 (2010).
- Guyette, J. P., Cohen, I. S., Gaudette, G. R. Strategies for regeneration of heart muscle. Crit Rev Eukaryot Gene Expr. 20, 35-50 (2010).
- Menasche, P. Cardiac cell therapy: Lessons from clinical trials. J Mol Cell Cardiol. , (2010).
- Ott, H. C., McCue, J., Taylor, D. A. Cell-based cardiovascular repair--the hurdles and the opportunities. Basic Res Cardiol. 100, 504-517 (2005).
- Terrovitis, J. V., Smith, R. R., Marban, E. Assessment and optimization of cell engraftment after transplantation into the heart. Circ Res. 106, 479-494 (2010).
- Nelson, T. J. Repair of acute myocardial infarction by human stemness factors induced pluripotent stem cells. Circulation. 120, 408-416 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유