Method Article
原子間力顕微鏡を用いて組換えDNAとタンパク質の複合体の可視化
要約
プラスミドDNA、細胞質タンパク質、およびDNA -タンパク質複合体の可視化のためのタッピングモード原子間力顕微鏡(AFM)方法が記載されている。方法は、生化学的な操作は、次のAFMイメージングのための試料を調製するための代替的なアプローチが含まれています。特定のタンパク質相互作用領域を含むDNAは、ほぼ生理的緩衝液条件下で観察される。
要約
原子間力顕微鏡(AFM)は、個々のタンパク質、DNA分子、タンパク質 - タンパク質複合体、およびDNA -タンパク質複合体の可視化が可能になります。顕微鏡のカンチレバーの先端にある任意の時点で、基板表面上に載っ高分子の標高を測定するナノスケールのプローブ、ナノメートルからマイクロメートルまでの画像領域を横断する、です。静電気力は緩くランダムな方向の基板に接続し、イメージングを可能にするためにタンパク質、脂質、及び核酸を引き起こす。生成されたデータは、巨大分子が離散的な大きさ( 図1)1,2の三次元粒子として解決する地形図を、似ている。タッピングモードAFMは、DNAやタンパク質などの比較的柔らかい生体のイメージングを可能にするカンチレバーの繰り返し振動を伴います。他のナノスケール顕微鏡技術上のAFMの顕著な利点の一つは、リアルタイムで、ほぼ生理的なバッファリング状態を含む水性緩衝液、で個々のタンパク質と高分子複合体を可視化するために、その相対的な適応性であり、染色や塗装せずにサンプルを撮像する。
ここで示す方法はDNAと緩衝液でimmunoadsorbed転写因子(すなわちグルココルチコイド受容体、GR)( 図2)の画像を説明します。 Immunoadsorbedタンパク質とタンパク質の複合体は、抗体のエピトープと( 図2A)して画像形成されたとの競合によりimmunoadsorbing抗体-ビーズペレットから分離することができる。これは、イメージングの前に興味のある生体分子の生化学的な操作が可能になります。一度精製、DNAとタンパク質を混合することができ、結果として相互作用の複合体は、同様に撮像することができます。マイカのDNAの結合は、Ni 2 +またはMg 2 +、まだタンパク質の活性を維持するサンプルバッファに追加できるように二価陽イオン3を 、必要になります。同様のアプローチを用いて、AFMは、個々のDNA鎖に結合したRNAポリメラーゼ4と修復酵素5、など、個々の酵素を、視覚化するために利用されている。これらの実験は、分子レベルで起きている蛋白質 - 蛋白質とDNA -タンパク質生物物理学的相互作用の重要な洞察を提供しています。 AFMによるイメージング、個々の高分子粒子は、粒子の均一性を決定するためと、画像化された粒子の構成成分の物理的な配置を特定するのに役立ちます。本方法は、GRがバインドできるGR -シャペロンタンパク質複合体の1,2とDNA鎖の可視化のために開発されましたが、それはさまざまなソースからのイメージングDNAとタンパク質サンプルに広く適用することができます。
プロトコル
1。汚染のないイメージを作成するDNAとタンパク質試料の準備
- 適当な水性緩衝液中でイメージ化し、場所に生体分子を分離します。撮像されるタンパク質は、液体クロマトグラフィー6を用いて精製することが、免疫吸着は抗体とペレット1,2の除去、またはProfinity正確な精製とタグの除去7( 図2A)が続きます。ミニプレップ精製( 図2B)によって撮像されるDNA分子を分離します。
- SDS - PAGEとウェスタンブロッティングを用いて画像化するタンパク質サンプルの組成と純度を確認してください。 DNAの場合は、制限消化とアガロースゲル電気泳動を完了することによって、シーケンスや純度を確認してください。
- マイカにサンプルの遵守を促進するためにAFM吸着バッファーでサンプルをインキュベートする。タンパク質サンプルの場合は、10mMのHEPES緩衝液を使用することができます。追加の低イオン強度塩または他の因子も同様に追加される可能性があります。 DNAサンプルの場合は、マイカ基板に吸着を促進するための二価カチオン(例えば、Mg 2 +のまたはNi 2 +)が含まれます。 DNAに適したのMg 2 +を含む緩衝液は10mMトリス、pH7.5の10 mMのNaCl、2mMのMgCl 2 3です。代替のNi 2 +、バッファは、10mMのHEPES、pH6.8の、10mMのNiCl 2です。
- 吸着バッファーで5μg/ mlの濃度にサンプルを希釈する。軽く混合します。顕微鏡が準備されている間に氷上で保存する。
2。取付AFMプローブ
- 対応するカンチレバーのインストールのドッキングステーションに液体セルプローブホルダを置きます。
- イメージングに使用する鋭い窒化レバー(SNL)プローブの長い、太いカンチレバーを('B'カンチレバーと呼ばれる)を探します。慎重に先端が垂直に保つように、液体セルプローブホルダに転送します。テクニカルノート:任意の高さからそれをドロップすると、カンチレバーまたは先端を損傷または破壊可能性があるため、プローブは、転送中に細心の注意を払う必要があります。 microlever SNL(MSNL)プローブは、SNLのプローブの代替として使用することができます。
- ドッキングステーションからプローブホルダを取り外し、それを調べて、正しく液体セルプローブホルダに装着されて確保するために光学顕微鏡下でカンチレバーを調べます。
- 慎重にローレットヘッドのクランプねじを締めて、楽器の蟻のアセンブリからのAFMヘッドを取り外します。テクニカルノート:AFMヘッドを操作しながら、細心の注意を払っても、短い距離(蟻のアセンブリ内に正しく取り付けられていない場合など)から、それをドロップするように、支払われなければ、実質的な損傷を与えることがあります。
- AFMヘッドを逆さにしてしっかりとAFMヘッドのベースで4ピンの上に液体セルプローブホルダを押してください。慎重に楽器の蟻のアセンブリにAFMヘッドを返す。測定器にAFMヘッドを固定するローレットヘッドのクランプネジを離します。
3。 、カンチレバーの先端の位置のレーザーを揃え、および光検出器の調整
- AFMの測定器ソフトウェアを使用して、オンボード光顕微鏡のノブを移動することによって、カンチレバーの先端を探します。必要に応じて先端の識別を向上させるために、顕微鏡の照明を調整します。測定器ソフトウェアに表示される十字線の近接にカンチレバー先端の終わりをもたらす。
- ソフトウェア上で光学系のコントローラーの上矢印と下矢印を調整することで、焦点にカンチレバーの先端をもたらす。光学系を調整しながらゆっくりと(S)またはミディアム(M)の速度を使用してください。
- レーザーの調整ノブを使用して、カンチレバーの先端にレーザーの位置を合わせます。赤色レーザーのドットが白の照射スポットの内側になるまで調整ノブを移動します。レーザーをカンチレバーの先端に配置されるまで、ジグザグなパターンを用いてカンチレバーアームに沿ってトレースします。正しく揃うと、強い反射スポットは、AFMヘッドのフロントウィンドウに表示されます。
- 中央AFMヘッドの光検出器のノブを調整することにより、光検出器。これにより、機器のソフトウェアの光検出器のディスプレイの十字のレーザードットを整列します。観測された信号の合計は約4〜6にする必要があります。
4。ポジショニングAFMヘッドとチューニングのカンチレバー
- AFMホルダープレートの上に磁化された試料ホルダーに金属原子間力顕微鏡の試料ディスクに接続されたマイカの新鮮劈開シートを置きます。この設定は、イメージングの前にステップ1で調製したDNAまたはタンパク質サンプルをAFMヘッドを配置するために使用されます。
- テクニカルノート:磁化された試料ホルダーと液晶セルのプローブホルダは、メカニズムとプローブホルダーを固定している他のサンプルよりも厚いです。マイカ - サンプルホルダーアセンブリとAFMヘッドとの間の不十分なクリアランスが現在ある場合は、機器のソフトウェアで数回を撤回アイコンを選択することにより、AFMヘッドを上に移動。
- 試料ディスクを初期イメージングのために配置されるようにAFMホルダープレートを回転させます。マイカ基板をAFMヘッドの下を中心にされていることを確認します。
- に向かってAFMヘッドを下に移動測定器ソフトウェアの焦点面のコントロールを使用して、マイカ - 試料ディスクの表面。 Zモーターの培地(M)の速度を選択し、AFMヘッドはマイカ上に約2mmになるまで表面に向かって継続する。この時点では、プローブと表面(先端のクラッシュと呼ばれる)between急激な接触を避けるためにゆっくりと(S)Zモーターの回転速度を使用するように切り替える。
- 雲母表面や先端の反射で異なる機能がフォーカスされるまで近いマイカ基板の表面にプローブを移動するために進んでください。測定器ソフトウェアからアイコン:"に焦点を当てて"使用して表面と先端反射焦点面を切り替えます。
- 測定器ソフトウェアから曲のアイコンを選択して、カンチレバーを調整してください。推奨SNLとMSNLのカンチレバープローブの共振周波数は20〜60 kHzです。オフセット5%のピークを選択してください。テクニカルノート:適切なカンチレバーのチューニングは十分なサンプルのイメージングのために不可欠です。
5。イメージング雲母の試料表面
- マイカの表面にプローブをかけます。 10μmとスキャンレートは1Hzまでに最初のスキャンサイズを設定します。積分ゲインと比例ゲインは、最初はそれぞれ、0.2〜0.4に設定することができます。トレースを持つとリトレーススキャンがほぼ重なるために、必要に応じてゲインを調整します。振幅の設定値を小さくすると、プローブとマイカ間の相互作用を増加させると関与を保証します。
- 10μmのフィールドの完全なスキャンイメージをキャプチャします。 1、5にサイズをスキャンし、0.5μmの各フィールドの完全な画像をキャプチャ減少。必要に応じてゲインとスキャンの速度を調整します。雲母表面の画像をキャプチャするDNAとタンパク質含有試料との比較のためにベースラインを提供します。
- 測定器ソフトウェア上で外すアイコンをシングルクリックするだけでプローブを外します。
6。興味のイメージングの生体分子
- ゆっくりとステップ1で調製したDNAやタンパク質試料を混合し、画像化されたマイカの表面にそれをロードするための準備。新鮮な吸着バッファ(最終サンプルの濃度= 0.5μg/ ml)を45μlを調製したサンプルの5μlを混ぜる。
- 慎重に直接マイカの表面に0.5μg/ mLとなる生体分子を含む溶液50μlを加える。プローブやAFMヘッドを移動せずにこれを行うと、試料溶液を確保するには(ただし、ピペットチップ)プローブと接触しています。
- 一時停止5分は、サンプル中の生体分子がマイカ表面に付着できるようにする。
- 5分の終了時、ピペットピペットチップとプローブ、AFMヘッド、またはマイカを触れないでするように注意して液体セルプローブホルダに吸着バッファの追加の50〜100μL。これは、メニスカスを形成し、AFMは流体でモードの画像をタップを可能にする。 図3は、流体セル、カンチレバー、試料、試料ホルダー、及びメニスカスの最終的な配置を示しています。
- 光検出器を再調整し、必要に応じてカンチレバーにレーザーを再調整してください。テクニカルノート:プローブ先端とレーザーのアライメントを表示するには、プローブホルダーにサンプルバッファーを加えることによって引き起こされる回折パターンが原因で複雑になっています。必要に応じて手動で、カンチレバーを再調整。
- 測定器ソフトウェアを使用してプローブを再係合する。垂直偏向、積分ゲイン、および必要に応じて比例ゲインを調整します。これは雲母のセクションが追加する前にサンプルやキャプチャ画像に即座にスキャン再イメージングのプロセスを開始します。
- 関心領域を識別するために、(500ナノメートル-10μm)のスキャンサイズを増やします。ズームインと画像解像度を向上させるために0.5 Hzでは、スキャン速度を減少させる
- イメージングが完了すると、測定器ソフトウェアのアイコンを撤回数回を選択することにより、プローブを外します。分解液体セルまたは試料ディスクの前に、AFMヘッドと試料ディスクとの間のスペースを確保してください。
- 徹底的に残留吸着バッファが蒸発するように形成される塩の結晶を防止するために蒸留水で液体セルプローブホルダと試料ディスクをすすぐ。圧縮空気で乾燥した。
7。代表的な結果:
AFM像の例を図4に示す。マイカ基板(A)は、DNAとタンパク質が吸着することができるその上に分子的に平坦な表面を提供する。前の生体分子試料のイメージングマイカは、画像のノイズの負の制御と評価しています。また、カンチレバーが適切に調整され、後続のサンプル画像が正しく行われる保証のレベルを提供します。二本鎖プラスミドDNA(B、D)、推定的にスーパーコイルは、容易に以前に平凡マイカ基板上に堆積し、その非対称な外観と均一によって識別されます。控えめな粒子サイズ(C、E)のタンパク質複合体はまた、マイカ基板から一意に区別することができる。粒径の違いは、サンプルの不均一性を示し、近似タンパク質複合体の化学量論や生化学的活性に役立ちます。プロの一般的な斜めの形状と一貫性のある方向タンパク質は予想どおりランダムにマイカ基板上に配向であるようにパネルCで観察TEINの粒子は、イメージングのアーティファクトです。観測されたアーティファクトの原因としては、物理的な先端異常やスキャン速度の速すぎるにおけるAFM像である。先端の畳み込みが( 図1Bに示す)は、x軸とy軸の絶対的な長さの測定の計算を防止しながら、高さの測定(z軸)との相対的なxとyの測定値は、撮像された生体分子の生物物理学的特性を推定するにもかかわらず役に立つかもしれません。
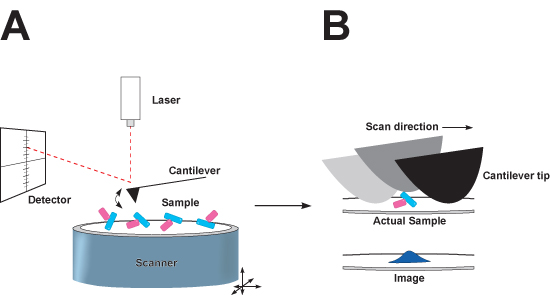
図1:モード原子間力顕微鏡(AFM)をタップの模式図。 、顕微鏡。カンチレバーの終わりにそれがどの生体分子複合体の吸着へのマイカ基板の表面上を走査するように上下に振動する鋭い先端です。スキャナは、xおよびy方向に移動すると、レーザービームは、それが上に座って生体分子複合体の上を通過するように先端が移動する垂直(z)は距離をマッピングする位置に敏感なフォトダイオード検出器の上にカンチレバーの背面から反射され、マイカ。先端のコンボリューションによって引き起こされるxとy方向の画像のBの歪み。従来の窒化ケイ素の先端の公称半径は、撮像すべき粒子よりも大きいです、そして先端の接触試料の端を横断面をとして。画像化されたxとy方向の大きい方を表示される粒子ではなく、z方向の先端のコンボリューションの結果。この効果は小さく、公称先端半径のヒントの使用を最小限に抑えることができます。

図2:immunoadsorbedタンパク質とDNAのサンプル調製のイラスト。 immunoadsorbed GRの、リリースモノクローナル抗体(mAb) - プロテインA -セファロース(PAS)ペレットから•HSP70タンパク質複合体。 mAbのエピトープを含むペプチドとimmunopelletをインキュベートすることは複雑なのAFMによる上清および可視化から収集できるように、ペレットからGR•HSP70タンパク質複合体の放出を容易にするでしょう。 B、AFMイメージングのためのDNAの調製は、二価陽イオン吸着バッファを使用する必要があります。二価陽イオンは、マイカ基板のためのDNAの親和性を向上させます。

図3:AFMヘッド、液晶セルのプローブホルダ、サンプル、試料ホルダー、およびバッファのメニスカスの最終的な配置。ピペットチップとAFMヘッド、液体の呼び出し、およびマイカ基板間の物理的接触を避けるために、マイカ基板上にサンプルと追加のバッファを堆積する際、注意する必要があります。 B、試料ディスクから液体セルプローブホルダにAの倍率バッファのメニスカスのスパン。
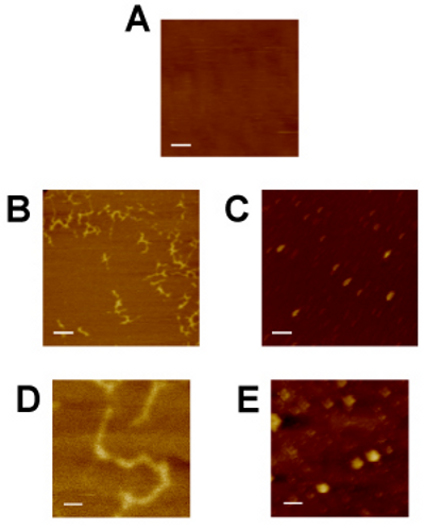
図4:マイカ基板の原子間力顕微鏡()、緩衝液で2xGal4 - 2xGRE - lucifereaseプラスミドDNA 8(B、D)、およびGR•HSP70タンパク質複合体(C、E)。マイカは、DNAとタンパク質の視覚化と比較して、コントロールのイメージとして機能します。 GR•HSP70蛋白質複合体は、モノクローナル抗体の競合抗体を(図2Aに図示)を用いて抗体 - ビーズペレットから放出してHSP70とでプライミングGRの免疫吸着することにより調製した。 DNAは、従来のプラスミドミニプレップで調製した。パネルA、B、およびCは、パネルDとEは、(スケールバー= 40 nm)のものとして、同等の倍率(スケールバー= 200 nm)のです。
ディスカッション
AFMは、リアルタイムでの水とほぼ生理的緩衝液中の画像の個々のコーティングされていない生体分子のできるユニークな顕微鏡技術を提供します。これは、個々のタンパク質とDNA分子だけでなく、多タンパク質複合体とタンパク質- DNA複合体の可視化が可能になります。 AFMによるイメージングの高分子粒子は、サンプルの均一性を評価するための、観測された粒子の構成成分の物理的な配置を特定するのに役立ちます。個々の高分子粒子を観測するこのアプローチは、関心の現在の10 3〜10 11個々の生体分子複合体を表す重要な総括的データを提供するような免疫沈降法、ポリアクリルアミドゲル電気泳動、およびサイズ排除カラムクロマトグラフィー等の一般的な生化学的方法、、に有用な補助することができますで与えられています。
多タンパク質複雑な化学量論、生体分子の相互作用、および補因子の要件への研究は、すべての原子間力顕微鏡を用いて検討することができます。ここで紹介する手法は、関心のある特定の生物物理学的な質問に対応するために適応させることができます。たとえば、バッファを交換可能な液体セルプローブホルダを使用して、それは蛋白質複合体形成のためのアッセイの補因子の要件に可能となります。撮像されている間、DNA -タンパク質のアセンブリであっても、ほぼリアルタイムとで形成され、解離することができます。 DNAは、興味のある特定のシーケンスを生成(推定応答要素または新規タンパク質結合配列など)を、仮説結合タンパク質と混合し、分子間相互作用の直接的な証拠を提供するために撮像することができます。
乾燥したサンプルはむしろ水溶液中のサンプル、および直鎖DNAのスタンドとクローズドサークルのDNAプラスミドこの方法3,9でイメージングされている両方よりも利用している場合はタッピングモードAFMイメージングは、実質的に少ない複雑です。ここで紹介する方法は、より生理的なイメージング環境を提供するために緩衝液でサンプルを利用しています。イメージング、タンパク質の他の注目に値する方法はまた、フィールド赤外線顕微鏡ニア10を含め、検討する必要があります。 AFMと協同して免疫吸着の補完的な使用は、十分に確立された生化学的手法を用いて、タンパク質複合体の無数を準備する機会を提供し、immunoadsorbing抗体 - ビーズペレットから放出以下、それらを可視化する。例えば、immunoadsorbed GRは、複雑な大きさと化学量論を推定するために、このアプローチを使用して2 HSP70分子シャペロンタンパク質1と同様にダイニンモーター蛋白質との関連付けについてアッセイされています。粒径と生物物理学的特徴(例えば剛性)AFM画像化された試料11,12で観察された生体分子の同一性を確かめるのに便利でした。それは、ターゲットの生体分子が存在する場合、そのターゲットに結合し、粒子サイズの増大を引き起こす相互作用する生体分子(リガンドまたはモノクローナル抗体など)、を添加することにより生体分子のアイデンティティを確認することも可能です。
開示事項
謝辞
この作品は、厚生グラントGM086822の国民の協会によって資金を供給された。著者は、博士に感謝します。彼らの専門的技術支援のためのアレックパホーモフ&ポールウォーレス(ワシントンのナノテクノロジーの利用施設の筑波大(NTUF))とアンドレアスレイド(ブルカーAXS)。 DNA AFMイメージングは、大学で行われた。ワシントンNTUF、国家ナノテクノロジー基盤ネットワークのメンバーの。 2xGal4 - 2xGRE - lucifereaseプラスミド好意博士キース山本(カリフォルニアの筑波大、サンフランシスコ)の研究室によって提供されていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
|---|---|---|---|
| 寸法3100 | ブルカー | 寸法3100 | |
| 次元の流体セル | ブルカー | DTFML - DD - HE | |
| シャープ窒化レバー(SNL)窒化ケイ素AFMプローブ | ブルカー | SNL - 10 | |
| Microlever鋭い窒化レバー(MSNL)窒化ケイ素AFMプローブ | ブルカー | MSNL - 10 | |
| ナノスコープAFMの測定器ソフトウェア | ブルカー | 004-132-000 | |
| 金属原子間力顕微鏡の試料ディスク | テッドペラ | 16208 | |
| グレードV1マイカディスク、12 mm径 | テッドペラ | 50から12 |
参考文献
- Murphy, P. J. M. Visualization and mechanism of assembly of a glucocorticoid receptorhsp70 complex that is primed for subsequent Hsp90-dependent opening of the steroid binding cleft. J Biol Chem. 278, 34764-34773 (2003).
- Harrell, J. M. Evidence for glucocorticoid receptor transport on microtubules by dynein. J Biol Chem. 279, 54647-54654 (2004).
- Pastre, D. Adsorption of DNA to mica mediated by divalent counterions: a theoretical and experimental study. Biophys J. 85, 2507-2518 (2003).
- Guthold, M. Direct observation of one-dimensional diffusion and transcription by Escherichia coli RNA polymerase. Biophys J. 77, 2284-2294 (1999).
- Petrucco, S., Volpi, G., Bolchi, A., Rivetti, C., Ottonello, S. A nick-sensing DNA 3'-repair enzyme from Arabidopsis. J Biol Chem. 277, 23675-23683 (2002).
- Murphy, P. J. M., Morishima, Y., Kovacs, J. J., Yao, T. P., Pratt, W. B. Regulation of the dynamics of hsp90 action on the glucocorticoid receptor by acetylation/deacetylation of the chaperone. J Biol Chem. 280, 33792-33799 (2005).
- Ruan, B., Fisher, K. E., Alexander, P. A., Doroshko, V., Bryan, P. N. Engineering subtilisin into a fluoride-triggered processing protease useful for one-step protein purification. Biochemistry. 43, 14539-14546 (2004).
- Meijsing, S. H., Elbi, C., Luecke, H. F., Hager, G. L., Yamamoto, K. R. The ligand binding domain controls glucocorticoid receptor dynamics independent of ligand release. Mol Cell Biol. 27, 2442-2451 (2007).
- Shen, X. C. A simple and effective sample preparation method for atomic force microscopy visualization of individual DNA molecules in situ. Mol Biol Rep. 38, 965-969 (2010).
- Paulite, M., Fakhraai, Z., Akhremitchev, B. B., Mueller, K., Walker, G. C. Assembly, tuning and use of an apertureless near field infrared microscope for protein imaging. J Vis Exp. , (2009).
- Cretu, A., Castagnino, P., Assoian, R. Studying the effects of matrix stiffness on cellular function using acrylamide-based hydrogels. J Vis Exp. , (2010).
- Brunger, A. T., Weninger, K., Bowen, M., Chu, S. Single-molecule studies of the neuronal SNARE fusion machinery. Annu Rev Biochem. 78, 903-928 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved