Method Article
Визуализация рекомбинантных ДНК и белковых комплексов с помощью атомно-силовой микроскопии
В этой статье
Резюме
Нажав режиме атомно-силовой микроскоп (АСМ) метод визуализации ДНК плазмиды, цитоплазматические белки и ДНК-белковых комплексов описан. Метод включает в себя альтернативные подходы для подготовки образцов для АСМ-изображений следующих биохимических манипуляций. ДНК, содержащей конкретных регионах взаимодействующих белков наблюдаются в ближнем физиологических условиях буфера.
Аннотация
Атомно-силовая микроскопия (АСМ) позволяет визуализировать отдельных белков, молекулы ДНК, белок-белковых комплексов, и ДНК-белковых комплексов. На конце кантилевера микроскопа является нано-зонда, который пересекает участки изображения от нанометров до микрометров, измерения высоты макромолекул отдыхая на поверхности подложки в любой заданной точке. Электростатические силы вызывают белки, липиды и нуклеиновые кислоты, чтобы свободно прикрепляться к субстрату в случайной ориентации и разрешения изображений. Сгенерированные данные напоминают топографические карты, где макромолекул решения в виде трехмерных частиц дискретных размеров (рис. 1) 1,2. Нажатие режиме АСМ включает в себя повторяющиеся колебания кантилевера, который позволяет изображения относительно мягких биоматериалы, такие как ДНК и белки. Одним из значительных преимуществ по сравнению с другими АСМ наноразмерных микроскопии является его относительная приспособленность к визуализации отдельных белков и макромолекулярных комплексов в водных буферов, в том числе почти физиологическим буфером условиях, в режиме реального времени, и без окрашивания или покрытия образца для включения в образ.
Метод, представленный здесь описывает изображения ДНК и immunoadsorbed фактор транскрипции (то есть глюкокортикоидных рецепторов, GR) в буферном растворе (рис. 2). Immunoadsorbed белков и белковых комплексов может быть отделено от immunoadsorbing антитело-шарик шарик-за конкуренции с эпитопом антитела, а затем в образ (рис. 2а). Это позволяет для биохимических манипуляций биомолекул интереса до визуализации. Как только очищенную, ДНК и белки могут быть смешанными, и результирующая комплекс взаимодействующих могут быть отображены также. Связывание ДНК слюды требует двухвалентных катионов 3, таких как Ni 2 + или Mg 2 +, которые могут быть добавлены в образце буфера при этом поддерживать белок деятельности. Используя аналогичный подход, АСМ была использована для визуализации отдельных ферментов, в том числе РНК-полимеразы 4 и ремонт фермента 5, связанные с отдельными нитей ДНК. Эти опыты значительно углубить понимание белок-белковых и ДНК-белковых взаимодействий биофизических происходит на молекулярном уровне. Изображения отдельных частиц макромолекулярных с AFM могут быть полезны для определения однородности частиц и для выявления физическое расположение составляющих компонентов из отображаемого частиц. Хотя настоящий метод был разработан для визуализации GR-шаперонов белковые комплексы 1,2 и ДНК которых GR может связать, он может быть применен в широком смысле ДНК и белка изображений образцов из различных источников.
протокол
1. Подготовка ДНК и белков образцы для включения в образ свободной от загрязнений
- Изолировать биомолекул для включения в образ и поместить в подходящий водный буфер. Белки для включения в образ может быть очищен методом жидкостной хроматографии 6, иммуноадсорбции последующим удалением антител и гранул 1,2, или Profinity точный очищение и удаление тегов +7 (рис. 2А). Изолировать молекулы ДНК для включения в образ по miniprep очистки (Рис. 2В).
- Подтверждение состава и чистоты белка образцы для включения в образ использованием SDS-PAGE и западных промокательной. Для ДНК, подтверждают последовательность и чистоту, заполнив ограничение переварить и агарозном гель-электрофореза.
- Инкубируйте образцы в АСМ адсорбции буфер для содействия соблюдению образца к слюды. Для образцов белка, 10 мМ HEPES буфере может быть использован. Дополнительная низкой ионной силой солей или других кофакторов может быть добавлена также. Для образцов ДНК, включают двухвалентных катионов (например, Mg 2 + или Ni 2 +) для содействия адсорбции на подложку слюды. Подходящей Mg 2 +-содержащих буфер для ДНК 10 мМ Трис, рН 7,5, 10 мМ NaCl, 2 мМ MgCl 2 3. Альтернативные Ni 2 + буфер 10 мМ HEPES, рН 6,8, 10 мМ NiCl 2.
- Развести образца до концентрации 5 мкг / мл в буфере адсорбции. Аккуратно перемешайте. Магазин на льду в то время как микроскоп готовится.
2. Монтаж АСМ зонда
- Место жидкости держатель зонда ячейки на соответствующие станции установки стыковки консоли.
- Найдите длинный, толстый консольные (именуемые консольные 'B') резкого нитрида рычаг (SNL) зонд, который будет использоваться для работы с изображениями. Аккуратно перенести его в жидком держатель зонда клетка, гарантируя, что наконечник остается в вертикальном положении. Техническое примечание: особая осторожность должна быть оплачена в то время как зонд находится в пути, так как, положив его с любой высоты может привести к повреждению или уничтожению консольные или совет. Microlever SNL (MSNL) зонда может быть использован как альтернатива зонд SNL.
- Удалите держатель зонда с док-станцией и изучить консольные под световым микроскопом, чтобы убедиться, что он не поврежден и правильно помещен в жидкий держатель зонда клетки.
- Осторожно выньте голову АСМ из сборки ласточкин хвост инструмент, затянув накаткой винтовых зажимов голову. Техническое примечание: особая осторожность должна быть оплачена при управлении голову AFM, как удаление его из даже короткие расстояния (например, если не установлен правильно в ласточкин хвост сборки) может нанести существенный ущерб.
- Обратить голову АСМ и твердо выдвиньте жидкости держатель зонда ячейку на четыре контакта у основания головы АСМ. Осторожно вернуть голову АСМ в сборку ласточкин хвост инструмента. Выпуск накаткой винтовым зажимом для крепления головы голову АСМ в прибор.
3. Доступ к кантилевера, выравнивая лазер, фотоприемник и корректировки
- Использование программного обеспечения инструментом АСМ, найдите кантилевера путем перемещения ручки борту световой микроскоп. Отрегулируйте освещение микроскоп, если необходимо совершенствовать наконечник идентификации. Принесите конце кантилевера в непосредственной близости от перекрестия отображается на приборной программного обеспечения.
- Принесите кантилевера в фокусе, регулируя стрелки вверх и вниз контроллера оптики на программное обеспечение. Используйте медленно (S) или средний (М) скорости во время настройки оптики.
- Совместите лазерный кантилевера использованием лазерной ручки регулировки. Перемещение ручек настройки, пока красная точка лазера внутри белое пятно подсветки. Трассировка по консольной подставку, используя зигзагообразный узор, пока лазер расположен на острия кантилевера. При правильном краю, сильным местом отражение появится в лобовое стекло головой АСМ.
- Центр фотодетектор, регулируя фотоприемника ручки на голову АСМ. Это позволит выровнять лазерная точка в перекрестье фотоприемника отображения инструмент программного обеспечения. Наблюдается суммарный сигнал должен быть примерно 4-6.
4. Позиционирование АСМ голову и настройка консольные
- Место свежесколотой листа слюды придает металлический диск образца АСМ на намагниченный держатель образца на вершине пластины держателя АСМ. Эта установка будет использоваться для позиционирования головы АСМ до визуализации ДНК или белка образца, приготовленного в шаге 1.
- Техническое примечание: намагниченный держатель образца и жидких держатель зонда ячейки толще, чем у других образцов механизмов и крепления датчика владельцев. Если в настоящее время недостаточно зазор между слюды-образец сборки держателя и АСМ головы, перемещение головки AFM до выбрав вывести значок на программный инструмент в несколько раз.
- Поверните пластину держателя АСМ так образца диск позиционируется для начальной обработки изображений. Обеспечить подложки слюды по центру под голову АСМ.
- Перемещение головы вниз к AFMповерхности слюды-образца диск с помощью контроля фокус поверхности инструмента программного обеспечения. Выбор среды (М) скорости на Z мотор, и продолжать в направлении поверхности, пока голова АСМ составляет около 2 мм выше слюды. В это время переключиться на использование медленно (S) Z скорость двигателя, чтобы избежать резкого контакта между зондом и поверхностью (называют сбой совет).
- Приступить, чтобы переместить зонд ближе к поверхности подложки слюды, пока различные функции на поверхности слюды или кончиком отражение находятся в фокусе. Переключение между поверхностью и кончиком отражение фокальных плоскостях с помощью "направлена на:" иконку из инструментов программного обеспечения.
- Выберите настройки иконку из инструментов программного обеспечения и настройки консоли. Резонансная частота рекомендуется SNL и зондов MSNL кантилевер 20-60 кГц. Выберите 5% пик смещения. Техническое примечание: Адекватная настройка консольные имеет важное значение для адекватного изображения образца.
5. Изображений поверхности образца слюды
- Привлекать зонда на поверхность слюды. Установить первоначальный размер сканирования до 10 мкм и скорости сканирования до 1 Гц. Интегральный коэффициент усиления и пропорционального усиления может быть изначально настроены на 0,2 и 0,4, соответственно. Отрегулируйте доходы по мере необходимости, чтобы иметь следов и повторить проверку примерно совпадают. Уменьшение амплитуды уставка увеличится взаимодействия между зондом и слюды и обеспечения взаимодействия.
- Захват изображения полного сканирования 10 мкм поле. Уменьшение размера сканирования до 5, 1 и 0,5 мкм и захвата полного изображения для каждого поля. Отрегулируйте прибыли и скорости сканирования по мере необходимости. Захват изображения поверхности слюды обеспечивает основу для сравнения с ДНК и белок-содержащих образцов.
- Отрыв зонд с помощью одного нажатия на разъединение значок на программный инструмент.
6. Изображений биомолекул интерес
- Аккуратно перемешайте ДНК или белка образца, приготовленного в шаге 1 и подготовить, чтобы загрузить его на отображаемой поверхности слюды. Смешайте 5 мкл подготовленного образца с 45 мкл свежей буфера адсорбции (конечная концентрация образца = 0,5 мкг / мл).
- Аккуратно добавить 50 мкл 0,5 мкг / мл биомолекулы раствор, содержащий непосредственно на поверхности слюды. Делайте это без перемещения зонда АСМ или голову, и обеспечить пример решения (но не пипетки наконечник) вступает в контакт с зондом.
- Пауза 5 минут, чтобы дать биомолекул в образце придерживаться поверхности слюды.
- По окончании 5 минут, пипетки дополнительные 50-100 мкл буфера адсорбции в жидкой держатель зонда ячейки осторожны, чтобы не задеть зонд, АСМ голову, или слюда с пипеткой чаевые. Это будет форма мениска и позволяют АСМ нажав режим изображения в жидкости. На рисунке 3 показана окончательная договоренность жидкости клетки, консольные, образец, держателя образца и мениска.
- Отрегулируйте фотоприемника и перестраивать лазер консольные по мере необходимости. Техническое примечание: просмотр наконечник зонда и лазерной центровки осложняется из-за дифракции вызванных добавив пример буфера в зонд держателя. Вручную перенастроить кантилевера, если это необходимо.
- Повторное участие зонд использованием инструментов программного обеспечения. Отрегулируйте вертикального отклонения, интегральные усиления и пропорциональный коэффициент усиления по мере необходимости. Это позволит начать процесс повторной визуализации разделе слюды отсканированы непосредственно перед добавлением образца и захвата изображений.
- Увеличение размера сканирования (500 нм-10 мкм) для выявления областей, представляющих интерес. Zoom-в и уменьшить скорость сканирования до 0,5 Гц для улучшения разрешения изображения
- После завершения визуализации, отрывайся зонд, выбрав вывести значок на программный инструмент в несколько раз. Обеспечить достаточный зазор между головкой AFM и образец диска перед разборкой жидкости ячейки или образец диска.
- Тщательно промойте жидкости держатель зонда клеток и образец диска с дистиллированной водой, чтобы предотвратить кристаллы соли от формирования как остаточные буфера испаряется адсорбции. Сухой сжатым воздухом.
7. Представитель Результаты:
Примеры изображений АСМ, представлены на рисунке 4. Слюда субстрата () обеспечивает молекулярно плоскую поверхность, на которую ДНК и белка может адсорбировать. Изображений слюды до биомолекулы образцы обеспечивает отрицательный контроль и оценка шума изображений. Она также обеспечивает уровень уверенности в том, что консольные правильно настроены и последующей визуализации образца будет успешным. Двухцепочечной ДНК плазмиды (B, D), предположительно суперспиральной, это легко определить по его внешнему виду и асимметричные равномерное сдаче на ранее ничем не примечательный слюды подложки. Белковых комплексов дискретных размеров частиц (С, Е) также однозначно отличить от подложки слюды. Различия размеров частиц указывают на неоднородность образца, а также может быть полезно для аппроксимации белкового комплекса стехиометрии или биохимической активности. Общие диагональные формы и последовательной ориентации пробелка частиц, наблюдаемых в Группе С изображениями артефакт, как белки бы ожидать ориентироваться на подложку слюды в произвольном порядке. Возможные причины наблюдаемого артефакт физической аномалией или наконечник АСМ изображения при слишком быстром о скорости сканирования. Хотя кончик свертки (показано на рисунке 1В) предотвращает абсолютной расчеты измерения длины осей х и у, измерения высоты (ось г) и относительная х и у измерения могут, тем не менее полезны для оценки биофизических свойств отображаемого биомолекул.
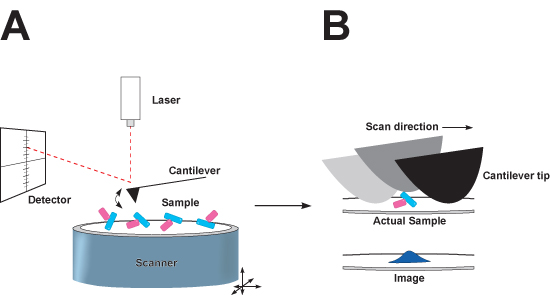
Рисунок 1: Схематическое представление нажав режиме атомно-силовой микроскопии (АСМ). , Микроскоп. В конце кантилевера острый кончик, который колеблется вверх и вниз, как он сканирует по поверхности подложки слюды которой адсорбируются биомолекулярных комплексов. Как сканера движется в направлениях х и у, лазерный луч отражается от задней консоли на позиционно-чувствительный детектор фотодиод для отображения вертикальной (г) расстояние кончика движется, как она проходит через биомолекулярных комплексов сидящего на слюды. Б. Искажение изображения в направлениях х и у вызванные кончиком свертки. Номинальный радиус обычных наконечник нитрида кремния больше частиц для включения в образ, и край наконечника контакты образца она пересекает поверхность. Совет свертки приводит к отображаемого частицы появляться больше в направлениях х и у, но не направление г. Этот эффект может быть сведен к минимуму за счет использования подсказок с меньшей номинальной радиус наконечника.

Рисунок 2: Иллюстрация immunoadsorbed белка и подготовки образцов ДНК. , Выпуск immunoadsorbed GR • hsp70 белковый комплекс из моноклональных антител (МКА)-белков-сефарозой (PAS) гранул. Инкубация immunopellet с пептид, содержащий мАт эпитоп будет способствовать освобождению GR • hsp70 белковый комплекс из гранул, что позволяет сложны, чтобы быть собраны из супернатанта и визуализируется с помощью АСМ. B, подготовка ДНК для АСМ изображений требует использования двухвалентных катионов адсорбции буфера. Двухвалентных катионов увеличивает сродство ДНК для слюды подложки.

Рисунок 3: Окончательное расположение головы АСМ, жидкие держатель зонда ячейки, выборка, держатель образца, и буферных мениска. , Следует соблюдать осторожность при сдаче на хранение образцов и дополнительный буфер на подложку слюды, чтобы избежать физического контакта между кончиком пипетки и АФМ голову, жидкие вызова, а также слюда подложки. В, А. Увеличение буфера мениска простирается от образца диск жидкости держатель зонда клетки.
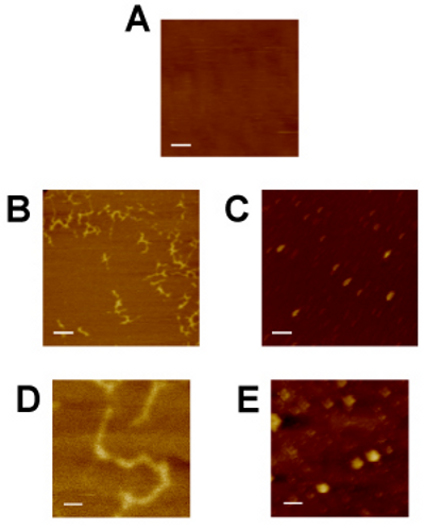
Рисунок 4: атомной микроскопии силу подложку слюды (), 2xGal4-2xGRE-luciferease ДНК плазмиды 8 (B, D), Г. Р. • hsp70 белковых комплексов (С, Е) в буферный раствор. Слюда служит управления изображением для сравнения с визуализацией ДНК и белка. • GR hsp70 белковых комплексов были подготовлены иммуноадсорбции ОТО загрунтовать hsp70, а затем освобожден из-антитело-бусинка осадок в мАт конкурирующих антител (показано на рисунке 2А). ДНК получены обычными плазмиды miniprep. Панели, В и С имеют эквивалентное увеличение (масштаб баров = 200 нм), так же как панели D и Е (масштаб баров = 40 нм).
Обсуждение
АСМ обеспечивает уникальные микроскопические техника способна изображений без покрытия отдельных биомолекул в водных и почти физиологическое буферных растворов в режиме реального времени. Это дает возможность визуализации отдельных белков и молекул ДНК, а также multiprotein комплексов и белок-ДНК комплексах. Изображений макромолекулярные частицы с AFM могут быть полезны для оценки однородности образца и для выявления физическое расположение составляющих компонентов наблюдаемых частиц. Такой подход наблюдения отдельных частиц макромолекулярных может быть полезным дополнением к обычным биохимические методы, такие как иммунопреципитации анализов, электрофорез в полиакриламидном геле и гель-хроматографии на колонке, которые обеспечивают значительные итоговые данные, представляющие 10 3 -10 11 отдельных комплексов биомолекулярных интереса настоящее в образце.
Исследование multiprotein комплекс стехиометрии, биомолекулярных взаимодействий и кофактор требования могут быть исследованы с помощью АСМ. Метод, изложенный здесь, может быть модифицированы с учетом конкретных биофизических интересующие вопросы. Например, при использовании жидкого держатель зонда ячейки способны обмениваться буфера, это возможность анализа кофактора требования к образованию белкового комплекса. ДНК-белковых сборки могут быть сформированы и диссоциированных в близком к реальному времени, и даже находясь в образ. ДНК может быть создан с конкретной последовательности интерес (например, элементы предполагаемого ответа или роман связывания с белками последовательности), смешанного с предположили связывающий белок, и отображаемого предоставить прямые доказательства межмолекулярных взаимодействий.
Нажатие режиме АСМ изображений значительно менее сложным, если сухие образцы используются образцы, а не в водных растворах, и линейные стоит ДНК и закрытого круга плазмид ДНК оба были отображаемого таким образом 3,9. Метод, представленный здесь используются образцы в буферных растворах с целью обеспечения более физиологических визуализации окружающей среды. Другие примечательные методы визуализации белков Следует также учитывать, в том числе ближнего поля инфракрасной микроскопии 10. Комплементарного использования иммуноадсорбции в супруги с АСМ обеспечивает возможность подготовить множество белковых комплексов, с использованием устоявшихся биохимических методов, а затем визуализировать их после освобождения из immunoadsorbing антитело-бусинка гранул. Например, immunoadsorbed ОТО анализировали на его связь с молекулярными белка hsp70 шаперона 1, а также белка динеин двигателя 2, используя этот подход, чтобы оценить размер и сложный стехиометрии. Размер частиц и биофизических особенностей (например, жесткости) были полезны в установлении личности биомолекул наблюдается в АСМ отображаемого образцы 11,12. Возможно также, чтобы подтвердить биомолекулы идентичности путем добавления взаимодействующего биомолекулы (например, лиганд или моноклональные антитела), которые связываются с его целью и причиной увеличения размера частиц, если цель биомолекулы присутствует.
Раскрытие информации
Благодарности
Эта работа финансировалась Национальным институтом здоровья Грант GM086822. Авторы хотели бы поблагодарить д-ра. Алек Пахомов и Пол Уоллес (Университет штата Вашингтон фонда Пользователь нанотехнологий (NTUF)) и Андреа Слейд (Bruker AXS) за их квалифицированную техническую помощь. АСМ изображения ДНК было проведено в Univ. Вашингтон NTUF, член Национальной сетевой инфраструктуры нанотехнологий. 2xGal4-2xGRE-luciferease плазмиды был любезно предоставлен лабораторией Доктор Кейт Ямамото (Университет Калифорнии, Сан-Франциско).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
|---|---|---|---|
| Измерения 3100 | Bruker | Измерения 3100 | |
| Сотовые измерения жидкости | Bruker | DTFML-ДД-HE | |
| Sharp рычаг нитрида (SNL) нитрида кремния АСМ-зондом | Bruker | SNL-10 | |
| Microlever резкое нитрида рычаг (MSNL) нитрида кремния АСМ-зондом | Bruker | MSNL-10 | |
| Наноскоп АСМ программный инструмент | Bruker | 004-132-000 | |
| Металл диски АСМ образца | Тед Пелла | 16208 | |
| Класс В1 Слюда диски, 12 мм | Тед Пелла | 50-12 |
Ссылки
- Murphy, P. J. M. Visualization and mechanism of assembly of a glucocorticoid receptorhsp70 complex that is primed for subsequent Hsp90-dependent opening of the steroid binding cleft. J Biol Chem. 278, 34764-34773 (2003).
- Harrell, J. M. Evidence for glucocorticoid receptor transport on microtubules by dynein. J Biol Chem. 279, 54647-54654 (2004).
- Pastre, D. Adsorption of DNA to mica mediated by divalent counterions: a theoretical and experimental study. Biophys J. 85, 2507-2518 (2003).
- Guthold, M. Direct observation of one-dimensional diffusion and transcription by Escherichia coli RNA polymerase. Biophys J. 77, 2284-2294 (1999).
- Petrucco, S., Volpi, G., Bolchi, A., Rivetti, C., Ottonello, S. A nick-sensing DNA 3'-repair enzyme from Arabidopsis. J Biol Chem. 277, 23675-23683 (2002).
- Murphy, P. J. M., Morishima, Y., Kovacs, J. J., Yao, T. P., Pratt, W. B. Regulation of the dynamics of hsp90 action on the glucocorticoid receptor by acetylation/deacetylation of the chaperone. J Biol Chem. 280, 33792-33799 (2005).
- Ruan, B., Fisher, K. E., Alexander, P. A., Doroshko, V., Bryan, P. N. Engineering subtilisin into a fluoride-triggered processing protease useful for one-step protein purification. Biochemistry. 43, 14539-14546 (2004).
- Meijsing, S. H., Elbi, C., Luecke, H. F., Hager, G. L., Yamamoto, K. R. The ligand binding domain controls glucocorticoid receptor dynamics independent of ligand release. Mol Cell Biol. 27, 2442-2451 (2007).
- Shen, X. C. A simple and effective sample preparation method for atomic force microscopy visualization of individual DNA molecules in situ. Mol Biol Rep. 38, 965-969 (2010).
- Paulite, M., Fakhraai, Z., Akhremitchev, B. B., Mueller, K., Walker, G. C. Assembly, tuning and use of an apertureless near field infrared microscope for protein imaging. J Vis Exp. , (2009).
- Cretu, A., Castagnino, P., Assoian, R. Studying the effects of matrix stiffness on cellular function using acrylamide-based hydrogels. J Vis Exp. , (2010).
- Brunger, A. T., Weninger, K., Bowen, M., Chu, S. Single-molecule studies of the neuronal SNARE fusion machinery. Annu Rev Biochem. 78, 903-928 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены