このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
の後胚表現型を識別するためのRNAiスクリーニング C.エレガンス
要約
我々は、タンパク質の発現と局在の後胚レギュレータを識別するための増感方法について説明します。 C.エレガンス RNAiベースゲノムの画面と機能的な、蛍光標識タンパク質を発現する統合された遺伝子を使用します。
要約
線虫C. elegansは、多くの遺伝子や遺伝子経路1の発見と機能解析のための貴重なモデルシステムであることが判明した。このシステムでは、研究のためのより洗練されたツールやリソースは、より微妙な表現型またはロールを持つ遺伝子の継続的な発見を容易にしています。
ここで我々はCを識別するための適応一般的なプロトコルを提示RNAiの2を使用して関心の後胚の表現型を有する線虫の遺伝子。この手順は、簡単にかどうかを解剖または化合物を顕微鏡の光や蛍光光学系により、アッセイの選択肢の表現に変更されます。このスクリーニングのプロトコルは、生物の物理的な資産および分子ツールにCを大文字にelegansの研究コミュニティが生産している。例として、我々は、この通常のローカライズに必要な遺伝子を識別するために、RNAiスクリーニングの蛍光産物を発現する統合されたトランスジーンの使用方法を示してい後期幼虫と成虫の製品。まず、完全長cDNAインサートを市販のゲノムRNAiライブラリーを使用していました。このライブラリは、候補遺伝子産物のRNAi還元することにより複数の候補の迅速な同定を容易にします。第二に、我々はRNAiと小文字を区別し、バックグラウンドで興味のある私たちのfluorecentlyタグ付きタンパク質を発現する統合された導入遺伝子を生成します。第三に、RNAi実験に孵化した動物を曝すことによって、この画面では、そうでなければ、目的のタンパク質を調節するのに後胚の役割をマスクしたい重要な胚の役割を担っている遺伝子産物の同定を可能にします。最後に、この画面では、単一細胞の解像度のために装備の複合顕微鏡を使用しています。
プロトコル
1。スクリーニング株の構築
スクリーニング株の慎重なデザインは、画面を成功させるために重要であり、他の3に記載されている。一部の研究者については、導入遺伝子から見える産物を発現する菌株を使用することは実験のために必要とされる。統合された導入遺伝子を保有する多くの菌株は、CGCまたは個々の研究者から入手することができます。トランスジェニック株は、画面に必要ですが、利用できない場合、それは砲撃4、UV / TMP 5、モス·トランスポゾン挿入6のような公開方法を使用して生成することができます。興味のある私たちのタンパク質を可視化するために、我々は成熟したcDNA配列(ここではDBL-1配列を使用)フレームにGFPをコードする配列を挿入した。このGFP融合タンパク質は、スコープを解剖では表示されませんので、表示されていた同時注入マーカーを使用し、関心の我々のタンパク質の視聴に影響を与えなかった(TTX-3P :: RFP は、いくつかの他の標準的なマーカーのレビューのために、7)を参照してください。その後、体外配列から統合された導入遺伝子を作成しました。我々は、トランスジーンのその砲撃はどちらも解剖顕微鏡の表現型を救出しないでもGFPタグ付きの製品の目に見えるレベルの生産(BeifussとGumienny、未発表)は、低コピー数の統合されたラインを生み出しました。もともと注射8,9によって行われた複数のコピー体外配列のUV / TMP統合は、導入遺伝子産物のレベル(図3A)を救出する、目に見えるが得られた。抗GFP抗体でウエスタンブロット法は、導入遺伝子(アレル名texIs100)が発現し(BeifussとGumienny、未発表)が正しく処理されることを確認した。統合された導入遺伝子はソースに関係なく、余分なバックグラウンドの変異を削除するには、5回他殖後する必要があります。
私たちの画面では、我々は興味のある唯一の蛋白質はトランスジェニック、タグ形式になりたかった。したがって、我々は機能的な内因性Gを削除機能喪失変異体DBL-1対立遺伝子を導入することにより、エン。
RNAiの効果最後に、私たちは、感歪。動物は、適切なを選ぶ際に興味のある組織(s)が考慮されるべきであるRNAiは10,11の影響を動物感受性変異を含まれている場合、ライブラリからRNAiは、多くの遺伝子は、遺伝子産物のより厳しい削減が生成されます。 RNAiは、背景11感。我々はスクリーニング株を作るために標準的なRRF-3(pk1426)対立遺伝子を使用していました。 RRF-3は、通常、体のRNAi 10を阻害するRNA依存性RNAポリメラーゼ(RDRP)ホモログである。 ERI-1またはERI-1、LIN-15Bのような他のRNAi hypersensitizing遺伝子の変異はRNAiの11から13の有効性を高めるために代わりに使用することができます。
texIs100; DBL-1(NK3)我々が作ったスクリーニング株は遺伝子型RRF-3(pk1426)があります 。
2。の選択と準備RNAiライブラリー
市販されているC. elegansの cDNAライブラリーは 、Cの予測遺伝子の約55%または87%を占めています虫個別に(ヴィダルラボやAhringerラボ·ライブラリは、それぞれ)。個々のクローンは、購入(オープンバイオシステムズ、Geneservice、(株))をご用意しています。そのクローンはほとんど完全長cDNAクローン化されたゲートウェイとダウンストリーム·アプリケーション(Invitrogen社、カールスバッド、カリフォルニア州)の準備ができているので、我々はビダルラボ(オープンBiosystems社)により構築ORF-RNAiライブラリーを選んだ。オリジナルAhringerラボゲノムcDNAライブラリーは、下流の特性評価実験14,15用として広く有用ではありませんcDNA断片を含んでいます。両方のライブラリは、挿入します(図1)隣接する2つのT7プロモーターを含むベクターを使用しています。コンストラクトは、イソプロピル-β-D-ガラクトピラノシド(IPTG)で誘導時にT7ポリメラーゼを発現菌株HT115で栽培されています。ライブラリークローンを含む細菌は次のようにIPTGで誘導されるdsRNAを(ステップ3.4参照)を生成します。
受領時にライブラリ全体を複製し、すべての実験の重複を使用しています。オリジナルと重複したライブラリは、電気ラインを分離するために接続されている別の-80℃の冷凍庫に保管する必要があります。
3。ライブラリークローンを持つ細菌の調製
- ラベルLB-カルベニシリン/テトラサイクリンプレート上で選択された摂食のライブラリークローンと同様に、陽性および陰性コントロール、(私たちは100mmプレートあたり8文化を育てる)からストリーク細菌(実験2ヶ月以内)と37℃で一晩( > 16時間)(図1)。各24ウェルプレートでは、我々は2つのコントロールを使用します。ポジティブコントロール、BLI-4(K04F10.4)は、用量依存性のポスト胚pheontype 16,17を生成します 。ネガティブコントロール、C06C3.5は、予測偽(つまりWormBase.org (BeifussとGumienny、未発表)が観察された表現型を発生しません)。
- を50μg/ mlカルベニシリン及び1mMのIPTG - (実験2ヶ月以内に、好ましくは、より早く)25を含む24ウェルセンチュウ増殖培地(NGM)プレートを準備します。 4℃で保管してください
- (1日目)各クローンについては、標準滅菌手法を用いて画線播種したプレート(S)(ステップ3.1)から単一コロニーを50μg/ mlのカルベニシリンを含む2 mlのLB培地に接種する。 37℃で一晩(> 16時間)220〜シェーカーセット内の - 240回転(図1)。解決策は、16時間後曇りでなければなりません。
- (2日目)翌朝、1mMの最終濃度に培養液にIPTGを添加し、二本鎖RNA(dsRNA)を産生を誘導する。 37℃で培養をインキュベート°C、220から240 rpmで、追加の4 - 5時間。このステップでは、NGMプレート(ステップ3.5)の寒天培地に単独でIPTGに依存するよりも、遺伝子産物のより一貫した堅牢なRNAiによるノックダウン効果を保証します。
- 各誘導細菌のCuのスポットを30μl25を含む24ウェルNGMのRNAiプレートの別々のウェルにlture - 50μg/ mlのカルベニシリンおよび1mMのIPTG(図1、RNAi実験を追跡するために使用されるテンプレートについては、図4を参照)。 20分間滅菌フローフードや細菌の斑点が乾くまで明らかにプレートを、置く。乾かし過ぎるません。 Overdryingは、寒天のエッジは、彼らが生じる隙間にクロールの場合取り返しのつかないだろう板や動物から引き離すようになります。
4。線虫の調製
線虫の段階的な人口で始まります。動物をステージングすると、コントロールと実験RNAiの臨床試験の間に観察さの違いは(RNAiは、発達の遅れが発生した場合ただし、これは(図2)クリーナで留意すべきである)は、単に動物の発達段階の違いに起因している可能性を減少させる。さらに、L1幼虫でRNAi実験を開始するとgenのRNAiにより胚性致死の潜在的な交絡の影響を未然に防ぐまた、関心の後胚役割を果たしている可能性がES。
ステージングは、最初のだけ卵の殻で保護された胚は生き残るスクリーニング株の混合段階の人口を漂白することによって達成される。 20℃で約12時間または16℃で18で約18時間以内に、この段階では、動物。よりしっかりとステージの動物、食べ物がなくてもM9培地で胚のハッチをさせることによる最初の幼生期(L1)で逮捕動物。同じ開始19歳からの食糧再開成長に配置飢えL1動物。
- (1日目)食の三百ミリメートル、板、妊娠、大人と胚を含むクリーンなスクリーニング株の動物を使用します。動物や胚を緩めて静かにプレート表面全体に液をピペッティングにより滅菌M9を使用して、プレートから動物を洗う。スクリューキャップ付き滅菌15 mlのチューブに洗浄液を転送します。
- 洗浄は、3.5ミリリットルより大きい場合は、動物(30秒〜3000 rpm)で回転を停止し、3.5ミリリットルの液体を除去する。洗浄はlである場合3.5ミリリットル以上のESS、3.5ミリリットルを合計するチューブにH 2 0またはM9を追加します。
- 化学物質の処理中に適切な防護服(白衣、手袋、ゴーグル)を着用してください。 1ミリリットル新鮮な漂白剤(5%次亜塩素酸ナトリウム、1歳未満)で0.5ミリリットル5 N NaOHを混ぜる。 3.5ミリリットルの線虫の洗浄に、この混合物を追加します。カウントアップタイマーを起動します。このプロセスは10分以上を取るべきではありません。それがない場合は、胚が危険にさらされ、収率が低下する可能性があり、または漂白剤は古いですし、交換する必要があります。
- 約10秒間ボルテックスチューブを。 4から10分間ボルテックス2分ごとに繰り返します。各ボルテックスした後、動物の死体解剖のために範囲の下で解決策を確認します。
- 胚は解放され、大人のお客様(6から8分)断片化されたときにテーブルトップ遠心機(〜3000回転、30秒)にチューブを回転させてペレット、胚を。
- ペレットを乱さない範囲で、できるだけ上清の程度を吸引除去する。注意してくださいではなく、貪欲。
- 〜10ミリリットルに滅菌M9を追加します。ペレットを再懸濁するために簡単にボルテックスまたはよく振る。
- スピンして、再度上清を除去します。漂白剤の匂いが管で検出することができる場合は、必要に応じてすすぎを繰り返します。
- 10の再懸濁し胚 - 15 mlの滅菌M9と小さい(25ml)を三角フラスコ(通気用)への転送。ひずみと実験のための適切な温度で振る(15 - 25°C)で一晩(> 20で16時間°C)。この時間内に、動物はすべて孵化し、L1の休眠で逮捕。
- 1ミリリットルM9(〜3000rpmで、30秒) - (2日目)0.5 15 mlチューブに再懸濁しでL1段動物スピンダウンする。独立したプレート上に5μLソリューションを配置し、動物の数をカウントします。 10μLソリューション - 必要に応じて30のワーム/ 3を得るために、ボリュームを調整します。
- 準備された24ウェルプレートの各ウェル中の細菌の上に約30次亜塩素酸同期L1段の動物を見つける。あまりにも多くのMOウェルあたり30匹以上の再成熟に達する前に飢えた集団になることがあります。蓋を斜めにしたプレートは乾燥させます。蓋を交換し、ゴムバンドで固定します。プレートを反転し、目的の段階で得点するために必要な時間のために適切な温度でそれを置きます。 RRF-3(pk1426)は温度に敏感な対立遺伝子であるため、我々のスクリーニング株の動物は15で成長した- 17°Cの三から四日間成虫動物(図1)L4観察する。
5。線虫の観察
線虫は、所望の段階(図2A)に成長した後(5日目)に、正と負のコントロールは解剖顕微鏡を使うことによって期待された表現型を作り出すことを確認します。それは用量依存的なポスト·胚の欠陥が水ぶくれ大人(軽度のRNAi表現型、図示せず)からの発達逮捕された、小さな幼虫(強い、eに、その範囲を生成するので、我々は、RNAiの有効性のコントロールとしてBLI-4を使用xpectedのRNAi表現型)(図2B)。その後、解剖顕微鏡を使ってもそれぞれの実験で動物を観察するとRNAi(図2C)によって誘導される明らかな異常な表現型を注意してください。コントロールが確認され、総表現型が記載された後、興味の表現のためにRNAi実験をスクリーニング。我々は、コントロール(図3)で始まる、蛍光、各RNAi実験から少なくとも5匹の動物を観察する63x目的を搭載した複合顕微鏡を使用しています。
- 4%の寒天パッド(H 2 Oの4%寒天)を作ることで、スライド(標準75×25ミリメートル)を準備します。寒天パッドの均一な厚さを確保するには、2つのスペーサー(各スペーサはその上のラボテープの2層に顕微鏡スライドで作られています)の間にきれいなスライドガラスを配置します。きれいなスライドガラスの中央上に溶融4%寒天の100μL(ガラスパスツールピペット二から三滴)約ピペット。スペーサーの上にすぐにでもそっと置かれ、追加のスライドを用いて溶融寒天を覆うことにより、寒天パッドを形成ND溶融寒天を。穏やかにパッドが1枚のスライドに付着したまま、離れてスライドガラスをスライドさせて寒天パッドを公開します。
- 寒天パッド上の麻酔〜5μLドロップ(レバミゾールまたはアジ化ナトリウムなど)を置きます。マウント8 - 麻酔で12匹。 22×22ミリメートル#1.5カバースリップ(または最高の化合物の顕微鏡に適したカバースリップの厚さ)と化合物の顕微鏡を用いて動物を観察してカバーしています。
- 各RNAi実験のレコード遺伝子、観察動物の数、および表現型の結果。画面には、標準テンプレート(例を参照、図5)を作成して使用します。
- 可能であれば、実験を繰り返すことによって、別の二次表現型によってRNAiの生産表現型を確認します。 (たとえば、画面例は、セカンダリ画面20のような主画面とボディサイズなどのGFPタグ付きDBL-1の局在の使用変化を示す。)細菌は、最大で同じストリーク(4℃で保存)から使用できます。 2ヶ月。古い縞は、rかもしれ液体一晩培養における成長不良でesult、最初restreakedする必要があります。
- シーケンスの挿入は、ライブラリのラベルと一致していることを確認するためのcDNAインサートの少なくとも一方の端(Ahringerライブラリが実行信頼性解析がありました。参照http://biocompute.bmi.ac.cn/CelRNAi/を )21。 5'-AGCGAGTCAGTGAGCGAG-3 'および5'-GTAAAACGACGGCCAGT-3'(M13f20プライマー):推奨されるプライマーは、(どちらのライブラリからの挿入のために)L4440-由来ベクターと側面の挿入部位のサイトでアニールする。
このメソッドを使用して、一人は、合理的にステージングして、実験の2〜4セットを毎週観察することができます。例えば、月曜日と火曜日にステージング動物はそれぞれ、木曜日と金曜日を観察することができ、再び月曜日と火曜日の観察のために金曜日と土曜日にステージングすることができます。毎日スクリーニング表現型(複数可)に応じて、セットには、化合物マイクロずつ24ウェルプレートを含むことができる表現型を迅速に識別された場合SCOPY以上。したがって、少なくとも88の異なるRNAi実験は、アカウント陽性および陰性コントロール及びスクリーニング率を考慮して、一週間で観察することができます。解剖スコープ画面が表示するために、スライド上の動物をマウントするため必要とせず、はるかに高速に実行することができます。複数の人にも驚異的なスケジュールおよび/または複数の顕微鏡を使用してラボのスループットを向上させることができます。寒天の薄膜上に動物の成長および表示を行うために、スライドに直接動物を含む寒天のスライスを転送するための代替方法は、時間を節約することができます。この変化は正常400X倍率22で男性の尾の異常をスクリーニングするために使用された。
6。代表的な結果
DBL-1 GFPタグ付きの通常と変更されたローカライズの例を図3に示されています。 GFPタグ付きDBL-1の正常な発現は腹側神経索細胞体とpunctae(図3A)の行が含まれています。 DBL-1 I動物はDBL-1 mRNAの翻訳(図3B)。DBL-1(RNAi)をも(データは示されていない)この例では、セカンダリ画面、小動物を生成します。防止飼育RNAである場合深刻な減衰のDBL-1の局在に影響を与える遺伝子は容易にこの画面(図3C)用に設計された菌株を用いたRNAiによって識別されます。

図1。 DBL-1シグナリングの細胞レギュレーターを同定するための画面方式を採用しています 。給餌ライブラリから細菌が、一晩増殖させ、IPTGで誘導し、細菌が二重鎖RNA(dsRNA)を生成できるようにするためにさらに4時間37℃でインキュベートする。誘導細菌培養液30μlを25μg/ mlのカルベニシリンおよび1mMのIPTGを含む24ウェルNGM(線虫の増殖培地)プレートにウェルあたり発見し、無菌のフローフード内で乾燥させる。我々は、次亜塩素酸塩処理embrさせることにより第一幼虫(L1)の幼虫をステージングヨーヨーは、L1休眠(逮捕された開発)を誘発する食品、せずにメディアで孵化。約30の同期L1段の動物は成長を再開すると細菌が23で作成されたdsRNAを消費するために動物を演出できます。RNAiライブラリーから、各ウェルを含む細菌の上にメッキされています。 15°C、若い成虫が目に見える表現型についてスクリーニングされ、72時間後。この年齢で、体の大きさの欠陥は明らかであり、蛍光はtexIs100導入遺伝子の発現から明るいです。
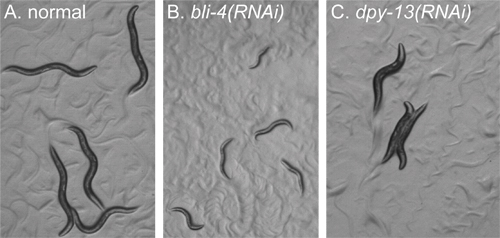
図2。スクリーニングの前に識別するために、表現型の例を示します 。ウェルプレートの動物のすべての画像は解剖顕微鏡を使用して、同じ倍率で撮影された。動物は、すべての飢餓のL1幼虫としてめっき後約72時間をイメージしました。すべての画像は同じように扱われました。 A)肉眼形態学的欠陥を与えていない遺伝子のRNAi。動物は野生型に表示されます。 B)RNBLI-4の愛。動物はdpy-13のRNAi)が逮捕された開発を表示し、パネルA. Cの動物に比べて小さいです。動物は、パネル内の動物と同じ開発段階にあるが、 "ずんぐりした"体の形態を表示します。
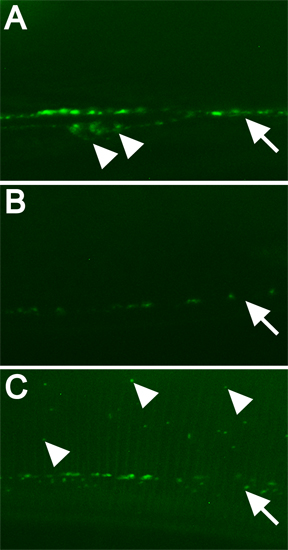
図3。特定の遺伝子の蛍光標識タンパク質の例としては、どのようにRNAiは、局在パターンを変更します 。すべての画像は回転するディスク共焦点顕微鏡、5秒で630x倍率で撮影された。露出。スケールバー=10μmである。すべての画像は同じように扱われました。開いている矢印は細胞体を示しています。矢印はpunctaeの行をマークします。塗りつぶされた矢印は、いくつかの異常にローカライズされたGFPタグ付きDBL-1を示しています。 A)RNAiの葉偽C06C3.5( "野生型")。 B)DBL-1(RNAi)を制御します。 C)GFPタグ付きDBL-1の正常な局在に必要な遺伝子のRNAi。
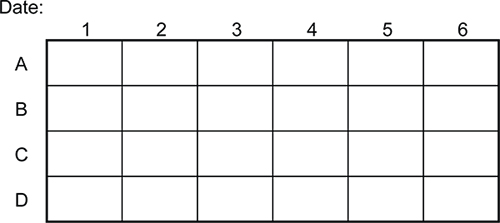
図4。 24ウェルプレートでのRNAi実験(ライブラリークローン)を追跡するためのテンプレートの例を示します 。このテンプレートは、直接プレートをラベリングとは異なり、実験の永久的な記録を作成するために使用することができます。
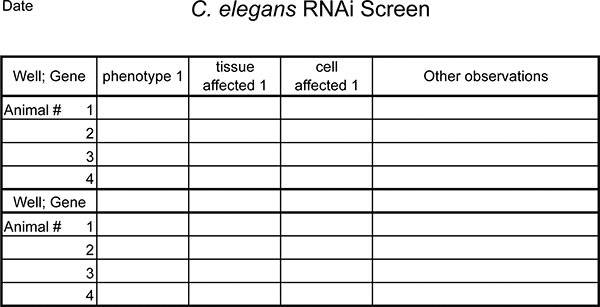
図5。 RNAiの表現型を記録するためのテンプレートの例を示します 。必要に応じて展開します。
ディスカッション
ここで紹介するRNAiスクリーニング方法は、通常の(トランスジェニック)後胚表現型に必要な遺伝子産物の高感度で迅速な分析を可能にします。に示す例では、蛍光標識タンパク質の細胞内局在性に関与する遺伝子の画面です。しかし、このプロトコルは、関心のある他の後胚の表現型に影響を及ぼす遺伝子を同定するために変更することができます。
このメソッドは?...
開示事項
我々は、開示することは何もありません。
謝辞
著者らは、注射マーカーのDBL-1のcDNAとDrクリストファー·ロンゴ(ワクスマン研究所、ラトガース大学、ニュージャージー州)の贈り物に博士リックパジェット(ワクスマン研究所、ラトガース大学、ニュージャージー州)に感謝したいと思います。博士バルトグラントの研究室は、GFPタグ付きDBL-1コンストラクトの低コピー数の統合のための遺伝子銃砲撃を行った。ルネ·ガルシア研究室では、texIs100の作成 中に技術支援を提供しました。ルネ·ガルシア、ロビンのLints、とHongmin秦研究所では、生産的なアドバイスを提供しました。この作品は、分子細胞医学のTAMHSC部からの起動資金によって賄われていた。化合物の範囲とスピニングディスク共焦点顕微鏡は、部門とディーン医学事務所のTAMHSC大学によって提供された資金で購入しました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| NGM寒天培地 | 線虫の増殖培地 | IPMサイエンティフィック株式会社 | NGM寒天プロトコル25に従って調製することができます |
| M9培地 | 22mmのKH 2 PO 4、 42MMのNa 2 HPO 4、 86mMのNaCl、 1 mMのMgSO 4を | 26 | |
| 寒天 | EMDケミカルズ | 1.01614.1000 | NGMプレートの水に2%であった。顕微鏡スライドパッドの水に4%(当初は、その後、溶融するためのマイクロオートクレーブ)。 |
| バクトペプトン | ベクトン·ディキンソン - Difco社製CP | 211677 | 0.25パーセント |
| IPTG | 研究プロダクツ国際社 | I56000-5.0 | 1mMの最終濃度 |
| カルベニシリン | 研究プロダクツ国際社 | C46000-5.0 | 50μg/ mlの希釈率 |
| LBブロスレノックス | ベクトン·ディキンソン - Difco社製CP | 240230 | 20グラム/リットル |
| テトラサイクリン | シグマ | 268054 | 12.5μg/ mlの希釈率 |
| 次亜塩素酸ナトリウム | すべてのブランド | 5%の家庭用漂白剤 | 新鮮な漂白剤を使用しています。 |
| 水酸化ナトリウム | すべてのブランド | CAS 1310-73-2 | 5 Nの在庫 |
| M9培地 | Wormlabレシピブック | http://130.15.90.245/wormlab_recipe_book.htm#Commonlab | 26 |
| levamisol | シグマ | 31742 | 100μM - 1mMの希釈率 |
| アジ化ナトリウム | フィッシャー·サイエンティフィック | S227 | M9の作業希釈で、10mMの |
| 24ウェルプレート | グライナーバイオワン | 662160 | VWR販売代理店 |
| 顕微鏡スライド | すべてのブランド | 75×25×1ミリメートル | |
| 顕微鏡カバースリップ | すべてのブランド | 22×22ミリメートルNo.1.5 | 顕微鏡メーカーが推奨する厚さを使用しています。 |
| 複合顕微鏡 | カールツァイス株式会社 | A1m | 実験のニーズに合わせて目標やフィルタを使用しています。 |
| メディア·ポンプ | マノスタットVaristalticポンプ | ケイト モデル#72-620-000 | チューブとマシンの適切な設定を使用 |
参考文献
- Giacomotto, J., Segalat, L. High-throughput screening and small animal models, where are we. Br. J. Pharmacol. 160, 204-216 (2010).
- Lamitina, T. Functional genomic approaches in C. elegans. Methods in Molecular Biology. 351, 127-138 (2006).
- Boutros, M., Ahringer, J. The art and design of genetic screens: RNA interference. Nat. Rev. Genet. 9, 554-566 (2008).
- Praitis, V., Casey, E., Collar, D., Austin, J. Creation of low-copy integrated transgenic lines in Caenorhabditis elegans. Genetics. 157, 1217-1226 (2001).
- Yandell, M. D., Edgar, L. G., Wood, W. B. Trimethylpsoralen induces small deletion mutations in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 91, 1381-1385 (1994).
- Frokjaer-Jensen, C. Single-copy insertion of transgenes in Caenorhabditis elegans. Nature Genetics. 40, 1375-1383 (2008).
- Giordano-Santini, R., Dupuy, D. Selectable genetic markers for nematode transgenesis. Cell. Mol. Life. Sci. , (2011).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833 (2008).
- Mello, C., Fire, A. DNA transformation. Methods in Cell Biology. 48, 451-482 (1995).
- Simmer, F. Loss of the putative RNA-directed RNA polymerase RRF-3 makes C. elegans hypersensitive to RNAi. Curr. Biol. 12, 1317-1319 (2002).
- Zhuang, J. J., Hunter, C. P. Tissue-specificity of Caenorhabditis elegans enhanced RNAi mutants. Genetics. , (2011).
- Samuelson, A. V., Klimczak, R. R., Thompson, D. B., Carr, C. E., Ruvkun, G. Identification of Caenorhabditis elegans genes regulating longevity using enhanced RNAi-sensitive strains. Cold Spring Harbor Symposia on Quantitative Biology. 72, 489-497 (2007).
- Wang, D. Somatic misexpression of germline P granules and enhanced RNA interference in retinoblastoma pathway mutants. Nature. 436, 593-597 (2005).
- Fraser, A. G. Functional genomic analysis of C. elegans chromosome I by systematic RNA interference. Nature. 408, 325-330 (2000).
- Kamath, R. S. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421, 231-237 (2003).
- Peters, K., McDowall, J., Rose, A. M. Mutations in the bli-4 (I) locus of Caenorhabditis elegans disrupt both adult cuticle and early larval development. Genetics. , 129-195 (1991).
- Thacker, C., Peters, K., Srayko, M., Rose, A. M. The bli-4 locus of Caenorhabditis elegans encodes structurally distinct kex2/subtilisin-like endoproteases essential for early development and adult morphology. Genes & Development. 9, 956-971 (1995).
- Byerly, L., Cassada, R. C., Russell, R. L. The life cycle of the nematode Caenorhabditis elegans. I. Wild-type growth and reproduction. Dev. Biol. 51, 23-33 (1976).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Savage-Dunn, C. Genetic screen for small body size mutants in C. elegans reveals many TGFbeta pathway components. Genesis. 35, 239-247 (2003).
- Qu, W. Reliability analysis of the Ahringer Caenorhabditis elegans RNAi feeding library: a guide for genome-wide screens. BMC Genomics. 12, 1471-2164 (2011).
- Nelson, M. D. A Bow-Tie Genetic Architecture for Morphogenesis Suggested by a Genome-Wide RNAi Screen in Caenorhabditis elegans. PLoS Genetics. 7, e1002010 (2011).
- Timmons, L., Fire, A. Specific interference by ingested dsRNA. Nature. 395, 854 (1998).
- Sarin, S., Prabhu, S., O'Meara, M. M., Pe'er, I., Hobert, O. Caenorhabditis elegans mutant allele identification by whole-genome sequencing. Nature Methods. 5, 865-867 (2008).
- Lewis, J. A., Fleming, J. T. Basic culture methods. Methods in Cell Biology. 48, 3-29 (1995).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved