Method Article
RNA精製によってクロマチンの単離(チャープ)
要約
Chirpが長い非コードRNAのゲノム結合部位(lncRNAs)をマッピングするための新規かつ迅速な手法である。メソッドは、lncRNAバインドされたゲノムサイトの列挙を許可するアンチセンスタイルオリゴヌクレオチドの特異性を利用しています。
要約
長い非コードRNAは、そのような投与量補正、プリント、発達遺伝子発現1,2,3,4,5,6,7として重要な生物学的プロセスのためにクロマチン状態の重要な調節因子である。仲介ヒストンH3リジン27トリメチル(H3K27me3)は、遺伝子特異的にクロマチンの状態を管理するための多数のlncRNAsのための広範な役割を示唆しているようなポリコーム抑圧的な複合体2(PRC2)などの特定のクロマチン修飾複合体との関連でlncRNAs数千人の最近の発見ファッション8,9。いくつかのlncRNAsが隣接遺伝子のシスに働くと考えられているが、他のlncRNAsは遠くに位置する遺伝子を調節するためにトランスで働いています。例えば、男性の細胞のX染色体上に、 ショウジョウバエ lncRNAs roX1とroX2バインド多数の領域、および量補償10,11のために重要である。しかし、その結合部位の正確な場所は、高解像度で知られていません。同様に、ヒトlncRNAギョレメでは、hにPRC2占有に影響を与える可能性が遺伝子のゲノムワイド3,12,13のundredsが、どのように特異性が達成されるかは不明である。 LncRNAsまた、複数のタンパク質複合体のアセンブリーを採用するモジュラー足場として機能することができます。古典的なトランス作用RNA足場は14複雑なテロメラーゼのテンプレートと足場としてTERC RNAである、ギョレメもPRC2のための足場と13の複雑なH3K4脱メチル化酵素として機能することができます。
クロマチンでのRNAの占有率をマッピングする先行研究は、実質的な洞察力15,16を認めたが 、一度に1つの遺伝子座でいます。最もlncRNAsの占有サイトが知られていない、とクロマチン調節におけるlncRNAsの役割は主にlncRNA摂動の間接的な影響から推測されています。マイクロアレイまたはディープシークエンシング(チップ·チップまたはチップ配列は、それぞれ)が続いてクロマチン免疫沈降が大きく、ゲノムスケールでのタンパク質-DNA相互作用の理解を向上させたように、ここではrecenを示していますTLY高解像度17で長いRNA占有ゲノムワイドにマッピングするための戦略を発表した。その後の数百塩基の解像度でゲノム結合部位のマップを生成するアンチセンスオリゴをタイルによってクロマチン複合体:このメソッドは、RNA精製(チャープ)( 図1)によるクロマチンの単離、ターゲットlncRNAの親和性のキャプチャに基づいています高感度、低バックグラウンド。アフィニティープローブの設計は、RNA配列の指定された簡単で、RNAの構造や機能ドメインの知識は必要ありませんので、チャープは多くのlncRNAsに適用されます。
プロトコル
1。プローブ設計
デザインアンチセンスDNAは、チャープによる標的RNAの選択的検索のためのプローブをタイル。
- オンラインでプローブデザイナを使用して、設計、アンチセンスオリゴプローブsinglemoleculefish.com 18。
- これらのパラメータを使用します。プローブはRNAの長さ= 1のプローブ/ 100 bpの数、2)ターゲットのGC%= 45; 3)オリゴヌクレオチドの長さ= 20; 4)間隔の長さ= 60から80です。デザイナーのための長すぎる場合は、セグメントにRNAを破る。リピートや広範な相同性の領域を省略します。
- 3プライム端にBiotinTEGの注文アンチセンスDNAプローブ。
- RNAに沿った位置に応じて標識プローブ。 "偶数"プールが2の番号すべてのプローブ、4、6、等が含まれており、 "奇数"プールはプローブが含まれているようにした2つのプールにそれらを分離番号1、3、5、などが100μMの濃度へのプローブのプールを希釈し、 -20℃で保存
- すべての実験では、使用して実行しなければならないお互いのために、内部統制として、両方のプール、。プローブ固有のノイズが、各プールに固有のものだろうが、実際のRNA依存性信号は、両方のプールから存在しているでしょう。これは、チャープ定量PCRとChirp-seqの両方に適用されます。
2。収穫細胞
チャープ実験に使用される細胞を収集します。
- コンフルエントに組織培養プレートまたはフラスコ内の細胞を成長させる。リン酸リンスは、かつて緩衝生理食塩水(PBS)とトリプシン処理。メディアの> 2倍のボリュームでトリプシンの渇きを、単一細胞懸濁液に細胞を再懸濁しを取り除くために、ピペッティングします。 50ミリリットルのファルコンチューブにすべてのメディアと再懸濁した細胞を転送します。 2000万細胞は通常、1つのチャープサンプルで十分です。
- 4分間800RCFでセルを回しています。必要に応じてPBS 40mlにメディアを再懸濁し4000万細胞を吸引し、チューブを兼ね備えています。 4分間800RCFでセルを回しています。デカントPBSは、慎重に角度の残りの液体を吸引除去する。
3。クロスリンク細胞と細胞ペレットを収集します。
架橋は、RNA-クロマチンの相互作用を維持し、細胞ペレットを準備するためにグルタルアルデヒドで細胞を採取した。
- 室温でのすべての手順を実行します。
- 室温でPBS中の1%グルタルアルデヒドを準備します。千万の細胞(0.4 mLの25%グルタルアルデヒドの在庫+ 9.6 mLのPBS)あたり10mlを準備します。グルタルアルデヒドは、新鮮なを使用する必要があります。
- ペレットを取り除くために、ファルコンチューブの底部をタップします。再懸濁し、細胞ペレットを1%グルタルアルデヒドでは、チャンクを避けるために小音量で始まるし、フルボリュームまで戻る。混在させる反転します。エンド·ツー·エンドのシェーカーまたはローテーター上で室温で10分間架橋。
- 5分間室温で1.25 Mグリシンの10分のボリュームと架橋反応をクエンチする。
- 5分間2000RCFでスピン。 20 mLの上清を吸引し、洗浄ペレットを5分間2000RCFで回転し、一度PBSを冷やして。
- wを吸引除去し、再懸濁灰化、架橋されたペレット20万個の細胞あたり1ml冷やしたPBSである。慎重にピペットチップでできるだけ多くのPBSを削除します。4℃で3分間2000RCFでエッペンドルフチューブやスピンに各MLを転送します。
- -80℃で液体窒素とストア内の細胞ペレットをフラッシュ凍結°C無期限に。
4。細胞溶解
細胞ライセートを調製するために架橋された細胞を溶解します。
- 室温で凍結細胞ペレットを解凍します。細胞ペレットを取り除くとミックスすることは困難をタップします。 4℃で3分間Cに対して2000RCFでペレットをスピンダウン残りのPBSを削除するには、シャープ10μlのピペットチップを使用しています。
- 電子天秤(1mgまで正確に)空のエッペンドルフチューブの風袋質量を(我々のチューブは非常に一貫して1.060グラムの重さ)。各ペレットを秤量し、その重量を記録します。架橋されたHeLa細胞の完全な15cmの皿は、通常、100 mgの重量を量る。
- FRESで溶解バッファー(ペレットの10倍質量、例えば、100mgの1 ml)を補完するHプロテアーゼインヒビター、PMSFとSuperaseイン(接続されたバッファのリストを参照してください)。よく混ぜる。
- 各チューブに10倍の体積を補充Lysis Bufferを追加し、ペレットを再懸濁します。小さなペレットを250μl補足溶解バッファーに再懸濁し<25 mgであった。サスペンションは滑らかでなければなりません。されていない場合は、500μlのアリコートに懸濁液を分割し、塊を分割する電動ペレットミキサーを使用しています。超音波処理にすぐに進んでください。
5。超音波処理
架橋された細胞ライセートを超音波処理によるせん断DNA。
- 15mlファルコンチューブに断片化で細胞溶解液を超音波洗浄します。各チューブに<1.5 mlのライセートを使用して、より高速な超音波処理のために、一度に2つ以下のチューブを超音波処理してください。
- パルス間隔OFF 45秒ON、30秒で最高の設定で4°Cの水浴中で超音波洗浄します。 30分ごとにライセートを確認してください。細胞ライセートが濁っなくなるまで超音波処理を続行します。これは、わずか30分、できるだけ多く4のような時間がかかる場合があります。数チューブ、サンプル量、浴温度、超音波処理時間の期間は、プロセスにかかる時間に影響します。チューブはおそらく異なる速度で超音波処理されるので、それらは均一性を確保するためにオリジナルのチューブに30分毎に再配布一緒にプール。注:グルタルアルデヒド架橋細胞はホルムアルデヒドと同等以上の超音波処理にかなり時間がかかります。
- ライセートが明確になると、新鮮なエッペンドルフチューブに5μLライセートを転送します。 90μLDNAプロテアーゼK(PK)バッファ(バッファ·リストを参照)、5μLPKを追加します。ボルテックスと簡単にスピンダウンします。 50℃で45分間インキュベートします。
- キアゲンPCR精製キットでDNAを抽出します。溶出は、30μLキアゲンのElution Buffer(EB)のDNAと1%アガロースゲル上のDNAのサイズを確認してください。 DNAのスメアの大部分は100から500 bpである場合には、超音波処理は完了です。されていない場合は、超音波処理を続行します。
- 4℃で10分間16100RCFで超音波処理したサンプルを遠心分離℃、液体nitrogeに1 mLのサンプルとフラッシュ·フリーズに上清のアリコートを組み合わせるN。 -80℃で保存
6。 CHIRP
バインドされたクロマチンをRNAおよび分離するために、ビオチン化DNAプローブをハイブリダイズする。
- 室温でクロマチンのチューブを解凍します。
- (クロマチンのmlあたり2 mlを準備し、バッファリストを参照してください)ハイブリダイゼーションバッファーを準備します。混在させる渦。
- ライセート1mlを使用する典型的なチャープサンプルについては、エッペンドルフチューブ内のDNAのINPUTと場所をRNAのINPUTと10μL、10μLを削除します。さらに使用するまで氷上で保管してください。
- 15mlファルコンチューブに1 mLのクロマチンを転送します。各チューブに2 mLのハイブリダイゼーションバッファーを追加します。合計ボリュームに対して、<1.5 mlを、エッペンドルフチューブを使用しています。
- 室温でプローブを解凍します。光度計のプローブは、(100μMプローブはスペック〜500から600 ng /μlに一本鎖DNAの設定を使用する必要があります)長い時間でそれを使用していない場合は、金額を確認する。特定の管(1mLのクロマチン、1 mLのクロマチン100ピコモル/μLのプローブの1μLあたり100 pmolのプローブ)をプローブの適切なボリュームを追加します。よく混ぜる。振盪しながら4時間37℃でインキュベートします。
- 20分は、ハイブリダイゼーションのために残っていると、C-1磁気ビーズ(4℃で保存)を作成します。プローブを100pmolの100μLを使用しています。バッファから別のビーズにDynaMag-2マグネットストリップを使用して、1 mLのunsupplemented溶解緩衝液で3回洗浄します。
- Lysis Bufferを元のボリュームの再懸濁し、ビーズ、新鮮なPMSF、PIとSuperaseインとサプリメント。 4時間のハイブリダイゼーション反応が完了した後、各チューブに100μLビーズを追加します。よく混ぜる。振とうしながら30分間37℃でインキュベートします。
- (サンプルあたり5 mL)をWash Bufferを準備します。混在させる渦。 37前のウォーム℃に使用前にPMSFを追加します。
- 1 mLの洗浄バッファーで5回ビーズを洗浄する。最初の洗浄では、1 mLの洗浄バッファーで別個のビーズ、デカントし、再懸濁しにDynaMag-15磁気ストライプを使用しています。 1.5mlのエッペンドルフチューブにボリュームを転送します。 5分間振とうしながら37℃でインキュベートします。
- その後の洗浄では、minicentrifuge上の各チューブをスピンダウン、1分間DynaMag-2磁気ストリップにサンプルを設定します。デカントのサンプルは、1 mLの洗浄バッファーで再懸濁しキムワイプ、で任意のしずくを拭いてください。 5分間振とうしながら37℃でインキュベートします。合計5回の洗浄のために繰り返します。
- 最後の洗浄では、よくビーズを再懸濁します。 100μLを除去し、RNA単離のために脇に置きます。 DNA画分に対する引当900μL。 DynaMag-2磁気ストライプ上のすべてのチューブをセットし、洗浄バッファーを削除します。一時的にダウンチューブを回転、磁石のストリップ上に置きます。シャープ10μlのピペットチップで完全に洗浄バッファーの最後のビットを削除します。
7。 RNAの単離
qRT-PCRにより定量するチャープサンプルからRNA画分を抽出します。
- 100μLビーズサンプルと10μLRNA入力サンプルを取る。 INPUTをRNAに85μLRNA PK緩衝液(pH7.0)を追加します。 95μLRNA PKバッファーpH 7.0に懸濁したビーズ。エンド·ツー·エンドの振とう45分間50°Cで5μLProteinease Kとインキュベートする。
- 簡単にチューブをスピンダウンし、℃、95℃のヒートブロックで10分間サンプルを沸かす
- 10秒間激しくボルテックス、500μLTRIZOLを追加し、氷上でサンプルを冷やす。室温で10分間インキュベートします。 -80℃で保存または4に進みます。
- TRIZOL処理したサンプルに100μlのクロロホルムを追加します。 10秒間激しくボルテックス。 4℃で15分間ベンチトップ遠心機に16100RCFで回転
- 有機およびインターフェイスを避けて、〜400μL水性上清を取り除きます。
- 600μL(1.5容積)100%エタノールを加え、よく混ぜる。 MIRNeasyミニカラムを介して、サンプルをスピン。 RWT(MIRNeasyミニキット)は、メーカーのプロトコルごとにRPEの2倍と1倍を洗ってください。 30μLのヌクレアーゼフリーH 2 O(NFH 2 O)で溶出します。
- 製造業者のプロトコルごとにDNA- フリーでRNAの溶出液を扱います。反応が完了した後、65℃で15分間サンプルを加熱℃で完全に残っているDNaseを失活させる。
- 1μLRNAを使用して、lncRNAを確認するために、定量RT-PCR解析のためにウェルあたり分離検索。 GAPDHはしばしばネガティブコントロールとして使用されます。
8。 DNA単離
シーケンシングにより同定または定量PCRにより定量化するためにCHIRPサンプルからDNA画分を抽出します。
- DNAの溶出バッファー(バッファリストを参照)、DNAの入力を含むサンプルあたり150μlのを準備します。
- 10μLのRNase A(10 mg / ml)と混合するDNA溶出バッファーmlの、ボルテックスあたり10μlのRNase H(10 U /μl)を追加します。
- RNアーゼによるDNA溶出バッファー150μLのビーズの各サンプルを再懸濁します。 (140μLに再懸濁し、DNAのINPUT)は、振とうしながら30分間37℃でインキュベートします。
- DynaMag-2磁気ストライプ上の別のビーズと清。上清を除去し、標識したチューブに加えます。
- 10μlのRNase A(10 mg / ml)とRNaseH(10 U /μL)と全く同じ8.2で行われている)とDNA溶出バッファーの第二のアリコートを準備します。各サンプルに150μL(DNAの入力を含む)、インキュベートを追加し、上清を除去します。すべての上清を回収(shoulD)〜300μLである。
- 各サンプルに15μLPKを追加します。振とうしながら45分間50℃でインキュベートします。
- 黄色のフェーズロック·ゲルチューブ(5PRIME)を押しプレスピン。フェーズロック·ゲルチューブにDNAサンプルを転送し、300μLPhOH追加:クロロホルム:イソアミルサンプルあたります。 10分間激しく振り、4℃で5分間16100RCFで卓上遠心機でスピンダウン上部(〜300μL)から水を取る。 3μLGlycoBlue、30μLNaOAc、900μLの100%EtOHを追加します。よく混ぜ、-20℃保存で一晩。
- 4℃で30分間16100RCFでサンプルをスピン℃に
- 慎重に上清をデカント。 1 mLの70%エタノールと混在させる渦を追加します。 5分間16100RCFでスピン。ピペットで上清を除去します。 1分間乾燥した空気。 30μLEBで再懸濁します。
- DNAサンプルは、定量PCRまたはIlluminaのプロトコルごとに、ハイスループットシーケンシングライブラリーの調製によって分析のための準備が整いました。
10。代表的な結果
図1 チャープワークフローを示しています。成功したチャープ実験では、一般的に著しく非特定のRNAを介して標的RNAを豊かにします。 図2 GAPDH上のHeLa細胞からヒトテロメラーゼRNA(TERC)、ネガティブコントロールとして豊富な細胞RNAの濃縮を示しています。 GAPDH RNAのわずか0.46パーセントを取得したのに対し、細胞内に存在するTERCのRNA(〜88%)の大半は、〜200倍の濃縮係数を示す、チャープを行うことによりプルダウンされました。そのような( 図2)は、哺乳動物細胞で発現されていませんLacZ遺伝子RNAを、標的プローブとして非特異的なプローブは、追加のネガティブコントロールとして使用することができます。
ターゲットlncRNAをバインドすることが期待DNA領域は、通常は定量PCRで測定した負の領域の上に飾られています。 図3は、我々が同じセルラインでのChirp-seqを行うことにより決定した初代ヒト包皮線維芽細胞に4つのギョレメにバインドされたサイトの定量PCRの検証を示しており、一方、 TERCとGAPDH DNAのサイト自体負の制御領域としてRVE。両方とも "偶数"と "奇数"プローブが負の領域に、真のlncRNA結合部位の特徴上の期待ギョレメにバインドされたサイトの得られた同等の濃縮を設定します。
CHIRP濃縮DNAのハイスループットシーケンシングはlncRNA結合部位のグローバルマップを生成します。 ショウジョウバエ lncRNA roX2は量補償のために必要とされる方法で、X染色体と相互作用することが知られています。 図4は、X染色体の節以上roX2結合プロファイルを示しています。両方とも "偶数"と "奇数"のサンプルが配列決定されていると、独自のノイズがオーバーラップ信号のトラックを生産するために排除されています。それぞれの "ピーク"はここroX2結合の強いサイトを示します。 roX2標的遺伝子の完全なトラックリストは、Chu らに記載されている2011年17。
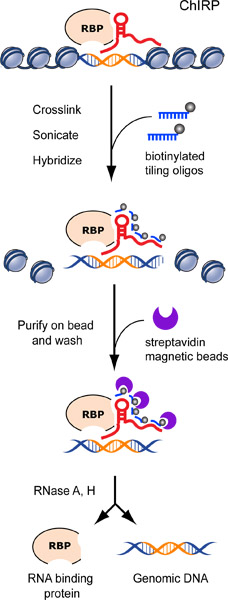
CHIRP proceの図1のフローチャートdure。クロマチンはlncRNAに架橋されています。in vivoでのタンパク質付加ビオチンタイルプローブはlncRNAをターゲットにハイブリダイズされ、クロマチン複合体は厳しい洗浄に続いて、磁性ストレプトアビジンビーズを用いて精製されています。我々は推定lncRNA結合配列がオレンジ色に図式化されたRNアーゼAとHのカクテルでlncRNA結合したDNAや蛋白質を溶出します。以前にChu らに発表され2011年17
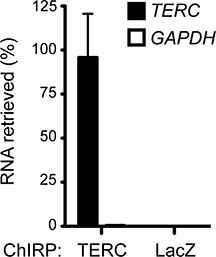
図2人間のTERC RNAのチャープを豊かに。 TERC-asDNAプローブは、細胞のTERC RNAおよびGAPDHの検出限界以下〜88%を取得します。 LacZを-asDNAプローブは陰性対照として使用し、どちらのRNAを取得しています。意味+ SDが表示されます。以前にChu らに発表され2011年17
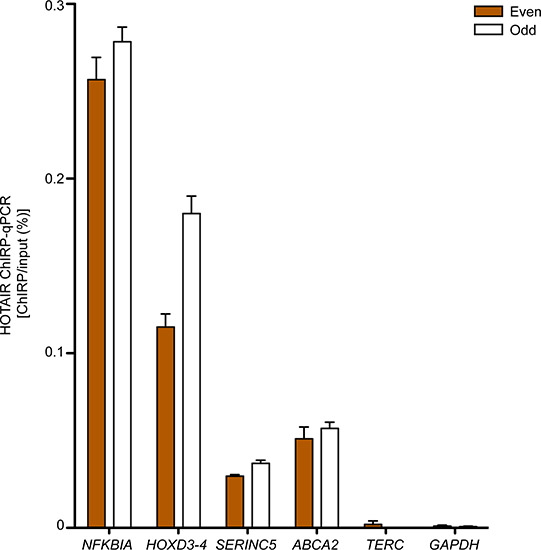
図3主なヒトのギョレメのChirp-定量PCRのためにエスキン線維芽細胞。NFKBIA、HOXD3-4、SERINC5とABCA2はギョレメと対話する領域です。TERCとGAPDHは、ネガティブコントロールとして役立った。意味+ SDが表示されます。以前にChu らに発表され2011年17
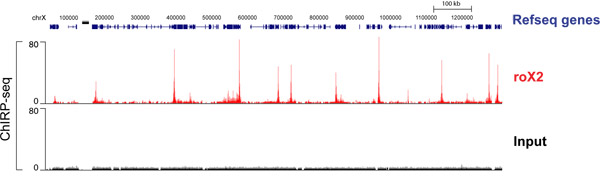
図4 SL2 ショウジョウバエの細胞内RNAのroX2のChirp-seqのデータ。 "たとえ"と "奇数"は別々に配列決定した、彼らのデータは、両方の唯一の共通のピークを反映してマージします。マージされたトラックが表示されます。以前にChu らに発表され2011年17
ディスカッション
ここでは、チャープ配列は、in vivo lncRNA結合部位をゲノムワイドにマッピングする方法を説明します。成功の鍵パラメータは、オリゴヌクレオチドプローブおよびグルタルアルデヒド架橋をタイルの分割プールです。アフィニティープローブの設計は、RNA配列与えられた簡単で、RNAの構造や機能ドメインの事前知識を必要としません。 roX2、TERCと、ギョレメの私たちの成功 - 2種の3ではなく別のRNAは - のChirp-seqは多くのlncRNAsに可能性が一般化であることを示唆している。すべての実験では、ケアと適切なコントロールと同様に結果を解釈する必要があります。異なるlncRNA条件の滴定、及び当該異なる親和性プローブまたは架橋剤の選択などの条件の賢明な変更が必要になる場合があり、RNA-クロマチンの相互作用のさまざまな側面を強調することができます。 CHIP-seqのように、すべてのバインディングイベントは、必ずしも機能的であり、さらなる研究は、RNA oの生物学的影響を把握する必要がありませんクロマチン上でccupancy。それにもかかわらず、我々は何千人も8,9の現在数の他のクロマチン関連lncRNAsの研究者のためにこの技術の多くの興味深いアプリケーションを予見する。 CHIP-seqはDNA-タンパク質相互作用のゲノムワイドな探求のためにドアを開いたように、 "RNAインタラクトーム"のチャープseqの研究は、生物学の多くの新たな道を明らかにすることができます。
開示事項
C. ChuさんとHYチャンは、この方法に基づいて特許出願に発明者として名前が付けられています。
謝辞
我々はT.ハングアップ、MCに感謝します。ツァイ、O.マナー、E.シーガル、M.黒田、T. Swigut、および議論のためのI. Shestopalov。シンガポール(CC)、NIH R01-CA118750とR01-HG004361(HYC)、および再生医療(HYC)はカリフォルニア工科大学の科学技術研究庁によってサポートされています。 HYCは、ハワード·ヒューズ医学研究所の初期のキャリアの科学者です。
資料
| Name | Company | Catalog Number | Comments |
| Buffer List: | |||
| Dissolve a pellet of complete protease inhibitor in 1 ml water as 50x stock. Make 100 mM PMSF in isopropanol (100x stock). Superase-in is used as 200x stock. Store all at -20 °C. | |||
| Lysis Buffer: | |||
| 50 mM Tris-Cl pH 7.0 10 mM EDTA 1% SDS Always add PMSF, P.I. and Superase-in fresh before use except when washing beads | |||
| Proteinase K Buffer (for DNA) | |||
| 100 mM NaCl 10 mM TrisCl pH 8.0 (For RNA use pH 7.0) 1 mM EDTA 0.5% SDS Add 5% by volume Proteainse K (Ambion AM2546 20 mg/ml) fresh before use | |||
| Hybridization Buffer | |||
| 750 mM NaCl 1% SDS 50 mM Tris-Cl pH 7.0 1 mM EDTA 15% formamide (store in the dark at 4 °C) Always add PMSF, P.I. and Superase-in fresh before use | |||
| Wash Buffer | |||
| 2x NaCl and Sodium citrate (SSC) (diluted from 20x SSC Invitrogen stock) 0.5% SDS Always add PMSF fresh before use | |||
| DNA elution Buffer | |||
| 50 mM NaHCO3 1% SDS | |||
| Table of specific reagents and equipment: | |||
| Glutaraldehyde (EM grade) | Sigma-Aldrich | G5882-10x10ml | |
| Motorized pellet mixer | VWR international | V8185-904 | |
| Protease inhibitor | Roche Group | 11873580001 | |
| PMSF | Sigma-Aldrich | 78830 | |
| Superase-in | Ambion | AM2696 | |
| Bioruptor | Diagenode | UCD-200 | |
| Falcon tubes (for sonication) | Corning | 430790 | |
| Proteinase K | Ambion | AM2546 | |
| PCR purification kit | Qiagen | 28106 | |
| C-1 magnetic beads | Invitrogen | 65002 | |
| PMSF | Sigma-Aldrich | P7626-25G | |
| DynaMag-15 magnet | Invitrogen | 123-01D | |
| DynaMag-2 magnet | Invitrogen | 123-21D | |
| MIRNeasy mini kit | Qiagen | 217004 | |
| Rnase H | Epicentre Biotechnologies | R0601K | |
| Rnase A | Sigma-Aldrich | R4875-100MG | |
| Phase Lock Gel Heavy | 5 PRIME | 2302810 | |
| Trizol | Invitrogen | 15596-018 | |
| Phenol:chloroform:Isoamyl | Invitrogen | 15593-031 | |
| Chloroform | Ricca | RSOC0020-1C | |
| GlycoBlue | Ambion | AM9515 | |
| Glycine | JT Baker | 4057-06 | |
| PBS, pH 7.4 | Invitrogen | 10010-049 | |
| Elution Buffer (EB) | Qiagen | 19086 | |
| 20x SSC | Invitrogen | 15557-036 | |
| 10% SDS | Invitrogen | 15553-027 | |
| DNA-free | Ambion | AM1906 | |
| Buffer kit | Ambion | AM9010 | |
| Formamide | Invitrogen | 15515-026 | |
参考文献
- Koziol, M. J., Rinn, J. L. RNA traffic control of chromatin complexes. Curr. Opin. Genet. Dev. 20, 142-148 (2010).
- Mercer, T. R., Dinger, M. E., Mattick, J. S. Long non-coding RNAs: insights into functions. Nat. Rev. Genet. 10, 155-159 (2009).
- Rinn, J. L. Functional demarcation of active and silent chromatin domains in human HOX loci by noncoding RNAs. Cell. 129, 1311-1323 (2007).
- Zhao, J., Sun, B. K., Erwin, J. A., Song, J. J., Lee, J. T. Polycomb proteins targeted by a short repeat RNA to the mouse X chromosome. Science. 322, 750-756 (2008).
- Kelley, R. L. Epigenetic spreading of the Drosophila dosage compensation complex from roX RNA genes into flanking chromatin. Cell. 98, 513-522 (1999).
- Pandey, R. R. Kcnq1ot1 antisense noncoding RNA mediates lineage-specific transcriptional silencing through chromatin-level regulation. Mol. Cell. 32, 232-246 (2008).
- Wang, K. C. A long noncoding RNA maintains active chromatin to coordinate homeotic gene expression. Nature. 472, 120-124 (2011).
- Khalil, A. M. Many human large intergenic noncoding RNAs associate with chromatin-modifying complexes and affect gene expression. Proc. Natl. Acad. Sci. U.S.A. 106, 11667-11672 (2009).
- Zhao, J. Genome-wide identification of polycomb-associated RNAs by RIP-seq. Mol. Cell. 40, 939-953 (2010).
- Meller, V. H., Wu, K. H., Roman, G., Kuroda, M. I., Davis, R. L. roX1 RNA paints the X chromosome of male Drosophila and is regulated by the dosage compensation system. Cell. 88, 445-457 (1997).
- Franke, A., Baker, B. S. The rox1 and rox2 RNAs are essential components of the compensasome, which mediates dosage compensation in Drosophila. Mol. Cell. 4, 117-122 (1999).
- Gupta, R. A. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis. Nature. 464, 1071-1076 (2010).
- Tsai, M. C. Long noncoding RNA as modular scaffold of histone modification complexes. Science. 329, 689-693 (2010).
- Zappulla, D. C., Cech, T. R. RNA as a flexible scaffold for proteins: yeast telomerase and beyond. Cold Spring Harb. Symp. Quant. Biol.. 71, 217-224 (2006).
- Nagano, T. The Air noncoding RNA epigenetically silences transcription by targeting G9a to chromatin. Science. 322, 1717-1720 (2008).
- Carter, D., Chakalova, L., Osborne, C. S., Dai, Y. F., Fraser, P. Long-range chromatin regulatory interactions in vivo. Nature. 32, 623-626 (2002).
- Chu, C., Qu, K., Zhong, F. L., Artandi, S. E., Chang, H. Y. Genomic Maps of Long Noncoding RNA Occupancy Reveal Principles of RNA-Chromatin Interactions. Mol. Cell. , (2011).
- Raj, A., van den Bogaard, P., Rifkin, S. A., van Oudenaarden, A., Tyagi, S. Imaging individual mRNA molecules using multiple singly labeled probes. Nat. Methods. 5, 877-879 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved