Method Article
しわコロニーの開発を使用したバイオフィルム形成を評価するための半定量的アプローチ
要約
我々は、バイオフィルム形成を調べるために、シンプルな半定量方法を提供 in vitroで。このメソッドは、しわの寄ったコロニーの発達によって評価されるように、バイオフィルム形成のタイミングとパターンの両方を監視するためにツァイスSTEMI 2000-C解剖顕微鏡(カメラ添付ファイル付き)を利用しています。
要約
バイオフィルム、または細胞外マトリックスにカプセル化された細胞の表面に接続されたコミュニティは、多くの細菌のための一般的なライフスタイルを表しています。バイオフィルム内では、細菌細胞は、しばしば抗生物質や他の環境ストレスを1に強化された抵抗を含む、改変された生理機能を示す。さらに、バイオフィルムは、ホスト微生物の相互作用に重要な役割を果たすことができます。ときに、個々の細菌転移バイオフィルムは、複雑な多細胞社会2を形成し、浮遊細胞を開発しています。研究室では、バイオフィルムは、特定のバイオフィルムの表現型の開発を評価することによって研究されています。一般的なバイオフィルムの表現型は固体寒天媒体3のしわやしわの細菌コロニーの形成を含む。しわの寄ったコロニー形成を識別し、特徴付ける変更されたバイオフィルムの表現型を示す菌株を、衝撃のバイオフィルム形成、環境条件を調査するために特にシンプルかつ有用な手段を提供します。 WRInkledコロニー形成は、 コレラ菌 5、 腸炎ビブリオ 6、 緑膿菌(Pseudomonas aeruginosa)7などの枯草菌(Bacillus subtilis)4、およびグラム陰性菌としてグラム陽性菌、両方を含む種々の細菌のバイオフィルム形成の指標として機能し、 ビブリオフィシャリ 8。
海洋細菌V. V.によって生成されたバイオフィルム: シャリは、ホストの植民地化の間にバイオフィルムの重要な役割のためにバイオフィルム形成のモデルとなっていますシャリは、ハワイのボブテイルイカEuprymna scolopes 8-10その植民地化を推進しています。重要なのは、in vitroで観察されたバイオフィルムの表現型は、Vの能力と相関シャリ細胞が効果的に宿主動物にコロニーを形成する:株が増加した展示ながら、in vitroでのバイオフィルム形成のために損なわ株は、植民地化の欠陥9,11を有しているバイオフィルムの表現型は、植民地8,12のために拡張されています。V.シャリしたがって 、細菌がバイオフィルム形成を調節する方法と、バイオフィルムの影響ホスト植民地化するためのメカニズムを評価するための単純なモデルシステムを提供します。
本稿では、使用して、バイオフィルム形成を評価するための半定量的方法を説明V.モデルシステムとしてシャリ 。このメソッドは、固形寒天培地上に定義されている濃度とボリュームで、細菌培養のスポッティング慎重を含む、斑点の文化は、単一の細菌のコロニーと同義語です。この "斑点のある文化"技術は、単一の、指定した時間ポイント(エンドポイントアッセイ)で総フィルムの表現型を比較したり、コロニーの直径のバイオフィルムの開発と測定値の経時的アッセイによって微妙なバイオフィルムの表現型を識別し、特徴付けるために利用することができます。 、バイオフィルム形成に影響されている。したがって、この手法は、バイオフィルム形成の半定量分析、あたりを提供していますしわの寄ったコロニーの開発と発展構造、シンプルな全体的な形態を超えた特性の相対的な大きさのタイミングとパターニングの評価をmitting。
プロトコル
1。初期特性と考慮事項
- バイオフィルム形成は、一般的に細胞密度と成長率の影響を受けています。したがって、成長率(時間をかけて光学密度(OD)の増加)と、単純な成長曲線と細胞播種アッセイを行うことにより、興味のある菌株(S)の収率(最終細胞数)を決定する必要があります。実験をスポッティングの結果を解釈するときに成長の障害、またはODと細胞数の相関関係の欠如は、考慮する必要があります。
- しわの寄ったコロニー形成を評価する際には、マイナー板·ツー·プレートの変動がバイオフィルムの開発に影響を与える可能性があるように、同じプレート上で適切なポジティブコントロールとネガティブコントロールが含まれています。
- スポッティングのために最高の条件、すなわち、制御、興味のある変異体(s)間の最も明確な違いを明らかにするものを識別します。そのような別のメディアや温度などの様々な条件下で、液体培養で株を成長させる、さまざまな段階に前のスポッティングへの成長(指数または固定相)のS。適切なメディアに様々な細胞密度で培養液10μlを発見し、コロニーの形態が明らかになるまで、所望の温度でインキュベートする。
- エンドポイントアッセイ(すなわち、48時間)スポッティング後、所定の時点でしわの寄ったコロニー形成の評価が含まれます。この評価は、その展示株(または展示することが提案されています)バイオフィルム形成に重大な欠陥のために有用である。
- タイムコースアッセイは、一定期間のしわのコロニー形成(すなわち、すべての時間)後にスポッティングを評価しています。このアッセイは、一定期間のしわのコロニー形成とパターンの開発の開始の決定を可能にすることにより、バイオフィルム形成の半定量的評価を可能にします。与えられた時間経過の収集ポイントの実験と数値の期間は、予備実験で決定されるべきである。
- 簡単に、ポスト·スポッティングで設定された時間を追跡するためにカウントアップするためにIMする人。
2。 Vのしわコロニー形態の微視的評価シャリ
- 接種V. LB-塩(LBS)培地13(1%[W / V]トリプトン、0.5%[w / vの]酵母エキス、2%[W / V]塩化ナトリウム、50mMトリス-HCl [5 mlのにシャリ細胞 pHを7.5])振とうしながら、必要な抗生物質とインキュベートを含む、28℃で一晩細胞が所望のOD 600(例えば、OD 600 = 0.2または0.5)に達するまで、午前中に、同じ条件の下で新鮮なLBS培地とインキュベート5ミリリットルに1:100希釈で細胞を継代。
- 1分間最大速度でマイクロ·セット内のマイクロチューブ遠心培養液をピペット1ミリリットル。吸引により上清を除去します。無菌の70パーセント人工海水1ミリリットル(ASW)(35 mMのMgSO 4を -7H 2 O 7のCaClでペレットを再懸濁することにより、残留のメディアや外成分を除去するために細胞を洗浄2-2H 2 O、210 mM NaClを、7 mMのKCl)を、遠心分離を繰り返します。 70パーセントASWの1ミリリットルで洗浄したペレットを再懸濁します。
- 600 nmでのODによって見積もられた各サンプルは、同じ数のセルが含まれていることを確認してください。追加の70パーセントASWとより濃縮された試料を希釈することにより、任意の必要な調整を行う。予備実験では、様々な初期OD値でスポット培養は菌株や条件の特定のセットに最適な出発ODを決定します。最良の結果がV.ために得られたスポットは約0.2のODの培養液から生成されます。 シャリ 。
- 必要な抗生物質を含むLBSプレート上に洗浄した細胞を10μlのを発見。プレートの上に文化をスポッティングする場合は、ちょうど寒天表面上に安定したピペット(指を含む)にいることを確認してください。ない角度で、垂直にスポット、スポットの均一な分布のために徐々に液体を取り出します。通常、各菌株が(プレート当たり最大6点)板ごとに一度発見され、ウィット実験ごとにhを複数のプレート(2-3)。
- 斑点のある文化が均等に分散残っていることを確認するには、スポットがインキュベーターにプレートを移動する前に乾燥させます。プレートを逆さにして、28℃、それらをインキュベート℃に
- 接種後12〜15時間で成長してスポット毎時初めの形態を監視することができます。我々は観察し、文書のコロニー形態やしわの寄ったコロニー形成の開始と進行を評価するためには、カメラアタッチメント(プログレC10 PLUS)とプログレCaptureProとImageJのソフトウェアプログラムと解剖スコープ(ツァイスSTEMI 2000-C)を使用します。
- 画像は上からキャプチャしている間に、ステップ2.5に記載されている特定のセットアップでは、スポットは、CL 1500 EC冷光源で透明ガラスステージを下から点灯している。このセットアップでは、ためにイメージングしわコロニー開発のための最適なV です 。 シャリ植民地(スポット)は半透明です。
- セントに記載されている特定の機器の有無にEP 2.5、フルコロニーに表示することができ、調節可能な光源と、理想的には、接続されたカメラを持つ任意の解剖顕微鏡を使ってモニターしわコロニー形態。必要であれば、デジタルカメラにも接続されたカメラが存在しない場合に利用しますが、これは最適ではありませんすることができます。
- 最高のしわの寄ったコロニーの開発を視覚化するためには、開発バイオフィルムの三次元形態が識別できるような細菌のコロニーの下に反射の照明の強さと角度の両方を調整する必要があります。斑点コロニーとコロニーのアーキテクチャは(しわ)を明確に区別されるような周囲の寒天を背景に、間に強いコントラストを提供する最適な照明条件を決定します。
- コロニーの色の変化がバイオフィルム形成時に発生する可能性があるとして、いくつかのケースでは、斑点を付けられたコロニーの色も、考慮する必要があります。明らかにするために光源の強度と角度を調整着色これらの微妙な変化。適切な設定が達成されれば、実験期間中のためにそれらを維持します。
- どのくらいの時間が経過接種の時からしわコロニー形成は、各株または条件を開始した時刻に注意してください。パターニングと3次元構造の形成(すなわち、縞が外側のエッジで形成または "波紋"を中心に発生する)が最初に明らかであるした時点として、しわの寄ったコロニー形成の開始を定義します。変異体の細胞は、しわのコロニー形成(例えば、 図2)の開始に減少または増加した時間を示すことができる。
- 適切なデジタル画像をキャプチャすることにより、しわの寄ったコロニー形成の開始と発展を文書化します。実験を通して画像を収集するときに同じ倍率を使用することが重要です。顕微鏡の接眼レンズからカメラの背面にあるレバーを使用してコンピュータ画面に表示を切り替えます。接眼レンズを切り替えるときと、パソコンの画面の表示は、ビューを調整し、それに応じて焦点。
- イメージング斑点培養する前に、ペトリ皿の蓋は、通常、鮮明画像を提供するために削除されます。見つけた文化は、ステップ2.5と2.6で説明されているセットアップを使用して、蓋を介して撮像することができますしかし、これはオプションの手順です。
- しわの寄ったコロニー形成開始後の各時点で、しわの寄ったコロニー開発のパターンに注意してください。アーキテクチャは、内部から生じることがある、またはこの評価インチ外は、異なる菌株によって、または別の条件の下で形成されたバイオフィルムを区別するためのメカニズムを提供します。
- 各時点での開発コロニーの直径を測定します。これは手動で行うか、デジタル関連ソフトウェアプログラムを使用することができます。デジタル処理した場合、プログレCaptureProソフトウェアプログラムを使用して、最初の実験で使用される特定の倍率にスケールバーをキャリブレーション。キャプチャされた各画像中のスケールバーが含まれています。
- ImageJのソフトウェアプログラムを使用して、コロニーの直径を計算するには、各画像ファイルを開きます。次のようにスケールバーを標準化し、ツールバーから "ストレートラインオプション"を選択します。同じ長さと幅の直線が埋め込まれたスケールバーをオーバーレイ。ラベルの付いたタブから "設定スケール"を選択し "分析"を"既知の距離"ボックスで、対応する長さ(オリジナルのスケールバーから決定され、すなわち、2 mm)を挿入し、 "OK"を選択してください。
- スポットを越えて水平線を挿入するには、 "ストレートライン"オプションを使用します。分析タブの下に、 "測定"を選択してください。新しい結果]ウィンドウで、計算された長さが提供されます。スポット間の垂直線を挿入することにより第2測定値を得る。直径を再計算します。 2つの測定値の平均値を記録します。グラフExcelなどのソフトウェアプログラムを使用して、各時点で各スポットの平均直径。
- 実験の終了は、指定された時点のいずれかで発生した場合、またはそれ以上が存在しない場合バイオフィルムの開発。終わりに達すると、PowerPointなどのソフトウェアプログラムを使用して、時間をかけてパターンの開発を可視化するために図(秒)に画像を統合することができます。
3。代表的な結果
これらの実験では、使用V.固体寒天表面にしわの寄ったコロニーの開発を評価することにより、バイオフィルム形成を研究するためのモデル生物としてシャリ 。 Vのバイオフィルム産生株40時間以内に大規模な3Dアーキテクチャとシャリのフォームコロニー( 図1)8,9,14。ときに時間かけて調べ、それがコントロール株によるしわの寄ったコロニーの形成は約12時間後の接種(特定の条件によって異なります)( 図2)9、早ければ開始することが明らかになります。対照的に、代表的な変異体によるバイオフィルム形成は約16時間後の接種9日まで開始しない場合、約4時間遅れで表示されています。 Repeaこれらの実験のtsは9この評価が半定量的な意思、タイミングは比較的一貫していたことが示唆された。バイオフィルム形成の第二の半定量的指標は、時間をかけて開発コロニーの直径の変化を利用しています。 図に示すように。図3Aは 、代表的なバイオフィルム有能な株はコロニーを形成する複雑性とバイオフィルムを形成しない代表的なひずみの相対直径の増加。これら二つの系統によって形成されたコロニーの直径の時間をかけて慎重に測定がバイオフィルム有能なコロニーのサイズはフィルム陰性のコロニーよりも大きい割合で増加したことを明らかにし、終了時点で2つはほぼ2で異なっていた - 倍( 図3B)。代表的な遅い時間または "エンドポイント"コロニー形態の画像が頻繁に文献で示されているものの、したがって、追加の、半定量的データは、バイオフィルム欠陥のより良い理解を許可しますその収集することができます。
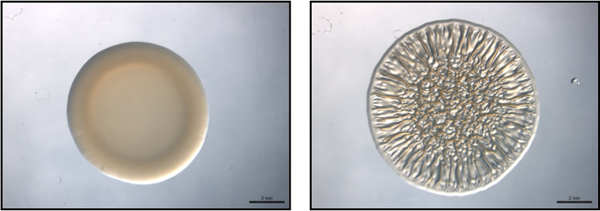
図1:エンドポイントアッセイ。この図は、Vの代表(右)は、非バイオフィルム形成(左)とバイオフィルム形成菌株を使用して、エンドポイントアッセイの例です。 シャリ 。これらの画像は、40時間後にスポッティングで収集した。これらの画像は、野生型で生成されたV.シャリには、ベクトル制御(非バイオフィルム形成)またはプラスミドRSCS過剰発現を含む(バイオフィルム形成)とモリスら 、2011年に収集したデータセットの一部であった。
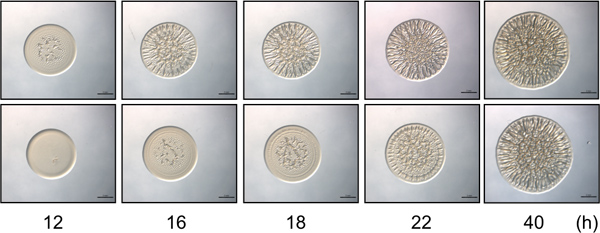
図2時間コース検定。上部のパネルには、Vのバイオフィルム有能なコントロール株によるバイオフィルム形成の代表的なイメージが含まれています選択された時間にわたってシャリ 。バイオフィルム形成の開始は、12時間では明らかである。下のパネルは、代表的なIが含まれていますVの変異株の魔術師16時間後の接種で開始するバイオフィルム形成と、時間をかけてしわの寄ったコロニー形成の開始が遅延(4時間)を示すシャリ 。これらの系統間の微妙な違いだけ以前の時点で観察されながら、40時間で株は、バイオフィルム形成の強度やパターニングに似ていることに注意してください。これらの画像は、RSCSを過剰発現する野生型および変異体sypEで生成されたV.シャリ·セルとデータの一部であったモリスら 、2011年に収集された設定します。
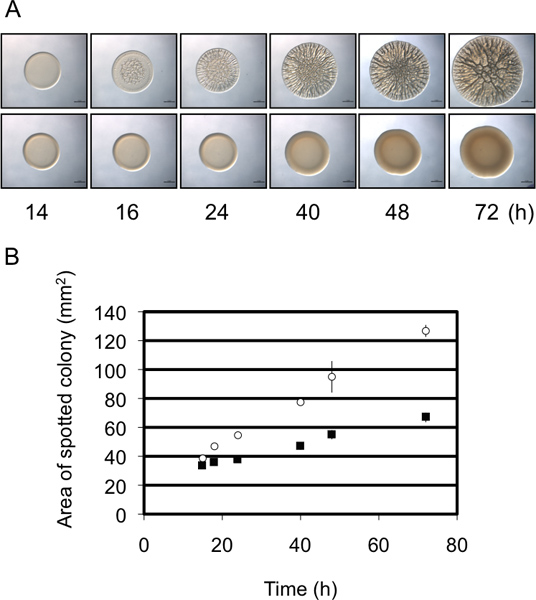
バイオフィルム形成の半定量分析は、 図3。コロニーの直径。 Vの代表的なバイオフィルム形成(上パネル)と非バイオフィルム形成(下パネル)株によるバイオフィルム形成の(A)の経時シャリ 。バイオフィルム形成株は大きな増加を示すことに注意してください。非バイオフィルム形成菌株からの相対時間をかけて直径インチこれらの画像は、野生型で生成されたV.シャリには、プラスミドRSCS過剰発現(バイオフィルム形成)またはベクトル制御(非バイオフィルム形成)を含む、モリスら 、2011年に収集したデータセットの一部であった。 (B)プロトコルで説明されているこれらのデータはImageJとExcelソフトウェアを使用して生成されたパネルAの2株による時間をかけてコロニーの直径の増加のグラフィカルな表現。
ディスカッション
本研究では、使用して、バイオフィルム形成を評価するための半定量的方法を説明V.モデル生物としてシャリ 。具体的には、固形寒天表面上に時間をかけてしわの寄ったコロニー形成としてのバイオフィルム形成と発展を監視するカメラの添付ファイル付きの解剖顕微鏡を利用しています。このプロトコルでは、我々は一般的にしわの寄ったコロニー形成を評価するために使用するメソッドの特定の2種類を概説しています。最初は私たちが選択された "最終"の時点で最終的に、全体的な3Dアーキテクチャ、パターニング、斑点のある文化の直径を観察することができ、エンドポイントアッセイである。このアプローチでは、バイオフィルム形成の劇的な欠陥につながる変異株や条件を評価するために最も有用です。しかし、このアプローチは、選択したエンドポイントの前の時点で発生する多くの微妙な違いを区別しません。より密接にしわの寄ったコロニー形成を監視するために、私たちは私たちがwの開始を識別することができますタイムコースアッセイを使用しコロニー形成をrinkledと時間をかけてその開発を監視します。このアプローチの結果として、しわの寄ったコロニー形成、3Dアーキテクチャ、およびパターニングのタイミングの微妙な違いを識別することができます。我々は、バイオフィルム形成の2つの半定量的なアッセイを生成するには、このタイムコースアッセイを使用していました。まず、株は3Dアーキテクチャを開発するために開始する時刻は、コントロール株のそれと比較することができます。私たちは、同じ条件で特定の変異体のバイオフィルム形成の遅延が9かなり一貫性があることを発見した。たとえば、データ、 図に示す。図2に示すように 、変異体は一貫してバイオフィルム形成を開始することで4時間の遅延について示した。バイオフィルム形成の第二の半定量的尺度は、しわの寄ったコロニー(スポット)の直径の大きさの変化である。我々は( 図3しわコロニーの直径が徐々に終了時点で2倍の違いについてに達し、非バイオコロニーのそれとは異なることを発見した)(モリスとビジック、未発表データ)。それはいくつかの変異体は、異なる動作をします可能性が残る日に、我々は、(未発表データ)(すなわち、コロニーの直径を増加させずにバイオフィルム形成)は、他のことなく1の表現型を観察していません。確かに、それはV.について報告されている他の人が15ないしながらコロニーの直径が大幅に増加いくつかのしわの寄ったコロニーの結果というコレラ 。それでも、時間の経過とともに径の変化を評価し、潜在的なバイオフィルムの変異体の特性評価に役立ち、そして/または、開発の遅れと変異株の追加の定量的尺度を提供することができます。バイオフィルム形成の二つの尺度(時間と直径)は、しわのコロニー形成の開始を決定するスポット径を決定することよりも、より敏感なだけでなく、より主観的である。そうであっても、両方の対策がバイオの研究に非常に便利ですがquantificatio容易に従順ではない表現型の半定量的評価を提供するN。
斑点を付けられた培養アッセイを行う場合には、斑点のある株は、培養されている環境条件を考慮することが重要です。しわの寄ったコロニー形成は、多くの栄養状況、温度、湿度など、さまざまな環境条件によって影響を受けています。実験間のばらつきを低減するために、それははるかに可能な限り(すなわち、セットのボリュームに寒天プレートを標準化し、制御された温度で培養発見株)を、これらの条件を標準化しておくと便利です。スポッティング実験間のばらつきのためにさらに制御する、実験の各セット内の適切なコントロール株を含めることが重要です。最後に、これらのアッセイからのデータを解釈するとき、それがしわのコロニー形成(例えば、バイオフィルム形成やパターニングの違いで遅延)の微妙な違いを評価し、特に複数回(3 +)、いずれの実験を行う必要があります。このプロトコルのいくつかの制限事項は次のとおりである:1)determin細胞が成長の欠陥を持っているかどうかをINGは難しいかもしれません:液体培養中の細胞の成長を正確に成長固体培地上でのレート、および可能ではありませんが、一緒にくっついてバイオフィルムを形成する細胞の成長の正確な決定を反映していない場合があります。 2)成長の欠陥を持つ株が分析し問題になる可能性があります3)それは微妙なバイオフィルムの表現型を有する系統間の直径の違いを区別することはできないかもしれません。4)同心のリング状に成長しない株のためにそれを正確に測定することができない場合があります直径の変化、パターニングがバイオフィルム形成の間に観察することができますが5)、結果としてバイオフィルムのパターニングを定量化する方法はありません、6)この実験的なセットアップとバイオフィルムのZ次元を測定する方法はありません。これらの制限にもかかわらず、このプロトコルは、それにもかかわらず、しわの寄ったコロニー形成の評価を支援するために数値データを取得する手段を提供します。
このプロトコルでは、特定のイメージングを活用するしわの寄ったコロニー形成を観察し、評価するためのシステム(すなわち、ツァイス実体顕微鏡とプログレCaptureProイメージングソフトウェア)。ここで説明した撮像システムは、強力です。しわのコロニー形成の開始を検出するため、経時的なアプローチで開発を評価する能力を大幅に解剖顕微鏡を使用して強化されています。この技術が利用できない場合は、プロトコルは、ズームフォーカスのあるシンプルなデジタルカメラを含む他の機器との使用のために適合させることができます。このプロトコルはしわコロニー開発の評価に焦点を当てているが、それはまた、ペリクル形成、細胞が培養液に静的に成長しているときに開発したバイオフィルムの形態を評価するために変更することができます。また、このプロトコルは、バイオフィルムの開発中に斑点のコロニーに特定の色素の取り込みを含むバイオフィルム形成の他の指標を評価する上で役立つ可能性があります。これらが含まれますが、そのようなコンゴーレッドとcalcofluとして染料が、これらに限定されないまたはこれは、セルロース、細菌のバイオフィルム16の共通コンポーネントにバインドすることができます。さらに、このプロトコルは、Vで使用するために開発されたがシャリは 、この生物に限定されるものではなく、そのような枯草菌(Bacillus subtilis)4、コレラ菌 5、 腸炎ビブリオ 6、 緑膿菌(Pseudomonas aeruginosa)7、すべての展示しわコロニー形成のような多数の異なる生物におけるバイオフィルム形成を研究するに一般化することができる。最後に、それはまた、 緑膿菌(Pseudomonas aeruginosa)18 Myxococcus xanthus 17の成長と空中構造の開発中に発生したパターニング、潜在的に、などの発達パターンを持つ他のコロニーの形態を研究するために適応させることができます。このプロトコルは、微生物学、バイオ研究者への一般的な使用のため、です。
開示事項
利害の衝突が宣言されません。
謝辞
この作品は、KLVに授与薬価R01助成金GM59690によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 機器の名前 | 会社 | カタログ番号 | コメント |
| ツァイスSTEMI 2000-C解剖顕微鏡 | ツァイス | 45505300000000000 | (ルーカス顕微鏡を介して取得) |
| プログレC10 PLUS | イエナオプティック光システム社 | 017953-602-26 | カメラアタッチメント(ルーカス顕微鏡を介して取得) |
| CL 1500 ECコールドライトソース | ツァイス | 4355400000000000 | (ルーカス顕微鏡を介して取得) |
| プログレCapturePro | イエナオプティック光システム社 | 登録されたカメラとフリーソフトウェア | 画像キャプチャするためのコンピュータプログラム |
| 画像J | NIH | からフリーソフト:IJ / download.htmlに "ターゲット=" _blank "> http://rsb.info.nih.gov/ij/download.html | 直径測定用のコンピュータプログラム |
参考文献
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin. Microbiol. Rev. 15, 167-167 (2002).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu. Rev. Microbiol. 56, 187 (2002).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20 (2005).
- Branda, S. S. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11621 (2001).
- Beyhan, S. Regulation of rugosity and biofilm formation in Vibrio cholerae: comparison of VpsT and VpsR regulons and epistasis analysis of vpsT, vpsR, and hapR. J. Bacteriol. 189, 388 (2007).
- Enos-Berlage, J. L., Guvener, Z. T., Keenan, C. E., McCarter, L. L. Genetic determinants of biofilm development of opaque and translucent Vibrio parahaemolyticus. Mol. Microbiol. 55, 1160 (2005).
- Merritt, J. H., Brothers, K. M., Kuchma, S. L., O'Toole, G. A. SadC reciprocally influences biofilm formation and swarming motility via modulation of exopolysaccharide production and flagellar function. J. Bacteriol. 189, 8154-8154 (2007).
- Yip, E. S., Geszvain, K., DeLoney-Marino, C. R., Visick, K. L. The symbiosis regulator rscS controls the syp gene locus, biofilm formation and symbiotic aggregation by Vibrio fischeri. Mol. Microbiol. 62, 1586-1586 (2006).
- Morris, A. R., Darnell, C. L., Visick, K. L. Inactivation of a novel response regulator is necessary for biofilm formation and host colonization by Vibrio fischeri. Mol. Microbiol. 82, 114 (2011).
- Nyholm, S. V. Roles of Vibrio fischeri and nonsymbiotic bacteria in the dynamics of mucus secretion during symbiont colonization of the Euprymna scolopes light organ. Appl. Environ. Microbiol. 68, 5113 (2002).
- Yip, E. S., Grublesky, B. T., Hussa, E. A., Visick, K. L. A novel, conserved cluster of genes promotes symbiotic colonization and σ54-dependent biofilm formation by Vibrio fischeri. Mol. Microbiol. 57, 1485 (2005).
- Mandel, M. J. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215 (2009).
- Graf, J., Dunlap, P. V., Ruby, E. G. Effect of transposon-induced motility mutations on colonization of the host light organ by Vibrio fischeri. J. Bacteriol. 176, 6986 (1994).
- Geszvain, K., Visick, K. L. The hybrid sensor kinase RscS integrates positive and negative signals to modulate biofilm formation in Vibrio fischeri. J. Bacteriol. 190, 4437 (2008).
- Krasteva, P. V. Vibrio cholerae VpsT regulates matrix production and motility by directly sensing cyclic di-GMP. Science. 327, 866 (2010).
- Romling, U. Characterization of the rdar morphotype, a multicellular behaviour in Enterobacteriaceae. Cell Mol. Life. Sci. 62, 1234 (2005).
- Berleman, J. E., Chumley, T., Cheung, P., Kirby, J. R. Rippling is a predatory behavior in Myxococcus xanthus. J. Bacteriol. 188, 5888 (2006).
- Lee, K., Veeranagouda, Y. Ultramicrocells form by reductive division in macroscopic Pseudomonas aerial structures. Environ. Microbiol. 11, 1117 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved