Method Article
Полу-количественный подход к оценке биопленки использование морщинистой развития колонии
В этой статье
Резюме
Мы предлагаем простые, полу-количественный метод для исследования биопленки В пробирке. Этот метод использует Zeiss Stemi 2000-C Анатомический микроскоп (с камерой приложение) для мониторинга сроков и структуры биопленки, по оценке развития морщинистые колонии.
Аннотация
Biofilms, or surface-attached communities of cells encapsulated in an extracellular matrix, represent a common lifestyle for many bacteria. Within a biofilm, bacterial cells often exhibit altered physiology, including enhanced resistance to antibiotics and other environmental stresses 1. Additionally, biofilms can play important roles in host-microbe interactions. Biofilms develop when bacteria transition from individual, planktonic cells to form complex, multi-cellular communities 2. In the laboratory, biofilms are studied by assessing the development of specific biofilm phenotypes. A common biofilm phenotype involves the formation of wrinkled or rugose bacterial colonies on solid agar media 3. Wrinkled colony formation provides a particularly simple and useful means to identify and characterize bacterial strains exhibiting altered biofilm phenotypes, and to investigate environmental conditions that impact biofilm formation. Wrinkled colony formation serves as an indicator of biofilm formation in a variety of bacteria, including both Gram-positive bacteria, such as Bacillus subtilis 4, and Gram-negative bacteria, such as Vibrio cholerae 5, Vibrio parahaemolyticus 6, Pseudomonas aeruginosa 7, and Vibrio fischeri 8.
The marine bacterium V. fischeri has become a model for biofilm formation due to the critical role of biofilms during host colonization: biofilms produced by V. fischeri promote its colonization of the Hawaiian bobtail squid Euprymna scolopes 8-10. Importantly, biofilm phenotypes observed in vitro correlate with the ability of V. fischeri cells to effectively colonize host animals: strains impaired for biofilm formation in vitro possess a colonization defect 9,11, while strains exhibiting increased biofilm phenotypes are enhanced for colonization 8,12. V. fischeri therefore provides a simple model system to assess the mechanisms by which bacteria regulate biofilm formation and how biofilms impact host colonization.
In this report, we describe a semi-quantitative method to assess biofilm formation using V. fischeri as a model system. This method involves the careful spotting of bacterial cultures at defined concentrations and volumes onto solid agar media; a spotted culture is synonymous to a single bacterial colony. This 'spotted culture' technique can be utilized to compare gross biofilm phenotypes at single, specified time-points (end-point assays), or to identify and characterize subtle biofilm phenotypes through time-course assays of biofilm development and measurements of the colony diameter, which is influenced by biofilm formation. Thus, this technique provides a semi-quantitative analysis of biofilm formation, permitting evaluation of the timing and patterning of wrinkled colony development and the relative size of the developing structure, characteristics that extend beyond the simple overall morphology.
протокол
1. Начальные характеристики и соображения
- Формирование биопленок, как правило, зависит от плотности клеток и роста. Таким образом, необходимо определить темпы роста (увеличение оптической плотности (ОП) с течением времени) и выход (конечное число клеток) деформации (а) интерес, выполняя простую кривую роста и анализы ячейки покрытия. Дефекты в рост или отсутствие корреляции между ОП и номер ячейки, должны быть приняты во внимание при интерпретации результатов экспериментов кровянистые выделения.
- Включите соответствующий положительный и отрицательный контроль на той же пластинке при оценке морщинистое образование колонии, как мелкие пластины к пластине изменения могут повлиять на развитие биопленки.
- Определить оптимальные условия для кровянистые выделения, то есть тех, которые имеют наиболее четкие различия между контролем и мутантов (ы) интересов. Рост напряжения в культуральной жидкости при различных условиях, таких как различные средства массовой информации или температуры, а также различные стадиис роста (экспоненциальный или стационарной фазы) до кровянистые выделения. Пятно 10 мкл культуры в различной плотности ячейки на соответствующие средства массовой информации, и инкубировать на желаемую температуру до колонии морфологии становятся очевидными.
- Конечной точкой анализа включает в себя оценку морщинистое образование колонии в заданный момент времени, после кровянистые выделения (т.е. 48 часов). Эта оценка используется для штаммов, которые проявляют (или предлагается выставлять) тяжелые нарушения формирование биопленок.
- Анализ времени курс оценивается морщинистыми формирование колоний в течение периода времени (например, каждый час), после кровянистые выделения. Этот анализ позволяет полу-количественной оценки биопленки, позволяя определения начала морщинистое образование колоний и характер развития в течение определенного периода времени. Продолжительность эксперимента и число приемных пунктов в течение заданного времени курс должен быть определен в предварительных экспериментах.
- Чтобы легко отслеживать время после кровянистые выделения, заход вIMER подсчитать.
2. Микроскопическая оценка морщинистой Морфология колонии в В. fischeri
- Инокулировать В. fischeri клеток в 5 мл LB-Соль (LBS) средние 13 (1% [/ о] триптон, 0,5% [/ о] дрожжевой экстракт, 2% [/ о] хлорид натрия, 50 мМ Трис-HCl [ рН 7,5]), содержащий необходимые антибиотики и инкубировать при встряхивании в течение ночи при 28 ° C. Утром, субкультуры клеток разведении 1:100 в 5 мл свежей среды, LBS и инкубировать в тех же условиях, пока клетки достигли желаемого OD 600 (например, OD 600 = 0,2 или 0,5).
- Внесите 1 мл культуры в трубку микроцентрифужную и центрифуги в микроцентрифуге набора максимальной скорости в течение одной минуты. Удалите супернатант аспирацией. Промойте клетки для удаления остатков средств массовой информации и внеклеточных компонентов ресуспендированием осадок в 1 мл стерильного 70% искусственной морской воде (ASW) (35 мМ MgSO 4-7H 2 O, 7 мМ CaCl2-2H 2 O, 210 мМ NaCl, 7 мМ KCl) и повторяя центрифугирования. Ресуспендируйте промытый осадок в 1 мл 70% ПЛО.
- Убедитесь, что каждый образец содержит такое же количество клеток, по оценкам ОП при 600 нм. Внесите необходимые изменения, разбавляя более концентрированный образцов с дополнительной 70% ПЛО. В предварительных опытах, место культуры в различных начальных значений ОП, чтобы определить оптимальное начало в сутки в течение заданного набора штаммов или условий. Наилучшие результаты получены В. fischeri когда пятна образуются из культур с диаметром около 0,2.
- Найди 10 мкл отмытых клеток на LBS чашки, содержащие необходимые антибиотики. Когда кровянистые выделения культуры на тарелку, убедитесь, что устойчивый пипетки (пальцем) чуть выше поверхности агара. Найди вертикально, а не под углом, и извлечь жидкость медленно для равномерного распределения месте. Обычно каждый штамм заметил один раз в пластине (до 6 мест на пластину), остроумиеч нескольких пластин (2-3) в эксперименте.
- Для того, чтобы культура пятнистый остается равномерно, позволяет место, чтобы высохнуть, прежде чем перейти пластины в инкубатор. Переверните пластины и инкубировать их при 28 ° C.
- Мониторинг морфологии растущей место почасовая, начиная с 12-15 часов после прививки. Мы используем рассечения область (Zeiss Stemi 2000-C) с камерой вложений (Progres C10 PLUS) и Прогресс CapturePro и ImageJ программное обеспечение для наблюдения и документирования морфологии колоний и оценить начало и прогрессирование морщинистое образование колонии.
- Для конкретной установки перечисленных в пункте 2.5, пятна освещены снизу через прозрачное стекло стадии CL 1500 EC холодный источник света, в то время как изображения будут захвачены сверху. Этот вариант является оптимальным для визуализации морщинистой развитие колонии, потому что В. fischeri колонии (пятна) являются прозрачными.
- При отсутствии специального оборудования, перечисленные в стEP 2.5, монитор морщинистой морфологии колонии с помощью любого вскрытия микроскоп, который позволяет для полного просмотра колонии и имеет регулируемый источник света и, в идеале, подключенной камеры. При необходимости, цифровая камера также может быть использован при отсутствии подключенной камеры, но это не является оптимальным.
- Для лучшей визуализации морщинистой развитие колонии, необходимо регулировать как интенсивность освещения и угла отражения под бактериальных колоний, что трехмерная морфология развивающихся биопленки можно различить. Определить оптимальные условия освещения, которые обеспечивают сильным контрастом между замечены колонии и окружающих агар фон, такой, что архитектура (морщины) колонии явно отличается.
- В некоторых случаях, цвет колонии пятнистых также должны быть приняты во внимание, так как изменения в колонии цвет может произойти во время формирование биопленок. Регулировка интенсивности и угла освещения выявить источникэти тонкие изменения в окраске. После соответствующей настройки будут достигнуты, поддерживать их на протяжении всего эксперимента.
- Обратите внимание, сколько времени проходит с момента прививки до момента, морщинистой формирования колонии инициирует для каждого штамма или состояния. Определить начало морщинистое образование колонии момент времени, при котором формирование паттернов и 3D-структур (например, страт формирование на внешнем крае или "рябь", происходящих в центре) является первым очевидным. Мутантных клеток может показать снижение или увеличение времени до начала морщинистое образование колонии (например, рис. 2).
- Документ начало и развитие морщинистой образование колонии, захватив соответствующих цифровых изображений. Важно, чтобы использовать тот же увеличение изображения при сборе течение всего эксперимента. Переключить вид из окуляр микроскопа на экране компьютера с помощью рычага, расположенного на задней панели камеры. При переключении между окуляроми просмотр экрана компьютера, настроить вид и сосредоточиться соответственно.
- Перед изображениями культур пятнистый, крышку чашки Петри, как правило, удалены, чтобы обеспечить ясное изображение. Тем не менее, это является дополнительным шагом, как пятнистый культуры могут быть отображены через крышку на установке, изложенные в шагах 2.5 и 2.6.
- В каждый момент времени после начала морщинистое образование колонии, обратите внимание на картины морщинистой развитие колонии. Архитектура может развиться изнутри или снаружи внутрь Эта оценка представляет собой механизм отличить биопленки образуются различными штаммами или в различных условиях.
- Измерьте диаметр развивающиеся колонии в каждый момент времени. Это можно сделать вручную или с использованием цифровой связанного программного обеспечения. Если все сделано в цифровой форме, использование программного обеспечения Progres CapturePro программы и первого калибровки шкалы к конкретному увеличение используемых в эксперименте. Включите линейки в каждое изображение в плен.
- Чтобы вычислить диаметр колонии с помощью программы ImageJ программного обеспечения, открывать каждый файл изображения. Стандартизация шкалы следующим образом: Выберите пункт "Прямая линия вариант" на панели инструментов. Перекрытие встроенных линейки прямой линией той же длины и ширины. Выберите "Установить масштаб" из вкладку "Анализ". В "известном расстоянии" окно вставки соответствующей длины (как определено в оригинальной шкалу, то есть, 2 мм) и выберите "OK".
- Используйте кнопку "Прямой линии", чтобы вставить горизонтальную линию поперек месте. Под анализа, выберите "Мера". В открывшемся окне результатов, расчетная длина будет предоставлена. Получить второе измерение, вставив перпендикулярную линию поперек месте. Повторно вычислить диаметр. Запишите среднее из двух измерений. График среднего диаметра для каждой точки в каждый момент времени с помощью программного обеспечения программы, такие как Microsoft Excel.
- В конце эксперимента происходит либо на указанный момент времени или при отсутствии дальнейшегоразвитие биопленки. После окончания достигнуто, консолидировать изображения в рисунок (ы) для визуализации модели развития с течением времени использование программного обеспечения, таких как PowerPoint.
3. Представитель Результаты
В этих экспериментах мы использовали В. fischeri в качестве модельного организма для изучения биопленки, оценивая развитие морщинистые колонии на твердой поверхности агара. Биопленки производству штаммов V. fischeri образуют колонии с большим 3D архитектура в течение 40 ч (рис. 1) 8,9,14. При проверке в течение времени, конечно, становится очевидным, что образование морщинистой колонии контрольного штамма инициирует уже около 12 часов после прививки (в зависимости от конкретных условий) (рис. 2) 9. С другой стороны, формирование биопленок представитель мутант задерживается примерно на 4 часа, а не начать примерно до 16 ч после инокуляции 9. RepeaTS этих экспериментов предположил, что времени оставалось относительно стабильным, что делает эту оценку полуколичественного 9. Второй полуфинал количественная мера биопленки используются изменение диаметра развивающиеся колонии с течением времени. Как показано на рис. 3А, представитель биопленки компетентных штамм образует колонии, которые увеличивают сложность и диаметром по отношению к представителю штамм, который не образует биопленки. Тщательные измерения в течение долгого времени диаметров колоний, образованных этими двумя штаммами показали, что размер биопленки компетентных колонии увеличилась в большей степени, чем биопленки негативных колоний, и в момент времени окончания двух отличалась почти в 2 - раза (рис. 3В). Таким образом, хотя образы представитель позднего времени или "конечной точки" Морфология колонии часто приводятся в литературе, дополнительные, полу-количественные данные могут быть собраны, которые позволят лучше понять биопленки дефекта.
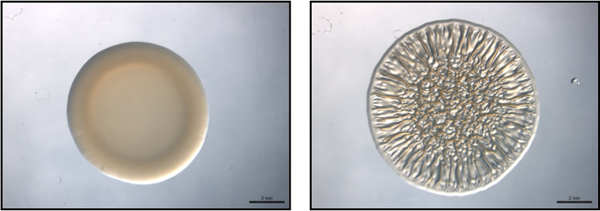
Рисунок 1. Конечные точки анализа. Эта цифра является примером конечной точкой анализа с использованием репрезентативных без формирования биопленок (слева) и формирования биопленок (справа) штаммов V. fischeri. Эти изображения были собраны в 40 ч после кровянистые выделения. Эти изображения были получены с дикого типа В. fischeri содержащих векторное управление (не образующих биопленки) и РЦНК гиперэкспрессией плазмиды (биопленки формирования) и входили в набор данных, собранных для Morris и соавт., 2011.
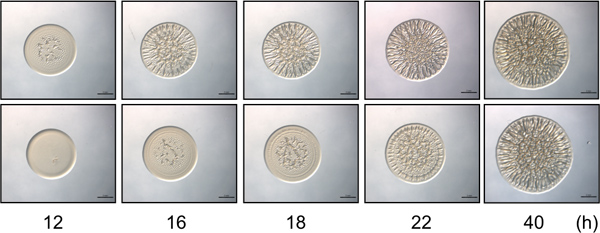
Рисунок 2. Время курса анализа. Верхняя панель содержит представитель изображения образование биопленки на биопленки компетентный контроль напряжения V. fischeri за выбранное время курса. Начало формирование биопленок очевидно в 12 час. Нижняя панель содержит представителя ямаги мутантного штамма В. fischeri, который показывает задержкой (4 ч) в начале морщинистое образование колонии с течением времени, формирование биопленок начало в 16 часов после прививки. Отметим, что в 40 часов штаммы похожи на интенсивность и структурирование формирование биопленок, в то время как тонкие различия между этими штаммами наблюдаются только на более ранних моментов времени. Эти изображения были получены с гиперэкспрессией РЦНК дикого типа и мутанта sypE В. fischeri клеток и являются частью набора данных, собранных для Morris и соавт., 2011.
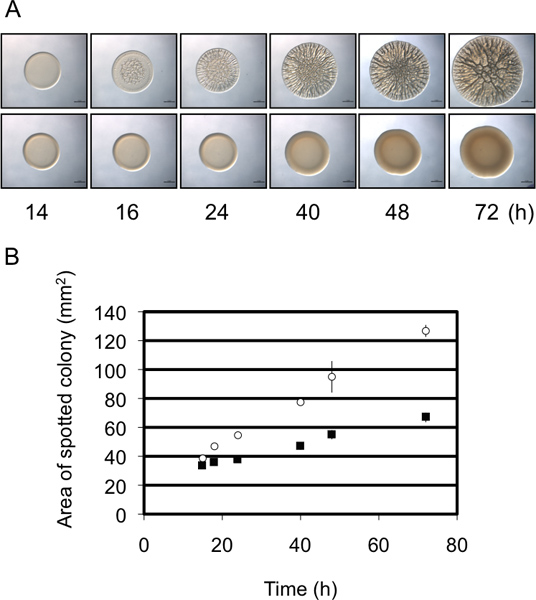
Рисунок 3. Колонии диаметра, полу-количественный анализ формирование биопленок. (A) Время хода биопленки представитель биопленки формирования (верхняя панель) и не образующих биопленки (нижняя панель) штаммов V. fischeri. Обратите внимание, что биопленки формирования штамм обладает большим увеличениемв диаметре, с течением времени по отношению к не-биопленки формирования напряжения. Эти изображения были получены с дикого типа В. fischeri содержащие РЦНК гиперэкспрессией плазмиды (биопленки формирования) или векторное управление (не образующих биопленки) и входили в набор данных, собранных для Morris и соавт., 2011. (Б) графическое представление увеличение диаметра колонии со временем между двумя штаммами в панели A. Эти данные были получены с использованием Excel ImageJ и программного обеспечения, как указано в протоколе.
Обсуждение
В этой работе мы описываем полуколичественного метода оценки биопленки использованием V. fischeri в качестве модельного организма. В частности, мы используем рассечения микроскоп с камерой крепление для контроля формирования биопленок и развития, морщинистой формирования колонии в течение долгого времени на твердой поверхности агара. В этом протоколе, мы выделяем два конкретных типов методов, которые мы обычно используем для оценки морщинистое образование колонии. Первым из них является конечной точкой анализа, который позволяет наблюдать в финал, общий 3D архитектуру, рисунка, и диаметр культуры пятнистый на выбранный «окончательные» момент времени. Такой подход является наиболее полезным для оценки мутантных штаммов или условия, которые приводят к резкому дефектами в формирование биопленок. Однако такой подход не делает различия между более тонкие различия, происходящие в моменты времени до выбранной конечной точки. Для более внимательно следить за морщинистой формирование колоний, мы используем анализ времени, конечно, что позволяет определить начало шrinkled образование колоний и следить за ее развитием с течением времени. В результате такого подхода, более тонкие различия в сроках морщинистое образование колонии, 3D архитектуру, и структурирование может быть идентифицирован. Мы использовали этот анализ раз курс для создания двух полуколичественного анализов формирование биопленок. Во-первых, время, когда напряжение начинает развиваться 3D-архитектура может быть по сравнению с контролем напряжения. Мы нашли, что задержка с формированием биопленки конкретного мутанта на тех же условиях достаточно последовательно 9. Например, в данные, приведенные на рис. 2 мутанта постоянно выставляются около 4 часов задержки начала формирование биопленок. Второй полуфинал количественная мера биопленки является изменение размера диаметра морщинистые колонии (спот). Мы обнаружили, что диаметр морщинистые колонии постепенно отличается от не-биопленки колонии, достигнув 2-кратную разницу в точке время окончания (рис. 3 ) (Morris и Visick, неопубликованные данные). На сегодняшний день мы не наблюдал один фенотип без другого (например, образование биопленки без увеличения диаметра колонии) (неопубликованные данные), хотя и остается возможной некоторые мутанты будут вести себя по-разному. Действительно, было сообщено, для В. холерных, что некоторые морщинистой результате колоний в значительном увеличении в колонии диаметром в то время как другие этого не делают 15. Тем не менее, оценивая изменения в диаметре, с течением времени может помочь в характеристике потенциальных мутантов биопленки и / или предоставить дополнительную количественную меру мутантов с задержками в развитии. Из этих двух мер биопленки (время и диаметр), определения начала морщинистое образование колоний является более чувствительным, но и более субъективным, чем определения диаметра пятна. Тем не менее, обе эти меры обеспечивают полу-количественной оценки фенотипа, что является чрезвычайно полезным для исследователей биопленки, но не легко поддаются quantificatioл.
При выполнении заметил культурный анализов, важно принять во внимание экологические условия, в которых замечены штаммов культивируют. Морщинистой формирование колоний, часто под влиянием различных условий окружающей среды, в том числе наличие питательных веществ, температура и влажность. Для уменьшения изменчивости между экспериментами, это полезно для стандартизации этих условий, как много можно (т.е. стандартизации агаром в заданном объеме и культивирования штаммов замечены при контролируемой температуре). Для дальнейшего контроля за изменчивостью между пятен экспериментов, важно включить соответствующие штаммы контроля в каждой серии экспериментов. Наконец, при интерпретации данных этих исследований, необходимо выполнить любой эксперимент несколько раз (3 +), особенно при оценке тонкие различия в морщинистое образование колоний (например, задержка в формировании биопленок или рисунок, различия). Некоторые ограничения этого протокола являются: 1) определяющиеING ли клетки имеют дефект роста может быть трудно: рост клеток в культуральной жидкости могут не точно отражать темпы роста на твердых средах, а также точного определения роста биопленки формирования клеток, которые могут держаться вместе, не всегда возможно; 2) деформации с ростом дефектов будет проблематично для анализа, 3) он не может быть можно выделить диаметр различия между штаммами с тонкими фенотипов биопленки, 4) для штаммов, которые не растут в концентрические кольца, не всегда возможно точно измерить изменения в диаметре, 5), а паттерны можно наблюдать во время формирование биопленок, нет никакого способа для количественного определения паттерна в результате биопленки и 6) нет способа измерить Z-размерности биопленки с этой экспериментальной установки . Несмотря на эти ограничения, тем не менее, этот протокол предоставляет возможность получить численные данные, чтобы помочь в оценке морщинистое образование колонии.
В этом протоколе, мы используем специальный изображенийсистемы (например, Zeiss рассечения микроскопа и Progres CapturePro изображений программное обеспечение), чтобы наблюдать и оценивать морщинистое образование колонии. Системы визуализации, описанные здесь является мощным: способность обнаруживать начало морщинистое образование колонии, и таким образом оценивать развитие с подхода, конечно время значительно усиливается с помощью рассечения микроскопом. Однако, если эта технология отсутствует, протокол может быть адаптирован для использования с другим оборудованием, в том числе простой цифровой фотоаппарат с зум-фокус. Хотя этот протокол сосредоточен на оценке морщинистой развитие колонии, она также может быть изменен, чтобы оценить пленка образование, форма биопленки, которая развивается, когда клетки растут статически в культуральной жидкости. Этот протокол также может оказаться полезной при оценке других показателей формирование биопленок, в том числе включение конкретных красителей в колонии пятнистых процессе развития биопленки. Они включают, но не ограничиваются, красители, такие как Конго красный и calcofluили которые могут связываться с целлюлозой, общие компоненты бактериальных биопленок 16. Кроме того, этот протокол, хотя и разработана для использования совместно с В. fischeri, не ограничивается этим организмом, но может быть обобщен на изучение биопленки во многих различных организмов, таких как Сенная палочка 4, холерный вибрион 5, Vibrio parahaemolyticus 6 и синегнойной палочки 7, все выставки морщинистое образование колонии. Наконец, он также может быть адаптирована для изучения морфологии других колоний, которые имеют с развитием картины, такие, как, возможно, паттерн, который происходит в процессе роста Myxococcus Ксанф 17 и воздушный развитие структуры синегнойной палочки 18. Этот протокол, таким образом, общего пользования в области микробиологии и биопленки исследователей.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана грантом R01 NHI GM59690 присуждена KLV.
Материалы
| Name | Company | Catalog Number | Comments |
| Наименование оборудования | Компания | Номер по каталогу | Комментарии |
| Zeiss Stemi 2000-C Анатомический микроскоп | Zeiss | 45505300000000000 | (Полученные через микроскоп Лукас) |
| Прогресс C10 PLUS | JENOPTIK Optical Systems GmbH | 017953-602-26 | Камера вложений (полученные через микроскоп Лукас) |
| CL 1500 EC источник холодного света | Zeiss | 4355400000000000 | (Полученные через микроскоп Лукас) |
| Прогресс CapturePro | JENOPTIK Optical Systems GmbH | Свободное программное обеспечение с зарегистрированным камерой | Компьютерная программа для захвата изображения |
| Изображение J | NIH | Бесплатное программное обеспечение:И.Я. / download.html "целевых =" _blank "> http://rsb.info.nih.gov/ij/download.html | Компьютерная программа для измерения диаметра |
Ссылки
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin. Microbiol. Rev. 15, 167-167 (2002).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu. Rev. Microbiol. 56, 187 (2002).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20 (2005).
- Branda, S. S. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11621 (2001).
- Beyhan, S. Regulation of rugosity and biofilm formation in Vibrio cholerae: comparison of VpsT and VpsR regulons and epistasis analysis of vpsT, vpsR, and hapR. J. Bacteriol. 189, 388 (2007).
- Enos-Berlage, J. L., Guvener, Z. T., Keenan, C. E., McCarter, L. L. Genetic determinants of biofilm development of opaque and translucent Vibrio parahaemolyticus. Mol. Microbiol. 55, 1160 (2005).
- Merritt, J. H., Brothers, K. M., Kuchma, S. L., O'Toole, G. A. SadC reciprocally influences biofilm formation and swarming motility via modulation of exopolysaccharide production and flagellar function. J. Bacteriol. 189, 8154-8154 (2007).
- Yip, E. S., Geszvain, K., DeLoney-Marino, C. R., Visick, K. L. The symbiosis regulator rscS controls the syp gene locus, biofilm formation and symbiotic aggregation by Vibrio fischeri. Mol. Microbiol. 62, 1586-1586 (2006).
- Morris, A. R., Darnell, C. L., Visick, K. L. Inactivation of a novel response regulator is necessary for biofilm formation and host colonization by Vibrio fischeri. Mol. Microbiol. 82, 114 (2011).
- Nyholm, S. V. Roles of Vibrio fischeri and nonsymbiotic bacteria in the dynamics of mucus secretion during symbiont colonization of the Euprymna scolopes light organ. Appl. Environ. Microbiol. 68, 5113 (2002).
- Yip, E. S., Grublesky, B. T., Hussa, E. A., Visick, K. L. A novel, conserved cluster of genes promotes symbiotic colonization and σ54-dependent biofilm formation by Vibrio fischeri. Mol. Microbiol. 57, 1485 (2005).
- Mandel, M. J. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215 (2009).
- Graf, J., Dunlap, P. V., Ruby, E. G. Effect of transposon-induced motility mutations on colonization of the host light organ by Vibrio fischeri. J. Bacteriol. 176, 6986 (1994).
- Geszvain, K., Visick, K. L. The hybrid sensor kinase RscS integrates positive and negative signals to modulate biofilm formation in Vibrio fischeri. J. Bacteriol. 190, 4437 (2008).
- Krasteva, P. V. Vibrio cholerae VpsT regulates matrix production and motility by directly sensing cyclic di-GMP. Science. 327, 866 (2010).
- Romling, U. Characterization of the rdar morphotype, a multicellular behaviour in Enterobacteriaceae. Cell Mol. Life. Sci. 62, 1234 (2005).
- Berleman, J. E., Chumley, T., Cheung, P., Kirby, J. R. Rippling is a predatory behavior in Myxococcus xanthus. J. Bacteriol. 188, 5888 (2006).
- Lee, K., Veeranagouda, Y. Ultramicrocells form by reductive division in macroscopic Pseudomonas aerial structures. Environ. Microbiol. 11, 1117 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены