Method Article
Ein semi-quantitativer Ansatz, um die Biofilmbildung Mit Wrinkled Colony Entwicklung zu bewerten
In diesem Artikel
Zusammenfassung
Wir bieten eine einfache, semi-quantitative Methode zur Biofilm-Bildung zu untersuchen In-vitro-. Diese Methode nutzt die Vorteile des Zeiss Stemi 2000-C Lupen-Mikroskop (mit Kamera-Anhang), um sowohl das Timing und die Muster der Bildung von Biofilmen zu überwachen, wie durch die Entwicklung der runzligen Kolonien beurteilt.
Zusammenfassung
Biofilme, oder die Oberfläche gebundenen Gemeinschaften von Zellen in einer extrazellulären Matrix verkapselt, stellen einen gemeinsamen Lebensstil für viele Bakterien. Innerhalb eines Biofilms, bakteriellen Zellen weisen oft Physiologie verändert wurde, einschließlich erhöhte Resistenz gegen Antibiotika und andere Belastungen der Umwelt ein. Darüber hinaus können Biofilme spielen eine wichtige Rolle in der Wirt-Mikroben-Interaktionen. Biofilme entstehen, wenn Bakterien Übergang von einzelnen, zu planktonischen Zellen bilden komplexe, mehrzellige Gemeinschaften 2. Im Labor sind Biofilme durch die Beurteilung der Entwicklung von spezifischen Phänotypen Biofilm untersucht. Eine gemeinsame Biofilm-Phänotyp beinhaltet die Bildung faltig oder runzelig Bakterienkolonien auf Agar-Medien 3. Wrinkled Koloniebildung erlaubt ein besonders einfaches und nützliches Mittel zur Identifizierung und Charakterisierung Bakterienstämme, die eine veränderte Biofilm-Phänotypen, und an Umweltbedingungen, die Einfluss auf die Biofilmbildung zu untersuchen. Wrinkled Koloniebildung dient als Indikator der Biofilmbildung in einer Vielzahl von Bakterien, einschließlich sowohl Gram-positive Bakterien, wie Bacillus subtilis 4, und Gram-negative Bakterien, wie Vibrio cholerae 5, Vibrio parahaemolyticus 6, Pseudomonas aeruginosa 7 und Vibrio fischeri 8.
Die marinen Bakterium V. fischeri wurde zum Vorbild für die Bildung von Biofilmen durch die kritische Rolle von Biofilmen bei Host Kolonisation: Biofilme durch produzierte V. fischeri Förderung ihrer Besiedlung der hawaiianischen Bobtail Squid Euprymna scolopes 10.08. Wichtig ist, korreliert Biofilm-Phänotypen in vitro beobachtet mit der Fähigkeit von V. fischeri Zellen wirksam zu kolonisieren Wirtstiere: Stämme für die Bildung von Biofilmen in vitro beeinträchtigt besitzen eine Kolonisierung Defekt 9,11, während die Stämme, die eine erhöhteBiofilm-Phänotypen sind für die Besiedlung 8,12 verbessert. V. fischeri ist somit ein einfaches Modellsystem, um die Mechanismen, durch die Bakterien regulieren Biofilmbildung und wie Biofilme Auswirkungen Host Kolonisation zu beurteilen.
In diesem Bericht beschreiben wir eine semi-quantitative Methode zur Beurteilung Biofilmbildung mit V. fischeri als Modellsystem. Dieses Verfahren beinhaltet die sorgfältige Spotting von Bakterienkulturen in definierten Konzentrationen und Volumina auf Agar-Medien, eine gefleckte kultur ist gleichbedeutend zu einer einzelnen Kolonie. Diese "spotted Kultur" Technik kann genutzt werden, um grobe Biofilm-Phänotypen bei einzelnen, vorgegebenen Zeit-Punkte (Endpunkt-Assays) zu vergleichen oder zu identifizieren und zu charakterisieren subtile Biofilm-Phänotypen durch die Zeit-Gänge-Assays von Biofilm Entwicklung und Messungen der Kolonie Durchmesser werden , der durch Bildung von Biofilmen beeinflusst. Somit stellt diese Technik eine semi-quantitative Analyse der Bildung von Biofilmen, promitting Auswertung der Zeitpunkt und die Strukturierung von faltige Kolonie Entwicklung und der relativen Größe des sich entwickelnden Struktur, Eigenschaften, die über die einfache Morphologie insgesamt zu verlängern.
Protokoll
1. Erstmalige Beschreibung und Überlegungen
- Biofilm-Bildung wird im Allgemeinen durch die Zelldichte und die Wachstumsrate beeinflusst. Daher ist es notwendig, die Wachstumsrate (Zunahme der optischen Dichte (OD) über die Zeit) und Ausbeute (endgültige Zellzahl) des Stammes (e) von Interesse, indem einfache Wachstumskurve und Zellaussaatdichten Assays zu bestimmen. Defekte im Wachstum, oder eine fehlende Korrelation zwischen OD und Zellzahl, müssen berücksichtigt werden bei der Interpretation der Ergebnisse von Experimenten Spotting.
- Schließen Sie die entsprechende positive und negative Kontrollen auf der gleichen Platte bei der Beurteilung faltige Kolonie-Bildung, als geringfügig von Platte zu Platte Variation Biofilmentwicklung auswirken können.
- Identifizieren Sie die besten Bedingungen für das Auffinden, dh solche, die die deutlichsten Unterschiede zwischen der Kontrolle und Mutante (en) von Interesse zu offenbaren. Wachsen Stämme in Flüssigkultur unter verschiedenen Bedingungen, wie verschiedene Medien oder Temperaturen und anderen Stufes des Wachstums (exponentiellen oder stationären Phase) vor dem Spotting. Spot 10 ul der Kultur bei verschiedenen Zelldichten auf die entsprechenden Medien, und inkubieren Sie bei der gewünschten Temperatur bis Morphologien Kolonie sichtbar werden.
- Der Endpunkt-Assay umfasst die Bewertung von faltiger Koloniebildung zu einem vorbestimmten Zeitpunkt nach dem Absetzen (dh 48 Stunden). Diese Einschätzung ist für nützlich, dass Stämme Ausstellung (oder werden vorgeschlagen, um zeigen) schweren Defekten in der Biofilmbildung.
- Der zeitliche Verlauf Assay beurteilt faltige Kolonie-Bildung über einen bestimmten Zeitraum (zB jede Stunde) post-Spotting. Dieser Assay ermöglicht eine semi-quantitative Bewertung von Biofilmbildung durch die die Bestimmung des Beginns von faltiger Kolonie-Bildung und Entwicklung Muster über einen Zeitraum. Die Dauer des Experiments und die Anzahl der Sammelstellen für eine bestimmte Zeit Kurs sollte in Vorversuchen ermittelt werden.
- Leicht nachvollziehen der Zeit post-Spotting, setzen Sie aufimer zu zählen.
2. Mikroskopische Beurteilung der Wrinkled Koloniemorphologie in V. fischeri
- Beimpfen V. fischeri Zellen in 5 ml LB-Salz (LBS) Medium 13 (1% [w / v] Trypton, 0,5% [w / v] Hefeextrakt, 2% [w / v] Natriumchlorid, 50 mM Tris-HCl [ pH 7,5]) enthält alle notwendigen Antibiotika und inkubieren unter Schütteln über Nacht bei 28 ° C Am Morgen, Subkultur der Zellen mit einer Verdünnung von 1:100 in 5 ml frisches Medium LBS und inkubieren unter den gleichen Bedingungen, bis die Zellen das gewünschte OD 600 erreicht haben (z. B. OD 600 = 0,2 oder 0,5).
- 1 ml der Kultur in ein Mikrozentrifugenröhrchen und Zentrifuge in einer Mikrozentrifuge Satz bei maximaler Geschwindigkeit für 1 Minute. Entfernen Sie den Überstand durch Absaugen. Die Zellen werden, um restliche Medien und extrazellulären Komponenten durch Resuspendieren des Pellets in 1 ml sterilem 70% künstlichem Meerwasser (ASW) (35 mM MgSO 4-7H 2 O, 7 mM CaCl entfernen2-2H 2 O, 210 mM NaCl, 7 mM KCl) und Wiederholen der Zentrifugation. Resuspendieren Sie das gewaschene Pellet in 1 ml 70% ASW.
- Stellen Sie sicher, dass jede Probe die gleiche Anzahl von Zellen, wie durch die OD bei 600 nm geschätzt enthält. Nehmen Sie die erforderlichen Anpassungen durch Verdünnen konzentrierter Proben mit zusätzlichen 70% ASW. In Vorversuchen an Ort und Stelle zu verschiedenen Kulturen Anfangs-OD-Werte für eine optimale Ausgangspunkt OD für eine gegebene Menge von Stämmen oder Bedingungen zu bestimmen. Die besten Ergebnisse werden erzielt für V. fischeri, wenn Flecken aus Kulturen mit einem Außendurchmesser von etwa 0,2 erzeugt werden.
- Spot 10 ul der gewaschenen Zellen auf LBS-Platten, die alle notwendigen Antibiotika. Beim Absetzen einer Kultur auf eine Platte, vergewissern Sie sich, um stetig die Pipette (mit dem Finger) knapp über der Agar-Oberfläche. Punkt der Abbildung, nicht in einem Winkel, und werfen Sie die Flüssigkeit langsam für eine gleichmäßige Verteilung des Spots. Typischerweise Jeder Stamm wird einmal pro Platte entdeckt (bis zu 6 Punkte pro Platte), with mehrere Platten (2-3) pro Experiment.
- Um sicherzustellen, dass das gefleckte Kultur gleichmäßig verteilt bleibt, damit der Ort, um vor dem Bewegen der Platte in den Inkubator zu trocknen. Kehren Sie die Platten und inkubieren sie bei 28 ° C
- Überwachen Sie die Morphologie der wachsenden Ort stündlich Anfang an 12-15 Stunden nach der Impfung. Wir verwenden ein Binokular (Zeiss Stemi 2000-C) mit einer Kamera Befestigung (ProgRes C10 PLUS) und der ProgRes CapturePro und ImageJ Software-Programme zu beobachten und zu dokumentieren Koloniemorphologie und um den Beginn und das Fortschreiten der faltige Kolonie-Bildung zu bewerten.
- Für die spezifische Konfiguration in Schritt 2.5 aufgeführt, werden die Spots von unten durch eine transparente Glas-Bühne mit einer CL 1500 EG kalte Lichtquelle beleuchtet, während die Bilder von oben erfasst werden. Dieses Setup ist optimal für die Bildgebung faltige Kolonie Entwicklung, weil V. fischeri Kolonien (Spots) sind durchscheinend.
- In Abwesenheit der spezifischen Ausrüstung Runde aufgeführtEP 2.5, Monitor faltig Koloniemorphologie mit jedem Seziermikroskop sich für die vollständige Kolonie Betrachtungswinkel ermöglicht und verfügt über eine verstellbare Lichtquelle und im Idealfall eine angeschlossene Kamera. Falls erforderlich, kann eine digitale Kamera auch in Abwesenheit von einer angeschlossenen Kamera verwendet werden, aber das ist nicht optimal.
- Um die besten sichtbar faltige Volksentwicklung, ist es notwendig, sowohl die Beleuchtungsstärke und Reflexionswinkel unterhalb der Bakterienkolonien, so dass die dreidimensionale Morphologie der Entwicklung von Biofilmen zu verzeichnen ist einzustellen. Bestimmung der optimalen Lichtverhältnissen, die den stärksten Kontrast zwischen der entdeckt Kolonie und dem umgebenden Hintergrund-Agar, so dass die Architektur (Falten) der Kolonie deutlich unterscheidbar ist bereitzustellen.
- In einigen Fällen muss die Farbe des gefleckten Kolonie auch berücksichtigt werden, wie Veränderungen in Farbe Kolonie während Biofilmbildung auftreten können. Einstellen der Intensität und des Winkels der Lichtquelle zu offenbarendiese subtilen Veränderungen in der Färbung. Sobald die entsprechenden Einstellungen erreicht werden, halten sie für die Dauer des Experiments.
- Beachten Sie, wie viel Zeit verstreicht von der Zeit der Inokulation zu dem Zeitpunkt, zu dem faltigen Koloniebildung initiiert für jeden Stamm oder eines Zustands. Den Anfangspunkt von faltiger Koloniebildung als der Zeitpunkt, bei dem die Bildung von Mustern und 3D-Strukturen (dh Streifen bildet sich an der äußeren Kante oder "Wellen" auftritt in der Mitte) zunächst ersichtlich. Mutierte Zellen verringert oder erhöht werden, um Zeit aufweisen Beginn von faltiger Koloniebildung (z. B. Bild. 2).
- Dokumentieren Sie die Start-und Entwicklung von faltige Kolonie-Bildung durch die Erfassung geeigneter digitaler Bilder. Es ist wichtig, um die gleiche Vergrößerung zu verwenden, wenn das Sammeln von Bildern während des Experiments. Schalten Sie den Blick aus dem Okular des Mikroskops auf dem Computer-Bildschirm mit dem Hebel auf der Rückseite der Kamera befindet. Beim Umschalten zwischen Okularund Computer-Bildschirm betrachten, stellen Sie den Blick und konzentrieren sich entsprechend.
- Bevor Bildgebung spotted Kulturen, wird der Deckel der Petrischale in der Regel entfernt, um das klarste Bild zu liefern. Dies ist jedoch ein optionaler Schritt, er entdeckt Kulturen durch den Deckel mit dem Setup in den Schritten 2.5 und 2.6 beschrieben abgebildet werden kann.
- Zu jedem Zeitpunkt nach Beginn der faltigen Koloniebildung, beachten Sie das Muster der faltige Kolonie Entwicklung. Die Architektur kann von innen nach außen zu entwickeln, oder von außen nach innen dieser Bewertung stellt einen Mechanismus, um die Biofilme von verschiedenen Stämmen oder unter unterschiedlichen Bedingungen ausgebildet unterscheiden.
- Messen Sie den Durchmesser des sich entwickelnden Kolonie zu jedem Zeitpunkt. Dies kann manuell erfolgen, oder digital über eine zugehörige Software-Programm. Wenn dies geschehen ist digital, verwenden Sie die ProgRes CapturePro Software-Programm und erste Kalibrierung der Skala bar auf die spezifische Vergrößerung in dem Experiment verwendet. Fügen Sie die Balken in jedem Bild eingefangen.
- Um die Kolonie mit dem Durchmesser ImageJ Software-Programm berechnen, öffnen Sie jede Bilddatei. Standardisierung der Maßstab wie folgt: Wählen Sie den "Straight-Option" aus der Symbolleiste. Überlagern des eingebetteten Maßstab mit einer geraden Linie von der gleichen Länge und Breite. Wählen Sie "Set Scale" aus der Registerkarte mit der Bezeichnung "Analyze". In der "bekannten Strecke"-Box, legen Sie die entsprechende Länge (von der Original-Maßstab bestimmt, dh 2 mm), und wählen Sie "OK".
- Verwenden Sie den "Straight Line"-Option, um eine horizontale Linie über der Stelle einfügen. Unter der Registerkarte Analysieren, wählen Sie "Messen". In dem neuen Fenster Ergebnisse, wird die berechnete Länge zur Verfügung gestellt werden. Besorgen Sie sich eine zweite Messung, indem Sie einen senkrechten Linie quer über den Platz. Neuberechnung des Durchmessers. Notieren Sie den Mittelwert der beiden Messungen. Grafik den durchschnittlichen Durchmesser für jeden Fleck zu jedem Zeitpunkt über ein Software-Programm wie Excel.
- Das Ende des Experiments erfolgt entweder zu einem festgelegten Zeitpunkt oder, wenn es keine weiterenEntwicklung des Biofilms. Wenn das Ende erreicht ist, zu konsolidieren die Bilder in einer Figur (en), um das Muster im Zeitablauf unter Verwendung eines Software-Programm, wie Powerpoint visualisieren.
3. Repräsentative Ergebnisse
In diesen Experimenten verwendeten wir V. fischeri als Modellorganismus zur Bildung von Biofilmen durch die Auswertung der Entwicklung der runzligen Kolonien auf festem Agar-Oberfläche zu studieren. Biofilm-produzierende Stämme von V. fischeri bilden Kolonien mit umfangreichen 3D-Architektur innerhalb von 40 h (Abb. 1) 8,9,14. Wenn über einen Zeitverlauf untersucht, wird deutlich, dass faltige Koloniebildung durch Kontrollstamm schon um 12 leitet h nach Inokulation (abhängig von den spezifischen Bedingungen) (Abb. 2) 9. Im Gegensatz dazu wird Biofilmbildung ein Vertreter Mutante von etwa 4 h verzögert, nicht eingeleitet, bis ca. 16 h nach der Inokulation 9. REPEAts dieser Experimente vorgeschlagen, dass das Timing relativ konsistent war, so dass diese Einschätzung semi-quantitative 9. Eine zweite halb-quantitative Messung der Biofilmbildung nutzt die Änderung des Durchmessers des sich entwickelnden Kolonie im Laufe der Zeit. Wie in gezeigt. 3A, bildet eine repräsentative Biofilm-kompetenten Stamm Kolonien, dass Zunahme der Komplexität und Durchmesser relativ zu einem repräsentativen Belastungen, die nicht zu Biofilmen. Genaue Messungen über die Zeit der Durchmesser der Kolonien von diesen beiden Stämmen gebildeten zeigte, dass die Größe der Biofilm-zuständigen Kolonien mit einer größeren Geschwindigkeit als die Biofilm-negativen Kolonien erhöht und am Ende Zeitpunkt die beiden unterschiedlich um nahezu 2 - Falte (3B). Obwohl also Bilder eines repräsentativen Spät-Zeitpunkt oder "Endpunkt" Kolonie-Morphologie in der Literatur häufig dargestellt sind, können zusätzliche, semi-quantitative Daten gesammelt werden, die ein besseres Verständnis des Biofilms Defekt zu ermöglichen.
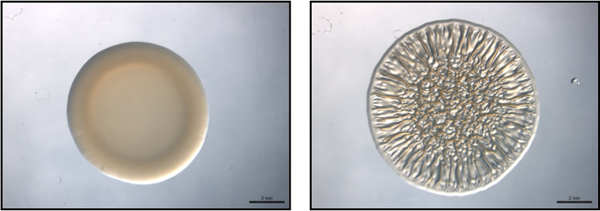
Abbildung 1. End-Point-Test. Diese Zahl ist ein Beispiel für eine Endpunkt-Assay unter Verwendung von nicht-repräsentativen Biofilm-bildenden (links) und Biofilm-bildenden (rechts) Stämme von V. fischeri. Diese Bilder wurden bei 40 h post-Spotting gesammelt. Diese Bilder wurden mit Wildtyp-V erzeugt fischeri, enthaltend einen Vektor-Kontrolle (nicht-Biofilm-bildenden) oder eine Überexpression RSCS Plasmid (Biofilm-bildenden) und waren Teil des Datensatzes für Morris et al., 2011 gesammelt.
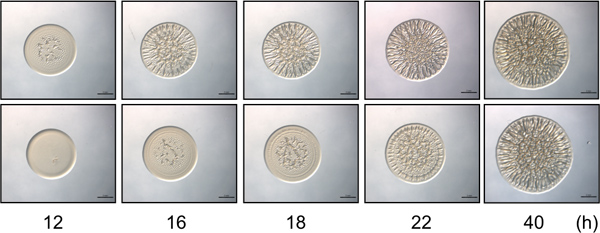
Abbildung 2. Zeit-Gänge-Assay. Das obere Feld enthält repräsentative Bilder von Biofilmbildung durch eine Biofilm-zuständigen Kontrollstamm von V. fischeri über einen ausgewählten zeitlichen Verlauf. Initiation der Biofilmbildung ist um 12 Uhr zeigt. Der untere Bereich enthält repräsentative iMagier von einem mutierten Stamm der V. fischeri, die eine Verzögerung (4h) in der Start von faltiger Koloniebildung im Laufe der Zeit, mit der Biofilmbildung Einleitung bei 16 h nach der Inokulation aufweist. Beachten Sie, dass bei 40 Stunden wurden die Stämme ähnliche in der Intensität und Strukturierung der Biofilm-Bildung zu suchen, während feine Unterschiede zwischen diesen Stämmen nur an den früheren Zeitpunkten beobachtet werden. Diese Bilder wurden mit RSCS überexprimierenden Wildtyp und Mutante generiert Sype V. fischeri Zellen und waren Teil des Datensatzes für Morris et al gesammelt., 2011.
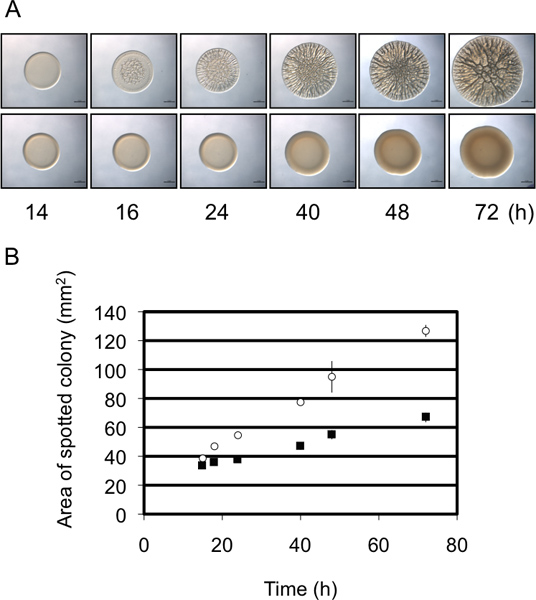
Abbildung 3. Colony Durchmesser als semi-quantitative Analyse der Biofilmbildung. (A) Zeitverlauf der Bildung von Biofilmen durch Vertreter Biofilm-bildenden (oberes Bild) und nicht-Biofilm-bildenden (unteres Bild) Stämme von V. fischeri. Beachten Sie, dass der Biofilm-bildenden Stamm eine stärkere Zunahme weistDurchmesser im Laufe der Zeit relativ zu dem nicht-bildender Stamm Biofilm. Diese Bilder wurden mit Wildtyp-V erzeugt fischeri, die eine Überexpression RSCS Plasmid (Biofilm-bildenden) oder ein Vektor-Kontrolle (nicht-Biofilm-bildenden) und waren Teil des Datensatzes gesammelt für Morris et al., 2011. (B) Grafische Darstellung des Anstiegs Koloniedurchmessers im Laufe der Zeit durch die beiden Stämme in der Platte A. Diese Daten unter Verwendung des ImageJ und Excel wurden wie in dem Protokoll behandelt.
Diskussion
In dieser Arbeit beschreiben wir eine semi-quantitative Methode zur Beurteilung Biofilmbildung mit V. fischeri als Modellorganismus. Genauer gesagt, nutzen wir ein Binokular mit Kamera Befestigung an Biofilmbildung und Entwicklung als faltige Kolonie-Bildung im Laufe der Zeit auf einer festen Agar-Oberfläche überwachen. In diesem Protokoll, skizzieren wir zwei spezifische Arten von Methoden, die wir häufig benutzen, um faltige Kolonie-Bildung zu bewerten. Der erste ist der Endpunkt-Assay, die uns um die abschließende, umfassende 3D-Architektur, Strukturieren und Durchmesser eines gefleckten Kultur an einem ausgewählten "endgültige" Zeitpunkt beobachten können. Dieser Ansatz ist besonders nützlich für die Beurteilung der Mutanten oder Bedingungen, die auf dramatische Mängel in der Biofilmbildung führen. Allerdings ist dieser Ansatz nicht zwischen mehr feine Unterschiede auftreten Zeitpunkten vor dem ausgewählten Endpunkt zu unterscheiden. Um genauer zu überwachen faltig Koloniebildung, verwenden wir einen zeitlichen Verlauf Assay, mit dem wir den Beginn der w identifizieren könnenrinkled Koloniebildung und beobachten ihre Entwicklung im Laufe der Zeit. Durch diesen Ansatz können feinere Unterschiede in der Zeit von faltiger Koloniebildung, 3D-Architektur, und Strukturieren identifiziert werden. Wir nutzten diese Zeit natürlich Assay auf zwei semi-quantitative Untersuchungen der Biofilmbildung zu generieren. Erstens kann der Zeitpunkt, zu dem ein Stamm beginnt, 3D-Architektur zu entwickeln, die der Kontrolle Stämme verglichen werden. Wir haben festgestellt, dass die Verzögerung bei der Bildung von Biofilmen zu einer bestimmten Mutante unter den gleichen Bedingungen relativ konstant 9 ist. Zum Beispiel, in den Daten gezeigt. 2, die Mutante zeigte konsistent etwa 4 h Verzögerung bei der Einleitung Biofilmbildung. Eine zweite halb-quantitative Messung der Biofilmbildung ist die Veränderung der Größe des Durchmessers der gefaltete Kolonie (Ort). Wir haben festgestellt, dass der Durchmesser von faltiger Kolonien schrittweise unterscheidet sich von der nicht-Biofilm Kolonien erreicht über eine 2-facher Unterschied in der Endzeitpunkt (3 ) (Morris und Visick, unveröffentlichte Daten). Bis heute haben wir nicht eine Phänotyp ohne das andere (dh Bildung von Biofilmen ohne eine Erhöhung der Kolonie Durchmesser) (unveröffentlichte Daten) beobachtet, obwohl es möglich bleibt, einige Mutanten wird sich anders verhalten. In der Tat ist es für V. berichtet cholerae, dass einige faltige Kolonien führen zu einem erheblichen Anstieg der Kolonie Durchmesser, während andere dies nicht tun 15. Dennoch könnte die Beurteilung der Änderung des Durchmessers im Laufe der Zeit in der Charakterisierung von potentiellen Biofilm Mutanten und / oder unterstützen eine zusätzliche quantitatives Maß von Mutanten mit Verzögerungen in der Entwicklung. Von den beiden Maßnahmen der Biofilmbildung (Zeit und Durchmesser), die Festlegung des Beginns der faltigen Koloniebildung ist empfindlicher, aber auch mehr subjektive, als die Bestimmung des Durchmessers des Spots. Trotzdem bieten beide Maßnahmen eine semi-quantitative Bewertung von einem Phänotyp, die äußerst nützlich, um Biofilm-Forscher aber nicht ohne weiteres zugänglich ist quantification.
Bei der Durchführung von Tests entdeckt kultiviert, ist es wichtig, die Umgebungsbedingungen, in denen die entdeckten Stämme kultiviert werden, zu berücksichtigen. Wrinkled Koloniebildung wird oft von verschiedenen Umweltbedingungen, einschließlich der Verfügbarkeit von Nährstoffen, Temperatur und Luftfeuchtigkeit beeinflusst. Um die Variabilität zwischen den Experimenten zu reduzieren, ist es hilfreich, diese Bedingungen zu standardisieren so viel wie möglich (dh die Normung der Agarplatten zu einem festgelegten Volumen und Kultivieren der entdeckt Stämme bei einer kontrollierten Temperatur). Zur weiteren Kontrolle, die Variabilität zwischen Spotting Experimente, ist wichtig, um die entsprechenden Kontrolle-Stämme innerhalb jeder Gruppe von Experimenten sind. Schließlich, bei der Interpretation der Daten aus diesen Tests ist es notwendig, jede einem Experiment mehrmals (3 +), insbesondere bei der Bewertung durchzuführen feine Unterschiede in faltige Koloniebildung (zB eine Verzögerung in der Biofilmbildung oder Strukturieren Unterschiede). Einige Einschränkungen dieses Protokolls sind: 1) dann selbst bestimmenIng. ob Zellen einen Defekt in Wachstum haben kann schwierig sein: das Wachstum von Zellen in Flüssigkultur Umständen nicht genau Wachstumsraten auf festen Medien, und eine genaue Bestimmung des Wachstums von Biofilm-bildenden Zellen, die zusammenhalten, nicht möglich sein kann; 2) Stämme mit Wachstumsstörungen wird es problematisch zu analysieren, 3) es nicht möglich sein, Unterschiede zwischen Stämmen Durchmesser mit feinen Biofilm-Phänotypen zu unterscheiden, 4) für Stämme, die nicht in einem konzentrischen Ring nicht wachsen kann es nicht möglich, genau zu messen Veränderungen im Durchmesser, 5), während Strukturieren während Biofilmbildung beobachtet werden kann, gibt es keine Möglichkeit, die Strukturierung der resultierenden Biofilm zu quantifizieren, und 6) gibt es keine Möglichkeit, um die Z-Dimension des Biofilms mit diesem experimentellen Aufbau zu messen . Trotz dieser Beschränkungen dieses Protokoll jedoch stellt ein Mittel, um numerische Daten zu erhalten, um bei der Beurteilung faltige Koloniebildung zu unterstützen.
In diesem Protokoll, verwenden wir eine spezielle BildgebungSystem (dh, ein Zeiss Binokular und ProgRes CapturePro Imaging-Software) zu beobachten und auszuwerten faltig Koloniebildung. Abbildungssystem hier beschriebenen ist stark: die Fähigkeit, den Beginn von faltiger Koloniebildung zu erfassen, und somit zu beurteilen Entwicklung mit einem zeitlichen Verlauf Ansatz wird stark durch die Verwendung von einem Präpariermikroskop verbessert. Allerdings, wenn diese Technologie nicht verfügbar ist, kann das Protokoll für die Verwendung mit anderen Geräten, einschließlich einer einfachen Digitalkamera mit einem Zoom-Fokus angepasst werden. Während dieses Protokoll steht die Bewertung von faltiger Volksentwicklung, könnte es auch so modifiziert werden Pellikelbildung, eine Form von Biofilm, der, wenn die Zellen wachsen statisch in flüssiger Kultur entsteht bewerten. Dieses Protokoll kann auch als nützlich erweisen bei der Beurteilung der anderen Indikatoren der Biofilmbildung, einschließlich der Berücksichtigung von speziellen Farbstoffen in die gefleckten Kolonien während der Entwicklung von Biofilmen. Diese umfassen, sind aber nicht beschränkt auf, Farbstoffe, wie Kongorot und calcoflu beschränktoder die auf die Cellulose, eine gemeinsame Komponente von bakteriellen Biofilmen 16 zu binden. Zusätzlich Dieses Protokoll, obwohl für den Einsatz entwickelt mit V. fischeri, ist nicht auf diese beschränkt, sondern Organismus kann verallgemeinert werden, um das Studium Biofilmbildung in zahlreichen verschiedenen Organismen, wie Bacillus subtilis 4, 5 Vibrio cholerae, Vibrio parahaemolyticus 6 und Pseudomonas aeruginosa 7, die zeigen alle faltigen Koloniebildung. Schließlich kann es auch angepasst an andere Morphologien Kolonie, die ein Entwicklungsmuster, wie zum Beispiel, möglicherweise, der Strukturierung, die während des Wachstums von xanthus 17 und Antenne Strukturentwicklung in Pseudomonas aeruginosa 18 auftritt haben zu studieren. Dieses Protokoll ist somit der allgemeinen Benutzung zur Mikrobiologie und Biofilm-Forscher.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von NHI R01 Zuschuss GM59690 verliehen KLV unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name der Ausrüstung | Firma | Katalog-Nummer | Kommentare |
| Zeiss Stemi 2000-C Lupen-Mikroskop | Zeiss | 45505300000000000 | (Erhalten durch Lukas Mikroskop) |
| ProgRes C10 PLUS | JENOPTIK Optical Systems GmbH | 017953-602-26 | Kamera-Aufsatz (erhalten durch Lukas Microscope) |
| CL 1500 EG-Kaltlichtquelle | Zeiss | 4355400000000000 | (Erhalten durch Lukas Mikroskop) |
| ProgRes CapturePro | JENOPTIK Optical Systems GmbH | Kostenlose Software mit registrierten Kamera | Computer-Programm für die Bilderfassung |
| Image J | NIH | Kostenlose Software aus:ij / download.html "target =" _blank "> http://rsb.info.nih.gov/ij/download.html | Computerprogramm für die Messungen des Durchmessers |
Referenzen
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin. Microbiol. Rev. 15, 167-167 (2002).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu. Rev. Microbiol. 56, 187 (2002).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20 (2005).
- Branda, S. S. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11621 (2001).
- Beyhan, S. Regulation of rugosity and biofilm formation in Vibrio cholerae: comparison of VpsT and VpsR regulons and epistasis analysis of vpsT, vpsR, and hapR. J. Bacteriol. 189, 388 (2007).
- Enos-Berlage, J. L., Guvener, Z. T., Keenan, C. E., McCarter, L. L. Genetic determinants of biofilm development of opaque and translucent Vibrio parahaemolyticus. Mol. Microbiol. 55, 1160 (2005).
- Merritt, J. H., Brothers, K. M., Kuchma, S. L., O'Toole, G. A. SadC reciprocally influences biofilm formation and swarming motility via modulation of exopolysaccharide production and flagellar function. J. Bacteriol. 189, 8154-8154 (2007).
- Yip, E. S., Geszvain, K., DeLoney-Marino, C. R., Visick, K. L. The symbiosis regulator rscS controls the syp gene locus, biofilm formation and symbiotic aggregation by Vibrio fischeri. Mol. Microbiol. 62, 1586-1586 (2006).
- Morris, A. R., Darnell, C. L., Visick, K. L. Inactivation of a novel response regulator is necessary for biofilm formation and host colonization by Vibrio fischeri. Mol. Microbiol. 82, 114 (2011).
- Nyholm, S. V. Roles of Vibrio fischeri and nonsymbiotic bacteria in the dynamics of mucus secretion during symbiont colonization of the Euprymna scolopes light organ. Appl. Environ. Microbiol. 68, 5113 (2002).
- Yip, E. S., Grublesky, B. T., Hussa, E. A., Visick, K. L. A novel, conserved cluster of genes promotes symbiotic colonization and σ54-dependent biofilm formation by Vibrio fischeri. Mol. Microbiol. 57, 1485 (2005).
- Mandel, M. J. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215 (2009).
- Graf, J., Dunlap, P. V., Ruby, E. G. Effect of transposon-induced motility mutations on colonization of the host light organ by Vibrio fischeri. J. Bacteriol. 176, 6986 (1994).
- Geszvain, K., Visick, K. L. The hybrid sensor kinase RscS integrates positive and negative signals to modulate biofilm formation in Vibrio fischeri. J. Bacteriol. 190, 4437 (2008).
- Krasteva, P. V. Vibrio cholerae VpsT regulates matrix production and motility by directly sensing cyclic di-GMP. Science. 327, 866 (2010).
- Romling, U. Characterization of the rdar morphotype, a multicellular behaviour in Enterobacteriaceae. Cell Mol. Life. Sci. 62, 1234 (2005).
- Berleman, J. E., Chumley, T., Cheung, P., Kirby, J. R. Rippling is a predatory behavior in Myxococcus xanthus. J. Bacteriol. 188, 5888 (2006).
- Lee, K., Veeranagouda, Y. Ultramicrocells form by reductive division in macroscopic Pseudomonas aerial structures. Environ. Microbiol. 11, 1117 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten